ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 3, с. 439-448
УДК 544.41:544.344:544.723.213
МЕХАНОХИМИЧЕСКИЙ СИНТЕЗ КАТАЛИЗАТОРА
ГИДРИРОВАНИЯ ИЗ ОКСИДА НИКЕЛЯ И
СИЛИКАГЕЛЯ
© 2021 г. А. В. Афинеевский*, Д. А. Прозоров, К. А. Никитин,
Т. Ю. Осадчая, А. Ю. Меледин
Ивановский государственный химико-технологический университет,
пр. Шереметевский 7, Иваново, 153000 Россия
*e-mail: afineevskiy@mail.ru
Поступило в Редакцию 18 декабря 2020 г.
После доработки 16 февраля 2021 г.
Принято к печати 20 февраля 2021 г.
Впервые осуществлен синтез нанесенного на силикагель никелевого катализатора гидрирования
непосредственно механохимическим методом из оксидов в одну стадию. Получен комплекс данных
о влиянии условий механохимической активации катализатора на величины удельной поверхности,
распределение пор, размер кристаллитов, дефектности кристаллической решетки. Исследована катали-
тическая активность полученного катализатора в реакции восстановления в мягких условиях кратных
углеродных связей в молекулах стирола, проп-2-ен-1-ола и диэтилового эфира малеиновой кислоты.
Даны рекомендации по установлению оптимальных параметров получения никелевого катализатора с
помощью механохимического синтеза.
Ключевые слова: жидкофазная гидрогенизация, механохимический синтез катализатора, оксид никеля,
нанесенный никель, активность катализатора
DOI: 10.31857/S0044460X21030100
В настоящее время в промышленности металл/
Главная особенность нанесенных катализато-
носитель - самый распространенный тип гетеро-
ров состоит в том, что активный материал состав-
генных катализаторов [1]. Для производства нане-
ляет лишь незначительную часть по массе и оса-
сенных металлических никелевых катализаторов
ждается на поверхности носителя [4-7]. Носитель
гидрирования в основном применяют осаждение
обеспечивает большую площадь поверхности и
компонентов из водных растворов и суспензий
стабилизирует дисперсию (избыточную энергию
или пропитку сформированного, специально при-
поверхностного натяжения) активного компонен-
готовленного носителя водными растворами со-
та (например, металлов, нанесенных на оксиды).
единений активных металлов. Одними из самых
Взаимодействия активной фазы и носителя, кото-
частых носителей являются силикагель, γ-Al2O3,
рые определяются химией поверхности носителя
цеолит NaX, оксид магния MgO, угли, которые
для данной активной фазы, отвечают за диспер-
пропитывают водным раствором гексагидрата
сию и химическое состояние последней.
хлорида никеля(II) или раствором гексагидрата
Большой интерес для синтеза новых катализа-
нитрата никеля(II) [2]. Активность гидрирующих
торов представляет механохимическая активация.
катализаторов, полученных методом пропитки но-
Роль ее заключается в увеличении поверхност-
сителя, обычно выше активности катализаторов,
ных дефектов, что сопровождается увеличением
приготовленных методом соосаждения [3].
глубины взаимодействия компонентов реакции,
439
440
АФИНЕЕВСКИЙ и др.
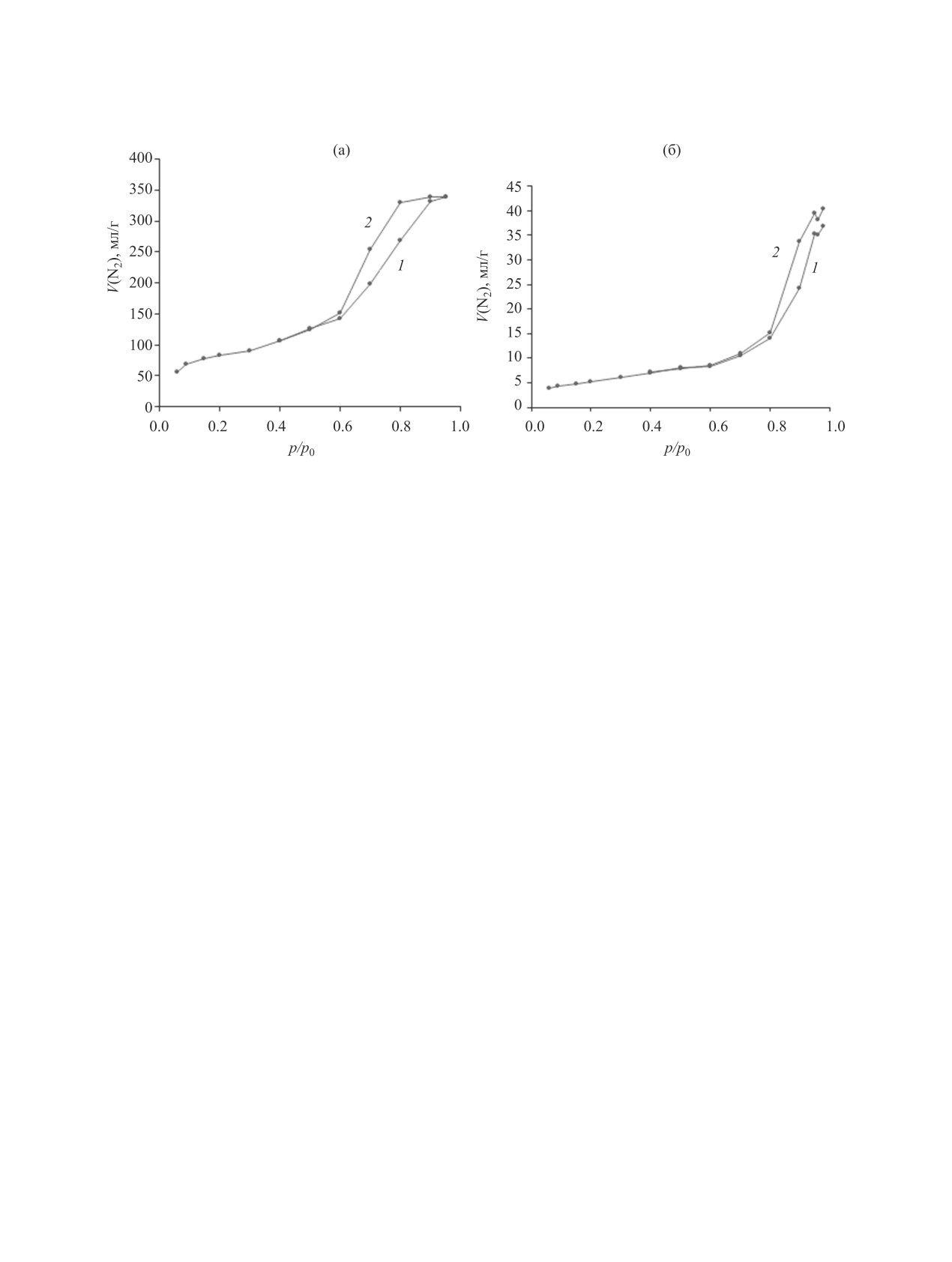
Рис. 1. Изотермы низкотемпературной адсорбции (1) и десорбции (2) N2 на (а) силикагеле, (б) оксиде никеля(II).
приводит к увеличению сорбционной способно-
Целью настоящей работы была разработка на-
сти, может влиять на температуру восстановления
учных основ одностадийного, безотходного синте-
нанесенного металла, повышать каталитическую
за нанесенных никелевых катализаторов реакций
активность и селективность, а также повышает
жидкофазной гидрогенизации с помощью механо-
прочность катализатора (устойчивостью к истира-
активации оксида никеля(II) и силикагеля.
нию) при этом снижаются трудо- и энергозатраты,
Активность катализаторов оценивали в реак-
уменьшается негативное воздействие на экологию
ции восстановления кратной углеродной связи в
(уменьшение стоков воды, отсутствие выделения
молекуле стирола, проп-2-ен-1-ола и диэтилового
парниковых газов).
эфира малеиновой кислоты. Выбор гидрируемых
Причиной увеличения сорбционной способно-
соединений был обоснован практическим отсут-
сти является образование «ювенильной» поверх-
ствием промежуточных и побочных продуктов
ности и появление на ней мест выхода дефектов
реакций, а также наличием достаточно обширной
кристаллической структуры [8].
базы литературных данных о кинетических зако-
номерностях их восстановления.
Согласно данным [9-12], катализаторы, син-
тезированные методом механохимической акти-
Известно [14-17], что кинетика гидрирования
вации, по активности и селективности зачастую
стирола и диэтилового эфира малеиновой кислоты
превосходят образцы, приготовленные по тради-
носит однотипный характер. Однако стирол и диэ-
ционным технологиям пропитки и соосаждения.
тиловый эфир малеиновой кислоты имеют разное
Повышение каталитической активности можно
строение, а значит, изменяя распределение пор,
объяснить, как увеличением дисперсности нане-
можно добиться различной активности для раз-
сенного металла, так и влиянием дефектов носите-
ных веществ на одном катализаторе, что позволит
управлять селективностью каталитической систе-
ля. Ряд свойств каталитических систем обусловлен
только влиянием дефектов [13]. Также доказано,
мы.
что механохимическая активация ведет к изме-
В работе был синтезирован ряд никелевых ка-
нению распределения пор в носителе. Таким об-
тализаторов гидрирования на основе оксида ни-
разом, механохимический способ получения ка-
келя и силикагеля. Ранее проведенные исследова-
тализаторов гидрирования потенциально должен
ния позволили выбрать носитель и соотношение
позволить не только управлять активностью, но и
металл/носитель [17-19]. Поэтому в качестве ос-
селективностью для выбранных процессов.
новного варьируемого параметра было выбрано
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
МЕХАНОХИМИЧЕСКИЙ СИНТЕЗ КАТАЛИЗАТОРА ГИДРИРОВАНИЯ
441
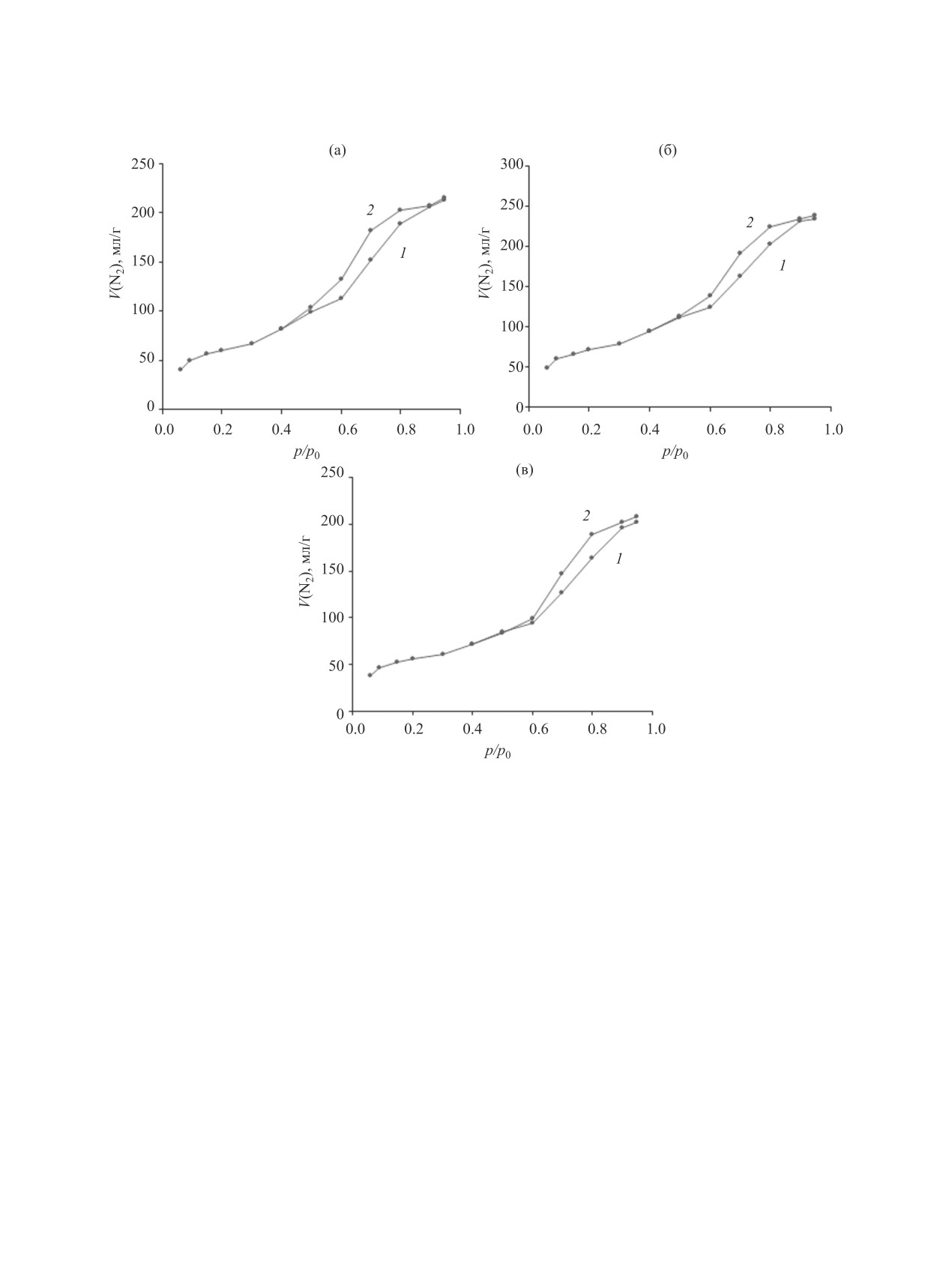
Рис. 2. Изотермы низкотемпературной адсорбции (1) и десорбции (2) N2 для катализаторов, подвергнутых механохимиче-
ской активации в режимах: (а) 30 с/30 Гц, (б) 30 с/40 Гц, (в) 30 с/50 Гц.
количество подводимой энергии. Подвод различ-
чистого силикагеля, который не подвергали ме-
ного количества энергии при механохимической
ханохимической активации
∑Vpore
0.468 см3/г,
активации удобно производить, изменяя время ак-
а для катализатора, подвергнутого механохи-
тивации и/или частоту вращения барабанов в пла-
мической активации с затраченной энергией в
нетарной мельнице.
40.8 кДж (режим: 40 Гц, 30 с) величина ∑Vpore
равна 0.322 см3/г, для затраченной энергии в
Увеличение мощности не оказывает однознач-
51 кДж (режим: 50 Гц, 30 с) ∑Vpore 0.281 см3/г.
ного эффекта на величину площади поверхности
вследствие наличия параллельных процессов де-
Анализ изотерм адсорбции (рис. 1, 2) показы-
струкции/агломерации. Тем не менее, можно сде-
вает, что они относятся к IV и V типу по С. Бруна-
лать однозначный вывод о влиянии количества
уэру. Характерная петля гистерезиса говорит о на-
затраченной энергии на размер пор: чем больше
личии мезопор. Распределение мезопор показано
подведено энергии, тем меньше становится по-
на гистограмме (рис. 3). Также на всех изотермах,
ровое пространство. Далее, как суммарный объ-
кроме рис. 1б, отвечающего оксиду никеля, при-
ем пор рассматривается общий объем только для
сутствует скачкообразный рост в начале изотермы
пор размером до 94.6 нм (∑Vpore). Например, для
адсорбции, характерный для IV типа по С. Брунау-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
442
АФИНЕЕВСКИЙ и др.
эру, что говорит о наличии небольшого количества
микропор.
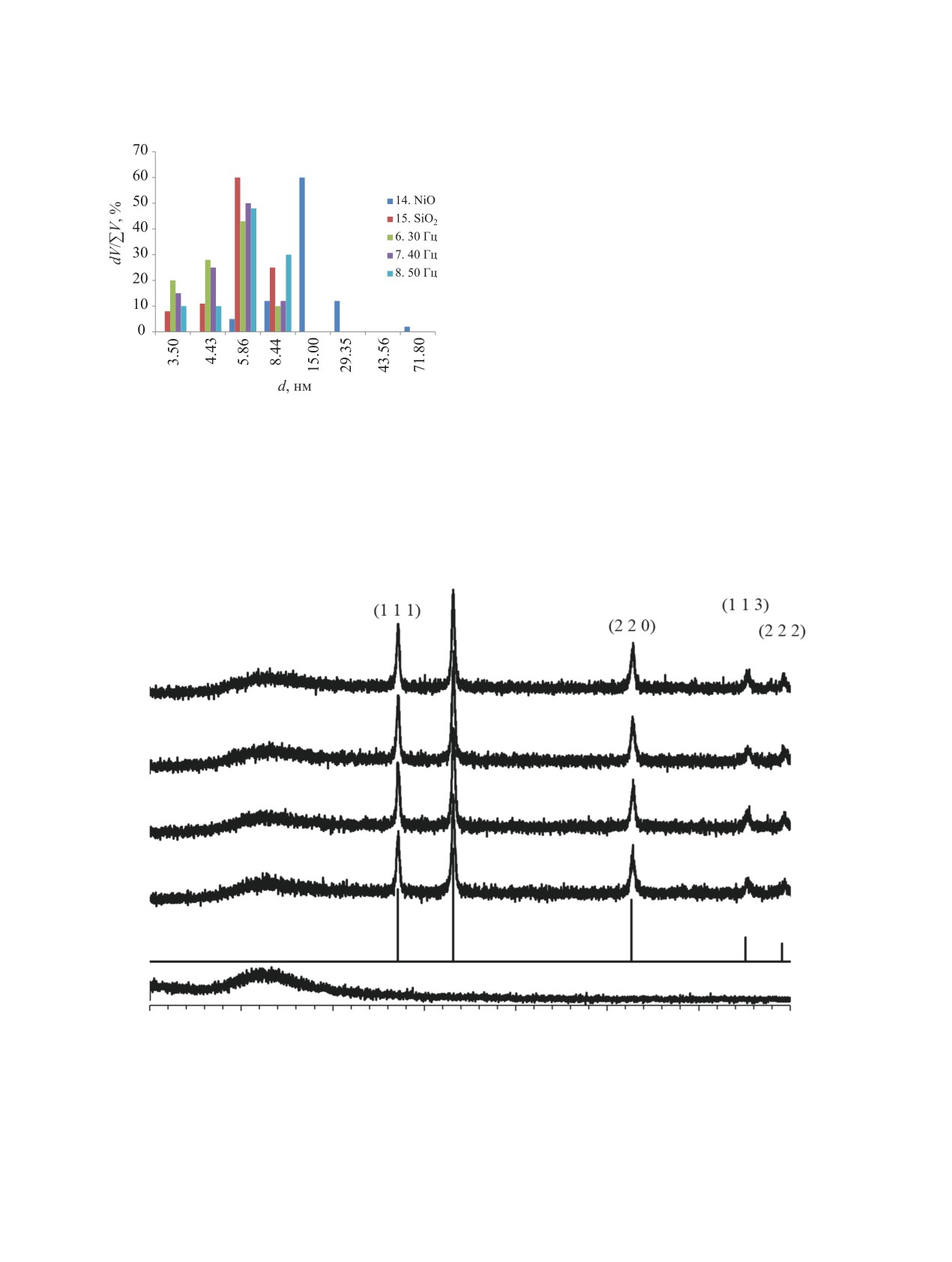
Анализ рис. 3 показывает, что увеличение за-
траченной энергии ведет к равномерному умень-
шению объема пор до 5.86 нм и симбатному уве-
личению пор со средним диаметром 8.44 нм (dDi
3.39 нм). Таким образом, изменяя количество
затраченной энергии можно планомерно изме-
нять распределение пор. Следовательно, регули-
руя распределение пор возможно регулировать
«геометрическую» селективность катализатора.
Выбранные нами модельные соединения имели
различный размер молекул. В связи с размерами
Рис. 3. Гистограммы распределения мезопор по ради-
молекул гидрируемых веществ, активность ката-
усу для исходных компонентов и для катализаторов,
лизаторов оказалась различной.
подвергнутых механохимической активации в течение
30 с при различной частоте (указана в легенде, номера
На рис. 4 приведены примеры рентгенограмм
соответствуют номерам в табл. 1).
нанесенного NiO на силикагель непосредственно
(2 0 0)
6
5
4
3
2
1
10
20
30
40
50
60
70
80
θ, град
Рис. 4. Рентгенограммы чистого силикагеля (1), бунзенита (2, данные из кристаллографической базы МИНКРИСТ) и
механоактивированных смесей оксида никеля и силикагеля с режимами механохимической активации: 3 - 10 с/40 Гц,
4 - 30 с/40 Гц, 5 - 60 с/40 Гц, 6 - 120 с/40 Гц.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
МЕХАНОХИМИЧЕСКИЙ СИНТЕЗ КАТАЛИЗАТОРА ГИДРИРОВАНИЯ
443
Таблица 1. Параметры механохимической активаций и физические характеристики активированного катализатора
Режим механохимической активации
№
Размер
скорость вращения
затраченная
Sуд, м2/г
опыта
время, с
частота, Гц a
gб
кристаллитов, нм в
барабанов, об/мин
энергия, кДж
1
Механическая смесь
-
-
-
282.8±0.8
44.2
2
10
20
400
6.8
9.4
265.2± 7.7
-
3
10
30
600
10.2
21.1
258.4± 0.6
-
4
10
40
800
13.6
37.6
273.7± 0.9
43.8
5
10
50
1000
17
58.7
258.4 ±1.4
-
6
30
30
600
30.6
21.1
228.3 ± 7.8
-
7
30
40
800
40.8
37.6
270.2 ± 9.6
47.5
8
30
50
1000
51
58.7
210.7 ± 7.6
-
9
60
40
800
81.6
37.6
270.9±0.6
43.8
11
120
40
800
163.2
37.6
279.1±0.1
42.7
12
180
40
800
244.8
37.6
283.8± 1.3
-
13
240
40
800
326.4
37.6
279.3± 1.2
-
14
Чистый NiO
-
-
-
19.4 ± 0.5
44.2
15
Чистый силикагель
-
-
-
367.3 ± 1.0
-
a Частоту подводимого тока к мотору регулировали с помощью инвертора.
б Центробежное ускорение, действующее на мелющие тела.
в Размер кристаллитов рассчитан по уравнению Шеррера-Силякова.
после механохимической активации. По получен-
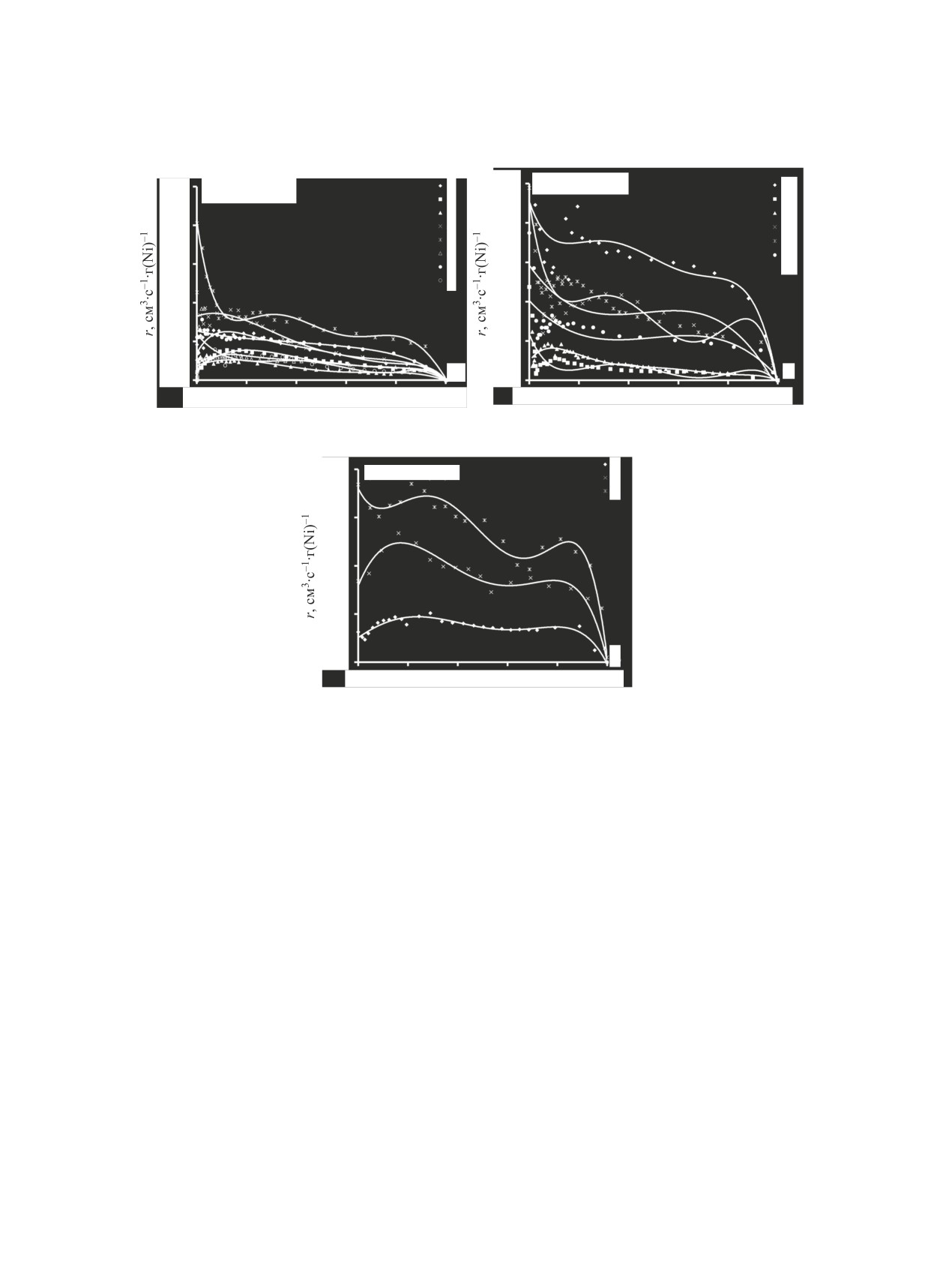
была исследована кинетика поглощения водорода
ным данным были рассчитаны размеры областей
в ходе реакции жидкофазной гидрогенизации сти-
когерентного рассеяния. Результаты расчетов при-
рола (рис. 5а), диэтилового эфира малеиновой кис-
ведены в табл. 1. Анализ полученных данных по-
лоты (рис. 5б), проп-2-ен-1-ола (рис. 5в). На пред-
казывает, что режим механохимической активации
ставленных рис. 5, 6 r - наблюдаемая скорость
практически не влияет на размер кристаллитов.
реакции см3(H2)·[с·г(Ni)]-1, α - количество погло-
щенного водорода, нормированное к единице.
В Дополнительных материалах на рис. S1 при-
веден пример исследования элементного состава
На рис. 6 показан пример сопоставления ки-
поверхности. Анализ производился с помощью
нетики поглощения водорода при гидрировании
синхронного построения микрофотографий по-
различных веществ (стирола, диэтилового эфира
средством растровой электронной микроскопии
малеиновой кислоты, проп-2-ен-1-ола) на образце
и энтропийного дисперсионного анализа из точек
катализатора, полученном при одном режиме ме-
набора растра. Анализ данных карт распределе-
ханохимической активации.
ния элементов показал, что размер частиц чистого
Таким образом, меняя режимы механохимиче-
NiO с увеличением затраченной энергии симбатно
ской активации, можно в значительной степени
уменьшается, соответственно, при малом подводе
варьировать скорость гидрирования выбранных
энергии никель неравномерно распределяется по
веществ, при этом можно добиться варианта, ког-
поверхности и значительное его число остается в
да скорости гидрирования для выбранных сое-
ненанесенном виде, однако при больших количе-
динений будут близки (рис. 6б) или значительно
ствах подведенной энергии распределение никеля
различаться (рис. 6а), что позволяет управлять се-
становится достаточно равномерным, что отража-
лективностью катализатора.
ется в его активности. Также проведенные иссле-
В табл. 2 приведены активность и время полу-
дования показали, что режим помола при 40 Гц
реакции для образцов катализаторов, полученных
дает наилучшее нанесение металла на подложку.
при различных режимах механохимической акти-
На полученных при различных режимах меха-
вации. Анализ данных показывает, что меньшее
нохимической активации образцах катализатора
влияние режим механохимической активации ока-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
444
АФИНЕЕВСКИЙ и др.
(a)
(б)
2.00
1
2.00
1
2
2
3
3
1.60
4
1.60
4
5
5
6
6
1.20
1.20
7
8
0.80
0.80
0.40
0.40
0.00
0.00
0.00
0.20
0.40
0.60
0.80
1.00
0.00
0.20
0.40
0.60
0.80
1.00
α
α
(в)
1.60
1
2
3
1.20
0.80
0.40
0.00
0.00
0.20
0.40
0.60
0.80
1.00
α
Рис. 5. Скорость поглощения водорода при гидрогенизации (а) стирола, (б) диэтилового эфира малеиновой кислоты,
(в) проп-2-ен-1-ола в воде на образцах катализатора, подвергнутого механохимической активации в различных условиях. (а)
1 - 30 с/40 Гц, 2 - 30 с/30 Гц, 3 - 30 с/50 Гц, 4 - 60 с/40 Гц, 5 - 120 c/40 Гц, 6 - 180 c/40 Гц, 7 - 240 c/40 Гц, 8 - 10 c/40 Гц;
(б) 1 - 30 с/40 Гц, 2 - 30 с/30 Гц, 3 - 30 с/50 Гц, 4 - 60 с/40 Гц, 5 - 120 c/40 Гц, 6 - 240 c/40 Гц; (в) 1 - 30 с/40 Гц,
2 - 60 с/40 Гц, 3 - 120 c/40 Гц. Условия проведения гидрирования: 30°C, mкат 1 г, массовая доля никеля - 25%.
зывает на гидрирование диэтилового эфира малеи-
При использовании метода механохимической
новой кислоты и большее - в случае стирола.
активации исключаются такие стадии синтеза ка-
тализатора, как осаждение, пропитка, фильтрация,
Анализ данных табл. 1, 2 позволяет сделать
вывод о симбатной зависимости активности ката-
сушка, прокаливание, используемые в традицион-
лизаторов и удельной площади поверхности, что
ных промышленных технологиях. Таким образом,
хорошо согласуется с постулатом об измерении
происходит резкое сокращение количества таких
активности катализатора через число активных
отходов, как стоки загрязненных вод и, что важно,
атомов.
растворителей, газов (например, оксиды азота при
использовании нитрата никеля), а также уменьша-
Механоактивация оказывает значительное вли-
ется время необходимое для приготовления ката-
яние на площадь поверхности (табл. 1, 2). Так как
лизаторов.
молекулы используемых веществ различаются по
размеру, то изменение морфологии частиц ката-
Связь величины площади удельной поверхно-
лизатора должно позволять дифференцировать по
сти и активности катализатора хорошо известна.
скоростям процесс их гидрирования.
Так как с увеличением площади идет увеличение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
МЕХАНОХИМИЧЕСКИЙ СИНТЕЗ КАТАЛИЗАТОРА ГИДРИРОВАНИЯ
445
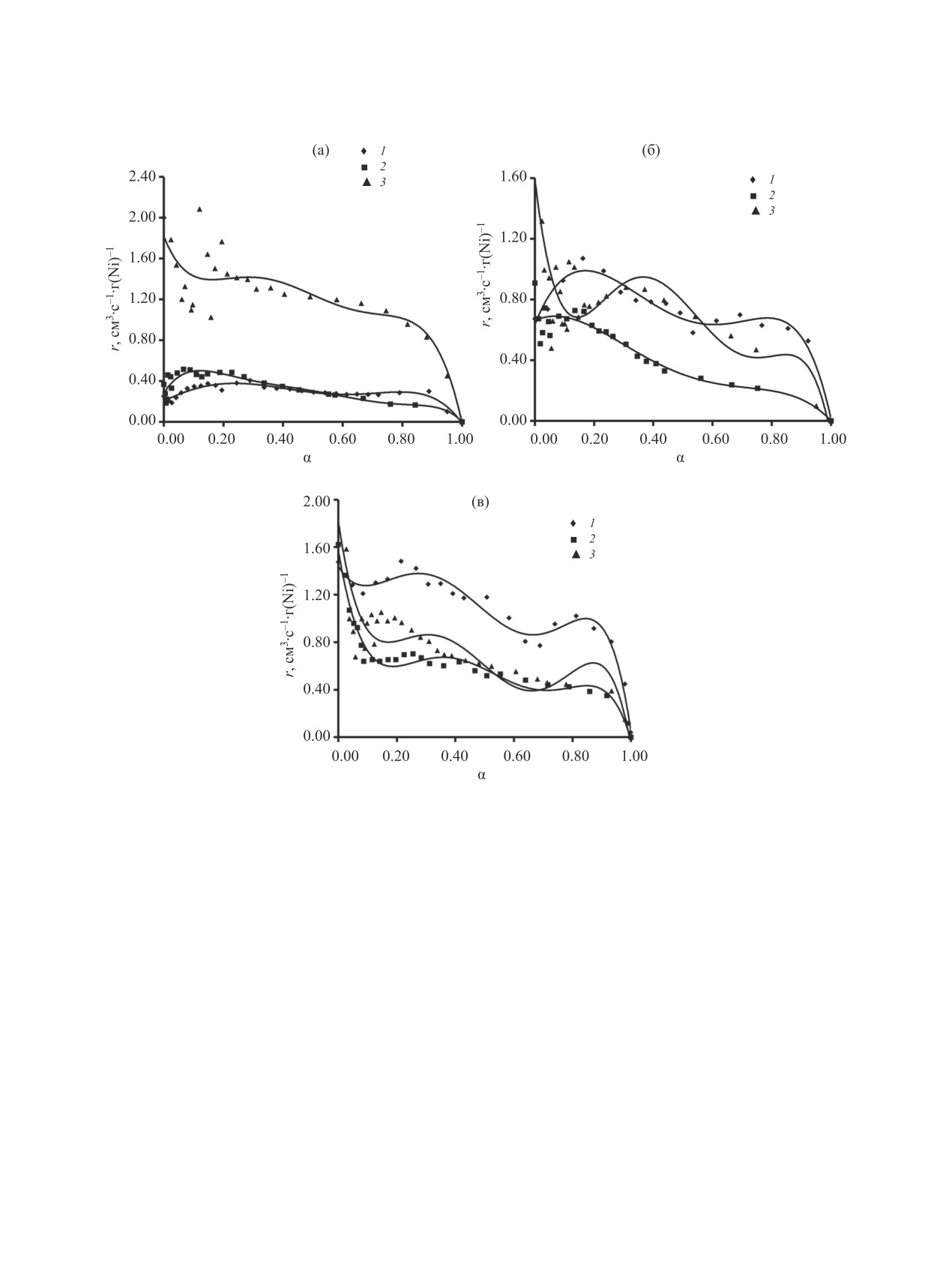
Рис. 6. Скорость поглощения водорода при гидрогенизации проп-2-ен-1-ола (1), стирола (2) и диэтилового эфира малеино-
вой кислоты (3) в воде на образцах катализатора, обработанных с режимом механохимической активации: (а) 30 с/40 Гц,
(б) 60 с/40 Гц, (в) 120 с/40 Гц. Условия проведения гидрирования: 30°C, mкат 1 г, массовая доля никеля - 25%.
числа активных центров, то и активность катали-
гии не только уменьшается общий объем пор, но
затора будет выше для всех выбранных гидриру-
и смещается распределение пор по размеру, тем
емых веществ. Таким образом, подбор условий,
самым обеспечивая доступ одним органическим
субстратам и снижая доступ другим. Это хорошо
приводящих к росту величины удельной поверх-
объясняет, почему скорость гидрирования диэти-
ности катализатора, будет оказывать влияние на
лового эфира малеиновой кислоты в ряде случаев
активность катализатора, но при этом не должен
выше, чем скорость гидрирования стирола, несмо-
оказывать влияния на селективность работы ка-
тря на то, что адсорбция стирола выше.
тализатора. С другой стороны, при различной
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
подводимой энергии к частицам при их механо-
химической активации будет приводить к изме-
В работе использовали следующие вещества и
нению распределения пор по размерам и объему.
реактивы: никеля(II) окись (ЧДА, ТУ-6-09-4125-
Установлено, что с увеличением подводимой энер-
80, ООО «Спектр-хим»), диэтиловый эфир ма-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
446
АФИНЕЕВСКИЙ и др.
Таблица 2. Активность исследуемых образцов катализаторов для гидрирования различных вещества
Режим механохимической активации катализатора
Активность, см3(H
)/[г(Ni)·с]в
2
время, с
частота, Гц
τ½, сб
Проп-2-ен-1-ол
30
40
1300
0.29
60
40
500
0.85
120
40
330
1.32
Стирол
10
40
1650
0.03
30
30
1260
0.32
30
40
900
0.30
30
50
1950
0.23
60
40
750
0.68
120
40
510
1.25
180
40
1650
0.51
240
40
850
0.50
Диэтиловый эфир малеиновой кислоты
30
30
300
1.54
30
40
3000
0.26
30
50
1800
0.32
60
40
750
0.92
120
40
510
1.12
240
40
3000
0.64
а Погрешность для определения τ½ составляла 5 с, а для активности - 7%. б Время полуреакции - время, за которое прореагирова-
ла половина от общего количества водорода. в Скорость реакции в начальный момент времени (0 < α ≤ 15%).
леиновой кислоты (ХЧ, ТУ 6-09-3932-87, ООО
мерата никеля делали 200 замеров диаметра части-
«Кристалл-Центр», d 1.064 г/см3), cтирол стаби-
цы. Для построения карт распределения элемен-
лизированный гидрохиноном (Ч, ТУ 6-09-11-2034-
тов на поверхности использовали совмещенную с
87, ООО «Ангара-реактив»), проп-2-ен-1-ол (ЧДА,
растровым электронным микроскопом приставку
ООО «Ангара-реактив»), силикагель марки Л 5/40
энергодисперсионного спектрометра (EDS) Oxford
мкм (ХЧ), водород электролитический марки Б
Instruments NanoAnalysis (Великобритания).
(ГОСТ 3022-80), вода дистиллированная (ГОСТ
Механохимический синтез проводили на мель-
6709-72).
нице Активатор-2SL с техническими характери-
Удельную поверхность определяли методом
стиками: скорость вращения центральной оси -
низкотемпературной адсорбции азота по методу
993-828 об/мин (мин), скорость вращения бараба-
Брунауэра-Эммета-Теллера с помощью аппарат-
нов - 1490-1242 об/мин (мин), соотношение ради-
ного комплекса Sorbi MS. Рентгенофазовый анализ
усов (центрального и барабанов) - 1.5, радиус пла-
проводили на дифрактометре Bruker D8 Advance с
нетарного вращения - 52.5 мм, внутренний радиус
использованием CuKα-излучения (λ 0.15406 нм).
барабанов - 35 мм, объем барабанов - 220 см3, по-
Для идентификации данных рентгенофазового
требляемая мощность - 1.7 кВт, 380 В/3 фазы; ме-
анализа использовали кристаллографическую
лющие тела: малые мелющие тела - диаметр 5 мм,
базу данных МИНКРИСТ. Для проведения грану-
масса 0.499 г; большие мелющие тела - диаметр
лометрического анализа использовали растровый
8 мм, масса 2.713 г; загрузка в каждом барабане
электронный микроскоп VEGA 3 TESCAN. По ми-
мелющих тел и смесь оксидов: малые мелющие
крофотографиям с помощью режима SE определя-
тела - 90 шт, большие мелющие тела - 90 шт,
ли морфологию частиц катализатора, с помощью
смесь оксидов - 41.369 г. Для регулировки мощ-
режима BSE - дисперсию агломератов никеля по
ности использовали инвертор TOSVERT VF-S11
размеру. Для определения среднего размера агло-
Toshiba.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
МЕХАНОХИМИЧЕСКИЙ СИНТЕЗ КАТАЛИЗАТОРА ГИДРИРОВАНИЯ
447
Механохимическую активацию проводили сле-
КОНФЛИКТ ИНТЕРЕСОВ
дующим образом. В барабан мельницы загружали
Авторы заявляют об отсутствии конфликта ин-
смесь NiO и силикагеля. Проводили механохими-
тересов.
ческую активацию при 10-50 Гц в течение 10-
240 с, что соответствует 0.08-9.86 кДж/г кат. затра-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
ченной энергии соответственно.
Дополнительные материалы для этой статьи
Исследование кинетики реакции жидкофазной
доступны по doi
10.31857/S0044460X21030100
гидрогенизации проводили статическим методом
для авторизованных пользователей
в нестационарных условиях в герметичном жид-
костном реакторе, обеспечивающем интенсивное
СПИСОК ЛИТЕРАТУРЫ
перемешивание реакционной массы, при атмос-
1.
Кулакова И.И., Лисичкин Г.В. Каталитическая химия.
ферном давлении водорода. Данная установка по-
М.: МГУ им. М.В. Ломоносова, 2014. С. 113.
зволяет проводить замеры поглощенного водорода
2.
Попов Ю.В., Мохов В.М., Небыков Д.Н., Ширханян
в нестационарном режиме протекания реакции, а
П.М., Гендлер Т.А., Шемет В.В. // ЖОХ. 2020. Т. 90.
также проводить отбор проб из объема реактора в
№ 6. С. 823; Popov Yu.V., Mokhov V.M., Nebykov D.
ходе проведения опыта [18].
N., Shirkhanyan P.M., Gendler T.A., Shemet V.V. // Russ.
J. Gen. Chem. 2020. Vol. 90. N 6. P. 931. doi 10.1134/
Методика активации нанесенных катали-
S1070363220060018
тических систем. Активацию (восстановление)
3.
Навалихина М.Д., Крылов О.В. // Усп. хим. 1998.
катализатора проводили следующим образом. По-
Т. 67. №. 7. С. 656.
мещали в трубчатую печь носитель (подложку) с
4.
Geus J.W., van Dillen J. Handbook of Heterogeneous
нанесенным оксидом никеля и восстанавливали в
Catalysis. Weinheim: Wiley-VCH, 1997. Vol. 1. P. 240.
токе водорода со скоростью 30 см3/мин при 450°C.
doi 10.1002/9783527610044hetcat0021
Подъем температуры осуществляли с 30 до 450°C
5.
Abildin T. // Chem. Bull. Kazakh Nat. Univ. 2013.
со скоростью нагрева 4 град/мин. Далее охлажда-
N 3. P. 76.
ли до комнатной температуры. В атмосфере водо-
6.
Попов Ю.В., Мохов В.М., Щербакова К.В. // Изв.
рода помещали под слой растворителя, затем под
Волг. гос. техн. унив. 2015. № 4. С. 159.
слоем растворителя переносили в реактор для ки-
7.
Клюев М.В. // Вестн. Ивановск. гос. унив. Сер. Есте-
нетических исследований.
ственные, общественные науки. 2014. № 2. С. 36.
8.
Молчанов В.В., Буянов Р.А. // Кинетика и катализ.
ФОНДОВАЯ ПОДДЕРЖКА
2001. Т. 42. № 3 С. 406; Molchanov V.V., Buyanov R.A. //
Измерение физических и физико-химических
Kinetics and Сatalysis. 2001. Vol. 42. N 3. P. 366. doi
свойств (в том числе удельной площади поверх-
10.1023/A:1010465315877
ности, рентгенофазовый и рентгеноструктурный
9.
Молчанов, В.В., Буянов Р.А. // Усп. хим. 2000. Т. 69.
анализ и др.) выполнены в рамках государствен-
№ 5. С. 47.
10.
Фундаментальные основы механической активации,
ного задания на выполнение научно-исследова-
механосинтеза, механохимических технологий /
тельской работы (тема № FZZW-2020-0010). Из-
Под ред. Е.Г. Аввакумова. Новосибирск: СО РАН,
мерение каталитических свойств нанесенного
2009. 343 с.
никеля выполнено при финансовой поддержке
11.
Григорьева Т.Ф., Баринова А.П., Ляхов Н.З. Меха-
гранта Президента для молодых ученых - канди-
нохимический синтез в металлических системах.
датов наук (проект МК-771.2020.3). Механохими-
Новосибирск: Параллель, 2008. 311 с.
ческий синтез выполнен Никитиным К.А. в рам-
12.
Болдырев С.В. // Усп. хим. 2006. Т. 75. № 3. С. 203.
ках программы «УМНИК» (№ 15605ГУ/2020, код
Boldyrev V.V. //Russ. Chem. Rev. 2006. Vol. 75. N 3.
0059080 от 07.07.2020). Исследование выполнено
P. 177. doi 10.1070/RC2006v075n03ABEH001205
в рамках научно-исследовательской работы Науч-
13.
Молчанов В.В., Буянов Р.А., Гойдин В.В. // Кинетика
ного совета РАН по физической химии на 2020 г.
и катализ. 1998. Т. 39. № 3. С. 465.
(№20-03-460-27) с использованием оборудования
14.
Betti C., Badano J., Lederhos C., Lederhos C.,
Центра коллективного пользования Ивановского
Maccarrone M., Carrara N., Coloma-Pascual F.,
государственного химико-технологического уни-
Quiroga M., Vera C. // React. Kinet. Mech. Cat. 2016.
верситета.
Vol. 117. P. 283. doi 10.1007/s11144-015-0910-8
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021
448
АФИНЕЕВСКИЙ и др.
15. Afineevskii A.V., Osadchaia T.Y., Prozorov D.A.,
A.V., Sukhachev Y.P., Sukhacheva M.D. // Russ. J. Phys.
Lukin M.V., Suhachev Y.P., Chelysheva M.D., Gundo-
Chem. (A). 2019. Vol. 93. N 11. P. 2158. doi 10.1134/
rov V.O. // J. Oil, Gas, Coal Eng. 2017. Vol. 5. N 6.
S0036024419110220
P.153. doi 10.11648/j.ogce.20170506.15
18. Афинеевский А.В., Прозоров Д.А., Осадчая Т.Ю.,
16. Афинеевский А.В., Прозоров Д.А., Осадчая Т.Ю., Лу-
Румянцев Р.Н. Гидрирование на гетерогенных ката-
кин М.В. // Изв. вузов. Сер. хим. и хим. технол. 2015.
лизаторах. Казань: Бук, 2020. 475 с.
Т. 58. № 3. С. 26. doi 10.60.60/ivkkt.20196206.58.78
19. Афинеевский А.В., Прозоров Д.А., Осадчая Т.Ю.,
17. Прозоров Д.А., Афинеевский А.В., Князев А.В., Су-
хачев, Я.П., Сухачева М.Д. // ЖФХ. 2019. Т. 93. №
Лукин М.В. // Изв. вузов. Сер. хим. и хим. технол.
11. C. 1681; Prozorov D.A. Afineevskii A.V., Knyazev
2015. Т. 58. № 11. С. 40.
Mechanochemical Synthesis of A Hydrogenation Catalyst
from Nickel Oxide and Silica Gel
A. V. Afineevskii*, D. A. Prozorov, K. A. Nikitin, T. Yu. Osadchaya, and A. Yu. Meledin
Ivanovo State University of Chemical Technology, Ivanovo, 153000 Russia
*e-mail: afineevskiy@mail.ru
Received December 18, 2020; revised February 16, 2021; accepted February 20, 2021
For the first time, the synthesis of a nickel hydrogenation catalyst supported on silica gel was carried out di-
rectly by the mechanochemical method from oxides in one stage. A set of data on the effect of the conditions
of mechanochemical activation of the catalyst on the specific surface area, pore distribution, crystallite size,
and crystal lattice imperfection was obtained. The catalytic activity of the obtained catalyst in the reduction
reaction under mild conditions of multiple carbon bonds in styrene, prop-2-en-1-ol, and diethyl ether of maleic
acid was studied. Recommendations are given for establishing the optimal parameters for obtaining a nickel
catalyst using mechanochemical synthesis.
Keywords: liquid-phase hydrogenation, mechanochemical synthesis, nickel oxide, supported nickel, catalyst
activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 3 2021