ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 495-505
УДК 544.353.3:547.436.3:547.262-304.2
РАВНОВЕСНЫЕ ПРОЦЕССЫ В РАСТВОРАХ
AlkNHCH2SO3H-NH2CH2CH2OH-H2O
© 2021 г. Р. Е. Хомаa,b,*, А. А. Эннанa, Р. М. Длубовскийa, Ю. В. Ишковb,
Т. С. Беньковскаяa, Е. М. Рахлицкаяb
a Физико-химический институт защиты окружающей среды и человека Министерства образования
науки и Национальной академии наук Украины, ул. Преображенская 3, Одесса, 65082 Украина
b Одесский национальный университет имени И. И. Мечникова, Одесса, 65082 Украина
*e-mail: rek@onu.edu.ua
Поступило в Редакцию 1 марта 2021 г.
После доработки 1 марта 2021 г.
Принято к печати 11 марта 2021 г.
Проведено рН-, редокс- и кондуктометрическое исследование кислотно-основного взаимодействия в
системах N-алкиламинометансульфокислота-2-аминоэтанол-вода (алкил = метил, 2-гидроксиэтил,
трет-бутил, бензил) в интервале температур 293-313 K. Рассчитаны ион-молекулярный состав иссле-
дуемых растворов, константы образования ассоциатов - ионных пар и триад. Выявлены корреляции
относительной устойчивости ионных ассоциатов с липофильностью (lgPow) и с силой (pKa) образующих
их кислот.
Ключевые слова: N-алкиламинометансульфокислоты, 2-аминоэтанол, кислотно-основное равновесие,
ионные ассоциаты
DOI: 10.31857/S0044460X21040016
Этаноламины, в частности 2-аминоэтанол, и
лярного состава растворов, констант диссоциации
их производные широко используются в качестве
и ассоциации.
хемосорбентов кислых газов (SiF4, SO2, CO2, H2S
Нами выявлены факторы, влияющие на ион-мо-
и др.) [1-13]. Их соли и комплексные соединения
лекулярный состав растворов N-алкиламинометан-
нашли применение при получении хемосорбен-
сульфокислота-2-аминоэтанол-вода и рассчитаны
тов-амфолитов, способных в зависимости от ус-
константы равновесных процессов при 293-313 K.
ловий поглощать как кислые, так и основные газы
Аминометансульфокислоты в водных растворах
[14, 15]. Известны буферные растворы на основе
преимущественно находятся в виде цвиттер-ио-
2-аминоэтанола [16-19]. Аминометансульфокис-
нов (≥95%) [28], продукты диссоциации которых -
лота и ее N-алкилпроизводные применяются как
аминометансульфонат-ионы
(1).
Автопротолиз
компоненты буферных растворов Гуда вследствие
воды описывается уравнением (2). В водных рас-
их специфических физико-химических свойств
творах 2-аминоэтанол протонируется (3).
и широкого спектра биологической активности
[20-23].
(1)
Совместное использование слабоосновного
R = H (1), CH3 (2), HOCH2CH2 (3), (CH3)3C (4), C6H5CH2
2-аминоэтанола [24] и слабокислой аминометан-
(5).
сульфокислоты [25, 26] в составе буферных рас-
(2)
творов может расширить границы pH их буферно-
го действия и увеличить буферную емкость [27].
(3)
Указанные характеристики зависят от ион-молеку-
495
496
ХОМА и др.
(4)
(5)
(6)
(7)
(8)
(9)
В системах N-алкиламинометансульфокисло-
Для определения электрохимических характе-
та-2-аминоэтанол-вода [29-31] существует веро-
ристик системы N-алкиламинометансульфокисло-
ятность образования ионных триад (4)-(6) и пар
та-2-аминоэтанол-вода проведено рН-, редокс- и
(7), (8), а также ион-молекулярных соединений (9)
кондуктометрическое титрование 0.01 М. раство-
при протекании кислотно-основных реакций и ас-
ров аминометансульфокислот 1-5 водным 0.10 М.
социации за счет электростатического взаимодей-
раствором 2-аминоэтанола 6 в интервале темпера-
ствия и образования H-связей.
тур 293-313 K (рис. 1-3).
C учетом закона действующих масс [уравнения
Для системы аминометансульфокислота
(1)-(9)], уравнения материального баланса по ами-
1-2-аминоэтанол первые экстремумы (минимумы)
нометансульфокислоте 1-5 (10), 2-аминоэтанолу 6
на дифференциальных рН-метрических кривых
(11) и условия электронейтральности (12) [32] по-
титрования (табл. 1) наблюдаются при молярном
лучаем систему уравнений (10)-(12).
соотношении компонентов основание-кислота
c1-5 = [RN+H2CH2SO2O-] + [RNHCH2SO2O-]
0.44-0.72 (~0.5), что, по-видимому, соответствует
+ 2cA + 2cБ + 2cВ + cГ +cД + cЕ,
(10)
образованию ионных триад (ассоциатов A, Б или
c6 = [HOCH2CH2NH2] + [HOCH2CH2N+H3] + cA + cБ
В). Вторые экстремумы, при молярном соотноше-
+ cВ + cГ + cД + cЕ,
(11)
нии основание:кислота = 0.96-1.16 (~1.0), веро-
[RNHCH2SO2O-] + [OH-] + CII = [H3O+]
ятно, обусловлены образованием ионных пар Г
+ [HOCH2CH2N+H3] + cВ + cД + cЕ,
(12)
или/и Д, а также ион-молекулярного ассоциата Е.
cA = [(RNHCH2SO2O-)(RN+H2CH2SO2O-) ∙
Указанным эффектам соответствуют 2 и 4 экстре-
(N+H3CH2CH2OH)],
мумы на дифференциальной редокс-метрической
cБ = [(RNHCH2SO2O-)(RNHCH2SO2O-)∙
кривой титрования (табл. 2), а также изломы на
(N+H3CH2CH2OH)],
кондуктометрической кривой титрования (рис. 3,
cВ = [(RN+H2CH2SO2O-)(RN+H2CH2SO2O-)∙
табл. 3).
(N+H3CH2CH2OH)],
cГ = [(RNHCH2SO2O-)∙(N+H3CH2CH2OH)],
Подобное поведение наблюдается и в системе
cД = [(RN+H2CH2SO2O-)∙(N+H3CH2CH2OH)],
аминометансульфокислота 5-2-аминоэтанол. Пер-
cЕ = [(RNHCH2SO2O-)∙(NH2CH2CH2OH)].
вому экстремуму (минимуму) на дифференциаль-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
Р
АВНОВЕСНЫЕ ПРОЦЕССЫ В РАСТВОРАХ
497
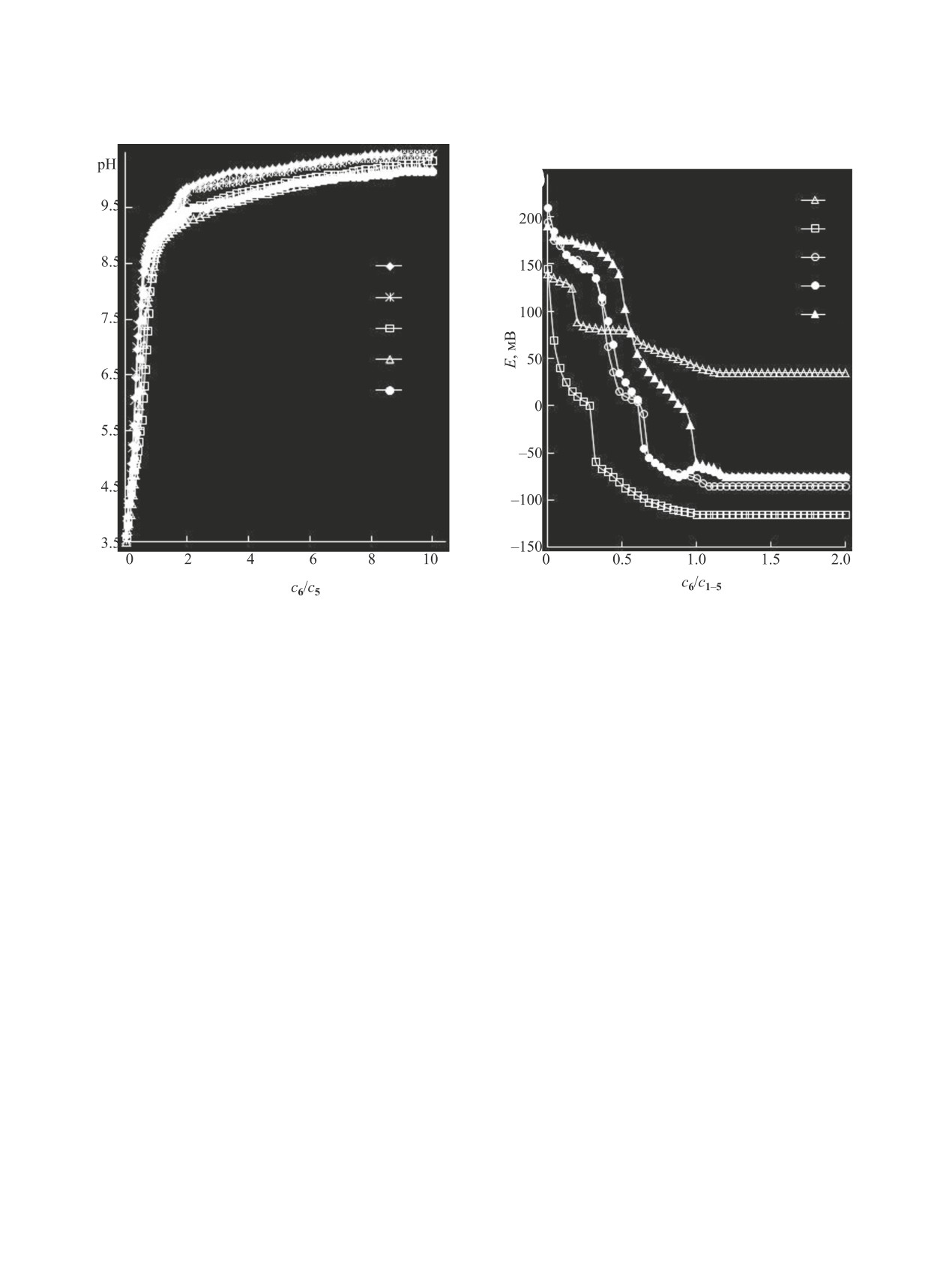
Рис. 2. Редоксметрические кривые титрования водных
Рис. 1. рН-Метрические кривые титрования водно-
растворов R- аминометансульфокислот 1-5 (1-5) во-
го раствора N-бензиламинометансульфокислоты
дным раствором 2-аминоэтанола 6 при 293 K. V01-5
5 водным раствором 2-аминоэтанола 6. V05 25 мл, c05
25 мл, c01-5 0.01 моль/л, c06 0.1 моль/л. R = H (1), CH3 (2),
0.01 моль/л, c06 0.1 моль/л; T, K: 293 - 1, 298 - 2, 303 - 3,
HOCH2CH2 (3), (CH3)3C (4), C6H5CH2 (5).
308 - 4, 313 - 5.
ной рН-метрической кривой титрования (рис. 1,
pH-метрических кривых титрования системы с
основание:кислота = ~0.50) соответствует второй
кислотой 4 наблюдаются по три экстремума в об-
эффект (максимум) на кондуктометрической кри-
ласти температур 298-313 K (табл. 1).
вой (рис. 3, табл. 3) при 293 K. Положение второ-
Отрицательные значения Δκ (рис. 3, табл. 3)
го экстремума (максимума) на дифференциальной
указывают на образование слабодиссоциирующих
рН-метрической кривой титрования (соотношение
частиц или/и менее подвижных ионов [33, 34], что
основание-кислота ~1.00) совпадает с положени-
подтверждается результатами расчетов, приведен-
ем третьего экстремума (максимума) на диффе-
ных ниже.
ренциальной редокс-метрической кривой титрова-
На основании данных рН-метрического ти-
ния и четвертого излома на кондуктометрической
трования с использованием вышеописанной
кривой.
физико-химической модели рассчитан ион-мо-
В системе с аминометансульфокислотами 2, 4
лекулярный состав систем N-алкиламинометан-
положения экстремумов на дифференциальных
сульфокислота-2-аминоэтанол-вода (например,
pH-метрических кривых титрования смещены в
рис. 4). Согласно полученным данным, аминоме-
область меньших значений молярных соотноше-
тансульфокислоты в исследованных растворах
ний основание-кислота по сравнению с системами
при соснование/скислота < 0.5 существуют преимуще-
кислота 1-2-аминоэтанол 6 и кислота 5-2-амино-
ственно в виде цвиттер-ионов (кривые 2а и 2б),
этанол 6 (табл. 1, рис. 1, кривые потенциометиче-
подобно системам RNHCH2SO3H-RNHCH2SO3K
ского титрования кислот 1-4 однотипны с кривы-
(RNHCH2SO3Na)-H2O [34]. При этом доля анио-
ми титрования кислоты 5). На дифференциальных
нов RNHCH2SO2O- (кривые 1а и 1б) меньше 1%, в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
498
ХОМА и др.
Таблица 1. Характеристики экстремумов дифференциальных рН-метрических кривых титрования 0.01 М. раство-
ров аминометансульфокислоты 1-5 0.1 М. водным раствором 2-аминоэтанола 6
1-й эффект (минимум)
2-й эффект (максимум)
3-й эффект (минимум)
Т, K
с
6
/с1-5
ΔрН/Δpс6
pH
с6/с1-5
ΔрН/Δpс6
pH
с6/с1-5
ΔрН/Δpс6
pH
1
293
0.60
-10.6
7.60
0.96
-1.2
9.32
298
0.44
-13.8
7.90
1.00
-0.6
9.80
303
0.72
-15.1
8.70
1.00
0.0
9.60
308
0.50
-13.4
6.35
1.16
-0.6
9.00
313
0.60
-14.1
7.60
1.12
-0.7
9.16
-
-
-
2
293
0.16
-7.30
8.80
0.24
-0.9
9.10
-
-
-
298
0.12
-7.70
8.95
0.20
-0.5
9.15
-
-
-
303
0.20
-7.40
8.80
0.32
-0.9
9.05
-
-
-
308
0.20
-6.30
8.80
0.32
-1.4
9.35
-
-
-
313
0.24
-5.20
8.80
0.32
-1.8
9.05
-
-
-
3
293
0.76
-22.9
7.80
1.04
-3.0
9.00
-
-
-
298
0.40
-4.5
4.85
0.50
-1.4
5.15
1.00
-34.1
7.85
303
0.56
-11.5
6.20
0.72
-2.2
6.80
0.92
-19.8
7.80
308
0.44
-17.6
6.40
0.64
-7.6
8.05
0.72
-12.9
8.55
313
0.32
-13.3
6.35
0.76
-2.3
8.75
0.92
-5.6
9.10
4
293
0.20
-6.8
7.70
0.50
-1.5
9.20
-
-
-
298
0.20
-10.1
8.60
0.50
-1.3
9.30
-
-
-
303
0.28
-9.2
8.70
0.50
-1.3
9.30
-
-
-
308
0.16
-6.1
8.85
0.36
-0.4
9.05
-
-
-
313
0.20
-9.5
8.90
0.28
-0.6
8.95
-
-
-
5
293
0.60
-10.6
8.35
0.92
-2.8
9.10
-
-
-
298
0.40
-10.2
7.00
0.72
-0.2
8.75
-
-
-
303
0.72
-15.1
8.00
1.16
-3.7
9.05
-
-
-
308
0.56
-14.7
6.70
1.04
-3.2
8.75
-
-
-
313
0.52
-21.1
7.50
0.76
-2.3
8.75
-
-
-
отличие от буферных систем с аминометансульфо-
ношения соснование/скислота = 0.2 (pH < 6.50). Даль-
натами калия и натрия [35].
нейшее прибавление основания приводит к связы-
Согласно проведенным расчетам, постепен-
ванию N+H3CH2SO2O- с NH2CH2CH2OH в триаду
ное увеличение концентрации 2-аминоэтанола 6 в
Б [уравнения (1), (3) и (5), соснование/скислота = 0.5)].
водном растворе аминометансульфокислоты при-
При рН ≤ 7.0 (рис. 1) протекает реакция (13), в ре-
водит к связыванию цвиттер-ионной формы по
зультате которой нейтральная триада переходит в
уравнению (4) в ионную триаду А вплоть до соот-
отрицательно заряженный ассоциат Б.
(13)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
Р
АВНОВЕСНЫЕ ПРОЦЕССЫ В РАСТВОРАХ
499
Рис. 3. Кондуктометрические кривые титрования во-
дных растворов R- аминометансульфокислот 1-5 (1-5)
водным раствором 2-аминоэтанола 6 при 293 K. V01-5
25 мл, c01-5 0.01 моль/л, c06 0.1 моль/л; Δκ = κ3 - κ2 - κ1,
где κ1 - удельная электропроводность (См·м-1) системы
основание 6-Н2О; κ2 - удельная электропроводность
(См·м-1) системы кислота 1-5-Н2О; κ3 - удельная элек-
тропроводность (См·м-1) системы кислота 1-5-осно-
вание 6-Н2О.
Указанные процессы обуслoвливают появление
первых эффектов на редоксметрических кривых:
скачка на интегральной (рис. 2, 1) и максимума на
дифференциальной кривой (табл. 2).
В отличие от незамещенной аминометансуль-
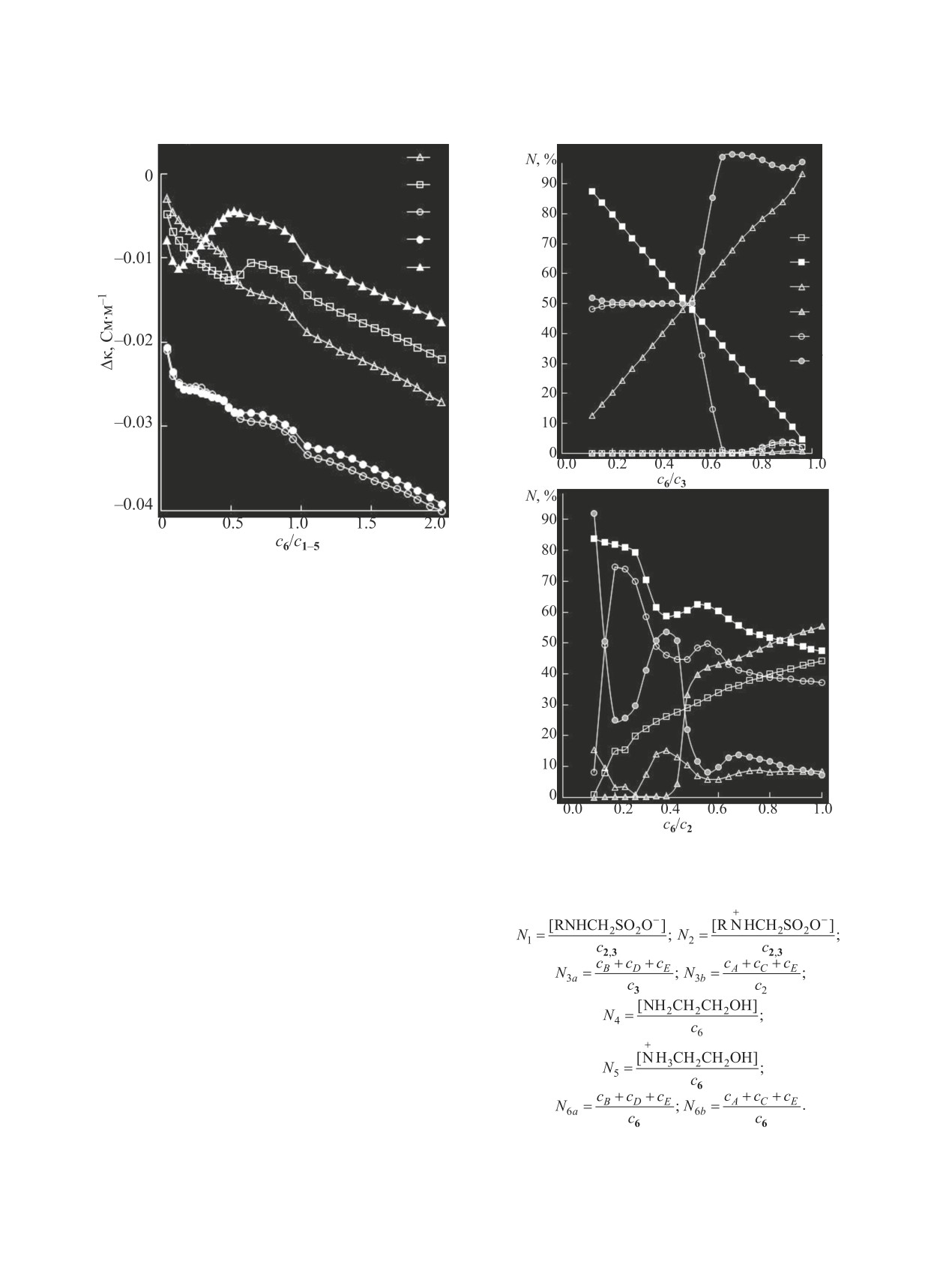
Рис. 4. Соотношение различных форм (А-Д) компо-
фокислоты 1, ее N-(2-гидрокси)этил- и N-бензил-
нентов в системах RNHCH2SO3H (2, 3)-NH2CH2CН2ОН
производные при соотношениях соснование/скислота <
(6)-H2O в зависимости от соотношения c6/c2,3 при 293
K. R = HOCH2CH2 (а); CH3 (б). Мольная доля:
0.5 образуют только отрицательно заряженные
ионные триады Б. Косвенно подтверждает обра-
зование заряженных триад в системе с N-бензил
аминометансульфокислотой 5 участок на кондук-
тометрической кривой, на котором значения Δκ
увеличиваются.
Для систем с кислотами
1,
3,
5 при
соснование/скислота < 0.5 2-аминоэтанол 6 находится
в виде протонированной формы N+H3CH2CH2OH
(рис. 4а, 5) и ионных ассоциатов А и/или Б
(рис. 4а, 6); доля протонированной формы прибли-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
500
ХОМА и др.
Таблица 2. Характеристики редокс-метрических кривых титрования 0.01 М. растворов аминометансульфокислоты
1-5 0.1 М. водным раствором 2-аминоэтанола 6 при 293 K
Интегральная кривая
Дифференциальная кривая
Эффект
с6/с1-5
E, мВ
вид
dЕ/dpс6, мВ
1
1-й
0.20
89
Максимум
376
2-й
0.50
80
Минимум
0
3-й
0.60
70
Максимум
279
4-й
0.80
55
Минимум
63
5-й
1.00
42
Максимум
198
6-й
1.20
35
Плато
0
2
1-й
0.20
10
Минимум
53
2-й
0.32
-59
Максимум
1053
3-й
0.40
-70
Минимум
68
4-й
0.50
-85
Максимум
187
5-й
1.00
-115
Плато
0
3
1-й
0.20
155
Минимум
0
2-й
0.40
166
Максимум
1066
3-й
0.60
0
Минимум
71
4-й
0.68
-54
Максимум
1883
5-й
1.00
-85
Плато
0
4
1-й
0.05
30
Максимум
830
2-й
1.00
-66
Минимум
-266
3-й
1.20
-75
Плато
0
5
1-й
0.05
103
Максимум
1133
2-й
0.75
310
Минимум
240
3-й
1.00
-60
Максимум
2477
4-й
1.20
-75
Плато
0
Таблица 3. Характеристики кондуктометрических кривых титрования 0.01 М. растворов аминометансульфокислоты
1-5 0.1 М. водным раствором 2-аминоэтанола 6 при 293 K
Кислота
Эффект
с6/с1-5
Δκ, См·м-1
Вид
1
1-й
0.50
-0.0111
Излом
2-й
1.00
-0.0185
Излом
2
1-й
0.50
-0.0127
Минимум
2-й
0.64
-0.0106
Максимум
3-й
1.00
-0.0144
Излом
3
1-й
0.20
-0.0253
Минимум
2-й
0.50
-0.0290
Излом
3-й
1.00
-0.0144
Излом
4
1-й
0.20
-0.0257
Минимум
2-й
0.50
-0.0282
Излом
3-й
1.00
-0.0323
Излом
5
1-й
0.12
-0.0113
Минимум
2-й
0.50
-0.0045
Максимум
3-й
0.80
-0.0060
Излом
4-й
1.00
-0.0100
Излом
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
Р
АВНОВЕСНЫЕ ПРОЦЕССЫ В РАСТВОРАХ
501
Таблица 4. Значения коэффициентов Аi и Вi в уравнении (18) для ионных ассоциатов A-Д
T, K
Ai
R2 а
с6/с1-5
Ai
R2 а
с6/с1-5
Ai
R2 а
с6/с1-5
1
A
Б
Г
293
9.24
-10.83
16.10
0.9798
0-0.20
-6.379
-256.9
0.9764
0.25-0.50
8.326
-1460
0.9827
0.50-1.00
298
9.31
-8.347
-114.9
0.9582
0-0.20
14.70
-1480
0.8952
0.25-0.50
-15.99
917.7
0.9054
0.50-0.70
303
9.02
-8.211
-157.7
0.9607
0-0.20
-1.612
-492.3
0.9564
0.25-0.50
10.94
-1631
0.9656
0.50-0.70
308
8.88
-
-
-
-
-0.797
-580.8
0.9451
0-0.50
-6.236
-393.7
0.9770
0.50-0.70
313
8.80
-8.052
-150.8
0.9985
0-0.20
-5.429
-255.4
0.9668
0.25-0.50
1.683
-640.3
0.9710
0.50-0.70
2
A
В
Д
293
9.67
-6.922
0
0.9999
0-0.24
-12.18
505.9
0.9432
0.25-0.44
-9.079
430.9
0.9742
0.50-10.0
298
9.71
-7.031
0
0.9999
0-0.24
-7.364
195.9
0.9894
0.25-0.44
-6.306
261.2
0.9875
0.50-10.0
303
9.56
-6.962
0
0.9999
0-0.24
-8.264
262.7
0.9979
0.25-0.44
-7.263
321.7
0.9869
0.50-10.0
308
9.34
-6.792
0
0.9999
0-0.24
-7.849
229.2
0.9999
0.25-0.44
-7.707
377.4
0.9481
0.50-10.0
313
8.77
-6.350
0
0.9999
0-0.24
-9.817
411.3
0.9927
0.25-0.44
-7.179
336.7
0.9833
0.50-10.0
3
В
Г
Д
293
9.37
-5.769
-453.9
0.9739
0-0.56
3.378
-1237
0.9871
0.58-1.00
-
-
-
-
298
9.21
-5.520
-502.8
0.9827
0-0.48
-4.465
-835.3
0.9618
0.84-1.00
-
-
-
-
303
9.02
-6.683
-392.4
0.9969
0-0.48
-4.091
-496.6
0.9881
0.52-1.00
-
-
-
-
308
8.74
1.841
-810.0
0.9713
0-0.44
10.77
-1398
0.9791
0.52-0.72
-5.481
218.7
0.9902
0.80-10.00
313
8.01
34.89
-2593
0.9641
0-0.44
-
-
-
-
-4.929
150.8
0.9891
0.52-10.00
4
Б
Г
Д
293
9.91
30.38
-2237
0.9878
0-0.56
-5.381
189.4
0.8367
0.58-1.00
-
-
-
-
298
9.99
23.31
-153
0.9545
0-0.48
-5.242
175.0
0.9670
0.56-1.00
-
-
-
-
303
9.95
-29.66
1330
0.9748
0-0.48
-7.271
266.8
0.9586
0.56-1.00
-14.71
703.3
0.9448
1.00-10.00
Б
В
Д
308
9.42
-7.778
0
0.9999
0-0.16
-9.548
345.6
0.8626
0.20-1.00
-2.61
0
0.9999
1.00-10.00
313
7.56
-6.127
0
0.9999
0-0.16
-12.22
599.1
0.9657
0.20-1.00
-3.778
-61.20
0.6137
1.00-10.00
5
Б
Г
Д
293
8.76
16.87
-1674
0.9970
0-0.48
-6.209
253.5
0.9659
0.52-1.00
-
-
-
-
298
8.97
19.69
1828
0.9922
0-0.48
-6.152
233.3
0.9358
0.52-1.00
-
-
-
-
303
8.61
-5.103
-403.5
0.9902
0-0.48
3.306
-1070
0.9752
0.52-1.00
-
-
-
-
308
7.56
5.626
-948.0
0.9755
0-0.48
-12.89
684.5
0.9761
0.52-1.00
-12.45
766.8
0.9681
1.00-10.00
313
6.25
13.43
-1185
0.9769
0-0.56
-5.00
0
0.9999
0.90
-2.209
0
0.9567
1.00-10.00
а R2 - величина достоверности аппроксимации.
зительно равна суммарной доле ассоциатов. Даль-
с цвиттер-ионами (рис. 4, 3, 6) в ионную пару Г за
нейшее увеличение количества 2-аминоэтанола 6
счет протекания реакций (7) и (14).
в указанных системах приводит к его связыванию
(14)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
502
ХОМА и др.
социат А, который при дальнейшем увеличении
общего количества 2-аминоэтанола переходит в
ионную триаду В [уравнение (15)], в отличие от
других аминометансульфокислот. Это обусловли-
вает изломы на соответствующих кривых (рис. 4б,
3, 6).
(15)
Происходит связывание цвиттер-ионов (рис. 4б,
2) с ионами N+H3CH2CH2OH (рис. 4б, 5) по ре-
акции (6). Описанные процессы обуслoвливают
появлению максимумов на дифференциальных
рН-метрических кривых (табл. 1), скачок на инте-
гральной (рис. 2, 2) и максимум на дифференци-
альной (табл. 2) редокс-метрических кривых ти-
трования (табл. 2).
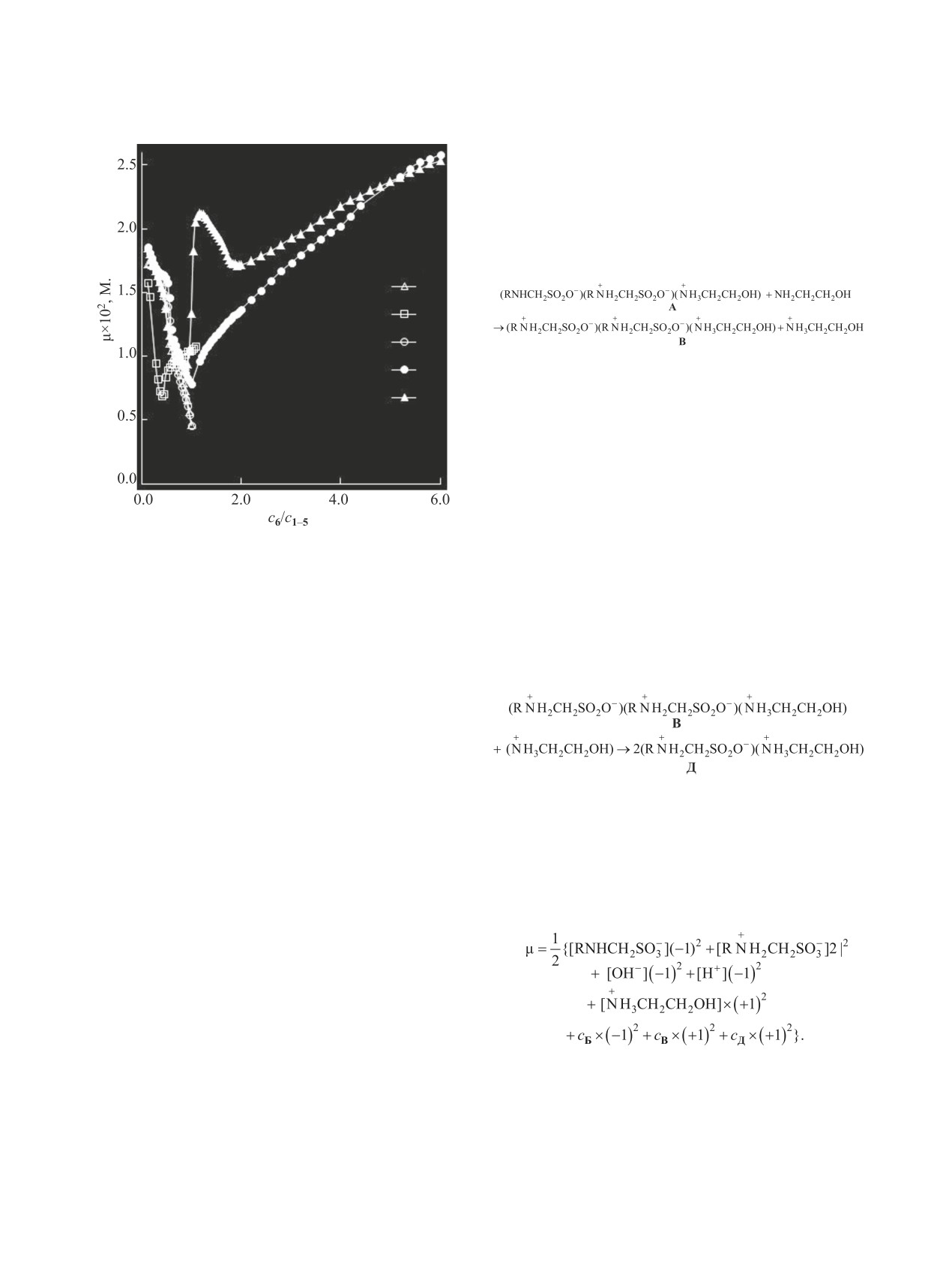
Рис. 5. Концентрационные зависимости ионных
В системе с кислотой 2 триада В при с6/с2 > 0.45
сил (μ, моль/л) в системах RNHCH2SO3H (1-5)-
(pH > 9.20) с увеличением концентрации 2-амино-
NH2CH2CН2ОН (6)-H2O (1-5) при 293 K. R = H (1),
этанола переходит в ионную пару Д [уравнение
CH3 (2), HOCH2CH2 (3), (CH3)3C (4), C6H5CH2 (5).
(16)]. Это приводит к появлению эффектов на
Начало реакции (14) фиксируется редокс-ме-
дифференциальной редокс-метрической (табл. 2)
трическим (рис. 2, 1, 3, 5; табл. 2) и кондуктоме-
и кондуктометрической (рис. 4, 2) кривых титро-
трическим (рис. 3, 1, 3, 5; табл. 3) титрованием при
вания.
соотношении соснование/скислота ≈ 0.5.
Поведение N-трет-бутиламинометансульфо-
(16)
кислоты 4 в области температур 293-303 K ана-
логично кислоте 3. Согласно расчетам (табл. 4),
вначале (соснование/скислота < 0.5) образуются отри-
цательно заряженные ионные триады, которые
Согласно проведенным расчетам, в исследо-
при соотношении соснование/скислота ≥ 0.56 перехо-
ванных системах N-алкиламинометансульфокис-
дят в ионную пару Г, что подтверждается данны-
лота-2-аминоэтанол-вода в температурном диа-
ми кондуктометрии и редокс-метрии. Ход кривых
пазоне 293-313 K образование ион-молекулярного
титрования водного раствора кислоты 3 (рис. 2, 3,
ассоциата Е не происходит. В связи с этим ионная
кривые 3) подобен ходу кривых титрования водно-
сила растворов определяется выражением (17).
го раствора кислоты 4 (рис. 2, 3, кривые 4).
В области 1.0 < соснование/скислота ≤ 10.0 для си-
стем с кислотами 3, 5 (при 308 и 313 K) и 4 (при
303-313 K) зафиксировано образование ассоциата
Д (табл. 4). Кроме того, кислота 4 при 308 и 313
(17)
K образует положительно заряженную триаду В
вместо ожидаемой ионной пары Г, характерной
Из-за отмеченной выше многокомпонентности
для кислот 1, 3, 5.
ион-молекулярного состава изученных систем,
Кислота
2,
подобно кислоте
1,
при
концентрационные зависимости ионной силы
соснование/скислота
≤ 0.24 (pH ≤ 9.10) образует ас-
(рис. 5) имеют сложный характер. В областях об-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
Р
АВНОВЕСНЫЕ ПРОЦЕССЫ В РАСТВОРАХ
503
Таблица 5. Значения липофильности (lgPow) аминометансульфокислот 1-5 и параметров уравнений (19) и (20) для
ионных ассоциатов A-Д
Кислота
lgPow [35]
Ассоциат
Уравнение
αi±Δα
δi±Δδ
R2 а
T, K
1
-0.67
A
19
-3.024±0.646
-0.573±0.071
0.9847
298-313
2
-0.27
A
19
-0.021±0.003
-0.723±0.030
0.9949
293-313
1
-0.67
Б
20
-607.4±12.9
-59.35±1.69
0.9976
293-313
3
-0.71
Б
20
-753.4±15.3
-52.53±0.93
0.9990
293-313
4
0.57
Б
20
-386.8±73.8
-58.25±2.64
0.9980
293-303
5
1.51
Б
20
193.8±41.2
88.62±4.23
0.9610
298-308
2
-0.27
В
20
-283.2±66.8
-66.44±7.22
0.9658
293-303
1
-0.67
Г
20
-664.6±95.9
-90.76±9.72
0.9667
293-313
3
-0.71
Г
20
-920.8±110.2
-50.74±17.21
0.8129
293-308
4
0.57
Г
20
-48.48±5.23
-43.40±3.70
0.9928
293-303
2
-0.27
Д
20
-110.9±6.82
-60.81±8.17
0.9486
293-313
а R2 - величина достоверности аппроксимации.
разования ионных триад А-В и ионной пары Г
рβI(T) = αi + δipKa(T).
(19)
для систем с кислотами 1 и 3 ионная сила μ имеет
Анализируя данные табл. 4, следует также от-
одинаковые значения (в пределах ошибки экспе-
метить, что для ионных ассоциатов Б-Д констан-
римента); для всех изученных систем ионная сила
ты уравнения (18) связаны между собой зависимо-
изменяется антибатно отношению соснование/скислота
стью (20) (табл. 5).
(рис. 5). В областях существования ионной пары Д
Bi = αi + δiAi ,
(20)
в системах с кислотами 3 и 4 (при соснование/скислота >
Для ионных ассоциатов одинакового состава
1.0), а также в системе с кислотой
5
параметры уравнений (19) и (20) изменяются сим-
(соснование/скислота > 2.0) взаимосвязь указанных ве-
батно липофильности (lgPow) соответствующих
личин имеет симбатный характер.
им аминометансульфокислот (табл. 5).
Рассчитаны концентрационные константы об-
В заключение следует отметить, что аминоме-
разования βА-βД ионных ассоциатов. В условиях
тансульфокислота и ее N-алкилпроизводные явля-
эксперимента отрицательные десятичные лога-
ются практически нетоксичными соединениями
рифмы указанных констант образования (рβi) <
[37] (V класс токсичности по классификации [38]
-1.0. Зависимости рβi от ионной силы растворов
или IV класс [39]). С учетом выявленных факто-
(μ, моль/л) имеют линейный характер и описыва-
ров, влияющих на константы образования ионных
ются уравнением (18), параметры которого пред-
пар и триад в системах аминометансульфокисло-
ставлены в табл. 4.
та-2-аминоэтанол-H2O, полученные результаты
рβi = Ai + Biμ.
(18)
рекомендуется использовать при оценке буферных
Четкой температурной зависимости концентра-
свойств исследованных растворов, а также при
ционных констант βА-βД, а также коэффициентов
разработке хемосорбентов-амфолитов на их основе.
уравнения (18) не наблюдается. Это, очевидно,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
указывает на различный тип связывания в ассоци-
атах одинакового состава при разных температу-
В исследованиях использовали аминометан-
рах.
сульфокислоту 1 и ее N-алкилпроизводные 2-5,
Сила кислоты 1 и ее N-метилпроизводного
синтезированные по оригинальным методикам
(pKa, табл. 4) при определенной температуре сим-
[23, 40-44]. Для приготовления исследуемых рас-
батна термодинамической константе образования
творов использовали дистиллированную воду,
соответствующих ионных триад В, т. е. (в соот-
при подготовке дистиллята для удаления О2 и СО2
ветствии с определением [36]) значению коэффи-
продували азот, предварительно очищенный про-
циента Ai в уравнении (18). Параметры уравнения
пусканием через щелочной раствор пирогаллола и
(19) представлены в табл. 5.
прокаленный хлорид кальция.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
504
ХОМА и др.
Потенциометрические измерения проводили
12.
Li X., Feng D., Chai M., Xu S., Mohammedomar A.,
при помощи иономера универсального ЭВ-74 и
Zhao W. // Energy Fuels. 2020. doi 10.1021/acs.
energyfuels.0c02404
рН-метра рН-150М. Точность измерения рН ±0.05
13.
Wang L., Zhang Y., Liu Y., Xie H., Xu Y., Wei J. // J.
ед. (ЭВ-74) и ±0.02 ед. (рН-150М), а редокс-потен-
Hazard. Mater. 2020. Article no. 122504. doi 10.1016/j.
циала ±1 мВ (ЭВ-74). Кондуктометрические изме-
jhazmat.2020.122504
рения выполняли на кондуктометре Эксперт-002
14.
Rippie C.W., Bishop H.B. Pat. US2722500A (1955).
(относительная ошибка ≤ 0.5%).
15.
Хома Р.Е., Эннан А.А., Длубовский Р.М., Абрамо-
ва Н.Н. // Вестн. ОНУ. Химия. 2016. Т. 21. № 1. C. 92.
КОНФЛИКТ ИНТЕРЕСОВ
doi 10.18524/2304-0947.2016.1(57).67515
Авторы заявляют об отсутствии конфликта ин-
16.
Hu S.Z., Salamone J.C. Pat. US 2005/0152928A1
(2005).
тересов.
17.
Stoll V.S., Blanchard J.S. // Methods Enzymol. 2009.
СПИСОК ЛИТЕРАТУРЫ
Vol. 463. P. 43. doi 10.1016/s0076-6879(09)63006-8
18.
Serrano-Medina A., Cornejo-Bravo J.M. // J. Mex.
1.
Morsi B.I., Charpentier J.C. // Mass Transfer with
Chem. Soc. 2011. Vol. 55. N 1. P. 2.
Chemical Reaction in Multiphase Systems. NATO ASI
19.
Song K., Park S., Kim W., Jeon C., Ahn J.-W. // Met.
Series (E). 1983. Vol. 72-73. Dordrecht: Springer, 1983.
2017. Vol. 7. N 6. P. 199.
doi 10.1007/978-94-015-6900-2_4
20.
Long R.D., Hilliard N.P., Chhatre S.A. Timofeeva T.V.,
2.
Resnik K.P., Yeh J.T., Pennline H.W. // Int. J. Env.
Yakovenko A.A., Dei D.K., Mensah E.A. // Beilstein J.
Techn. Manage. 2004. Vol. 4. N 1-2. P. 89. doi 10.1504/
Org. Chem. 2010. Vol. 6. N. 31. doi 10.3762/bjoc.6.31
IJETM.2004.004634
21.
Ferreira C.M.H., Pinto I.S.S., Soares E.V., Soares
3.
Воронков М.Г., Гребнева Е.А., Трофимова О.М., Ал-
H.M.V.M. // RSC Adv. 2015. Vol. 5. N 39. P. 30989. doi
банов А.И., Чернов Н.Ф., Чипанина Н.Н. // ЖОХ.
10.1039/c4ra15453c
2006. Т. 76. Вып. 12. С. 1938; Voronkov M.G.,
22.
Grygorenko O.O., Biitseva A.V., Zhersh S. //
Grebneva E.A., Trofimova O.M., Albanov A.I., Cher-
Tetrahedron. 2018. Vol. 74. N 13. P. 1355. doi 10.1016/j.
nov N.F., Chipanina N.N. // Russ. J. Gen. Chem. 2006.
tet.2018.01.033
Vol. 76. N 12. P. 1851. doi 10.1134/S1070363206120012
23.
Хома Р.Е., Гельмбольдт В.О., Эннан А.А., Гриди-
4.
Гельмбольдт В.О. // ЖНХ. 2009. Т. 54. № 6. С 981;
на Т.Л., Федчук А.С., Лозицкий В.П., Ракипов И.М.,
Gelmboldt V.O. // Russ. J. Inorg. Chem. 2009. Vol. 54.
Владыка А.С. // Хим.-фарм. ж. 2019. Т. 53. № 5.
N 6. P. 916. doi 10.1134/S003602360906014X
С. 65; Khoma R.E., Gelmboldt V.O., Ennan A.A.,
5.
Nasrifar K., Tafazzol A.H. // Ind. Eng. Chem. Res. 2010.
Gridina T.L., Fedchuk A.S., Lozitsky V.P., Rakipov I.M.,
Vol. 49. N 16. P. 7620. doi 10.1021/ie901181n
Vladika A.S. // Pharm. Chem. J. 2019. Vol. 53. N 5.
P. 436. doi 10.1007/s11094-019-02016-w
6.
Jeon S.-B., Lee S., Kang M.-K., Kang D.-J., Oh K.-J. //
24.
Goldberg R.N., Kishore N., Lennen R.M. // J. Phys.
Ind. Eng. Chem. Res. 2013. Vol. 52. N 13. P. 4881. doi
Chem. Ref. Data. 2002. Vol. 31. N 2. P. 231. doi
10.1021/ie302667
10.1063/1.1416902
7.
Ren S., Hou Y., Tian S., Chen X., Wu W. // J. Phys.
25.
Benoit R.L., Boulet D., Frechette M. // Can. J. Chem.
Chem. (B). 2013. Vol. 117. N 8. P. 2482. doi 10.1021/
1988. Vol. 66. P. 3038. doi 10.1139/v88-470
jp311707e
26.
Хома Р.Е. // ЖФХ. 2017. Т. 91. № 1. С. 79; Kho-
8.
Jou F.-Y., Mather A.E. // J. Nat. Gas Eng. 2016. Vol. 1.
ma R.E. // Russ. J. Phys. Chem. 2017. Vol. 91. N 1. P.
N 2. P. 141. doi 10.7569/jnge.2016.692504
76. doi 10.1134/S0036024417010125
9.
Хома Р.Е., Длубовский Р.М., Гельмбольдт В.О. //
27.
Perrin D.D., Dempsey B. Buffers for pH and Metal Ion
ЖОХ. 2016. Т. 86. Вып. 8. С. 1271; Khoma R.E.,
Control. London: Springer, 1974. 176 p.
Dlubovskiу R.M., Gelmboldt V.O. // Russ. J. Gen.
28.
Хома Р.Е. // Вестник ОНУ. Химия. 2013. T. 18. № 4.
Chem. 2016. Vol. 86. N 8. P. 1811. doi 10.1134/
С. 63. doi 10.18524/2304-0947.2013.4(48).37890
S1070363216080065
29.
Alvarez V.H., Mattedi S., Martin-Pastor M., Aznar M.,
10.
Babamohammadi S., Shamiri A., Borhani T.N.G.,
Iglesias M. // J. Chem. Thermodyn. 2011. Vol. 43. N 7.
Shafeeyan M.S., Aroua M.K., Yusoff R. // J. Mol. Liq.
P. 997. doi 10.1016/j.jct.2011.01.014
2018. Vol. 249. P. 40. doi 10.1016/j.molliq.2017.10.151
30.
Новицкий Э.Г., Василевский В.П., Грушевенко Е.А.,
11.
Luo Q., Feng B., Liu Z., Zhou Q., Zhang Y., Li N. //
Волков А.В., Васильева В.И. // Электрохимия. 2017.
Energy Fuels. 2018. Vol. 32. N 3. P. 3647. doi 10.1021/
№ 4. С. 445. doi 10.7868/S0424857017040119;
acs.energyfuels.7b03648
Novitskii E.G., Vasilevskii V.P., Grushevenko E.A.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
Р
АВНОВЕСНЫЕ ПРОЦЕССЫ В РАСТВОРАХ
505
Volkov A.V., Vasil’eva V.I. // Russ. J. Electrochem. 2017.
40. Cameron T.S., Chute W.J., Knop O. // Canadian J. Chem.
Vol. 53. N 4. P. 391. doi 10.1134/s1023193517040103
1984. Vol. 62. N 3. P. 540. doi 10.1139/v84-090
31. Wu A., Gao Y., Zheng L. // Green Chem. 2019. Vol. 21.
41. Хома Р.Е., Шестака А.А., Шишкин О.В., Баумер В.Н.,
N 16. P. 4290. doi 10.1039/c9gc01808e
Брусиловский Ю.Э., Короева Л.В., Эннан А.А., Гель-
32. Бек М., Надьпал И. Исследование комплексообразо-
мбольдт В.О. // ЖОХ. 2011. T. 81. Вып. 3. С. 525;
вания новейшими методами. М.: Мир, 1989. 413 с.
Khoma R.E., Shestaka A.A., Shishkin O.V., Baumer V.N.,
33. Худякова Т.А., Крешков А.П. Кондуктометрический
Brusilovskii Yu.E., Koroeva L.V., Ennan A.A., Gelm-
метод анализа. М.: ВШ, 1975. 207 с.
boldt V.O. // Russ. J. Gen. Chem. 2011. Vol. 81. N 3. P.
34. Танганов Б.Б. Взаимодействия в растворах электро-
620. doi 10.1134/s1070363211030352
литов: моделирование сольватационных процессов,
42. Хома Р.Е., Гельмбольдт В.О., Шишкин О.В., Бау-
равновесий в растворах полиэлектролитов и мате-
матическое прогнозирование свойств химических
мер В.Н., Короева Л.В.. // ЖОХ. 2013. Т. 83. Вып. 5.
систем. М.: Академия естествознания, 2009. С. 141.
С. 834; Khoma R.E., Gelmboldt V.O., Shishkin O.V.,
35. Хома Р.Е., Еннан А.А.-А., Чеботарев А.Н., Водзин-
Baumer V.N., Koroeva L.V. // Russ. J. Gen. Chem. 2013.
ский С.В. // Укр. хим. ж. 2019. Т. 85. № 9. С. 3. doi
Vol. 83. N 5. P. 969. doi 10.1134/s1070363213050149
10.33609/0041-6045.85.9.2019.3-16
43. Хома Р.Е., Гельмбольдт В.О., Эннан А.А., Бау-
36. Хартли Ф., Бергес К., Олкок Р. Равновесия в раство-
мер В.Н., Пузан А.Н. // ЖОХ. 2015. Т. 85. Вып. 10.
рах. М.: Мир, 1983. 360 с.
С. 1650; Khoma R.E., Gelmboldt V.O., Ennan A.A.,
37. Khoma R.E., Baumer V.N., Antonenko P.B., Snihach A.O.,
Baumer V.N., Puzan A.N. // Russ. J. Gen. Chem. 2015.
Godovan V.V., Ennan A.A., Dlubovskii R.M., Gelm-
Vol. 85. N 10. P. 2282. doi 10.1134/s1070363215100102
boldt V.V. // Вопр. химии и хим. технол. 2019. № 6.
44. Хома Р.Е., Гельмбольдт В.О., Баумер В.Н., Эн-
С. 255. doi 10.3390/met7060199
нан А.А., Водзинский С.В., Ишков Ю.В., Раки-
38. Сидоров К.К. // Токсикология новых промышленных
пов И.М. // ЖОХ. 2021. Т. 91. Вып. 2. С. 212;
химических веществ. 1973. Вып. 13. С. 47.
39. OECD Guideline for Testing of Chemicals, No 423:
Khoma R.E., Gelmboldt V.O., Baumer V.N., Ennan A.A.,
Acute Oral Toxicity-Acute Toxic Class Method.
Vodzinskii S.V., Ishkov Yu.V., Rakipov I.M. Russ. J.
EU: Organisation for Economic Cooperation and
Gen. Chem. 2021. Vol. 91. N 2. P. 241. doi 10.1134/
Development. 2001
S1070363221020043
Equilibrium Processes in AlkNHCH2SO3H-NH2CH2CH2OH-
H2O Solutions
R. E. Khomaa,b,*, A. A. Ennana, R. M. Dlubovskiia, Yu. V. Ishkovb,
T. S. Bienkovskaa, and E. M. Rakhlitskayab
aPhysical-Chemical Institute of Environment and Human Protection of the Ministry of Education and Science
and the National Academy of Sciences of Ukraine Odessa, 65082 Ukraine
bOdessa I.I. Mechnikov National University, Odessa, 65082 Ukraine
*e-mail: rek@onu.edu.ua
Received March 1, 2021; revised March 1, 2021; accepted March 11, 2021
Acid-base interactions in the aminomethanesulfonic (N-alkylaminomethanesulfonic) acid-monoethanolamine-
water (alkyl = methyl, 2-hydroxyethyl, tert-butyl and benzyl) systems in the temperature range of 293-313 K
were investigated by pH, redox and conductometric measurements. The ionic and molecular compositions of
these solutions and formation constants of ionic pairs and triples were calculated. Relative stability of the ionic
associates correlated with lipophilicity (lgPow) and strength (pKa) of acids forming them.
Keywords: aminomethanesulfonic acids, monoethanolamine, acid-base equilibrium, ionic associates
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021