ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 510-516
УДК 547-31/-39:547.422
ЩЕЛОЧНОЙ АЛКОГОЛИЗ ПРОИЗВОДНЫХ
гем-ДИХЛОРЦИКЛОПРОПАНА
© 2021 г. Г. З. Раскильдина*, Г. Н. Сахабутдинова, А. И. Мусин, С. С. Злотский
Уфимский государственный нефтяной технический университет, ул. Космонавтов 1, Уфа, 450062 Россия
*e-mail: graskildina444@mail.ru
Поступило в Редакцию 26 января 2021 г.
После доработки 30 января 2021 г.
Принято к печати 7 февраля 2021 г.
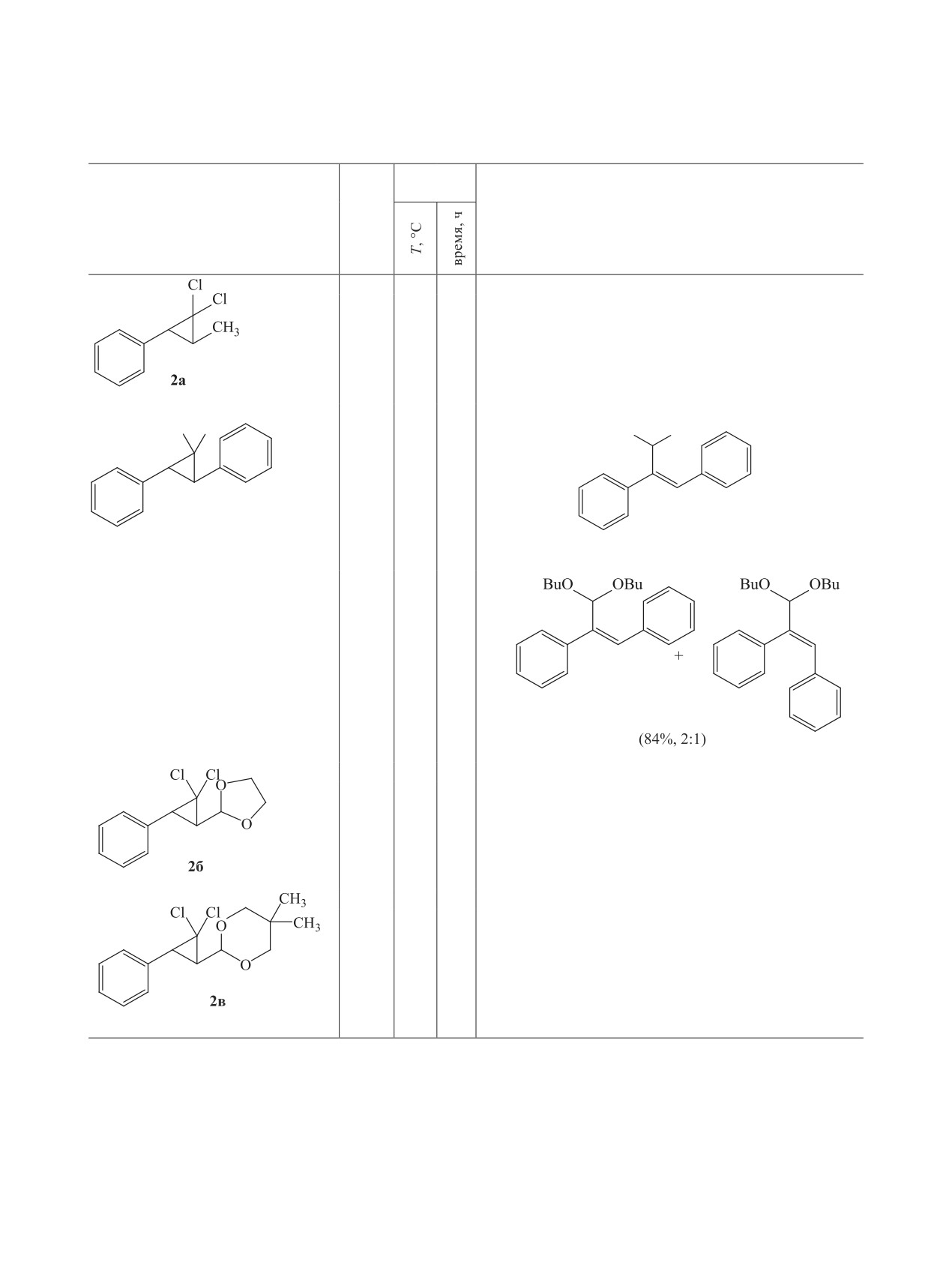
Реакцией дихлоркарбенирования получены производные гем-дихлорциклопропана: (3-метил-2,2-дихлор-
циклопропил)бензол, 2-(3-фенил-2,2-дихлорциклопропил)-1,3-диоксолан, 5,5-диметил-2-(3-фе-
нил-2,2-дихлорциклопропил)-1,3-диоксан. Исследовано их расщепление щелочью в присутствии
этанола и бутан-1-ола. Методами ЯМР и хромато-масс-спектрометрии установлено строение получен-
ных ацеталей.
Ключевые слова: гем-дихлорциклопропан, алкоголиз, (2,2-дихлорциклопропил)бензол, ацетали
DOI: 10.31857/S0044460X2104003Х
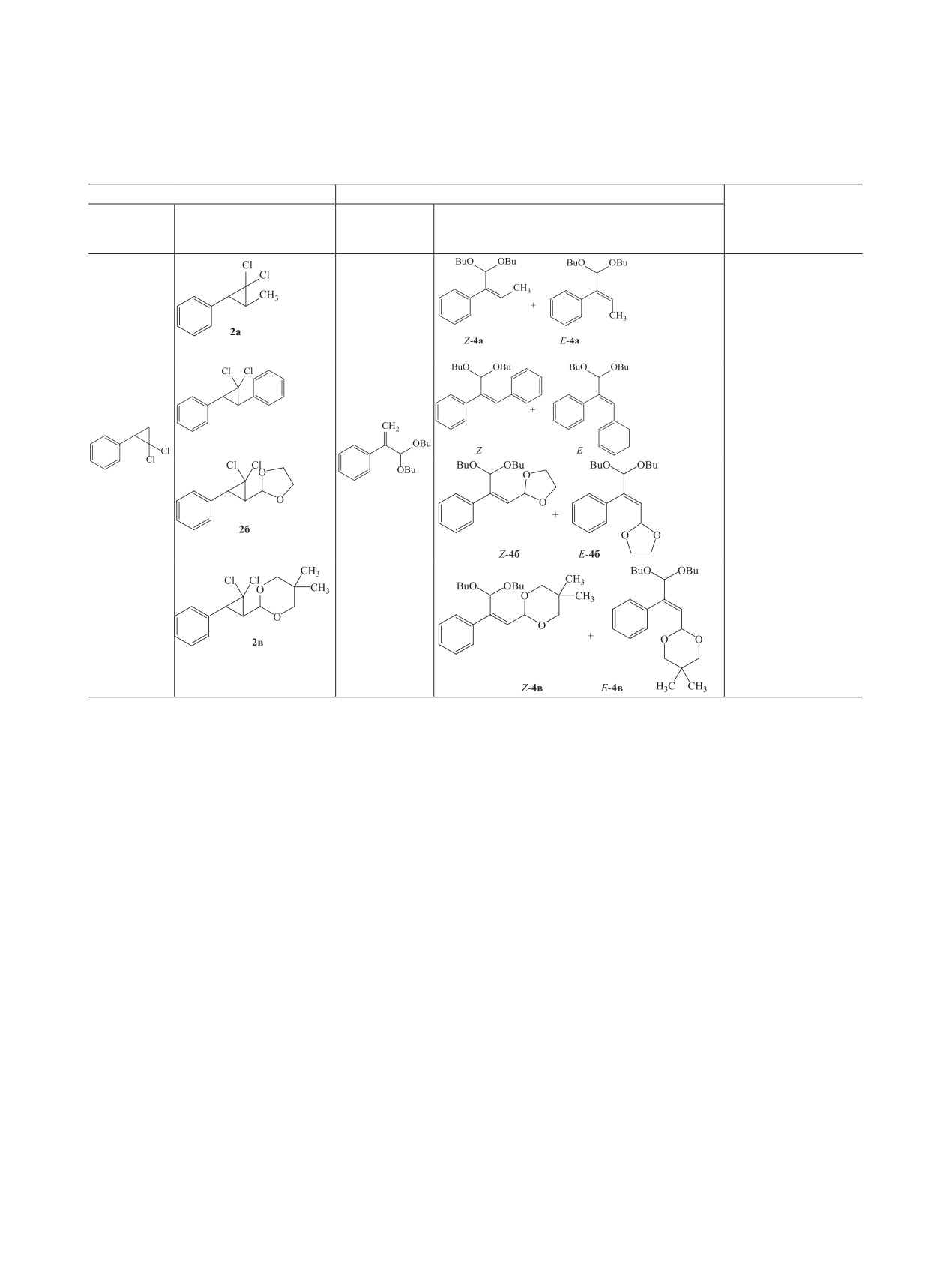
Полифункциональные производные циклопро-
ния соединения 2a потребовалось заменить этанол
пана применяются при получении ингибиторов
на бутан-1-ол и увеличить температуру до 120°С
коррозии, биопрепаратов, добавок к топливу, мас-
(8 ч). В этих условиях выходы ацеталей 4a-в,
лам и полимерам [1-4]. гем-Дигалогеноциклопро-
представляющих собой смесь Z- и E-изомеров,
паны подвергаются расщеплению с образованием
составили 63, 86 и 81% соответственно. В случае
различных соединений [5], например, дибромиды
ацеталей 4б, в преобладают Z-изомеры (Z:E = 3:1).
разрушаются спиртовым раствором щелочи до
Расщепление соединения 2a происходит не сте-
замещенных алкинов [6]. В ряде случаев реакция
реоселективно: Z- и E-изомеры 4а образуются в
протекает неселективно, и наряду с алкинами об-
одинаковых количествах (табл. 1). Вероятно, при
разуются производные карбонильных соединений
расщеплении трехчленного цикла по связи Cl2C-
[7-13].
CHCH3 метильная группа не препятствует враще-
нию вокруг связи PhCH-CHCH3.
Ранее нами был описан синтез ацеталей 2-фени-
лакролеина щелочным алкоголизом (2,2-дихлор-
Методом конкурентных реакций найдено,
циклопропил)бензола
[9,
14]. Продолжая эти
что в условиях бутанолиза циклические ацета-
исследования, мы получили на основе (1Е)-проп-
ли 2б, в по активности близки между собой и с
1-ен-1-илбензола 1a и циклических ацеталей ко-
(2,2-дихлоpциклопропил)бензолом, в то время как
ричного альдегида 1б, в соответствующие произ-
(3-метил-2,2-дихлорциклопропил)бензол
2a по
водные гем-дихлорциклопропана 2а-в и изучили
сравнению с (2,2-дихлоpциклопропил)бензолом в
их алкоголиз в щелочной среде. Нагревание сое-
5 раз менее активен (табл. 2). Очевидно, метильная
динений 2б, в в этаноле (80°С, 20 ч) в присутствии
группа в (3-метил-2,2-дихлорциклопропил)бензо-
NaOH (0.02 г/моль) привело к Z-ацеталям 3б, в с
ле 2a увеличивает прочность трехчленного цикла
сохранением транс-положения заместителей при
и снижает его способность к перегруппировке.
двойной связи (схема 1).
1,1′-(3,3-Дихлорциклопропан-1,2-диил)дибен-
В этих условиях (3-метил-2,2-дихлорциклопро-
зол в 8 раз активнее (2,2-дихлоциклопропил)бен-
пил)бензол 2a оказался устойчив. Для расщепле-
зола, что обусловлено присутствием в молекуле
510
ЩЕЛОЧНОЙ АЛКОГОЛИЗ ПРОИЗВОДНЫХ
511
Схема 1.
дифенилзамещенного
гем-дхлорциклопропана
пропана и исследовано их расщепление щелочью
двух способных к миграции бензильных атомов
в присутствии алифатических спиртов с образо-
водорода [14].
ванием карбонильных соединений с выходами
56-86%.
Строение соединений 3a-в и 4a-в установ-
лено на основании данных ЯМР 1H, 13C и хро-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
мато-масс-спектрометрии. Характерный протон
Продукты реакции анализировали методом
группы CH при двойной связи в спектре ЯМР
ГЖХ на хроматографе Кристалл-2000М (Россия)
1H Z-изомера соединения 4б проявляется в более
с детектором по теплопроводности, газ-носитель -
сильном поле в виде дублета дублетов в области
гелий марки А (колонка длиной 2 м и диаметром
5.80 м. д. в отличие от аналогичного протона в
5 мм, 5% SE-30 на носителе Chromaton N-AW).
E-изомере соединения 4б (5.99 м. д.).
Программированный температурный режим: тер-
В спектре ЯМР 13С E-изомера соединения 4в
мостат колонок 80-230°С, скорость увеличения
сигналы углеродных атомов при двойной свя-
температуры 20 град/мин, температура испарителя
зи проявляются в более слабом поле (126.97 и
и детектора 250°С. Масс-спектры записывали на
137.03 м. д.) по сравнению с сигналами анало-
приборе Кристалл-5000М. Условия анализа: капил-
гичных атомов Z-изомера (125.97 и 136.25 м. д.).
лярная колонка длиной 30 м, температура колонки
Согласно величинам интегральной интенсивности
от 80 до 280°С, температура переходной линии
протонов при двойной связи в спектрах ЯМР 1H,
300°С, температура источника ионов 300°С; по-
соотношение Z- и E- изомеров соединений 4б, в
вышение температуры со скоростью 20 град/мин;
составляет 3:1.
газ-носитель - гелий. Спектры ЯМР 1Н и 13С за-
Таким образом, реакцией дихлоркарбениро-
писывали на спектрометре Bruker AVANCE-500 с
вания получены производные гем-дихлорцикло-
рабочими частотами 400.13 и 75.47 МГц соответ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
512
РАСКИЛЬДИНА и др.
Таблица 1. Щелочной алкоголиз производных (2,2-дихлорциклопропил)бензола
Условия
реакции
Продукт реакции
Соединение
Спирт
(выход, %; соотношение Z- и E-изомеров)
EtOH
80
20
-
BuOH
120
8
4a (63%, 1:1)
EtOH
80
20
Cl Cl
EtO
OEt
[14]
(56%, Z-изомер)
BuOH
120
8
EtOH
80
20
3б (72%, Z-изомер)
BuOH
120
8
4б (86%, 3:1)
EtOH
80
20
3в (73%, Z-изомер)
BuOH
120
8
4в (81%, 3:1)
ственно, растворитель - CDCl3, внутренний стан-
бензола 1а, либо 3.5 г (0.02 моль) 2-[(Е)-2-фенил-
дарт - SiMe4.
этенил]-1,3-диоксолана 1б, либо 4.5 г (0.02 моль)
Производные гем-дихлорциклопропана (2a-в).
5,5-диметил-2-[(E)-2-фенилэтенил]-1,3-диоксана
К смеси 2.4 г (0.02 моль) (1Е)-проп-1-ен-1-ил-
1в, 60 мл CHCl3 и 0.1 г бензилтриэтиламмонийхло-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
ЩЕЛОЧНОЙ АЛКОГОЛИЗ ПРОИЗВОДНЫХ
513
Таблица 2. Относительная активность производных гем-дихлорциклопропана А и В (1:1, моль) в реакции щелочно-
го расщепления в бутан-1-оле (120°С, 3 ч)
Реагенты
Продукты реакции
Относительная
активность
А
Б
В
Г
соединений A/Б
5:1
1:8 [14]
1:1
1:1
рида при энергичном перемешивании в течение
129 (100), 115 (24), 102 (4), 89 (8), 77 (6), 63 (9), 51
30 мин прибавляли 64 г 50%-ного раствора NaOH
(10), 39 (4).
при температуре реакционной смеси, не превыша-
2-(3-Фенил-2,2-дихлорциклопропил)-1,3-ди-
ющей 0°С. После окончания прибавления NaOH
оксолан (2б). Выход 3.8 г (74%), желтая жидкость.
смесь перемешивали 30 мин и выливали в 250 мл
Спектр ЯМР 1Н, δ, м. д.: 2.18 к (1H, CHCCl2, J
холодной воды. Органический слой отделяли, из
6.3 Гц), 2.91 д (1H, CHCHCCl2), J 7.1 Гц), 3.92 т
водного слоя продукты реакции экстрагировали
(1H, CH2CH2O, J 7.1 Гц), 3.98 д (1H, CH2CH2O, J
CHCl3 (2×25 мл). Органические вытяжки сушили
7.1 Гц), 4.02 д (1H, OCH2CH2, J 7.1 Гц), 4.10 т (1H,
CaCl2. Растворитель отгоняли, остаток хромато-
OCH2CH2, J 7.1 Гц), 4.99 д (1H, OCHO, J 6.1 Гц),
графировали на колонке с SiO2 (элюент - гексан).
7.28 д (2HAr, J 7.0 Гц), 7.35 т (2HAr, J 7.0 Гц), 7.43
(3-Метил-2,2-дихлорциклопропил)бензол
т (1HAr, J 7.0 Гц). Спектр ЯМР 13C, δC, м. д.: 36.87
(2а). Выход 3.3 г (83%), желтая жидкость. Спектр
(CHCHCCl2), 37.96 (CHCCl2), 65.38 (OCH2CH2O),
ЯМР 1Н, δ, м. д.: 1.49 д (3Н, CH3, J 6.3 Гц), 1.97-2.03
66.25 (CCl2), 104.01 (OCHO),128.32 (2CAr), 128.61
м (1Н, CH), 2.44 д (1Н, CHPh, J 8.3 Гц), 7.27 д
(2CAr), 128.88 (CAr), 133.59 (Сi). Масс-спектр, m/z
(2НAr), 7.33 т (1HAr, J 7.1 Гц), 7.38 т (2HAr, J 7.1 Гц).
(Iотн, %): 260 (1) [М]+, 252 (2), 219 (4), 147 (12), 114
(20), 101 (8), 77 (10), 73 (96), 63 (5), 46 (30)
Спектр ЯМР 13C, δC, м. д.: 14.94 (CH3), 29.83 (CH),
41.75 (CHPh), 66.67 (CCl2), 127.48 (CAr), 128.29
5,5-Диметил-2-(3-фенил-2,2-дихлорцикло-
(2CAr), 128.75 (2CAr), 135.09 (Ci). Масс-спектр, m/z
пропил)-1,3-диоксан (2в). Выход 4.7 г (78%),
(Iотн, %): 202 (2) [М]+, 185 (4), 165 (60), 149 (26),
желтая жидкость. Спектр ЯМР 1Н, δ, м. д.: 0.84 с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
514
РАСКИЛЬДИНА и др.
(3H, CH3), 0.88 с (3H, CH3), 2.32 т (1Н, CHCCl2,
J 7.1 Гц), 3.47 д (4Н, OCH2C, J 11.0 Гц), 3.71 к (4H,
J 8.1 Гц), 2.71 д (1Н, CHCHCCl2, J 8.1 Гц), 3.33
CH2CH3, J 7.1 Гц), 4.38 д (1Н, OCHO, J 4.4 Гц),
д (4Н, OCH2C, J 11.0 Гц), 5.28 д (1Н, OCHO,
5.09 с [1H, CH(OEt)2], 5.87 д. д (1H, =CH, J 4.7,
J 8.1 Гц),7.20 д (2HAr, J 7.1 Гц), 7.23 т (2HAr, J
7.1 Гц), 7.34 д (2HAr, J 7.1 Гц), 7.45 т (2HAr, J
7.1 Гц), 7.47 т (1HAr, J 7.1 Гц). Спектр ЯМР 13C, δС,
7.1 Гц), 7.53 т (1HAr, J 7.1 Гц). Спектр ЯМР 13С, δС,
м. д.: 21.90 (CH3), 23.10 (CH3), 30.16 (СCH3), 41.09
м. д.: 15.41 (2CH2CH3), 21.93 (CH3), 23.04 (CH3),
(CHCHCCl2), 44.10 (CHCCl2), 63.05 (CCl2), 80.99
31.49 [С(CH3)2], 62.32 (2CH2CH3), 62.46 (2OCH2C),
(2OCH2C), 107.33 (OCHO), 126.58 (2CAr), 128.30
98.93 (OCHO), 104.63 [CH(OEt)2], 126.23 (=CH),
(2CAr), 128.42 (CAr), 132.64 (Ci). Масс-спектр, m/z
127.83 (CAr), 128.01 (2CAr), 128.41 (2CAr), 133.10
(Iотн, %): 377 (1) [М]+, 299 (2), 185 (10), 149 (16),
(Ci), 136.30 (C=). Масс-спектр, m/z (Iотн, %): 321 (2)
115 (100), 69 (80), 45 (30), 41 (24).
[М]+, 275 (4), 245 (3), 207 (2), 159 (8), 144 (4), 131
(10), 115 (16), 103 (100), 77 (8), 75 (34), 69 (16), 47
Щелочной алкоголиз производных гем-ди-
(10), 41 (4).
хлорциклопропана. К раствору 4.1 г (0.02 моль)
(3-метил-2,2-дихлорциклопропил)бензола
2а,
Выход смеси Z- и E-изомеров 4a (1:1) 3.5 г
либо 5.0 г (0.02 моль) 2-(3-фенил-2,2-дихлорцикло-
(63%), желтое масло.
пропил)-1,3-диоксолана 2б, либо 6.0 г (0.02 моль)
[(2Z)-1,1-Дибутоксибут-2-ен-2-ил]бензол (Z-
5,5-диметил-2-(3-фенил-2,2-дихлорциклопро-
4a). Спектр ЯМР 1Н, δ, м. д.: 0.86 т (6H, CH2CH3,
пил)-1,3-диоксана 2в в этаноле или в бутан-1-оле
J 7.1 Гц), 1.34 к (4H, CH2CH3, J 7.1 Гц), 1.50-1.56
(150 мл) добавляли 0.8 г (0.02 моль) NaOH и кипя-
м (4H, CH2CH2), 1.66 д (3H, CH3), 3.50-3.59 м (4H,
тили соответственно 20 или 8 ч. Через каждые 3 ч
2OCH2), 5.08 с [1H, CH(OBu)2], 5.35 к (1H, =CH,
отбирали пробы по 10 мл реакционной массы для
J 7.1 Гц), 7.21 т (1HAr, J 7.1 Гц), 7.29 т (2HAr, J
определения образования продукта реакции. По
7.1 Гц), 7.54 д (2HAr, J 7.1 Гц). Спектр ЯМР 13С,
окончании реакции реакционную массу охлажда-
δС, м. д.:
11.54
(2CH2CH3), 12.46 (CH3),
18.33
ли, добавляли 10 мл бензола, промывали насыщен-
(2CH2CH3),
31.38
(2CH2CH2),
65.87
(2OCH2),
ным раствором Na2SO4, осушали, растворитель
100.08
[CH(OBu)2], 118.79 (=CH), 127.86 (CAr),
удаляли.
129.30 (2CAr), 129.59 (2CAr), 134.74 (Сi), 134.99
(С=). Масс-спектр, m/z (Iотн, %): 277 (6) [М]+, 208
2-[(1Z)-3,3-Диэтокси-2-фенилпроп-1-ен-1-
(42), 180 (77), 165 (19), 131 (16), 107 (42), 91 (20),
ил]-1,3-диоксолан (3б). Выход 3.9 г (72%), желтое
79 (18), 57 (33), 40 (100).
масло. Спектр ЯМР 1Н, δ, м. д.: 1.24 т (6H, CH2CH3,
J 7.1 Гц), 3.57 к (4H, CH2CH3, J 7.1 Гц), 3.70 т
[(2E)-1,1-Дибутоксибут-2-ен-2-ил]бензол (E-
(1H, CH2CH2O, J 6.8 Гц), 3.85 д (1H, CH2CH2O, J
4a). Спектр ЯМР 1Н, δ, м. д.: 0.80 т (6H, CH2CH3, J
6.8 Гц), 3.94 т (1H, OCH2CH2, J 6.8 Гц), 4.02 д
7.1 Гц), 1.36 к (4H, CH2CH3, J 7.1 Гц), 1.52-1.57 м
(1H, OCH2CH2, J 6.8 Гц), 4.61 д (1H, OCHO, J
(4H, CH2CH2), 1.70 д (3H, CH3, J 7.1 Гц), 3.46-3.50
7.1 Гц), 5.44 с [1H, CH(OEt)2], 5.80 д. д (1H, =CH,
м (4H, OCH2), 5.15 с [1H, CH(OBu)2], 5.29 к
J 4.8, 7.1 Гц), 7.35 д (2HAr, J 7.1 Гц), 7.50 т (2HAr, J
(1H, =CH, J 7.1 Гц), 7.18 т (1HAr, J 7.1 Гц), 7.27
7.1 Гц), 7.59 т (1HAr, J 7.1 Гц). Спектр ЯМР 13С,
т (2HAr, J 7.1 Гц), 7.56 д (2HAr, J 7.1 Гц). Спектр
δС, м. д.: 15.13 (2CH2CH3), 62.54 (2CH2CH3), 65.07
ЯМР 13С, δС, м. д.: 10.98 (2CH2CH3), 11.86 (CH3),
(OCH2CH2О), 99.09 (OCHO), 100.91 (CH(OEt)2),
18.30 (2CH2CH3), 31.22 (2CH2CH2), 65.92 (2OCH2),
126.44 (=CH), 127.69 (2CAr), 127.82 (2CAr), 128.01
100.06
[CH(OBu)2], 118.85 (=CH), 127.82 (CAr),
(CAr), 133.15 (Ci), 143.83 (C=). Масс-спектр, m/z
129.26 (2CAr), 129.66 (2CAr), 134.70 (Сi), 135.04
(Iотн., %): 279 (3) [М]+, 232 (14), 203 (20), 175 (6),
(С=). Масс-спектр, m/z (Iотн, %): 277 (4) [М]+, 208
161 (12), 131 (20), 115 (28), 103 (100), 89 (14), 77
(39), 180 (70), 165 (25), 131 (21), 107 (40), 91 (20),
79 (26), 57 (30), 40 (90).
(38), 73 (36), 47 (20), 31 (6).
Выход смеси Z- и E-изомеров 4б (3:1) 5.8 г
5,5-Диметил-2-[(1Z)-2-фенил-3,3-диэтокси-
проп-1-ен-1-ил]-1,3-диоксан (3в). Выход 4.7 г
(86%), желтое масло.
(73%), желтое масло. Спектр ЯМР 1Н, δ, м. д.: 0.72
2-[(1Z)-3,3-Дибутокси-2-фенилпроп-1-ен-1-
с (3H, CH3), 1.26 с (3H, CH3), 1.33 т (6H, CH2CH3,
ил]-1,3-диоксолан (Z-4б). Спектр ЯМР 1Н, δ, м. д.:
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
ЩЕЛОЧНОЙ АЛКОГОЛИЗ ПРОИЗВОДНЫХ
515
0.95 т (6H, CH2CH3, J 7.1 Гц), 1.37 м (4H, CH2CH3),
(2OCH2), 66.71 (2OCH2C), 99.04 (OCHO), 101.68
1.41 м (4H, CH2CH2), 1.46 м (4H, OCH2), 3.35 т
[CH(OBu)2], 125.97 (=CH), 127.79 (2CAr), 127.87
(1H, OCH2CH2, J 6.8 Гц), 3.48 д (1H, OCH2CH2, J
(2CAr), 127.90 (CAr), 136.25 (Ci), 142.72 (C=). Масс-
6.8 Гц), 3.64 т (1H, CH2CH2O, J 6.8 Гц), 3.68 д
спектр, m/z (Iотн, %): 377 (2) [М]+, 303 (8), 246 (10),
(1H, CH2CH2O, J 6.8 Гц), 5.16 д (1H, OCHO, J
207 (14), 159 (68), 144 (20), 131 (36), 115 (66), 103
7.1 Гц), 5.42 с [1H, CH(OBu)2], 5.80 д. д (1H, =CH,
(100), 77 (16), 69 (38), 57 (84), 44 (46), 41 (52).
J 7.1, 4.7 Гц), 7.30 д (2HAr, J 7.1 Гц), 7.35 т (2HAr, J
5,5-Диметил-2-[(1E)-3,3-дибутокси-2-фенил-
7.1 Гц), 7.50 т (1HAr, J 7.1 Гц). Спектр ЯМР 13С,
проп-1-ен-1-ил]-1,3-диоксан (E-4в). Спектр ЯМР
δС, м. д.: 13.71 (2CH2CH3), 19.36 (2CH2CH3), 31.76
1Н, δ, м. д.: 0.65 с (3H, CH3), 0.78 с (3H, CH3), 0.97
(2CH2CH2), 62.67 (OCH2CH2O), 66.84 (2OCH2),
т (6H, CH2CH3, J 7.1 Гц), 1.23 м (4H, CH2CH3), 1.45
104.03 (OCHO), 110.80 [CH(OBu)2], 116.55 (=CH),
м (4H, CH2CH2), 3.37 д (4Н, OCH2C, J 11.0 Гц), 3.63
127.92 (2CAr), 127.96 (2CAr), 129.11 (CAr), 131.76
м (4H, OCH2), 5.14 д (1Н, OCHO, J 4.4 Гц), 5.41 с
(Ci), 138.19 (C=). Масс-спектр, m/z (Iотн, %): 335 (2)
[1H, CH(OBu)2], 6.06 д. д (1H, =CH, J 4.7, 7.1 Гц),
[М]+, 255 (24), 200 (20), 157 (64), 131 (20), 114 (32),
7.28 т (2HAr, J 7.1 Гц), 7.35 д (2HAr, J 7.1 Гц), 7.50
102 (100), 89 (20), 77 (12), 73 (74), 57 (96), 42 (46),
т (1HAr, J 7.1 Гц). Спектр ЯМР 13С, δС, м. д.: 13.89
30 (54).
(2CH2CH3), 18.90 (2CH2CH3), 21.01 (CH3), 22.69
2-[(1E)-3,3-Дибутокси-2-фенилпроп-1-ен-1-
(CH3),
27.58
[C(CH3)2],
30.98
(2CH2CH2), 66.17
ил]-1,3-диоксолан (E-4б). Спектр ЯМР 1Н, δ, м. д.:
(2OCH2), 66.49 (2OCH2C), 97.82 (OCHO), 102.80
0.82 т (6H, CH2CH3, J 7.1 Гц), 1.27 м (4H, CH2CH3),
[CH(OBu)2], 126.97 (=CH), 127.45 (2CAr), 127.57
1.39 м (4H, CH2CH2), 1.44 м (4H, OCH2), 3.50 т
(2CAr), 127.61 (CAr), 137.03 (Ci), 143.06 (C=). Масс-
спектр, m/z (Iотн, %): 377 (3) [М]+, 303 (10), 246 (15),
(1H, OCH2CH2, J 6.8 Гц), 3.55 д (1H, OCH2CH2, J
207 (30), 159 (80), 144 (26), 131 (52), 115 (82), 103
6.8 Гц), 3.82 т (1H, CH2CH2O, J 6.8 Гц), 3.86 д
(100), 77 (26), 69 (40), 57 (82), 44 (84), 41 (54).
(1H, CH2CH2O, J 6.8 Гц), 5.08 д (1H, OCHO, J
7.1 Гц), 5.40 с [1H, CH(OBu)2], 5.99 д. д (1H, =CH,
ФОНДОВАЯ ПОДДЕРЖКА
J 7.1, 4.7 Гц), 7.23 д (2HAr, J 7.1 Гц), 7.28 т (2HAr, J
Исследования выполнены при государствен-
7.1 Гц), 7.32 т (1HAr, J 7.1 Гц). Спектр ЯМР 13С,
ной поддержке молодых российских ученых -
δС, м. д.: 13.85 (2CH2CH3), 19.29 (2CH2CH3), 31.24
кандидатов наук и докторов наук (грант № МК-
(2CH2CH2), 63.07 (OCH2CH2O), 66.76 (2OCH2),
1689.2020.3).
104.10 (OCHO), 108.50 [CH(OBu)2], 118.32 (=CH),
127.77 (2CAr), 127.90 (2CAr), 129.17 (CAr), 131.92
КОНФЛИКТ ИНТЕРЕСОВ
(Ci), 138.23 (C=). Масс-спектр, m/z (Iотн., %): 335
Авторы заявляют об отсутствии конфликта
(1) [М]+, 255 (20), 200 (6), 157 (78), 131 (12), 114
интересов.
(30), 102 (90), 89 (12), 77 (14), 73 (62), 57 (98), 42
СПИСОК ЛИТЕРАТУРЫ
(38), 30 (48).
1. Борисова Ю.Г., Раскильдина Г.З., Яныбин В.М.,
Выход смеси Z- и E-изомеров 4в (3:1) 6.0 г
Султанова Р.М., Спирихин Л.В., Злотский С.С. //
(81%), желтое масло.
Докл. АН. 2016. Т. 466. № 2. С. 174; Borisova Yu.G.,
5,5-Диметил-2-[(1Z)-3,3-дибутокси-2-фенил-
Raskildina G.Z., Yanybin V.M., Sultanova R.M.,
проп-1-ен-1-ил]-1,3-диоксан (Z-4в). Спектр ЯМР
Spirikhin L.V., Zlotsky S.S. // Doklady Chem. 2016.
1Н, δ, м. д.: 0.67 с (3H, CH3), 0.76 с (3H, CH3), 0.93
Vol. 466. N 2. P. 174. doi 10.1134/S0012500816010043
т (6H, CH2CH3, J 7.1 Гц), 1.25 м (4H, CH2CH3), 1.40
2. Валиев В.Ф., Раскильдина Г.З., Злотский С.С. //
ЖПХ. 2016. Т. 89. Вып. 5. С. 619; Valiev V.F., Raskildi-
м (4H, CH2CH2), 3.35 д (4Н, OCH2C, J 11.0 Гц), 3.59
na G.Z., Zlotsky S.S. // Russ. J. Appl. Chem. 2016.
м (4H, OCH2), 5.08 д (1Н, OCHO, J 4.4 Гц), 5.38 с
Vol. 89. N 5. P. 753. doi 10.1134/S1070427216050116
[1H, CH(OBu)2], 5.86 д. д (1H, =CH, J 4.7, 7.1 Гц),
3. Сухоносова Е.В., Злотский С.С., Чанышев Р.Р. //
7.24 т (2HAr, J 7.1 Гц), 7.38 д (2HAr, J 7.1 Гц), 7.44
Баш. хим. ж. 2017. Т. 24. № 1. С. 7.
т (1H Ar, J 7.1 Гц). Спектр ЯМР 13С, δС, м. д.: 13.85
4. Клеттер Е.А., Ганиуллина Э.Р., Мусавиров О.Р., Ши-
(2CH2CH3), 19.37 (2CH2CH3), 22.00 (CH3), 23.05
риазданова А.Р., Злотский С.С. // Баш. хим. ж. 2009.
(CH3),
27.77
[C(CH3)2],
31.57
(2CH2CH2), 65.38
Т. 16. № 1. С. 16.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
516
РАСКИЛЬДИНА и др.
5. Борисова Ю.Г., Раскильдина Г.З., Злотский С.С. //
9. Yadav G.D., Krishnan M.S. // Org. Proc. Res. Dev. 1998.
ЖОХ. 2016. Т. 86. Вып. 9. С. 1564; Borisova Yu.G.,
Vol. 2. P. 86. doi 10.1021/op970047d
Raskildina G.Z., Zlotsky S.S. // Russ. J. Gen. Chem.
10. Masuhara Y., Tanaka T., Takenaka H., Hayase S.,
2016. Vol. 86. N 9. P. 2126. doi 10.1134/
Nokami T., Itoh T. // J. Org. Chem. 2019. Vol. 84. N 9.
P. 5440. doi 10.1021/acs.joc.9b00415
S1070363216090255
11. Song X., Xu C., Du D., Zhao Z., Zhu D., Wang M. // Org.
6. Костиков Р.Р., Варакин Г.С., Молчанов А.П., Оглоб-
Lett. 2017. Vol. 19. N 24. P. 6542. doi 10.1021/acs.
лин К.А. // ЖОрХ. 1996. Т. 32. Вып. 1. С. 33; Kosti-
orglett.7b03254
kov R.R., Varakin G.S., Molchanov A.P., Ogloblin K.A. //
12. Grant T.N., West F.G. // J. Am. Chem. Soc. 2006.
Russ. J. Org. Chem. 1996. Vol. 32. N 1. P. 31. doi
Vol. 128. N 29. P. 9348. doi 10.1021/ja063421a
10.1002/chin.199644086
13. Kagabu S., Mizoguchi S. // Synthesis. 1995. P. 372. doi
7. Аминова Э.К., Злотский С.С., Казакова А.Н., Прос-
10.1055/S-1996-4220
курнина М.В. // Изв. вузов. Сер. хим. и хим. технол.
14. Сахабутдинова Г.Н., Раскильдина Г.З., Злот-
2013. Т. 56. № 6. С. 11.
ский С.С. // ЖОХ. 2020. Т. 90. Вып. 9. С. 1456;
8. Аминова Э.К., Казакова А.Н., Михайлова Н.Н., Ни-
Sakhabutdinova G.N., Raskil’dina G.Z., Zlotskii S.S. //
заева Э.Р., Байбулатов В.Д., Злотский С.С. // Баш.
Russ. J. Gen. Chem. 2020. Vol. 90. N 9. P. 1750. doi
хим. ж. 2013. Т. 20. № 1. С. 28.
10.1134/S1070363220090248
Alkaline Alcoholysis of gem-Dichlorocyclopropane Derivatives
G. Z. Raskil’dina*, G. N. Sakhabutdinova, A. I. Musin, and S. S. Zlotskii
Ufa State Petroleum Technological University, Ufa, 450062 Russia
* e-mail: graskildina444@mail.ru
Received January 26, 2021; revised January 30, 2021; accepted February 7, 2021
The dichlorocarbenation reaction gave gem-dichlorocyclopropane derivatives: (3-methyl-2,2-dichloro-
cyclopropyl)benzene, 2-(3-phenyl-2,2-dichlorocyclopropyl)-1,3-dioxolane, and 5,5-dimethyl-2- (3-phenyl-2,2-
dichlorocyclopropyl)-1,3-dioxane. Their cleavage with alkali in the presence of ethanol and butan-1-ol was
studied. Structure of the obtained acetals was established by NMR and gas chromatography-mass spectrometry
data.
Keywords: gem-dichlorocyclopropane, alcoholysis, (2,2-dichlorocyclopropyl)benzene, acetals
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021