ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 522-530
УДК 547.789.11:547.789.14
СИНТЕЗ И РЕГИОСПЕЦИФИЧНОЕ БРОМИРОВАНИЕ
(2Е,4Е)-5-АРИЛ-2-(4-АРИЛТИАЗОЛ-2-ИЛ)ПЕНТА-
2,4-ДИЕННИТРИЛОВ
© 2021 г. Н. А. Пахолкаa, В. В. Доценкоb,c, Б. С. Кривоколыскоd, К. А. Фроловa,d,
Н. А. Аксеновc, И. В. Аксеноваc, С. В. Щербаковc, С. Н. Овчаровc, С. Г. Кривоколыскоa,d,*
a Лаборатория «ХимЭкс», Луганский государственный университет имени В. Даля, кв. Молодёжный 20-А/7,
Луганск, 91034 Украина
b Кубанский государственный университет, Краснодар, 350040 Россия
c Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
d Луганский государственный медицинский университет имени Святителя Луки, Луганск, 91045 Украина
*e-mail: ksg-group-lugansk@mail.ru
Поступило в Редакцию 26 февраля 2021 г.
После доработки 26 февраля 2021 г.
Принято к печати 11 марта 2021 г.
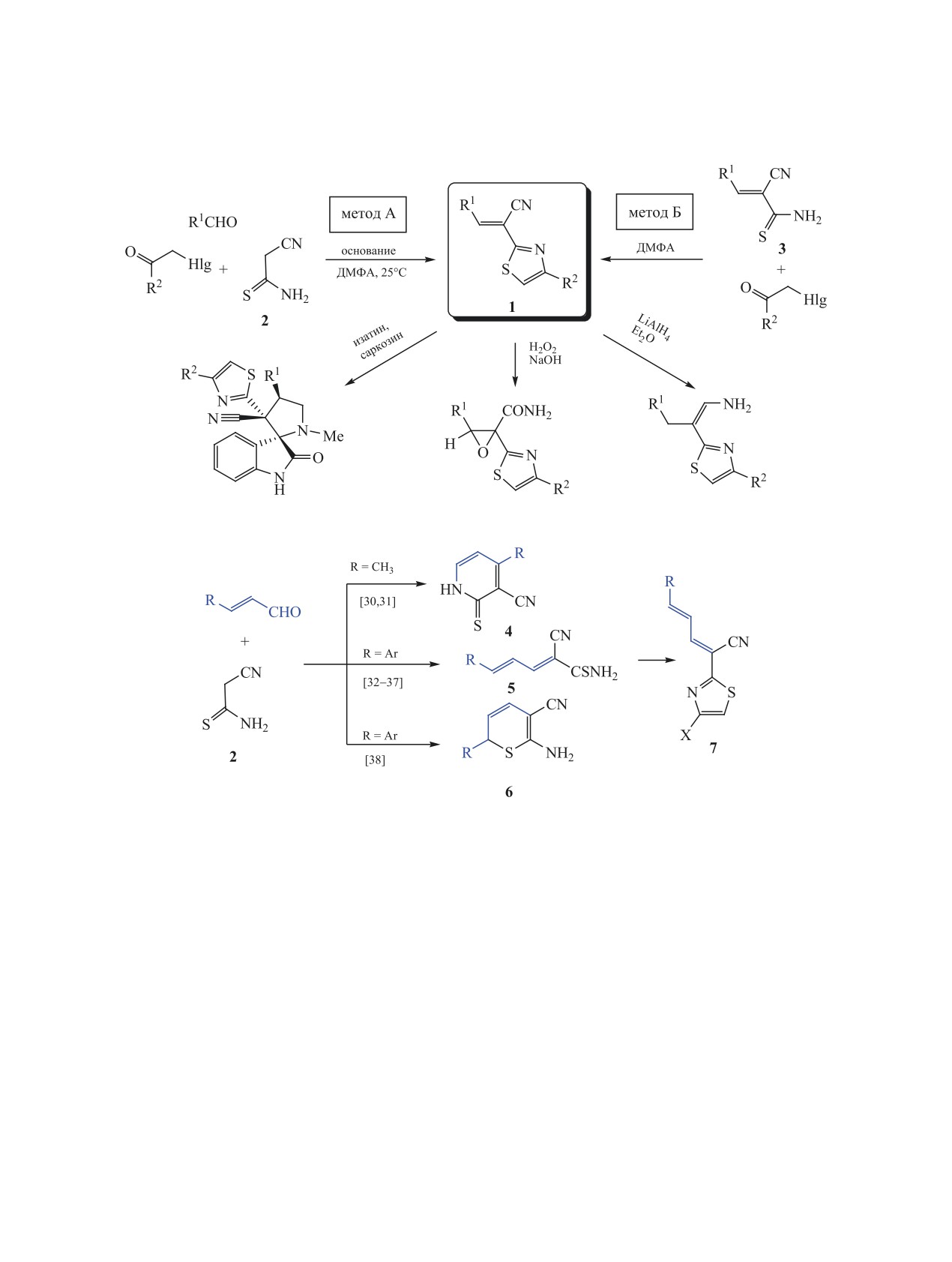
Взаимодействием (2Е,4Е)-5-фенил-2-циано-2,4-пентадиентиоамида или (Е)-3-(2-нитрофенил)акролеина
и цианотиоацетамида с α-бромкетонами получены новые (2Е,4Е)-5-арил-2-(4-арилтиазол-2-ил)пен-
та-2,4-диеннитрилы. Прямое бромирование последних действием брома в ДМФА протекает региоспеци-
фично в положение C5 тиазольного цикла без затрагивания диеновой системы и приводит к образованию
новых (2Е,4Е)-5-арил-2-(5-бром-4-арилтиазол-2-ил)пента-2,4-диеннитрилов.
Ключевые слова: цианотиоацетамид, конденсация Кнёвенагеля, (2Е,4Е)-5-арил-2-циано-2,4-пентади-
ентиоамиды, синтез тиазолов по Ганчу, бромирование, 5-бромтиазолы
DOI: 10.31857/S0044460X21040053
Тиазол и его функциональные производные
да 2 с альдегидами [27-29]. Вместе с тем известно,
зарекомендовали себя в качестве ценных реаген-
что в реакциях с α,β-непредельными альдегидами
тов для органического синтеза и имеют широкое
тиоамид 2 ведет себя неоднозначно: возможно
биологическое применение [1-6]. Из литератур-
образование 2-тиоксопиридинов 4 [30, 31], пен-
ных данных [7-21] следует, что функциональные
тадиентиоамидов 5 [32-37] или 2Н-тиопиранов 6
производные тиазола - 3-R-2-(тиазол-2-ил)акрило-
[38] (схема 2). В литературе имеются единичные
нитрилы 1 - можно легко получить реакцией аль-
упоминания о получении тиазолов 7 по Ганчу с
дегидов с цианотиоацетамидом 2 и α-бром(хлор)-
использованием тиоамидов 5 [39]; в то же время,
кетонами (метод А, схема 1) или методом Ганча из
такие продукты представляют интерес для полу-
(2Е)-3-R-2-цианотиоакриламидов 3 и галогенкето-
чения более сложных систем ряда пирроло[1,2-c]-
нов (метод Б, схема 1). Соединения 1 успешно ис-
тиазолия [40] или полигетероциклических гибрид-
пользовались как активированные электронодефи-
ных молекул [23, 41]. Следует также отметить, что
цитные субстраты в реакциях [3+2]-диполярного
соединения 5 и 7 недостаточно полно охарактери-
циклоприсоединения [22], окисления по Радзишев-
зованы спектральными методами [32-37, 39].
скому с образованием оксиран-2-карбоксамидов
Целью настоящего исследования являлось по-
[23-25], для получения функциональных 2-(β-
лучение новых
2-(4-арилтиазол-2-ил)пента-2,4-
аминовинил)тиазолов [26] (схема 1).
диеннитрилов 7, изучение их строения с привлече-
Непредельные тиоакриламиды 3 обычно легко
нием методов двумерной спектроскопии ЯМР. По-
получить реакцией Кнёвенагеля цианотиоацетами-
мимо этого, в развитие направления работы [42],
522
СИНТЕЗ И РЕГИОСПЕЦИФИЧНОЕ БРОМИРОВАНИЕ
523
Схема 1.
Схема 2.
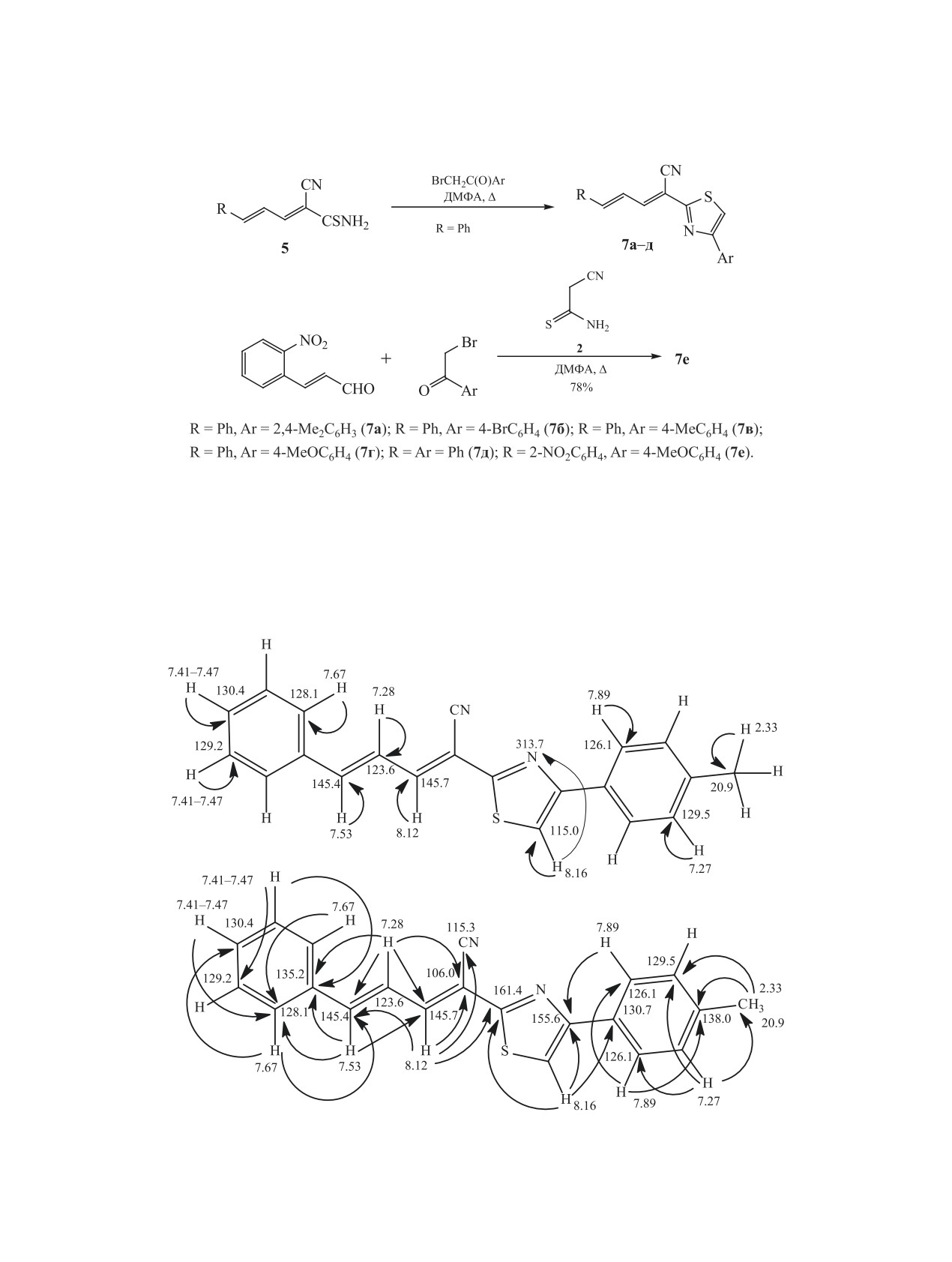
нами была изучена регионаправленность броми-
в ацетоне, ДМФА, умеренно - в хлороформе или
рования соединений 7.
ДМСО, плохо растворимые в этаноле. Строение
При взаимодействии
(2Е,4Е)-5-фенил-2-циа-
полученных соединений 7а-е детально изучено
но-2,4-пентадиентиоамида (5, R = Ph) с α-бромке-
с привлечением методов спектроскопии ЯМР на
тонами при кратковременном нагревании в ДМФА
ядрах 1Н и 13С (DEPTQ), 2D ЯМР (1H-13C HSQC,
нами были получен ряд 2-(4-арилтиазол-2-ил)-
1H-13C HMBC, 1H-15N HMBC) (рис. 1, 2), а также
пента-2,4-диеннитрилов 7a-д с выходами 79-91%
ИК спектроскопии. Характерной особенностью
(схема 3). Также было установлено, что многоком-
спектров ЯМР 1Н соединений 7а-е является нали-
понентная конденсация 3-(2-нитрофенил)акролеи-
чие сигналов протонов Н4, Н5, Н3 пента-2,4-диено-
на с цианотиоацетамидом 2 и далее с 4-метоксифе-
вого фрагмента в областях 7.27-7.29 (д. д, J 11.2-
нацилбромидом в аналогичных условиях приводит
11.4, 14.8-15.3 Гц), 7.52-7.78 (д, J 14.8-15.3 Гц),
к новому производному тиазола 7е c выходом 78%.
8.11-8.25 м. д. (д, J 11.2-11.4 Гц) соответственно.
Тиазолы 7а-е представляют собой мелкокри-
Узкий синглет протона Н5 тиазола обнаруживает-
сталлические порошкообразные вещества жел-
ся при 7.85-8.29 м. д. В спектрах ЯМР 13С сигна-
того или оранжевого цвета, хорошо растворимые
лы углерода =С4Н проявляются в области 123.5-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
524
ПАХОЛКА и др.
Схема 3.
124.7 м. д., фрагмента =С5Н - 138.5-145.6 м. д.,
поглощения, соответствующая валентным коле-
=С3Н - 144.6-146.0 м. д., СС≡N - 105.9-108.5 м. д.,
баниям сопряженной нитрильной группы (2218-
С≡N - 115.0-115.4 м. д., атома С2 тиазола - 160.5-
2226 см-1).
161.8 м. д., атома С4 тиазола - 154.2-155.9 м. д.,
В литературе описаны
[23,
41] единичные
атома С5 тиазола - 113.9-118.1 м. д. В ИК спектрах
примеры, демонстрирующие реакционную спо-
соединений 7а-е наблюдается характерная полоса
собность тиазолов 7. Наличие активированных
Рис. 1. Основные корреляции в спектрах 2D ЯМР HSQC, HMBC 1H-13C и 1H-15N соединения 7в.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И РЕГИОСПЕЦИФИЧНОЕ БРОМИРОВАНИЕ
525
Рис. 2. Основные корреляции в в спектрах 2D ЯМР HSQC и HMBC 1H-13C тиазола 7г.
циклов и сопряженной диеновой системы делает
7а, б значения химических сдвигов, однако сигнал
соединения 7 привлекательными объектами для
С5 тиазола смещается в сильное поле и проявляет-
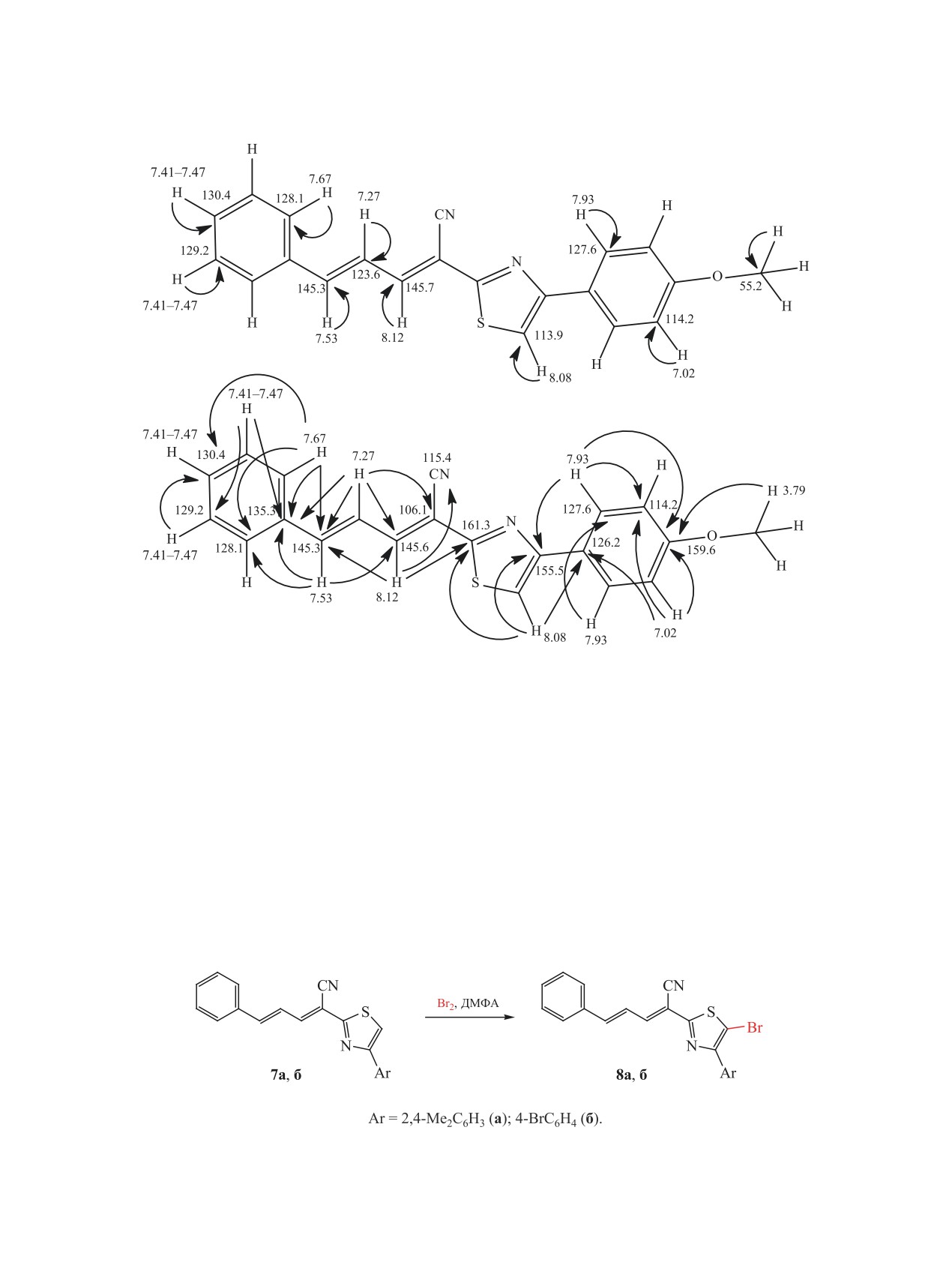
изучения реакций галогенирования. Мы устано-
ся в области 105.3-107.1 м. д. В ИК спектрах сое-
вили, что действие эквимолярного количества или
динений 8а, б также наблюдаются слабые полосы
избытка брома в ДМФА не затрагивает диеновый
поглощения валентных колебаний сопряженной
фрагмент соединений 7а, б. Бромирование проте-
нитрильной группы при 2214-2216 см-1. Данные
кает региоспецифично по положению С5 тиазоль-
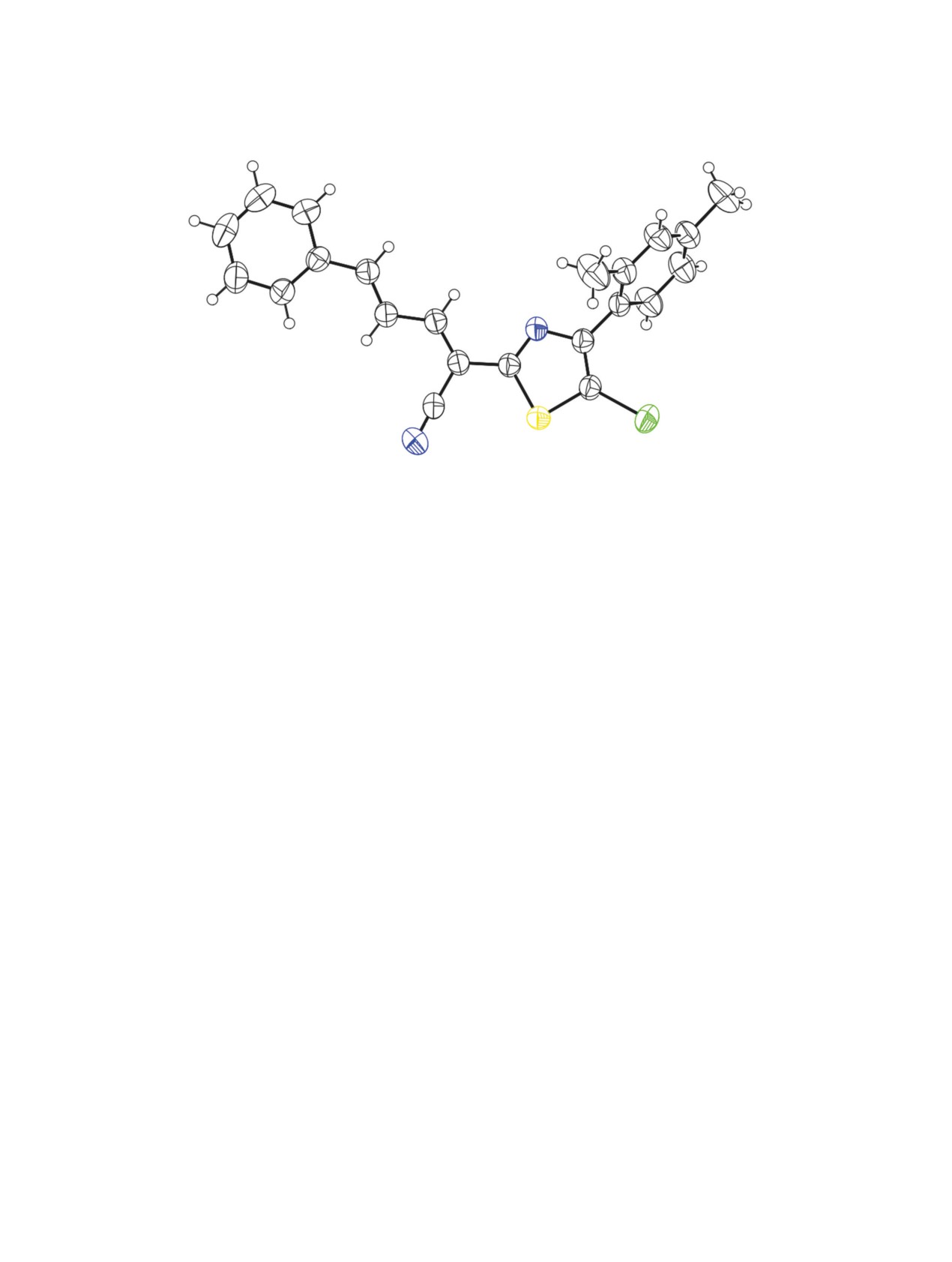
рентгеноструктурного анализа 5-бромтиазола 8а
ного цикла с образованием 5-бромтиазолов 8а, б с
представлены на рис. 3.
выходами 94 и 91% соответственно (схема 4).
Таким образом, получен ряд новых (2Е,4Е)-
В спектрах ЯМР 1Н и 13С соединений 8а, б
5-арил-2-(4-арилтиазол-2-ил)пента-2,4-диенни-
большинство сигналов имеют близкие к тиазолам
трилов и изучено их строение. Показано, что
Схема 4.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
526
ПАХОЛКА и др.
22
C
C11
C18
C17
C10
C21
16
C
C12
C19
C9
8
13
C
C
C20
C14
C15
C7
C2
C6
N2
C3
C4
C1
C5
Br1
S1
N1
Рис. 3. Общий вид молекулы соединения 8a. Тепловые эллипсоиды неводородных атомов показаны на уровне 50%-ной
вероятности нахождения атома.
бромирование синтезированных соединений но-
нитрила в EtOH в присутствии Et3N. В остальных
сит региоспецифичный характер и приводит к
случаях использовали коммерчески доступные
(2Е,4Е)-5-арил-2-(5-бром-4-арилтиазол-2-ил)пен-
реагенты.
та-2,4-диеннитрилам. Строение ключевых продук-
(2Е,4Е)-2-(4-Арилтиазол-2-ил)пента-2,4-ди-
тов реакций установлено с привлечением методов
еннитрилы 7a-д (общая методика). Смесь 1.07 г
2D спектроскопии ЯМР и рентгеноструктурного
(5 ммоль) (2Е,4Е)-5-фенил-2-циано-2,4-пентади-
анализа.
ентиоамида 5, 5 ммоль соответствующего α-брома-
цетофенона в 10 мл ДМФА доводили до кипения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Смесь фильтровали через складчатый бумажный
Спектры ЯМР записаны на спектроме-
фильтр. Через 12 ч кристаллический осадок тиа-
тре Bruker DPX-400 [400.40 (1Н), 100.63 (13С),
золов 7 отфильтровывали, промывали этанолом и
40.55 МГц (15N)] в ДМСО-d6 или CDCl3. Вну-
гексаном, сушили 3 ч при 60°C.
тренний стандарт - ТМС или остаточные сигналы
(2Е,4Е)-2-[4-(2,4-Диметилфенил)тиа-
растворителя. ИК спектры регистрировали на ИК
зол-2-ил]-5-фенилпента-2,4-диеннитрил
(7a).
Фурье-спектрометре Bruker Vertex 70 с пристав-
Выход 85%, желто-оранжевый мелкокристалли-
кой НПВО на кристалле алмаза, спектральное раз-
ческий порошок, т. пл. 138-140°С. ИК спектр, ν,
решение ±4 см-1. Элементный анализ проводили
см-1: 2222 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6),
на C,H,N-анализаторе Carlo Erba 1106. Контроль
δ, м. д.: 2.31 с, 2.42 с (6Н, 2Ме), 7.09 д (1H, H5 Ar, J
чистоты полученных соединений осуществляли
8.0 Гц), 7.13 с (1Н, H3 Ar), 7.28 д. д (1Н, Н4, J 11.3,
методом ТСХ на пластинах Silufol UV254, элюент
15.3 Гц), 7.40-7.47 м (3Н, Н3, Н4, Н5 Ph), 7.53 д (1Н,
ацетон-гексан 1:1, проявитель - пары иода, УФ
H6 Ar, J 8.0 Гц), 7.54 д (1Н, Н5, J 15.3 Гц), 7.68 д. д
детектор. Температуры плавления определяли на
(2Н, Н2, Н6 Ph, J 1.6, 8.0 Гц), 7.85 с (1Н, Н5 тиазол),
столике Кофлера и не корректировали.
8.11 д (1Н, Н3, J 11.3 Гц). Спектр ЯМР 13С, δС, м.
(2Е,4Е)-5-Фенил-2-циано-2,4-пентадиентиоа-
д.: 20.7, 20.9 (2Ме), 106.2* (CC≡N), 115.3* (C≡N),
мид 5 [33, 35] был получен реакцией Кнёвенагеля
118.1 (C5H тиазол), 123.6 (С4Н), 126.6 (CH Ar),
цианотиоацетамида с коричным альдегидом. Ци-
128.0 (C2H, C6H Ph), 129.1 (C3H, C5H Ph), 129.5
анотиоацетамид 2 был синтезирован [43] пропу-
(CH Ar), 130.3 (C4H Ph), 130.7* (C Ar), 131.6 (CH
сканием тока сероводорода через раствор малоно-
Ar), 135.2* (C1 Ph), 135.4*, 137.7* (2C Ar), 145.3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И РЕГИОСПЕЦИФИЧНОЕ БРОМИРОВАНИЕ
527
(C5H), 145.5 (C3H), 155.9* (C4 тиазол), 160.5* (С2
ОМе), 7.02 д (2Н, Н3, Н5 Ar, J 8.7 Гц), 7.27 д. д (1Н,
тиазол). Здесь и далее звездочкой обозначены
Н4, J 11.4, 15.3 Гц), 7.41-7.47 м (3Н, Н3, Н4, Н5 Ph),
сигналы атомов углерода, находящиеся в противо-
7.53 д (1Н, Н5, J 15.3 Гц), 7.67 уш. д (2Н, Н2, Н6 Ph,
фазе в спектре ЯМР 13C DEPTQ. Найдено, %: C
J 7.8 Гц), 7.93 д (2Н, Н2, Н6 Ar, J 8.7 Гц), 8.08 с (1Н,
77.02; H 5.45; N 7.97. C22H18N2S. Вычислено, %: C
Н5 тиазол), 8.12 д (1Н, Н3, J 11.4 Гц). Спектр ЯМР
77.16; H 5.30; N 8.18. М 342.47.
13С, δС, м. д.: 55.2 (ОМе), 106.1* (CС≡N), 113.9 (C5H
(2Е,4Е)-2-[4-(4-Бромфенил)тиазол-2-ил]-
тиазол), 114.2 (C3H, C5H Ar), 115.4* (С≡N), 123.6
(С4Н), 126.2* (C1 Ar), 127.6 (C2H, C6H Ar), 128.1
5-фенилпента-2,4-диеннитрил (7б). Выход 84%,
ярко-желтый мелкокристаллический порошок, т.
(C2H, C6H Ph), 129.2 (C3H, C5H Ph), 130.4 (С4Н Ph),
пл. 176-178°С. ИК спектр, ν, см-1: 2226 сл (С≡N).
135.3* (C1 Ph), 145.3 (C5H), 145.6 (C3H), 155.5* (C4
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 7.28 д. д (1Н,
тиазол), 159.6* (С4 Ar), 161.3* (С2 тиазол). Найде-
Н4, J 11.2, 15.3 Гц), 7.42-7.46 м (3Н, Н3, Н4, Н5 Ph),
но, %: C 73.49; H 4.78; N 7.90. C21H16N2OS. Вычис-
7.54 д ( 1Н, Н5, J 15.3 Гц), 7.66 д (2Н, Н3, Н5 Ar,
лено, %: C 73.23; H 4.68; N 8.13. М 344.44.
J 8.0 Гц), 7.68 м (2Н, Н2, Н6 Ph), 7.95 д (2Н, Н2,
(2Е,4Е)-5-Фенил-2-(4-фенилтиазол-2-ил)-
Н6 Ar, J 8.0 Гц), 8.13 д (1Н, Н3, J 11.2 Гц), 8.29 с
пента-2,4-диеннитрил (7д). Выход 91%, желтый
(1Н, Н5 тиазол). Спектр ЯМР 13С, δС, м. д.: 105.9*
мелкокристаллический порошок, т. пл. 111-113°С.
(CС≡N), 115.2* (С≡N), 116.6 (C5H тиазол), 121.74*
ИК спектр, ν, см-1: 2220 сл (С≡N). Спектр ЯМР
(C4 Ar), 123.5 (C4H), 128.1 (C2H, C6H Ph или Ar),
1Н (ДМСО-d6), δ, м. д.: 7.27 д. д (1Н, Н4, J 11.4,
128.2 (C2H, C6H Ar или Ph), 129.1 (C3H, C5H Ph),
15.3 Гц), 7.37 т (1H, H4 Ar, J 7.2 Гц), 7.41-7.48 м
130.4 (C4H Ph), 131.8 (C3H, C5H Ar), 132.5* (C1 Ar),
(5Н, Н3, Н4, Н5 Ph; H3, H5 Ar), 7.52 д (1Н, Н5, J
135.2* (C1 Ph), 145.6 (C5H), 146.0 (C3H), 154.2* (C4
15.3 Гц), 7.66 д. д (2Н, Н2, Н6 Ph, J 1.5, 7.8 Гц), 8.00
тиазол), 161.8* (С2 тиазол). Найдено, %: C 61.19; H
д (2Н, Н2, Н6 Ar, J 7.6 Гц), 8.12 д (1Н, Н3, J 11.4 Гц),
3.33; N 7.37. C20H13BrN2S. Вычислено, %: C 61.08;
8.23 с (1Н, Н5 тиазол). Спектр ЯМР 13С, δС, м. д.:
H 3.33; N 7.12. М 393.31.
106.0* (CС≡N), 115.3* (С≡N), 115.9 (C5H тиазол),
(2Е,4Е)-2-[4-(4-Метилфенил)тиазол-2-ил]-5-
123.5 (С4Н), 126.2 (2CH Ar), 128.1 (C2H, C6H Ph),
фенилпента-2,4-диеннитрил (7в). Выход 79%,
128.6 (C4H Ar), 128.9 (2CH Ar), 129.2 (C3H, C5H
ярко-желтый мелкокристаллический порошок,
Ph), 130.4 (С4Н Ph), 133.4* (C1 Ar), 135.2* (C1 Ph),
т. пл. 152-154°С. ИК спектр, ν, см-1: 2220 сл (С≡N).
145.5 (C5H), 145.8 (C3H), 155.5* (C4 тиазол), 161.6*
Спектр ЯМР 1Н (ДМСО-d6), δС, м. д.: 2.33 с (3Н,
(С2 тиазол). Найдено, %: C 76.22; H 4.62; N 9.07.
Ме), 7.27** д (2Н, Н3, Н5 Ar, J 8.1 Гц), 7.28** д. д
C20H14N2S. Вычислено, %: C 76.40; H 4.49; N 8.91.
(1Н, Н4, J 11.4, 15.2 Гц), 7.41-7.47 м (3Н, Н3, Н4, Н5
М 314.41.
Ph), 7.53 д (1Н, Н5, J 15.2 Гц), 7.67 д. д (2Н, Н2, Н6
(2Е,4Е)-2-[4-(4-Метоксифенил)тиазол-2-ил]-
Ph, J 1.4, 7.8 Гц), 7.89 д (2Н, Н2, Н6 Ar, J 8.1 Гц),
5-(2-нитрофенил)пента-2,4-диеннитрил
(7е).
8.12 д (1Н, Н3, J 11.4 Гц), 8.16 с (1Н, Н5 тиазол).
Смесь 0.89 г (5 ммоль) (Е)-3-(2-нитрофенил)акро-
**Частичное наложение сигналов. Спектр ЯМР
леина и 0.5 г (5 ммоль) цианотиоацетамида 2 пере-
13С, δС, м. д.: 20.9 (Ме), 106.0* (CС≡N), 115.0 (C5H
мешивали 30 мин в 10 мл ДМФА, затем добавляли
тиазол), 115.3* (С≡N), 123.6 (С4Н), 126.1 (C2H,
1.15 г (5 ммоль) α-бром-4-метоксиацетофенона.
C6H Ar), 128.1 (C2H, C6H Ph), 129.2 (C3H, C5H Ph),
Смесь доводили до кипения, фильтровали через
129.5 (C3H, C5H Ar), 130.4 (С4Н Ph), 130.7* (C1 Ar),
складчатый бумажный фильтр. Через 12 ч осадок
135.2* (C1 Ph), 138.0* (C4 Ar), 145.4 (C5H), 145.7
отфильтровывали, промывали этанолом и гекса-
(C3H), 155.6* (C4 тиазол), 161.4* (С2 тиазол). Най-
ном, сушили 3 ч при 60°C. Выход 1.52 г (78%),
дено, %: C 76.64; H 4.71; N 8.77. C21H16N2S. Вы-
оранжевый мелкокристаллический порошок, т. пл.
числено, %: C 76.80; H 4.91; N 8.53. М 328.44.
194-196°С. ИК спектр, ν, см-1: 2219 сл (С≡N).
(2Е,4Е)-2-[4-(4-Метоксифенил)тиазол-2-ил]-
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.79 с (3Н,
5-фенилпента-2,4-диеннитрил (7г). Выход 85%,
ОМе), 7.02 д (2Н, Н3, Н5 Ar, J 8.3 Гц), 7.29 д. д (1Н,
оранжевый мелкокристаллический порошок, т. пл.
Н4, J 11.2, 14.8 Гц), 7.64 д. д (1Н, Н4 нитрофенил,
160-162°С. ИК спектр, ν, см-1: 2221 сл (С≡N).
J 7.6, 7.7 Гц), 7.78 д (1Н, Н5, J 14.8 Гц), 7.79 м (1Н,
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.79 с (3Н,
Н5 нитрофенил), 7.94 д (2Н, Н2, Н6 Ar, J 8.3 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
528
ПАХОЛКА и др.
8.05 м (2Н, Н3, Н6 нитрофенил), 8.13 c (1Н, Н5
(C2H, C6H Ar), 130.6* (C4H Ph), 131.5 (C1 Ar),
тиазол), 8.25 д (1Н, Н3, J 11.2 Гц). Спектр ЯМР 13С,
131.6* (C3H, C5H Ar), 135.1 (C1 Ph), 146.5* (C5H),
δС, м. д.: 55.2 (OMe), 108.5* (CС≡N), 114.6 (C5H
147.1* (C3H), 151.5 (C4 тиазол), 161.7 (С2 тиазол).
тиазол), 115.0* (С≡N), 124.7 (С4Н), 126.1* (C1 Ar),
Найдено, %: C 51.06; H 2.80; N 5.82. C20H12Br2N2S.
127.7 (C2H, C6H Ar), 127.9, 128.7 (2CH нитрофе-
Вычислено, %: C 50.87; H 2.56; N 5.93. М 472.20.
нил), 129.8* (C1 нитрофенил), 130.7, 133.8 (2CH
Рентгеноструктурный анализ. Эксперимен-
нитрофенил), 138.5 (C5H), 144.6 (C3H), 148.3* (C2
тальный материал для кристалла соединения 8a
нитрофенил), 155.6* (C4 тиазол), 159.6* (C4 Ar),
(C22H17BrN2S) получен на автоматическом четы-
161.0* (С2 тиазол). Найдено, %: C 64.96; H 3.63;
рехкружном дифрактометре Agilent Super Nova,
N 11.06. C21H15N3O3S. Вычислено, %: C 64.77; H
Dual, Cu at zero, Atlas S2 при 293(2) K. Структура
3.88; N 10.79. М 389.44.
расшифрована прямым методом в комплексе про-
Замещенные 5-бромтиазолы 8а, б (общая
грамм Olex2 [44] и ShelXD [45], и уточнена с по-
методика). К раствору 5 ммоль тиазола 7а, б в
мощью пакета SHELXL [46]. Структура уточнена
10 мл ДМФА медленно по каплям добавляли
полноматричным МНК в анизотропном приближе-
0.31 мл (6 ммоль) брома, затем смесь незамедли-
нии для неводородных атомов по F2. Основные ха-
тельно фильтровали через складчатый бумажный
рактеристики эксперимента и параметры элемен-
фильтр. Через 12 ч осадок отфильтровывали, про-
тарной ячейки 8a: размер кристалла 0.475×0.155×
мывали этанолом и гексаном, сушили 3 ч при 60°C.
0.125 мм, кристаллическая система моноклин-
(2Е,4Е)-2-[5-Бром-4-(2,4-диметилфенил)-
ная, пространственная группа P21/c, M 421.34;
тиазол-2-ил]-5-фенилпента-2,4-диеннитрил
параметры ячейки: а 6.63950(5), b 21.33495(19), с
(8a). Выход 94%, желтые игольчатые кристаллы,
14.15181(14)Å,β93.7471(8)°,V2000.37(3)Å3,Z4,dвыч
т. пл. 145-147°С. ИК спектр, ν, см-1: 2214 сл
1.399 г/см3; μ(CuKα) 3.820 мм-1, F(000) 856.0, об-
(С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 2.17 с,
ласть углов съемки θ 7.508-153.132°, интервалы
2.33 с (6Н, 2Ме), 7.10 д (1H, H5 Ar, J 7.3 Гц), 7.17
индексов отражений -5 ≤ h ≤ 8, -26 ≤ k ≤ 26, -17 ≤ l ≤
с (1Н, H3 Ar), 7.23 д (1Н, H6 Ar, J 7.3 Гц), 7.28 д.
17; число измеренных отражений - 21206, число
д (1Н, Н4, J 11.3, 15.3 Гц), 7.44 м (3Н, Н3, Н4, Н5
независимых отражений - 4194 (Rint 0.0234, Rsigma
Ph), 7.53 д (1Н, Н5, J 15.3 Гц), 7.67 м (2Н, Н2, Н6
0.0197), число отражений с I > 2σ(I) - 4194, чис-
Ph), 8.07 д (1Н, Н3, J 11.3 Гц). Спектр ЯМР 13С, δС,
ло уточняемых параметров - 237; R-факторы [I >
м. д.: 19.5, 20.8 (2Ме), 105.6* (CC≡N), 107.1* (C5
2σ(I)]: R1 0.0335 (wR2 0.0961); R-факторы по всем
тиазол), 114.7* (C≡N), 123.5 (С4Н), 126.3 (CH Ar),
отражениям: R1 0.0355 (wR2 0.0981), GOOF по F2
128.2 (C2H, C6H Ph), 129.1 (C3H, C5H Ph), 129.2* (C
1.051, Δρmax и Δρmin 0.35 и -0.65 е/Å3. Результаты
Ar), 129.9 (CH Ar), 130.5 (C4H Ph), 131.0 (CH Ar),
РСА соединения 8a депонированы в Кембридж-
135.1* (C1 Ph), 136.6*, 138.6* (2C Ar), 146.1 (C5H),
ский банк структурных данных (CCDC 2052451).
146.5 (C3H), 155.2* (C4 тиазол), 161.1* (С2 тиазол).
ФОНДОВАЯ ПОДДЕРЖКА
Найдено, %: C 62.49; H 4.22; N 6.44. C22H17BrN2S.
Вычислено, %: C 62.71; H 4.07; N 6.65. М 421.36.
Исследование выполнено при финансовой
(2Е,4Е)-2-[5-Бром-4-(4-бромфенил)тиазол-
поддержке Кубанского научного фонда в рам-
2-ил]-5-фенилпента-2,4-диеннитрил (8б). Выход
ках научного проекта МФИ-20.1-26/20 (заявка
91%, светло-оранжевый мелкокристаллический
№ МФИ-20.1/45) и Министерства образования
порошок, т. пл. 201-203°С. ИК спектр, ν, см-1:
и науки Российской Федерации (тема 0795-2020-
2216 сл (С≡N). Спектр ЯМР 1Н (ДМСО-d6), δ,
0031) с использованием оборудования научно-об-
м. д.: 7.27 д. д (1Н, Н4, J 11.3, 15.3 Гц), 7.45 м (3Н,
разовательного центра «Диагностика структуры
Н3, Н4, Н5 Ph), 7.56 д (1Н, Н5, J 15.3 Гц), 7.69 м (2Н,
и свойств наноматериалов» Кубанского государ-
Н2, Н6 Ph), 7.74 д (2Н, Н3, Н5 Ar, J 8.4 Гц), 7.88 д
ственного университета.
(2Н, Н2, Н6 Ar, J 8.4 Гц), 8.10 д (1Н, Н3, J 11.3 Гц).
КОНФЛИКТ ИНТЕРЕСОВ
Спектр ЯМР 13С, δС, м. д.: 105.3, 105.5 (CС≡N, C5H
тиазол), 114.6 (С≡N), 122.5 (C4 Ar), 123.5* (C4H),
Авторы заявляют об отсутствии конфликта
128.2* (C2H, C6H Ph), 129.2* (C3H, C5H Ph), 130.2*
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И РЕГИОСПЕЦИФИЧНОЕ БРОМИРОВАНИЕ
529
СПИСОК ЛИТЕРАТУРЫ
Relat. Elem. 2004. Vol. 179. P. 2113. doi
10.1080/10426500490475049
1.
Rouf A., Tanyeli C. // Eur. J. Med. Chem. 2015. Vol. 97.
18.
Hassan S.M., Abdel Aal M.M., El-Maghraby A.A.,
P. 911. doi 10.1016/j.ejmech.2014.10.058
Bashandy M.S. // Phosphorus, Sulfur, Silicon,
2.
Tawfik S.S., Liu M., Farahat A.A. // Arkivoc. 2020. Pt i.
Relat. Elem.
2009. Vol.
184. P.
427. doi
P. 180. doi 10.24820/ark.5550190.p011.308
10.1080/10426500802176523
3.
Chhabria M.T., Patel S., Modi P., Brahmkshatriya P.S. //
19.
Дяченко В.Д. // ЖОХ. 2015. Т. 85. № 4. С. 618;
Curr. Top. Med. Chem. 2016. Vol. 16. N 26. P. 2841. doi
Dyachenko V.D. // Russ. J. Gen. Chem. 2015. Vol. 85.
10.2174/1568026616666160506130731
N. 4. P. 861. doi 10.1134/S1070363215040167
4.
Ali S.H., Sayed A.R. // Synth. Commun. 2020. doi
20.
Кривоколыско С.Г., Дяченко В.Д., Литвинов В.П. //
10.1080/00397911.2020.1854787
ХГС. 1999. № 10. С. 1370; Krivokolysko S.G.,
5.
de Souza M.V.N. // J. Sulfur Chem. 2005. Vol. 26. N 4-5.
Dyachenko V.D., Litvinov V.P. // Chem. Heterocycl.
P. 429. doi 10.1080/17415990500322792
Comp. 1999. Vol. 35. N 10. P. 1190. doi 10.1007/
6.
Mishra R., Sharma P.K., Verma P.K., Tomer I., Mathur G.,
BF02323378
Dhakad P.K. // J. Heterocycl. Chem. 2017. Vol. 54. N 4.
21.
Дяченко И.В., Рамазанова Е.Ю., Дяченко В.Д. //
P. 2103. doi 10.1002/jhet.2827
ЖОрХ. 2014. Т. 50. № 12. С. 1839; Dyachenko I.V.,
7.
Abd El-Gilil Sh.M. // J. Mol. Struct. 2019. Vol. 1194.
Ramazanova E.Yu., Dyachenko V.D. // Russ. J. Org.
P. 144. doi 10.1016/j.molstruc.2019.04.048
Chem. 2014. Vol. 50. N 12. P.1821. doi 10.1134/
8.
Suntsova P.O., Eltyshev A.K., Pospelova T.A., Slepu-
S1070428014120185
khin P.A., Benassi E., Belskaya N.P. // Dyes Pigm. 2019.
22.
Pavlovska T.L., Lipson V.V., Shishkina S.V., Musa-
Vol. 166. P.60. doi 10.1016/j.dyepig.2019.02.051
tov V.I., Nichaenko J.A., Dotsenko V.V. // Chem.
9.
Bashandy M.S., Abd El-Gilil Sh.M. // Heterocycles.
Heterocycl. Comp. 2017. Vol. 53. N 4. P.460. doi
2016. Vol. 92. N 3. P. 431. doi 10.3987/COM-15-13384
10.1007/s10593-017-2075-z.
10.
Hussain S.M., El-Reedy A.M., El-Sharabasy S.A. //
23.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П. //
Tetrahedron. 1988. Vol. 44. N 1. P. 241. doi 10.1016/
Изв. АН. Сер. Хим. 2005. № 10. С. 2319; Dotsen-
S0040-4020(01)85113-9
ko V.V., Krivokolysko S.G., Litvinov V.P. // Russ. Chem.
11.
Дяченко В.Д. Литвинов В.П. // ХГС. 1998. № 2.
Bull., Int. Ed. 2005. Vol. 54. N 10. P. 2394. doi 10.1007/
С. 213; Dyachenko V.D., Litvinov V.P. // Chem.
s11172-006-0128-z
Heterocycl. Comp. 1998. Vol. 34. N 2. P. 188. doi
24.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П.,
10.1007/BF02315182
Гутов А.В. // Докл. АН. 2007. Т. 412. № 4. С. 494;
12.
Кривоколыско С.Г., Дяченко В.Д., Нестеров В.Н.,
Dotsenko V.V., Krivokolysko S.G., Litvinov V.P.,
Литвинов В.П. // ХГС. 2001. № 7. С. 929;
Gutov A.V. // Doklady Chem. 2007. Vol. 412. Pt 2. P. 29.
Krivokolysko S.G., Dyachenko V.D., Nesterov V.N.,
doi 10.1134/S0012500807020012
Litvinov V.P. // Chem. Heterocycl. Comp. 2001.
25.
Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. // J.
Vol. 37. N 2. P. 855. doi 10.1023/A:1012499424379
Heterocycl. Chem. 2011. Vol. 48. N 1. P. 162. doi
13.
Дяченко В.Д., Литвинов В.П. // ЖОрХ. 1998. Т. 34.
10.1002/jhet.493
Вып. 4. С. 592; Dyachenko V.D., Litvinov V.P. // Russ.
26.
Фролов К.А., Доценко В.В., Кривоколыско С.Г., Чер-
J. Org. Chem. 1998. Vol. 34. N 4. P. 557.
нега А.Н., Литвинов В.П. // Изв. АН. Сер. Хим. 2005.
14.
Дяченко В.Д., Кашнер А.Ю., Самусенко Ю.В. //
№ 5. С. 1301; Frolov K.A., Dotsenko V.V., Krivokolys-
ЖОХ. 2014. Т. 84. № 2. С. 266; Dyachenko V.D., Kash-
ko S.G., Chernega A.N., Litvinov V.P. // Russ. Chem.
ner A.Yu., Samusenko Yu. V. // Russ. J. Gen. Chem. 2014.
Bull. 2005. Vol. 54. N 5. P. 1340. doi 10.1007/s11172-
Vol. 84. N 2. P. 259. doi 10.1134/S1070363214020169
005-0406-1
15.
Гончаренко М.П., Шаранин Ю.А., Туров А.В. //
27.
Литвинов В.П. // Усп. хим. 1999. Т. 68. № 9. С. 817;
ЖОрХ. 1993. Т. 29. № 8. С. 1610; Goncharenko M.P.,
Litvinov V.P. // Russ. Chem. Rev. 1999. Vol. 68. N 9.
Sharanin Yu.A., Turov A.V. // Russ. J. Org. Chem. 1993.
P. 737. doi 10.1070/RC1999v068n09ABEH000533
Vol. 29. N. 8. P. 1341.
28.
Дяченко В.Д., Дяченко И.В., Ненайденко В.Г. //
16.
Nesterov V.N., Montoya N.G., Antipin M.Yu.,
Усп. хим. 2018. Т. 87. № 1. С. 1; Dyachenko V.D.,
Sanghadasa M., Clark R.D., Timofeeva T.V. // Acta
Dyachenko I.V., Nenajdenko V.G. // Russ. Chem. Rev.
Crystallogr. (С). 2002. Vol. 58. P. o72. doi 10.1107/
2018. Vol. 87. N 1. P. 1. doi 10.1070/RCR4760
S0108270101020170
29.
Магерамов А.М., Шихалиев Н.Г., Дяченко В.Д., Дя-
17.
Khafagy M.M., El-Maghraby A.A., Hassan S.M.,
ченко И.В., Ненайденко В.Г. α-Цианотиоацетамид.
Bashandy M.S. // Phosphorus, Sulfur, Silicon,
М.: Техносфера, 2018. 224 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
530
ПАХОЛКА и др.
30.
Шелякин В.В., Дяченко В.Д., Шаранин Ю.А. // ХГС.
Chem. 2020. Vol. 85. N 21. P. 13837. doi 10.1021/acs.
1995. Т. 31. № 2. С. 269; Shelyakin V.V., Dyachenko
joc.0c01934
V.D., Sharanin Yu.A. // Chem. Heterocycl. Compd. 1995.
39. Дяченко В.Д. // Ж. орг. фарм. хім. 2012. Т. 10.
Vol. 31. N 2. P. 239. doi 10.1007/BF01169689
№ 2(38). С. 54.
31.
Attaby F.A., Elghandour A.H.H., Mustafa H.M., Ibra-
40. Дяченко В.Д. // ЖОрХ. 2012. Т. 48. № 1. С. 147;
Dyachenko V.D. // Russ. J. Org. Chem. 2012. Vol. 48.
hem Y.M. // J. Chin. Chem. Soc. 2002. Vol. 49. N 4.
N 1. P. 143. doi 10.1134/S1070428012010241
P. 561. doi 10.1002/jccs.200200087
41. Дяченко И.В. // ЖОХ. 2019. Т. 89. № 5. С. 701;
32.
Гринштейн В.Я., Шеринь Л.А. // Изв. АН ЛатвССР.
Dyachenko I.V. // Russ. J. Gen. Chem. 2019. Vol. 89.
Сер. хим. 1963. № 4. С. 469; C. A. 1964. Vol. 60.
N 5. P. 896. doi 10.1134/S1070363219050062
5392b.
42. Пахолка Н.А., Абраменко В.Л., Доценко В.В., Аксе-
33.
Ho Y.W., Wang I.J. // // J. Heterocycl. Chem. 1995.
нов Н.А., Аксенова И.В., Кривоколыско С.Г. // ЖОХ.
Vol. 32. N 3. P. 819. doi 10.1002/jhet.5570320323
2021. Т. 91. № 3. С. 386; Pakholka N.A., Abramen-
34.
Nesterov V.N., Antipin M.Y., Timofeeva T.V., Clark R.D. //
ko V.L., Dotsenko V.V., Aksenov N.A., Aksenova I.V.,
Acta Crystallogr. (C). 2000. Vol. 56. N 1. P. 88. doi
Krivokolysko S.G. // Russ. J. Gen. Chem. 2021. Vol. 91.
10.1107/S0108270199012998
N 3. P. 357. doi 10.1134/S1070363221030038
35.
Фролов К.А., Доценко В.В., Кривоколыско С.Г. //
43. Доценко В.В., Кривоколыско С.Г., Половинко В.В.,
ХГС. 2012. № 10. С. 1668; Frolov K.A., Dotsenko V.V.,
Литвинов В.П. // ХГС. 2012. № 2. С. 328; Dotsen-
Krivokolysko S.G. // Chem. Heterocycl. Compd. 2013.
ko V.V., Krivokolysko S.G., Polovinko V.V., Litvinov V.P. //
Vol. 48. N 10. P. 1555. doi 10.1007/s10593-013-1173-9
Chem. Heterocycl. Compds. 2012. Vol. 48. P. 309. doi
36.
Al-Waleedy S.A., Bakhite E.A., Abbady M.S., Abdu-
10.1007/s10593-012-0991-5
Allah H.H. // J. Heterocycl. Chem. 2020. Vol. 57. N 6.
44. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
P. 2379. doi 10.1002/jhet.3954
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
37.
Bandgar B.P., Zirange S.M., Wadgaonkar P.P. //
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Synth. Commun. 1997. Vol. 27. N 7. P. 1153. doi
45. Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
10.1080/00397919708003351
P. 112. doi 10.1107/S0108767307043930
38.
Gagarin A.A., Suntsova P.O., Minin A.S., Pozdina V.A.,
46. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Slepukhin P.A., Benassi E., Belskaya N.P. // J. Org.
P. 3. doi 10.1107/S2053229614024218
Synthesis and Regiospecific Bromination
of (2E,4E)-5-Aryl-2-(4-arylthiazol-2-yl)penta-2,4-dienenitrile
N. A. Pakholkaa, V. V. Dotsenkob,c, B. S. Krivokolyskod, K. A. Frolova,d, N. A. Aksenovc,
I. V. Aksenovac, S. V. Shcherbakovc, S. N. Ovcharovc, and S. G. Krivokolyskoa,d,*
a Laboratory “KhimEx”, V. Dahl Lugansk State University, Lugansk, 91034 Ukraine
b Kuban State University, Krasnodar, 350040 Russia
c North Caucasus Federal University, Stavropol, 355009 Russia
d St. Luke Lugansk State Medical University, Lugansk, 91045 Ukraine
*e-mail: ksg-group-lugansk@mail.ru
Received February 26, 2021; revised February 26, 2021; accepted March 11, 2021
The reaction of (2E,4E)-5-phenyl-2-cyano-2,4-pentadientioamide or (E)-3-(2-nitrophenyl)acrolein and cyanoth-
ioacetamide with α-bromoketones afforded new (2E,4E)-5-aryl-2-(4-arylthiazol-2-yl) penta-2,4-dienenitriles.
Direct bromination of the latter by the action of bromine in DMF proceeded regiospecifically at the C5 position
of the thiazole ring without affecting the diene system and leads to the formation of new (2E,4E)-5-aryl-2-(5-
bromo-4-arylthiazol-2-yl)penta- 2,4-diennitriles.
Keywords: cyanothioacetamide, Knoevenagel condensation, (2E,4E)-5-aryl-2-cyano-2,4-pentadienetioamides,
Hantzch thiazole synthesis, bromination, 5-bromothiazoles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021