ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 531-538
УДК 547.883:544.6.018.2:544.632
СИНТЕЗ СИММЕТРИЧНЫХ БИЯДЕРНЫХ
ПЕРХЛОРАТОВ 5,6-ДИГИДРО-1,2,4,5-ТЕТРАЗИНИЯ
© 2021 г. С. Г. Кострюков*, А. Ш. Козлов, Д. А. Краснов, А. А. Буртасов,
П. С. Петров, В. С. Тезикова, А. Ю. Асфандеев, Т. Д. Идрис
Национальный исследовательский Мордовский государственный университет имени Н. П. Огарёва,
ул. Большевистская 68, Саранск, 430005 Россия
*e-mail: kostryukov_sg@mail.ru
Поступило в Редакцию 6 февраля 2021 г.
После доработки 6 февраля 2021 г.
Принято к печати 20 февраля 2021 г.
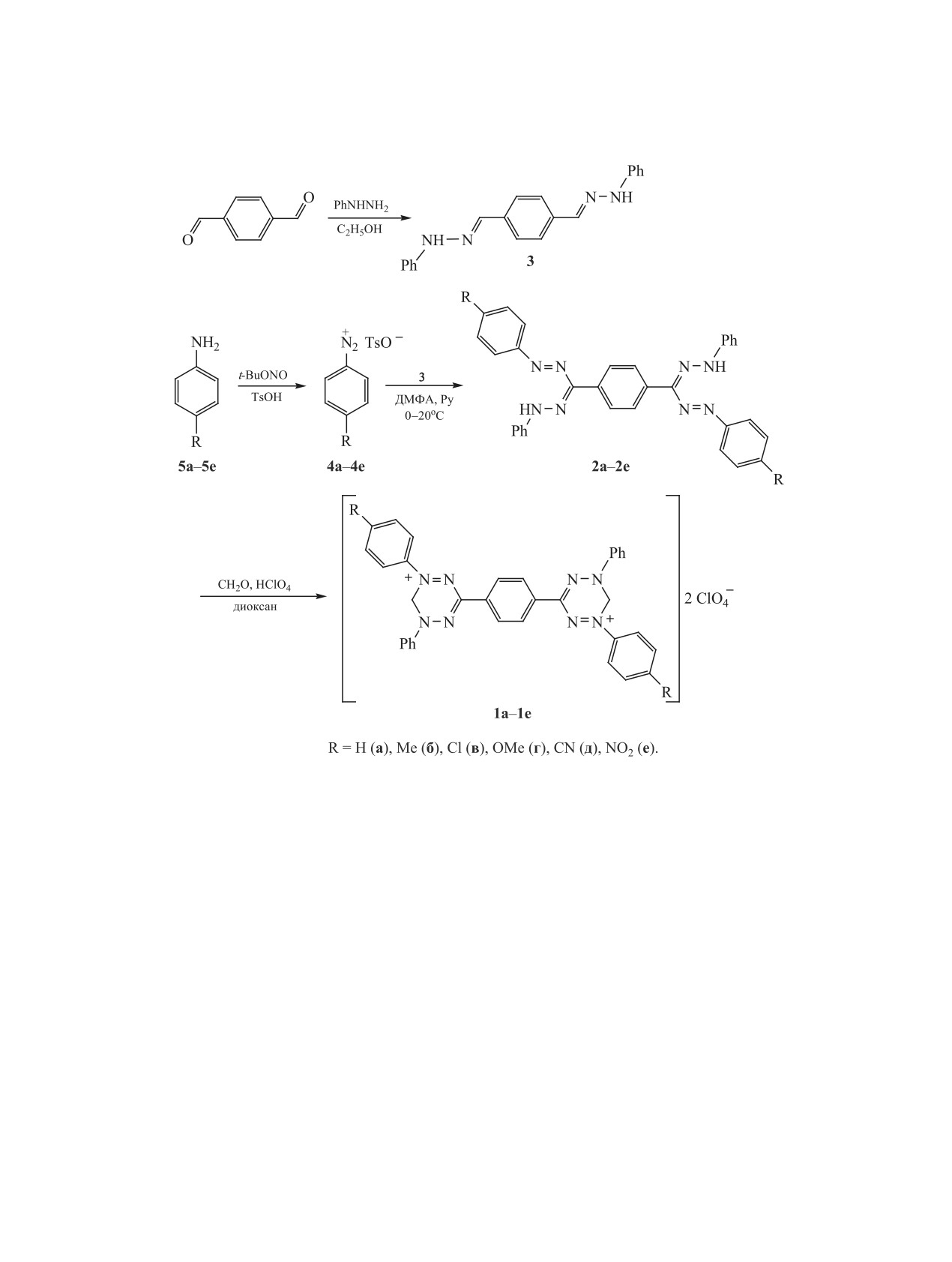
Трехстадийным синтезом из терефталевого альдегида получена серия 3,3′-(1,4-фенилен)бис[5-фенил-1-
(4-R-фенил)-5,6-дигидро-1,2,4,5-тетразиний]перхлоратов (R = H, Me, Cl, OMe, CN, NO2). Тетразиниевые
соли получены взаимодействием соответствующих формазанов с формалином в присутствии хлорной
кислоты в диоксане. Формазаны и перхлораты тетразиния выделены в индивидуальном состоянии и
охарактеризованы данными элементного анализа, ИК, УФ, ЯМР 1Н и 13С спектроскопии. Исследовано
электрохимическое восстановление перхлоратов тетразиния методом циклической вольтамперометрии.
Полученные соединения - перспективные предшественники симметричных бирадикальных систем на
основе вердазильных радикалов.
Ключевые слова: формазан, вердазил, 5,6-дигидро-1,2,4,5-тетразинийперхлорат, циклическая воль-
тамперометрия
DOI: 10.31857/S0044460X21040065
Соли 5,6-дигидро-1,2,4,5-тетразиния (вердази-
зуется соль вердазилия, которая в щелочной среде
лия) являются предшественниками вердазильных
в присутствии формальдегида восстанавливается
радикалов, которые представляют собой класс ста-
до нейтрального лейкооснования, легко окисляю-
бильных органических радикалов. Благодаря вы-
щегося кислородом воздуха до вердазильного ра-
сокой химической стабильности и структурному
дикала [13, 15-17]. Предложен способ получения
разнообразию они находят широкое и разносто-
триарилвердазильных радикалов восстановлением
роннее применение [1, 2]. Наиболее исследовано
перхлоратов вердазилия аскорбиновой кислотой в
применение вердазильных радикалов в качестве
присутствии раствора аммиака [18]. Аналогичный
строительных блоков для создания молекулярных
подход применен для синтеза открытоцепных по-
магнетиков [3-7], комплексообразователей [8-11]
дандов с концевыми вердазильными фрагментами
и редокс-активных компонентов органических
[19].
аккумуляторов
[12-14]. Первые представители
На наш взгляд, соли вердазилия можно ис-
вердазильных радикалов были получены в 1964 г.
пользовать как прекурсоры новых вердазильных
[15].
радикалов. Нами получена серия симметричных
Наиболее доступный способ получения три-
биядерных перхлоратов 5,6-дигидро-1,2,4,5-тет-
арилвердазильных радикалов - взаимодействие
разиния и изучено их электрохимическое восста-
1,3,5-триарилформазанов с альдегидами, напри-
новление. Симметричные биядерные перхлораты
мер формальдегидом, в кислой среде с последую-
5,6-дигидро-1,2,4,5-тетразиния 1а-е с различными
щей обработкой основанием. В кислой среде обра-
заместителями в ароматическом кольце получены
531
532
КОСТРЮКОВ и др.
Схема 1.
из терефталевого альдегида в три стадии (схема 1).
очистки. Реакцию проводили в смеси ДМФА и пи-
На первой стадии получен фенилгидразон тереф-
ридина в соотношении 2:1.
талевого альдегида 3, на второй - формазаны, на
Тозилаты арендиазония выбраны на основании
третьей - соответствующие перхлораты. Для син-
того, что получение хлоридов арендиазония из па-
теза перхлоратов 1a-е использован метод, предло-
ра-замещенных анилина 5в-е затруднено из-за их
женный Катрицким [19].
низкой растворимости в воде и низкой реакцион-
Фенилгидразон 3 получен конденсацией тереф-
ной способности. Большая растворимость аренди-
талевого альдегида с фенилгидразином с выходом
азонийтозилатов 4a-е в органических раствори-
90%, его константы соответствуют литературным
телях позволила предельно упростить процедуру
данным [20]. Формазаны 2а-е синтезированы при
очистки формазанов 2а-е. Практически все фор-
взаимодействии фенилгидразона терефталевого
мазаны - темно-красные кристаллические веще-
альдегида 3 с тозилатами арендиазония 4a-е, ко-
ства, кроме соединения 2е, которое в отличие от
торые, в свою очередь, были получены при дей-
остальных имеет оранжевую окраску.
ствии п-толуолсульфокислоты и трет-бутилни-
Формазаны
2a-е получены в индивидуаль-
трита на растворы производных анилина 5а-е в
ном виде и охарактеризованы данными УФ, ИК,
смеси ТГФ-AcOH. Соли диазония 4а-е вводили в
ЯМР 1Н и 13С спектроскопии. В УФ спектрах
реакции с фенилгидразоном 3 без дополнительной
формазанов имеются три максимума поглощения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ СИММЕТРИЧНЫХ БИЯДЕРНЫХ ПЕРХЛОРАТОВ
533
Схема 2.
в интервалах 240-260, 305-330 и 370-480 нм. В
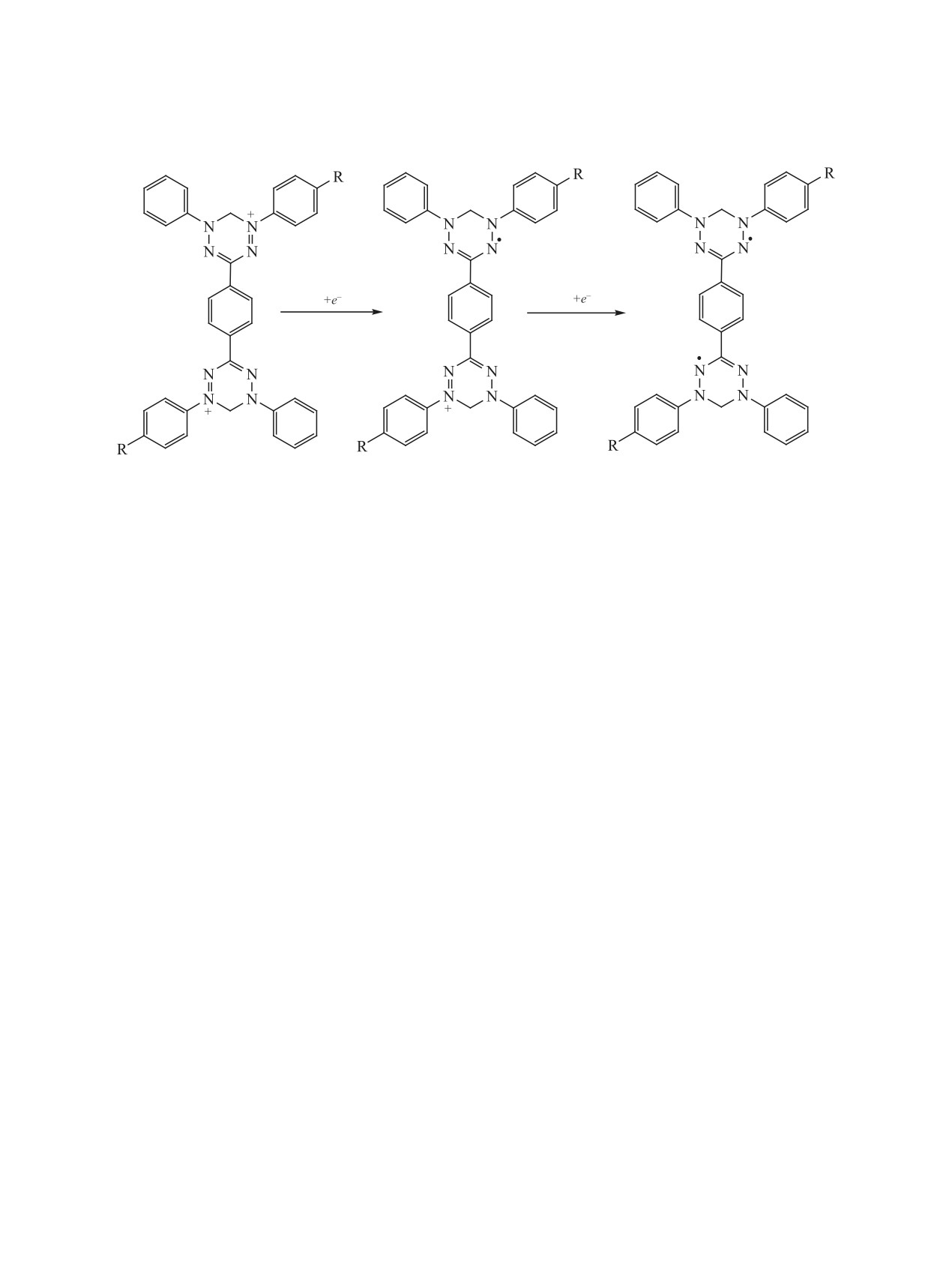
Методом циклической вольтамперометрии
ИК спектрах присутствуют полосы поглощения,
(ЦВА) исследованы электрохимические свойства
характерные для связей C=N (1600-1590), N-H
триарилвердазильных радикалов [17]. Замести-
(3400-3300) и N=N (1510-1480 см-1) формазаново-
тели в положении 2 тетразинильного фрагмента
го фрагмента.
влияют на потенциал окисления радикала, а заме-
Циклизацию формазанов 2а-е проводили в
стители в положении 6 влияют на величину потен-
циала восстановления радикала. Можно полагать,
диоксане при взаимодействии с 37%-ным раство-
ром формалина в присутствии хлорной кислоты и
что природа заместителей в солях вердазилия бу-
получали перхлораты вердазилия 1a-е (схема 1).
дет влиять на их способность при действии под-
Строение перхлоратов 1a-е подтверждено данны-
ходящих восстановителей превращаться в лейко-
ми УФ, ИК спектроскопии. В УФ спектрах имеют-
основания, а затем в радикалы. С целью проверки
ся два максимума поглощения в интервалах 250-
этого предположения и изучения возможности по-
260 и 370-420 нм, а также малоинтенсивный пик в
лучения вердазильных радикалов проведено соот-
интервале 510-620 нм. В ИК спектрах солей 1a-е
ветствующее исследование растворов солей 1а-е в
присутствуют полосы поглощения связей C=N
MeCN с помощью ЦВА в трехэлектродной ячейке
(1600-1590), N=N (1490-1510) и перхлорат-аниона
(фоновый электролит - 0.1 М. раствор Bu4NBF4,
(1120-1090 см-1). Перхлораты вердазилия 1a-е -
рабочий электрод - стеклоуглеродный, вспомо-
интенсивно окрашенные темно-синие или тем-
гательный - платиновый, электрод сравнения -
но-коричневые (в зависимости от природы заме-
стандартный хлоридсеребряный. На кривых ЦВА
стителя) кристаллические вещества.
солей 1а-е присутствуют по два одноэлектрон-
ных пика восстановления в диапазоне от -0.30 до
Методом DFT исследовано влияние различ-
-1.00 В (Ag/AgCl/KCl), которые, по-видимому, от-
ных заместителей на распределение электронной
носятся к восстановлению дикатионов сначала до
плотности для граничных орбиталей на примере
катион-радикала и затем до бирадикала (схема 2).
триарилвердазильных радикалов [12]. Окисление
радикалов до катионов облегчается присутствием
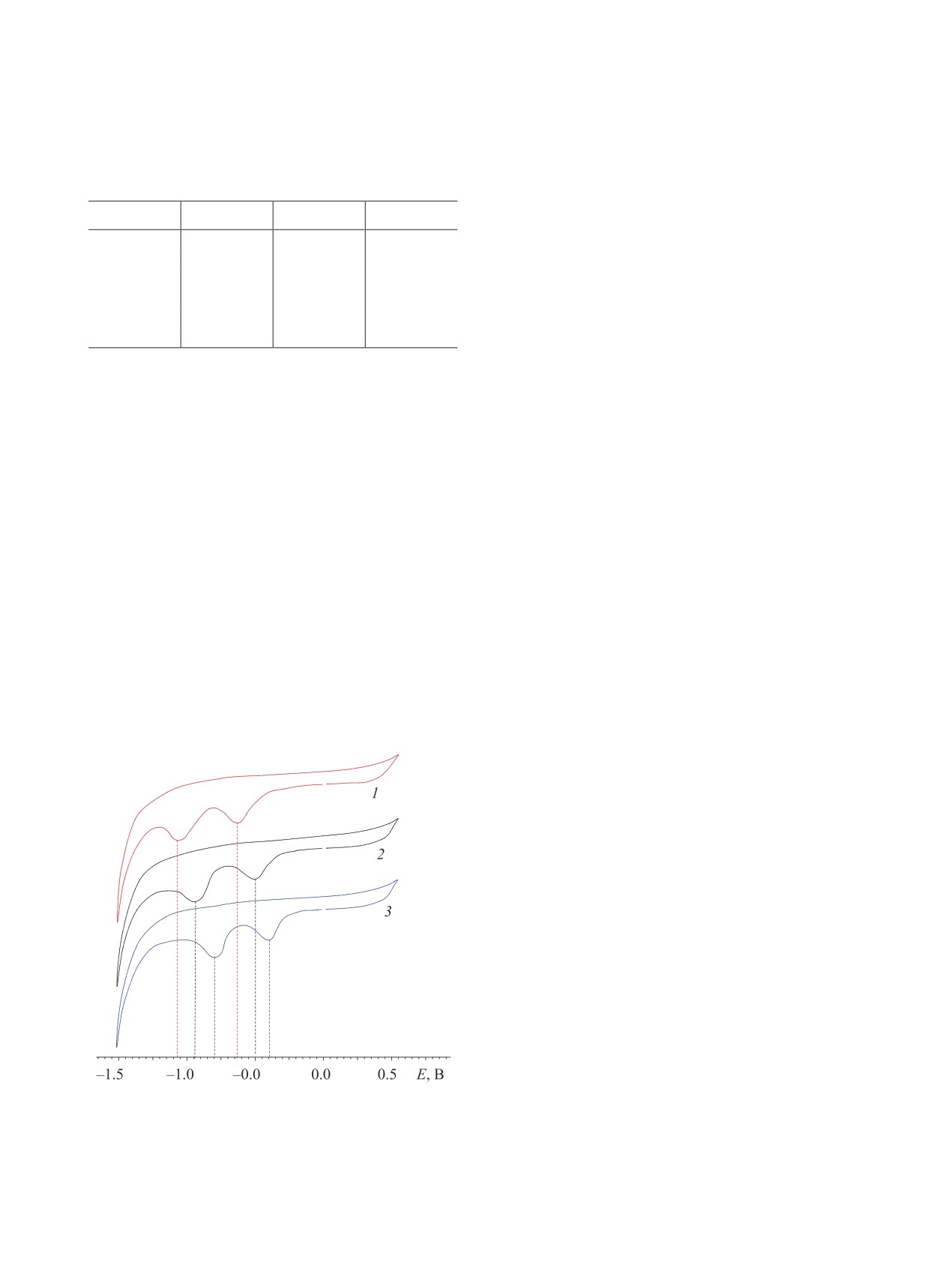
В таблице приведены значения полуволн пиков
донорных заместителей, тогда как акцепторные
восстановления перхлоратов вердазилия 1a-е. Как
заместители затрудняют окисление. Природа за-
видно из таблицы, природа заместителя в пара-по-
местителя в перхлоратах вердазилия 1а-е также
ложении ароматического кольца оказывает влия-
влияет на распределение электронной плотности
ние на способность катионов вердазилия восста-
и, следовательно, на способность катионов верда-
навливаться. Электронодонорные заместители Ме
зилия восстанавливаться с образованием соответ-
(1б), OMe (1г) облегчают восстановление, тогда
ствующих вердазильных радикалов.
как электроноакцепторные заместители CN (1д) и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
534
КОСТРЮКОВ и др.
нению незамещенным производным 1а (кривая 2).
Электрохимические параметры восстановления 3,3′-
(1,4-фенилен)бис[5-фенил-1-(4-R-фенил)-5,6-дигидро-
Таким образом, полученные в три стадии из
1,2,4,5-тетразиний]перхлоратов 1a-е
терефталевого альдегида перхлораты
5,6-диги-
№
R
E1восст, B
E2восст, B
дро-1,2,4,5-тетразиния с донорными заместителя-
1a
H
-0.50
-0.96
ми в ароматическом кольце способны легко пре-
1б
Me
-0.44
-0.81
вращаться в соответствующие бисвердазильные
1в
Cl
-0.49
-0.86
радикалы и могут рассматриваться в качестве их
1г
OMe
-0.35
-0.78
предшественников.
1д
CN
-0.59
-0.98
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1е
NO2
-0.68
-1.06
Растворители перед использованием высуши-
вали и перегоняли. Все реагенты были приобре-
NO2 (1е) значительно затрудняют его. Атом хлора
тены у ООО «Сигма-Алдрич Рус»/ООО «Мерк» и
незначительно влияет на электродные потенциа-
использованы в оригинальном виде.
лы. Таким образом, можно предположить, что би-
радикалы будут легко получаться из вердазильных
Спектры ЯМР 1Н и 13С сняты на спектрометре
солей 1а-г.
JNM-ECX400 (JEOL, Япония, 400.1 и 100.6 MГц со-
ответственно) для растворов веществ в ДМСО-d6,
На рисунке представлены циклические воль-
химические сдвиги измеряли относительно SiMe4.
тамперограммы некоторых перхлоратов верда-
ИК спектры получены в таблетках KBr на Фу-
зилия, которые наилучшим образом показывают
рье-спектрометре ИнфраЛЮМ ФТ-02 (Россия).
изменения в электрохимическом поведении соеди-
Электронные спектры поглощения записывали на
нений 1a (R = H), 1г (R = OMe) и 1е (R = NO2) под
спектрофотометре Shimadzu UV-2600. Элемент-
влиянием заместителей. Как видно из рисунка, под
ный анализ выполнены на СHNS-анализаторе
влиянием метоксигруппы значение первого потен-
Vario MICRO (Германия). Условия аналитической
циала восстановления уменьшилось на 0.15 В, а
ТСХ: адсорбент - Silufol UV-245, элюенты - бен-
второго - на 0.18 В, а под влиянием нитрогруппы,
зол, бензол-этилацетат (2:1), проявление в иодной
наоборот, первый потенциал восстановления уве-
камере. Температуры плавления соединений опре-
личился на 0.18 В, а второй - на 0.10 В по срав-
деляли в запаянных стеклянных капиллярах с ис-
пользованием анализатора точки плавления МР-50
(Mettler Toledo, Швейцария).
Электрохимические данные были получены
методом циклической вольтамперометрии для
растворов в ацетонитриле (фоновый электролит -
0.1 М. раствор Bu4NBF4) с использованием потен-
циостата Gamry (Канада) в электрохимической
ячейке объемом 5 мл. В качестве рабочего элект-
рода использовали стеклоуглеродный электрод,
S2 0.125 см2. Электрод тщательно полировали и
промывали перед измерениями. Вспомогатель-
ный электрод - платиновый, электрод сравнения -
стандартный хлоридсеребряный (E0 0.33 В в MeCN
против Fc/Fc+). Все растворы деаэрировали, про-
дувая аргоном.
Фенилгидразон терефталевого альдегида
(3). К раствору 6.07 г (0.042 моль) солянокисло-
го фенилгидразина и 2.88 г безводного ацетата
Циклические вольтамперограммы соединений 1е (1),
1a (2) и 1г (3).
натрия в 70 мл воды добавляли при постоянном
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ СИММЕТРИЧНЫХ БИЯДЕРНЫХ ПЕРХЛОРАТОВ
535
перемешивании небольшими порциями
2.68 г
129.20, 129.51, 135.33, 144.25, 149.72. Найдено, %:
(0.02 моль) терефталевого альдегида в 25 мл ди-
C 76.74; H 4.95; N 21.60. C32H26N8. Вычислено, %:
оксана. По окончании прибавления реакционную
C 73.54; H 5.01; N 21.44.
смесь перемешивали при комнатной температуре
3,3′-(1,4-Фенилен)бис[1-(4-метилфе-
60 мин. Выпавший осадок отфильтровывали, про-
нил)-5-фенил-формазан]
(2б). Выход
1.43 г
мывали на фильтре водой и сушили на воздухе.
(52%), т. пл. 210-211°C (ДМФА-пиридин-Н2О).
Перекристаллизовывали из смеси этанол-ДМСО.
ИК cпектр, ν, см-1: 3431 (N-H), 2965 (СН3), 1692,
Выход 5.34 г (85%), желтые кристаллы, т. пл. 264-
1598 (C=N), 1494 (N=N), 1226, 1033, 824, 747.
265°C (ДМСО-этанол). Спектр ЯМР 1H, δ, м. д.:
Электронный спектр поглощения (MeОН), λ, нм:
6.77-6.73 т. т (2HAr, J 7.5, 1.6), 7.09-7.01 д. д (4HAr,
259, 306, 482. Спектр ЯМР 1H, δ, м. д.: 2.37 с (6Н,
J 7.7, 1.6), 7.64 с (4H, CHAr), 7.96 с (2Н, CHAr), 8.01
СН3), 6.99-7.08 м (2HAr), 7.25-7.31 м (12НAr), 7.72
с (2Н, N=CH), 10.38 уш. с (2H, NH). Спектр ЯМР
д. д (4HAr, J 7.7, 1.6), 7.90 с (4НAr), 10.88 уш. с (2H,
13C, δС, м. д.: 112.00, 118.79, 125.85, 129.11, 135.30,
NH). Спектр ЯМР 13C, δС, м. д.: 21.63 (СН3), 113.88,
136.15, 145.16. Найдено, %: C 76.39; H 5.76; N
118.65,
124.46,
126.12,
128.73,
129.23,
135.33,
17.84. C20H18N4. Вычислено, %: C 76.41; H 5.77; N
139.71, 144.35, 149.35. Найдено, %: C 74.10; 5.43;
17.82.
N 20.47. C34H30N8. Вычислено, %: C 74.16; H 5.49;
Общая методика синтеза тозилатов аренди-
N 20.35.
азония 4а-е [21]. Смешивали 0.01 моль произво-
3,3′-(1,4-Фенилен)бис[5-фенил-1-(4-хлорфе-
дного анилина 5а-е, 5 мл ТГФ, 0.015 ммоль мо-
нил)формазан] (2в). Выход 1.24 г (42%), т. пл.
ногидрата п-толуолсульфокислоты, 15 мл ледяной
213-215°C (ДМФА-пиридин-Н2О). ИК спектр,
уксусной кислоты. При охлаждении до 0°С к по-
ν, см-1: 3350 (N-H), 1604 (C=N), 1491 (N=N),
лученной смеси добавляли 0.02 ммоль t-BuONO,
1259, 1134, 743. Электронный спектр поглощения
перемешивали при 0°С 30 мин, а затем 60 мин при
(MeОН), λ, нм: 280, 320, 434. Спектр ЯМР 1H, δ,
комнатной температуре, после чего добавляли в
м. д.: 7.08 т. т (2HAr, J 6.9, 2.1), 7.36-7.29 м (8HAr),
10 мл диэтилового эфира, выпавший осадок от-
7.67 д. т (4HAr, J 7.7, 1.5), 7.73 д. т (4HAr, J 7.7, 1.5),
фильтровывали. Полученные тозилаты арендиазо-
7.88 с (4НAr), 10.96 уш. с (2H, NH). Спектр ЯМР
ния вводили в реакцию без дополнительной очист-
13C, δС, м. д.: 114.56, 125.12, 126.34, 127.56, 128.56,
ки.
129.30, 130.54, 134.31, 136.49, 145.74, 152.16. Най-
Синтез формазанов 2a-е. Раствор 0.005 моль
дено, %: C 65.04; H 4.10; N 18.97. C32H24Cl2N8. Вы-
фенилгидразона 3 в смеси 2.5 мл пиридина и 5 мл
числено, %: C 64.98; H 4.09; N 18.94.
ДМФА охлаждали до -5ºС. К полученному раство-
3,3′-(1,4-Фенилен)бис[1-(4-метоксифе-
ру при 0-5°С добавляли 0.01 моль соответствую-
нил)-5-фенилформазан] (2г). Выход 1.31 г (45%),
щего тозилата арендиазония 4a-е. Темно-красную
т. пл.
215-217°C (ДМФА-пиридин-Н2О). ИК
реакционную смесь выдерживали 24 ч при темпе-
cпектр (KBr), ν, см-1: 3340, 2850 (C-H), 1601, 1490,
ратуре не выше 5°С, затем добавляли 2 мл воды.
1266, 1090, 757. Электронный спектр поглощения
Выпавший осадок отфильтровывали, промывали
(MeОН), λ, нм: 258, 389, 495. Спектр ЯМР 1H, δ, м. д.:
на фильтре последовательно метанолом, водой,
3.79 с (6H, OCH3), 7.03 т. т (2HAr, J 6.9, 2.0), 7.12
метанолом и диэтиловым эфиром.
д. т (4HAr, J 7.7, 1.7), 7.31-7.26 м (8HAr), 7.83 д. т
3,3′-(1,4-Фенилен)бис(1,5-дифенилформа-
(4HAr, J 7.5, 1.3), 7.88 с (4НAr), 10.65 уш. с (2H, NH).
Спектр ЯМР 13C, δС, м. д.: 35.68 (OCH3), 112.00,
зан) (2a). Выход 1.34 г (51.3%), т. пл. 213-215°C
(ДМФА-пиридин-Н2О). ИК спектр, ν, см-1: 3353
118.79, 125.85, 129.11, 135.30, 136.15, 145.16. Най-
(N-H), 1600 (C=N), 1497 (N=N), 1256, 1133, 751,
дено, %: C 70.14; H 5.09; N 19.36. C34H30N8O2. Вы-
числено, %: C 70.09; H 5.19; N 19.23.
699. Электронный спектр поглощения (MeОН), λ,
нм: 245, 305, 389. Спектр ЯМР 1H, δ, м. д.: 7.06-
3,3′-(1,4-Фенилен)бис[5-фенил-1-(4-циано-
7.01 м (2HAr), 7.26-7.43 м (18HAr), 7.79 с (4HAr),
фенил)формазан] (2д). Выход 1.49 г (52%), т. пл.
10.80 уш. с (2H, NH). Спектр ЯМР 13C, δС, м. д.:
248-250°C (ДМФА-пиридин-Н2О). ИК cпектр,
113.88,
124.46,
125.85,
126.01,
128.56,
128.92,
ν, см-1: 3447(N-H), 2255 (CN), 1687, 1598 (C=N),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
536
КОСТРЮКОВ и др.
1497 (N=N), 1253, 1144, 752. Электронный спектр
(диоксан-Н2О). ИК спектр, ν, см-1: 2951 (CH3),
поглощения (MeОН), λ, нм: 249, 378, 485. Спектр
1597 (С=N), 1497 (N=N), 1272, 1166, 1102 (ClO4),
ЯМР 1H, δ, м. д.: 7.03 т. т (2HAr, J 6.7, 2.1), 7.12 д. т
795. Электронный спектр поглощения (MeOH), λ,
(4HAr, J 7.7, 1.7), 7.31-7.26 м (8HAr), 7.83 д. т (4HAr,
нм: 252, 343, 517. Найдено, %: C 55.81; H 4.11; N
J 7.5, 1.3), 7.88 с (4НAr), 10.65 уш. с (2H, NH).
16.42. C36H32N8·2ClO4. Вычислено, %: C 55.75; H
Спектр ЯМР 13C, δС, м. д.: 112.95, 114.06, 118.62
4.16; N 14.45.
(CN), 120.97, 122.92, 125.94, 129.00, 134.01, 136.85,
3,3′-(1,4-Фенилен)бис[5-фенил-1-(4-хлорфе-
143.51, 144.76, 155.36. Найдено, %: C 71.24; H
нил)-5,6-дигидро-1,2,4,5-тетразиний]перхлорат
4.95; N 19.40. C36H30N8O2. Вычислено, %: C 71.27;
(1в). Выход 0.45 г (55%), т. пл. 204°C (разл.) (ди-
H 4.98; N 18.47.
оксан-Н2О). ИК спектр, ν, см-1: 1598 (С=N), 1495
3,3′-(1,4-Фенилен)бис[1-(4-нитрофе-
(N=N), 1259, 1139, 1097 (ClO4), 1078, 930, 795.
нил)-5-фенилформазан] (2е). Выход 1.84 г (60%),
Электронный спектр поглощения (MeOH), λ, нм:
т. пл.
237-237°C (ДМФА-пиридин-Н2О). ИК
255, 350, 576. Найдено, %: C 50,07; H 3,23; N 13,70.
спектр, ν, см -1: 3434 (N-H), 1599 (C=N), 1538
C34H26Cl2N8·2ClO4. Вычислено, %: C 50.02; H 3.21;
(NO2), 1510 (N=N), 1351 (NO2), 1230, 1103, 846,
N 13.73.
750. Электронный спектр поглощения (MeОН), λ,
3,3′-(1,4-Фенилен)бис[1-(4-метоксифенил)-
нм: 238, 307, 367. Спектр ЯМР 1H, δ, м. д.: 7.03
5-фенил-5,6-дигидро-1,2,4,5-тетразиний]-
т. т (2HAr, J 6.9, 2.0), 7.31-7.26 м (8HAr), 7.80 д.т
перхлорат (1г). Выход 0.56 г (69%), т. пл. 224°C
(4HAr, J 7.7, 1.3), 7.93 с (4НAr), 8.20 д. т (4HAr, J 7.7,
(разл.) (диоксан-Н2О). ИК спектр, ν, см-1: 2850
1.3), 10.95 уш. с. (2H, NH). Спектр ЯМР 13C, δС,
(OCH3), 1599 (С=N), 1499 (N=N), 1277, 1240, 1167,
м. д.: 114.70, 120.98, 122.97, 124.80, 125.94, 128.95,
1096 (ClO4), 1040, 932. Электронный спектр погло-
134.01, 144.80, 146.91, 158.06. Найдено, %: C
щения (MeOH), λ, нм: 261, 347, 598. Найдено, %: C
62.81; H 3.98; N 22.82. C32H24N10O4. Вычислено,
53,48; H, 4,03; N 13,85. C36H32N8O2·2ClO4. Вычис-
%: C 62.74; H 3.95; N 22.86.
лено, %: C 53,54; H 3,99; N 13,88.
Общая методика синтеза перхлоратов 1a-е.
3,3′-(1,4-Фенилен)бис[5-фенил-1-(4-цианофе-
К раствору 0.001 моль формазана 2а-е в 20 мл ди-
нил)-5,6-дигидро-1,2,4,5-тетразиний]перхлорат
оксана при перемешивании добавляли 4 мл 37%-
(1д). Выход 0.39 г (49%), т. пл. 255°C (разл.) (ди-
ного раствора формалина и нагревали до 60°С.
оксан-Н2О). ИК спектр, ν, см-1: 2255 (CN), 1594
Реакционную смесь охлаждали до комнатной
(С=N), 1507 (N=N), 1270, 1098 (ClO4), 836. Элек-
температуры и при 20-25°С добавляли по каплям
тронный спектр поглощения (MeOH), λ, нм: 262,
1.4 мл 70%-ной HClO4. Полученную смесь пере-
385, 612. Найдено, %: C 54.23; H 3.30; N 17.55.
мешивали до полного расходования формазана
C36H26N10·2ClO4. Вычислено, %: C 54.21; H 3.29;
(контроль по ТСХ, от 40 до 120 мин); раствор ста-
N 17.56.
новился темно-синим. По окончании реакции в ре-
акционную смесь добавляли 5 мл воды, выпавший
3,3′-(1,4-Фенилен)бис[1-(4-нитрофенил)-
осадок отфильтровывали и промывали на фильтре
5-фенил-5,6-дигидро-1,2,4,5-тетразиний]-
диэтиловым эфиром (3×10 мл).
перхлорат (1е). Выход 0.38 г (45%), т. пл. 182°C
(разл.) (диоксан-Н2О). ИК спектр, ν, см-1: 1600
3,3′-(1,4-Фенилен)бис(1,5-дифенил-5,6-диги-
дро-1,2,4,5-тетразиний)перхлорат
(1a). Выход
(C=N), 1556 (NO2), 1512 (N=N), 1351 (NO2), 1332,
0.39 г (52%), т. пл. 215°C (разл.) (диоксан-Н2О).
1227, 1110 (ClO4), 841. Электронный спектр погло-
ИК спектр, ν, см-1: 1599 (С=N), 1502 (N=N), 1256,
щения (MeCN), λ, нм: 248, 415, 604. Найдено, %: C
1105 (ClO4), 752. Электронный спектр поглощения
48.83; H 3.16; N 16.75. C34H26N10O4·2ClO4. Вычис-
(MeОН), λ, нм: 256, 376, 510. Найдено, %: C 54.70;
лено, %: C 48.76; H 3.13; N 16.72.
H 3.84; N 14.95. C34H28N8·2ClO4. Вычислено, %: C
КОНФЛИКТ ИНТЕРЕСОВ
54.63; H 3.78; N 14.99.
Авторы заявляют об отсутствии конфликта
3,3′-(1,4-Фенилен)бис[5-фенил-1-(4-метил-
интересов.
фенил)-5,6-дигидро-1,2,4,5-тетразиний]перхло-
рат (1б). Выход 0.41 г (53%), т. пл. 220°C (разл.)
СПИСОК ЛИТЕРАТУРЫ
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ СИММЕТРИЧНЫХ БИЯДЕРНЫХ ПЕРХЛОРАТОВ
537
1.
Липунова Г.Н., Федорченко Т.Г., Чупахин О.Н. //
12.
Кострюков С.Г., Черняева О.Ю., Танасейчук Б.С.,
Усп. хим. 2013. Т. 82. № 8. C. 701; Lipunova
Козлов А.Ш., Пряничникова М.К., Буртасов А.А. //
G.N., Fedorchenko T.G., Chupakhin O.N. // Russ.
Изв. АН. Сер. хим. 2020. Т. 69. № 7. С.1321;
Chem. Rev. 2013. Vol. 82. N 8. P. 701. doi 10.1070/
Kostryukov S.G., Chernyaeva O.Y., Tanaseichuk B.S.,
RC2013v082n08ABEH004341
Kozlov A. Sh., Pryanichnikova M.K., Burtasov A.A. //
2.
Липунова Г.Н., Федорченко Т.Г., Цмокалюк А.Н., Чу-
Russ. Chem. Bull. 2020. Vol. 69. N 7. P. 1321. doi
пахин О.Н. // Изв. АН. Сер. Хим. 2020. № 7. С. 1203;
10.1007/s11172-020-2905-5
Lipunova G.N., Fedorchenko T.G., Tsmokalyuk A.N.,
13.
Charlton G.D., Barbon S.M., Gilroy J.B., Dyker C.A. //
Chupakhin O.N. // Russ. Chem. Bull. 2020. Vol. 69.
J. Energy Chem. 2019. Vol. 34. P. 52. doi 10.1016/j.
N 7. P. 1203. doi 10.1007/s11172-020-2892-6
jechem.2018.09.020
3.
Vaz M.G.F., Andruh M. // Coord. Chem. Rev. 2021. Vol.
14.
Korshunov A., Milner M.J., Grünebaum M., Studer A.,
427. N 213611. doi 10.1016/j.ccr.2020.213611
Winte, M., Cekic-Laskovic I. // J Mater. Chem. (A).
4.
Miyamoto S., Iwasaki Y., Uemoto N., Hosokoshi Y.,
2020. Vol. 8. N 42/ P. 22280. doi 10.1039/d0ta07891c
Fujiwara H., Shimono S., Yamaguchi H. // Phys.
15.
Kuhn R., Trischman H. // Monatsh. Chem. 1964. Bd 95.
Rev. Mat. 2019. Vol. 3. N. 6. N 064410. doi 10.1103/
N 2. S. 457. doi 10.1007/BF00901311
PhysRevMaterials.3.064410
5.
Brook D.J.R., Fleming C., Chung D., Richardson C.,
16.
Цебулаева Ю.В., Пряничникова М.К., Танасей-
Ponce S., Das R., Srikanth H., Heindl R., Noll B.C. //
чук Б.С. // Изв. вузов. Сер. хим. и хим. технол. 2018.
Dalton Trans. 2018. Vol. 47. N 18. P. 6351. doi 10.1039/
Т. 61. № 1. С. 23. doi 10.6060/tcct.20186101.5528
c8dt00805a
17.
Кострюков С.Г., Баландина А.В., Козлов А.Ш.,
6.
Solea A.B., Wohlhauser T., Abbasi P., Mongbanziama Y.,
Крайнов Е.В., Пряничникова М.К., Черняева О.Ю.,
Crochet A., Fromm K.M., Novitchi G., Train C.,
Ахматова А.А., Люкшина Ю.И. // ЖОХ. 2020.
Pilkington M., Mamul O. // Dalton Trans. 2018.
Т. 90. Вып. 3. С. 353; Kostryukov S.G., Balandina A.V.,
Vol. 47. N 14. P. 4785. doi 10.1039/c8dt00840j
Kozlov A.S., Kraynov E.V., Pryanichnikova M.K.,
7.
Iwase K., Yamaguchi H., Ono T., Shimokawa T.,
Chernyaeva O.Y., Akhmatova A.A., Lukshina Y.I. // Russ.
Nakano H., Matsuo A., Kindo K., Nojiri H., Hosokoshi Y. //
J. Gen. Chem. 2020. Vol. 90. N 3. P. 341. doi 10.1134/
J. Phys. Soc. Japan. 2013. Vol. 82. N 7. N 074719. doi
S1070363220030044
10.7566/JPSJ.82.074719
18.
Katritzky A.R., Belyakov S.A. // Synthesis. 1997. N 1.
8.
Brook D.J.R. // Comm. Inorg. Chem. 2015. Vol. 35.
P. 17. doi 10.1055/s-1997-1516
N 1. P. 1. doi 10.1080/02603594.2014.974805
19.
Katritzky A.R., Belyakov S.A., Denisko O.V., Maran U.,
9.
Kumar V., Shova S., Novitchi G., Train C. // Compt.
Dalal N.S. // J. Chem. Soc. Perkin Trans. 2. 1998. N 3.
Rend. Chim. 2019. Vol. 22. N 6-7. P. 541. doi 10.1016/j.
P. 611. doi 10.1039/a707561h
crci.2019.03.008
20.
Khodja I.A., Boulebd H. // Mol. Divers. 2020. doi
10.
Sanz C.A., Patrick B.O., Hicks R.G. // Dalton Trans.
2017. Vol. 46. N 33. P. 12674. doi 10.1039/c9dt02549a
10.1007/s11030-020-10064-8
11.
McKinnon S.D.J., Patrick B.O., Lever A.B.P.,
21.
Chuprun S., Dar’in D., Kantin G., Krasavin M. //
Hicks R.G. // Inorg. Chem. 2013. Vol. 52. N 14. P. 8053.
Synthesis. 2019. Vol. 51. N 21. P. 3998. doi 10.1055/s-
doi 10.1021/ic400704j
0039-1690159
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
538
КОСТРЮКОВ и др.
Synthesis of Symmetric Binuclear
5,6-Dihydro-1,2,4,5-tetrazinium Perchlorates
S. G. Kostryukov*, A. Sh. Kozlov, D. A. Krasnov, A. A. Burtasov, P. S. Petrov,
V. S. Tezikova, A. Yu. Asfandeev, and T. D. Idris
National Research Ogarev Mordovia State University, Saransk, 430005 Russia
*e -mail: kostryukov_sg@mail.ru
Received February 6, 2021; revised February 6, 2021; accepted February 20, 2021
A series of 3,3′-(1,4-phenylene)bis(1-4-R-phenyl)-5-phenyl-5,6-dihydro-1,2,4,5-tetrazinium) perchlorates
(R = H, Me, Cl, OMe, CN, NO2) were obtained as a result of a three-stage synthesis from terephthalic aldehyde.
The synthesis of tetrazinium salts was carried out by reaction of the corresponding formazans with formalin in
the presence of perchloric acid in dioxane. Formazans and tetrazinium perchlorates were isolated in individual
state and characterized by elemental analysis, IR, UV, 1H and 13C NMR spectroscopy data. The process of elec-
trochemical reduction of tetrazinium perchlorates was studied using the method of cyclic voltammetry (CV).
It has been shown that these compounds are perspective precursors of symmetric biradical systems based on
verdazyl radicals.
Keywords: formazan, verdazyl, 5,6-dihydro-1,2,4,5-tetrazinium, perchlorate, cyclic voltammetry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021