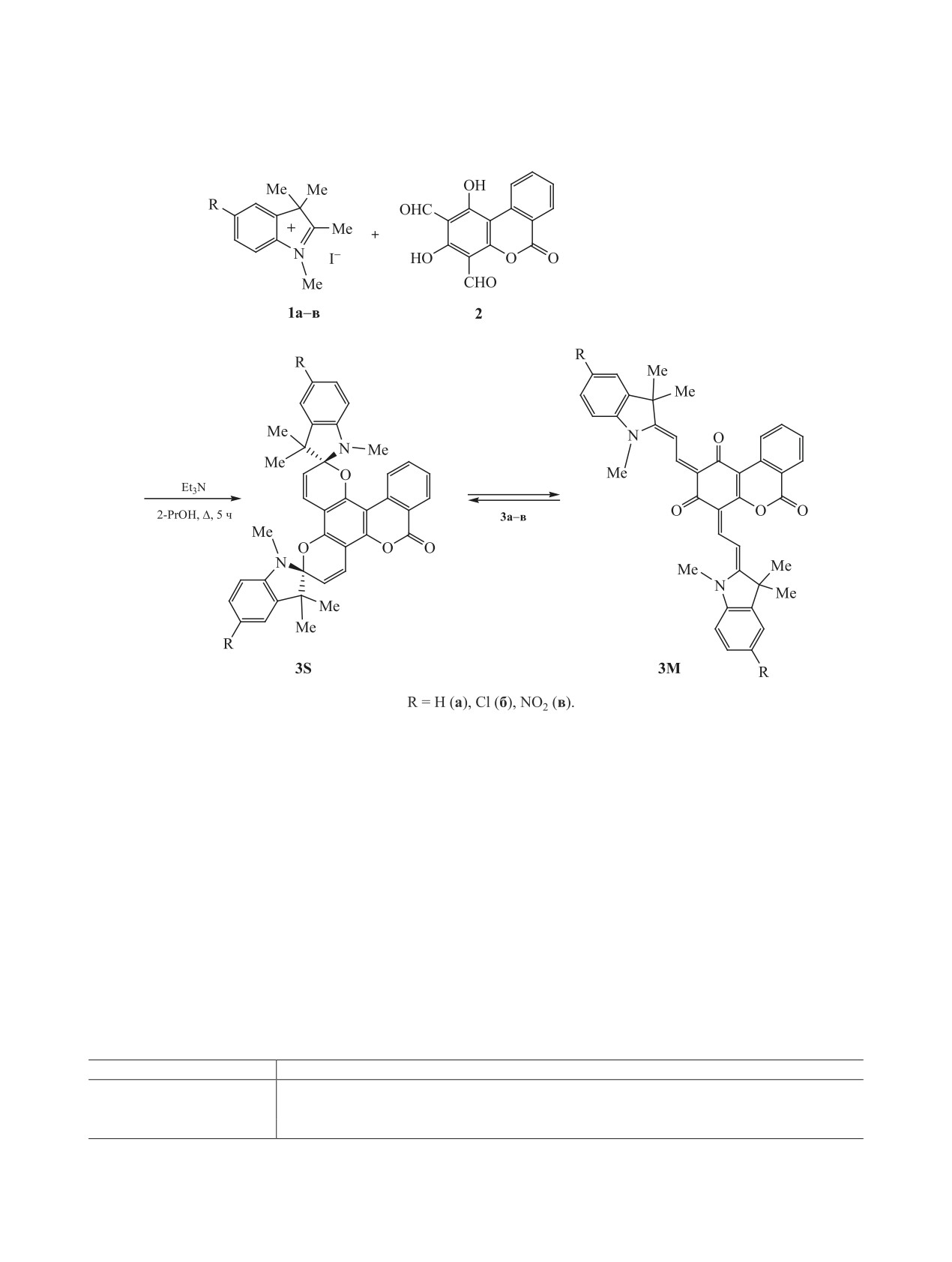
ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 544-549
УДК 547.642:547.816
СИНТЕЗ И ФОТОХРОМНЫЕ СВОЙСТВА
БИССПИРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ НА
ОСНОВЕ 1,3-ДИГИДРОКСИ-6-ОКСО-6H-БЕНЗО[c]-
ХРОМЕН-2,4-ДИКАРБАЛЬДЕГИДА
© 2021 г. О. Г. Николаеваa, О. Ю. Карлутоваa, Е. Б. Гаеваa,
А. Д. Дубоносовb,*, А. В. Метелицаa, В. А. Бреньa, В. И. Минкинa
a Научно-исследовательский институт физической и органической химии Южного федерального университета,
Ростов-на-Дону, 344090 Россия
b Федеральный исследовательский центр «Южный научный центр Российской академии наук»,
пр. Чехова 41, Ростов-на-Дону, 344006 Россия
*e-mail: aled@ipoc.sfedu.ru
Поступило в Редакцию 5 марта 2021 г.
После доработки 5 марта 2021 г.
Принято к печати 18 марта 2021 г.
Синтезированы бисспироциклические соединения на основе 1,3-дигидрокси-6-оксо-6H-бензо[c]хро-
мен-2,4-дикарбальдегида. Соединения с заместителями R = H, Cl в положениях 5,5′ индолинового
фрагмента в ДМСО существуют в открытой мероцианиновой форме; при R = NO2 соответствующее бис-
спиросоединение сущестствует в виде таутомерной смеси спироциклической и мероцианиновой форм.
В ДМСО полученные соединения подвергаются фотоиндуцированной циклизации. Нитропроизводное
демонстрирует свойства как положительного, так и отрицательного фотохромизма.
Ключевые слова: бензо[c]хромен, кумарин, бисспиропираны, поглощение, фотохромизм, фотохромные
«весы»
DOI: 10.31857/S0044460X21040089
Спиропроизводные пирана - наиболее извест-
денсацией иодидов 3Н-индолия 1a-в [14] с 1,3-ди-
ный и изучаемый класс фотохромных соединений
гидрокси-6-оксо-6H-бензо[c]хромен-2,4-дикар-
вследствие возможности целенаправленной моди-
бальдегидом 2 [15] в присутствии триэтиламина
фикации их структуры и спектрально-люминес-
(схема 1).
центных свойств в широких пределах [1-4], соз-
Согласно данным спектроскопии ЯМР 1Н, со-
дания устройств оптической записи информации,
единения 3а, б находятся в открытой мероциани-
молекулярных переключателей, био- и хемосенсо-
новой форме 3M. В растворах в ДМСО-d6 наблю-
ров, а также возможности адресной доставки ле-
даются два шестипротонных синглетных сигнала
карственных препаратов [5-9].
при 1.68-1.75 м. д. и два трехпротонных синглет-
Соединения с двумя фрагментами спиропира-
ных сигнала при 3.53-3.56 м. д. Сигналы прото-
на изучены в значительно меньшей степени, одна-
нов диеновых мостиков проявляются в виде двух
ко наличие двух потенциально неэквивалентных
дублетов в области 7.90-7.98 и 8.39-8.44 м. д. Со-
фотоактивных центров открывает возможность
единение 3в существует в виде таутомерной смеси
получения мультифункциональных фотохромных
спироциклической S и мероцианиновой M форм.
систем [10-13]. Соединения 3a-в получены кон-
В сильнопольной области наряду с сигналами при
544
СИНТЕЗ И ФОТОХРОМНЫЕ СВОЙСТВА
545
Схема 1.
1.18, 1.26 и 2.78, 2.86 м. д., соответствующими
цепторный заместитель Cl в положениях 5 и 5′ ин-
двум парам магнитно-неэквивалентных геминаль-
долинового фрагмента соединения 3б в ~1.6 раза
ных метильных и N-метильных групп индолино-
снижает интенсивность поглощения по сравнению
вого фрагмента в спироциклическом таутомере,
с незамещенным соединением 3а. Для нитропро-
присутствуют по два сигнала этих же групп в меро-
изводного 3в равновесие в растворе ДМСО сильно
цианиновой форме при 1.74, 1.77 и 3.55, 3.56 м. д.
смещено в сторону спироциклической формы, что
Судя по интенсивности сигналов, соотношение
подтверждается практически полным отсутствием
спироциклической S и мероцианиновой M форм
полос в видимом диапазоне спектра и максимумом
составляет 3:1.
при 367 нм. Длинноволновые максимумы соеди-
нения 3в смещены батохромно по сравнению с со-
Растворы соединений 3a-в в ДМСО характе-
единениями 3а, б.
ризуются интенсивными полосами электронного
поглощения, характерными для мероцианино-
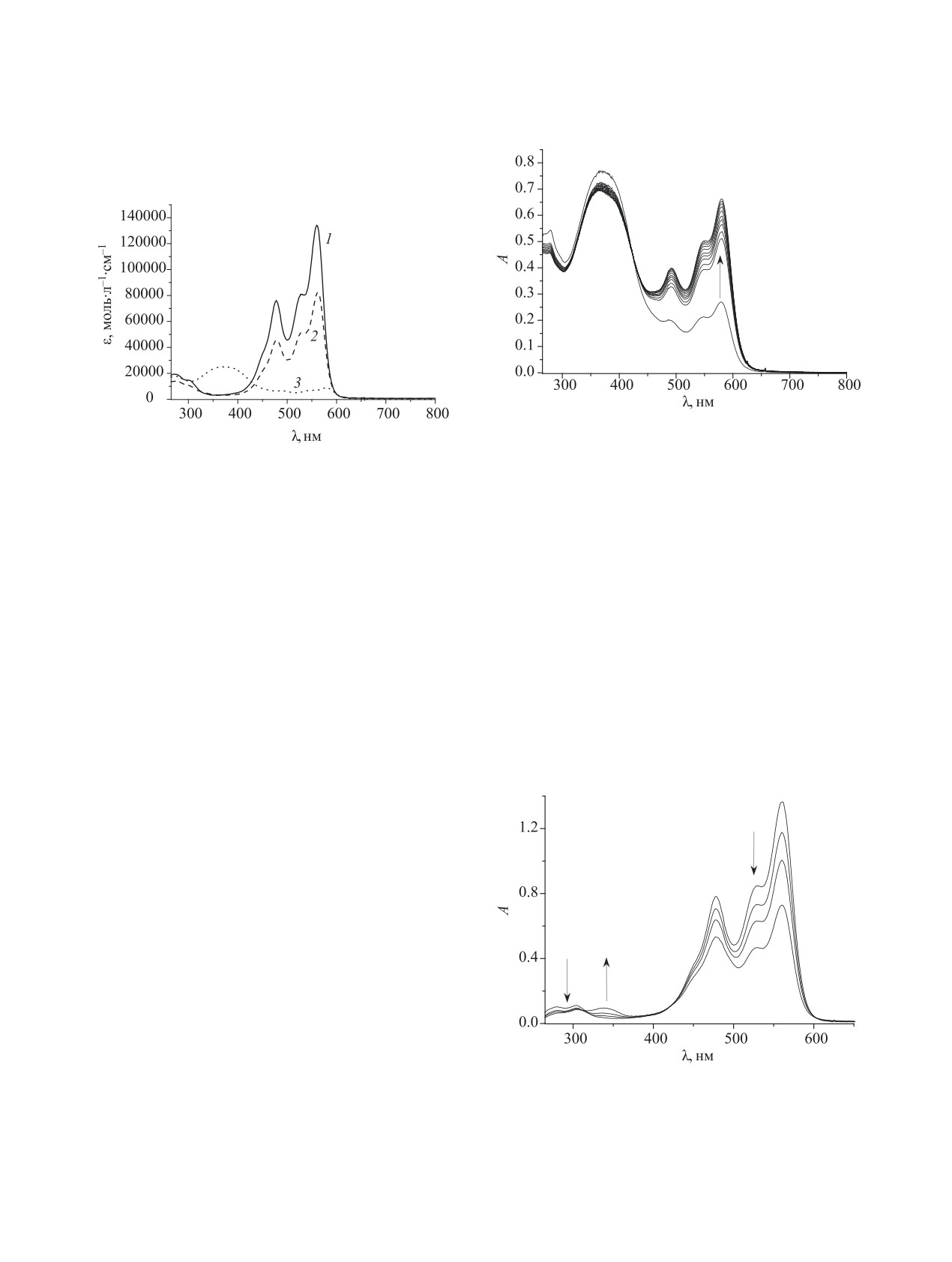
Cпектры растворов соединений 3а, б в ДМСО
вых форм, с максимумами при 477-479, 528-531
при облучении УФ светом не изменяются, что свя-
и 561-562 нм (см. таблицу, рис. 1). Электроноак-
зано с присутствием в растворах, согласно данным
Спектральные характеристики соединений 3a-в в ДМСО при 293 K
Соединение
λ, нм (ε, л·моль-1·см-1)
3a
300 пл (15400), 477 (75200), 528 (80300), 561 (131000)
3б
299 пл (10900), 479 (45600), 531 (51300), 562 (80600)
3в
367 (25300), 490 (6700), 547 (7000), 579 (8900)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
546
НИКОЛАЕВА и др.
Рис. 2. Изменение спектров поглощения раствора сое-
динения 3в в ДМСО при облучении светом (λ 365 нм).
Рис. 1. Спектры поглощения соединений 3a-в (1-3) в
с3в 3.06×10-5 моль/л, 293 K, интервал съемки между
ДМСО при 293 K.
спектрами - 30 с.
ЯМР 1Н, преимущественно мероцианиновых тау-
онарное состояние. После выключения источни-
томеров. Соединение 3в существует в растворах в
ка УФ излучения система релаксирует в исходное
виде равновесия спироциклических и мероциани-
состояние равновесия, демонстрируя положитель-
новых таутомеров (рис. 2) и обладает положитель-
ный фотохромизм. Облучение видимым светом
ным фотохромизмом. При облучении УФ светом
на полосе поглощения мероцианиновых изомеров
(λ 365 нм) раствора соединения 3в в ДМСО про-
инициирует цикл отрицательного фотохромизма,
исходит фотореакция с образованием окрашенных
приводящего к изменению цвета раствора до уста-
мероцианиновых таутомеров (рис. 2). После пре-
новления нового фотостационарного состояния.
После прекращения облучения система релакси-
кращения облучения система возвращается к ис-
рует в исходное состояние равновесия. Следова-
ходному равновесному состоянию.
тельно, растворы соединения 3в демонстрируют
При облучении растворов соединений 3a-в
свойство так называемых фотохромных «весов»,
видимым светом в полосах поглощения мероциа-
ниновых таутомеров наблюдается отрицательный
фотохромизм. При облучении светом (λ 546 нм)
происходит обесцвечивание растворов вследствие
протекания фотоинициированной циклизации в
спироформу S (рис. 3). Уменьшение интенсивно-
сти полосы поглощения мероцианинового тауто-
мера соединения 3a при 561 нм сопровождается
появлением полосы в коротковолновой области
спектра (λ 338 нм), что характерно для спиро-
циклических производных пирана [16]. После
прекращения облучения исходные спектры погло-
щения восстанавливаются.
Вследствие установления равновесия между
спироциклическим S и мероцианиновым изоме-
Рис. 3. Изменение спектров поглощения раствора сое-
рами M при нормальных условиях при УФ облу-
динения 3а в ДМСО при облучении светом (λ 546 нм).
чении происходит дополнительное окрашивание
с3а 1.07×10-5 моль/л, 293 K, интервал съемки между
растворов соединения 3в и возникает фотостаци-
спектрами - 600 с.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ФОТОХРОМНЫЕ СВОЙСТВА
547
когда фотоиндуцированное отклонение доли ме-
1,3,6(2Н,4Н)-трион
(3а). Выход
54%, т. пл.
роцианинового изомера в ту или иную сторону
260-262°С (i-PrOH). Спектр ЯМР 1H (ДМСО-d6),
компенсируется противоположными термически-
δ, м. д. (J, Гц): 1.68 c (6H, Me), 1.71 c (6H, Me), 3.53
ми процессами [17].
c (3H, NMe), 3.54 c (3H, NMe), 7.17-7.54 м (8НAr +
1Нкумарин), 7.83-7.85 м (1Hкумарин), 7.90 д (1H, H1, J
Таким образом, полученные бисспиросоедине-
14.3), 7.98 д (1H, H1, J 13.8), 8.13 т (1Нкумарин, J 9.2),
ния на основе 1,3-дигидрокси-6-оксо-6H-бензо[c]-
хромен-2,4-дикарбальдегида существуют в виде
8.41 д (1H, H1, J 13.8), 8.72 д (1H, H2, J 14.1), 9.57
д (1Нкумарин, J 8.2). Найдено, %: C 78.65; Н 5.66; N
таутомерной смеси спироциклической и мероциа-
ниновой форм, их растворы в ДМСО подвергают-
7.85. C39H34N2O4. Вычислено, %: C 78.77; Н 5.76;
ся фотоиндуцированной циклизации, а нитропро-
N 4.71.
изводное проявляет свойства как положительного,
2,4-Бис[2-(1,3,3-триметил-5-хлор-1,3-диги-
так и отрицательного фотохромизма.
дроиндол-2-илиден)этилиден]-1Н-бензо[c]хро-
мен-1,3,6(2Н,4Н)-трион (3б). Выход 40%, т. пл.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
),
275-277°С (i-PrOH). Спектр ЯМР 1H (ДМСО-d6
Спектры ЯМР 1Н получены на спектрометре
δ, м. д. (J, Гц): 1.71 с (12H, Me), 3.53 c (6Н, NMe),
Bruker DPX-250 (250 MГц) в ДМСО-d6. В качестве
7.19-7.54 м (4НAr + 1Нкумарин), 7.70-7.75 м (2НAr),
внутреннего стандарта использовали остаточные
7.84-7.99 м (3Нкумарин, Н1, Н2), 7.92 д (1H, H1, J
сигналы протонов дейтерорастворителя. Коле-
14.1), 8.17 т (1Hкумарин, J 6.0), 8.42 д (1H, H2, J 14.1),
бательные спектры записаны на приборе Varian
9.58 д (1Н, Hкумарин, J 8.1). Найдено, %: C 70.74;
Excalibur 3100 FT-IR методом нарушенного пол-
Н 5.02; N 4.40. C39H32Cl2N2O4. Вычислено, %: C
ного внутреннего отражения с использованием
70.59; Н 4.86; N 4.22.
кристалла ZnSe. Электронные спектры поглоще-
2,6-Диспиро(1,3,3-триметил-5-нитро-1,3-ди-
ния исследуемых соединений регистрировали на
гидроиндол-2′)-2Н,6Н,10Н-бензо[c]дипира-
спектрофотометре Agilent 8453 с приставкой для
но[2,3-f:2,3-h]хромен-10-он
(3в). Выход
40%,
термостатирования образцов. Фотолиз раство-
т. пл.
250-252°С (i-PrOH). Спектр ЯМР
1H
ров проводили при облучении системой Newport
(ДМСО-d6), δ, м. д., (J, Гц): форма S, 1.14 c (3H,
с ртутной лампой мощностью 200 Вт с набором
Me), 1.18 c (3H, Me), 1.26 c (3H, Me), 1.32 c (3H,
интерференционных светофильтров (установка
Me), 2.78 c (3H, NMe), 2.86 c (3H, NMe), 5.85 д (1H,
Newport). Для приготовления растворов исполь-
H3′, J 10.5), 5.87 д (1H, H13′, J 10.5), 6.83 м (2H, Н7,
зовали ДМСО спектральной чистоты (Aldrich).
H7′′), 6.88 д (1Н, H4′, J 10.6), 7.13 т (1Н, Hкумарин, J
Температуры плавления определяли в стеклянных
7.8), 7.34 с (1Н, H14′, J 10.3), 7.38 д (1Hкумарин, J 7.8),
капиллярах на приборе ПТП (М). Элементный
7.88 д (1Hкумарин, J 7.8), 8.05 c (1H, Н4), 8.07 c (1H,
анализ выполняли классическим методом [18].
Н4′′), 8.14-8.17 м (3Н, Н6, H6′′, Hкумарин); форма M,
Общая методика получения соединений 3a-в.
1.74 с (6H, Me), 1.77 с (6H, Me), 3.55 c (3Н, NMe),
К раствору 2 ммоль иодида 2,3,3-триметилиндо-
3.56 c (3Н, NMe), 7.39 д (2H, Н7, H7′′, J 7.0), 7.13
лия 1а-в и 1 ммоль (0.284 г) 1,3-дигидрокси-6-ок-
т (1Hкумарин, J 7.8), 7.39 т (1Hкумарин, J 7.8), 7.88 д
со-6H-бензо[c]хромен-2,4-дикарбальдегида
2 в
(1Hкумарин, J 7.8), 8.21 д (2Н, Н6, H6′′, J 8.1), 8.25 c
50 мл изопропанола прибавляли при нагревании
(1H, Н4), 8.29 c (1H, Н4′′), 8.54 д (1H, H1, J 13.8),
0.7 ммоль (0.1 мл) триэтиламина. Смесь кипятили
8.59 д (1H, H2, J 14.4), 8.64-8.71 м (2H, H1, Н2),
5 ч, затем охлаждали, выливали в воду (50 мл) и
9.50 м (1Hкумарин). Найдено, %: C 68.26; Н 4.85; N
несколько раз экстрагировали хлороформом. Экс-
8.25. C39H32N4O8. Вычислено, %: C 68.41; Н 4.71;
тракт сушили CaCl2 и упаривали до объема 10-
N 8.18.
15 мл. Остаток очищали методом колоночной хро-
ФОНДОВАЯ ПОДДЕРЖКА
матографии на Al2O3 (элюент - CHCl3) и кристал-
лизовали из изопропанола.
Работа выполнена при финансовой поддержке
2,4-Бис[2-(1,3,3-триметил-1,3-дигидроиндол-
Министерства науки и высшего образования РФ в
2-илиден)этилиден]-1Н-бензо[c]хромен-
рамках государственного задания в сфере научной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
548
НИКОЛАЕВА и др.
деятельности № 0852-2020-0019, а также в рамках
Heterocycl. Compd. 2015. Vol. 51. P. 229. doi 10.1007/
государственного задания Южного научного цен-
s10593-015-1689-2
12.
Ожогин И.В., Ткачев В.В., Лукьянов Б.С., Муха-
тра РАН (№ 01201354239, А.Д. Дубоносов).
нов Е.Л., Чернышев А.В., Комиссарова О.А., Мин-
КОНФЛИКТ ИНТЕРЕСОВ
кин В.И., Алдошин С.М. // Докл. АН. 2016. Т. 471.
С. 676; Ozhogin I.V., Tkachev V.V., Lukyanov B.S.,
Авторы заявляют об отсутствии конфликта
Mukhanov E.L., Chernyshev A.V., Komissarova O.A.,
интересов.
Minkin V.I., Aldoshin S.M. // Doklady Chem. 2016.
СПИСОК ЛИТЕРАТУРЫ
Vol. 471. P. 378. doi 10.1134/S0012500816120090
13.
Муханов Е.Л., Алексеенко Ю.С., Дороган И.В., Тка-
1.
Bertelson R.C. Organic Photochromic and Thermo-
чев В.В., Лукьянов Б.С., Алдошин С.М., Безуг-
chromic Compounds / Eds J.C. Crano, R. Guglielmetti.
лый С.О., Минкин В.И., Утенышев А.Н., Рящин О.Н. //
New York: Kluwer Academic Publishers, 1999. Vol. 1.
ХГС. 2010. Т. 46. С. 357; Mukhanov E.L., Alekseen-
P. 11.
ko Yu.S., Dorogan I.V., Tkachev V.V., Lukyanov B.S.,
2.
Kortekaas L., Browne W.R. // Chem. Soc. Rev. 2019.
Aldoshin S.M., Bezuglyi S.O., Minkin V.I., Uteny-
Vol. 48. P. 3406. doi 10.1039/C9CS00203K
shev A.N., Ryashchin O.N. // Chem. Heterocycl. Compd.
3.
Klajn R. // Chem. Soc. Rev. 2014. Vol. 43. P. 148. doi
2010. Vol. 46. P. 279. doi 10.1007/s10593-010-0503-4
10.1039/C3CS60181A
14.
Pottier E., Sergent M., Phan Tan Luu R., Gugliel-
4.
Минкин В.И. // Усп. хим. 2013. Т. 82. С. 1; Minkin V.I.
metti R. // Bull. soc. сhim. Fr. 1992. Vol. 101. N 8.
// Russ. Chem. Rev. 2013. Vol. 82. P. 1. doi 10.1070/
P. 719. doi 10.1002/bscb.19921010810
RC2013v082n01ABEH004336
15.
Николаева О.Г., Карлутова О.Ю., Дубоносов А.Д.,
5.
Bercovic G., Krongauz V., Weiss V. // Chem. Rev. 2000.
Брень В.А., Минкин В.И. // ЖОХ. 2020. Т. 90.
Vol. 100. N 5. P. 1741. doi 10.1021/cr9800715
Вып. 12. С. 1807; Nikolaeva O.G., Karlutova O.Yu.,
6.
Pianowski Z.L. // Chem. Eur. J. 2019. Vol. 25. N 20.
Dubonosov A.D., Bren V.A., Minkin V.I. // Russ. J.
P. 5128. doi 10.1002/chem.201805814
Gen. Chem. 2020. Vol. 90. N 12. P. 2219. doi 10.1134/
7.
Zhang X., Chen L., Lim R.H., Gonuguntla S., Lim K.W.,
S1070363220120014
Pranantyo D., Yong W.P., Yam W.J.T., Low Z., Teo W.J.,
16.
Николаева О.Г., О.Ю. Костырина, Е.Н. Шепелен-
Nien H.P., Loh Q.W., Soh S. // Adv. Mater. 2019. Vol. 31.
ко, А.В. Цуканов, Метелица А.В., Г.С. Бородкин,
N 11. Article 1804540. doi 10.1002/adma.201804540
А.Д. Дубоносов, В.А. Брень, В.И. Минкин. // ЖОрХ.
8.
Sahoo P.R., Prakash K., Kumar S. // Coord. Chem. Rev.
2011. Т. 47. Вып. 9. С. 1348; Nikolaeva O.G., Kostyri-
2018. Vol. 357. P. 18. doi 10.1016/j.ccr.2017.11.010
na O.Yu., Shepelenko E.N., Tsukanov A.V., Meteli-
9.
Cardano F., Del Canto E., Giordani S. // Dalton Trans.
tsa A.V., Borodkin G.S., Dubonosov A.D., Bren, V.A.,
2019. Vol. 48. P. 15537. doi 10.1039/c9dt02092
Minkin V.I. // Russ. J. Org. Chem. 2011. Vol. 47. N 9.
10.
Ozhogin I.V., Mukhanov E.L., Chernyshev A.V.,
P. 1370. doi 10.1134/S1070428011090193
Pugachev A.D., Lukyanov B.S., Metelitsa A.V. // J. Mol.
17.
Metelitsa A., Chernyshev A., Voloshin N., Solov’eva E.,
Struct. 2020. Vol. 1221. Article 128808. doi 10.1016/j.
Irina Rostovtseva I., Dorogan I., Gaeva E., Guseva A. //
molstruc.2020.128808
Dyes and Pigments. 2021. Vol. 186. Article 109070. doi
11.
Николаева О.Г., Карлутова О.Ю., Чепрасов А.С.,
10.1016/j.dyepig.2020.109070
Метелица А.В., Дороган И.В., Дубоносов А.Д.,
18.
Гельман Н.Э., Терентьева Н.А., Шанина Г.М., Кипа-
Брень В.А. // ХГС. 2015. Т. 51. С. 229; Nikolaeva O.G.,
ренко Л.М., Резл В. Методы количественного орга-
Karlutova O.Yu., Cheprasov A.S., Metelitsa A.V.,
нического элементного микроанализа. М.: Химия,
Dorogan I.V., Dubonosov A.D., Bren V.A. // Chem.
1987.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ФОТОХРОМНЫЕ СВОЙСТВА
549
Synthesis and Photochromic Properties of Bis-spirocyclic
Compounds Based on 1,3-Dihydroxy-6-oxo-6H-benzo[c]-
chromene-2,4-dicarbaldehyde
O. G. Nikolaevaa, O. Yu. Karlutovaa, E. B. Gaevaa, A. D. Dubonosovb,*, A. V. Metelitsaa,
V. A. Brena, and V. I. Minkina
a Institute of Physical and Organic Chemistry, Southern Federal University, Rostov-on-Don, 344090 Russia
b Federal Research Center “Southern Scientific Center of the Russian Academy of Sciences”, Rostov-on-Don, 344006
Russia
*e-mail:aled@ipoc.sfedu.ru
Received March 5, 2021; revised March 5, 2021; accepted March 18, 2021
Nonsymmetric bis-spiropyran derivatives based on 1,3-dihydroxy-6-oxo-6H-benzo[c]chromene-2,4-dicarbal-
dehyde were synthesized. The obtained compounds with substituents R = H, Cl at positions 5, 5’ of the indoline
fragment in a DMSO solution exist in a fully open merocyanine form. Their change for the electron-acceptor
group NO2 results to the existence of the corresponding bis-spiropyran in the form of a tautomeric mixture
of spirocyclic and merocyanine forms. The resulting compounds in a DMSO solution undergo photoinduced
cyclization. The nitro derivative demonstrates both positive and negative photochromism.
Keywords: benzo[c]chromene, coumarin, bis-spiropyran, absorption, photochromism, photochromic “balance”
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021