ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 550-555
УДК 544.43:[547.661.2;547.469.3]
ВЗАИМОДЕЙСТВИЕ 2,2′-ДИ(4-ХЛОРФЕНИЛ)-
1,1′,3,3′-ТЕТРАОКСО-2,2′,3,3′-ТЕТРАГИДРО-1H,1′H-6,6′-
БИ(БЕНЗО[de]ИЗОХИНОЛИН)-7,7′-ДИКАРБОНОВОЙ
КИСЛОТЫ С ДИОКСИДОМ ТИОМОЧЕВИНЫ В
ВОДНО-ЩЕЛОЧНОМ РАСТВОРЕ
© 2021 г. Ю. В. Поленов*, К. С. Никитин, Е. В. Егорова, Д. А. Патрушева
Ивановский государственный химико-технологический университет,
пр. Шереметевский 7, Иваново, 153000 Россия
*e-mail: polyurij@yandex.ru
Поступило в Редакцию 3 февраля 2021 г.
После доработки 3 февраля 2021 г.
Принято к печати 18 февраля 2021 г.
Исследована восстановительная циклизация калиевой соли 2,2′-ди(4-хлорфенил)-1,1′,3,3′-тетраок-
со-2,2′,3,3′-тетрагидро-1H,1′H-6,6′-би(бензо[de]изохинолин)-7,7′-дикарбоновой кислоты под действием
диоксида тиомочевины в водно-щелочном растворе. Получены продукты восстановления двух или
четырех оксогрупп в N,N′-ди(4-хлорфенил)диимиде 3,4,9,10-перилентетракарбоновой кислоты, а также
продукт циклизации неустановленного состава. Состав и количество промежуточных и конечных продук-
тов циклизации зависят от концентрации восстановителя и присутствия в растворе кислорода воздуха.
Предложен стадийный стехиометрический механизм восстановительной циклизации.
Ключевые слова: кубоген, диимид 3,4,9,10-перилентетракарбоновой кислоты, диоксид тиомочевины,
восстановительная циклизация, стехиометрический механизм реакции
DOI: 10.31857/S0044460X21040090
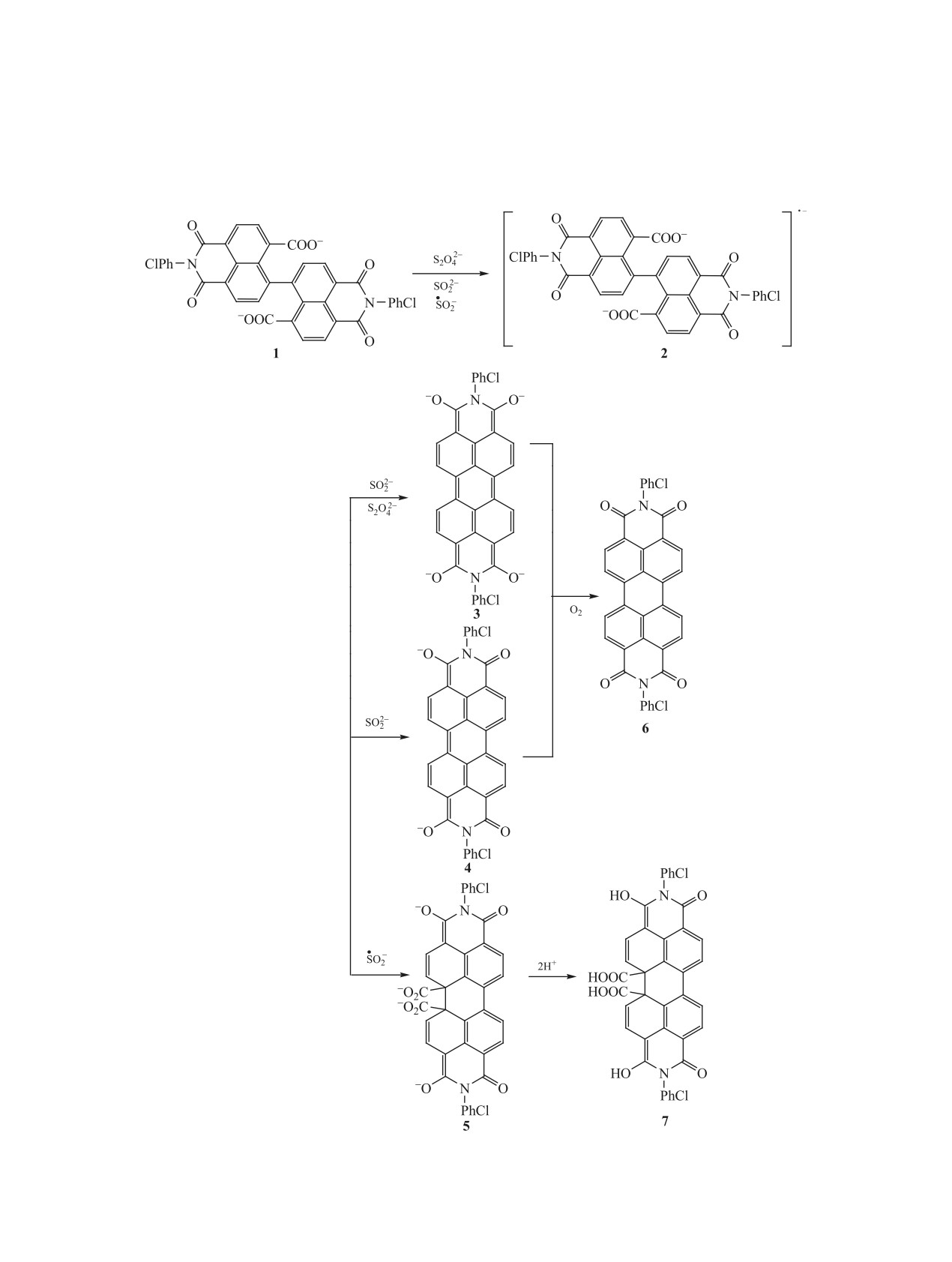
Реакция восстановительной циклизации 2,2′
[4] с образованием диалкоголятов - производных
замещенных
1,1′,3,3′-тетраоксо-2,2′,3,3′-тетраги-
замещенных диимидов перилентетра- и гексакар-
дро-1H,1′H-6,6′-би(бензо[de]изохинолин)-7,7′-ди-
боновой кислот с двумя восстановленными кар-
карбоновой кислоты (кубогенов) лежит в основе
бонильными группами. Состав и выход продуктов
получения периленовых красителей в процессах
реакции зависят от природы восстановителя.
печатания тканей и крашения волокон [1]. Произ-
При превращении кубогена с 4-хлорфенильным
водные перилентетракарбоновой кислоты приме-
заместителем при атомах азота (кубоген красный)
няются в качестве лазерных красителей [2] и пре-
в присутствии гидрокси- и аминоалкансульфина-
образователей световой энергии в электрическую
тов натрия в водно-щелочном растворе обнаруже-
[3].
ны несодержащие карбоксильных групп продукты
Восстановительная циклизация калиевой
циклизации в различных степенях окисления - ди-
соли
2,2′-ди(2,5-диметилфенил)-1,1′,3,3′-тетраок-
оксид-анион и тетраоксид-анион [5].
со-2,2′,3,3′-тетрагидро-1H,1′H-6,6′-би(бензо[de]-
Нами изучено действие диоксида тиомоче-
изохинолин)-7,7′-дикарбоновой кислоты протека-
вины на циклизацию кубогена красного с целью
ет при действии дитионита натрия, гидроксиме-
установления влияния восстановителя на зако-
тансульфината натрия и диоксида тиомочевины
номерности протекания циклизации кубогенов с
550
ВЗАИМОДЕЙСТВИЕ 2,2′-ДИ(4-ХЛОРФЕНИЛ)-...
551
Схема 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
552
ПОЛЕНОВ и др.
предполагается, что на первой стадии восстанов-
ления кубогенов в водно-щелочной среде различ-
ными химическими восстановителями образуется
радикальная частица исходного кубогена, в ко-
торой неспаренный электрон взаимодействует с
магнитными ядрами одного из нафтильных фраг-
ментов [4]. Образование радикала подтверждено
данными ЭПР. Можно предположить, что сме-
щение полосы поглощения исходного кубогена в
коротковолновую область спектра происходит в
результате образования интермедиата 2 - произво-
дного 1,1′-бинафталина.
В водно-щелочных растворах восстановитель-
ной активностью обладают не молекулы диоксида
тиомочевины, а продукты их разложения - анионы
сульфоксиловой кислоты SO2-, образующиеся в
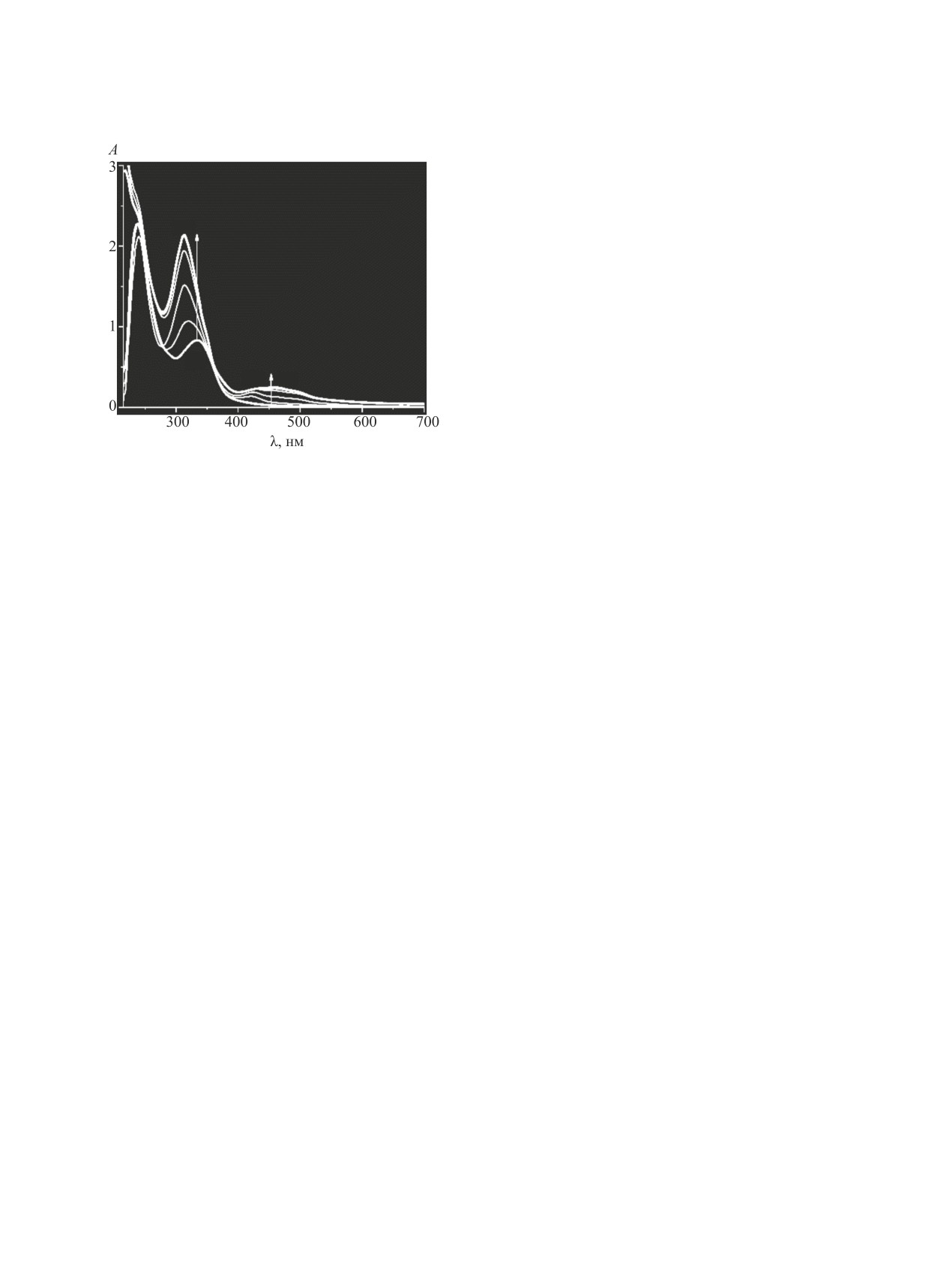
Рис. 1. Изменение электронных спектров поглощения
раствора в ходе реакции восстановительной цикли-
ходе расщепления (1) связи углерод-сера [6]. Эти
зации кубогена красного диоксидом тиомочевины
же анионы образуются как интермедиаты-восста-
(восстановитель) в анаэробных условиях при 301 K
новители в водных растворах гидроксиметансуль-
(свосст 7.95×10-4 моль/л, сNaOH 0.12 моль/л, скуб 3.86×
10-5 моль/л).
фината натрия [7].
(NH2)2CSO2 + 2OH- → SO2- + (NH2)2CO + H2O. (1)
При восстановительной циклизации кубогена
различными заместителями при атомах азота. При
красного в реакции с гидрокси- и аминоалкан-
восстановлении в атмосфере аргона (анаэробные
сульфинатами в аэробных условиях наряду с ди-
условия) после смешения растворов кубогена 1
оксид-анионом 4 образуется тетраоксид-анион 3 -
(схема 1) и диоксида тиомочевины полоса погло-
производное диимида 3,4,9,10-перилентетракар-
щения исходного соединения (кубогена) в элек-
боновой кислоты 6 с четырьмя восстановленными
тронном спектре (λ 330 нм) смещается в коротко-
оксогруппами, которое, судя по представленным
волновую область до 315 нм, и появляется новая
спектрам (рис. 1), в анаэробных условиях в реак-
полоса при λ 424 нм (рис. 1).
ционной системе не образуется.
Интенсивность поглощения при указанных
Сравнение спектров поглощения в ходе цикли-
длинах волн возрастает, на 33-ей минуте в за-
зации кубогена в анаэробных (рис. 1) и аэробных
данных условиях эксперимента появляется но-
(рис. 2) условиях показывает, что конечные про-
вый максимум поглощения при 479 нм. Затем
дукты циклизации различаются. В аэробных ус-
последние две полосы сливаются в одну широ-
ловиях образуется тетраоксид-анион 3, так как
кую полосу с максимумом при ~475 нм. Образо-
максимумы спектра поглощения при 500 и 536 нм
вание широкой полосы поглощения при 475 нм
характерны для продукта восстановления кубоге-
отмечалось при восстановлении кубогена крас-
на красного дитионитом натрия [8].
ного гидроксиметансульфинатом натрия [5]. При
Значительное количество дитионит-анионов
этой длине волны поглощает 2,9-диаза-3,8-ди-
образуется при разложении диоксида тиомочеви-
оксо-2,9-ди(4-хлорфенил)-1,2,3,8,9,10-гексаги-
ны в аэробных условиях за счет реакции анионов
дродибензо[cd,lm]-1,10-диолат 4. Следовательно,
сульфоксиловой кислоты с растворенным кисло-
он образуется и при восстановлении кубогена
родом, поэтому можно утверждать, что активны-
красного диоксидом тиомочевины.
ми интермедиатами-восстановителями в данном
Сведения о каких-либо промежуточных соеди-
случае являются именно ионы S2O2-.
нениях, предшествующих образованию конечно-
При большом избытке диоксида тиомочевины
го продукта циклизации, отсутствуют [5]. Однако
по сравнению с исходным кубогеном в аэробных
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
ВЗАИМОДЕЙСТВИЕ 2,2′-ДИ(4-ХЛОРФЕНИЛ)-...
553
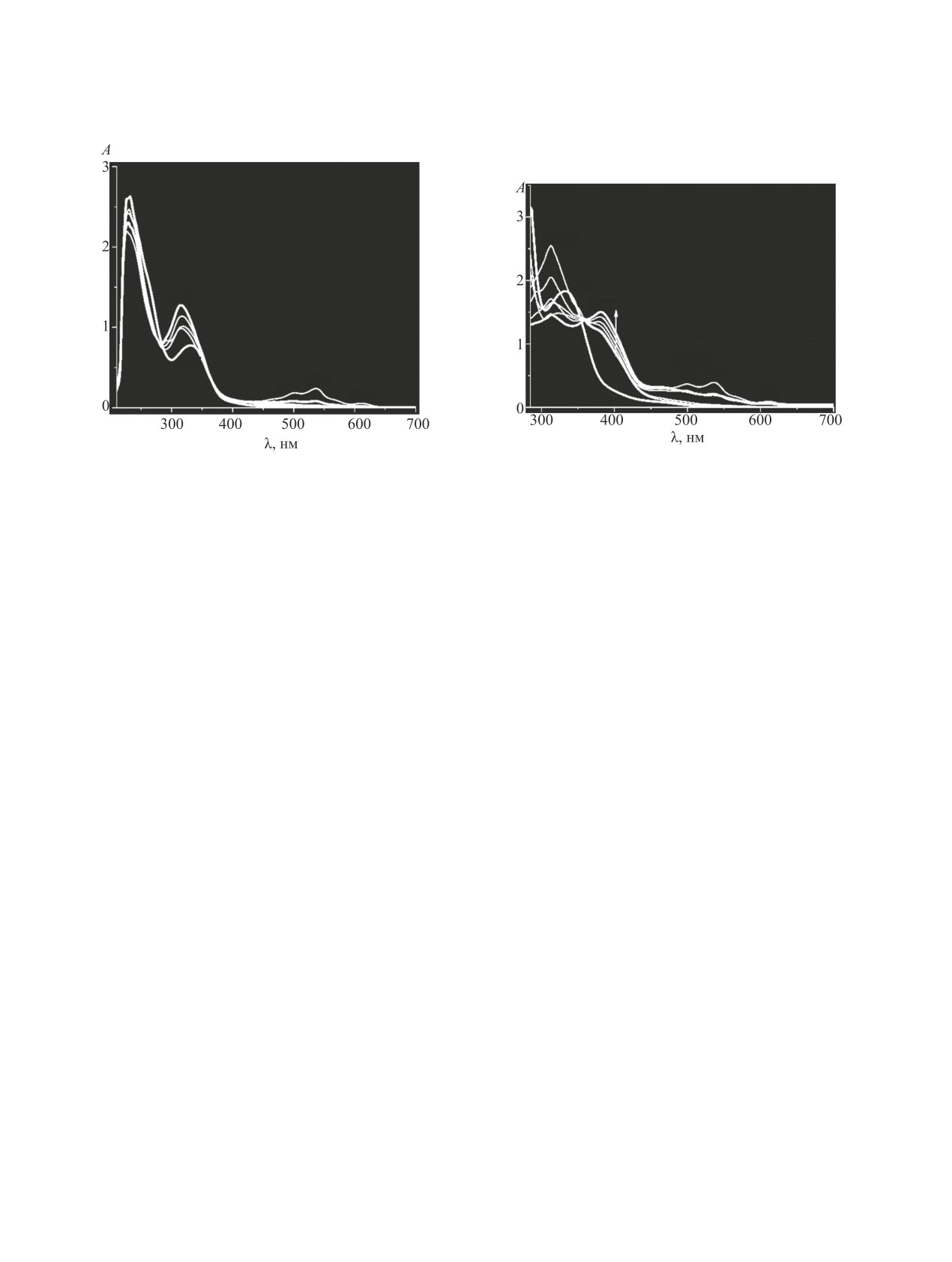
Рис. 2. Изменение электронных спектров поглощения
Рис. 3. Изменение электронных спектров поглощения
раствора в ходе реакции восстановительной цикли-
раствора в ходе реакции восстановительной циклиза-
зации кубогена красного в аэробных условиях при
ции кубогена красного в аэробных условиях при 301
301 K (с восст 7.95×10-4 моль/л, сNaOH
0.12 моль/л,
K (свосст 8.5×10-3 моль/л, сNaOH 0.12 моль/л, скуб 3.86×
скуб 3.86×10-5 моль/л).
10-5 моль/л).
условиях при восстановительной циклизации воз-
в растворе. Об этом свидетельствует появление
можно образование еще одного продукта циклиза-
небольшого количества красного осадка на стен-
ции с двумя карбоксильными группами [4].
ках кюветы по окончании реакции. Во всех опы-
Нами были проведены опыты, в которых кон-
тах как в аэробных, так и в анаэробных условиях,
центрация диоксида тиомочевины была на 2 по-
после окисления реакционной массы было вы-
делено твердое красное вещество, электронный,
рядка выше концентрации исходного кубогена.
Анализ изменений в спектрах поглощения в ходе
ИК и масс-спектры которого соответствовали
реакции (рис. 3) показывает, что после смешения
N,N′-ди(4-хлорфенил)диимиду
3,4,9,10-перилен-
растворов кубогена и диоксида тиомочевины по-
тетракарбоновой кислоты 6.
лоса поглощения исходного соединения (рис. 3,
При попытке выделить из реакционной мас-
1) при λ 330 нм смещается в коротковолновую об-
сы продукт реакции, раствор которого имеет
ласть (313 нм), и появляется новая полоса при λ
максимум поглощения при длине волны 382 нм
382 нм, интенсивность которой увеличивается в
(рис. 3), получено твердое желтое вещество, ко-
ходе реакции. К 120-ой минуте в спектре появля-
торое на воздухе быстро окислялось до произ-
ются полосы поглощения с максимумами при 499
водного перилена. Установить состав получен-
и 536 нм, а интенсивность полосы при λ 313 нм
ного соединения не удалось. В его масс-спектре
уменьшается. К 180-ой минуте поглощение в
присутствовали различные типы ионов с не-
длинноволновой области спектра достигает мак-
большой молекулярной массой, а ИК спектр
симума, а затем его интенсивность уменьшается.
идентичен спектру периленового производ-
Можно предположить, что максимум при 313 нм
ного. По аналогии с циклизацией калиевой соли
относится, как было отмечено ранее, к радикаль-
2,2′-ди(2,5-диметилфенил)-1,1′,3,3′-тетраок-
ной частице - промежуточному продукту реакции.
со-2,2′,3,3′-тетрагидро-1H,1′H-6,6′-би(бензо[de]-
Максимумы при 499 и 536 нм соответствуют те-
изохинолин)-7,7′-дикарбоновой кислоты [4] мож-
траоксид-аниону 3. Уменьшение интенсивности
но предположить, что указанный продукт цикли-
полос через 180 мин обусловлено взаимодействи-
зации имеет в своем составе две карбоксильные
ем продукта реакции с остаточным кислородом
группы. Его образование в аэробных условиях
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
554
ПОЛЕНОВ и др.
при достаточно большой концентрации диоксида
зировали окислением тиомочевины (ХЧ) 37%-ным
тиомочевины происходит за счет взаимодействия
раствором пероксида водорода [11]. Доля основно-
исходного кубогена с анион-радикалами диоксида
го вещества, найденная иодометрическим методом
серы, образующимися в результате диссоциации
[12], составляла не менее 98%.
дитионит-анионов (2). При малых концентрациях
Реакция циклизации кубогена. Навеску кубо-
диоксида тиомочевины они образуются в неболь-
гена красного (0.003 г) растворяли в 0.25 М. рас-
шом количестве, так как равновесие (2) смещено
творе гидроксида натрия. В мерной колбе на 50 мл
влево, и побочный продут циклизации не образу-
растворяли диоксид тиомочевины и доводили до
ется.
метки дистиллированной водой. Полученные рас-
творы смешивали и наливали в кювету спектро-
S2O2- ↔ 2SO•-.
(2)
фотометра UV-Vis Cary 60 (Agilent Technologies,
Подводя итог обсуждению стехиометрическо-
США), если реакцию проводили в аэробных усло-
го механизма циклизации кубогена красного в
виях. При проведении реакции в анаэробных ус-
водно-щелочной среде при взаимодействии с ди-
ловиях через приготовленные растворы перед их
оксидом тиомочевины, можно констатировать, что
смешением продували аргон.
в отсутствие кислорода воздуха восстановление
2,9-Диаза-1,10-дигидрокси-3,8-диоксо-
протекает за счет анионов сульфоксиловой кис-
2,9-ди(4-хлорфенил)-1,2,3,8,9,10-гексагидроди-
лоты SO2- (1 → 2 → дианион 4). При небольшом
бензо[cd,lm]-5а,5b-дикарбоновая кислота (7). В
избытке диоксида тиомочевины в присутствии
токе аргона реакция 2 г кубогена и 3 г диоксида
кислорода воздуха в основном образуются ин-
тиомочевины в 250 мл 2%-ного раствора NaOH
термедиаты-восстановители - дитионит-анионы
при 90°С протекала 60 мин. Реакционную смесь
S2O2-, и реакция преимущественно протекает по
хроматографировали на колонке со штапелирован-
маршруту 1 → 2 → тетраанион 3. При окислении
ной вискозной пряжей. Элюент - водный раствор,
кислородом воздуха соединений 3 и 4 в твердой
содержащий 2% Na2CO3 и 1% диоксида тиомо-
фазе образуется периленовый краситель 6.
чевины. Желтую фракцию отделяли, добавляли
При большом избытке восстановителя в при-
NaHCO3 (0.1 г) и медленно приливали 10%-ный
сутствии кислорода воздуха протекает параллель-
раствор соляной кислоты до рН 1-2. Образовав-
ная реакция с появляющимися в достаточном коли-
шийся осадок отфильтровывали, промывали дис-
честве анион-радикалами SO•-: 1 → 2 → продукт
тиллированной водой, не содержащей кислорода,
циклизации 5 с двумя карбоксилатными группами.
и сушили в вакуумном эксикаторе над P2O5. По-
При подкислении раствора образовалась неустой-
лученный продукт представлял собой мелкокри-
чивая дикарбоновая кислота 7, которая на воздухе
сталлический порошок желтого цвета, краснею-
окислялась с отщеплением карбоксильных групп
щий на воздухе. Растворим в концентрированном
до периленового красителя 6.
водно-щелочном растворе и тетрагидрофуране, не-
растворим в спиртах, бензоле, хлороформе. Элек-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
, нм: 425.
тронный спектр поглощения (ТГФ), λmax
Масс-спектры регистрировали на время-
N,N′-Ди(4-хлорфенил)диимид-3,4,9,10-пери-
пролетном масс-спектрометре Shimadzu Axima
лентетракарбоновой кислоты (6). Твердые крас-
Confidence (MALDI-TOF). Инфракрасные спектры
ные осадки, образующиеся во всех опытах, после
снимали на ИК Фурье-спектрометре TENSOR II
окончания реакции и выдержки реакционной мас-
(Bruker AXS Gmbb). Элементный анализ проводи-
сы на воздухе отфильтровывали, сушили и анали-
ли на анализаторе углерода, водорода, азота, серы
зировали. ИК спектр, ν, см-1: 1642 с (С=O), 1722
и кислорода с электронными микровесами FLASH
ср (С=O), 1665 с (С-Nимид), 792 с, 1018 сл (СAr-Cl),
EA1112 Termo Quest.
1260 с, 1460 с (перилен). Электронный спектр
Исходный образец кубогена получен и очищен
поглощения (ТГФ), λmax, нм: 453, 484, 519. Масс-
сотрудниками Государственного научного центра
спектр, m/z (Iотн, %) 613 (99) [M - H]+. Найдено, %:
«НИОПИК» (Москва) по известной методике [10].
С 70.80; Н 2.53; N 4.42. C36H16Cl2N2O4. Вычисле-
Восстановитель - диоксид тиомочевины - синте-
но, %: С 70.71; Н 2.64; N 4.58.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
ВЗАИМОДЕЙСТВИЕ 2,2′-ДИ(4-ХЛОРФЕНИЛ)-...
555
БЛАГОДАРНОСТЬ
5. Поленов Ю.В., Буданов В.В. // ЖПХ. 1996. Т. 69.
Вып. 12. С. 2022; Polenov Yu.V., Budanov V.V. // Russ.
Работа выполнена в Научно-исследовательском
J. Appl. Chem. 1996. Vol. 69. N 12. P. 1837.
институте термодинамики и кинетики химических
6. Никитин К.С., Поленов Ю.В., Егорова Е.В. // ЖФХ.
процессов при Ивановском государственном хи-
2020. Т. 94. № 10. С. 1505; Nikitin K.S., Polenov Yu.V.,
Egorova E.V. // Russ. J. Phys. Chem. (A). 2020.
мико-технологическом университете с использо-
Vol.
94. N
10. P.
1338. doi
10.31857/
ванием оборудования Центра коллективного поль-
S0044453720100209
зования.
7. Поленов Ю.В., Пушкина В.А., Егорова Е.В., Лабу-
тин А.Н., Хализов Р.А. // Кинетика и катализ. 2002.
КОНФЛИКТ ИНТЕРЕСОВ
Т. 43. № 4. С. 505; Polenov Yu.V., Pushkina V.A.,
Egorova E.V., Labutin A.N., Khalizov R.L. //
Авторы заявляют об отсутствии конфликта
Kinet. Catal. 2002. Vol. 43. N 4. P. 465. doi
интересов.
10.1023/A:1019814732139
СПИСОК ЛИТЕРАТУРЫ
8. Поленов Ю.В., Кублашвили Г.Д., Буданов В.В., Бел-
кин А.И., Ворожцов Г.Н. // ЖПХ. 1990. Т.63. Вып.
1. Докунихин Н.С., Ворожцов Г.Н., Алексеев В.И., Фи-
7. С. 1622.
липпова М.С., Шулепова О.И., Масанова И.Н., Ряби-
9. Сильверстейн Р., Вебстер Ф., Кимл. Д. Спектроме-
нин В.А. // Хим. пром. 1981. № 10. С. 592.
трическая идентификация органических соедине-
2. Adamow A., Sznitko L., Chrzumnicka E., Stachera J.,
ний. М.: БИНОМ. Лаборатория знаний, 2011. С. 128.
10. Ворожцов Г.Н., Масанова Н.Н., Алексеев В.И., Со-
Szukalski A., Martynski T., Mysliwiec J. // Sci. Rep.
ломатин Г.Г. А. с. 919342 (1979) // Б. И. 1983. № 3.
2019. Vol. 9. N 2143. doi 10.1038/s41598-019-38484-z
11. Буданов В.В., Макаров С.В. Химия серосодержащих
3. Zhao D., Wu O., Cai Z, Zheng T., Chen W., Lu J., Yu L. //
восстановителей (ронгалит, дитионит, диоксид тио-
Chem. Mater. 2016. Vol. 28. N. 4. P. 1139. doi 10.1021/
мочевины). М.: Химия, 1994. С. 144.
acs.chemmater.5b04570
12. Шафран И.Г., Степанова А.Г., Панкратьева Л.И. //
4. Шулепова О.И., Рябинин В.А., Стариченко В.Ф.,
Тр. ИРЕА. Хим. реактивы и препараты. 1963.
Ворожцов Г.Н. // ЖОрХ. 1993. Т. 29. Вып. 5. С. 1001.
Вып. 25. С. 215.
Reaction of 2,2′-Di(4-chlorophenyl)-1,1′,3,3′-tetraoxo -
2,2′,3,3′-tetrahydro-1H,1′H-6,6′-di(benzo[de]isoquinoline)-
7,7′-dicarboxylic Acid with Thiourea Dioxide
in Water-Alkaline Solution
Yu. V. Polenov*, K. S. Nikitin, E. V. Egorova, and D. A. Patrusheva
Ivanovo State University of Chemistry and Technology, Ivanovo, 153000 Russia
*e-mail: polyurij@yandex.ru
Received February 3, 2021; revised February 3, 2021; accepted February 18, 2021
The stoichiometric mechanism of the reductive cyclization of 2,2′-di(4-chlorophenyl)-1,1′,3,3′-tetraoxo-2,2′,3,3′-
tetrahydro-1H,1′H-6,6′-di(benzo[de]isoquinoline)-7,7′-dicarboxylic acid potassium salt under the action of
thiourea dioxide in an aqueous-alkaline solution was studied. The reduction products of two or four oxo groups
in 3,4,9,10-perilentetracarboxylic acid N,N′-di(4-chlorophenyl)diimide were obtained, as well as the cyclization
product of an unknown composition. It is shown that the composition and quantity of intermediate and final
products of the cyclization depend on the concentration of the reducing agent and the presence of air oxygen in
the solution, which is due to the formation of various reducing intermediates from the reducing agent molecules.
A stepwise stoichiometric mechanism of reductive cyclization reaction was proposed.
Keywords: cubogen, perylenetetracarboxylic acid diimide, thiourea dioxide, reductive cyclization, stoichio-
metric mechanism
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021