ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 572-579
Памяти Л. А. Свиридовой
УДК 541.128.1;546.46;547.241
N′-СУЛЬФОНИЛ- И N′-АЦИЛГИДРАЗОНЫ
α- И β-ДИФЕНИЛФОСФОРИЛАЛКАНОНОВ:
СИНТЕЗ И СТРОЕНИЕ
© 2021 г. А. Б. Урюпинa, Г. В. Бодринa, И. Б. Горюноваa, Е. И. Горюновa, В. Н. Хрусталевb,c,
Н. А. Быстроваa, В. К. Брельa, К. А. Кочетковa,d,*
a Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
ул. Вавилова 28, Москва, 119991 Россия
b Российский университет дружбы народов, Москва, 117198 Россия
c Институт органической химии имени Н. Д. Зелинского Российской академии наук, Москва 119991 Россия
d Российский химико-технологический университет имени Д. И. Менделеева, Москва, 125047 Россия
*e-mail: const@ineos.ac.ru
Поступило в Редакцию 18 февраля 2021 г.
После доработки 18 февраля 2021 г.
Принято к печати 25 февраля 2021 г.
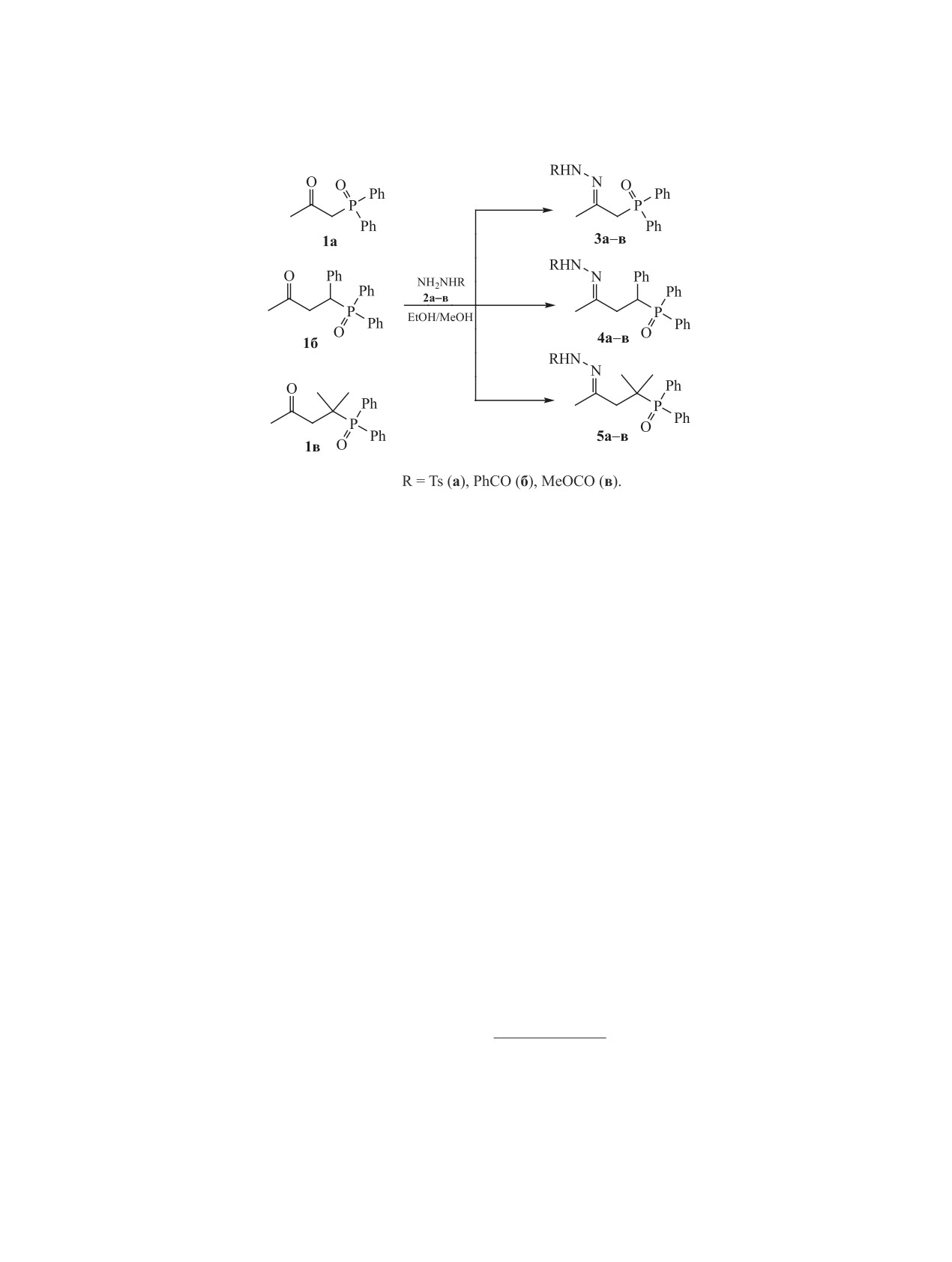
Взаимодействие насыщенных ациклических α- и β-(дифенилфосфорил)алканонов с сульфонил- и
ацилгидразинами приводит к соответствующим гидразонам с выходами до 90%. Строение полученных
соединений установлено по данным рентгеноструктурного анализа и спектроскопии ЯМР.
Ключевые слова: (диарилфосфорил)алканоны, сульфонил(ацил)гидразины, гидразоны, строение
DOI: 10.31857/S0044460X21040119
N-Ацил- [1-4] и N-сульфонилгидразоны (диал-
феназид - гидразида (дифенилфосфорил)уксусной
коксифосфорил)алканонов [5, 6] широко исполь-
кислоты [9-11].
зуются в препаративной органической и элемен-
Как N-ацилгидразоны кетонов [12], так и (ди-
тоорганической химии в качестве прекурсоров в
фенилфосфорил)алканоны
[13-16] обладают
синтезе разнообразных азотистых гетероциклов
высокой комплексообразующей способностью
(производных 4,5-дигидропиразола, пиразолиди-
по отношению к f- и d-элементам, в связи с чем
на, пиразола, 1,2,3-тиадиазола [1, 4-6]) и Р,Р-ди-
N-ацилгидразоны соответствующих фосфорилке-
алкоксипроизводных аминофосфорильных соеди-
тонов со структурными фрагментами C(O)NHN и
нений [2, 3] - двух классов веществ, обладающих
P(O) могут представлять собой оригинальные ги-
ярко выраженной биологической активностью [7,
бридные P,N-лиганды.
8]. С этой целью могут быть с успехом применены
До настоящего времени отсутствует эффек-
и N-ацилгидразоны (дифенилфосфорил)алкано-
тивный подход к дизайну N-ацил- и N-сульфо-
нов [1-3], с достаточно высокой вероятностью так-
нилгидразонов (дифенилфосфорил)кетонов. В
же проявляющие физиологическую активность.
известных методиках получения единичных пред-
Ранее перспективность поиска эффективных фар-
ставителей N-ацилпроизводных1 в качестве исход-
макологически активных соединений путем соче-
ных фосфорорганических соединений выступают
либо коммерчески малодоступные прекурсоры
тания в их молекулах дифенилфосфорильного и
гидразинового фрагментов была подтверждена на
1 Информация о N-сульфонилгидразонах дифенилфосфори-
примере создания лекарственного препарата фос-
лалканонов в литературе отсутствует.
572
N′-СУ
ЛЬФОНИЛ- И N′-АЦИЛГИДРАЗОНЫ
573
Схема 1.
(фосфорилаллены [1-3]), либо относительно ла-
необходимо использовать катализатор и увеличить
бильные алкиловые эфиры диарилфосфинистых
температуру. Выходы гидразонов 5а-в достигают
кислот [17], а синтез соответствующих гидразонов
65-90%.
часто многостадиен [1, 17], что в совокупности
Состав синтезированных гидразонов фосфо-
существенно ограничивает возможность исполь-
рилкетонов подтвержден данными элементного
зования этого класса элементоорганических сое-
анализа, их строение определено на основании
динений.
данных спектроскопии ЯМР 1Н и 31Р и масс-спек-
Наиболее рациональный вариант получения
трометрии. В спектрах ЯМР 31Р{1H} гидразонов
N′-ацил- и N′-сульфонилгидразонов (диарилфос-
наблюдается один синглетный сигнал в области
форил)алканонов - прямое взаимодействие ука-
31-39 м. д., что предполагает существование в рас-
занных кетонов и N-замещенных гидразинов.
творе лишь одного из двух возможных геометри-
Нами разработан простой и высокоэффективный
ческих изомеров (син- или анти-). В пользу это-
подход к синтезу широкого круга фосфорилзаме-
го предположения свидетельствует также только
щенных кетонов с использованием модифициро-
один набор сигналов индикаторных групп в спек-
ванной реакции Конанта [18, 19].
трах ЯМР 1Н соединений. Для гидразона 3б полу-
Взаимодействие
1-(дифенилфосфорил)про-
чен спектр ЯМР 13С{1H}, зарегистрированный на
пан-2-она 1а и 4-(дифенилфосфорил)-4-фенилбу-
приборе с высокой разрешающей способностью
тан-2-она 1б с сульфонил- и ацилзамещенными
(Bruker AV-600) и полностью соответствующий
гидразинами RNHNH2 2а-в [R = тозил (a), бензо-
предполагаемой структуре. С использованием дву-
ил (б), метоксикарбонил (в)] в среде этанола или
мерных корреляций COSY, HMQC и HMBC прове-
метанола при комнатной температуре приводит
дено корректное соотнесение сигналов в спектрах
к гидразонам (дифенилфосфорил)кетонов 3а-в и
ЯМР 13С{1H} и ЯМР 1Н2.
4а-в соответственно с относительно небольшими
Строение N′-тозилгидразона
1-(дифенилфос-
выходами (30-50%) (схема 1). Применение кислот-
форил)пропан-2-она
3a и N′-бензоилгидразо-
ных катализаторов (TsOH или АсОН), а также по-
вышение температуры до 50°С ускоряет реакцию
2 Присутствие в спектрах ЯМР 1Н, 13С и 31Р раствора гидра-
зона 3б сигналов только одного из двух возможных стере-
и существенно увеличивает (до 90%) выход. Для
оизомеров зафиксировано ранее [1]. Аналогичная картина
обеспечения достаточно высокой скорости реак-
наблюдалась в спектрах ЯМР растворов структурно близких
ций стерически затрудненного 4-(дифенилфосфо-
ацилгидразонов Ph2P(O)CH2СMe=NNHC(O)R (R = Me, OEt)
рил)-4-метилпентан-2-она 1в с гидразинами 2а-в
[1-3].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
574
УРЮПИН и др.
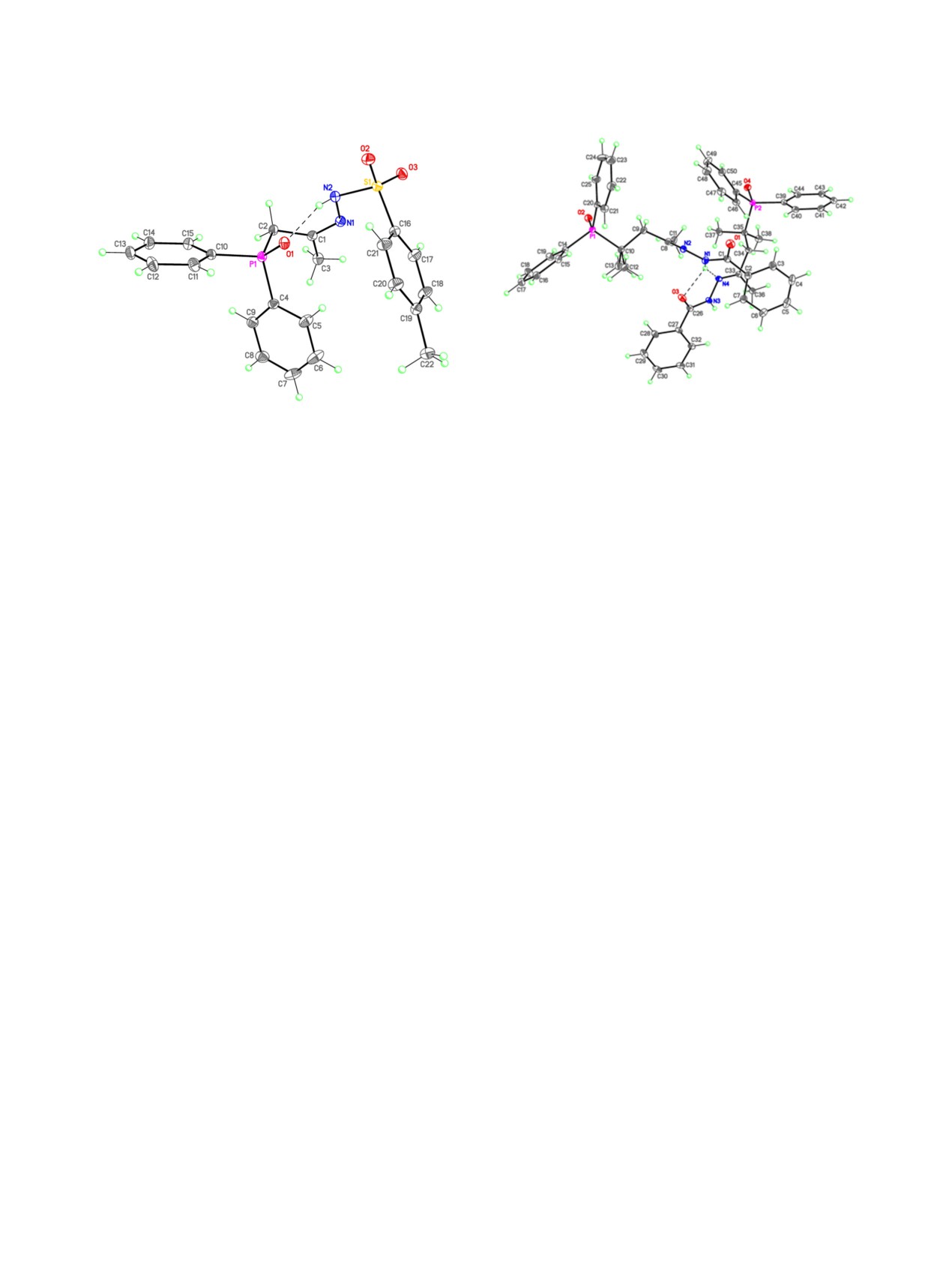
Рис. 2. Общий вид молекулы N′-бензоилгидразона
Рис. 1. Общий вид молекулы N′-тозилгидразона 1-(ди-
4-(дифенилфосфорил)-4-метилпентан-2-она 5б, (пред-
фенилфосфорил)пропан-2-она 3a. Штриховой лини-
ставлены две кристаллографически независимые моле-
ей показана внутримолекулярная водородная связь
кулы). Штриховыми линиями показаны межмолекуляр-
Р=О···N-H.
ные водородные связи N-H···O=P и N-H···N.
на
4-(дифенилфосфорил)-4-метилпентан-2-она
остаточных протонов в дейтерированном раство-
5б было дополнительно подтверждено методом
рителе, внутренний эталон для спектров ЯМР 13С -
РСА. Гидразон 3а в кристаллическом состоянии
сигналы ядер атомов углерода дейтерированного
существует в виде син-изомера, стабилизирован-
растворителя, внешний эталон для спектров ЯМР
ного внутримолекулярной водородной связью
31Р - 85%-ная H3PO4.
P=O···H-N (рис. 1). В кристалле соединения 5б
Масс-спектры распада (электронная иониза-
внутримолекулярная водородная связь отсутству-
ция, 70 эВ, прямой ввод) регистрировали на прибо-
ет и реализуется термодинамически более выгод-
ре Finnigan SSQ-7000; масс-спектры высокого раз-
ная анти-конфигурация (рис. 2).
решения (HRMS) - на приборе Bruker micrOTOF
Можно полагать, что в кристаллическом со-
II Transform (ионизация электроспреем). Элемент-
стоянии аналогичные конфигурации фрагмента
ный анализ выполнен в лаборатории микроанализа
С=N реализуются и у аналогов гидразонов 3а, 5б
Института элементоорганических соединений им.
с такой же длиной углеродной цепи, разделяющей
А.Н. Несмеянова Российской академии наук на ав-
группы Р=О и С=N.
томатическом CHN-микроанализаторе Carlo Erba
Таким образом, взаимодействие монозамещен-
EA1108 CHNS-O. Температуру плавления измеря-
ных сульфонил- и ацилгидразинов с α- и β-(ди-
ли с помощью индикатора точки плавления марки
фенилфосфорил)алканонами в спиртовой среде в
Electrothermal IA 9000 в запаянном капилляре. Ход
присутствии кислых катализаторов при комнат-
реакций и чистоту образующихся соединений кон-
ной температуре или при небольшом нагревании
тролировали с помощью ТСХ на силуфоле UV-254
представляет собой простой и достаточно эффек-
(Merck) (элюент - петролейный эфир-ацетон, 3:2).
тивный путь к практически важным N′-ацилги-
Исходные (дифенилфосфорил)алканоны 1а-в
дразонам фосфорилзамещенных карбонильных
получали по известным методикам [19, 20].
соединений.
N′-Тозилгидразон
1-(дифенилфосфорил)-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
пропан-2-она
(3a). а. К раствору
0.13 г
Спектры ЯМР регистрировали на приборах
(0.5 ммоль) 1-(дифенилфосфорил)пропан-2-она 1а
Bruker Avance 300 [300.11 MГц (1H)], Bruker Avance
в 4 мл этанола при перемешивании добавляли 0.1 г
400 [400.13 (1H) и 161.98 MГц (31P)] и Bruker
(0.5 ммоль) тозилгидразина
2а. Реакционную
Avance 600 [600.22 (1H) и 150.925 MГц (13С)]. Вну-
смесь перемешивали 6 ч при комнатной темпера-
тренний эталон для спектров ЯМР 1H - сигналы
туре. Образовавшийся осадок отфильтровывали,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
N′-СУ
ЛЬФОНИЛ- И N′-АЦИЛГИДРАЗОНЫ
575
промывали этанолом (2×1.5 мл) и сушили 2 ч при
б. При проведении реакции при комнатной тем-
100°С в вакууме (~1 Торр) над P2O5. Выход 0.10 г
пературе с добавлением TsOH выход составил 0.08
(47%), т. пл. 170-171°С. Спектр ЯМР 1Н (CDCl3),
г (42%), при добавлениии AcOH - 0.075 г (40%).
δ, м. д. (J, Гц): 1.51 с (3H, СН3С=N), 2.52 с (3H,
При 50°С в присутствии TsOH выход равен 0.12 г
СН3С6Н4), 3.46 д (2H, СН2, 2JНР 14.5), 7.38-7.64
(64%), а в присутствии AcOH - 0.16 г (84%).
м (12HAr), 8.00-8.02 м (2HAr), 10.95 с (1Н, NH).
N′-Метоксикарбонилгидразон
1-(дифенил-
Спектр ЯМР 31Р (CDCl3): δР 33.8 м. д. Масс-
фосфорил)пропан-2-она (3в). а. Получали анало-
спектр, m/z (Iотн, %): 271 (14) [M - Ts]+, 243 (26)
гично из 0.13 г (0.5 ммоль) 1-(дифенилфосфорил)
[M - TsNHN]+, 215 (4) [Ph2P(O)CH2]+, 201 (100)
пропан-2-она 1а и 0.05 г (0.5 ммоль) метоксикар-
[Ph2P(O)]+, 183 (7) [TsNHN]+, 155 (7) [Ts]+, 77 (21)
бонилгидразина 2в в среде метанола. Выход 0.05 г
[Ph]+, 30 (100) [NHNH]+. Найдено, %: C 61.70; H
(30%), т. пл. 180-181°С. Спектр ЯМР1H (CDCl3), δ,
5.51; N 6.17; Р 7.27. C22H23N2О3РS. Вычислено, %:
м. д. (J, Гц): 1.60 с (3H, CH3С=N), 3.38 д (2H, CH2,
C 61.96; H 5.44; N 6.57; Р 7.26.
2JНР 15.0), 3.69 с (3H, СН3O), 7.43-7.52 м (6HAr),
б. При проведении реакции при комнатной
7.69-7.75 м (4HAr), 10.77 c (1H, NH). Спектр ЯМР
температуре с добавлением 10 мг (0.05 ммоль)
31Р (CDCl3): δР 32.0 м. д. Масс-спектр, m/z (Iотн, %):
TsOH·Н2О (10 мол%) выход соединения 3а повы-
330 (25) [M]+, 299 (15) [M - CH3O]+, 256 (7) [М -
шался до 68%; при добавлении 9 мг (0.15 ммоль,
CH3OCONH]+, 241 (9) [M - CH3OCONH-CH3]+,
30 мол%) ледяной AcOH выход составил 0.18 г
215 (4) [Ph2P(O)CH2]+, 201 (45) [Ph2P(O)]+, 77 (11)
(84%). При проведении реакции при 50°С с добав-
[Ph]+, 29 (100) [NHN]+. Найдено, %: C 61.35; H
лением TsOH выход составил 0.18 г (84%), а в при-
5.59; N 8.43; Р 9.59. C17H19N2О3Р. Вычислено, %: C
сутствии AcOH - 0.19 г (87%).
61.81; H 5.80; N 8.48; Р 9.38.
N′-Бензоилгидразон
1-(дифенилфосфорил)-
б. При проведении реакции при комнатной тем-
пропан-2-она (3б). а. Получали аналогично из
пературе с добавлением TsOH выход равен 55%, а
0.13 г
(0.5 ммоль)
1-(дифенилфосфорил)про-
при использовании в качестве кислотного катали-
пан-2-она 1а и 0.068 г (0.5 ммоль) бензоилгидра-
затора AcOH выход, по данным ЯМР, возрастает
зина 2б. После сушки над P2O5 выход 0.07 г (37%),
до 90%.
т. пл. 242-244°С (238-239°С [1]). Спектр ЯМР 1Н
N′-Тозилгидразон
4-(дифенилфосфо-
(СDCl3, c 0.1 моль/л), δ, м. д. (J, Гц): 1.75 с (3Н,
рил)-4-фенилбутан-2-она (4а). а. Получали ана-
СН3), 3.51 д (2Н, СН2, 2JHP 14.6), 7.48 т [2Нм,
логично из 0.17 г (0.5 ммоль) 4-(дифенилфосфо-
PhC(O), 3JHH 7.0], 7.52 т [1Hп, PhC(O), 3JHH 6.9],
рил)-4-фенилбутан-2-она 1б и 0.1 г (0.5 ммоль)
7.54-7.60 м [4Hм, PhP(O)], 7.64 т [2Hп, PhP(O), 3JHH
тозилгидразина 2a. Продукт реакции выделяли
7.0], 7.80 д. д [4Hо, PhP(O), 3JHH 7.8, 3JHP 11.4], 8.17
методом препаративной ТСХ на стеклянных пла-
д [2Hо, PhC(O), 3JHH 6.8], 12.25 c (1H, NH). Спектр
стинах (180×240 мм) с нанесенным силикагелем
ЯМР 13С (СDCl3, c 0.1 моль/л), δС, м. д. (J, Гц): 26.4
(CH3), 36.9 д (СH2, 1JCP 62.4), 127.9 [Сo, C6H5C(O)],
(60 PF254 с 30% гипса) фирмы «Merck», элюент -
128.6 [См, С6Н5С(О)], 129.2 д [См, PhP(O), 3JCP
низкокипящий петролейный эфир-ацетон,
4:2.
Выход 0.10 г (36%), т. пл. 218-220°С. Спектр ЯМР
12.5], 130.2 д [Си, PhP(O), 1JCP 101.3], 131.0 д [Co,
PhP(O), 2JCP 9.7], 131.7 [Cп, C6H5C(O)], 133.0 [Cп,
1H (ДМСО-d6), δ, м. д.: 1.60 с (3H, CH3C=N), 2.47 c
PhP(O)], 133.2 [Си, C6H5C(O)], 151.2 д (C=N, 2JCP
(3H, CH3C6H4), 2.75-2.82 м (2H, CH2), 4.23-4.29 м
9.7), 165.3 c (C=O). Спектр ЯМР 31Р (CDCl3): δР
(1H, CH), 7.04-7.08 м (5HAr), 7.40-7.59 м (10HAr),
32.0 м. д. Масс-спектр, m/z (Iотн, %): 376 (12) [M]+,
7.74-7.88 м (4HAr), 10.04 с (1H, NH). Спектр ЯМР
361 (3) [M - CH3]+, 271 (6) [M - PhCO]+, 256 (3)
31Р (ДМСО-d6): δР 31.9 м. д. Масс-спектр, m/z (Iотн,
[М - PhC(O)NH]+, 241 (4) [M - PhC(O)NHCH3]+,
%): 361 (4) [M - Ts]+, 334 (65) [M - TsNHN]+, 315
216 (100) [Ph2P(O)CH3]+, 201 (37) [Ph2P(O)]+, 161
(1) [M - P(O)Ph2]+, 292 (4) [PhCHP(O)Ph2]+, 201
(3)
[M - Ph2P(O)]+, 105 (38) [PhC(O)]+, 77 (36)
(100) [Ph2P(O)]+, 91 (14) [PhCH2]+, 77 (8) [Ph]+, 29
[Ph]+. Найдено, %: C 70.31; H 5.62; N 7.29; Р 8.77.
(100) [NHN]+. Найдено, %: C 67.41; H 5.70; N 5.39;
C22H21N2О2Р. Вычислено, %: C 70.20; H 5.62; N
Р 6.08. C29H29N2О3РS. Вычислено, %: C 67.43; H
7.44; Р 8.23.
5.66; N 5.42; Р 6.00.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
576
УРЮПИН и др.
б. При проведении реакции в присутствии ката-
ли аналогично при 50°С с добавлением TsOH,
литических количеств TsOH выход составил 0.11 г
исходя из 0.14 г (0.5 ммоль) 4-(дифенилфосфо-
(39%), при добавлении AcOH - 0.08 г (30%). При
рил)-4-метилпентан-2-она 1в и 0.1 г (0.5 ммоль)
проведении реакции при повышенной температуре
тозилгидразина 2a. Выход 0.15 г (65%), т. пл.
(50°С) в присутствии TsOH выход составил 0.16 г
210-211°С. Спектр ЯМР 1H (CDCl3), δ, м. д. (J,
(60%), в присутствии AcOH - 0.15 г (55%).
Гц): 1.12 д (3H, СН3СР, 3JНР 15.6), 1.32 д (3H,
N′-Бензоилгидразон
4-(дифенилфосфо-
СН3СР, 3JНР 15.3), 1.78 с (3H, СН3C=N), 2.45 с (3H,
рил)-4-фенилбутан-2-она
(4б) получали ана-
СН3С6Н4), 2.78 д (2Н, СН2, 3JHP 9.0), 7.48-7.56 м
логично из 0.17 г (0.5 ммоль) 4-(дифенилфосфо-
(8HAr), 7.74-7.80 м (2HAr), 7.94-8.03 м (4НAr), 11.41
рил)-4-фенилбутан-2-она 1б и 0.068 г (0.5 ммоль)
с (1Н, NH). Спектр ЯМР 31Р (CDCl3): δР 38.8 м. д.
бензоилгидразина 2б. Продукт реакции выделяли
Масс-спектр, m/z (Iотн, %): 313 (5) [M -Ts]+, 267 (5)
с помощью препаративной ТСХ аналогично сое-
[М - Ph2P(O)]+, 244 (1) [(CH3)2CP(O)Ph2]+, 224
динению 4a. Выход 0.12 г (50%), т. пл. 224-226°С.
(3)
[M -(CH3)2CP(O)Ph2]+, 201 (100) [Ph2P(O)]+,
Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 1.77 с (3H,
183 (11) [TsNHN]+, 155 (5) [Ts]+. Масс-спектр: m/z
CH3), 3.18-3.58 м (2H, CH2), 4.52-4.55 м (1H, CH),
491.1529 [M + Na]+. Найдено, %: C 64.40; H 5.79;
7.15-7.18 м (3HAr), 7.36-7.76 м (15HAr), 8.07-8.12
N 5.57; Р 6.70. C25H29N2О3РS. Вычислено, %: C
м (2HAr), 10.35 c (1H, NH). Спектр ЯМР 31Р (ДМ-
64.08; H 6.24; N 5.98; Р 6.61. Мвыч 491.1534.
СО-d6): δР 31.6 м. д. Масс-спектр, m/z (Iотн, %): 466
N′-Бензоилгидразон
4-(дифенилфосфо-
(15) [M]+, 362 (14) [M - С(О)Ph]+, 346 (80) [М -
рил)-4-метилпентан-2-она
(5б) получали ана-
NHC(O)Ph]+, 306 (8) [Ph2PC(O)CH(Ph)CH3]+, 291
логично из 0.14 г (0.5 ммоль) 4-(дифенилфос-
(5)
[Ph2P(O)CH(Ph)]+, 265 (85) [M - Ph2P(O)]+,
форил)-4-метилпентан-2-она 1в и 0.068 г
(0.5
202 (76) [Ph2PH(O)]+, 201 (64) [Ph2P(O)]+, 161 (37)
ммоль) бензоилгидразина 2б. Выход 0.19 г (82%),
[PhC(O)NHN=CCH3]+, 105 (100) [PhC(O)]+, 77 (56)
т. пл. 113-114°С. Спектр ЯМР 1H (CDCl3), δ, м.
[Ph]+. Найдено, %: C 74.94; H 5.78; N 5.92; Р 6.61.
д. (J, Гц): 1.26-1.36 м (6H, СН3CP), 1.97 с (3H,
C29H27N2О2Р. Вычислено, %: C 74.66; H 5.83; N
СН3C=N), 2.76 д (2H, СН2, 3JHP 9.0), 7.29-7.45 м
6.00; Р 6.64.
(8HAr), 7.79-8.19 м (7HAr), 9.54 с (1Н, NH). Спектр
N′-Метоксикарбонилгидразон
4-(дифенил-
ЯМР 31Р (CDCl3): δР 39.8 м. д. Масс-спектр, m/z
фосфорил)-4-фенилбутан-2-она (4в). а. Получали
(Iотн, %): 418 (9) [M]+, 403 (5) [M - CH3]+, 298 (6)
аналогично из 0.17 г (0.5 ммоль) 4-(дифенилфос-
[M -PhCONH]+, 243 (8) [Ph2P(O)C(СН3)2]+, 217
форил)-4-фенилбутан-2-она 1б и 0.05 г (0.5 ммоль)
(89) [M - Ph2P(O)]+, 202 (100) [Ph2P(O)H]+, 161
метоксикарбонилгидразина 2в в среде метанола.
(62) [PhC(O)NHN+≡CCH3]+, 125 (17) [PhP(O)H]+,
Выход 0.13 г (50%), т. пл. 220-221°С. Спектр ЯМР
105 (58) [PhCO]+. Масс-спектр: m/z 441.1702 [M +
1H (CDCl3), δ, м. д.: 1.70 с (3H, CH3C=N), 2.79-2.81
м (1H, CH2), 3.11-3.14 м (1H, CH2), 3.75-3.78 м
Na]+. Найдено, %: C 71.84; H 6.71; N 6.43; Р 7.22.
(1H, CH), 3.86 c (3H, CH3O), 7.10-7.40 м (8HAr),
C25H27N2О2Р. Вычислено, %: C 71.75; H 6.50; N
7.47-7.53 м (2HAr), 7.61-7.64 м (3HAr), 7.96-7.98 м
6.69; Р 7.40. Mвыч 441.1708.
(2HAr), 9.30 с (1Н, NH). Спектр ЯМР 31Р (CDCl3):
N′-Метоксикарбонилгидразон
4-(дифенил-
δP 33.6 м. д. Масс-спектр, m/z (Iотн, %): 420 (33)
фосфорил)-4-метилпентен-2-она (5в) получали
[M]+, 346 (100) [M - CH3OC(O)NH]+, 219 (100) [M -
аналогично исходя из 0.14 г (0.5 ммоль) 4-(дифе-
P(O)Ph2]+, 201 (45) [Ph2P(O)]+, 145 (47) [N=C(CH3)
нилфосфорил)-4-метилпентан-2-она 1в и 0.05 г
CH2CHPh]+, 77 (20) [Ph]+, 29 (67) [NHN]+. Найде-
(0.5 ммоль) метоксикарбонилгидразина 2в в среде
но, %: C 68.49; H 5.92; N 6.59; Р 7.31. C24H25N2О3Р.
метанола. Выход 0.21 г (90%), т. пл. 195-196°С.
Вычислено, %: C 68.56; H 5.99; N 6.66; Р 7.37.
Спектр ЯМР 1H (CDCl3), δ, м. д. (J, Гц):1.22 д
б. При нагревании при 50°С в присутствии ка-
(3H, СН3СР, 3JНР 15.5), 1.81 д (3H, СН3СР, 3JНР
тализатора TsOH выход составил 0.11 г (42%), а в
15.0), 2.01 с (3H, СН3С=N), 2.58 д (2H, СН2, 3JHP
присутствии AcOH - 0.18 г (70%).
9.0), 3.69 с (3Н, СН3O), 7.45-7.96 м (10HAr), 8.43
N′-Тозилгидразон
4-(дифенилфосфорил)-
с (1Н, NH). Спектр ЯМР 31Р (CDCl3): δР 39.08 м.
4-метилпентан-2-она
(5а). Реакцию проводи-
д. Масс-спектр, m/z (Iотн, %): 372 (27) [M]+, 340 (5)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
N′-СУ
ЛЬФОНИЛ- И N′-АЦИЛГИДРАЗОНЫ
577
[М -СН3O]+, 298 (14) [M - CH3OC(O)NH]+, 243 (7)
спешными, поэтому его вклад в общую картину
[Ph2P(O)C(CH3)2]+, 201 (24) [Ph2P(O)]+, 171 (100)
рассеяния удален с помощью программ SQUEEZE
[M - Ph2P(O)]+, 77 (9) [Ph]+. Масс-спектр: m/z
в PLATON16 [22]. Абсолютные структуры обоих
395.1484 [M + Na]+. Найдено, %: C 64.62; H 6.80; N
соединений объективно определены путем уточ-
7.44; Р 8.21. C20H25N2О3Р. Вычислено, %: C 64.50;
нения параметра Флэка [0.014(15) и 0.13(4) для со-
H 6.77; N 7.52; Р 8.32. Mвыч 395.1500.
единений 3а и 5б соответственно]. Атом водорода
группы NH в молекуле соединения 3а локализован
Рентгеноструктурный анализ. Бесцвет-
методом Фурье-синтеза и уточнен с фиксирован-
ный призматический кристалл соединения
3а
ными параметрами изотропного смещения [Uiso(H)
(C22H23N2O3PS, M
426.46) моноклинный, про-
1.2Ueq(N)]. Другие атомы водорода в обоих соеди-
странственная группа P21; параметры элементар-
нениях были размещены в расчетных положениях
ной ячейки при 100 K: a 10.4406(4), b 9.5171 (4),
и уточнены в жесткой модели с фиксированны-
с 11.0258 (5) Å; β 103.031 (1)°, V 1067.36 (8) Å3, Z
ми параметрами изотропного смещения [Uiso(H)
2, dвыч 1.327 г/см3, F (000) 448, μ 0.252 мм-1. Па-
1.5Ueq(C) для метильных групп и 1.2Ueq(N,C) для
раметры элементарной ячейки измерены с исполь-
других групп]. Расчеты проводили с использова-
зованием дифрактометра Bruker APEX-II CCD
нием программы SHELXTL [23].
(MoKα-излучение, графитовый монохроматор,
ω- и φ-режимы сканирования) определены и уточ-
Кристаллографические данные для соедине-
нены по 12539 интенсивностям отражений (6165
ний 3a и 5б∙1/2CH2Cl2 депонированы в Кембридж-
независимых отражений, Rint 0.016). Поглощение
ском банке структурных данных (CCDC 1912606,
учитывали с помощью программы SADABS (Tmin
1912607).
0.940, Tmax 0.951) [21]. Конечные коэффициенты
ФОНДОВАЯ ПОДДЕРЖКА
дивергенции R1 0.030 для 6022 независимых отра-
жений с I > 2σ (I) и wR2 0.080 для всех независи-
Работа выполнена при финансовой поддержке
Министерства науки и высшего образования Рос-
мых отражений, S 1.057.
сийской Федерации (проект № 075-03-2020-223
Бесцветный призматический кристалл соеди-
(FSSF-2020-0017)). Исследования методом ЯМР
нения 5б∙1/2CH2Cl2 (C25H27N2O2P∙1/2CH2Cl2, M
проведены при поддержке Министерства науки и
460.95) орторомбический, пространственная груп-
высшего образования Российской Федерации с ис-
па P212121; параметры элементарной ячейки при
пользованием научного оборудования Центра ис-
100 K: a 14.5107 (6), b 14.6548 (6), с 23.7866 (9) Å;
следования строения молекул Института элемен-
V 5058.3 (4) Å3, Z 8, dвыч. 1.207 г/см3, F (000) 1932,
тоорганических соединений им. А.Н. Несмеянова
μ 0,238 мм-1. Параметры элементарной ячейки из-
РАН.
мерены с использованием дифрактометра Bruker
APEX-II CCD (MoKα-излучение, графитовый мо-
КОНФЛИКТ ИНТЕРЕСОВ
нохроматор, ω- и φ-режимы сканирования) опре-
Авторы заявляют об отсутствии конфликта
делены и уточнены по 68512 интенсивностям
интересов.
отражений (15380 независимых отражений, Rint
0.070). Поглощение учитывали с помощью про-
СПИСОК ЛИТЕРАТУРЫ
граммы SADABS (Tmin 0.954; Tmax 0.963) [21]. Ко-
1. de los Santos J.M., Lopez Y., Aparicio D., Palasios F. //
нечные коэффициенты дивергенции R1 0.047 для
J. Org. Chem. 2008. Vol. 73. N 2. P. 550. doi 10.1021/
11551 независимых отражений с I > 2σ(I) and wR2
jo702050t
0.114 для всех независимых отражений, S 1.004.
2. Palasios F., Aparicio D., Lopez Y., de los Santos J.M. //
Tetrahedron. 2005. Vol. 61. N 11. P. 2815. doi 10.1016/j.
Структуры определены прямыми методами и
tet.2005.01.081
уточнены методом наименьших квадратов на ма-
3. Palasios F., Aparicio D., Lopez Y., de los Santos J.M. //
трице F2 с параметрами анизотропного смещения
Tetrahedron Lett. 2004. Vol. 45. N 22. P. 4345. doi
для не водородных атомов. Кристалл соединения
10.1016/j.tetlet.2004.03.192
5б включает молекулу дихлорметана в асимме-
4. Chen H., Wang W.-H., Xue M., Cao R.-Z., Liu L.-Z. //
тричной ячейке. Все попытки моделировать и
Heteroatom Chem. 2000. Vol. 11. N 6. P. 413. doi
уточнить положение дихлорметана были безу-
10.1002/1098-1071(2000)11:6<413::aid-hc9>3.0.co;2-t
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
578
УРЮПИН и др.
5.
Almirante N., Benicchio A., Cerri A., Fedrizzi G.,
15.
Сафиулина А.М., Матвеева А.Г., Евтушенко А.В.,
Marazzi G., Santagostino M. // Synlett. 1999. N 3.
Лизунов А.В., Горюнов Е.И., Горюнова И.Б., Бо-
P. 299. doi 10.1055/s-1999-2608
дрин Г.В., Семенов А.А., Брель В.К. // ЖОХ. 2015.
6.
Almirante N., Cerri A., Fedrizzi G., Marazzi G.,
Т. 85. Вып. 9. С. 1551; Safiulina A.M., Matveeva A.G.,
Santagostino M. // Tetrahedron Lett. 1998. Vol. 39.
Evtushenko A.V., Lizunov A.V., Goryunov E.I.,
N 20. P. 3287. doi 10.1016/s0040-4039(98)00472-9
Goryunova I.B., Bodrin G.V., Semenov A.A., Brel V.K. //
7.
Sondhi S.M., Dinodia M., Singh J., Rani R. //
Russ. J. Gen. Chem. 2015. Vol. 85. N. 9. Р. 2128. doi
Curr. Bioact. Compd. 2007. Vol. 3. N 2. P 91. doi
10.1134/S1070363215090170
10.2174/157340707780809554
16.
Ильин Е.Г., Паршаков А.С., Данилов В.В., Яржем-
8.
Palacios F., Alonso C., de los Santos J.M. // Chem. Rev.
ский В.Г., Горюнов Е.И., Горюнова И.Б., Нифан-
2005. Vol. 105. N 3. P. 899. doi 10.1021/cr040672y
тьев Э.Е. // Докл. АН. 2016. Т. 471. № 2. С. 163;
9.
Гаврилова Е.Л., Сайфутдинова М.Н., Тарасова Р.И.,
Il’in E.G., Parshakov A.S., Danilov V.V., Yarzhemskii
Шаталова Н.И., Семина И.И., Губайдуллин А.Т. //
V.G., Goryunov E.I., Goryunova I.B., Nifant’ev E.E. //
Изв. АН. Сер. хим. 2016. № 5. С. 1372; Gavrilova E.L.,
Doklady Chem. 2016. Vol. 471. Pt 1. P. 314. doi
Sajfutdinova M.N., Tarasova R.I., Shatalova N.I.,
10.1134/S0012500816110045
Semina I.I., Gubajdullin A.T. // Rus. Chem. Bull. 2016.
17.
Corbel B., Medinger L., Haelters J.P., Sturtz G. //
Vol. 65. N 5. P. 1372. doi 10.1007/s11172-016-1464-2
Synthesis. 1985. N 11. P. 1048. doi 10.1055/s-1985-
10.
Тарасова Р.И., Семина И.И., Воскресенская О.В.,
31424
Ларина М.Л., Мухутдинов Э.А., Губайдуллин А.Т.,
18.
Бодрин Г.В., Горюнов Е.И., Горюнова И.Б., Нелюби-
Литвинов И.А. // Хим.-фарм. ж. 2007. Т. 41. № 2.
на Ю.В., Петровский П.В., Григорьев М.С., Сафиу-
С. 11; Tarasova R.I., Semina I.I., Voskresenskaya O.V.,
лина A.M., Тананаев И.Г., Нифантьев Э. Е. // Докл.
Larina M.L., Mukhutdinov E.A., Gubaidullin A.T.,
АН. 2012. Т. 447. № 4. С. 401; Bodrin G.V., Goryu-
Litvinov I.A. // Pharm. Chem. J. 2007. Vol 41. N 2.
nov E.I., Goryunova I.B., Nelyubina Yu.V., Petrov-
P. 59. doi 10.1007/s11094-007-0015-4
skii P.V., Grigor’ev M.S., Safiulina A.M., Tananaev I.G,
11.
Тарасова Р.И., Москва В.В. // ЖОХ. 1997. Т. 67.
Nifant’ev E.E. // Doklady Chem. 2012. Vol. 447. Pt 2.
Вып. 9. С. 1483; Tarasova R.I., Moskva V.V. // Russ. J.
P. 269. doi 10.1134/S0012500812120014
Gen. Chem. Vol. 67. N 9. P. 1393
19.
Горюнов Е.И., Бодрин Г.В., Горюнова И.Б., Нелюби-
12.
Bikas R., Farzaneh-Bonab H., Noshiranzadeh N.,
на Ю.В., Петровский П.В., Стрелкова Т.В., Пере-
Aygun M., Emami M., Lis T. // J. Coord. Chem. 2018. Vol.
гудов А.С., Матвеева А.Г., Пасечник М.П., Матве-
71. N 8. P. 1127. doi 10.1080/00958972.2018.1446083
ев С.В., Нифантьев Э.Е. // Изв. АН. Сер. хим. 2013.
13.
Матвеева А.Г., Горюнов Е.И., Ту А.М., Сафиули-
№ 3. С. 779; Goryunov E.I., Bodrin G.V., Goryuno-
на А.М., Горюнова И.Б., Бодрин Г.В., Лесив А.В.,
va I.B., Nelyubina Yu.V, Petrovskii P.V., Strelko-
Синегрибова О.А., Брель В.К. // Изв. АН. Сер. хим.
va T.V., Peregudov A.S., Matveeva A.G., Pasechnik M.P.,
2014. № 11. С. 2493; Matveeva A.G., Goryunov E.I.,
Matveev S.V., Nifant’ev E.E. // Russ. Chem. Bull. 2013.
Tu A.M., Safiulina A.M., Goryunova I.B., Bodrin G.V.,
Vol. 62. N 3. P. 780. doi 10.1007/s11172-013-0106-1
Lesiv A.V., Sinegribova O.A., Brel V.K. // Russ. Chem.
20.
Mazzotta S., Gramigna L., Bernardi L., Ricci A. // Org.
Bull. 2014. Vol. 63. N 11. P. 2493. doi 10.1007/s11172-
014-0767-4
Proc. Res. Developm. 2010. Vol. 14. N 3. P. 687. doi
14.
Сафиулина А.М., Матвеева А.Г., Лизунов А.В., Бодрин
10.1021/op1000308
Г.В., Горюнов Е.И., Григорьев М.С., Семенов А.А.,
21.
Sheldrick G.M. SADABS. Vol. 2.03. Bruker/Siemens
Брель В.К., Нифантьев Э.Е. // Докл. АН. 2015. Т. 460.
Area Detector Absorption Correction Program, Bruker
№ 6. С. 673; Safiulina A.M., Matveeva A.G., Lizunov
AXS, Madison, Wisconsin (USA), 2003
A.V., Bodrin G.V., Goryunov E.I., Grigor’ev M.S.,
22.
Spek A.L. PLATON. A Multipurpose Crystallographic
Semenov A.A., Brel V.K., Nifant’ev E.E. // Doklady
Tool, Utrecht University, The Netherlands, 2016.
Chem. 2015. Vol. 460. Pt 2. P. 57. doi 10.7868/
23.
Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
S0869565215060146
Pt 1. P. 3. doi 10.1107/S2053229614024218
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
N′-СУ
ЛЬФОНИЛ- И N′-АЦИЛГИДРАЗОНЫ
579
N′-Sulfonyl- and N′-Acylhydrazones
of α- and β-Diphenylphosphorylalkanones:
Synthesis and Structure
A. B. Uryupina, G. V. Bodrina, I. B. Goryunovaa, E. I. Goryunova, V. N. Khrustalevb,c,
N. A. Bystrovaa, V. K. Brela, and K. A. Kochetkova,d,*
a Nesmeyanov Institute of Organoelement Compounds, Russian Academy of Sciences, Moscow, 119991 Russia
b Peoples’ Friendship University of Russia, Moscow, 117198 Russia
c N.D. Zelinsky Institute of Organic Chemistry, Russian Academy of Sciences, Moscow, 119991 Russia
d Mendeleev Russian University of Chemical Technology, Moscow, 125047 Russia
*e-mail: const@ineos.ac.ru
Received February 18, 2021; revised February 18, 2021; accepted February 25, 2021
The reaction of saturated acyclic α- and β-(diphenylphosphoryl)alkanones with sulfonyl- and acylhydrazines
leads to the corresponding hydrazones in yields up to 90%. Structure of the obtained compounds was established
from the data of single crystal X-ray diffraction analysis and NMR spectroscopy.
Keywords: (diarylphosphoryl)alkanones, sulfonyl(acyl)hydrazines, hydrazones, structure
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021