ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 613-621
УДК 546.661:546.663:547.814.1:547.816.2
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
КОМПЛЕКСОВ Eu3+ И Tb3+
С КУМАРИН-3-КАРБОНОВЫМИ КИСЛОТАМИ
© 2021 г. Н. А. Громака, Ф. А. Колоколовb, В. В. Доценкоa,c*,
Н. А. Аксеновc, И. В. Аксеноваc
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
b Российский химико-технологический университет имени Д. И. Менделеева, Москва, 125047 Россия
cСеверо-Кавказский федеральный университет, Ставрополь, 355009 Россия
*e-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 29 декабря 2020 г.
После доработки 29 декабря 2020 г.
Принято к печати 30 января 2021 г.
На основе кумарин-3-карбоновой кислоты и ее производных синтезированы новые комплексные со-
единения Eu3+ и Tb3+ [Ln(H2O)2L2]Cl∙H2O. Состав и структура лигандов и полученных комплексных
соединений подтверждены методами ЯМР и ИК спектроскопии, термогравиметрии и комплексономе-
трического титрования. Координационные соединения европия(III) с кумарин-3-карбоновой и 6-нитро-
кумарин-3-карбоновой кислотами обладают эффективной люминесценцией.
Ключевые слова: кумарин-3-карбоновые кислоты, кислота Мельдрума, лантаниды, люминесцентные
свойства, комплексообразование
DOI: 10.31857/S0044460X2104017Х
В настоящее время ведется активный поиск но-
ческими методами [20]. Комплексные соединения
вых материалов для создания органических свето-
производных кумарин-3-карбоновой кислоты с
излучающих диодов (OLED’s), представляющих
металлами обладают рядом практически важных
собой тонкопленочные многослойные устрой-
свойств. Например, серебряные комплексы [7, 21]
ства, способные эффективно преобразовывать
проявляют антибактериальную и фунгицидную
электрическую энергию в фотонное излучение. К
активность, комплексы с Sm3+, Gd3+ и Dy3+ [12],
наиболее востребованным светоизлучающим ма-
Ce3+, La3+ и Nd3+ [22], Ho3+ и Pr3+ [23], La3+ [24],
териалам относятся комплексные соединения лан-
Er3+ [25], Ga3+ [26] обладают цитотоксичностью в
танидов(III) с органическими лигандами.
отношении раковых клеток.
Способность производных кумарина, в част-
Комплексы производных кумарин-3-карбоно-
ности, кумарин-3-карбоновой кислоты, к образо-
вой кислоты с Cu(II) были предложены к исполь-
ванию комплексных соединений с различными
зованию в качестве эффективных флуоресцентных
ионами металлов изучена и описана в ряде работ
индикаторов присутствия следов воды в органиче-
[1-4]. Кумарин-3-карбоновая кислота 1 и ее произ-
ских растворителях [6]. Комплексные соединения
водные ранее использовались в качестве лигандов
лантанидов(III) с кумарин-3-карбоновой кислотой
в реакциях комплексообразования с Cu(II) [4-6],
1 в растворе обладают люминесцентными свой-
Ag(I) [7], Sn(IV) [8, 9], Ni(II), Co(II), Zn(II) и Mn(II)
ствами [13, 14, 18, 27]. Эффект тушения люми-
[10]. Комплексные соединения кислоты 1 с катио-
нисценции комплексов кислоты 1 с Eu3+ и Tb3+ в
нами лантанидов [11-19] изучены квантово-хими-
присутствии соединений фосфора был использо-
613
614
ГРОМАК и др.
Схема 1.
CH3
O
O
COOH
CHO
CH3
Et3N, EtOH
+
O
O O
OH
O
1-4
COOH
COOH
O2N
COOH
=
O O
O O
O O
1-4
1
9
2
10
8
10a
1
COOH
7
COOH
10b
2
6
HO
O O
O 3 O
5
4
3
4
ван для анализа фосфорорганических пестицидов
строение и фотолюминесцентные свойства ком-
[17]. Комплексы производных кумарин-3-карбо-
плексов Eu3+ и Tb3+ с кумарин-3-карбоновой кис-
новой кислоты с Ce3+, Er3+, Eu3+, Nd3+ в растворе
лотой 1, 6-нитрокумарин-3-карбоновой кислотой
обладают флуоресценцией
[28], интенсивность
2, 7-гидроксикумарин-3-карбоновой кислотой 3 и
которой зависит от концентрации лантанид-иона.
бензо[f]кумарин-3-карбоновой кислотой 4.
На примере ингибирования реакции Фентона по-
Кумарин-3-карбоновая кислота 1 и ее про-
казано, что комплексы соединения 1 с Nd3+, Sm3+
изводные 2-4 были синтезированы по реакции
и Gd3+ обладают антиоксидантным эффектом [29].
конденсации Кнёвенагеля по модифицированной
Важно отметить, что нет единого мнения о стро-
процедуре [36] (схема 1) при взаимодействии соот-
ении комплексных соединений. Вероятно, способ
ветствующих 2-гидроксибензальдегидов с кисло-
связывания депротонированного лиганда L- и сте-
той Мельдрума [37] в присутствии триэтиламина в
хиометрия комплекса зависят от природы иона
качестве основного катализатора. Соединения 1-4
металла и от условий проведения синтеза [17-20,
идентифицированы и детально охарактеризованы
30]. Продукты взаимодействия солей лантанидов
методами ИК, ЯМР 1Н и 13С спектроскопии. Пол-
с кумарин-3-карбоновой кислотой LH различают-
ное отнесение сигналов в ЯМР спектрах лиганда
ся по составу и стехиометрии: LnL2Cl(NO3)∙2H2O
1 сделано на основании комплексного анализа с
[11, 18, 24, 27, 29], LnL2(NO3)∙H2O [12, 15-17, 22,
привлечением методов двумерной спектроскопии
23, 29], LnL3∙3H2O [13, 14, 19], LnL2(NO3) [23, 25]
ЯМР (1Н-1Н COSY, 13С DEPTQ, HSQC 1H-13C,
или LnL3 [28].
HMBC 1H-13C). Основные химические сдвиги и
Cведения о получении комплексов лантанидов
гетероядерные корреляции в молекуле соединения
1 представлены на рис. 1, полный набор наблюда-
с производными кумарин-3-карбоновой кислоты
емых корреляций - в табл. 1.
практически отсутствуют. В продолжение наших
исследований в области химии гетероатомных ли-
В спектрах ЯМР 1H полученных карбоновых
гандов с карбоксильными группами [31] и люми-
кислот 1-4 наблюдается уширенный пик в обла-
несцирующих карбоксилатов лантанидов [32-35]
сти 13.10-13.49 м. д., характерный для протона
изучена возможность направленного синтеза,
карбоксильной группы. Характерный сигнал кар-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
615
(a)
(б)
7.88
8.72
118.0
O
H
H
O
130.2
148.3
164.0
7.37-7.40
H
13.17
124.8
OH
OH
118.4
134.3
O O
7.69-7.73
H
O
O
116.1
156.7
154.5
H
7.42
Рис. 1. Основные химические сдвиги и корреляции в спектрах ЯМР 1H (а) и 13C (б) кумарин-3-карбоновой кислоты 1.
бонильного углерода группы СООН наблюдается
кислоты. Комплексные соединения Tb3+, Eu3+ c
в спектрах ЯМР 13С DEPTQ карбоновых кислот
кумарин-3-карбоновой кислотой и ее произво-
1-4 в области 163.5-164.3 м. д., в то время как сиг-
дными (HL) синтезировали в водно-спиртовых
нал карбонильного атома углерода кумаринового
растворах гексагидрата хлорида лантанида и кис-
фрагмента проявляется при 156.7-158.0 м. д.
лоты HL в мольном соотношении LnCl3∙6H2O-HL
Хлориды лантанидов, используемые для син-
1:3. Полученные соединения представляют собой
теза комплексных соединений, получали раство-
устойчивые на воздухе вещества, состав которых
рением соответствующих оксидов (Tb2O3, Eu2O3)
соответствует общей формуле [Ln(H2O)2L2]Cl∙H2O
в конц. HCl с последующим удалением избытка
(табл. 2, схема 2).
Схема 2.
COOH
(1) KOH, EtOH/H2O
(2) LnCl3·6H2O
O
O
O
O
Cl-·Η
Ο
2
O O
O O
Ln3+
O
O
1-4
H
O
O H
H H
Таблица 1. Наблюдаемые корреляции в спектрах 1Н-13С HSQC, 1Н-13С HMBC и 1Н-1H COSY кумарин-3-карбоновой
кислоты 1а
δ, м. д.
δН, м. д.
1H-13C HSQC
1H-13C HMBC
1Н-1H COSY
116.1* (C8), 118.0 (C4а), 130.2* (C5),
7.69-7.73 м (1H, H7), 7.88 д. д (1H,
7.37-7.40 м (1H, H6)
124.8* (C6)
134.3* (C7)
H5)
7.42 д. д (1H, H8)
116.1* (C8)
118.0 (C4а), 124.8* (C6), 154.5 (C8а)
7.69-7.73 м (1H, H7)
116.1* (C8), 124.8* (C6), 130.2* (C5),
7.37-7.40 м (1H, H6), 7.42 д. д (1H,
7.69-7.73 м (1H, H7)
134.3* (C7)
154.5 (C8а)
H8)
118.0 (C4а), 134.3* (C7), 148.3* (C4),
7.88 д. д (1H, H5)
130.2* (C5)
7.37-7.40 м (1H, H6)
154.5 (C8а)
118.0 (C4а), 118.4 (C3), 130.2* (C5),
8.72 с (1H, H4)
148.3* (C4)
-
154.5 (C8а), 156.7 (C2), 164.0 (CO2H)
13.17 уш. с (1H,
-
–
-
COOH)
а Здесь и далее звездочкой обозначены сигналы в противофазе.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
616
ГРОМАК и др.
Таблица 2. Данные термогравиметрического анализа комплексов Eu3+ c кислотами 1-4 (L1-L4)
Найдено, %
Вычислено, %
Комплекс
Ln
L + Cl
H
2
O
Ln
L + Cl
H2O
[Eu(H2O)2L12]Cl∙H2O
24.3
67.1
8.6
24.5
66.7
8.7
[Eu(H2O)2L22]Cl∙H2O
21. 2
71.1
7.7
21.4
71.0
7.6
[Eu(H2O)2L32]Cl∙H2O
23.6
68.1
8.3
23.3
68.3
8.3
[Eu(H2O)2L42]Cl∙H2O
21.3
71.1
7.6
21.2
71.3
7.5
Таблица 3. Доля металла в комплексных соединениях с кислотами 1-4 (L1-L4) по данным комплексонометрии
Ln, %
Соединение
найдено
вычислено
[Tb(H2O)2L12]Cl∙H2O
25.4
25.4
[Eu(H2O)2L12]Cl∙H2O
24.4
24.5
[Tb(H2O)2L22]Cl∙H2O
22.2
22.2
[Eu(H2O)2L22]Cl∙H2O
21.5
21.4
[Tb(H2O)2L32]Cl∙H2O
24.1
24.1
[Eu(H2O)2L32]Cl∙H2O
23.2
23.3
[Tb(H2O)2L42]Cl∙H2O
21.9
21.9
[Eu(H2O)2L42]Cl∙H2O
21.2
21.2
Присутствие хлорид-ионов в составе комплекса
рин-3-карбоновой кислотой 3 (L3) [Eu(H2O)2L32]Cl∙
подтверждается тестом с нитратом серебра. Сте-
H2O (рис. 2), наблюдаются эндоэффекты в области
хиометрия взаимодействия соответствует уравне-
80-220°С. Потеря массы связана с отщеплением
нию (1).
внешнесферной (до 140°С) и внутрисферной (до
LnCl3∙6H2O + 2HL
220°С) воды. Серия экзотермических эффектов
→ [Ln(H2O)2L2]Cl∙H2O + 2HCl + 3H2O.
(1)
обусловлена разложением лиганда. Остаточная
По данным термогравиметрического анализа
масса соответствует оксиду европия(III). Область
комплексного соединения Eu3+ с 7-гидроксикума-
термостабильности отсутствует.
Рис. 2. Термограмма комплексного соединения Eu3+ с 7-гидроксикумарин-3-карбоновой кислотой 3 (L3) [Eu(H2O)2L32]Cl∙H2O.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
617
Таблица 4. Отнесение полос поглощения (нм) в ИК спектрах кислот 1-4 и комплексов Eu3+ и Tb3+ с соответствую-
щими лигандами L1-L4
ν(O-H),
ν(С=О),
ν(С=О),
Соединение
димеры карбоновых
νas(COO-)
νs(COO-)
кислот
карбоксил
карбонил
1
2800-2400
1671
1736
-
-
[Tb(H2O)2L12]Cl∙H2O
-
-
1705
1609
1391
[Eu(H2O)2 L12]Cl∙H2O
-
-
1704
1608
1390
2
2800-2400
1678
1722
-
-
[Tb(H2O)2 L22]Cl∙H2O
-
-
1694
1615
1402
[Eu(H2O)2 L22]Cl∙H2O
-
-
1695
1618
1404
3
2800-2400
1680
1732
-
-
[Tb(H2O)2 L32]Cl∙H2O
-
-
1701
1598
1386
[Eu(H2O)2 L32]Cl∙H2O
-
-
1703
1601
1386
4
2800-2400
1683
1725
-
-
[Tb(H2O)2 L42]Cl∙H2O
-
-
1703
1607
1388
[Eu(H2O)2 L42]Cl∙H2O
-
-
1702
1608
1389
Состав и структура комплексных соединений
ния по энергии триплетного уровня лиганда T1 и
Eu3+ и Tb3+ с кумарин-3-карбоновой кислотой и
излучающего уровня иона лантанида (оптималь-
ее производными подтверждены данными ИК
ная разница Δ = 2500-4000 см-1) [39]. Триплет-
спектроскопии и комплексонометрического ти-
ные уровни кислот 1-4 определены по спектрам
трования. Выходы, данные элементного анализа
фосфоресценции комплексов Gd3+. За энергию Т1
и спектральные характеристики комплексов пред-
принимали значение длинноволновой полосы ис-
ставлены в табл. 3 и 4.
пускания в спектре фосфоресценции комплексов
Gd3+. Получены следующие значения триплет-
С целью определения способа координации
кислот с ионами лантанидов были сопоставлены
ных уровней Т1: 21186 (1), 19569 (2), 19252 (3),
18050 см-1 (4).
ИК спектры кислот 1-4 и полученных на их осно-
ве комплексов (табл. 4). В спектрах комплексов, в
В комплексе Tb3+ (5D4 20500 см-1) с кума-
отличие от ИК спектров кислот, отсутствуют поло-
рин-3-карбоновой кислотой 1 Δ = 686 см-1, поэ-
сы в области 2800-2400 см-1, которые соответству-
тому эффективный внутримолекулярный перенос
ют димерам карбоновых кислот, а также полоса
энергии с органического лиганда на ион Tb3+ не-
валентного колебания связи С=О карбоксильной
возможен. Триплетные уровни остальных кислот
группы в области 1670 см-1, что может свидетель-
находятся по энергии еще ниже, чем излучающий
ствовать о ее участии в образовании комплекса.
терм иона Tb3+. По этой причине люминесценция
Полоса валентного колебания карбонильной груп-
комплексов Tb3+ с кислотами 2-4 невозможна, что
пы кумаринового фрагмента при 1735 см-1 смеща-
подтверждается экспериментальными данными.
ется в сторону меньших длин волн, что предпола-
Для комплексов Eu3+ оптимальное значе-
гает ее участие в комплекообразовании. Поскольку
ние разности между энергиями Т1 и 5D0 терма
разница частот (Δν) асимметричного и симметрич-
(17200 см-1) составляет 2500-3500 см-1. В ком-
ного валентных колебаний ионизированной кар-
плексе Eu3+ c кумарин-3-карбоновой кислотой 1
боксильной группы составляет меньше 220 см-1,
Δ = 3986 см-1, в комплексе с 6-нитрокумарин-3-кар-
можно заключить, что карбоксильные группы ку-
боновой кислотой 2 - 2369 см-1, с бензо[f]кума-
марин-3-карбоновой кислоты и ее производных
рин-3-карбоновой кислотой 4 - 850 см-1, Таким
координированы с ионами лантанида(III) биден-
образом, можно предполагать эффективную лю-
татно [38].
минесценцию для комплексов Eu3+ с лигандами
Для эффективной люминесценции необходимо,
1-3, что подтверждается экспериментально. Наи-
чтобы соблюдалось условие близости расположе-
более интенсивно люминесцируют комплексные
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
618
ГРОМАК и др.
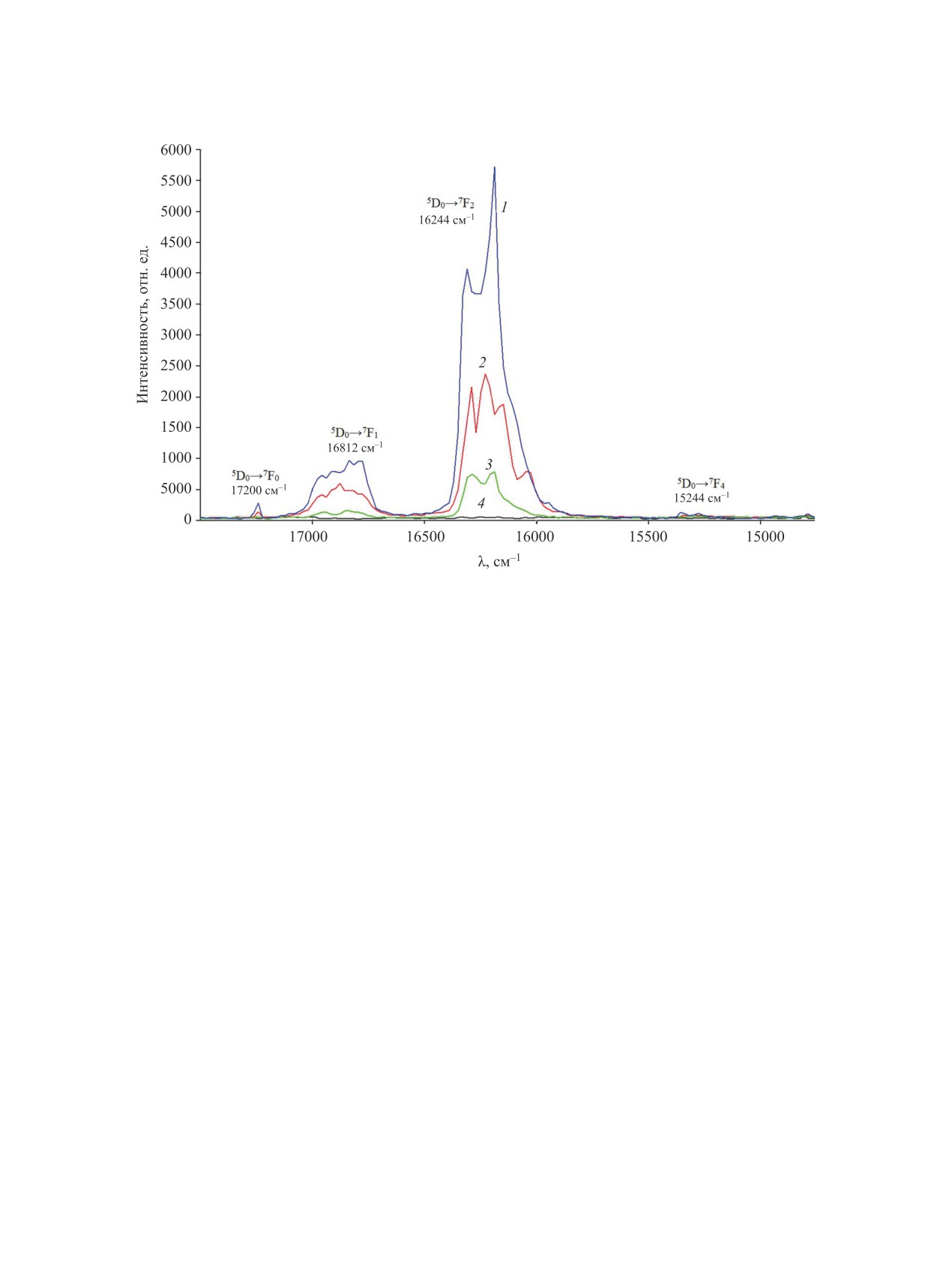
Рис. 3. Спектры люминесценции комплексных соединений Eu3+ с кислотами 1-4 (1-4, лиганды L1-L4 соответственно).
соединения Eu3+ c кумарин-3-карбоновой 1 и 6-ни-
быть использованы в качестве высокоэффектив-
трокумарин-3-карбоновой 2 кислотами.
ных люминесцентных материалов в органических
светоизлучающих диодах (OLEDs). Комплексные
На рис. 3 представлены спектры люминес-
соединения Tb3+ с изученными кислотами люми-
ценции комплексных соединений Eu3+ с кума-
несцентными свойствами не обладают.
рин-3-карбоновой
1,
6-нитрокумарин-3-карбо-
новой 2, 7-гидроксикумарин-3-карбоновой 3 и
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
бензо[f]кумарин-3-карбоновой 4 кислотами. Наи-
Спектры ЯМР (1Н, 1Н-1Н COSY, 13С DEPTQ,
более интенсивная полоса (5700) с максимумом
HSQC 1H-13C, HMBC 1H-13C) записаны на спек-
16244 см-1 соответствует переходу 5D0→7F2, поло-
трометре Bruker Avance III HD NanoBay (400 MГц)
са 16812 см-1 относится к переходу 5D0→7F1, по-
в ДМСО-d6, рабочие частоты 400.17 (1Н) и 100.62
лоса 17200 см-1 - к переходу 5D0→7F0; наименее
(13С) MГц. Внутренний стандарт - ТМС или оста-
интенсивная полоса с максимумом 15244 см-1 со-
точные сигналы растворителя. ИК спектры запи-
ответствует переходу 5D0→7F4.
саны на ИК Фурье-спектрометре Bruker Vertex
Таким образом, комплексные соединения
70 в диапазоне волновых чисел 4000-350 см-1 с
Eu3+ и Tb3+ с кумарин-3-карбоновой кислотой и
использованием приставки нарушенного полного
впервые полученные комплексы с 6-нитрокума-
внутреннего отражения (НПВО) на кристалле ал-
рин-3-карбоновой,
7-гидроксикумарин-3-карбо-
маза. Термограммы комплексных соединений за-
новой и бензо[f]кумарин-3-карбоновой кислотами
писаны на синхронном термоанализаторе Netzsch
[Ln(H2O)2L2]Cl∙H2O исследованы методами ЯМР
STA 409 PC/PG при динамическом нагревании
и ИК спектроскопии, термогравиметрии, запи-
10 град/мин до 1000°С в атмосфере воздуха с ис-
саны их спектры люминесценции. Координаци-
пользованием алундовых тиглей. Спектры лю-
онные соединения Eu3+ с кумарин-3-карбоновой
минесценции твердых образцов записывали на
и 6-нитрокумарин-3-карбоновой кислотами об-
спектрометре SPEX Ramalog при возбуждении
ладают эффективной люминесценцией и могут
азотным лазером, λвозб 337 нм. Регистрацию люми-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
619
несценции проводили при комнатной температуре
7-Гидроксикумарин-3-карбоновая кислота
в диапазоне 29500-13000 см-1. Элементный анализ
(3). В 25 мл этанола при перемешивании раство-
проводили на C,H,N-анализаторе Carlo Erba 1106.
ряли 3.08 г (0.021 моль) кислоты Мельдрума [37]
Чистоту кислот 1-4 контролировали методом ТСХ
и 2.95 г (0.021 моль) 2,4-дигидроксибензальдеги-
на пластинах Sorbfil ПТСХ-АФ-А (ООО «Имид»,
да (синтезирован формилированием резорцина по
Краснодар), элюент - ацетон-гексан, 1:1, прояви-
Вильсмайеру-Хааку [41]). К полученной смеси
тель - пары иода, УФ детектор.
добавляли 2-3 капли Et3N и перемешивали 2 ч при
Кумарин-3-карбоновая кислота (1) получе-
комнатной температуре. Полученный желто-зеле-
на по модифицированной методике [36]. К сме-
ный осадок отфильтровывали и сушили на воздухе
си 3.08 г (0.021 моль) кислоты Мельдрума [37] и
до постоянной массы. Выход 4.02 г (91%), т. пл.
2.24 мл (0.021 моль) салицилового альдегида в
260°С (т. пл. 261-263°С [36]). Спектр ЯМР 1Н, δ,
20 мл этилового спирта добавляли 4 капли Et3N.
м. д.: 6.91 м (1H, H6), 7.08 д (1H, H8, 4J 1.9 Гц),
Происходила гомогенизация смеси, окраска рас-
7.80 д (1H, H5, 3J 8.6 Гц), 8.70 с (1H, H4), 11.32 уш.
твора изменялась с желтой на красно-оранжевую.
с (1Н, ОН), 13.10 уш. с (1H, COOH). Найдено, %:
Полученный раствор нагревали 2 ч при 75°С при
С 58.18; H 3.01. С10Н6О5. Вычислено, %: С 58.26;
перемешивании. Осадок отфильтровывали на
H 2.93.
фильтре Шотта, промывали водным этанолом и
Бензо[f]кумарин-3-карбоновая кислота (4). К
сушили на воздухе до постоянной массы. Выход
смеси 2.16 г (0.015 моль) кислоты Мельдрума [37]
3.44 г (85%), т. пл. 190°С (т. пл. 191-192°С [36]),
и 2.58 г (0.015 моль) 2-гидроксинафталин-1-кар-
белый мелкокристаллический порошок. Спектр
бальдегида в 30 мл этанола добавляли 4-5 капель
ЯМР 1Н, δ, м. д.: 7.37-7.40 м (1H, H6), 7.42 д. д
Et3N. Реакционную массу перемешивали 2 ч при
(1H, H8, 3J 7.8, 4J 1.6 Гц), 7.69-7.73 м (1H, H7), 7.88
75°С. Осадок отфильтровывали, промывали хо-
д. д (1H, H5, 3J 7.6, 4J 1.5 Гц), 8.72 с (1H, H4), 13.17
лодным этанолом и сушили на воздухе до посто-
уш. с (1H, COOH). Спектр ЯМР 13С DEPTQ, δС,
янной массы. Выход 2.62 г (73%), т. пл. 230-232°С,
м. д.: 116.1* (C8), 118.0 (C4а), 118.4 (C3), 124.8*
мелкокристаллический желто-оранжевый поро-
(C6), 130.2* (C5), 134.3* (C7), 148.3* (C4), 154.5
шок. Спектр ЯМР 1Н, δ, м. д.: 7.55 д (1H, 3J 8.8 Гц),
(C8а), 156.7 (C2), 164.0 (COOH). Здесь и далее звез-
7.60-7.64 м (1H), 7.72-7.76 м (1H), 8.04 д (1H, 3J
дочкой обозначены сигналы в противофазе. Най-
7.8 Гц), 8.26 д (1H, 3J 9.8 Гц), 8.54 д (1H, 3J 7.8 Гц),
дено, %: С 63.15; H 3.21. С10Н6О4. Вычислено, %:
9.31 с (1H, H1), 13.29 уш. с (1H, COOH). Спектр
С 63.16; H 3.18.
ЯМР 13С DEPTQ, δС, м. д.: 112.0 (C10b), 116.4* (C5),
6-Нитрокумарин-3-карбоновая кислота (2).
117.2 (C2), 122.3* (C8), 126.4* (C9), 128.9* (2C,
К смеси 3.08 г (0.021 моль) кислоты Мельдрума
С7,C10), 129.0 (C6a), 129.8 (C10a), 135.8* (C6), 143.6*
[37] и 3.57 г (0.021 моль) 5-нитросалицилового
(C1), 155.0 (C4a), 156.7 (C3), 164.3 (COOH). Найде-
альдегида в 20 мл этанола добавляли 4 капли Et3N.
но, %: С 69.92; H 3.46. С14Н8О4. Вычислено, %: С
Полученную смесь нагревали при перемешивании
70.00; H 3.36.
до гомогенизации и перемешивали 2 ч при ком-
Общая методика синтеза комплексных сое-
натной температуре. Осадок отфильтровывали,
промывали водным этанолом и сушили на воздухе
динений Tb3+ и Eu3+ с кислотами 1-4. К 10 мл
до постоянной массы. Выход 3.86 г (77%), т. пл.
спиртового раствора (суспензии) 3 ммоль кислоты
231-232°С (т. пл. 235-236°С [40]), светло-желтый
1-4 добавляли 10 мл водно-спиртового раствора
мелкокристаллический порошок. Спектр ЯМР 1Н,
эквивалентного количества гидроксида калия. К
δ, м. д.: 7.62 д (1H, H8, 3J 8.8 Гц), 8.47 д. д (1H, H7,
полученному раствору при постоянном переме-
3J 8.8, 4J 2.9 Гц), 8.86 с (1H, H4), 8.88 д (1H, H5,
шивании по каплям добавляли 10 мл спиртового
4J 2.9 Гц), 13.49 уш. с (1H, COOH). Спектр ЯМР
раствора 1 ммоль гексагидрата TbCl3 или EuCl3.
13С DEPTQ), δС, м. д.: 117.7* (C8), 118.3 (C3), 120.3
Реакционную смесь перемешивали 2 ч при 25°С.
(C4а), 125.9* (C5), 128.3* (C7), 143.6 (C7), 147.1*
Осадок отфильтровывали, промывали холодным
(C4), 155.4 (C8а), 158.0 (C2), 163.5 (COOH). Найде-
спиртом и сушили на воздухе 1 сут, затем в вакуум-
но, %: С 51.04; H 2.19; N 5.92. С10Н5NО6. Вычисле-
ной печи до постоянной массы, хранили в эксика-
но, %: С 51.08; H 2.14; N 5.96.
торе. Содержание иона лантанида(III) в комплексе
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
620
ГРОМАК и др.
определяли комплексонометрическим титровани-
12.
Kostova I., Momekov G., Stancheva P. // Metal-
ем, точность определения ±0.2% [42] (табл. 2-4).
Based Drugs. 2007. Vol. 2007. Article ID 15925. doi
10.1155/2007/15925
Выходы комплексов 45-66%.
13.
Roh S.G., Baek N.S., Hong K.S., Kim H.K. // Bull. Kor.
БЛАГОДАРНОСТЬ
Chem. Soc. 2004. Vol. 25. N 3. P. 343. doi 10.5012/
bkcs.2004.25.3.343
Исследования выполнены с использованием
14.
Roh S.G., Baek N., Hong K.S., Oh J., Kim H. // Mol.
оборудования Центра коллективного пользования
Cryst. Liq. Crystals. 2004. Vol. 425. N 1. P. 167. doi
«Эколого-аналитический центр” Кубанского госу-
10.1080/15421400490506739.
дарственного университета (уникальный иденти-
15.
Georgieva I., Trendafilova N., Kiefer W., Rastogi V. K.,
фикатор центра RFMEFI59317Х0008).
Kostova I. // Vibrat. Spectroscopy. 2007. Vol. 44. N 1.
P. 78. doi 10.1016/j.vibspec.2006.09.001
ФОНДОВАЯ ПОДДЕРЖКА
16.
Georgieva I., Kostova I., Trendafilova N., Rastogi V.K.,
Работа выполнена при финансовой поддержке
Kiefer W. // J. Mol. Struct. 2010. Vol. 979. N 1-3. P. 115.
Министерства образования и науки Российской
doi 10.1016/j.molstruc.2010.06.013
Федерации (тема 0795-2020-0031).
17.
Hussein B.H.M., Khairy G.M., Kamel R.M. //
Spectrochim. Acta (A). 2016. Vol. 158. P. 34. doi
КОНФЛИКТ ИНТЕРЕСОВ
10.1016/j.saa.2016.01.008
Авторы заявляют об отсутствии конфликта ин-
18.
Bisi Castellani C., Carugo O. // Inorg. Chim. Acta.
1989. Vol. 159. N 2. P. 157. doi 10.1016/S0020-
тересов.
1693(00)80560-5
СПИСОК ЛИТЕРАТУРЫ
19.
Dutt N.K., Sarma U.U.M. // Ind. J. Chem. (A). 1977.
Vol. 15. P. 361.
1.
Grazul M., Budzisz E. // Coord. Сhem. Rev. 2009.
20.
Georgieva I., Trendafilova N., Aquino A.J., Lischka H. //
Vol. 253. P. 2588. doi 10.1016/j.ccr.2009.06.015
Inorg. Chem. 2007. Vol. 46. N 25. P. 10926. doi
2.
Kostova I., Momekov G., Zaharieva M., Karaivanova M. //
10.1021/ic7016616
Eur. J. Med. Chem. 2005. Vol. 40. N 6. P. 542. doi
21.
Thati B., Noble A., Rowan R., Creaven B.S., Walsh M.,
10.1016/j.ejmech.2004.12.007
McCann M., Egan D., Kavanagh K. // Toxicology
3.
Kostova I., Manolov I., Nicolova I., Konstantinov S.,
in vitro. 2007. Vol. 21. N 5. P. 801. doi 10.1016/j.
Karaivanova M. // Eur. J. Med. Chem. 2001. Vol. 36.
N 4. P. 339. doi 10.1016/S0223-5234(01)01221-1
tiv.2007.01.022
4.
Karaliota A., Kretsi O., Tzougraki C. // J. Inorg.
22.
Kostova I., Momekov G. // Appl. Organomet. Chem.
Biochem. 2001. Vol. 84. N 1-2. P. 33. doi 10.1016/
2007. Vol. 21. N 4. P. 226. doi 10.1002/aoc.1205
S0162-0134(00)00214-2
23.
Kostova I., Stefanova T. // J. Rare Earths. 2010. Vol. 28.
5.
Zheng P., Eskandari A., Lu C., Laws K., Aldous L.,
Suppl. 1. P. 40. doi 10.1016/S1002-0721(10)60367-5
Suntharalingam K. // Dalton Trans. 2019. Vol. 48. N 18.
24.
Kostova I., Trendafilova N., Pinzaru S.C., Kiefer W.,
P. 5892. doi 10.1039/C8DT04706E
Momekov G. // J. Optoelectron. Adv. Mater. 2007.
6.
Cheng W., Xie Y., Yang Z., Sun Y., Zhang M. Z., Ding Y.,
Vol. 9. N 3. P. 532
Zhang W. // Anal. Chem. 2019. Vol. 91. N 9. P. 5817.
25.
Kostova I., Grigorov P., Balkansky S., Stefanova T. //
doi 10.1021/acs.analchem.9b00132
Ind. J. Biotechnol. 2011. Vol. 10. P. 387.
7.
Creaven B. S., Egan D.A., Kavanagh K., McCann M.,
26.
Kostova I., Stefanova T. // Ind. J. Pure Appl. Phys. 2012.
Noble A., Thati B., Walsh M. // Inorg. Chim. Acta. 2006.
Vol. 50. P. 547.
Vol. 359. N 12. P. 3976. doi 10.1016/j.ica.2006.04.006
27.
Lis S., Staninski K., Grzyb T. // Int. J. Photoenergy. 2008.
8.
Ng S. W., Kumar Das V. G. // Acta Cryst. (C). 1997.
Vol. 2008. Article ID 131702. doi 10.1155/2008/131702
Vol. 53. N 8. P. 1034. doi 10.1107/S0108270197004307
28.
Cisse L., Djande A., Capo-Chichi M., Delattre F., Saba A.,
9.
Ng S. W. // Acta Cryst. (C). 1999. Vol. 55. N 4. P. 523.
Brochon J.C., Sanouski S., Tine A., Aaron J.J. // J.
doi 10.1107/S0108270198014991
Fluoresc. 2017. Vol. 27. N 2. P. 619. doi 10.1007/
10.
Creaven B.S., Devereux M., Georgieva I., Karcz D.,
s10895-016-1990-1
McCann M., Trendafilova N., Walsh M. // Spectrochim.
29.
Martin J., Mladěnka P., Saso L., Kostova I. //
Acta (A). 2011. Vol. 84. N 1. P. 275. doi 10.1016/j.
Redox Rep. 2016. Vol. 21. N 2. P. 84. doi
saa.2011.09.041
10.1179/1351000215Y.0000000031
11.
Mihaylov T., Trendafilova N., Kostova I., Georgieva I.,
30.
Furia E., Beneduci A., Russo N., Marino T. // New
Bauer G. // Chem. Phys. 2006. Vol. 327. N 2-3. P. 209.
J. Chem. 2018. Vol. 42. N 13. P. 11006. doi 10.1039/
doi 10.1016/j.chemphys.2006.04.009
C8NJ01244J
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ЛЮМИНЕСЦЕНТНЫЕ СВОЙСТВА
621
31. Доценко В.В., Кривоколыско С.Г., Чернега А.Н.,
Aksenova I.V. // Russ. J. Gen. Chem. 2019. Vol. 89.
Литвинов В.П. // Изв. АН. Сер. xим. 2002. № 8.
N 12. P. 2413. doi 10.1134/S1070363219120144
С. 1432; Dotsenko V.V., Krivokolysko S.G., Cherne-
36. Song A., Wang X., Lam K. S. // Tetrahedron Lett.
ga A.N., Litvinov V.P. // Russ. Chem. Bull. 2002.
2003. Vol. 44. N 9. P. 1755. doi 10.1016/S0040-
Vol. 51. N 8. P. 1556. doi 10.1023/A:1020939712830
4039(03)00108-4
32. Перетертов В.А., Колоколов Ф.А. // ЖНХ. 2018.
37. Нестерова И.Н., Шахназаров A.K., Позняк A.M.,
Т. 63. № 5. С. 631; Peretertov V.A., Kolokolov F.A. //
Лакоза М.И., Шемерянкин Б.В., Граник В.Г. // Хим.-
Russ. J. Inorg. Chem. 2018. Vol. 63. N 5. P. 661. doi
фарм. ж. 1994. Т. 28. № 8. С. 41; Nesterova I.N.,
10.1134/S0036023618050169
Shanazarov A.K., Poznyak A.M., Lakoza M.I.,
33. Назаренко М.А., Офлиди А.И., Колоколов Ф.А. Па-
нюшкин В.Т. // ЖОХ. 2017. Т. 87. Вып. 5. С. 833;
Shemeryankin B.V., Granik V.G. // Pharm. Chem. J.
Nazarenko M.A., Oflidi A.I., Kolokolov F.A., Panyush-
1994. Vol. 28. N 8. P. 583. doi 10.1007/BF02219035
kin V.T. // Russ. J. Gen. Chem. 2017. Vol. 87. N 5.
38. Накамото К. Инфракрасные спектры неорганиче-
P. 1022. doi 10.1134/S1070363217050218
ских и координационных соединениий. М.: Мир,
34. Колоколов Ф.А., Кулясов А.Н., Магомадова М.А., Ша-
1991. С. 484.
пиева Х.К., Михайлов И.Е., Душенко Г.А., Панюш-
39. De Bettencourt-Dias A. // Dalton Trans. 2007. N 22.
кин В.Т. // ЖОХ. 2016. Т. 86. Вып. 5. С. 873; Koloko-
P. 2229. doi 10.1039/b702341c
lov F.A., Kulyasov A.N., Magomadova M.A., Shapie-
40. Clinton R.O., Laskowski S.C. // J. Am. Chem. Soc. 1949.
va K.K., Mikhailov I.E., Dushenko G.A., Panyush-
Vol. 71. N 11. P. 3602. doi 10.1021/ja01179a007
kin V.A. // Russ. J. Gen. Chem. 2016. Vol. 86. N 5.
41. Mendelson W.L., Hayden S. // Synth. Commun. 1996.
P. 1209. doi 10.1134/S1070363216050418
Vol. 26. N 3. P. 603. doi 10.1080/00397919608003654
35. Котлова И.А., Колоколов Ф.А., Доценко В.В., Аксе-
нов Н.А., Аксенова И.В. // ЖОХ. 2019. Т. 89. Вып.
42. Рябчиков Д.И., Рябухин В.А. Аналитическая химия
12. С. 1901. doi 10.1134/S0044460X1912014X; Kotlo-
редкоземельных элементов и иттрия. М.: Наука,
va I.A., Kolokolov F.A., Dotsenko V.V., Aksenov N.A.,
1966. 383 с.
Synthesis and Luminescent Properties
of Eu3+ and Tb3+ Complexes with Coumarin-3-Carboxylic Acids
N. A. Gromaka, F. A. Kolokolovb, V. V. Dotsenkoa,c,*, N. A. Aksenovc, and I. V. Aksenovac
aKuban State University, Krasnodar, 350040 Russia
bMendeleev Russian University of Chemical Technology, Moscow, 125047 Russia
c North Caucasus Federal University, Stavropol, 355009 Russia
*e-mail: victor_dotsenko_@mail.ru
Received December 29, 2020; revised December 29, 2020; accepted January 30, 2021
New Eu3+ and Tb3+ complex compounds [Ln(H2O)2L2]Cl∙H2O were synthesized on the basis of coumarin-
3-carboxylic acid and its derivatives. Composition and structure of the ligands and the obtained complex
compounds were confirmed by NMR and IR spectroscopy, thermogravimetry, and complexometric titration
methods. Europium(III) complex with coumarin-3-carboxylic and 6-nitrocoumarin-3-carboxylic acids show
effective luminescence.
Keywords: coumarin-3-carboxylic acids, Meldrum’s acid, lanthanides, luminescent properties, complexation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021