ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 627-637
УДК 546.284;547.979.733
СИНТЕЗ И ФОТОКАТАЛИТИЧЕСКИЕ
СВОЙСТВА СЛОИСТОГО СИЛИКАТА МАГНИЯ,
МОДИФИЦИРОВАННОГО КАТИОННЫМИ
ПРОИЗВОДНЫМИ ХЛОРИНА e6
© 2021 г. И. В. Лоухинаа,*, М. А. Градоваb, И. С. Худяеваа, А. В. Лобановb, Д. В. Белыха
а Институт химии Коми научного центра Уральского отделения Российской академии наук,
ул. Первомайская 48, Сыктывкар, 167000 Россия
b Федеральный исследовательский центр химической физики имени Н. Н. Семенова Российской академии наук,
Москва, 119991 Россия
*e-mail: loukhina@yandex.ru
Поступило в Редакцию 3 февраля 2021 г.
После доработки 3 февраля 2021 г.
Принято к печати 21 февраля 2021 г.
Синтетические образцы слоистого силиката магния, модифицированные моно-, ди- и трикатионными
производными хлорина е6, проявляют сопоставимую фотохимическую активность в отношении ряда
восстановителей - селективно окисляющегося синглетным кислородом 1,3-дифенилизобензофурана и
легко окисляющегося пероксидом водорода 1,2-фенилендиамина. Оптимальная фотохимическая актив-
ность модифицированных силикатов магния достигается при соотношении 1 грамм силиката магния к
4-8 мкмоль производного хлорина е6.
Ключевые слова: катионные производные хлорина е6, слоистый силикат магния, гетерогенные фото-
катализаторы
DOI: 10.31857/S0044460X21040193
Порфириновые соединения характеризуются
конструкций, материалов для электродов электро-
уникальными спектральными, фотофизическими
химических суперконденсаторов, перезаряжае-
и фотохимическими свойствами; введение раз-
мых аккумуляторных батарей [9-14]. Обработка
нообразных заместителей в порфириновый ма-
сточных вод гибридными системами на основе
кроцикл позволяет гибко регулировать свойства
порфиринов или порфиринатов металлов приво-
порфиринов и расширяет спектр областей их при-
дит к фотодеградации токсичных загрязняющих
менения. В медицине порфирины используются
веществ [15-18].
при фотодинамической терапии онкологических
Порфирины и порфиринаты металлов высту-
заболеваний [1-3] и фотодинамической инактива-
пают в качестве фотосенсибилизаторов и (реже)
ции микроорганизмов [4-7]. Модифицированные
фотокатализаторов при фотоиндуцированном вы-
порфиринами или порфиринатами металлов по-
делении водорода [19, 20], фотовосстановлении
верхности, фотоактивные в видимом свете и об-
углекислого газа [21, 22], фотокаталитическом
ладающие бактерицидными свойствами [8], пер-
эпоксидировании алкенов [23, 24] и др. [14].
спективны для применения в медицинских целях
и в промышленности. В энергетике тетрапирроль-
Склонность к ассоциации порфиринов и ме-
ные макрогетероциклы находят применение при
таллопорфиринов препятствует проявлению их
совершенствовании способов использования аль-
каталитических свойств [25]. Предотвратить ас-
тернативных источников энергии, включая разра-
социацию молекул макроциклов возможно путем
ботку эффективных солнечных батарей различных
иммобилизации их в неорганической матрице,
627
628
ЛОУХИНА и др.
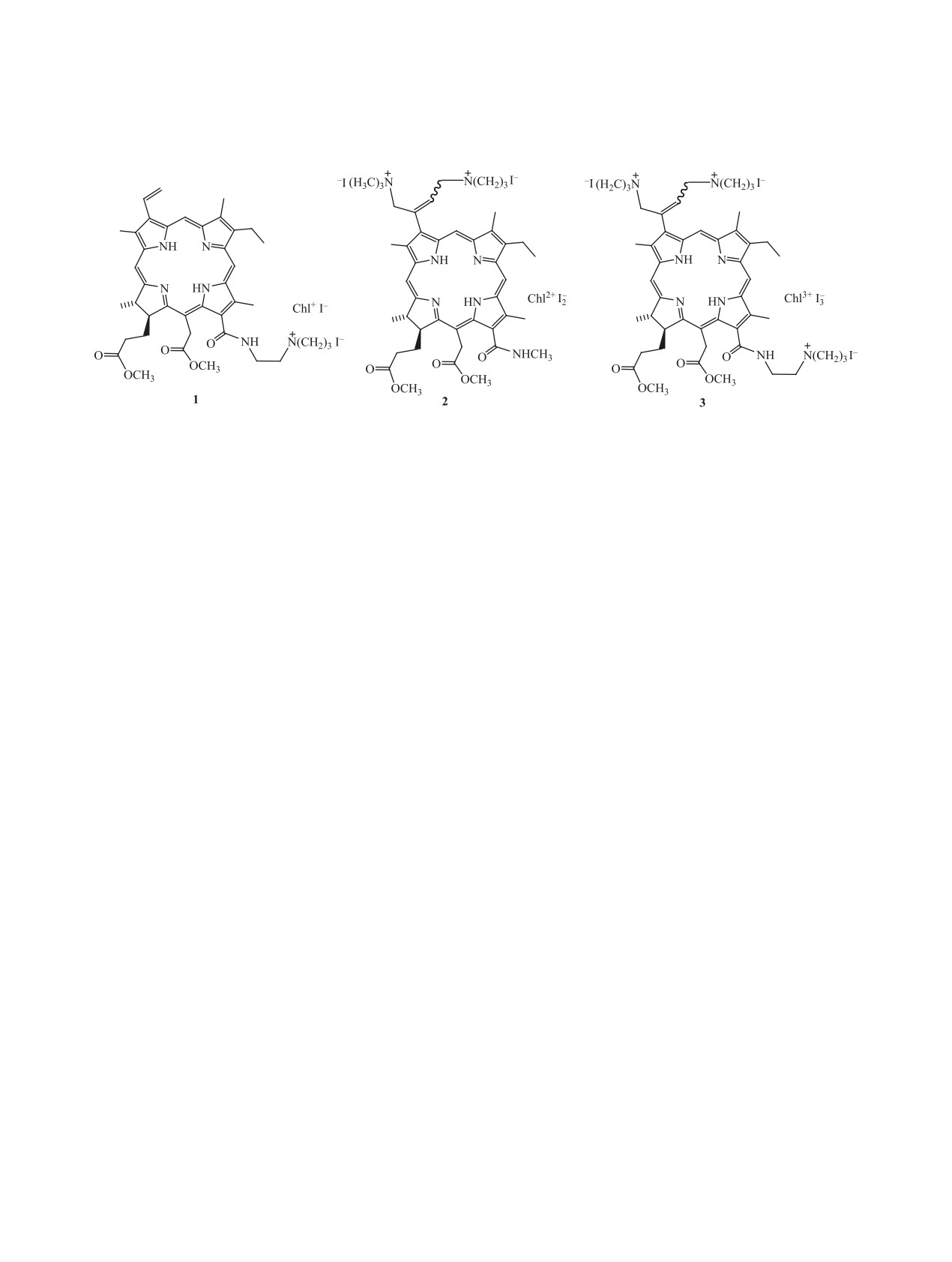
Схема 1.
которая играет роль либо относительно инертно-
е6 1-3 с одной, двумя и тремя положительно за-
го носителя [26], либо среды, активно взаимодей-
ряженными группами (схема 1), проведен подбор
ствующей с молекулами пигмента [27-29].
соотношений производных хлорина и слоистого
Слоистые силикаты как носители характери-
силиката магния, оптимальных для получения мо-
дифицированных образцов с изолированными (не-
зуются высокой стабильностью, обладают обра-
тимой гибкостью слоев, способны предотвращать
ассоциированными) макроциклическими молеку-
лами, и дана оценка фотокаталитических свойств
агрегацию и регулировать ориентацию молекул
порфиринов [26, 30], повышать их фотостабиль-
полученных модифицированных образцов силика-
та магния.
ность, регулировать фотохимические и флуорес-
центные свойства [30, 31]. В качестве матриц для
В работе использовали производные хлорина
проведения фотохимических реакций хорошо
с одной катионной группой - (17S)-2,7,12,18-те-
подходят синтетические смектиты (монтморил-
траметил-15-(метоксикарбонилметил)-17-[2-(мет-
лонит, сапонит, гекторит), так как их коллоидные
оксикарбонил)этил]-13-{N-[2-(триметиламмо-
растворы прозрачны в ультрафиолетовом диапа-
нио)этил]карбамoил}-3-этенил-8-этилхлори-
зоне спектра [26] и характеризуются отсутствием
ниодид (1), с двумя катионными группами -
структурных примесей окрашенных ионов железа,
(17S)-3-[(3E,Z)-бис(1,4-триметиламмо-
которые могут гасить возбужденное состояние мо-
нио)бут-2-ен-2-ил]-2,7,12,18-тетраметил-
лекулы гостя.
13-(N-метилакарбамоил)-15-(метоксикарбонил-
В качестве неорганического носителя нами
метил)-17-[2-(метоксикарбонил)этил]-8-этилхло-
выбран синтетический слоистый силикат магния,
риндииодид (2), с тремя катионными группами -
имеющий состав гекторита. Гекторит - слоистый
(17S)-3-[(3E,Z)-бис(1,4-триметиламмонио)бут-
триоктаэдрический силикат (2:1) [32], в котором
2-ен-2-ил]-2,7,12,18-тетраметил-15-(метокси-
между двумя сетками кремнийкислородных те-
карбонилметил)-17-[2-(метоксикарбонил)этил]-
траэдров располагается одна Mg-кислородно-ги-
13-{N-[2-(триметиламмонио)этил]карбамо-
дроксильная октаэдрическая сетка. Замещение в
ил}-8-этилхлоринтрииодид (3).
октаэдрической сетке Mg2+ на Li+ приводит к воз-
Ранее было установлено, что при разбавлении
никновению отрицательного заряда слоя. Отрица-
водных суспензий соединений 1-3 происходит
тельный заряд распределен по всем атомам кис-
разрушение коллоидных частиц с переходом сое-
лорода слоя и компенсируется гидратированными
динений 1-3 в мономолекулярное состояние [34].
катионами, которые могут вступать в реакции ион-
Основываясь на этой особенности поведения ка-
ного обмена [32, 33].
тионных производных хлорина е6, для получения
Нами изучено взаимодействие слоистого сили-
модифицированных образцов силиката магния мы
ката магния с катионными производными хлорина
проводили реакции силиката с соединениями 1-3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ФОТОКАТАЛИТИЧЕСКИЕ СВОЙСТВА
629
в условиях высокого разбавления, что обеспечива-
ло максимальную концентрацию изолированных
макроциклических молекул.
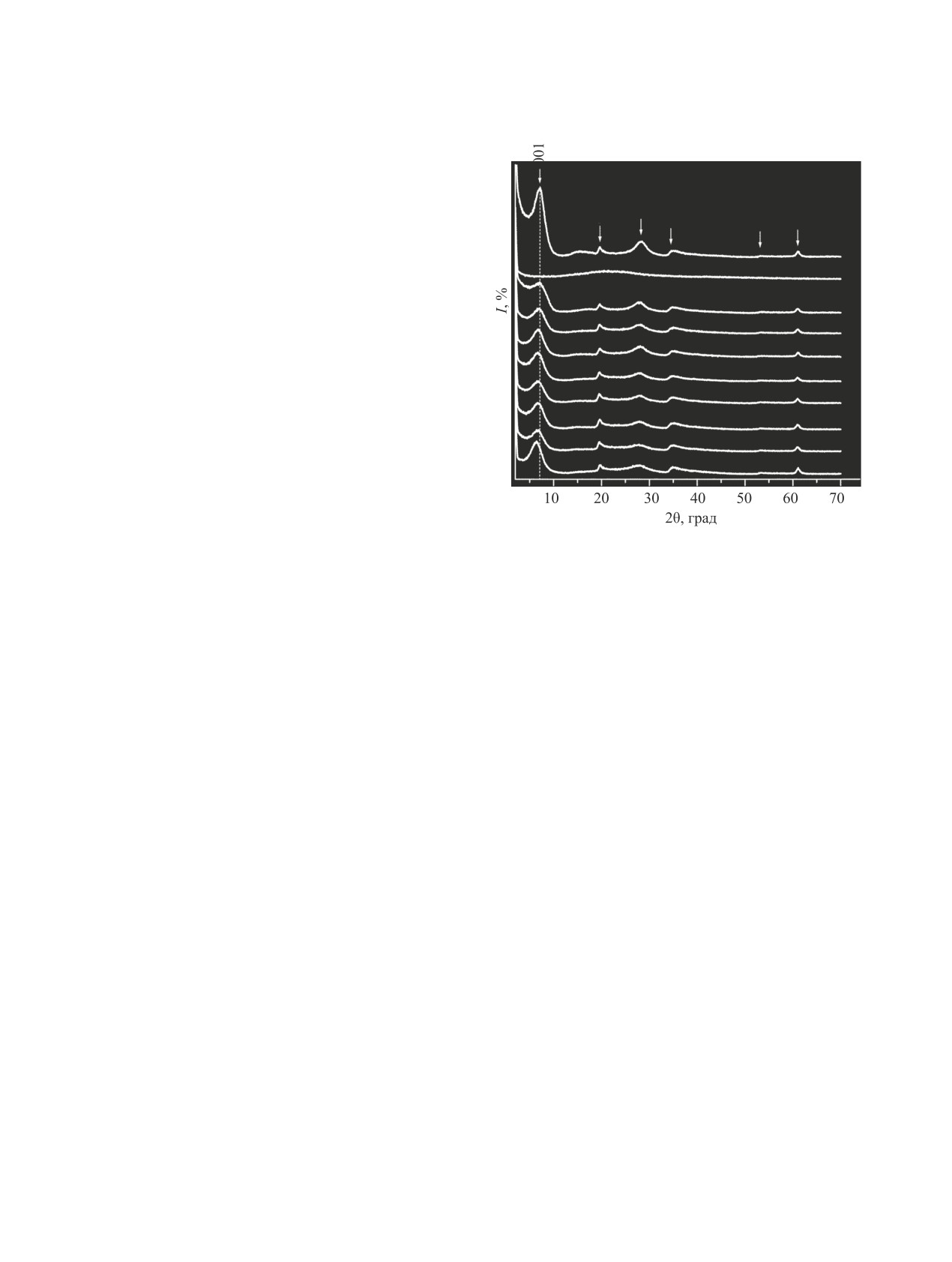
Характерная особенность смектитов, получен-
ных в мягких условиях, - их низкая кристаллич-
ность [35]. Согласно результатам РФА, частицы
исходного синтетического слоистого силиката
магния (гекторита) слабо кристаллизованы, о чем
свидетельствует уширение и низкая интенсив-
ность рефлексов фазы (d001 1.25, d020 110 0.450,
d004 0.312, d130 220 0.254, d310 0.172, d060 0.152 нм)
(рис. 1, 1).
Соединения 1-3, по данным рентгенофазового ана-
лиза, имеют однотипные рентгенограммы. На рис. 1,
2 приведена рентгенограмма соединения 1, в которой
присутствует гало в области 2θ 10 - 35°, что указывает
на рентгеноаморфное состояние производного хлори-
на е6 1.
На поверхности силикатных частиц может про-
Рис. 1. Рентгенограммы исходного силиката магния
текать кристаллизация изначально рентгеноамор-
(1), соединения 1 (2), модифицированных образцов,
фных производных хлорина е6 [36]. В образцах си-
полученных при действии соединений 1-3, (мкмоль на
1 г силиката магния): 1, 2.1 (3); 3, 2.1 (4); 2, 1.4 (5), 2.1
ликата магния, модифицированных соединениями
(6), 4.2 (7), 8.5 (8), 17.1 (9), 34.6 (10).
1-3, на поверхности частиц силиката отсутствуют
крупные окристаллизованные частицы соедине-
ний 1-3, так как на рентгенограммах модифици-
зависимости от плотности укладки органического
рованных образцов наблюдаются только рефлексы
компонента [38]. Следовательно, при введении ма-
фазы силиката магния (рис. 1, 3-10).
лых количеств соединения 1 в модифицированных об-
Размер межслоевого пространства образцов (см.
разцах могут присутствовать пакеты слоев силиката
таблицу) рассчитывали по результатам РФА как раз-
магния, интеркалированных катионами соединения 1,
ницу между размером межплоскостного расстояния
слоев силиката магния, в которых катионы размеще-
рефлекса 001 силиката магния и толщиной слоя
ны на поверхности частиц, и пакеты исходных слоев
смектитов (0.96 нм [32]).
силиката магния. Присутствие в составе модифици-
Внесение соединения 1 в количестве 1-8 мкмоль
рованных образцов 1.1-1.4 (см. таблицу) гидрофоб-
на 1 г силиката приводит к уменьшению размера меж-
ного производного хлорина е6 приводит к удалению
слоевого пространства в модифицированном образце
молекул воды с поверхности и из межслоевого про-
(см. таблицу) по сравнению с исходным силикатом
странства.
магния, что может быть обусловлено вытеснением
При увеличении количества соединения 1 в образ-
молекул воды из межслоевого пространства силиката
цах до 17-35 мкмоль/г размер межслоевого простран-
[37]. При этом не происходит значительного измене-
ства увеличивается в результате размещения катионов
ния заряда поверхности модифицированных частиц и
соединения 1 в межслоевом пространстве, так как раз-
наблюдается их укрупнение по сравнению с исходным
мер межслоевого пространства модифицированных
силикатом магния (см. таблицу). Присутствие как
образцов 1.5 и 1.6 (см. таблицу) сопоставим с разме-
модифицированных пакетов слоев, так и пакетов
ром молекул хлорина е6. Размеры молекулы хлорина
исходных силикатных слоев характерно для си-
е
: 1.7 нм (высота) × 1.7 нм (ширина) [39] × ~ 0.35
6
ликатов, модифицированных малым количеством
[37]-0.71 [39] нм (толщина). Молекулы соединения
органического компонента. Из-за гибкости сили-
1 в межслоевом пространстве модифицированных
катных слоев возможно колебание высоты слоя в
образцов силиката магния находятся в горизон-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
630
ЛОУХИНА и др.
Размер межслоевого пространства, гидродинамический диаметр и электрокинетический потенциал слоистого сили-
ката магния и образцов силиката, модифицированного соединениями 1-3
Количество
Размер межплоскостного
Средний
Номер
введенного
Размер межслоевого
ζ-Потенциал,
расстояния по рефлексу
диаметр
образца
соединения
пространства, нм
мВ
001, нм
частиц, нм
1-3, мкмоль/г
Силикат магния
-
1.25
0.29
133±1
-33±1
1.1
1.4
1.23
0.27
256±3
-36±2
1.2
2.1
1.21
0.25
207±3
-30±1
1.3
4.2
1.23
0.27
270±10
-31±1
1.4
8.5
1.20
0.24
279±10
-35±5
1.5
17.1
1.29
0.33
745±59
-22±1
1.6
34.6
1.30
0.34
336±7
-25±2
2.1
1.4
1.30
0.34
233±4
-32±1
2.2
2.1
1.30
0.34
190±2
-33±1
2.3
4.2
1.30
0.34
232±3
-33±1
2.4
8.5
1.29
0.33
232±5
-32±1
2.5
17.1
1.31
0.35
331±1
-30±1
2.6
34.6
1.38
0.42
448±22
-30±1
3.1
1.4
1.30
0.34
233±6
-33±1
3.2
2.1
1.26
0.30
148±1
-34±1
3.3
4.2
1.29
0.33
201±6
-30±1
3.4
8.5
1.31
0.35
209±5
-34±1
3.5
17.1
1.30
0.34
640±30
-30±1
3.6
34.6
1.34
0.38
730±57
-31±1
тальной ориентации, так как размер межслоевого
мещением катионов 2, 3 на поверхности силикатных
пространства соответствует размеру молекул хло-
частиц, при этом размеры частиц модифицированных
рина е6 по толщине. Снижение отрицательного элек-
образцов возрастают скачкообразно (см. таблицу).
трокинетического потенциала частиц образцов 1.5 и
В электронных спектрах модифицированных об-
1.6 (см. таблицу), по сравнению с исходным силика-
разцов (рис. 2) полосы поглощения соединений 1-3
том магния указывает на размещение катионов соеди-
смещены относительно их положения в спектрах ин-
нения 1 на поверхности частиц силиката.
дивидуальных соединений 1-3 в этаноле в результате
В образцах, модифицированных ди-, трикатион-
взаимодействия производных хлорина е6 с силикатом
ными производными хлорина е6, наблюдается увели-
магния. Полосы поглощения при 405 и 643 - 645 нм
чение межслоевого промежутка по сравнению с ис-
(рис. 2а, 3-5), 404, 405 и 642 нм (рис. 2б, 3-5), 404, 405,
ходным силикатом магния уже при введении малых
642 и 643 нм (рис. 2в, 3-5) в электронных спектрах
количеств соединения 2 или 3, что, вероятно, обуслов-
модифицированных образцов аналогичны полосам в
лено большим числом объемистых заместителей в ма-
спектрах поглощения растворов соединений 1, 2 и 3
кроцикле. Сравнение размера межслоевого простран-
соответственно в 0.1 н. соляной кислоте. Соединения
ства модифицированных образцов 2.1-2.6, 3.1-3.6 (см.
1-3 в 0.1 н. соляной кислоте протонированы, следо-
таблицу) с размерами хлорина е6 позволяет сделать
вательно, и в модифицированных образцах внутрици-
вывод об интеркаляции катионов 2 и 3 в межслоевое
клические атомы азота соединений 1-3 находятся в
пространство силиката.
протонированном состоянии за счет взаимодействия
с протонодонорными группами ОН силиката маг-
При увеличении количества соединений 2, 3 до
ния.
17-35 мкмоль/г в составе модифицированных образ-
цов отмечается снижение отрицательного электроки-
Увеличение количества соединений 1-3 в моди-
нетического потенциала частиц, что обусловлено раз-
фицированных образцах приводит к батохромному
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ФОТОКАТАЛИТИЧЕСКИЕ СВОЙСТВА
631
Рис. 2. (а) Спектры поглощения соединения 1 в этаноле (1), 0.1 н. HCl (2), модифицированных образцов 1.1 (3), 1.2 (4), 1.3
(5), 1.4 (6), 1.5 (7), 1.6 (8) в воде. (б) Спектры поглощения соединения 2 в этаноле (1), 0.1 н. HCl (2), модифицированных
образцов 2.1 (3), 2.2 (4), 2.3 (5), 2.4 (6), 2.5 (7), 2.6 (8) в воде. (в) Спектры поглощения соединения 3 в этаноле (1), 0.1 н. HCl
(2), модифицированных образцов 3.1 (3), 3.2 (4), 3.3 (5), 3.4 (6), 3.5 (7), 3.6 (8) в воде.
смещению полосы Соре и Q полосы (рис. 2а-в, 6-8),
изменяется нелинейно (рис. 3а). Разгорание флу-
что может быть обусловлено как образованием водо-
оресценции (λmax 646 нм) происходит в образцах,
родных связей между внутрициклическими атомами
содержащих 1-4 мкмоль/г соединения 2 (рис. 3а,
азота катионов соединений 1-3 и протонодонорными
1-3). Дальнейшее увеличение количества соеди-
группами силиката, так и агрегацией производных
нения 2 до 8-35 мкмоль/г (рис. 3а, 4-6) приводит
хлорина е6.
к тушению флуоресценции, сопровождающему-
ся увеличением интенсивности длинноволновой
В модифицированных образцах катионы соеди-
компоненты (λmax 702 нм) в спектре испускания,
нений 1-3 находятся в неассоциированном виде. С
что может быть следствием межхромофорного
увеличением количества вводимых производных
взаимодействия в результате агрегации молекул
хлорина е6 происходит их ассоциация в модифи-
хлорина. Батохромное смещение Q-полосы погло-
цированных образцах силиката. Присутствие в
щения в электронных спектрах (рис. 2б, 7, 8) моди-
образцах мономолекулярных форм катионов сое-
фицированных образцов с большим количеством
динений 1-3 подтверждается их флуоресценцией.
соединения 2 (17-35 мкмоль/г) также подтвержда-
Сопоставление интенсивности флуоресценции и
ет агрегацию дикатионного производного хлорина
эффективности генерации синглетного кислорода
е6 2.
позволяет определить влияние количества введен-
Полученные результаты согласуются с фото-
ных производных хлорина е6 на фотофизические
химической активностью модифицированных
свойства и фотохимическую активность образцов
образцов при генерации синглетного кислорода.
модифицированного силиката.
Фотохимическую активность оценивали по скоро-
При увеличении количества соединения 2 в
сти окисления 1,3-дифенилизобензофурана - се-
модифицированных образцах интенсивность
лективного химического акцептора синглетного
флуоресценции связанной мономерной формы
кислорода (1O2). Согласно кинетическим кривым
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
632
ЛОУХИНА и др.
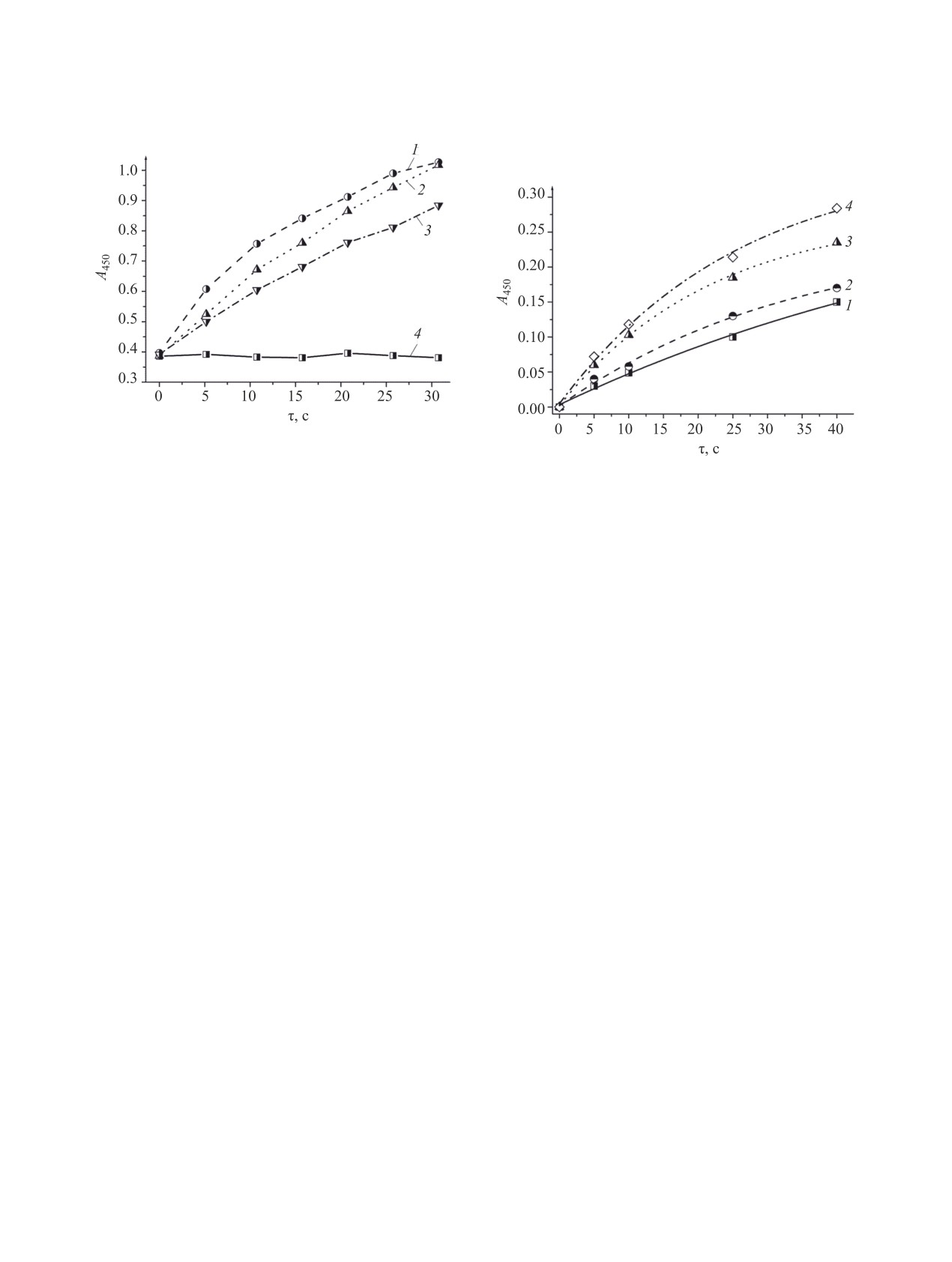
Рис. 3. Спектры флуоресценции (а) и кинетические кривые (б) окисления 1,3-дифенилизобензофурана в присутствии
модифицированных образцов силиката магния, полученных при действии соединения 2 (мкмоль на 1 г силиката магния):
1.4 (1), 2.1 (2), 4.2 (3), 8.5 (4), 17.1 (5), 34.6 (6). Доля слоистого силиката магния в системе 0.06%.
(рис. 3б), зависимость фотохимической активно-
Интенсивность флуоресценции модифициро-
сти модифицированных образцов от количества
ванных образцов с одинаковым количеством со-
введенного соединения 2 имеет нелинейный ха-
единений 1-3 имеет близкие значения (рис. 4а).
рактер. Наиболее высокие скорости генерации
Кроме того, по данным мониторинга эффектив-
синглетного кислорода наблюдаются для образ-
ности окисления 1,3-дифенилизобензофурана, для
цов 2.3 и 2.4 (см. таблицу, рис. 3б, 3, 4), что сви-
модифицированных образцов с одинаковым коли-
детельствует о присутствии в них максимального
чеством соединений 1-3 сопоставима и фотохи-
количества фотосенсибилизатора в фотоактивной
мическая активность при генерации синглетного
мономолекулярной (неагрегированной) форме.
кислорода (рис. 4б).
Рис. 4. Спектры флуоресценции (а) и кинетические кривые окисления (б) 1,3-дифенилизобензофурана в присутствии
модифицированных образцов силиката магния, синтезированных при действии на силикат магния 2.13 мкмоль (на 1 г
силиката) соединения 1 (1), соединения 2 (2), соединения 3 (3); в присутствии немодифицированного силиката магния (4).
Концентрация соединений 1-3 в системе 1 мкмоль/л.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ФОТОКАТАЛИТИЧЕСКИЕ СВОЙСТВА
633
Рис. 5. Кинетические кривые фотосенсибилизирован-
ного окисления 1,2-фенилендиамина в присутствии
модифицированных образцов силиката магния, по-
Рис. 6. Кинетические кривые фотосенсибилизирован-
лученных при действии 2.1 мкмоль (на 1 г силиката
ного окисления 1,2-фенилендиамина в присутствии мо-
магния) соединения 1 (1) соединения 2 (2), соединения
дифицированных образцов, полученных при действии
3 (3); в присутствии немодифицированного силиката
соединения 2 (мкмоль на 1 г силиката магния): 1.4 (1),
магния (4). Концентрация соединений 1-3 в системе
2.1 (2), 4.2 (3), 8.5 (4). Доля слоистого силиката магния
1 мкмоль/л.
в системе 0.02%.
На фотохимическую активность модифициро-
моно-, ди- и трикатионных производных хлорина
ванных слоистых силикатов оказывает наиболь-
е6 получены модифицированные силикаты магния, в
шее влияние не количество катионных групп, вхо-
которых, по данным физико-химических методов ис-
дящих в состав молекулы производного хлорина
следования, неассоциированные моно-, ди- и три-
е6, а количество производных хлорина е6 в фото-
катионы производных хлорина е6 располагаются
активной форме. Максимальная эффективность
как на поверхности, так и в межслоевом простран-
фотосенсибилизации достигается при количествах
стве частиц силиката магния. Увеличение коли-
соединений 1-3 в модифицированном образце по-
чества вводимых производных хлорина е6 до 17-
рядка 4-8 мкмоль на 1 г силиката магния.
35 мкмоль на 1 г силиката приводит к их ассоциа-
ции в модифицированных образцах.
Фотохимическую активность модифицирован-
ных образцов силиката магния исследовали так-
В модифицированных образцах силиката маг-
же при сенсибилизированном окислении 1, 2-фе-
ния возникают как ионные химические связи меж-
нилендиамина пероксидом водорода. Образцы
ду отрицательно заряженным магний-силикатным
с одинаковыми количествами соединений
1-3
слоем и катионами производных хлорина е6, так и
демонстрируют фотохимическую активность, со-
электростатические взаимодействия между протони-
поставимую с максимальным значением, харак-
рованными внутрициклическими атомами азота про-
терным для модифицированного монокатионным
изводных хлорина е6 и ионизированными гидроксиль-
производным хлорина е6 1 образца силиката маг-
ными группами силиката магния.
ния (рис. 5, 1). В присутствии образцов силиката
Модифицированные катионными производны-
магния, модифицированных соединением 2 в ко-
ми хлорина е6 силикаты магния проявляют фото-
личестве 4-8 мкмоль на 1 г силиката, наблюдается
химическую активность в отношении 1,3-дифе-
существенное возрастание скорости окисления
нилизобензофурана, селективно окисляющегося
1, 2-фенилендиамина (рис. 6).
синглетным кислородом, и 1,2-фенилендиамина,
Таким образом, методом термообработки с ис-
окисляющегося пероксидом водорода. Фотохими-
пользованием разбавленных водных растворов
ческая активность катионных производных хло-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
634
ЛОУХИНА и др.
рина е6 в составе модифицированного слоисто-
30 с на ультразвуковом диспергаторе МЭФ 93.1
го силиката магния сопоставима, а оптимальное
(мощность 600 Вт, частота 22 кГц, интенсивность
значение фотохимической активности достигает-
ультразвукового воздействия до 250 Вт/см2).
ся при концентрации производных хлорина е6 4-
Квалификация исходных реактивов, использо-
8 мкмоль на 1 г силиката.
вавшихся в работе, не ниже ч.д.а.
Снижение фотохимической активности и ин-
Синтез слоистого силиката магния проводили
тенсивности флуоресценции в модифицированных
по методике, представленной в работе [40]. По ре-
образцах с высокой долей производных хлорина
зультатам термогравиметрического анализа, коли-
е6 (17-35 мкмоль на 1 г силиката) обусловлено их
чество адсорбированной воды в слоистом силика-
агрегацией, что приводит к дезактивации возбуж-
те магния 12.87 %.
денных состояний и к снижению эффективности
(17S)-2,7,12,18-Тетраметил-15-(метоксикар-
переноса энергии/электрона с фотовозбужденных
бонилметил)-17-[2-(метоксикарбонил)этил]-
молекул производных хлорина е6.
13-{N-[2-(триметиламмонио)этил]карбамoил}-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3-этенил-8-этилхлориниодид (1), (17S)-3-[(3E,Z)-
бис(1,4-триметиламмонио)бут-2-ен-2-ил]-
Рентгенофазовый анализ порошкообразных
2,7,12,18-тетраметил-13-(N-метилакарбамо-
образцов проводили на дифрактометре Shimadzu
ил)-15-(метоксикарбонилметил)-17-[2-(меток-
XRD-6000 (излучение CuKα, область углов 2θ
сикарбонил)этил]-8-этилхлориндииодид
(2),
2-70°, скорость съемки 1 град/мин). Электронные
(17S)-3-[(3E,Z)-бис(1,4-триметиламмонио)-
спектры поглощения записывали на спектроме-
бут-2-ен-2-ил]-2,7,12,18-тетраметил-15-(меток-
тре Shimadzu UV-1700 (PharmaSpec) в дистилли-
сикарбонилметил)-17-[2-(метоксикарбонил)-
рованной воде (модифицированные образцы) и в
этил]-13-{N-[2-(триметиламмонио)этил]карбамо-
этаноле (соединения 1-3) в области 300-900 нм
ил}-8-этилхлоринтрииодид (3) получены согласно
в кварцевых кюветах шириной 10 мм, в кювете
приведенным методикам [41-43] соответственно.
сравнения - дистиллированная вода (модифици-
рованные образцы) и этанол (соединения 1-3).
Модифицированные соединением 1 образ-
цы силиката магния (1.1, 1.2, 1.3, 1.4, 1.5, 1.6)
Гидродинамический диаметр и электрокине-
получены при введении в силикат магния соответ-
тический потенциал частиц определяли методами
динамического рассеяния света и лазерного допле-
ственно 1.4, 2.1, 4.2, 8.5, 17.1, 34.6 мкмоль соеди-
ровского электрофореза соответственно с исполь-
нения 1 на 1 г силиката (первая цифра обозначает
соединение 1, вторая цифра - порядковый номер
зованием лазерного анализатора ZetaSizerNano ZS
(Malvern Instruments). Источник излучения - лазер
образца, соответствующий постепенному возрас-
He-Ne с длиной волны излучения 633 нм и мощ-
танию количества введенного соединения 1). В
ностью 4 мВт. Измерения размеров и электрокине-
20 мл дистиллированной воды вносили 0.0120 г
тического потенциала частиц выполняли при зна-
(14 мкмоль) соединения 1 и получали исходный
чениях угла рассеяния света соответственно 173 и
раствор с концентрацией соединения 1 0.0006 г/мл.
13° при 25°C. Для каждого образца выполняли не
Образец 1.1. К 0.4 мл исходного раствора со-
менее трех повторных измерений. Для измерений
единения 1 с концентрацией 0.0006 г/мл добав-
использовали U-образные капиллярные поликар-
ляли 22.2 мл дистиллированной воды и получали
бонатные кюветы с позолоченными электродами
22.6 мл рабочего раствора. В 20 мл дистиллиро-
DTS1070 (Malvern Instruments).
ванной воды при интенсивном перемешивании
Стационарные спектры флуоресценции образ-
вносили 0.2257 г силиката магния (0.2000 г в пе-
цов регистрировали на люминесцентном спектро-
ресчете на безводный силикат магния) и переме-
метре Perkin Elmer LS-50 в кварцевых кюветах с
шивали 1 ч (25±3°С). Золь слоистого силиката
длиной оптического пути 10 мм при комнатной
магния нагревали (100±3°С) и по каплям в течение
температуре. Длина волны возбуждения флуорес-
не менее 5 ч вводили 22.6 мл рабочего раствора
ценции 405 нм. Предварительно проводили ульт-
соединения 1. Реакцию продолжали непрерывно
развуковое диспергирование образцов в течение
24 ч при интенсивном перемешивании и нагре-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ФОТОКАТАЛИТИЧЕСКИЕ СВОЙСТВА
635
вании. Полученный модифицированный образец
7.6 мл рабочего раствора соединения 3. В 20 мл
силиката подвергали лиофильной сушке, после
дистиллированной воды при интенсивном пере-
чего отмывали водой до отрицательной реакции с
мешивании вносили 0.2257 г слоистого силиката
AgNO3, центрифугировали и снова подвергали ли-
магния (0.2000 г в пересчете на безводный силикат
офильной сушке. Аналогично получали образцы
магния) и перемешивали 1 ч (25±3°С). Затем золь
1.2-1.6.
слоистого силиката магния нагревали (100±3°С)
и по каплям в течение не менее 5 ч вводили
Модифицированные соединением 2 образцы
7.6 мл рабочего раствора соединения 3. Реакция
силиката магния (2.1, 2.2, 2.3, 2.4, 2.5, 2.6) полу-
продолжалась непрерывно 24 ч при интенсивном
чены введением в силикат магния соответствен-
перемешивании и нагревании. Полученный моди-
но1.4, 2.1, 4.2, 8.5, 17.1, 34.6 мкмоль соединения 2
фицированный образец силиката магния подверга-
в расчете на 1 г силиката (первая цифра обозначает
ли лиофильной сушке, после чего отмывали водой
соединение 2, вторая цифра - порядковый номер
до отрицательной реакции с AgNO3, центрифу-
образца). В 150 мл дистиллированной воды вноси-
гировали и снова подвергали лиофильной сушке.
ли 0.0170 г (16 мкмоль) соединения 2 и получали
Аналогично получали образцы 3.2-3.6.
исходный раствор с концентрацией соединения 2
0.0001 г/мл.
Фотохимическая активность образцов си-
ликата магния, модифицированных соеди-
Образец 2.1. К 2.6 мл исходного раствора со-
нениями 1-3. В качестве восстановителей при
единения 2 с концентрацией 0.0001 г/мл добав-
исследовании фотохимической активности моди-
ляли 16.3 мл дистиллированной воды и получали
фицированных образцов выбраны 1,3-дифенили-
18.9 мл рабочего раствора. В 20 мл дистиллирован-
зобензофуран (Acros Organics) и 1,2-фениленди-
ной воды при интенсивном перемешивании вноси-
амин (Merck). Ультразвуковое диспергирование
ли 0.2257 г слоистого силиката магния (0.2000 г в
навесок образцов проводили в дистиллированной
пересчете на безводный силикат магния) и пере-
воде в присутствии восстановителей на ультразву-
мешивали 1 ч (25±3°С). Затем золь слоистого си-
ковом диспергаторе МЭФ 93.1 в течение 30 с при
ликата магния нагревали (100±3°С) и по каплям
мощности 600 Вт и частоте 22 кГц. Облучение
в течение не менее 5 ч вводили 18.9 мл рабочего
суспензий производили в кварцевых кюветах ши-
раствора соединения 2. Реакция продолжалась не-
риной 10 мм при непрерывном перемешивании.
прерывно 24 ч при интенсивном перемешивании
Источник излучения - галогенная лампа мощно-
и нагревании. Полученный модифицированный
стью 150 Вт с оранжевым светофильтром ОС-13
образец силиката магния подвергали лиофильной
(λ > 600 нм). Мощность светового потока 10 мВт/см2.
сушке, после чего отмывали водой до отрицатель-
Оптическую плотность образцов в процессе облу-
ной реакции с AgNO3, центрифугировали и снова
чения регистрировали на длине волны максимума
подвергали лиофильной сушке. Аналогично полу-
поглощения восстановителя (415 нм для 1,3-дифе-
чали образцы 2.2-2.6.
нилизобензофурана и 450 нм для 1,2-фениленди-
Модифицированные соединением 3 образцы
амина) на спектрофотометре Hach DR 4000V. Все
силиката магния (3.1, 3.2, 3.3, 3.4, 3.5, 3.6) полу-
измерения производили при комнатной температу-
чали ведением в силикат магния соответственно
ре в насыщенных воздухом суспензиях.
1.4, 2.1, 4.2, 8.5, 17.1, 34.6 мкмоль соединения 3 в
расчете на 1 г силиката (первая цифра обозначает
ФОНДОВАЯ ПОДДЕРЖКА
соединение 3, вторая цифра - порядковый номер
Работа выполнена в рамках государствен-
образца). В 40 мл дистиллированной воды вноси-
ных заданий Министерства науки и высше-
ли 0.0200 г (16 мкмоль) соединения 3 и получали
го образования Российской Федерации (тема
исходный раствор с концентрацией соединения 3
0082-2018-0006,
регистрационный
номер
0.0005 г/мл.
№ АААА-А18-118020890097-1; тема
0412-
Образец 3.1. К 0.7 мл исходного раствора со-
2019-0012, регистрационный номер
№ ААА-
единения 3 с концентрацией 0.0005 г/мл добав-
А-А18-118020690233-5) с использованием обо-
ляли 6.9 мл дистиллированной воды и получали
рудования Центра коллективного пользования
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
636
ЛОУХИНА и др.
«Химия» Института химии Коми научного центра
15.
Marin M.L., Santos-Juanes L., Arques A., Amat A.M.,
Уральского отделения РАН.
Miranda M.A. // Chem. Rev. 2012. Vol. 112. N 3.
P. 1710. doi 10.1021/cr2000543
КОНФЛИКТ ИНТЕРЕСОВ
16.
Nowakowska M., Szczubiałka K. // Polym. Degrad.
Stab. 2017. Vol. 145. P. 120. doi 10.1016/j.
Авторы заявляют об отсутствии конфликта
polymdegradstab.2017.05.021
интересов.
17.
Ussia M., Urso M., Miritello M., Bruno E., Curcuruto G.,
СПИСОК ЛИТЕРАТУРЫ
Vitalini D., Condorelli G.G., Cantarella M., Privitera V.,
Carroccio S.C. // RSC Adv. 2019. Vol. 9. P. 30182. doi
1.
Abrahamse H., Hamblin M.R. // Biochem. J. 2016.
10.1039/c9ra06328e
Vol. 473. P. 347. doi 10.1042/BJ20150942
18.
Regulska E., Rivera-Nazario D.M., Karpinska J.,
2.
Kwiatkowski S., Knap B., Przystupski D., Saczko J.,
Plonska-Brzezinska M.E., Echegoyen L. // Molecules.
Kędzierska E., Knap-Czop K., Kotlińska J., Michel O.,
2019. Vol. 24. N 6. P. 1118. doi 10.3390/
Kotowski K., Kulbacka J. // Biomed. Pharmacother.
molecules24061118
2018. Vol.
106. P.
1098. doi
10.1016/j.
19.
Giannoudis E., Benazzi E., Karlsson J., Copley G.,
biopha.2018.07.049
Panagiotakis S., Landrou G., Angaridis, P., Nikolaou V.,
3.
McFarland S.A., Mandel A., Dumoulin-White R.,
Matthaiaki C., Charalambidis G., Gibson E.A.,
Gasser G. // Curr. Opin. Chem. Biol. 2020. Vol. 56.
Coutsolelos A.G. // Inorg. Chem. 2020. Vol. 59. N 3.
P. 23. doi 10.1016/j.cbpa.2019.10.004
P. 1611. doi 10.1021/acs.inorgchem.9b01838
4.
Wozniak A., Grinholc M. // Front. Microbiol. 2018.
20.
Ladomenou K., Natali M., Iengo E., Charalampidis G.,
Vol. 9. P. 930. doi 10.3389/fmicb.2018.00930
Scandola F., Coutsolelos A.G. // Coord. Chem. Rev.
5.
Soares J.M., Corrêa T.Q., Inada N.M., Bagnato V.S.,
2015. Vol. 304-305. P. 38. doi 10.1016/j.ccr.2014.10.001
Blanco K.C. // J. Pharm. Pharmacol. 2018. Vol. 6.
21.
Nadeem S., Mumtaz A., Mumtaz M., Mutalib M.I.A.,
P. 863. doi 10.17265/2328-2150/2018.09.009
Shaharun M.S., Abdullah B. // J. Mol. Liq. 2018.
6.
Moura N.M.M., Esteves M., Vieira C., Rocha G.M.S.R.O.,
Faustino M.A.F., Almeida A., Cavaleiro J.A.S., Lodeiro C.,
Vol. 272. P. 656. doi 10.1016/j.molliq.2018.09.077
Neves M.G.P.M.S. // Dyes Pigm. 2019. Vol. 160. P. 361.
22.
Amao Y., Kataoka R. // Catal. Today. 2018. Vol. 307.
P. 243. doi 10.1016/j.cattod.2017.12.029
doi 10.1016/j.dyepig.2018.06.048
7.
Sobotta L., Sniechowska J., Ziental D., Dlugaszewska J.,
23.
Tatsumi D., Tsukamoto T., Honna R., Hoshino S.,
Potrzebowski M.J. // Dyes Pigm. 2019. Vol. 160. P. 292.
Shimada T., Takagi S. // Chem. Lett. 2017. Vol. 46.
doi 10.1016/j.dyepig.2018.08.004
P. 1311. doi 10.1246/cl.170521
8.
Demel J., Lang K. // Eur. J. Inorg. Chem. 2012. P. 5154.
24.
Teramura K., Tsuneoka H., Ogura K., Sugimoto T.,
doi 10.1002/ejic.201200400
Shishido T., Tanaka T. // ChemCatChem. 2014. Vol. 6.
9.
Walter M.G., Rudine A.B., Wamser C.C. // J. Porphyrins
P. 2276. doi 10.1002/cctc.201402131
Phthalocyanines. 2010. Vol. 14. P. 759. doi 10.1142/
25.
Гуринович Г.П., Севченко А.Н., Соловьев К.Н. //
S1088424610002689
Усп. физ. наук. 1963. Т. 79. № 2. С.173. doi 10.3367/
10.
Urbani M., Grätzel M., Nazeeruddin M.K., Torres T. //
UFNr.0079.196302a.0173
Chem. Rev. 2014. Vol. 114. N 24. P. 12330. doi 10.1021/
26.
Takagi S., Shimada T., Ishida Y., Fujimura T., Masui D.,
cr5001964
Tachibana H., Eguchi M., Inoue H. // Langmuir. 2013.
11.
Calmeiro J.M.D., Gira G., Ferraz F.M., Fernandes S.R.G.,
Vol. 29. P. 2108. doi 10.1021/la3034808
Pinto A.L., Lourenço L.M.O., Tome J.P.C., Perei-
27.
Градова М.А., Осташевская И.И., Градов О.В., Ло-
ra C.C.L. // Dyes Pigm. 2020. Vol. 177. P. 108280. doi
банов А.В., Иванов В.Б. // Макрогетероциклы. 2018.
10.1016/j.dyepig.2020.108280
Т. 11. № 4. С. 404; Gradova M.A., Ostashevskaya I.I.,
12.
Matsuo Y., Ogumi K., Jeon I.J., Wang H., Nakagawa T. //
Gradov O.V., Lobanov A.V., Ivanov V.B. / /
RSC Adv. 2020. Vol. 10. P. 32678. doi 10.1039/
Macroheterocycles. 2018. Vol. 11. N 4. P. 404. doi
d0ra03234d
10.6060/mhc181001g
13.
Mathew S., Yella A., Gao P., Humphry-Baker R.,
28.
Dhital B., Vishal G.R., Lu H.P. // Phys. Chem.
Curchod B.F., Ashari-Astani N., Tavernelli I.,
Chem. Phys. 2017. Vol. 19. P. 17216. doi 10.1039/
Rothlisberger U., Nazeeruddin M.K., Grätzel M. // Nat.
C7CP01476G
Chem. 2014. Vol. 6. P. 242. doi 10.1038/NCHEM.1861
29.
Won D.-I., Lee J.-S., Ba Q., Cho Y.-J., Cheong H.-Y.,
14.
Park J.M., Lee J.H., Jang W.-D. // Coord. Chem.
Choi S., Kim C.H., Son H.-J., Pac C., Kang S.O. //
Rev. 2020. Vol. 407. P. 213157. doi 10.1016/j.
ACS Catal. 2018. Vol. 8. P. 1018. doi 10.1021/
ccr.2019.213157
acscatal.7b02961
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ И ФОТОКАТАЛИТИЧЕСКИЕ СВОЙСТВА
637
30. Eguchi M., Shimada T., Inoue H., Takagi S. // J. Phys.
38. He H., Frost R.L., Bostrom T., Yuan P. Duong L., Yang D.,
Chem. (C). 2016. Vol. 120. N 13. P. 7428. doi 10.1021/
Xi Y., Kloprogge J.T. // Appl. Clay. Sci. 2006. Vol. 31.
acs.jpcc.6b01211
P. 262. doi 10.1016/j.clay.2005.10.011
31. Tokieda D., Tsukamoto T., Ishida Y., Ichihara H.,
39. Carrado K.A., Winans R.E. // Chem. Mater. 1990.
Shimada T., Takagi S. // J. Photochem. Photobiol.
Vol. 2. N 3. P. 328. doi 10.1021/cm00009a027
(A). 2017. Vol. 339. P. 67. doi 10.1016/j.
40. Лоухина И.В., Худяева И.С., Бугаева А.Ю.,
jphotochem.2017.01.013
Белых Д.В. // Бутлеровск. сообщ. 2019. Т. 58. № 4.
32. Грим Р.Е. Минералогия глин. М.: ИЛ, 1956. 454 с.
С. 34. doi 10.37952/ROI-jbc-01/19-58-4-34
33. Тарасевич Ю.И. Строение и химия поверхности сло-
41. Гущина О.И., Ларкина Е.А., Миронов А.Ф. // Макро-
истых силикатов. Киев: Наукова думка, 1988. 248 с.
гетороциклы. 2014. Т. 7. № 4. С. 414; Gushchina O.I.,
34. Belykh D., Loukhina I., Mikhaylov V., Khudyaeva I. //
Larkina E.A., Mironov A.F. // Macroheterocycles. 2014.
Chem. Pap. 2020. doi 10.1007/s11696-020-01421-w
Vol. 7. N 4. P. 414. doi 10.6060/mhc140931g
35. Ogawa M., Matsutomo T., Okada T. // J. Ceram. Soc.
42. Тарабукина И.С., Старцева О.М., Патов С.А.,
Japan. 2008. Vol. 116. N 12. P. 1309. doi 10.2109/
Белых Д.В. // Макрогетероциклы. 2015. Т. 8. № 2.
jcersj2.116.1309
С. 168; Tarabukina I.S., Startseva O.M., Patov S.A.,
36. Лоухина И.В., Худяева И.С., Бугаева А.Ю., Дуд-
Belykh D.V. // Macroheterocycles. 2015. Vol. 8. N 2.
кин Б.Н., Белых Д.В. // ЖОХ. 2017. Т. 87. Вып. 5.
P. 168. doi 10.6060/mhc150456b
С. 718; Loukhina I.V., Khudyaeva I.S., Bugaeva A.Yu.,
43. Венедиктов Е.А., Туликова Е.Ю., Рожкова Е.П., Ху-
Dudkin B.N., Belykh D.V. // Russ. J. Gen. Chem. 2017.
дяева И.С., Белых Д.В., Березин Д.Б. // Макрогете-
Vol. 87. N 5. P. 912. doi 10.1134/S1070363217050036
роциклы. 2017. Т. 10. № 3. С. 295; Venediktov E.A.,
37. Fujimura T., Shimada T., Hamatani S., Onodera S.,
Tulikova E.Yu., Rozhkova E.P., Khudyaeva I.S., Be-
Sasai R., Inoue H., Takagi S. // Langmuir. 2013. Vol. 29.
lykh D.V., Berezin D.B. // Macroheterocycles. 2017.
N 16. P. 5060. doi 10.1021/la4003737
Vol. 10. N 3. P. 295. doi 10.6060/mhc170404v
Synthesis and Photocatalytic Properties of Magnesium Silicate
Modified with Cationic Chlorin e6 Derivatives
I. V. Loukhinaa,*, M. A. Gradovab, I. S. Khudyaevaa, А.V. Lobanovb, and D. V. Belykha
а Institute of Chemistry of Komi Science Centre of the Ural Branch of the Russian Academy of Sciences,
Syktyvkar, 167000 Russia
b N.N. Semenov Federal Research Center for Chemical Physics, Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: loukhina@yandex.ru
Received February 3, 2021; revised February 3, 2021; accepted February 21, 2021
New organomodified magnesium silicates were synthesized in aqueous medium using mono-, di-, and tricationic
chlorin e6 derivatives and synthetic layered magnesium silicate. Magnesium silicates modified with mono-,
di- and tricationic chlorin e6 derivatives exhibit comparable photochemical activity both in 1,3-diphenylisoben-
zofuran photooxidation by singlet oxygen and in 1,2-phenylenediamine oxidatiojn by hydrogen peroxide. The
optimal photochemical activity of organomodified magnesium silicates is achieved at the content of chlorin e6
derivatives about 4-8 μmol per 1 g of magnesium silicate.
Keywords: cationic chlorin е6 derivatives, layered magnesium silicate, photocatalysts
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021