ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 643-648
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.327;547.512;542.943.5
ОДНОРЕАКТОРНЫЙ ОЗОНОЛИТИЧЕСКИЙ СИНТЕЗ
АЦИЛГИДРАЗОНОВ
ИЗ 1-МЕТИЛ-2,2-ДИХЛОР-1-ЭТЕНИЛЦИКЛОПРОПАНА
© 2021 г. Ю. В. Мясоедоваа,*, Л. Р. Гарифуллинаа, Г. З. Раскильдинаb,
С. С. Злотскийb, Г. Ю. Ишмуратовa
a Уфимский институт химии, Уфимский федеральный исследовательский центр Российской академии наук,
пр. Октября 71, Уфа, 450054 Россия
b Уфимский государственный нефтяной технический университет, Уфа, 450064 Россия
*e-mail: legostaevayuv@yandex.ru
Поступило в Редакцию 26 октября 2020 г.
После доработки 9 ноября 2020 г.
Принято к печати 17 ноября 2020 г.
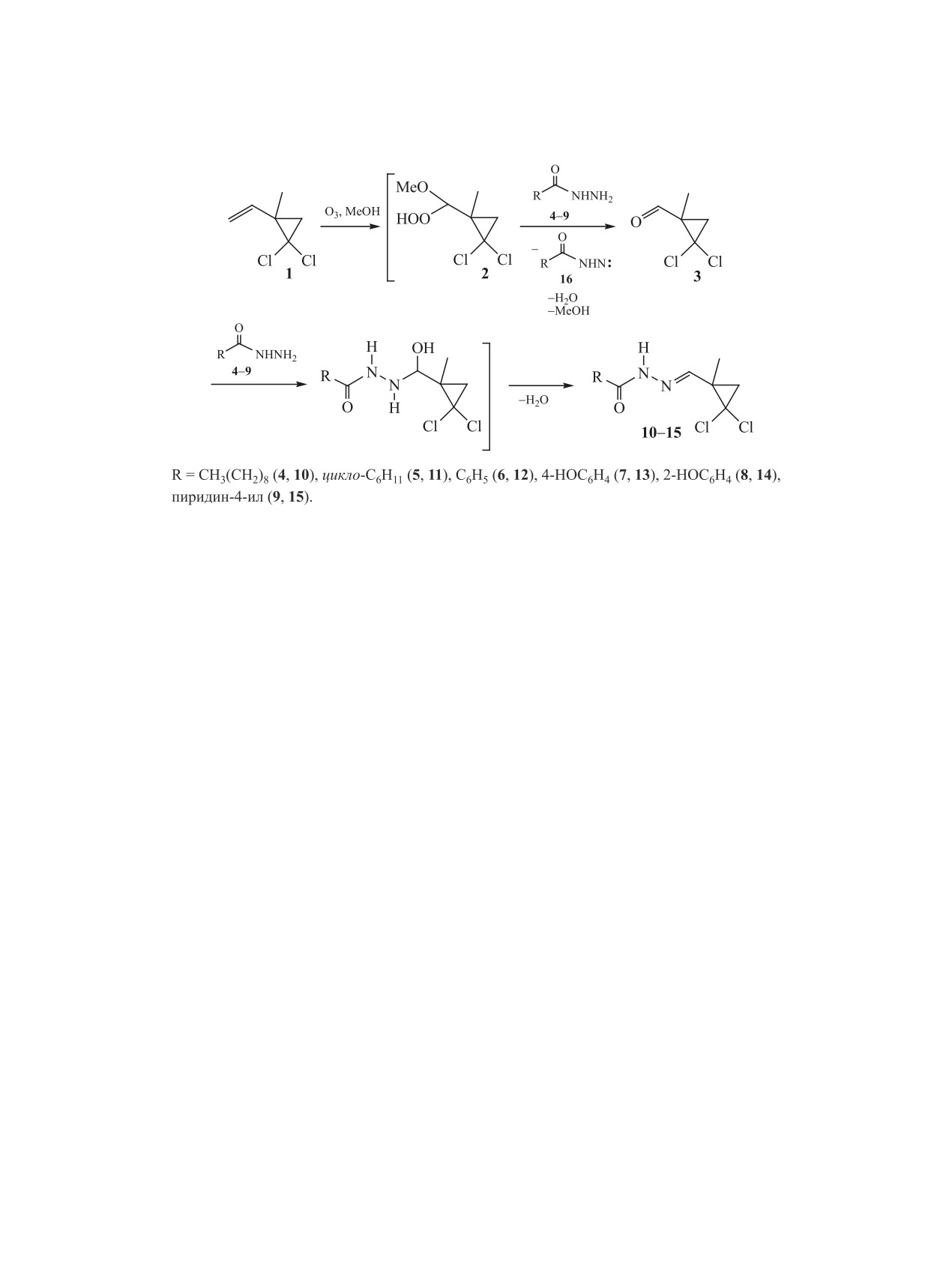
Предложен однореакторный синтез ацилгидразонов, основанный на озонолитическом расщеплении
1-метил-2,2-дихлор-1-этенилциклопропана в метаноле и обработке промежуточно образующихся пе-
роксидов двукратным избытком гидразидов ряда карбоновых кислот (декановой, циклогексановой,
изоникотиновой, бензойной, п- и о-гидроксибензойных кислот).
Ключевые слова: 1-метил-2,2-дихлор-1-этенилциклопропан, озонолиз-восстановление, гидразиды
карбоновых кислот, ацилгидразоны
DOI: 10.31857/S0044460X21040211
Синтез, изучение свойств и применение произ-
На большом количестве примеров показано,
водных циклопропана при получении гетеро-, кар-
что соединения с гидразоновым фрагментом об-
бо- и алициклических систем - одно из интенсивно
ладают различными видами биологической актив-
развивающихся направлений органической химии
ности [8, 9] и комплексообразующими свойствами
[1-3]. Соединения с гем-дихлорциклопропановым
[10]. Гидразоны обычно получают конденсацией
фрагментом используются в качестве субстратов
карбонильных соединений с гидразином или его
при синтезе веществ с различными полезными
производными в спиртовых растворителях в при-
свойствами: пестицидными, ростстимулирующи-
сутствии катализаторов [11]. Циклопропилгидра-
ми, фармакологическими [4]. Комплексные инги-
зоны получали с высокими выходами обработкой
биторы на основе аминов с гем-дихлорциклопро-
этанольного раствора циклопропилкетонов гидра-
пановым фрагментом обладают степенью защиты
зингидратом и BaO в качестве катализатора [12].
до 85-95% [5]. Производные гем-дигалогенци-
Гидразиды карбоновых кислот также вступа-
клопропана с алкенильным заместителем могут
ют в реакцию конденсации с карбонильными со-
служить мономерами и полупродуктами нефте-
единениями, приводя к ацилгидразонам, которые
химического синтеза [4, 6]. Сообщалось о синте-
в последнее время приобрели большое значение
зе циклопропилацилгидразонов, проявляющих
из-за разнообразных биологических свойств,
активность в отношении вируса простого герпеса
включая антибактериальную, противогрибковую,
(HSV-1) [7].
противосудорожную, противовоспалительную,
643
644
МЯСОЕДОВА и др.
Схема 1.
противомалярийную и противотуберкулезную ак-
при комнатной температуре, приводит к ацилги-
тивность [13, 14].
дразонам 10-15 с выходами от 63 до 81% (схема 1).
Относительно низкие выходы (63-69%) получены
Ранее было показано, что при использовании
в реакциях с аренкарбогидразидами 6-8, высокие
избытка гидразидов карбоновых кислот в качестве
(74-81%) - с гидразидами 4, 5 и 9.
восстановителей пероксидных продуктов озоноли-
за алкенов в некоторых случаях, преимущественно
В спектрах ЯМР 13С соединений 10-15 при-
при проведении реакций в метаноле, образуются
сутствуют сигналы, характерные для групп СH=N
ацилгидразоны [15]. В связи с этим нами разрабо-
(дублет в области 145-153 м. д.) и С=О (синглет
тан однореакторный синтез новых потенциально
при 162-176 м. д.). В спектрах ЯМР 1Н получен-
полезных соединений, сочетающих ацилгидразо-
ных соединений присутствует синглет протона
новый и дихлорциклопропановый фрагменты, из
группы СН=N при 7.0-7.5 м. д., а также уширен-
этенилциклопропана 1 с использованием метода
ный синглет протона группы NН в области 10-
озонолитического расщепления с применени-
12 м. д.
ем двукратного избытка гидразидов карбоновых
Два атома хлора в соединениях 1, 10-15 легко
кислот, различающихся строением, наличием и
детектируются в масс-спектрах по четкому три-
положением функциональных групп: декановой
плету пиков, отстоящих друг от друга на 2 а. е. м.
(4), циклогексанкарбоновой (5), бензойной (6),
Предполагаемый механизм протекающих ре-
п-гидрокси- (7) и о-гидрокси- (8) бензойных, а
акций представлен на схеме 1. На первом этапе
также изоникотиновой кислот 9 (схема 1).
при окислении озоном соединения 1 в метаноле
Стратегия синтеза ацилгидразонов заключа-
формируется метоксигидропероксид 2, который,
лась в низкотемпературном (-70°С) окислении
вступая в окислительно-восстановительную ре-
двойной связи
1-метил-2,2-дихлор-1-этенилци-
акцию с гидразидом соответствующей кислоты,
клопропана 1 озоном в метаноле и восстановлении
окисляет его, вероятно, до нитрена 16 [16], а сам
гидразидами 4-9 промежуточно образующегося
восстанавливается до альдегида 3. Нуклеофиль-
α-метоксигидропероксида 2 в 1-метил-2,2-дихлор-
ное присоединение гидразидов 4-9 к альдегиду
циклопропанкарбальдегид 3. Альдегид 3 из реак-
3 с последующей дегидратацией приводит к ги-
ционной смеси не выделяли; его конденсация с ги-
дразонам 10-15. Скорость обеих реакций (окис-
дразидами 4-9, протекающая при перемешивании
лительно-восстановительного взаимодействия с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
ОДНОРЕАКТОРНЫЙ ОЗОНОЛИТИЧЕСКИЙ СИНТЕЗ
645
пероксидом 2 и нуклеофильного присоединения
[М - Сl]+, 319 [М - Н]-. Найдено, %: С 56.20; Н
к промежуточному альдегиду 3) возрастает с уве-
8.23; N 9.05. С15Н26Cl2N2O. Вычислено, %: С
личением нуклеофильности незамещенного атома
56.07; Н 8.16; N 8.72.
азота гидразидов 4-9 в ряду: о-гидроксибензойной
N′-[(1-Метил-2,2-дихлорциклопропил)ме-
(8) < п-гидроксибензойной (7) < бензойной (6) <
тилиден]циклогексанкарбогидразид (11). При
циклогексанкарбоновойовой (5) < изоникотиновой
использовании гидразида циклогексанкарбоновой
(9) < декановой (4) кислот.
кислоты 5 (1.87 г) получили 1.35 г (74%) ацилги-
Таким образом, однореакторный синтез ацил-
дразона 11, т. пл. 76-77°С (CHCl3), Rf 0.51 (петро-
гидразонов озонолитическим расщеплением
лейный эфир-трет-бутилметиловый эфир, 1:1).
доступного
1-метил-2,2-дихлор-1-этенилцикло-
ИК спектр, ν, см-1: 3062 (NH), 1665 (С=N). Спектр
пропана в метаноле и использованием в качестве
ЯМР 1Н (CDCl3-MeOD), δ, м. д.: 1.20-1.35 м (5Н,
СН2), 1.38 с (3Н, СН3), 1.50-1.70 м (5Н, СН2), 1.73
реагента избытка гидразидов карбоновых кислот
может быть предложен для получения потенци-
д (1Н, С3Н2, J 7.4 Гц) 1.75 д (1Н, С3Н2, J 7.5 Гц),
2.85-2.95 м (1H, СН), 7.00 с (1H, СН=N), 10.10 уш.
ально полезных соединений с фрагментом 1-ме-
с (1H, NН). Спектр ЯМР 13С (CDCl3-MeOD), δС,
тил-2,2-дихлорциклопропана.
м. д.: 17.47 (СН3), 25.27 (2СН2), 25.66(СН2), 29.03
1-Метил-2,2-дихлор-1-этенилциклопропан
1
(2СН2), 31.62 (СН2), 32.40 (С), 43.49 (СН), 65.33
получали по известной методике [17].
(ССl2), 145.84 (СH=N), 173.66 (С=О). Масс-спектр,
Общая методика синтеза ацилгидразонов
m/z (Iотн, %): 277 (100), 279 (74), 281 (16) [М + Н]+,
10-15. Через раствор 1.0 г (6.6 ммоль) соедине-
241 (54) [М - Сl]+. Найдено, %: С 52.15; Н 6.72;
ния 1 в 20 мл МеОН при -70°С барботировали
N 10.03. С12Н18Cl2N2O. Вычислено, %: С 52.00; Н
озоно-кислородную смесь до появления голубого
6.55; N 10.11.
окрашивания. Реакционную смесь продували ар-
N′-[(1-Метил-2,2-дихлорциклопропил)мети-
гоном, при 0°С добавляли 13.2 ммоль гидразида
лиден]бензогидразид (12). При использовании ги-
соответствующей кислоты 4-9. Полученную смесь
дразида бензойной кислоты 6 (1.79) получили 1.16
перемешивали при комнатной температуре до ис-
г (69%) ацлгидразона 12, т. пл. 99-100°С (CHCl3),
чезновения перекисей (контроль - иод-крахмаль-
Rf 0.28 (петролейный эфир-трет-бутилметило-
ная проба). Реакционную смесь упаривали, оста-
вый эфир, 1:1). ИК спектр, ν, см-1: 3065 (NH), 1665
ток растворяли в CHCl3 (100 мл), промывали Н2О
(С=N). Спектр ЯМР 1Н (CDCl3-MeOD), δ, м. д.:
(до рН 7), сушили Na2SO4 и упаривали. Остаток
1.43 д (2Н, СН2, J 7.7 Гц), 1.48 с (3Н, СН3), 1.88 д
гидразида удаляли при кристаллизации продукта
(2Н, СН2, J 8.0 Гц), 7.30-7.35 м (1Н, СН), 7.38-7.45
реакции из трет-бутилметилового эфира.
м (2Н, СН), 7.55 с (1Н, СН=N), 7.80 д (2Н, СН,
N′-[(1-Метил-2,2-дихлорциклопропил)мети-
J 7.7 Гц), 11.25 уш. с (1Н, NН). Спектр ЯМР 13С
лиден]декангидразид (10). При использовании
(CDCl3-MeOD), δС, м. д.: 17.61 (СН3), 31.83 (СН2),
гидразида декановой кислоты 4 (2.45 г) получили
32.88 (С), 65.45 (ССl2), 128.47 (2СН), 128.81 (2СН),
1.70 г (81%) ацилгидразона 10, т. пл. 119-120°С
131.94 (СН), 132.58 (С), 151.86 (СH=N), 165.05
(CHCl3), Rf
0.5 (петролейный эфир-трет-бу-
(С=О). Масс-спектр, m/z (Iотн, %): 271 (10), 273
тилметиловый эфир, 1:1). ИК спектр, ν, см-1:
(60), 275 (12) [М + Н]+, 235 (45) [М - Сl]+. Найдено,
3060 (NH), 1663 (С=N). Спектр ЯМР 1Н (CDCl3-
%: С 53.20; Н 4.48; N 10.74. С12Н12Cl2N2O. Вычис-
MeOD), δ, м. д.: 0.65 с (3Н, СН3), 1.20 с (3Н, СН3),
лено, %: С 53.11; Н 4.46; N 10.33.
1.40-1.60 м (12Н, СН2), 1.65 д (2Н, С3Н2, J 7.3 Гц),
N′-[(1-Метил-2,2-дихлорциклопропил)ме-
2.05-2.15 м (2Н, СН2), 2.45-2.55 м (2Н, СН2), 7.10 с
тилиден]-4-гидроксибензогидразид
(13). При
(1Н, СН=N), 10.30 уш. с (1Н, NН). Спектр ЯМР 13С
использовании гидразида п-гидроксибензойной
(CDCl3-MeOD), δС, м. д.: 13.84 (СН3), 17.67 (СН3);
кислоты 7 (2.0 г) получили 1.25 г (66%) ацилги-
22.46, 24.69, 25.40, 29.04, 29.09, 29.16, 29.20, 29.27
дразона 13, вязкое вещество, Rf 0.65 (петролей-
(8СН2), 31.68 (СН2), 32.45 (С), 65.39 (ССl2), 146.11
ный эфир-трет-бутилметиловый эфир, 1:1). ИК
(СH=N), 176.79 (С=О). Масс-спектр, m/z (Iотн, %):
спектр, ν, см-1: 1662 (С=N), 3061 (NH). Спектр
321 (100), 323 (62), 325 (12) [М + Н]+, 285 (51)
ЯМР 1Н (CDCl3), δ, м. д.: 1.48 с (3Н, СН3), 1.88 д
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
646
МЯСОЕДОВА и др.
(1Н, СН2, J 2.0 Гц), 1.91 д (1Н, СН2, J 2.0 Гц), 3.75
270 (13) [М - Н]-, 236 (65) [М - Сl]+, 200 (62) [М -
уш. с (1Н, ОН), 6.90 д (2Н, СН, J 8.7 Гц), 7.75 с
Cl - НCl]+. Найдено, %: С 48.61; Н 4.12; N 15.51.
(1Н, СН=N), 7.85 д (2Н, СН, J 8.7 Гц), 9.25 уш. с
С11Н11Cl2N3O. Вычислено, %: С 48.55; Н 4.07; N
(1Н, NН). Спектр ЯМР 13С (CDCl3), δС, м. д.: 17.67
15.44.
(СН3), 31.78 (СН2), 32.52 (С), 65.45 (ССl2), 115.36
ИК спектры записывали на приборе IR
(2СН), 121.65 (С), 131.82 (2СН), 160.92 (СОН),
Prestige-21 Shimadzu в тонком слое. Спектры
164.27 (СH=N), 167.50 (С=О). Масс-спектр, m/z
ЯМР регистрировали на спектрометре Bruker
(Iотн, %): 287 [М + Н]+, 285 [М - Н]–. Найдено, %: С
Avance III 500 [рабочие частоты 500.13 МГц (1Н),
50.22; Н 4.26; N 9.88. С12Н12Cl2N2O2. Вычислено,
125.76 МГц (13С)], внутренний стандарт - ТМС.
%: С 50.19; Н 4.21; N 9.76.
ГЖХ-Анализ выполняли на приборе Chrom-5
N′-[(1-Метил-2,2-дихлорциклопропил)ме-
[длина колонки 1.2 м, неподвижная фаза - силикон
тилиден]-2-гидроксибензогидразид
(14). При
SE-30 (5%) на носителе Chromaton N-AW-DMCS
использовании гидразида о-гидроксибензойной
(0.16-0.20 мм), рабочая температура 50-300°С],
кислоты 8 (2.0 г) получили 1.20 г (63%) ацилги-
газ-носитель - гелий.Масс-спектры снимали на хро-
дразона 14, вязкое вещество, Rf 0.35 (петролей-
мато-масс-спектрометре LCMS-2010 EV Shimadzu
ный эфир-трет-бутилметиловый эфир, 1:1). ИК
(ввод образца шприцем, элюент - ацетонитрил-
спектр, ν, см-1: 3065 (NH), 1663 (С=N). Спектр
вода, 95:5, скорость потока - 0.1 мл/мин) в режиме
ЯМР 1Н (CDCl3), δ, м. д.: 1.43 с (3Н, СН3), 1.47
регистрации положительных и отрицательных ио-
д (1Н, СН2, J 8.8 Гц), 1.83 д (1Н, СН2, J 7.4 Гц),
нов при потенциале капилляра 4.5 и -3.5 кВ. Тем-
3.40 уш. с (1Н, ОН), 7.30-7.45 м (3Н, СН), 7.73 с
пература интерфейса APCI - 250°С, нагревателя -
(1Н, СН=N), 7.90 д (1Н, СН, J 7.6 Гц), 11.45 уш. с
200°С, испарителя - 230°С. Скорость потока не-
(1Н, NН). Спектр ЯМР 13С (CDCl3), δС, м. д.:
булизирующего (распыляющего) газа (азот)
-
17.75 (СН3), 31.99 (СН2), 32.73 (С), 65.44 (ССl2),
2.5 л/мин. Элементный анализ выполняли на
113.87 (С), 117.99 (СН), 119.03 (СН), 128.66 (СН),
134.40 (СН), 152.24 (СH=N), 160.86 (СОН), 164.89
CHNS-анализаторе Euro-3000 (Hekatech). Контроль
(С=О). Масс-спектр, m/z (Iотн, %): 287 [М + Н]+,
методом ТСХ проводили на SiO2 марки Sorbfil
285 [М - Н]-. Найдено, %: С 50.20; Н 4.19; N 9.81.
(Россия). Для колоночной хроматографии приме-
С12Н12Cl2N2O2. Вычислено, %: С 50.19; Н 4.21; N
няли SiO2 (70-230) марки Lancaster (Великобрита-
9.76.
ния). Производительность озонатора - 40 ммоль О3/ч.
N′-[(1-Метил-2,2-дихлорциклопропил)ме-
ФОНДОВАЯ ПОДДЕРЖКА
тилиден]пиридин-4-карбогидразид
(15). При
Работа выполнена при финансовой поддержке
использовании изониазида 9 (1.8 г) после коло-
Российской академии наук в рамках программы
ночной хроматографии на SiO2 (петролейный
«Фундаментальные основы химии» (тема № 8,
эфир-трет-бутилметиловый эфир,
5:1→2:1,
«Хемо-, регио- и стереоселективные превращения
трет-бутилметиловый эфир, СHCl3) выделили
терпеноидов, стероидов и липидов в направлен-
1.42 г (79%) гидразона 15, т. пл. 140°С (CHCl3), Rf
0.13 (петролейный эфир-трет-бутилметиловый
ном синтезе низкомолекулярных биорегуляторов»,
эфир, 1:1). ИК спектр, ν, см-1: 3061 (NH), 1662
№ госрегистрации AAAA-A20-120012090023-8) с
(С=N). Спектр ЯМР 1Н (CDCl3-MeOD), δ, м. д.:
использованием оборудования Центра коллектив-
1.45 с (3Н, СН3), 1.50 д (1Н, СН2, J 7.7 Гц), 1.85 д
ного пользования «Химия» Уфимского института
(1Н, СН2, J 7.4 Гц), 7.51 с (1Н, СН=N), 7.75 д (2Н,
химии РАН и Регионального центра коллективно-
СН, J 6.0 Гц), 8.55 д (2Н, СН, J 6.0 Гц), 11.85 уш.
го пользования «Агидель» Уфимского федераль-
с (1Н, NН). Спектр ЯМР 13С (CDCl3-MeOD), δС,
ного исследовательского центра РАН.
м. д.: 17.49 (СН3), 31.79 (СН2), 32.65 (С), 65.31
КОНФЛИКТ ИНТЕРЕСОВ
(ССl2), 121.81 (2СН), 140.66 (С), 149.53 (2СН),
153.66 (СH=N), 162.53 (С=О). Масс-спектр, m/z
Авторы заявляют об отсутствии конфликта
(Iотн, %): 272 (100), 274 (68), 276 (11) [М + Н]+,
интересов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
ОДНОРЕАКТОРНЫЙ ОЗОНОЛИТИЧЕСКИЙ СИНТЕЗ
647
СПИСОК ЛИТЕРАТУРЫ
10.
Коган В.А., Луков В.В., Щербаков И.Н. // Коорд.
хим. 2010. Т. 36. № 6. С. 403; Kogan V.A., Lukov V.V.,
1.
Анисимова Н.А., Беркова Г.А., Дейко Л.И. // ЖОХ.
Shcherbakov I.N. // Russ. J. Coord. Chem. 2010.
2002. Т. 72. Вып. 1. С. 86; Anisimova N.A., Berko-
Vol. 36. N 6. P. 401. doi 10.1134/S1070328410060011
va G.A., Deiko L.I. // Russ. J. Gen. Chem. 2002. Vol. 72.
N 1. P. 86. doi 10.1023/a:1015301513947
11.
Loncle C., Brunel J.M., Vidal N., Dherbomez M.,
Letourneux Y. // Eur. J. Med. Chem. 2004. Vol. 39.
2.
Казакова А.Н., Спирихин Л.В., Злотский С.С. //
ЖОХ. 2013. T. 83. Вып. 2. C. 294; Kazakova A.N.,
P. 1067. doi 10.1016/j.ejmech.2004.07.005
Spirikhin L.V., Zlotsky S.S. // Russ. J. Gen. Chem. 2013.
12.
Di Chenna P.H., Ferrara A., Ghini A.A., Burton G. // J.
Vol. 83. N 2. P. 348. doi 10.1134/s1070363213020187
Chem. Soc. Perkin Trans. 1. 2002. P. 227. doi 10.1039/
3.
Талибов Г.М. // ЖОрХ. 2018. Т. 54. Вып. 8. С. 1242;
b107258g
Talybov G.M. // Russ. J. Org. Chem. 2018. Vol. 54. N 8.
13.
Popiolek L. // Med. Chem. Res. 2017. Vol. 26. Р. 287.
P. 1256. doi 10.1134/S1070428018080225
doi 10.1007/s00044-016-1756-y
4.
Клеттер Е.А., Козырева Ю.П., Кутуков Д.И., Злот-
14.
Mohareb R.M., Fleita D.H., Sakka O.K. // Molecules.
ский С.С. // Нефтехимия. 2010. Т. 50. Вып. 1. С. 66;
2011. N 16. P. 16. doi 10.3390/molecules16010016
Kletter E.A., Kozyreva Yu.P., Kutukov D.I., Zlotskii S.S. //
15.
Легостаева Ю.В., Гарифуллина Л.Р., Назаров И.С.,
Petrol. Chem. 2010. Vol. 50. N 1. P. 65. doi 10.1134/
Кравченко А.А., Ишмуратова Н.М., Ишмура-
S0965544110010093
тов Г.Ю. // ХПС. 2017. Вып. 5. С. 758; Legostae-
5.
Раскильдина Г.З., Султанова Р.М., Злотский С.С. //
va Yu.V., Garifullina L.R., Nazarov I.S., Kravchen-
Изв. Уфимск. научн. центра РАН. 2019. Вып. 3. С. 5.
ko A.A., Ishmuratova N.M., Ishmuratov G.Yu. // Chem.
6.
Копсов С.В., Злотский С.С. // ЖПХ. 2008. Т. 81.
Nat. Compd. 2017. Vol. 53. N 5. P. 891. doi 10.1007/
Вып. 3. С. 490; Kopsov S.V., Zlotskii S.S. // Russ. J.
s10600-017-2149-2
App. Chem. 2008. Vol. 81. N 3. P. 475. doi 10.1134/
S1070427208030269
16.
Мясоедова Ю.В., Гарифуллина Л.Р., Нуриева Э.Р.,
Ишмуратова Н.М., Ишмуратов Г.Ю. // ХПС. 2020.
7.
McNulty J., Babu Dokuburra C., D’Aiuto L., Demers M.,
Вып 2. С. 227; Myasoedova Yu.V., Garifullina L.R.,
McClain L., Piazza P., Williamson K., Zheng W.,
Nimgaonkar V.L. // Bioorg. Med. Chem. Lett. 2020. doi
Nurieva E.R., Ishmuratova N.M., Ishmuratov G.Yu. //
10.1016/j.bmcl.2020.127559
Chem. Nat. Compd. 2020. Vol. 56. N 2. P. 259. doi
10.1007/s10600-020-03002-5
8.
Verma G., Marella A., Shaquiquzzaman M., Akhtar M.,
Ali M.R., Alam M.M. // J. Pharm. Bioallied Sci. 2014.
17.
Раскильдина Г.З., Борисова Ю.Г., Яныбин В.М.,
Vol. 6. N 2. P. 69. doi 10.4103/0975-7406.129170
Злотский С.С. // Нефтехимия. 2017. Т. 57. Вып. 2.
9.
Khan M.S., Siddiqui S.P., Tarannum N. // Hygeia:
С. 220; Raskil’dina G.Z., Borisova Yu.G., Yanybin V.M.,
J. Drugs Med. 2017. Vol. 9. N 1. P. 61. doi
Zlotskii S.S. // Petrol. Chem. 2017. Vol. 57. N 3. P. 278.
10.15254/H.J.D.Med.9.2017.165
doi 10.7868/S0028242117020149
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
648
МЯСОЕДОВА и др.
One-Pot Ozonolytic Synthesis of Acylhydrazones
from 1,1-Dichloro-2-ethenyl-2-methylcyclopropane
Yu. V. Myasoedovaa,*, L. R. Garifullinaa, G. Z. Raskil’dinab,
S. S. Zlotskiib, and G. Yu. Ishmuratova
a Ufa Institute of Chemistry, Ufa Research Center of the Russian Academy of Sciences, Ufa, 450054 Russia
b Ufa State Petroleum Technological University, Ufa, 450062 Russia
*e-mail: legostaevayuv@yandex.ru
Received October 26, 2020; revised November 9, 2020; accepted November 17, 2020
A one-pot ozonolytic synthesis of acylhydrazones from 1,1-dichloro-2-ethenyl-2-methylcyclopropane was
proposed based on ozonolytic cleavage of the substrate in methanol and the treatment of intermediate peroxides
with a two-fold excess of hydrazides of capric, cyclohexanoic, isonicotinic, benzoic, para- and ortho-hydroxy-
benzoic acids.
Keywords: 1,1-dichloro-2-ethenyl-2-methylcyclopropane, ozonolysis, reduction, carboxylic acid hydrazides,
acylhydrazones
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021