ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 4, с. 653-656
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.241
СИНТЕЗ 2,3,5,6-ТЕТРАКИС(ДИФЕНИЛФОСФИНИЛ)-
ПИРИДИНА - N,O-ДОНОРНОГО ЛИГАНДА
НОВОГО ТИПА С НЕОБЫЧНЫМИ
КОМПЛЕКСООБРАЗУЮЩИМИ СВОЙСТВАМИ
О. И. Артюшин, А. В. Вологжанина, В. К. Брель*
Институт элементоорганических соединений имени А. Н. Несмеянова Российской академии наук,
ул. Вавилова 28, Москва, 119991 Россия
*e-mail: v_brel@mail.ru
Поступило в Редакцию 23 октября 2020 г.
После доработки 1 ноября 2020 г.
Принято к печати 11 ноября 2020 г.
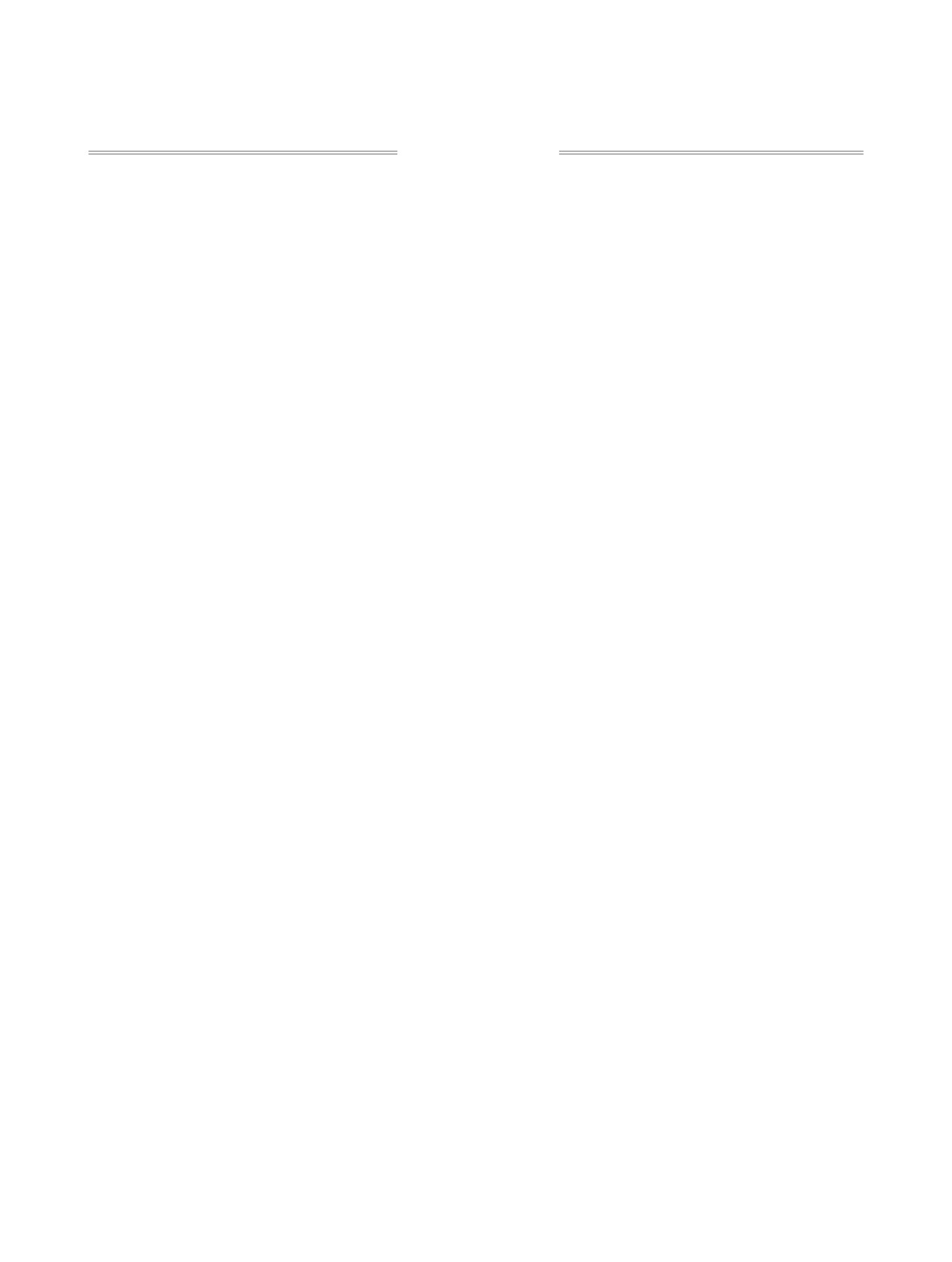
Разработан простой и эффективный метод синтеза нового N,O-донорного лиганда - 1,2,4,5-тетра(дифе-
нилфосфинил)пиридина, и изучены его коплексообразующие свойства с нитратом уранила. Строение
комплекса установлено методом рентгеноструктурного анализа.
Ключевые слова: синтез лигандов, комплексообразование, N,O-донорные лиганды, рентгеноструктур-
ный анализ
DOI: 10.31857/S0044460X21040235
N,O-Донорные лиганды, основу которых со-
и лантаноидов из азотнокислых растворов [4]. В
ставляют N-содержащие гетероциклические сое-
настоящей работе нами синтезирован новый пред-
динения (пиридины, триазины, триазолы, тетраз-
ставитель N,O-донорных лигандов - 2,3,5,6-тетра-
олы и т. д.) с привитыми к ним карбонильными и,
кис(дифенилфосфинил)пиридин 1, и показано, что
особенно, фосфорильными группами, в настоящее
при комплексообразовании с уранилнитратом он
время широко применяются для разделения акти-
ведет себя необычным образом, давая комплекс 3
нидов и лантанидов при переработке отработанно-
островного димерного строения (схема 1).
го ядерного топлива [1]. Особый интерес среди них
Синтез соединения 1 осуществлен разработан-
на сегодняшний момент представляют 2,6-бис(ди-
ным нами методом, исходя из 2,3,5,6-тетрафтор-
фенилфосфинил)пиридин и его ближайшие ана-
пиридина, при этом в качестве промежуточного
логи, которые проявили уникально высокую Am/
продукта был получен 2,3,5,6-тетракис(дифенил-
Cm селективность [2]. Вместе с тем, синтез подоб-
фосфино)пиридин 2, представляющий самостоя-
ных соединений весьма непрост и предполагает
тельный интерес.
использование палладий-катализируемого кросс-
Для подтверждения состава и определения
сочетания [3].
строения комплекса 3 медленной кристаллизаци-
Ранее нами был разработан простой и эффектив-
ей из смеси CHCl3-MeCN были получены моно-
ный метод синтеза 1,2,4,5-тетракис(дифенилфос-
кристаллы, пригодные для рентгеноструктурного
финил)бензола, проявившего высокую экстракци-
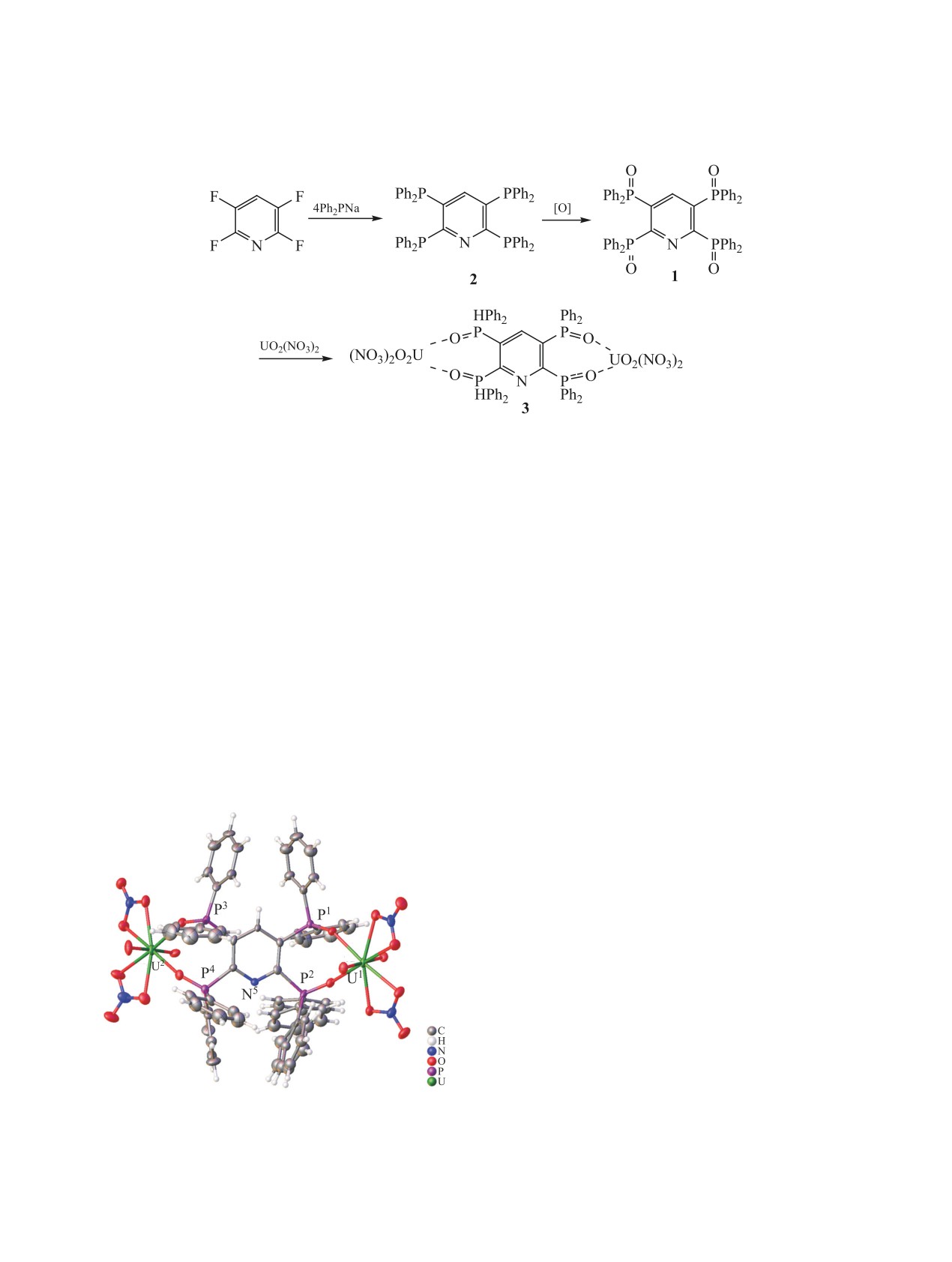
анализа (см. рисунок). Кристаллы, полученные на
онную способность при извлечении актиноидов
границе двух фаз, содержат комплекс состава
653
654
АРТЮШИН и др.
Схема 1.
[(UO2)2(tpp)(NO3)4] и молекулы обоих растворите-
13.4(2)°]. Комплекс имеет островное димерное
лей. Молекула tpp является тетрадентатным мости-
строение. Соседние фосфорильные группы распо-
ково-хелатным лигандом между двумя катионами
ложены по одну сторону относительно плоскости
уранила, при этом в образовании координационных
пиридильного фрагмента, а противолежащие -
по разные стороны. Экваториальные плоскости
связей участвуют все атомы кислорода, но не атом
координационных полиэдров расположены под
азота. Нитрат-анионы являются бидентатно-хелат-
углами 49(1) и 50(2)° к плоскости, образованной
ными лигандами по отношению к катиону, так что
четырьмя атомами фосфора и пиридином. Можно
атомы урана(VI) имеют координационное число 8,
предположить, что конформация комплекса стаби-
а координационный полиэдр UVIO8 имеет форму
лизирована контактами C-H···π и π···π с участи-
гексагональной бипирамиды, в аксиальных поло-
ем фенильных колец, при этом электронная пара
жениях которой находятся атомы кислорода кати-
атома азота пиридина экранирована фенильными
она UO2+. Катионы уранила равноплечны [r(U=O)
кольцами, что затрудняет возможность ее участия
1.749(6)-1.773(6) Å], линейны [угол O=U=O со-
в растворах в образовании водородных связей.
ставляет 177.9(3)-179.7(3)°] и примерно парал-
2,3,5,6-Тетрафторпиридин, дифенилфосфин,
лельны друг другу [угол между ними составляет
гексагидрат нитрата уранила - коммерческие про-
дукты. ТГФ абсолютировали кипячением с бензо-
фенилкетилнатрием, все реакции проводили в ат-
мосфере сухого аргона.
2,3,5,6-Тетракис(дифенилфосфино)пиридин
(2). К раствору 3.06 г (16.4 ммоль) дифенилфос-
фина в 50 мл ТГФ добавляли 0.378 г (16.4 ммоль)
натрия, раскатанного в фольгу, и перемешивали
4 ч до полного его растворения. К полученному
раствору при охлаждении до -20°С прибавляли
по каплям 0.495 г (3.28 ммоль, 80% от теории)
2,3,5,6-тетрафторпиридина. Полученную смесь
перемешивали при этой температуре 1 ч, затем
4 ч при 20°С и 3 ч при 60°С. После охлаждения до
20°С прибавляли последовательно 3 мл метанола
и 50 мл воды, затем растворители отгоняли в ва-
кууме до половины первоначального объема. Жел-
Общий вид молекулы комплекса [(UO2)2(tpp)(NO3)4] в
кристалле (CCDC 2039621).
тый осадок отфильтровывали и промывали водой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
СИНТЕЗ 2,3,5,6-ТЕТРАКИС(ДИФЕНИЛФОСФИНИЛ)ПИРИДИНА
655
(2×50 мл), сушили в вакууме и перекристаллизо-
вательно осторожно помещали растворы 0.1 г
вывали из смеси этанол-хлороформ (1:1). Выход
(0.11 ммоль) фосфиноксида 1 в 3 мл хлороформа
2.2 г (82%), т. пл. 235-236°С, желтоватые кристал-
и 0.114 г (0.23 ммоль) гексагидрата уранилнитра-
лы. ИК спектр, ν, см-1 : 510 ср, 592 ср, 693 с, 742
та в 3 мл ацетонитрила и оставляли на 4 сут при
с, 1354 ср, 1435 ср, 1480 ср, 1584 сл. Спектр ЯМР
20°С. Образовавшиеся кристаллы отфильтровыва-
1Н{31P} (CDCl3), δ, м. д.: 6.83 с (1Н, C4H), 6.96 д и
ли, промывали гексаном и сушили в вакууме. Вы-
6.97 д (2×8Н, о-СНPh, 3JНН 7.8 Гц), 7.06 т и 7.10 т
ход 0.189 г (100%), т. разл. 440°С, желто-зеленые
(2×8Н, м-СНPh, 3JНН 7.8 Гц), 7.20 т (8Н, п-СНPh, 3JНН
кристаллы. ИК спектр, ν, см-1: 939 ср (UO2), 1029
7.8 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
ср, 1282 ср, 1491 ср, 1520 ср (NO3), 1172 ср (P=O).
127.60 д и
128.33 д (м-СНPh,
3JРС
7.4 Гц),
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 7.14 уш. с (8Н,
128.07 и 128.57 (п-СНPh), 133.70 д и 134.40 д
п-СНPh), 7.36 уш. с и 7.43 уш. с (2×8Н, о-СНPh),
(о-СНPh, 2JPC 20.0 Гц), 135.35 д и 135.40 д (ипсо-
7.50-7.80 м (16Н, м-СНPh), 8.24 уш. с (1Н, С4Н).
СPh, 1JРС 11.3 Гц), 135.93 д и 135.98 д (ипсо-СPh,
Спектр ЯМР 31Р (CDCl3), δР, м. д.: 42.97 уш. с и
1JРС 8.0 Гц), 140.69 д. д (С3, 1JРС 38.2, 2JPC 18.6 Гц),
44.23 уш. с (2×2Р). Найдено, %: С 36.74; Н 2.57; N
144.48 т (С4Н, 2JPC 6.9 Гц), 166.66 д. д (С2, 1JРС
4.03. C53H41N5О20P4U2·CHCl3·CH3CN. Вычислено,
31.0, 2JPC 10.5 Гц). Спектр ЯМР 31Р (CDCl3), δР,
%: С 36.79; Н 2.48; N 4.59.
м. д.: -16.90 д и -11.40 д (3JРР 136.0 Гц). Масс-
ИК спектры записывали в таблетках KBr на
спектр (ESI-HRMS), m/z: 816.2268 [C53H41NP4 +
спектрометре FT IR Bruker Tensor 37 c разреше-
3H]+ (вычислено: 816.2262).
нием 2 см-1 в диапазоне 4000-400 см-1. Спектры
2,3,5,6-Тетракис(дифенилфосфинил)пири-
ЯМР 1Н и 31Р регистрировали на спектрометре
дин (1). К раствору 1.16 г (1.42 ммоль) фосфина
Bruker AV-400 (400.13 и 161.97 МГц соответствен-
2 в 20 мл хлороформа при интенсивном переме-
но) в растворах CDCl3 и ДМФА-d7. Спектры ЯМР
шивании прибавляли по каплям 1 мл 30%-ной
13С регистрировали на приборе Bruker AV-600
Н2О2 (8.82 ммоль). Смесь перемешивали при ком-
(150.925 МГц) в тех же растворителях в режиме
натной температуре 2 ч, затем прибавляли 20 мл
JMODECHO. В качестве внутренних стандартов
воды. Органический слой отделяли и упаривали
использовали остаточные сигналы растворителей,
досуха в вакууме. Остаток выдерживали в вакууме
для спектров ЯМР 31Р в качестве внешнего стан-
0.1 мм рт. ст. при 80°С до постоянной массы. Выход
дарта использовали 85%-ный раствор фосфорной
1.25 г (100%), т. пл. 305-306°С, бесцветные кри-
кислоты.
сталлы. ИК спектр, ν, см-1: 533 ср, 562 с, 599 ср, 694
ср, 723 ср, 1119 ср, 1206 ср (Р=О), 1438 ср. Спектр
Рентгеноструктурный анализ соедине-
ЯМР 1Н{31P} (CDCl3), δ, м. д.: 7.21 т и 7.23 т (2×8Н,
ния 3∙СHCl3∙MeCN выполнен на дифрактометре
м-СНPh, 3JНН 7.8 Гц), 7.38 т и 7.47 т (2×4Н, п-СНPh,
Bruker Apex 2 с ССD-детектором с использова-
3JНН 7.8 Гц), 7.10 д и 7.53 д (2×8Н, о-СНPh, 3JНН
нием MoKα-излучения. При 120.0(2) K структу-
7.8 Гц), 8.39 с (1Н, С4Н). Спектр ЯМР 13С (CDCl3),
ра состава C55.5H44Cl4.5N5.5O20P4U2 (M
1867.42)
δС, м. д.: 127.98 д и 128.12 д (м-СНPh, 3JРС 6.4 Гц),
моноклинная, пространственная группа P21/c,
130.90 д (ипсо-СPh, 1JРС 104.0 Гц), 131.42-131.64 м
a 15.8382(12), b 23.5747(17), c 19.4048(14) Å, β
(о,п-СНPh), 131.80 д (о-СНPh, 2JPC 11.0 Гц), 131.68 д
110.601(1)°, V 6782.1(9) Å3, Z 4, dвыч 1.829 г/см3.
(ипсо-СPh, 1JРС 110.0 Гц), 136.20 д. д. д (С3, 1JРС
Поглощение учтено эмпирически. Структура рас-
59.0, 2JPC 14.0, 4JРС 3.0 Гц), 149.30 т. т (С4Н, 2JPC =
шифрована с помощью программы SHELXT [5]
3JРС = 6.5 Гц), 161.66 д. д. д (С2, 1JРС 82.0, 2JPC
и уточнена полноматричным МНК по F2 в ани-
10.5, 4JРС 6.2 Гц). Спектр ЯМР 31Р (CDCl3), δР,
зотропном приближении для всех неводородных
м. д.: 27.30 д и 24.46 д (3JРР 4.4 Гц). Масс-спектр
атомов с использованием программ SHELXL [5]
(ESI-HRMS), m/z: 880.2056 [C53H41NО4P4 ]+ (вы-
и OLEX2 [6]. Атомы водорода найдены геометри-
числено: 880.2058).
чески и уточнены в модели наездника. Параметры
Комплекс
2,3,5,6-тетракис(дифенилфосфи-
уточнения: R1 0.0727 (по 12540 наблюдаемым от-
нил)пиридина с нитратом уранила (3). В про-
ражениям) и wR2 0.1580 (по 20702 независимым
бирку диаметром 2 см и высотой 10 см последо-
отражениям [Rint 0.1217]), GOF 1.098. Результаты
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021
656
АРТЮШИН и др.
РСА зарегистрированы в Кембриджском центре
Verma P.K., Kalmykov S.N., Mohapatra P.K. // Dalton
структурных данных (CCDC 2039621).
Trans. 2019. Vol. 48. P. 16279. doi 10.1039/c9dt033422f
ФОНДОВАЯ ПОДДЕРЖКА
2. Matveev P.I., Borisova N.E., Andreadi N.G., Zakiro-
va G.G., Petrov V.G., Belova E.V., Kalmykov S.N.,
Исследование выполнено при финансовой под-
Myasoedov B.F. // Dalton Trans. 2019. Vol. 48. P. 2554.
держке Российского научного фонда (проект № 20-
doi 10.1039/c8dt04729d
13-00329). Регистрация спектров ЯМР выполнена
при поддержке Министерства науки и высшего об-
3. Zakirova G.G., Mladentsev D. Yu., Borisova N.E. //
разования Российской Федерации с использовани-
Tetrahedron Lett. 2017. Vol. 58. P. 3415. doi 10.1016/j.
ем научного оборудования Центра исследования
tetlet.2017/07/055
строения молекул Института элементоорганиче-
4. Turanov A.N., Karandashev V.K., Artyushin O.I.,
ских соединений РАН.
Brel V.K. // Solvent Extr. Ion Exch. 2020. Vol. 38. N 2.
КОНФЛИКТ ИНТЕРЕСОВ
P. 166. doi 10.1080/07366299.2019.1708001
Авторы заявляют об отсутствии конфликта
5. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
интересов.
P. 3. doi 10.1107/S2053229614026540
СПИСОК ЛИТЕРАТУРЫ
6. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
1. Bhattacharyya A., Ansari S.A., Matveev P.I., Zakiro-
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
va G.G., Borisova N.E., Petrov V.G., Sumyanova T.,
Vol. 42. Pt 2. P. 339. doi 10.1107/S0021889808042726
Synthesis of 2,3,5,6-Tetra(diphenylphosphinyl)pyridine -
N,O-Donor Ligand of a New Type with Unusual Complexing
Properties
O. I. Artyushin, A. V. Vologzhanina, and V. K. Brel*
Nesmeyanov Institute of Organoelement Compounds, Russian Academy of Sciences, Moscow, 119991 Russia
*e-mail: v_brel@mail.ru
Received October 23, 2020; revised November 1, 2020; accepted November 11, 2020
A simple and effective method was proposed for the synthesis of a new N,O-donor ligand - 1,2,4,5-tetrakis(di-
phenylphosphinyl)pyridine, and its complexing properties with uranyl nitrate were studied. Structure of the
complex was established using single crystal X-ray diffraction analysis.
Keywords: ligand synthesis, complexation, N,O-donor ligands, X-ray diffraction analysis
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 4 2021