ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 5, с. 676-687
УДК 547.793
СИНТЕЗ И ОСОБЕННОСТИ СТРОЕНИЯ
2-(1,2,4-ОКСАДИАЗОЛ-5-ИЛ)АНИЛИНОВ НА ОСНОВЕ
АМИДОКСИМОВ И ИЗАТОВОГО АНГИДРИДА
© 2021 г. М. В. Тарасенкоa,*, В. Д. Котляроваa, С. В. Байковb, А. А. Шетневa
a Центр трансфера фармацевтических технологий, Ярославский государственный педагогический университет
имени К. Д. Ушинского, ул. Республиканская 108, Ярославль, 150000 Россия
b Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
*e-mail: mkarunnaya@mail.ru
Поступило в Редакцию 4 марта 2021 г.
После доработки 4 марта 2021 г.
Принято к печати 11 марта 2021 г.
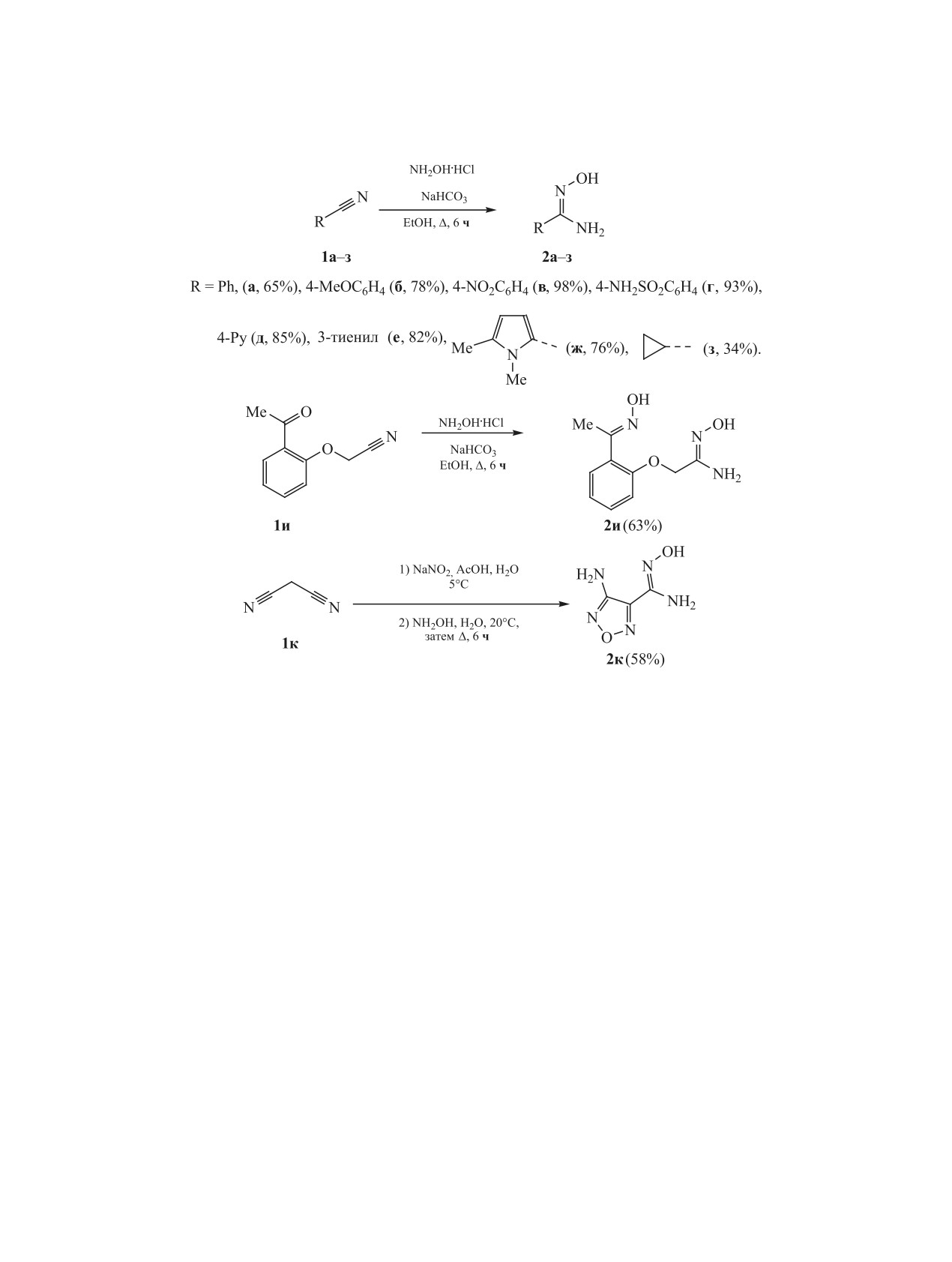
Разработан эффективный однореакторный метод синтеза 2-(1,2,4-оксадиазол-5-ил)анилинов на основе ре-
акции амидоксимов с изатовым ангидридом и его производными в системе NaOH-ДМСО при комнатной
температуре. Данный метод позволяет получать замещенные анилины различной структуры, содержащие
фрагмент 1,2,4-оксадиазола, без использования защитных групп. Потенциал реакции включает широкий
круг арил-, гетарил- и циклоалкиламидоксимов и изатовых ангидридов с различными заместителями в
ароматическом кольце, а также у атома азота амидной группы. Методом рентгеноструктурного анализа
выявлены внутримолекулярные водородные связи между атомом азота оксадиазольного фрагмента и
группой NH2 амидоксима.
Ключевые слова: амидоксимы, амины, основный катализ, гетероциклические соединения
DOI: 10.31857/S0044460X21050036
1,2,4-Оксадиазольный цикл - хорошо извест-
гибиторов сиртуина 2 [19]. Помимо медицинского
ный фармакофорный фрагмент, который входит
применения, эти гетероциклы используются для
в состав активных фармацевтических препара-
разработки энергетических материалов [20-22],
тов различной терапевтической направленности
флуоресцентных красителей
[23,
24], OLED-
[1, 2]. Например, аталурен используется для ле-
устройств [25, 26], сенсоров [27, 28], а также ин-
чения мышечной дистрофии Дюшенна [3] и дру-
сектицидов [29]. Кроме того, 1,2,4-оксадиазолы
гих заболеваний, вызванных нонсенс-мутациями
могут трансформироваться в другие гетероциклы
[4]. Азилсартан применяется для лечения гипер-
из-за низкой ароматичности и наличия слабой
тонии [5], а опикапон был одобрен в качестве
связи O-N, что активно используется в органиче-
дополнительной терапии болезни Паркинсона
ском синтезе [30-32]. Поэтому разработка новых
[6-8]. Некоторые производные 1,2,4-оксадиазо-
эффективных и удобных методов синтеза 1,2,4-ок-
ла являются селективными ингибиторами изо-
садиазолов с различными периферийными функ-
форм карбоангидразы человека, которые связаны
циональными группами является одной из важных
с терапией рака [9-11]. Кроме того, они входят в
задач современной органической химии.
состав препаратов для лечения возрастных за-
болеваний [12, 13], противомикробных средств
Ранее нами было показано, что система MOH-
[14-17], а также являются новым классом двой-
ДМСО является подходящей средой для постро-
ных агонистов αr/δ-рецепторов, активирующих
ения 1,2,4-оксадиазольного цикла при комнатной
пролиферацию пероксисом (PPARα/δ) [18], и ин-
температуре [33-35]. В частности, было изучено
676
СИНТЕЗ И ОСОБЕННОСТИ СТРОЕНИЯ 2-(1,2,4-ОКСАДИАЗОЛ-5-ИЛ)АНИЛИНОВ
677
Схема 1.
взаимодействие амидоксимов с карбоновыми кис-
дия(II) [53], представлялось интересным вовле-
лотами [36] и широким рядом их производных,
чение ангидридов изатовых кислот в реакцию с
включая хлорангидриды
[37], сложные эфиры
амидоксимами в системе MOH-ДМСО. В данной
[38], альдегиды [39] и циклические ангидриды
работе представлен синтез широкого ряда новых
дикарбоновых кислот [40-43]. Важным преиму-
2-(1,2,4-оксадиазол-5-ил)анилинов на основе ре-
ществом представленного подхода является воз-
акции амидоксимов с изатовыми ангидридами при
можность использования соединений, содержа-
комнатной температуре в среде NaOH–ДМСО.
щих свободные аминогруппы, тогда как обычное
Амидоксимы 2a-и были получены взаимодей-
нагревание губительно для этой функциональной
ствием соответствующих нитрилов 1a-и с гидрох-
группы и требуется использование специфической
лоридом гидроксиламина в присутствии NaHCO3
защиты [44-46]. В продолжение исследований мы
в этаноле при кипячении (схема 1). В случае
обратили внимание на изатовый ангидрид и его
2-(2-ацетилфенокси)ацетонитрила как карбониль-
аналоги, которые также могут вступать в реакцию
ная, так и цианогруппа реагируют с гидроксила-
с амидоксимами с образованием 1,2,4-оксадиазо-
мином. Выход целевых соединений варьировался
лов, содержащих незащищенную аминогруппу в
от 34 до 98%. Амидоксим 2к синтезировали из ма-
орто-положении по отношению к гетероцикли-
лононитрила 1к нитрозированием с последующей
ческому фрагменту [47]. Поскольку такие сое-
конденсацией с гидроксиламином по известной
динения проявляют биологическую активность
методике [54] (схема 1).
[48-50] и используются в качестве ценных прекур-
соров для создания фармацевтических препаратов
Первоначально мы проверили применимость
[51, 52] и диаминокарбеновых комплексов палла-
метода к описанной реакции. Как правило, взаи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
678
ТАРАСЕНКО и др.
Оптимизация условий реакцииa
Время, ч
№ опыта
MOH (экв.)
Выход 4а, %
стадия 1
стадия 2
1
NaОН
2
1
88
2
KОН
2
1
84
3
LiOH
2
1
81
4б
NaОН
2
1
91
5в
NaОН
2
1
89
6
NaOH
3
1
98
7
NaOH
4
1
98
8
NaOH
3
0.5
73
a Условия реакции: амидоксим 2a (2 ммоль), ДМСО (2 мл), 20°С.
б Использовали 1.5 экв. NaOH.
в Использовали 1.2 экв. изатового ангидрида 3a.
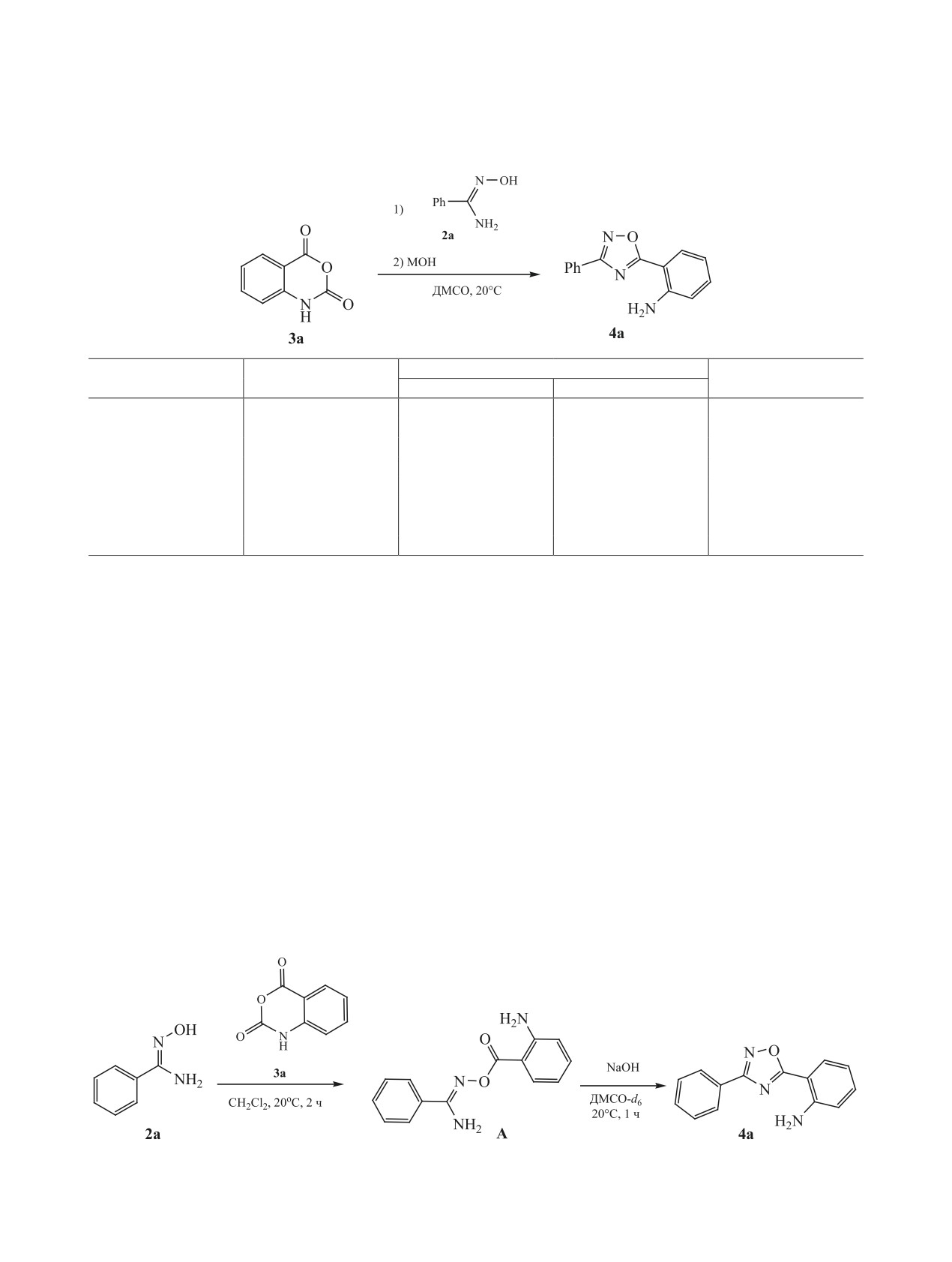
модействие амидоксимов с ацильными реагента-
ное соединение А (схема 2). Примечательно, что
ми, такими как ангидриды, включает две стадии:
в более ранней работе интермедиатом считал-
O-ацилирование амидоксима и последующая ци-
ся N-ациламидоксим [47]. Чтобы устранить это
клодегидратация в 1,2,4-оксадиазол [40, 55]. Со-
несоответствие, структуру выделенного соеди-
гласно нашим данным, сильные основания, такие
нения А исследовали методами спектроскопии
как гидроксиды щелочных металлов, катализиру-
ЯМР 1Н и 13С и масс-спектрометрии. В спектре
ют вторую стадию, что позволяет проводить ее
ЯМР 1Н присутствуют характерные сигналы двух
при температуре окружающей среды. Таким об-
групп NH2 [33, 40, 55] (уширенные синглеты при
разом, мы провели реакцию бензамидоксима 2a
6.65 и 6.83 м. д.), тогда как сигнал ОН-протона
с изатовым ангидридом 3a в дихлорметане при
отсутствует. Это наблюдение вместе с другими
комнатной температуре и выделили промежуточ-
спектральными данными (для более подробной
Схема 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ И ОСОБЕННОСТИ СТРОЕНИЯ 2-(1,2,4-ОКСАДИАЗОЛ-5-ИЛ)АНИЛИНОВ
679
Схема 3.
информации см. Дополнительные материалы)
изатового ангидрида 3a с бензамидоксимом 2a в
указывает на то, что именно О-ациламидоксим
качестве модельной реакции (см. таблицу). Пер-
является интермедиатом А. Его обработка NaOH
воначально мы провели сравнение гидроксидов
в ДМСО-d6 при комнатной температуре приводит
различных металлов (см. таблицу, оп. № 1-3), и
к образованию соответствующего 1,2,4-оксади-
NaOH был признан наиболее подходящим основа-
азола с выходом 99% (по данным ЯМР 1H) через
нием для исследуемой реакции. Кроме того, было
1 ч. Таким образом, применимость данного метода
показано, что количество ангидрида и основания
к этому типу субстратов подтверждена.
не оказывает положительного влияния на выход
На следующем этапе мы подобрали оптималь-
целевого продукта (оп. № 4 и 5), тогда как количе-
ные условия реакции, используя взаимодействие
ство примесей увеличивается.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
680
ТАРАСЕНКО и др.
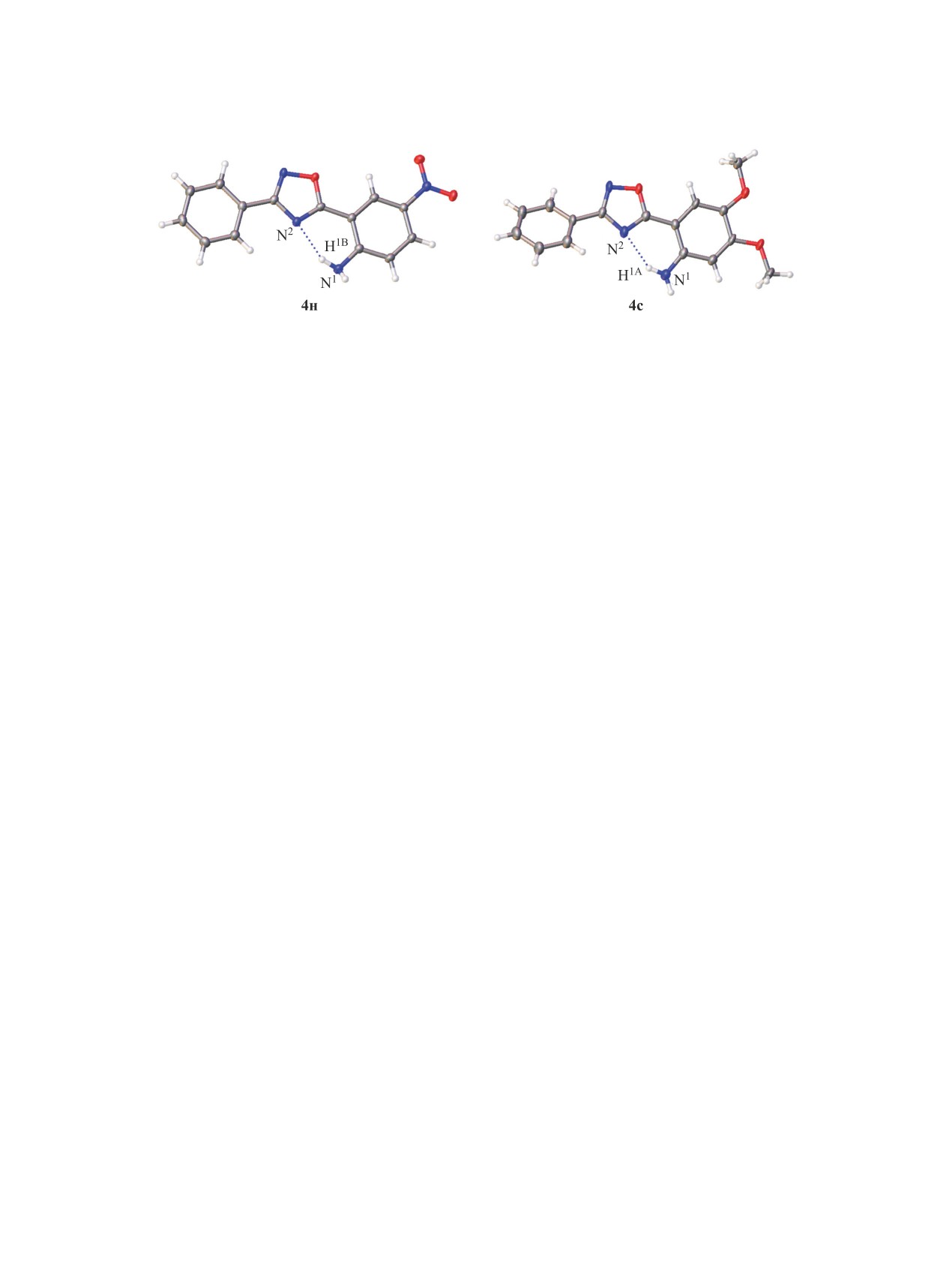
Общий вид молекул соединений 4н (CCDC 2063906) и 4с (CCDC 2063908) в кристалле. Расстояние H∙∙∙N2 составляет
2.0455(11) (4н) и 2.15(6) Å (4с).
Поскольку более высокий выход продукта обе-
В заключение, нами разработан эффективный
спечивался добавлением MOH непосредственно
однореакторный метод получения 1,2,4-оксадиазо-
на втором этапе [40], временной режим также был
лов, содержащих свободную аминогруппу, путем
исследован (таблица 1, оп. № 6-8). Установлено,
конденсации амидоксимов с изатовыми ангидри-
что для стадий O-ацилирования и циклодегидрата-
дами в системе NaOH-ДМСО. Реакция протекает
ции были достаточно 3 и 1 ч соответственно.
при комнатной температуре в течение нескольких
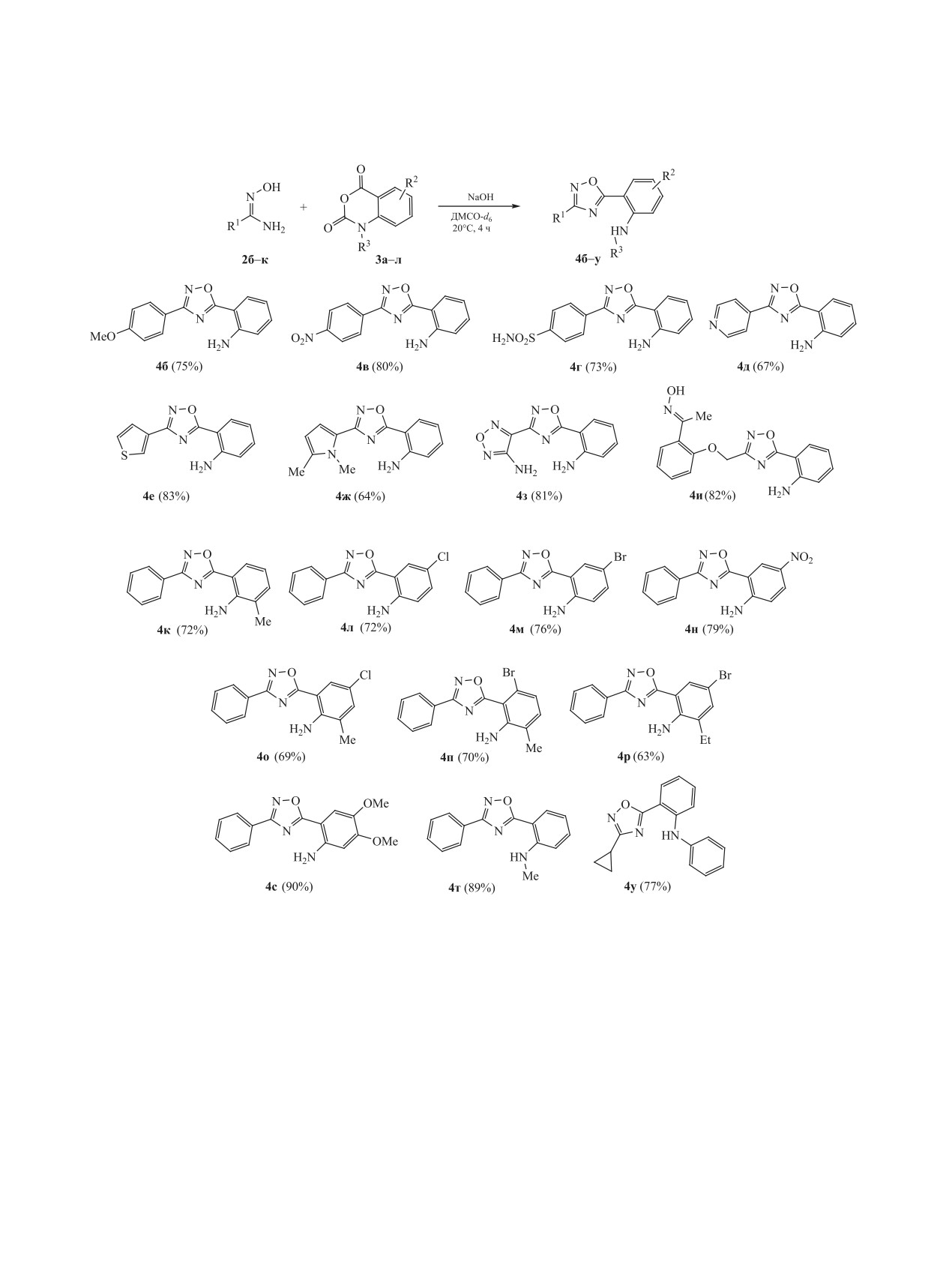
Разработав оптимальные условия, мы иссле-
часов с образованием целевых 1,2,4-оксадиазо-
довали возможности и ограничения реакции с ис-
лов с хорошим выходом. Простота и возможность
пользованием различных амидоксимов, а также
использования широкого круга амидоксимов и
некоторых изатовых ангидридов (включая N-заме-
изатовых ангидридов делают этот метод привле-
щенные аналоги). Для начала изатовый ангидрид
кательным для комбинаторной химии и создания
3a вводили в реакцию с широким рядом аромати-
новых лекарственных средств.
ческих (содержащих как электронодонорные, так
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
и электроноакцепторные заместители), гетероаро-
матических и алифатических амидоксимов 2б-и.
Все реагенты и растворители являлись коммер-
Выход целевых анилинов 4б-и составил 64-98%.
ческими продуктами и использовались без допол-
Амидоксимы 2з и 2и, имеющие незащищенные
нительной очистки. Контроль за ходом реакций
оксимную и аминогруппы, соответственно, реа-
осуществляли с помощью тонкослойной хромато-
гируют с изатовым ангидридом 3a непосредствен-
графии (пластины Silufol UV-254 Macherey-Nagel)
но с участием амидоксимного фрагмента без ка-
с использованием УФ света для проявления. Коло-
ких-либо побочных процессов.
ночную хроматографию проводили на силикагеле
Далее мы исследовали реакционную способ-
марки 60 (0.040-0.063 мм) 230-400 меш, элюируя
ность изатовых ангидридов 3б-л с заместителями
смесью гексан-этилацетат. Спектры ЯМР запи-
как в ароматическом кольце, так и при атоме азо-
сывали на Bruker Avance DPX 400 [400 (1H) и 101
та. Как видно из схемы 3, структура ангидрида не
МГц (13C)] в ДМСО-d6 или в CDCl3. Температуры
оказывает значительного влияния на исследуемую
плавления определяли в открытых капиллярах на
реакцию.
приборе Electrothermal IA 9300 series. Масс-спек-
Структура соединений 4н и 4с исследована
тры высокого разрешения (HRMS) снимали на
методом рентгеноструктурного анализа. Моно-
спектрометре Bruker Maxis HRMS-ESI-qTOF
кристаллы были получены медленным испаре-
(электроспрей-ионизация).
нием соответствующих растворов в ДМСО. Об-
Амидоксимы 2a-и получали по методике [56].
щий вид молекул соединений 4н и 4с в кристалле
представлены на рисунке. Данные РСА, указы-
N′-Гидроксибензимидамид (2a) [56]. Выход
вают на внутримолекулярную водородную связь
12.87 г (65%), белое порошкообразное вещество,
N-H∙∙∙N2оксадиазол в обеих структурах.
т. пл. 67-69°С. Спектр ЯМР 1H, δ, м. д.: 5.68 уш. с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ И ОСОБЕННОСТИ СТРОЕНИЯ 2-(1,2,4-ОКСАДИАЗОЛ-5-ИЛ)АНИЛИНОВ
681
(2Н, NH2), 7.34-7.40 м (3H, Ar), 7.62-7.69 м (2H,
798 мг (63%), бежевое порошкообразное веще-
Ar), 9.59 с (1H, OH).
ство, т. пл. 154-156°С. Спектр ЯМР 1H, δ, м. д.:
2.10 с (3H, CH3), 4.44 с (2H, CH2), 5.57 уш. с (2H,
N′-Гидрокси-4-метоксибензимидамид
(2б)
NH2), 6.95 т. д (1H, Ar, J 7.6, 1.2 Гц), 7.13 д. д (1H,
[56]. Выход 0.97 г (78%), белое порошкообразное
Ar, J 8.4, 1.2 Гц), 7.23 д. д (1H, Ar, J 7.6, 2.0 Гц),
вещество, т. пл. 107-109°С. Спектр ЯМР 1H, δ, м. д.:
3.76 с (3Н, OCH3), 5.67 уш. с (2Н, NH2), 6.92 д (2Н,
7.29-7.36 м (1H, Ar), 9.31 с (1H, OH), 10.97 с (1H,
Ar, J 7.6 Гц), 7.08 д (2Н, Ar, J 7.6 Гц), 9.43 с (1H,
OH). Спектр ЯМР 13C, δС, м. д.: 15.77, 67.05, 113.12,
121.06, 128.08, 129.66, 130.12, 149.60, 154.69,
OH).
156.50. Масс-спектр, m/z: 224.1019 [M + H]+ (вы-
N′-Гидрокси-4-нитробензимидамид (2в) [56].
числено для C10H14N3O3: 224.1030).
Выход 1.20 г (98%), желтое порошкообразное ве-
щество, т. пл. 188-190°С. Спектр ЯМР 1H, δ, м. д.:
4-Амино-N′-гидрокси-1,2,5-оксадиазол-
5.94 уш. с (2Н, NH2), 7.95 д (2Н, Ar, J 8.4 Гц), 8.20
3-карбоксимидамид (2к) [54]. Смесь малоно-
д (2Н, Ar, J 8.4 Гц), 10.07 с (1H, OH).
нитрила (1 г, 15,2 ммоль), воды (2 мл) и уксус-
ной кислоты (0.85 мл, 15 ммоль) охлаждали до
N′-Гидрокси-4-сульфамоилбензимидамид
5°C и добавляли по каплям раствор NaNO2 (1.1 г,
(2г) [10]. Выход 1.1 г (93%), бежевое порошко-
16 ммоль) в воде (1.7 мл). Полученный раствор
образное вещество, т. пл. 218-219°С. Спектр ЯМР
перемешивали при 10°C в течение 1 ч с последу-
1H, δ, м. д.: 5.93 уш. с (2H, NH2), 7.37 с (2H, NH2),
ющим нагреванием до комнатной температуры в
7.80-7.84 м (4H, Ar), 9.86 с (1H, OH).
течение ночи. Реакционную смесь охлаждали до
N′-Гидроксиизоникотинимидамид (2д) [57].
5°C, затем по каплям добавляли раствор NaOH
Выход 1.16 г (85%), бежевое порошкообразное ве-
(0.6 г, 1.5 ммоль) в воде (4 мл) и водный раствор
щество, т. пл. 198-200°С. Спектр ЯМР 1H, δ, м. д.:
гидроксиламина (50 мас%, 2.2 г, 32 ммоль) при
6.00 уш. с (2H, NH2), 7.60-7.69 м (2H, Ar), 8.52-
интенсивном перемешивании при 15°C в течение
8.63 м (2H, Ar), 10.04 с (1H, OH).
2.5 ч с последующим перемешиванием при ком-
N′-Гидрокситиофен-3-карбоксимидамид (2е)
натной температуре в течение 1 ч. Реакционную
[40]. Выход 1.07 г (82%), белое порошкообразное
смесь медленно нагревали до 100°C и кипятили в
вещество, т. пл. 85-86°С. Спектр ЯМР 1H, δ, м. д.:
течение 1.5 ч, затем охлаждали до комнатной тем-
5.76 уш. с (2H, NH2), 7.33 д (1H, J 4.8 Гц), 7.47-
пературы. Осадок отфильтровывали, промывали
7.51 м (1H), 7.80 д (1H, J 0.8 Гц), 9.45 с (1H, OH).
водой (3×1.8 мл) и сушили при комнатной темпе-
N′-Гидрокси-1,5-диметил-1H-пиррол-2-кар-
ратуре на воздухе. Выход 1.26 г (58%), бледно-жел-
боксимидамид (2ж). Выход 971 мг (76%), ко-
тое порошкообразное вещество, т. пл. 190-192°С.
ричневое порошкообразное вещество, т. пл. 142-
Спектр ЯМР 1H, δ, м. д.: 6.21 с (2H, NH2), 6.30 с
144°С. Спектр ЯМР 1H, δ, м. д.: 2.18 с (3H, CH3),
(2H, NH2), 10.49 с (1H, OH).
3.63 с (3H, CH3), 5.46 уш. с (2H, NH2), 5.78 д. д
Синтез N-[(2-аминобензоил)окси]бензими-
(1H, J 3.6, 0.8 Гц), 6.27 д (1H, J 3.6 Гц), 9.55-7.93
дамида (А). К раствору амидоксима 2a (136 мг,
м (1H), 9.32 с (1H, OH). Спектр ЯМР 13C, δС, м. д.:
1 ммоль) в дихлорметане (15 мл) добавляли изато-
12.73, 32.94, 106.15, 108.84, 125.35, 131.64, 147.68.
вый ангидрид 3a (163 мг, 1 ммоль). Реакционную
Масс-спектр, m/z: 154.0964 [M + H]+ (вычислено
смесь перемешивали при комнатной температуре
для C7H12N3O: 154.0957).
в течение 2 ч. Образовавшийся осадок отфильтро-
N′-Гидроксициклопропанкарбоксимидамид
вывали, промывали гексаном (25 мл) и сушили на
(2з) [58]. Выход 514 мг (34%), бесцветное масло.
воздухе при комнатной температуре. Выход 174 мг
Спектр ЯМР 1H, δ, м. д.: 0.51-0.69 м (4H, Alk),
(68%), бежевое порошкообразное вещество.
1.27-1.37 м (1H, Alk), 5.19 уш. с (2H, NH2), 8.69 с
Спектр ЯМР 1H, δ, м. д.: 6.53-6.59 м (1H, Ar), 6.65
(1H, OH).
с (2H, NH2), 6.78 д. д (1H, Ar, J 8.4, 1.2 Гц), 6.83 с
N′-Гидрокси-2-{2-[1-(гидроксиимино)этил]-
(2H, NH2), 7.24-7.30 м (1H, Ar), 7.43-7.56 м (3H,
фенокси}ацетамидимид (2и) получали взаимо-
Ar), 7.74-7.82 м (2H, Ar), 8.07 д. д (1H, Ar, J 8.0,
действием 3 экв. NH2OH.HCl с 2-(2-ацетилфе-
1.6 Гц). Спектр ЯМР 13C, δС, м. д.: 109.00, 115.12,
нокси)ацетонитрилом 1и (1 г, 5.71 ммоль). Выход
116.79,
127.34,
128.81,
130.86,
131.59,
132.46,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
682
ТАРАСЕНКО и др.
134.22, 151.90, 157.03, 165.82. Масс-спектр, m/z:
ЯМР 1H, δ, м. д.: 6.71 т (1H, Ar, J 7.6 Гц). 6.85 с
278.0909 [M + Na]+ (вычислено для C14H13N3ONa:
(2H, NH2), 6.98 д (1H, Ar, J 8.4 Гц), 7.36 т (1H, Ar, J
278.0900).
7.6 Гц), 7.85 д (1H, Ar, J 8.0 Гц), 8.39 с (4H,
Циклодегидратация N-[(2-аминобензоил)-
Ar). Спектр ЯМР 13C, δС, м. д.: 104.00, 116.28,
117.26,
124.67,
129.07,
129.99,
132.67,
134.66,
окси]бензимидамида A до 2-(3-фенил-1,2,4-ок-
149.46, 149.83, 166.58, 175.90. Масс-спектр, m/z:
садиазол-5-ил)анилина 4a. К раствору O-ацил-
амидоксима A (10 мг, 0.39 ммоль) в ДМСО
283.0830 [M + Na]+ (вычислено для C14H10N4O3Na:
283.0826).
(0.56 мл) быстро добавляли порошкообразный
NaOH (3 мг, 0.78 ммоль). Реакционную смесь вы-
4-[5-(2-Аминофенил)-1,2,4-оксадиазол-3-ил]-
держивали при комнатной температуре 1 ч и ис-
бензолсульфонамид (4г). Выход 463 мг (73%),
следовали методом ЯМР 1Н.
бежевое порошкообразное вещество, т. пл. 249-
Общая методика синтеза соединений 4a-у. К
250°C (разл.). Спектр ЯМР 1H, δ, м. д.: 6.68-6.75
раствору 2 ммоль амидоксима 2 в 2-3 мл ДМСО
м (1H, Ar), 6.98 д. д (1H, Ar, J 8.4, 1.2 Гц), 7.01 с
добавляли 2 ммоль изатового ангидрида 3. Реак-
(2H, NH2), 7.34-7.41 м (1H, Ar), 7.56 с (2H, NH2),
ционную смесь перемешивали при комнатной тем-
7.87 д. д (1H, Ar, J 8.0, 1.6 Гц), 8.01-8.07 м (2H, Ar),
пературе в течение 3 ч, затем быстро добавляли
8.33-8.41 м (2H, Ar). Спектр ЯМР 13C, δС, м. д.:
порошкообразный NaOH (2 ммоль). Полученную
103.77,
116.16,
117.12,
126.98,
128.38,
128.97,
смесь перемешивали при комнатной температуре
129.65, 134.70, 147.06, 149.40, 166.95, 175.53.
1 ч, затем разбавляли холодной водой (30 мл). Об-
Масс-спектр, m/z: 339.0527 [M + Na]+ (вычислено
разовавшийся осадок отфильтровывали, промыва-
для C14H12N4O3SNa: 339.0522).
ли охлажденной водой (25 мл) и сушили на возду-
2-[3-(Пиридин-4-ил)-1,2,4-оксадиазол-5-ил]-
хе при 50°C.
анилин (4д). Выход 319 мг (67%), светло-жел-
2-(3-Фенил-1,2,4-оксадиазол-5-ил)анилин
тое порошкообразное вещество, т. пл. 164-165°C.
(4a) [59]. Выход 465 мг (98%), белое порошко-
Спектр ЯМР 1H, δ, м. д.: 6.66-6.75 м (1H, Ar),
образное вещество, т. пл. 131-132°C. Спектр ЯМР
6.98 д. д (1H, Ar, J 8.4, 1.1 Гц), 7.01 с (2H, NH2),
1H, δ, м. д.: 6.66-6.74 м (1H,), 6.89-7.09 м (3H, Ar,
7.33-7.42 м (1H, Ar), 7.86 д. д (1H, Ar, J 8.0, 1.6 Гц),
NH2), 7.31-7.39 м (1H, Ar), 7.53-7.66 м (3H, Ar),
8.06-8.17 м (2H, Py), 8.78-8.90 м (2H, Py). Спектр
8.15 м (2H, Ar), 7.85 д. д (1H, Ar, J 8.0, 1.2 Гц).
ЯМР 13C, δС, м. д.: 103.62, 116.13, 117.14, 121.63,
Спектр ЯМР 13С, δС, м. д.: 104.01, 116.11, 117.06,
128.95, 134.00, 134.76, 149.46, 151.26, 166.48,
126.71, 127.69, 128.93, 129.65, 132.01, 134.51,
175.79. Масс-спектр, m/z: 239.0934 [M + H]+ (вы-
149.32, 167.75, 175.20. Масс-спектр, m/z: 260.0785
числено для C13H11N4O 239.0927).
[M + Na]+ (вычислено для C14H11N3ONa: 260.0794).
2-[3-(Тиен-3-ил)-1,2,4-оксадиазол-5-ил]ани-
2-[3-(4-Метоксифенил)-1,2,4-оксадиазол-
лин (4е). Выход 403 мг (83%), бежевое порошко-
5-ил]анилин (4б) [60]. Выход 401 мг (75%), бе-
образное вещество, т. пл. 132-133°C. Спектр ЯМР
лое порошкообразное вещество, т. пл. 142-144°C.
1H, δ, м. д.: 6.65-6.73 м (1H), 6.91-7.07 м (3H, Ar,
Спектр ЯМР 1H, δ, м. д.: 3.85 с (3H, OCH3), 6.69 т
NH2), 7.30-7.39 м (1H), 7.69 д. д (1H, J 5.2, 1.2 Гц),
(1H, Ar, J 7.6 Гц), 6.96-6.98 м (3H, Ar, NH2), 7.12
7.79 д. д (1H, J 5.2, 3.2 Гц), 7.84 д. д (1H, J 8.0,
д (2H, Ar, J 8.8 Гц), 7.31-7.40 м (1H, Ar), 7.84 д.
1.2 Гц), 8.49 д. д (1H, J 2.8, 1.2 Гц). Спектр ЯМР
д (1H, Ar, J 8.0, 1.2 Гц), 8.08 д (2H, Ar, J 8.8 Гц).
13C, δС, м. д.: 103.93, 116.05, 117.04, 126.25, 128.06,
Спектр ЯМР 13C, δС, м. д.: 55.86, 104.12, 115.04,
128.92, 128.96, 129.46, 134.47, 149.31, 164.37,
116.08,
117.02,
118.98,
128.91,
129.37,
134.40,
174.84. Масс-спектр, m/z: 244.0532 [M + H]+ (вы-
149.25, 162.21, 167.44, 174.89. Масс-спектр, m/z:
числено для C12H10N3OS: 244.0539).
290.0897 [M + Na]+ (вычислено для C15H13N3O2Na:
2-[3-(1,5-Диметил-1H-пиррол-2-ил)-1,2,4-ок-
290.0900).
садиазол-5-ил]анилин (4ж). Выход 325 мг (64%),
2-[3-(4-Нитрофенил)-1,2,4-оксадиазол-5-ил]-
бежевое порошкообразное вещество, т. пл. 85-
анилин (4в). Выход 451 мг (80%), желтое по-
87°C. Спектр ЯМР 1H, δ, м. д.: 2.29 с (3H, CH3),
рошкообразное вещество, т. пл. 242-243°C. Спектр
3.85 с (3H, CH3), 6.02 д (1H, пиррол, J 3.6 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ И ОСОБЕННОСТИ СТРОЕНИЯ 2-(1,2,4-ОКСАДИАЗОЛ-5-ИЛ)АНИЛИНОВ
683
6.65-6.73 м (1H, Ar), 6.85-7.01 м (4H, Ar, NH2),
м (3H, Ar), 7.79 д (1H, Ar, J 2.4 Гц), 8.06-8.23 м
7.30-7.38 м (1H, пиррол), 7.82 д. д (1H, Ar, J 8.0,
(2H, Ar). Спектр ЯМР 13C, δС, м. д.: 104.80, 119.04,
1.6 Гц). Спектр ЯМР 13C, δС, м. д.: 12.74, 33.39,
119.18,
126.50,
127.53,
127.72,
129.64,
132.10,
104.05,
108.32,
114.28,
116.06,
116.96,
119.48,
134.24, 148.11, 167.84, 174.07. Масс-спектр, m/z:
128.92, 134.30, 135.83, 149.19, 162.55, 173.27.
272.0595 [M + H]+ (вычислено для C14H11ClN3O:
Масс-спектр, m/z: 255.1241 [M + H]+ (вычислено
272.0575).
для C14H15N4O: 255.1240).
4-Бром-2-(3-фенил-1,2,4-оксадиазол-5-ил)-
4-[5-(2-Аминофенил)-1,2,4-оксадиазол-
анилин (4м). Выход 480 мг (76%), коричневое по-
3-ил)-1,2,5-оксадиазол-3-амин (4з). Выход 395 мг
рошкообразное вещество, т. пл. 178-180°C. Спектр
(81%), белое порошкообразное вещество, т. пл.
ЯМР 1H, δ, м. д.: 6.96 д (1H, Ar, J 8.8 Гц), 7.15 с (2H,
257-259°С. Спектр ЯМР 1H, δ, м. д.: 6.52 с (2H,
NH2), 7.48 д. д (1H, Ar, J 8.8, 2.4 Гц,), 7.57-7.67 м
NH2), 6.71 т (1H, Ar, J 7.6 Гц), 6.91 с (2H, NH2),
(3H, Ar), 7.91-7.96 м (1H, Ar), 8.10-8.23 м (2H, Ar).
6.97 д (1H, Ar, J 8.4 Гц), 7.38 т (1H, Ar, J 7.6 Гц),
Спектр ЯМР 13C, δС, м. д.: 107.44, 108.34, 118.24,
7.88 д (1H, Ar, J 7.8 Гц). Спектр ЯМР 13C, δС, м.
126.77, 127.49, 128.81, 131.20, 131.22, 136.46,
д.: 103.23, 116.33, 117.22, 129.17, 135.16, 137.70,
146.50, 168.01, 173.79. Масс-спектр, m/z: 316.0081
149.60, 155.98, 159.07, 175.86. Масс-спектр, m/z:
[M + H]+ (вычислено для C14H11BrN3O: 316.0080).
267.0600 [M + Na]+ (вычислено для C10H8N6O2:
4-Нитро-2-(3-фенил-1,2,4-оксадиазол-5-ил)-
267.0601).
анилин (4н). Выход 446 мг (79%), оранжевое по-
1-(2-{[5-(2-Аминофенил)-1,2,4-оксадиа-
рошкообразное вещество, т. пл. 227-229°C. Спектр
зол-3-ил]метокси}фенил)этан-1-оноксим
(4и).
ЯМР 1H, δ, м. д.: 7.05 д (1H, Ar, J 9.2 Гц), 7.52-7.67
Выход 531 мг (82%), бежевое порошкообразное
м (3H, Ar, NH2), 7.96-8.30 м (5H, Ar), 8.63 д (1H, Ar,
вещество, т. пл. 168-170°C. Спектр ЯМР 1H, δ, м.
J 2.4 Гц). Спектр ЯМР 13C, δС, м. д.: 103.08, 117.11,
д.: 2.13 с (3H,CH3), 5.43 с (2H, CH2), 6.69 т (1H, Ar,
126.20, 126.47, 127.80, 129.06, 129.61, 132.22,
J 7.6 Гц), 6.82-6.97 м (3H, Ar, NH2), 7.01 т (1H, Ar,
136.27, 153.60, 167.92, 173.39. Масс-спектр, m/z:
J 7.6 Гц), 7.15-7.30 м (2H, Ar), 7.31-7.41 м (2H, Ar),
305.0654 [M + Na]+ (вычислено для C14H10N4O3Na:
7.81 д (1H, Ar, J 7.2 Гц), 11.03 с (1H, OH). Спектр
305.0645).
ЯМР 13C, δС, м. д.: 15.71, 61.55, 103.80, 113.41,
2-Метил-6-(3-фенил-1,2,4-оксадиазол-
116.24,
117.00,
121.77,
128.33,
128.91,
129.89,
130.27, 134.67, 149.24, 154.44, 155.86, 166.77,
5-ил)-4-хлоранилин (4о). Выход 393 мг (69%),
175.34. Масс-спектр, m/z: 347.1115 [M + Na]+ (вы-
бежевое порошкообразное вещество, т. пл. 185-
числено для C17H16N4O3Na: 347.1115).
187°C. Спектр ЯМР 1H, δ, м. д.: 2.24 с (3H, CH3),
5.87 с (2H, NH2), 6.84 д (1H, Ar, J 8.0 Гц), 7.14 д
2-Метил-6-(3-фенил-1,2,4-оксадиазол-5-ил)-
(1H, Ar, J 8.0 Гц), 7.51-7.61 м (3H, Ar), 8.12-8.25 м
анилин (4к). Выход 361 мг (72%), белое порошко-
(2H, Ar). Спектр ЯМР 13C, δС, м. д.: 17.65, 105.72,
образное вещество, т. пл. 147-150°C. Спектр ЯМР
119.10,
121.51,
126.73,
127.49,
128.91,
131.27,
1H, δ, м. д.: 2.29 с (3H, CH3), 6.08 с (2H, NH2), 6.77 т
132.43,
133.75,
147.51,
167.27,
174.19. Масс-
(1H, Ar, J 7.6 Гц), 7.28 д (1H, Ar, J 7.2 Гц), 7.50-7.59
спектр, m/z: 308.0564 [M + Na]+ (вычислено для
м (3H, Ar), 7.91-7.98 м (1H, Ar), 8.14-8.23 м (2H,
C15H12ClN3ONa: 308.0561).
Ar). Спектр ЯМР 13C, δС, м. д.: 17.62, 105.57, 116.72,
123.14, 127.02, 127.13, 127.49, 128.83, 131.14,
3-Бром-6-метил-2-(3-фенил-1,2,4-оксади-
134.54, 146.14, 167.82, 175.29. Масс-спектр, m/z:
азол-5-ил)анилин (4п). Выход 462 мг (70%),
274.0952 [M + Na]+ (вычислено для C15H13N3ONa:
коричневое порошкообразное вещество, т. пл.
274.0951).
187-191°C. Спектр ЯМР 1H, δ, м. д.: 2.27 с (3H,
2-(3-Фенил-1,2,4-оксадиазол-5-ил)-4-хлор-
CH3), 6.11 с (2H, NH2), 7.35-7.40 м (1H, Ar), 7.50-
анилин (4л). Выход 390 мг (72%), белое порошко-
7.61 м (3H, Ar), 8.05 д (1H, Ar, J 2.4 Гц), 8.12-8.23
образное вещество, т. пл. 114-115°С. Спектр ЯМР
м (2H, Ar). Спектр ЯМР 13C, δС, м. д.: 18.03, 105.39,
1H, δ, м. д.: 7.00 д (1H, Ar, J 8.8 Гц), 7.12 с (2H,
106.32, 126.46, 127.18, 127.61, 128.20, 129.73,
NH2), 7.36 д. д (1H, Ar, J 8.8, 2.4 Гц), 7.53-7.62
132.15,
136.92,
146.62,
167.72,
174.30. Масс-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
684
ТАРАСЕНКО и др.
спектр, m/z: 352.0062 [M + Na]+ (вычислено для
174.10. Масс-спектр, m/z:
278.1291
[M + H]+
C15H12BrN3ONa: 352.0056).
(вычислено для C17H16N3O: 278.1288).
4-Бром-6-(3-фенил-1,2,4-оксадиазол-
БЛАГОДАРНОСТЬ
5-ил)-2-этиланилин (4р). Выход 433 мг (63%),
Авторы выражают благодарность Е. Помазун за
бежевое порошкообразное вещество, т. пл. 172-
помощь в редактировании рукописи.
174°C. Спектр ЯМР 1H, δ, м. д.: 1.34 т (3H, Et, J
7.6 Гц), 2.59 к (2H, Et, J 7.6 Гц), 6.17 с (2H, NH2),
ФОНДОВАЯ ПОДДЕРЖКА
7.36 д (1H, Ar, J 2.4 Гц), 7.48-7.61 м (3H, Ar),
Работа выполнена при финансовой поддерж-
8.05 д (1H, Ar, J 2.4 Гц), 8.16 д. д (2H, Ar, J 7.6,
ке Российского научного фонда (грант № 20-73-
2.0 Гц). Спектр ЯМР 13C, δС, м. д.: 12.16, 23.81,
00203) с использованием оборудования Ресурсных
106.98, 108.33, 126.72, 127.48, 128.86(2C), 130.91,
центров Санкт-Петербургского государственного
131.28,
134.84,
144.60,
167.87,
174.20. Масс-
университета «Магнитно-резонансные методы ис-
спектр, m/z: 366.0204 [M + Na]+ (вычислено для
следования», «Методы анализа состава вещества»
C16H14BrN3ONa: 366.0212).
и «Рентгенодифракционные методы исследова-
4,5-Диметокси-2-(3-фенил-1,2,4-оксади-
ния».
азол-5-ил)анилин
(4с). Выход
535 мг
(90%),
КОНФЛИКТ ИНТЕРЕСОВ
белое порошкообразное вещество, т. пл. 164-
165°C. Спектр ЯМР 1H, δ, м. д.: 3.76 с (3H, OCH3),
Авторы заявляют об отсутствии конфликта
3.81 с (3H, OCH3), 6.57 с (1H, Ar), 6.78 с (2H, NH2),
интересов.
7.25 д (1H, Ar, J 1.6 Гц), 7.55-7.66 м (3H, Ar), 8.09-
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
8.18 м (2H, Ar). Спектр ЯМР 13C, δС, м. д.: 55.84,
Дополнительные материалы для этой статьи
56.56, 95.07, 99.75, 110.25, 126.95, 127.64, 129.60,
доступны по doi
10.31857/S0044460X21050036
131.88, 140.98, 146.30, 155.44, 167.60, 174.99.
для авторизованных пользователей.
Масс-спектр, m/z: 298.1174 [M + H]+ (вычислено
для C16H16N3O3: 298.1186).
СПИСОК ЛИТЕРАТУРЫ
N-Метил-2-(3-фенил-1,2,4-оксадиазол-5-ил)-
1. Biernacki K., Daśko M., Ciupak O., Kubiński K.,
анилин (4т) [47]. Выход 447 мг (89%), белое по-
Rachon J., Demkowicz S. // Pharmaceuticals. 2020.
рошкообразное вещество, т. пл. 88-89°C. Спектр
Vol. 13. P. 111. doi 10.3390/ph13060111
ЯМР 1H, δ, м. д.: 3.07 с (3H, CH3), 6.73-6.84 м (2H,
2. Pace A., Buscemi S., Piccionello A.P., Pibiri I. //
Ar), 7.42-7.49 м (1H, Ar), 7.50-7.59 м (3H, Ar),
Adv. Heterocycl. Chem. 2015. P. 85. doi 10.1016/
bs.aihch.2015.05.001
7.62-7.84 уш. с (1H, NH), 8.05 д. д (1H, Ar, J 8.0,
3. Welch E.M., Barton E.R., Zhuo J., Tomizawa Y.,
1.6 Гц), 8.15-8.22 м (2H, Ar). Спектр ЯМР 13C, δС,
Friesen W.J., Trifillis P., Paushkin S., Patel M.,
м. д.: 29.90, 105.45, 110.99, 115.45, 126.98, 127.49,
Trotta C.R., Hwang S., Wilde R.G., Karp G., Takasugi J.,
128.83, 129.46, 131.15, 134.31, 148.89, 167.66,
Chen G., Jones S., Ren H., Moon Y.-C., Corson D.,
174.96. Масс-спектр, m/z: 252.1129 [M + H]+ (вы-
Turpoff A.A., Campbell J.A., Conn M.M., Khan A.,
числено для C15H14N3O: 252.1131).
Almstead N.G., Hedrick J., Mollin A., Risher N., Weet-
2-(3-Циклопропил-1,2,4-оксадиазол-
all M., Yeh S., Branstrom A.A., Colacino J.M., Babiak J.,
5-ил)-N-фениланилин (4у). Выход 427 мг (77%),
Ju W.D., Hirawat S., Northcutt V.J., Miller L.L., Spatrick
P., He F., Kawana M., Feng H., Jacobson A., Peltz
белое порошкообразное вещество, т. пл. 90-91°C.
S.W., Sweeney H.L. // Nature. 2007. Vol. 447. P. 87. doi
Спектр ЯМР 1H, δ, м. д.: 1.10-1.18 м (4H, Alk),
10.1038/nature05756
2.17-2.26 м (1H, Alk), 6.84-6.91 м (1H, Ar), 7.12-
4. Campofelice A., Lentini L., Di Leonardo A., Melfi R.,
7.19 м (1H, Ar), 7.27-7.32 м (2H, Ar), 7.32-7.38 м
Tutone M., Pace A., Pibiri I. // Int. J. Mol. Sci. 2019.
(2H, Ar), 7.38-7.43 м (2H, Ar), 8.01-8.09 м (1H,
Vol. 20. P. 3329. doi 10.3390/ijms20133329
Ar), 9.43 уш. с (1H, NH). Спектр ЯМР 13C, δС, м.
5. Lanier G., Sankholkar K., Aronow W.S. // Am.
д.: 6.89, 7.87, 107.46, 114.08, 117.96, 122.34, 123.77,
J. Ther. 2014. Vol. 21. P. 419. doi 10.1097/
129.53, 129.63, 133.58, 140.66, 144.86, 171.73,
MJT.0b013e31824a0ed7
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ И ОСОБЕННОСТИ СТРОЕНИЯ 2-(1,2,4-ОКСАДИАЗОЛ-5-ИЛ)АНИЛИНОВ
685
6.
Kiss L.E., Ferreira H.S., Torrão L., Bonifácio M.J.,
Bioorg. Chem. 2020. Vol. 100. P. 103867. doi 10.1016/j.
Palma P.N., Soares-da-Silva P., Learmonth D.A. //
bioorg.2020.103867
J. Med. Chem. 2010. Vol. 53. P. 3396. doi 10.1021/
19.
Moniot S., Forgione M., Lucidi A., Hailu G.S., Neb-
jm1001524
bioso A., Carafa V., Baratta F., Altucci L., Giacché
7.
Scott L.J. // Drugs. 2016. Vol. 76. P. 1293. doi 10.1007/
N., Passeri D., Pellicciari R., Mai A., Steegborn C.,
s40265-016-0623-y
Rotili D. // J. Med. Chem. 2017. Vol. 60. P. 2344. doi
8.
Ferreira J.J., Lees A., Rocha J.-F., Poewe W., Rascol
10.1021/acs.jmedchem.6b01609
O., Soares-da-Silva P. // Lancet. Neurol. 2016. Vol. 15.
20.
Yan T., Cheng G., Yang H. // Chempluschem. 2019.
P. 154. doi 10.1016/S1474-4422(15)00336-1
Vol. 84. P. 1567. doi 10.1002/cplu.201900454
9.
Krasavin M., Shetnev A., Sharonova T., Baykov S.,
21.
Yang X., Zhou J., Xing X., Huang Y., Yan Z., Xue Q.,
Tuccinardi T., Kalinin S., Angeli A., Supuran C.T. //
Wang X., Wang B. // RSC Adv. 2020. Vol. 10. P. 26425.
Bioorg. Chem. 2018. Vol. 76. P. 88. doi 10.1016/j.
doi 10.1039/D0RA04517A
bioorg.2017.10.005
22.
Yang F., Zhang P., Zhou X., Lin Q., Wang P., Lu M. //
10.
Krasavin M., Shetnev A., Sharonova T., Baykov S.,
Cryst. Growth Des. 2020. Vol. 20. P. 3737. doi 10.1021/
Kalinin S., Nocentini A., Sharoyko V., Poli G.,
acs.cgd.0c00016
Tuccinardi T., Presnukhina S., Tennikova T.B., Supuran
23.
Matta A., Bahadur V., Taniike T., Van der Eycken J.,
C.T. // Eur. J. Med. Chem. 2019. Vol. 164. P. 92. doi
Singh B.K. // Dyes Pigments. 2017. Vol. 140. P. 250. doi
10.1016/j.ejmech.2018.12.049
10.1016/j.dyepig.2017.01.050
11.
Shamsi F., Hasan P., Queen A., Hussain A., Khan P.,
24.
Schramm S., Weiß D. // Adv. Heterocycl. Chem. 2019.
Zeya B., King H.M., Rana S., Garrison J., Alajmi M.F.,
P. 103. doi 10.1016/bs.aihch.2018.10.003
Rizvi M.M.A., Zahid M., Imtaiyaz Hassan M., Abid M. //
25.
Li Q., Cui L.-S., Zhong C., Jiang Z.-Q., Liao L.-S. // Org.
Bioorg. Chem. 2020. Vol. 98. P. 103754. doi 10.1016/j.
Lett. 2014. Vol. 16. P. 1622. doi 10.1021/ol5002494
bioorg.2020.103754
26.
Li Q., Cui L.-S., Zhong C., Yuan X.-D., Dong S.-C.,
12.
Shetnev A., Osipyan A., Baykov S., Sapegin A., Chirko-
Jiang Z.-Q., Liao L.-S. // Dyes Pigments. 2014. Vol. 101.
va Z., Korsakov M., Petzer A., Engelbrecht I.,
P. 142. doi 10.1016/j.dyepig.2013.09.029
Petzer J.P. // Bioorg. Med. Chem. Lett. 2019. Vol. 29.
27.
Pibiri I., Palumbo Piccionello A., Calabrese A., Bus-
P. 40. doi 10.1016/j.bmcl.2018.11.018
cemi S., Vivona N., Pace A. // Eur. J. Org. Chem. 2010.
13.
Wang M., Liu T., Chen S., Wu M., Ha, J., Li Z. // Eur. J.
P. 4549. doi 10.1002/ejoc.201000763
Med. Chem. 2021. Vol. 209. P. 112874. doi 10.1016/j.
28.
Malkondu S., Altinkaya N., Erdemir S., Kocak A. //
ejmech.2020.112874
Sensors Actuators (B). 2018. Vol. 276. P. 296. doi
14.
Shetnev A., Baykov S., Kalinin S., Belova A., Sharoy-
10.1016/j.snb.2018.08.112
ko V., Rozhkov A., Zelenkov L., Tarasenko M., Sady-
29.
Lambert W.T., Buysse A.M., Wessels F.J. // Pest. Manag.
kov E., Korsakov M., Krasavin M. // Int. J. Mol. Sci.
Sci. 2020. Vol. 76. P. 497. doi 10.1002/ps.5537
2019. Vol. 20. P. 1699. doi 10.3390/ijms20071699
30.
Piccionello A.P., Pace A., Buscemi S. // Chem.
15.
O’Daniel P.I., Peng Z., Pi H., Testero S.A., Ding D.,
Heterocycl. Compd. 2017. Vol. 53. P. 936. doi 10.1007/
Spink E., Leemans E., Boudreau M.A., Yamaguchi T.,
s10593-017-2154-1
Schroeder V.A., Wolter W.R., Llarrull L.I., Song W.,
31.
Strelnikova J.O., Rostovskii N.V., Starova G.L.,
Lastochkin E., Kumarasiri M., Antunes N.T., Espahbodi
Khlebnikov A.F., Novikov M.S. // J. Org. Chem. 2018.
M., Lichtenwalter K., Suckow M.A., Vakulenko S.,
Vol. 83. P. 11232. doi 10.1021/acs.joc.8b01809
Mobashery S., Chang M. // J. Am. Chem. Soc. 2014.
32.
Strelnikova J.O., Rostovskii N.V., Khoroshilova O.V.,
Vol. 136. P. 3664. doi 10.1021/ja500053x
Khlebnikov A.F., Novikov M.S. // Synthesis. 2021.
16.
Atmaram Upare A., Gadekar P.K., Sivaramakrishnan H.,
Vol. 53. P. 348. doi 10.1055/s-0040-1707278
Naik N., Khedkar V.M., Sarkar D., Choudhari A.,
33.
Baykov S., Sharonova T., Osipyan A., Rozhkov S.,
Mohana Roopan S. // Bioorg. Chem. 2019. Vol. 86.
Shetnev A., Smirnov A. // Tetrahedron Lett. 2016.
P. 507. doi 10.1016/j.bioorg.2019.01.054
Vol. 57. P. 2898. doi 10.1016/j.tetlet.2016.05.071
17.
Krasavin M., Lukin A., Vedekhina T., Manicheva O.,
34.
Baykov S., Semenov A., Tarasenko M., Boyar-
Dogonadze M., Vinogradova T., Zabolotnykh N.,
skiy V.P. // Tetrahedron Lett. 2020. Vol. 61. P. 152403.
Rogacheva E., Kraeva L., Sharoyko V., Tennikova T.B.,
doi ,10.1016/j.tetlet.2020.152403
Dar’in D., Sokolovich E. // Eur. J. Med. Chem. 2019.
35.
Tarasenko M., Sidneva V., Belova A., Romanycheva A.,
Vol. 166. P. 125. doi 10.1016/j.ejmech.2019.01.050
Sharonova T., Baykov S., Shetnev A., Kofanov E.,
18.
Kaur P., Bhat Z.R., Bhat S., Kumar R., Kumar R.,
Kuznetsov M. // Arkivoc. 2018. P. 458. doi 10.24820/
Tikoo K., Gupta J., Khurana N., Kaur J., Khatik G.L. //
ark.5550190.p010.760dd
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
686
ТАРАСЕНКО и др.
36.
Sharonova T., Pankrat’eva V., Savko P., Baykov S.,
49.
Almansour A.I., Suresh Kumar R., Arumugam N.,
Shetnev A. // Tetrahedron Lett. 2018. Vol. 59. P. 2824.
Sriram D. // Eur. J. Med. Chem. 2012. Vol. 53. P. 416.
doi 10.1016/j.tetlet.2018.06.019
doi 10.1016/j.ejmech.2012.04.021
37.
Панкратьева В.Е., Шаронова Т.В., Тарасенко М.В.,-
50.
Basham K.J., Bhonde V.R., Kieffer C., Mack J.B.C.,
Байков С.В., Кофанов Е.Р. // ЖОрХ. 2018. Т. 54.
Hess M., Welm B.E., Looper R.E. // Bioorg. Med.
Вып. 8. С. 1236; Pankrat’eva V.E., Sharonova T.V.,
Chem. Lett. 2014. Vol. 24. P. 2473. doi 10.1016/j.
Tarasenko M.V., Baikov S.V., Kofanov, E.R. // Russ.
bmcl.2014.04.013
J. Org. Chem. 2018. Vol. 54. P. 1250. doi 10.1134/
51.
Mori T., Takada Y., Hatakoshi M., Matsuo N. // Biosci.
S1070428018080213
Biotechnol. Biochem. 2004. Vol. 68. P. 425. doi
38.
Baykov S., Sharonova T., Shetnev A., Rozhkov S.,
10.1271/bbb.68.425
Kalinin S., Smirnov A.V. // Tetrahedron. 2017. Vol. 73.
52.
Mcnaughton-Smith G.A., Reed A.D., Atkinson R.N. Pat.
P. 945. doi 10.1016/j.tet.2017.01.007
WO 2004016221 (2004).
39.
Шетнев А.А., Панкратьева В.Е., Куничкина А.С.,
53.
Байков С.В., Труханова Ю.А., Тарасенко М.В.,
Власов А.С., Проскурина И.К., Котов А.Д., Корса-
Кинжалов М.А. // ЖОХ. 2020. Т. 90. Вып. 10.
ков М.К. // ЖОрХ. 2020. Т. 56. Вып. 7. С. 1064.
С. 1567; Baikov S.V., Trukhanova Y.A., Tarasenko M.V.,
Shetnev A.A., Pankratieva V.E., Kunichkina A.S., Vla-
Kinzhalov M.A. // Russ. J. Gen. Chem. 2020. Vol. 90.
sov A.S., Proskurina I.K., Kotov A.D., Korsakov M.K. //
P. 1892. doi 10.1134/S1070363220100126
Russ. J. Org. Chem. 2020. Vol. 56. P. 1181. doi 10.1134/
54.
Pagoria P.F., Zhang M.-X., Zuckerman N.B., DeHope A.J.,
S107042802007009X
Parrish D.A. // Chem. Heterocycl. Compd. 2017.
40.
Tarasenko M., Duderin N., Sharonova T., Baykov S.,
Vol. 53. P. 760. doi 10.1007/s10593-017-2122-9
Shetnev A., Smirnov A.V. // Tetrahedron Lett. 2017.
55.
Циулин П.А., Соснина В.В., Красовская Г.Г., Да-
Vol. 58. P. 3672. doi 10.1016/j.tetlet.2017.08.020
нилова А.С., Байков С.В., Кофанов Е.Р. // ЖОрХ.
41.
Presnukhina S., Tarasenko M., Baykov S., Smirnov S.N.,
2011. Т. 47. Вып. 12. С. 1838; Tsiulin P.A., Sosnina
Boyarskiy V.P., Shetnev A., Korsakov M.K. //
V.V., Krasovskaya G.G., Danilova A.S., Bai-
Tetrahedron Lett. 2020. Vol. 61. P. 151543. doi
kov S.V., Kofanov E.R. // Russ. J. Org. Chem. 2011.
10.1016/j.tetlet.2019.151543
Vol. 47. P. 1874. doi 10.1134/S1070428011120153
42.
Baykov S., Tarasenko M., Zelenkov L.E., Kasatkina S.,
56.
Yang C.-T., Han J., Liu J., Gu M., Li Y., Wen J., Yu H.-Z.,
Savko P., Shetnev A. // Eur. J. Org. Chem. 2019. P. 5685.
Hu S., Wang X. // Org. Biomol. Chem. 2015. Vol. 13.
doi 10.1002/ejoc.201900843
P. 2541. doi 10.1039/C4OB02456G
43.
Тарасенко М.В., Преснухина С.И., Байков С.В.,
57.
Borg S., Luthman K., Nyberg F., Terenius L., Hacksell U. //
Шетнев А.А. // ЖОХ. 2020. Т. 90. Вып. 9. С.1349;
Eur. J. Med. Chem. 1993. Vol. 28. P. 801. doi
Tarasenko M.V., Presnukhina S.I., Baikov S.V., Shet-
10.1016/0223-5234(93)90115-U
nev A.A. // Russ. J. Gen. Chem. 2020. Vol. 90. P. 1611.
58.
Augustine J.K., Akabote V., Hegde S.G., Alagarsamy P. //
doi 10.1134/S1070363220090042
J. Org. Chem. 2009. Vol. 74. P. 5640. doi 10.1021/
44.
Liu J., Li H., Chen K.-X., Zuo J.-P., Guo Y.-W., Tang W.,
jo900818h
Li X.-W. // J. Med. Chem. 2018, Vol. 61. P. 11298. doi
59.
Draghici B., El-Gendy B., Katritzky A. // Synthesis.
10.1021/acs.jmedchem.8b01430
2012. P. 547. doi 10.1055/s-0031-1289673
45.
Volobueva A., Egorova A., Galochkina A., Ekins S.,
Zarubaev V., Makarov V. // Molecules. 2020. Vol. 25.
60.
Конюшкин Л.Д., Годовикова Т.И., Воронцова C.K.,
Цыганов Д.В., Карманова И.Б., Райхштат М.М.,
P. 1345. doi 10.3390/molecules25061345
46.
Childress E.S., Kharel Y., Brown A.M., Bevan D.R.,
Фирганг С.И., Покровский М.А., Покровский А.Г.,
Lynch K.R., Santos W.L. // J. Med. Chem. 2017. Vol. 60.
Семенова М.Н., Семенова В.В. // Изв. АН. Сер. хим.
P. 3933. doi 10.1021/acs.jmedchem.7b00233
2010. № 12. С. 2212; Konyushkin L.D., Godoviko-
47.
Nagahara K., Takagi K., Ueda T. // Chem. Pharm. Bull.
va T.I., Vorontsova S.K., Tsyganov D.V., Karmano-
1975. Vol. 23. P. 3178. doi 10.1248/cpb.23.3178
va I.B,. Raihstat M.M., Firgang SI., Pokrovskii M.A.,
48.
Ranjith Kumar R., Perumal S., Menéndez J.C.,
Pokrovskii A.G., Semenova M.N., Semenov V.V. // Russ.
Yogeeswari P., Sriram D. // Bioorg. Med. Chem. 2011.
Chem. Bull. 2010. Vol. 59. P. 2268. doi 10.1007/s11172-
Vol. 19. P. 3444. doi 10.1016/j.bmc.2011.04.033
010-0387-6
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ И ОСОБЕННОСТИ СТРОЕНИЯ 2-(1,2,4-ОКСАДИАЗОЛ-5-ИЛ)АНИЛИНОВ
687
2-(1,2,4-Oxadiazol-5-yl)anilines Based on Amidoximes
and Isatoic Anhydrides: Synthesis and Structure Features
M. V. Tarasenkoa,*, V. D. Kotlyarovaa, S. V. Baykovb, and A. A. Shetneva
a Pharmaceutical Technology Transfer Centre, K.D. Ushinsky Yaroslavl State Pedagogical University,
Yaroslavl, 150000 Russia
b St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: mkarunnaya@mail.ru
Received March 4, 2021; revised March 4, 2021; accepted March 11, 2021
An efficient one-pot method was developed for the synthesis of 2-(1,2,4-oxadiazol-5-yl)anilines via the reaction
of amidoximes with isatoic anhydrides in a NaOH-DMSO medium at ambient temperature. The method allows
to obtain structurally diverse substituted anilines bearing the 1,2,4-oxadiazole motif in moderate to excellent
yields without the utilization of protective groups. The reaction scope includes aryl, hetaryl, and cycloalkyl
amidoxime and isatoic anhydrides with different substituents in the aromatic ring as well as at the amide N atom.
Structures of two anilines were studied by single crystal X-ray diffraction method and intramolecular hydrogen
bonding between N atom of oxadiazole moiety and NH2 group was revealed.
Keywords: amidoximes, amines, base catalysis, heterocycles
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021