ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 5, с. 688-693
К 70-летию со дня рождения В. Н. Чарушина
УДК 547.873;547.753
СОЧЕТАНИЕ РЕАКЦИЙ SH/аза-ДИЛЬСА-АЛЬДЕРА
КАК ЭФФЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ
8-ГИДРОКСИ(МЕТОКСИ)ЗАМЕЩЕННЫХ
2-[6-(1-МЕТИЛИНДОЛ-3-ИЛ)ПИРИДИН-2-ИЛ]-
ХИНОЛИНОВЫХ ЛИГАНДОВ/ФЛУОРОФОРОВ
© 2021 г. М. И. Савчукa,b, Д. С. Копчукa,b, И. Н. Егоровb, А. Ф. Хасановb, C. C. Рыбаковаb,
Г. В. Зыряновa,b, *, В. Л. Русиновa,b, О. Н. Чупахинa,b
a Институт органического синтеза Уральского отделения Российской академии наук,
ул. С. Ковалевской 22, Екатеринбург, 620990
b Уральский федеральный университет, Екатеринбург, 620002 Россия
*e-mail: gvzyryanov@gmail.com
Поступило в Редакцию 29 марта 2021 г.
После доработки 29 марта 2021 г.
Принято к печати 11 апреля 2021 г.
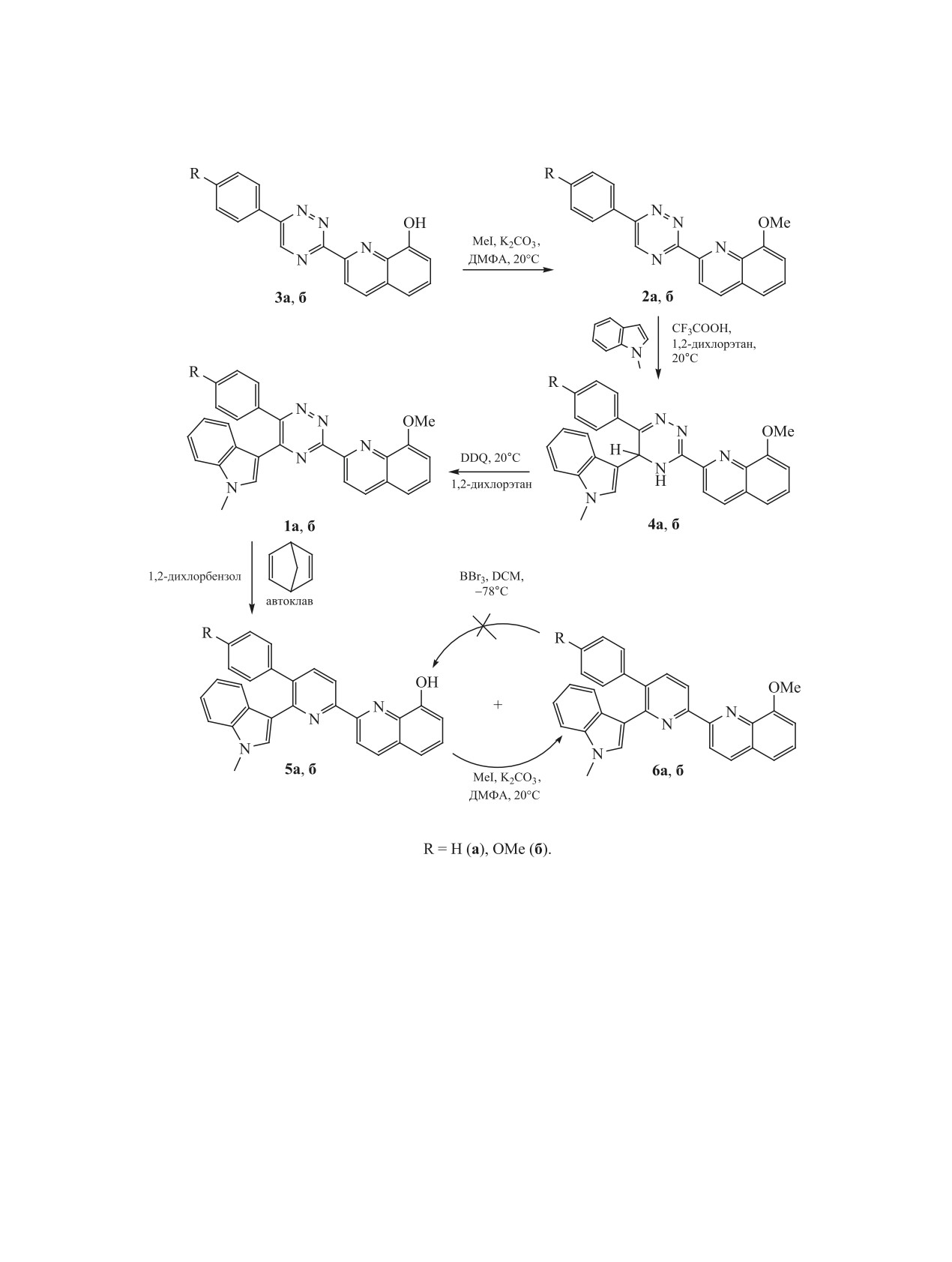
Сочетанием реакций SNH при взаимодействии 8-метоксизамещенных 2-(6-арил-1,2,4-триазин-3-ил)хи-
нолинов с индолом и реакции аза-Дильса-Альдера полученных 1,2,4-триазинов с 2,5-норборнадиеном
синтезированы 8-гидрокси(метокси)замещенные 2-[6-(1-метилиндол-3-ил)пиридин-2-ил]хинолиновые
лиганды. При этом возможность деметилирования метоксигруппы хинолинового фрагмента 1,2,4-три-
азинового прекурсора продемонстрирована непосредственно в ходе реакции аза-Дильса-Альдера в
автоклавных условиях.
Ключевые слова: реакция аза-Дильса-Альдера, 1,2,4-триазин, 8-метоксихинолин, деметилирование,
автоклав
DOI: 10.31857/S0044460X21050048
Реакция аза-Дильса-Альдера в ряду 1,2,4-три-
жениям 3 и 4 алифатический карбоцикл [12, 13],
азинов широко используется для получения раз-
производные изохинолина [14-16] или их аннели-
нообразных производных (би)пиридина
[1-3].
рованные производные [17, 18], aрилзамещенные
Прежде всего это обусловлено широкими возмож-
пиридины [19]. Также необходимо отметить, что в
ностями префункционализации
1,2,4-триазино-
ряде случаев, наряду с превращением 1,2,4-триа-
вого каркаса [4-6], в том числе с использованием
зинового цикла в пиридиновый, в ходе процесса
атом-экономных реакций нуклеофильного заме-
имеют место параллельные или конкурентные
щения водорода (SNH) [7, 8]. При этом в качестве
превращения, затрагивающие функциональные
диенофилов могут быть использованы 2,5-нор-
группы как в составе 1,2,4-триазина/пиридина,
борнадиен, енамины, ариновые интермедиаты,
так и в составе заместителей. Так, были описаны
замещенные ацетилены, в результате чего могут
примеры восстановления нитрогруппы в составе
быть получены, соответственно, 3,4-незамещен-
ароматического заместителя
1,2,4-триазинов до
ные пиридины [9, 10], в том числе пиридоны [11];
аминогруппы [20, 21], восстановление трихлорме-
пиридины, имеющие аннелированный по поло-
тильной группы в положении С3 1,2,4-триазина до
688
СОЧЕТАНИЕ РЕАКЦИЙ S
N
H/
аза-ДИЛЬСА-АЛЬДЕРА
689
Схема 1.
дихлорметильной [22, 23], частичное децианиро-
Ранее мы предложили удобный синтетический
вание в 5-циано-1,2,4-триазинах [24], а также до-
подход к производным пиридина, имеющим в по-
мино-трансформации 1,2,4-триазиновой системы
ложении С2 остаток индол-3-ила [27], в результате
под действием аринов [25]. В данной работе опи-
последовательных дезоксигенативного нуклео-
сано еще одно обнаруженное нами параллельное
фильного замещения водорода в ряду 1,2,4-триа-
превращение 8-метоксихинолинового фрагмента в
зин-4-оксидов и реакции аза-Дильса-Альдера с
ходе реакции аза-Дильса-Альдера 8-метоксизаме-
2,5-норборнадиеном, причем вторая стадия реали-
щенных
2-(6-арил-1,2,4-триазин-3-ил)хинолинов
зуется в автоклаве в условиях повышенных тем-
с 2,5-норборнадиеном, позволяющее одностадий-
пературы и давления, тогда как в традиционных
ным/однореакторным образом получать 8-гидрок-
условиях, а именно при кипячении в толуоле,
си(метокси)замещенные2-[6-(1-метилиндол-3-ил)-
о-ксилоле или о-дихлорбензоле, осуществить дан-
пиридин-2-ил]хинолиновые лиганды/флуорофоры.
ное превращение не удается. С целью изучения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
690
САВЧУК и др.
возможностей применения этого синтетическо-
9.65 м. д. Следует отметить, что, как ранее было
го метода в данной работе нами проводилась оп-
описано в литературе [27], проведение аналогич-
тимизация синтетических подходов к произво-
ной реакции в ряду незамещенных по положению
дным 2,2′-бипиридина, имеющим в положении
С5 3-(8-метоксихинолин-2-ил)-1,2,4-триазинов в
С6 остаток индола. В этом контексте в настоящей
условиях кипячения в о-ксилоле в отсутствие ав-
статье мы сообщаем о возможностях получения
токлава не приводило к образованию продуктов
8-гидрокси(метокси)-2-[6-(1-метилиндол-3-ил)
деметилирования хинолинового фрагмента.
пиридин-2-ил]хинолиновых лигандов путем со-
Нами также была показана возможность не
четания реакций нуклеофильного замещения во-
разделять полученную смесь продуктов, а прове-
дорода (SNH) и реакций аза-Дильса-Альдера исходя
сти реакцию метилирования свободной гидрок-
из 8-метоксизамещенных 2-(6-арил-1,2,4-триазин-
сигруппы соединений 5 по той же методике [27],
3-ил)хинолинов.
что была использована для получения триазинов
Исходные 5-индолил-1,2,4-триазины 1 были
2, в результате чего продукты 6 были получены
получены на основе соединений 2, синтезиро-
в чистом виде, их выход по отношению к исход-
ванных путем алкилирования 3-(8-гидроксихи-
ным 1,2,4-триазинам 1 составил 70-75%. Следует
нолин-2-ил)-1,2,4-триазинов
3 по описанному
также отметить, что осуществить направленное
методу [27] (схема 1). Введение остатка N-мети-
деметилирование 8-метоксигруппы в 2-[6-(1-ме-
линдола в положение С5 триазинового ядра было
тилиндол-3-ил)пиридин-2-ил]хинолинах 6 для по-
проведено по реакции нуклеофильного замещения
лучения их 8-гидрокизамещенных производных 5
водорода (вариант присоединение-отщепление),
путем реакции с трибромидом бора в дихлормета-
который был также ранее описан [25]. При этом
не не удалось.
промежуточные σН-аддукты 4 были ароматизо-
Таким образом, нами продемонстрирова-
ваны действием 2,3-дихлор-5,6-дициано-1,4-бен-
на успешная применимость сочетания реакций
зохинона (DDQ) в качестве окислителя. Реализо-
SNH при взаимодействии 8-метоксизамещенных
вать дальнейшую реакцию аза-Дильса-Альдера с
2-(6-арил-1,2,4-триазин-3-ил)хинолинов с ин-
2,5-норборнадиеном в классических условиях, т. е.
долом и реакции аза-Дильса-Альдера
5-индо-
при кипячении в толуоле или даже в более высо-
лил-3-(8-метоксихинолин-2-ил)-1,2,4-триазинов с
кокипящих растворителях, таких как о-ксилол или
2,5-норборнаденом в условиях повышенных дав-
1,2-дихлорбензол, не удалось, и из реакционной
ления и температуры в автоклаве для получения
массы были практически количественно выделены
8-метокси(гидрокси)замещенных
2-[6-(индол-3-
1,2,4-триазиновые прекурсоры. Вследствие этого
ил)пиридин-2-ил]хинолинов. При этом продемон-
данная реакция нами была проведена при нагре-
стрирована возможность частичного деметилиро-
вании 1,2,4-триазинов 1 с 2,5-норборнадиеном в
вания метоксигруппы хинолинового фрагмента
1,2-дихлорбензоле до 215°С в условиях автоклава.
1,2,4-триазинового прекурсора непосредственно в
В результате этой реакции в составе реакционной
ходе реакции аза-Дильса-Альдера в условиях ав-
массы были обнаружены два соединения, а имен-
токлава.
но с выходом 30-40% продукт деметилирования
ЭКСПЕРМЕНТАЛЬНАЯ ЧАСТЬ
метоксигруппы фрагмента хинолина 5, а также
продукт 6 с фрагментом 8-метоксихинолина. Ин-
Для проведения реакций аза-Дильса-Альдера
тересно, что деметилирование протекало исклю-
при повышенном давлении был использован сте-
чительно по фрагменту хинолина и при этом не
клянный толстостенный реактор фирмы «Sigma-
затрагивало другие метоксигруппы, например, в
Aldrich». Спектры ЯМР 1H и 13С записаны на
составе ароматического заместителя 1,2,4-триази-
спектрометре Bruker Avance-400 (400 МГц), вну-
на 1б. Наличие соединений 5 в составе реакцион-
тренний стандарт - SiMe4. Масс-спектры (тип
ной массы доказано данными масс-спектрометрии
ионизации - электроспрей) записаны на приборе
(электроспрей), а также спектроскопии ЯМР 1Н.
MicrOTOF-Q II Bruker Daltonics (Бремен, Герма-
Так, в частности, наблюдается уширенный син-
ния). Элементный анализ выполнен на CHN ана-
глет протона гидроксигруппы хинолина в области
лизаторе РЕ 2400 II PerkinElmer.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СОЧЕТАНИЕ РЕАКЦИЙ S
H/N
аза-ДИЛЬСА-АЛЬДЕРА
691
1,2,4-Триазины 3 и 2б получены по описанному
Масс-спектр, m/z: 476.20 [M + H]+. Найдено, %: С
методу [27].
73.20; Н 5.23; N 14.67. С29Н25N5O2. Вычислено, %:
С 73.25; Н 5.30; N 14.73.
8-Метокси-2-(6-фенил-1,2,4-триазин-3-ил)-
хинолин (2a) был получен по ранее описан-
Общая методика получения 8-метокси-2-(5-
ному методу [27]. Выход 75%. Спектр ЯМР 1Н
(1-метил-1Н-индол-3-ил)-1,2,4-триазин-3-ил)-
(ДМСО-d6), δ, м. д.: 4.10 c (3H, OCH3), 7.24 д (1H,
хинолинов 1. 2,3-Дихлор-5,6-дициано-1,4-бензо-
Н-6, хинолин, J 8.0 Гц), 7.54-7.69 м (5H, Ph, хино-
хинон (170 мг, 0.75 ммоль) добавляли к раствору
лин), 8.31-8.36 м (2H, Ph), 8.47-8.53 м (1H, Н-3 хи-
соответствующего
4,5-дигидро-1,2,4-триазина
4
нолин, J 8.4 Гц), 8.65 д (1H, Н-4 хинолин, J 8.4 Гц),
(0.67 ммоль) в 1,2-дихлорэтане (30 мл). Получен-
9.57 c (1H, H5). Масс-спектр, m/z: 315.12 [M + H]+.
ную смесь перемешивали при комнатной темпера-
Найдено, %: С 72.55; Н 4.41; N 17.77. С19Н14N4O.
туре в течение 8 ч. Растворитель удаляли при по-
Вычислено, %: С 72.60; Н 4.49; N 17.82.
ниженном давлении. Продукт реакции выделяли
колоночной хроматографией (нейтральная окись
Общая методика получения σН-аддуктов 4.
К суспензии соответствующего 1,2,4-триазина 2
алюминия, элюент - этилацетат).
(0.7 ммоль) в 1,2-дихлорэтане (30 мл) добавляли
8-Метокси-2-[5-(1-метил-1Н-индол-3-ил)-
N-метилиндол (0.092 мл, 0.7 ммоль) и трифторук-
6-фенил-1,2,4-триазин-3-ил]хинолин (1a). Вы-
сусную кислоту (0.166 мл, 2 ммоль). Полученный
ход 265 мг (0.6 ммоль, 80%). Спектр ЯМР 1Н
раствор перемешивали при комнатной температу-
(ДМСО-d6), δ, м. д.: 3.71 с (3H, CH3), 4.19 c (3H,
ре в течение 8 ч. Смесь промывали водным раство-
OCH3), 6.86 с (1Н, Н2, индол), 7.27-7.33 м (3Н, ин-
ром карбоната натрия, растворитель удаляли при
дол, Н7, хинолин), 7.47-7.48 м (1Н, индол), 7.60-
пониженном давлении. Продукт реакции исполь-
7.63 м (5Н, Ph, Н5,6, хинолин), 7.73-7.75 м (2H,
зовали на следующей стадии без дополнительной
Ph), 8.52 д (1Н, Н3, хинолин, J 8.4 Гц), 8.71 д (1H,
очистки.
Н4, хинолин, J 8.4 Гц), 9.11-9.13 м (1Н, индол).
Масс-спектр, m/z: 444.18 [M + H]+. Найдено, %: С
8-Метокси-2-(5-(1-метил-1Н-индол-3-ил)-6-
75.77; Н 4.70; N 15.75. С28Н21N5O. Вычислено, %:
фенил-4,5-дигидро-1,2,4-триазин-3-ил)хинолин
(4a). Выход 264 мг (0.59 ммоль, 85%). Спектр ЯМР
С 75.83; Н 4.77; N 15.79.
1Н (ДМСО-d6), δ, м. д.: 3.72 с (3H, CH3), 4.05 c (3H,
8-Метокси-2-[6-(4-метоксифенил)-5-(1-ме-
OCH3), 6.55 с (1H, HСsp3), 7.16-7.22 м (2Н, индол),
тил-1Н-индол-3-ил)-1,2,4-триазин-3-ил]хино-
7.31 д (1H, Н7, хинолин, J 8.0 Гц), 7.39-7.48 м (5Н,
лин (1б). Выход 276 мг (0.58 ммоль, 78%). Спектр
Ph, индол), 7.60 д (1Н, Н5, хинолин, J 8.0 Гц), 7.67
ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.73 с (3H, CH3), 3.90
д. д (1H, Н6, хинолин, J 8.0 Гц), 8.90-8.95 м (3Н,
c (3H, OCH3), 4.15 c (3H, OCH3), 7.09 с (1Н, Н2,
Ph, индол), 8.24 д (1H, Н3, хинолин, J 8.4 Гц), 8.56-
индол), 7.17 д (2Н, CH3OC6H4, J 8.4 Гц), 7.34-7.36
8.58 м (1Н, Н4, хинолин, J 8.4 Гц). Масс-спектр,
м (3H, индол, хинолин), 7.54-7.56 м (1Н, индол),
m/z: 446.19 [M + H]+. Найдено, %: С 75.41; Н 5.15;
7.64-7.66 м (2Н, индол, хинолин), 7.71 д (2H,
N 15.68. С28Н23N5O. Вычислено, %: С 75.49; Н
CH3OC6H4, J 8.4 Гц), 8.59 д (1H, Н3, хинолин, J
5.20; N 15.72.
8.4 Гц), 8.69 д (1H, Н4, хинолин, J 8.4 Гц), 9.09-9.12
м (1Н, индол). Масс-спектр, m/z: 474.19 [M + H]+.
8-Метокси-2-(5-(1-метил-1Н-индол-3-ил)-6-
Найдено, %: С 73.50; Н 4.86; N 14.71. С29Н23N5O2.
метоксифенил-4,5-дигидро-1,2,4-триазин-3-ил)-
Вычислено, %: С 73.56; Н 4.90; N 14.79.
хинолин (4б). Выход 289 мг (0.61 ммоль, 87%).
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.79 с (6H,
Общая методика получения 8-метокси-2-[6-
CH3, OCH3), 4.10 c (3H, OCH3), 6.56 с (1H, HСsp3),
(1-метил-1Н-индол-3-ил)пиридин-2-ил]хиноли-
6.97 д (2Н, CH3OC6H4, J 8.8 Гц), 7.12-7.24 м (3H,
нов 6. К суспензии соответствующего 1,2,4-три-
индол), 7.30-7.32 м (1Н, Н7, хинолин, J 7.6 Гц),
азина 1 (0.5 ммоль) в 1,2-дихлорбензоле (20 мл)
7.40-7.42 м (2Н, индол), 7.60 д (1H, Н5, хинолин,
добавляли 2,5-норборнадиен (4 ммоль). Получен-
J 8.4 Гц), 7.68 д. д (1H, Н6, хинолин, J 8.4 Гц),
ную смесь перемешивали в автоклаве в атмосфере
7.91 д (2H, CH3OC6H4, J 8.8 Гц), 8.25 д (1H, Н3, J
аргона при 215°С в течение 20 ч, затем раствори-
8.8 Гц, хинолин), 8.58 д (1Н, Н4, хинолин, J 8.8 Гц).
тель удаляли при пониженном давлении. Иоди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
692
САВЧУК и др.
стый метил (0.037 мл, 0.6 ммоль) и карбонат калия
СПИСОК ЛИТЕРАТУРЫ
(744 мг, 5.4 ммоль) добавляли к раствору получен-
1.
Прохоров А.М., Кожевников Д.Н. // ХГС. № 8.
ной смеси в безводном ДМФА (30 мл). Смесь пе-
С. 1237; Prokhorov A.M., Kozhevnikov D.N. // Chem.
ремешивали при комнатной температуре в течение
Heterocycl. Compd. 2012. Vol. 48. P. 1153. doi 10.1007/
8 ч, затем добавляли воду (20 мл). Осадок отфиль-
s10593-012-1117-9
тровывали и промывали водой.
2.
Boger D. L., Panek J. S. // J. Org. Chem. 1981. Vol. 46.
P. 2179. doi 10.1021/jo00323a044
8-Метокси-2-[6-(1-метил-1Н-индол-3-ил)-5-
3.
Zyryanov G.V., Kopchuk D.S., Kovalev I.S., Santra S.,
фенилпиридин-2-ил]хинолин (6a). Выход 154 мг
Rahman M., Khasanov A.F., Krinochkin A.P.,
(0.35 ммоль, 70%). Спектр ЯМР 1Н (ДМСО-d6), δ,
Taniya O.S., Chupakhin O.N., Charushin V.N. //
м. д.: 3.69 с (3H, CH3), 4.11 c (3H, OCH3), 6.69 с
Mendeleev Commun. 2020. Vol. 30. P. 537. doi
(1Н, Н2, индол), 7.10-7.12 м (1Н, индол), 7.17-7.21
10.1016/j.mencom.2020.09.001
м (2H, индол), 7.37-7.40 м (6Н, Ph, индол, хино-
4.
Kozhevnikov D.N., Rusinov V.L., Chupakhin O.N. //
лин), 7.51-7.52 м (2Н, Ph), 7.86 д (1H, H3, Py, J
Adv. Heterocycl. Chem. 2002. Vol. 82. P. 261. doi
10.1016/S0065-2725(02)82029-3
8.0 Гц), 8.17 д (1Н, хинолин, J 6.0 Гц), 8.40 д (1H,
5.
Кожевников Д.Н. , Русинов В.Л., Чупахин О.Н. //
Н3, хинолин, J 8.8 Гц), 8.58 д (1Н, H4, Py, J 8.0 Гц),
Усп. хим. 1998. Т. 67. № 8. С. 633; Kozhevni-
8.74 д (1H, Н4, хинолин, J 8.8 Гц). Масс-спектр,
kov D.N., Rusinov V.L., Chupakhin O.N. // Russ.
m/z: 442.19 [M + H]+. Найдено, %: С 81.56; Н 5.19;
Chem. Rev. 1998. Vol. 67. N 8. P. 633. doi 10.1070/
N 9.47. С30Н23N3O. Вычислено, %: С 81.61; Н 5.25;
RC1998v067n08ABEH000437
N 9.52.
6.
Kozhevnikov D.N., Kozhevnikov V.N., Prokhorov A.M.,
8-Метокси-2-[5-(4-метоксифенил)-6-(1-ме-
Ustinova M.M., Rusinov V.L., Chupakhin O.N.,
Aleksandrov G.G., König B. // Tetrahedron Lett. 2006.
тил-1Н-индол-3-ил)пиридин-2-ил]хинолин (6б).
Vol. 47. P. 869. doi 10.1016/j.tetlet.2005.12.006
Выход 176 мг (0.37 ммоль, 75%). Спектр ЯМР 1Н
7.
Charushin V.N., Chupakhin O.N. // Top. Heterocycl.
(ДМСО-d6), δ, м. д.: 3.72 с (3H, CH3), 3.82 c (3H,
Chem. 2014. Vol. 37. P. 1. doi 10.1007/7081_2013_119
OCH3), 4.10 c (3H, OCH3), 6.80 с (1Н, Н2, индол),
8.
Chupakhin O.N., Charushin V.N. // Pure Appl. Chem.
6.93 д (2Н, CH3OC6H4, J 8.4 Гц), 7.10 д. д (1H, Н6,
2017. P. 1195. doi 10.1515/pac-2017-0108
хинолин, J 7.2 Гц,), 7.17-7.21 м (2Н, индол, Н7,
9.
Pfueller O.C., Sauer J. // Tetrahedron Lett. 1998.
хинолин), 7.31 д (2Н, CH3OC6H4, J 8.4 Гц), 7.39 д
Vol. 39. P. 8821. doi 10.1016/S0040-4039(98)02043-7
(1H, Н5, хинолин, J 8.4 Гц), 7.51-7.52 м (2Н, ин-
10.
Kozhevnikov V.N., Kozhevnikov D.N., Nikitina T.V.,
Rusinov V.L., Chupakhin O.N., Zabel M., König B. //
дол), 7.82-7.84 м (1H, H3, Py, J 8.0 Гц), 8.11-8.13 м
J. Org. Chem. 2003. Vol. 68. P. 2882. doi 10.1021/
(1H, индол), 8.41 д (1H, Н3, хинолин, J 8.4 Гц), 8.54
jo0267955
д (1H, H4, Py, J 8.0 Гц), 8.70-8.72 м (1H, Н4, хино-
11.
Савчук М.И., Штайц Ю.К., Копчук Д.С., Ель-
лин, J 8.4 Гц). Масс-спектр, m/z: 472.20 [M + H]+.
цов О.С., Поспелова Т.А., Русинов В.Л., Чупа-
Найдено, %: С 81.56; Н 5.19; N 9.47. С31Н25N3O2.
хин О.Н. // ХГС. 2019. Т. 55. № 10. С. 985; Sav-
Вычислено, %: С 78.96; Н 5.34; N 8.91.
chuk M.I., Shtaitz Y.K., Kopchuk D.S., Zyryanov G.V.,
Eltsov O.S., Pospelova T.А., Rusinov V.L., Chupa-
ФОНДОВАЯ ПОДДЕРЖКА
khin O.N. // Chem. Heterocycl. Compd. 2019. Vol. 55.
Работа выполнена при поддержке Россий-
P. 985. doi 10.1007/s10593-019-02566-7
ского научного фонда (грант № 19-73-10144),
12.
Catozzi N., Bromley W.J., Wasnaire P., Gibson M.,
Taylor R.J.K. // Synlett. 2007. P. 2217. doi 10.1055/s-
а также в рамках выполнения государственно-
2007-984918
го задания (проект
№ 0398-2019-0005 ААА-
13.
Kopchuk D.S., Krinochkin A.P., Starnovskaya E.S.,
А-А19-119012290117-6) с использованием обору-
Shtaitz Y.K., Khasanov A.F., Taniya O.S., Santra S.,
дования Центра коллективного пользования «Спек-
Zyryanov G.V., Majee A., Rusinov V.L., Chupakhin O.N. //
троскопия и анализ органических соединений».
ChemistrySelect. 2018. Vol. 3. P. 4141. doi 10.1002/
slct.201800220
КОНФЛИКТ ИНТЕРЕСОВ
14.
Rocha Gonsalves A.M.d’A., Pinho e Melo T.M.V.D.,
Авторы заявляют об отсутствии конфликта
Gilchrist T.L. // Tetrahedron. 1992. Vol. 48. P. 6821. doi
интересов.
10.1016/S0040-4020(01)89873-2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СОЧЕТАНИЕ РЕАКЦИЙ S
H/N
аза-ДИЛЬСА-АЛЬДЕРА
693
15.
Копчук Д.С., Никонов И.Л., Хасанов А.Ф., Гундала С.,
22.
Chepchugov N.V., Kopchuk D.S., Kovalev I.S., Zyrya-
Криночкин А.П., Слепухин П.А., Зырянов Г.В., Вен-
nov G.V., Rusinov V.L., Chupakhin O.N. // Mendeleev
катапурам П., Чупахин О.Н., Чарушин В.Н. // ХГС.
Commun. 2016. Vol. 26. P. 220. doi 10.1016/j.
2019. Т. 55. № 10. С. 978; Kopchuk D.S., Nikonov I.L.,
mencom.2016.04.014
Khasanov A.F., Gundala S., Krinochkin A.P., Slepu-
23.
Kopchuk D.S., Krinochkin A.P., Kovalev I.S.,
khin P.A., Zyryanov G.V., Venkatapuram P., Chupa-
Taniya O.S., Zyryanov G.V., Rusinov V.L., Chupa-
khin O.N., Charushin V.N. // Chem. Heterocycl. Compd.
khin O.N., Petrov A.Yu., Suvorova A.I. // AIP Conf.
2019. Vol. 55. P. 978. doi 10.1007/s10593-019-02565-8
Proc. 2020. Vol. 2280. P. 040024-1-040024-3. doi
16.
Копчук Д.С., Никонов И.Л., Зырянов Г.В., Кова-
лев И.С., Чупахин О.Н. // ХГС. 2014. Т. 50. № 6.
10.1063/5.0018034
С. 983; Kopchuk D.S., Nikonov I.L., Zyryanov G.V.,
24.
Копчук Д.С.,Хасанов А.Ф., Чепчугов Н.В., Кова-
Kovalev I.S., Rusinov V.L., Chupakhin O.N. // Chem.
лев И.С.,Зырянов Г.В., Русинов В.Л., Чупахин О.Н. //
Heterocycl. Compd. 2014. Vol. 50. P. 907. doi 10.1007/
ЖОрХ. 2017. Т. 53. № 1. С. 103; Kopchuk D.S.,
s10593-014-1545-9
Khasanov A.F., Chepchugov N.V., Kovalev I.S.,
17.
Taniya O.S., Kopchuk D.S., Khasanov A.F., Kova-
Zyryanov G.V., Rusinov V.L., Chupakhin O.N. // Russ.
lev I.S., Zyryanov G.V., Charushin V.N., Chupakhin O.N. //
J. Org. Chem. 2017. Vol. 53. P. 99. doi 10.1134/
Chem. Heterocycl. Compd. 2019. Vol. 55. P. 505. doi
S1070428017010183
10.1007/s10593-019-02491-9
25.
Kopchuk D.S., Nikonov I.L., Khasanov A.F., Giri K.,
18.
Kopchuk D.S., Chepchugov N.V., Taniya O.S., Khasa-
Santra S., Kovalev I.S., Nosova E.V., Gundala S.,
nov A.F., Giri K., Kovalev I.S., Santra S., Zyrya-
nov G.V., Majee A., Rusinov V.L., Chupakhin O.N. //
Venkatapuram P., Zyryanov G.V., Majee A., Chupakhin
Tetrahedron Lett. 2016. Vol. 57. P. 5639. doi 10.1016/j.
O.N. // Org. Biomol. Chem. 2018. Vol. 16. P. 5119. doi
tetlet.2016.11.008
10.1039/c8ob00847g
19.
Diring S., Retailleau P., Ziessel R. // J. Org. Chem.
26.
Savchuk M.I., Kovalev I.S., Rusinov V.L., Kop-
2007. Vol. 72. P. 10181. doi 10.1021/jo7019866
chuk D.S., Krinochkin A.P., Zyryanov G.V., Chupa-
20.
Kopchuk D.S., Khasanov A.F., Kovalev I.S., Zyrya-
khin O.N., Charushin V.N. // Mendeleev Commun. 2020.
nov G.V., Rusinov V.L., Chupakhin O.N. // Mendeleev
Vol. 30. P. 712. doi 10.1016/j.mencom.2020.11.007
Commun. 2013. Vol. 23. P. 209. doi 10.1016/j.
27.
Kozhevnikov V.N., Shabunina O.V., Kopchuk D.S.,
mencom.2013.07.010
21.
Lorion M., Guillaumet G., Brière J.-F., Suzenet F. //
Ustinova M.M., König B., Kozhevnikov D.N. //
Org. Lett. 2015. Vol. 17. P. 3154. doi 10.1021/acs.
Tetrahedron. 2008. Vol. 64. P. 8963. doi 10.1016/j.
orglett.5b01487
tet.2008.06.040
Combination of the SH/aza-Diels-Alder Reactions as Effective
Synthetic Approach to 8-Hydroxy(methoxy)-Substituted
2-[6-(1-Methylindol-3-yl)pyridin-2-yl]quinoline
Ligands/Fluorophores
М. I. Savchuka,b, D. S. Kopchuka,b, I. N. Egorovb, А. F. Khasanovb, S. S. Rybakovab,
G. V. Zyryanova,b,*, V. L. Rusinova,b, and О. N. Chupakhina,b
a Postovsky Institute of Organic Synthesis, Ural Branch of the Russian Academy of Sciences, Yekaterinburg, 620990 Russia
b Ural Federal University, Yekaterinburg, 620002 Russia
*e-mail: gvzyryanov@gmail.com
Received March 29, 2021; revised March 29, 2021; accepted April 11, 2021
8-Hydroxy(methoxy)-substituted 2-[6-(1-methylindol-3-yl)pyridin-2-yl]quinoline ligands were synthesized
by means of combination of SNH reaction between 8-methoxy-substituted 2-(6-aryl-1,2,4-triazin-3-yl)
quinolones and indole and aza-Diels-Alder reaction of the obtained 1,2,4-triazines with 2,5-norbornadiene.
The demethylation of quinolone moiety of 1,2,4-triazine precursor during aza-Diels-Alder reaction in autoclave
was demonstrated.
Keywords: aza-Diels-Alder reaction, 1,2,4-triazine, 8-methoxyquinoline, demethylation, autoclave
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021