ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 5, с. 694-702
УДК 542.943:547.854.4:547.781.8/.718
СИНТЕЗ, СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ
АНАЛИЗ N-(2,4-ДИХЛОРФЕНИЛ)-
2-[6-МЕТИЛ-2,4-ДИОКСО-3-(ТИЕТАН-3-ИЛ)-1,2,3,4-
ТЕТРАГИДРОПИРИМИДИН-1-ИЛ]АЦЕТАМИДА
© 2021 г. В. А. Катаевa, С. А. Мещеряковаa, Е. С. Мещеряковаb, Т. В. Тюмкинаb,
Л. М. Халиловb, В. В. Лазаревc, В. В. Кузнецовc,d,*
a Башкирский государственный медицинский университет, Уфа, 450008 Россия
b Институт нефтехимии и катализа Российской академии наук, Уфа, 450075 Россия
c Уфимский государственный авиационный технический университет, ул. К. Маркса 12, Уфа, 450008 Россия
d Уфимский государственный нефтяной технический университет, Уфа, 450062 Россия
*e-mail: kuzmaggy@mail.ru
Поступило в Редакцию 26 марта 2021 г.
После доработки 26 марта 2021 г.
Принято к печати 15 апреля 2021 г.
Взаимодействием 6-метилурацила с 2-хлорметилтиираном получен 6-метил-3-(тиетан-3-ил)урацил.
Его взаимодействием с N-(2,6-дихлорфенил)-2-хлорацетамидом получен N-(2,4-дихлорфенил)-2-[6-ме-
тил-2,4-диоксо-3-(тиетан-3-ил)-1,2,3,4-тетрагидропиримидин-1-ил]ацетамид, строение которого установ-
лено методами рентгеноструктурного анализа, ЯМР и ИК спектроскопии. Компьютерное моделирование
в рамках приближений PBE/3ζ, PBE/cc-pVDZ и PBE/SV(P) показало, что конформационное поведение
полученного ацетамида обусловлено внутренним вращением тиетанильной группы как в газовой фазе,
так и в растворах хлороформа и диметилсульфоксида.
Ключевые слова: 6-метил-3-(тиетан-3-ил)урацил, производные 6-метилурацила, тиетаны, компьютерное
моделирование, кластерная модель
DOI: 10.31857/S0044460X2105005X
Производные 6-метилурацила широко распро-
расширению спектра биологической активности
странены в живой природе [1], применяются в
полученных производных. В связи с изложенным,
органическом синтезе [2] и служат основой для
целью настоящего исследования является синтез
получения ряда новых лекарственных соединений
ранее неизвестного амидного производного 6-ме-
[3]. Производные тиетана широко используются в
тил-3-(тиетан-3-ил)урацила, изучение его строе-
органическом синтезе, а их противовоспалитель-
ния, а также конформационный анализ в рамках
ные, седативные, инсектицидные свойства делают
DFT приближений PBE/3ζ, PBE/cc-pVDZ, PBE/
этот класс соединений перспективными объекта-
SV(P) (программный комплекс ПРИРОДА [8].
ми для исследований в фармацевтике [4, 5]. Поми-
Целевой
N-(2,4-дихлорфенил)-2-[6-метил-
мо этого, амиды 1,2,3,4-тетрагидропиримидинкар-
2,4-диоксо-3-(тиетан-3-ил)-1,2,3,4-тетрагидропи-
боновых кислот при общей низкой токсичности
римидин-1-ил]ацетамид 1 снтезировали в два этапа
обладают антиоксидантной и антиметастатиче-
(схема
1). Вначале взаимодействием
6-метил-
ской активностью [6, 7]. Таким образом, введение
урацила
2 с хлорметилтиираном получали
тиетанового заместителя и амидной группировки
промежуточный
6-метил-3-(тиетан-3-ил)пири-
в молекулу 6-метилурацила должно привести к
мидин-2,4(1Н,3Н)дион
3, как описано ранее
694
СИНТЕЗ, СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
695
Схема 1.
O
S
O
S
H
N
Cl
N
KOH
O
N
CH3
O
N
CH3
H
H
2
3
S
O
N
Cl
Cl
H
O
N
CH3
N
3+Cl
H
N
O
Cl
O
4
Cl
1
[9]; строение его было доказано в работе [10]. Вза-
кристаллы с пространственной группой Pna21
имодействием производного 3 с N-(2,6-дихлорфе-
(табл. 1). Тиетанильный заместитель находится
у атома N3 [10]. Ацетамидная часть приподнята
нил)-2-хлорацетамидом 4 был получен конечный
над плоскостью урацильного кольца, а угол меж-
ацетамид 1. Строение его подтверждено методами
ду плоскостями дихлорфенильного и урацильного
ЯМР 1Н и ИК спектроскопии и однозначно доказа-
фрагментов составляет 58.7(3)° (рис. 1). В табл. 2
но методом рентгеноструктурного анализа.
приведены отдельные длины связей, а также ва-
По данным рентгеноструктурного анализа, мо-
лентные и торсионные углы в молекуле соедине-
лекулы ацетамида 1 формируют орторомбические
ния 1.
Таблица 1. Кристаллографические данные и детали рентгеноструктурного эксперимента
Параметр
Значение
Формула
C16H15Cl2N3O3S
М
400.27
Температура, K
293(2)
Кристаллическая система
Орторомбическая
Пространственная группа
Pna21
a, Å
29.6126(17)
b, Å
4.7615(3)
c, Å
12.1663(6)
Объем, Å3
1715.44(16)
Z
4
dвыч, мг/мм3
1.550
μ, мм-1
0.522
F(000)
824.0
Область сканирования по θ, град
-22 ≤ h ≤ 42, -6 ≤ k ≤ 3, -14 ≤ l ≤ 16
Область индекса отражений
3596 [Rint 0.0149, Rsigma 0.0291]
Число измеренных/независимых отражений
3596/1/286
GOOF
1.116
R1 для Ihkl>2σ(I), wR2
R1 0.0364, wR2 0.0742
R1 для всех Ihkl, wR2
R1 0.0397, wR2 0.0769
∆ρmax/∆ρmax, e/Å3
0.20/-0.22
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
696
КАТАЕВ и др.
Таблица 2. Избранные длины связей, валентные и торсионные углы в молекуле ацетамида 1 (данные расчета PBE/3ζ)
Длины связей, r, Å
Валентные углы, φ, град
Торсионные углы, φ, град
расчет
эксперимент
расчет
эксперимент
расчет
эксперимент
C3-N2
C1N2C3
C3N2C11C18
1.383
1.383(4)
123.9
123.5(2)
60.01
52.35(2)
N2-C11
C16S17C18
C1N2C11C18
1.478
1.473(3)
76.87
77.39(14)
-118.16
-126.81(2)
C18-S17
C11C16S17
N4C7C24N25
1.863
1.830(3)
89.25
89.94(19)
64.76
147.91(16)
О9-С3
N2C1C5
C7C24N25C27
1.239
1.213(3)
114.5
115.0(2)
178.76
179.79(9)
C5-С6
N2C3N4
1.361
1.341(4)
116.8
117.1(2)
N25-С24
C3N4C6
1.377
1.350(4)
122.4
122.0(2)
С32-Cl33
C7C24N25
1.748
1.732(3)
112.9
114.8(2)
C24-O26
C27C32
C31
1.224
1.218(3)
121.6
122.0(3)
Конформационный анализ ацетамида 1 про-
принципе обобщенного градиентного прибли-
водили с помощью DFT расчетных приближений
жения (GGA) и хорошо зарекомендовал себя при
PBE/3ζ, PBE/cc-pVDZ и PBE/SV(P) (программный
анализе различных органических и неорганиче-
комплекс ПРИРОДА [8]). Метод PBE основан на
ских молекулярных систем [11]. Базисный набор
тройного валентного расщепления 3ζ [12], являет-
ся полноэлектронным нерелятивистским атомным
базисом гауссового типа, содержащим диффузную
часть и поляризационные функции. Валентно-рас-
щепленный корреляционно согласованный базис-
ный набор cc-pVDZ [13] и валентно-расщеплен-
ный базисный набор SV(P) [14] также эффективно
используются для корректной оценки термодина-
мических параметров различных химических про-
цессов.
Методом PBE/3ζ установлено, что глобаль-
ному минимуму на поверхности потенциальной
энергии ацетамида 1 соответствует конформер А
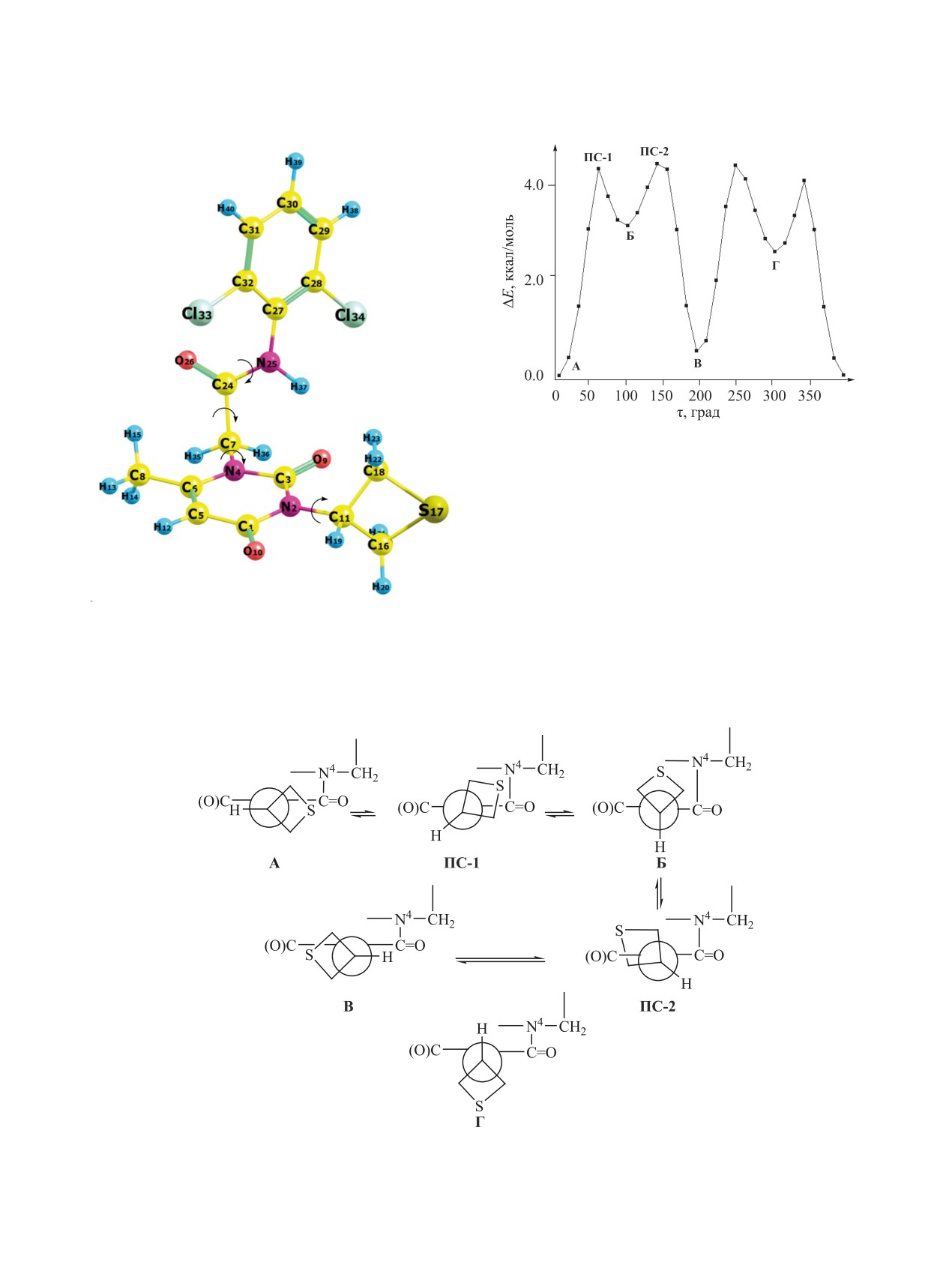
(рис. 2), близкий к его кристаллической структуре
(рис. 1).
Расчетные значения длин связей, валентных
и торсионных углов в сравнении с данными РСА
представлены в табл. 2. Основные структурные
различия связаны с конформацией амидной ча-
сти: в случае изолированной молекулы она более
отклонена от урацильного фрагмента; угол между
плоскостями дихлорфенильного и урацильного
колец составляет 120°. Заметны также изменения
Рис. 1. Общий вид молекулы соединения 1 в кристалле.
в значениях некоторых торсионных углов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ, СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
697
Рис. 3. Зависимость относительной энергии ацетамида
1 от величины торсионного угла C1N2C11H19 (относи-
тельная энергия формы А принята за нуль).
Для оценки конформационной подвижности
молекулы соединения 1 был выполнен конформа-
ционный анализ путем последовательного враще-
ния вокруг связей N4-C7, C7-C24 и C24-N25 в амид-
ном фрагменте на 360° (рис. 2). В каждом случае
Рис. 2. Конформер А, отвечающий минимуму потенци-
оценивали максимальную энергию переходного
альной энергии для изолированной молекулы ацетами-
да 1 по данным расчета PBE/3ζ.
состояния относительного главного минимума,
Схема 2.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
698
КАТАЕВ и др.
Таблица 3. Энергетические параметры конформационных превращений молекул ацетамида 1 по данным метода
PBE
Соединение
Базисный набор
Конформер
Вращение вокруг связи
ΔG°298 (ΔG≠298), ккал/мольа
1
3ζ
ПС
N4-C7
(12.77)
cc-pVDZ
ПС
(15.07)
SV(P)
ПС
(14.30)
3ζ
ПС
C7-C24
(10.13)
cc-pVDZ
ПС
(10.85)
SV(P)
ПС
(10.70)
3ζ
ПС
C24-N25
(16.61)
cc-pVDZ
ПС
(17.01)
SV(P)
ПС
(16.50)
3ζ
Б
N2-C11
1.94
В
0.15
Г
1.97
ПС-1
(4.36)
ПС-2
(4.40)
cc-pVDZ
В
0.66
ПС-2
(4.52)
SV(P)
В
0.30
ПС-2
(4.75)
1@5CHCl3
3ζ
В
0.10
ПС-2
(3.94)
cc-pVDZ
В
0.08
ПС-2
(3.98)
SV(P)
В
-0.30
ПС-2
(4.42)
1@5ДМСО
3ζ
В
0.90
ПС-2
(4.54)
cc-pVDZ
В
0.80
ПС-2
(3.69)
SV(P)
В
1.07
ПС-2
(4.59)
а Относительно конформера А.
который во всех случаях отвечал форме А. Поми-
также почти вырожденные по энергии переходные
мо этого был также рассчитан барьер внутренне-
состояния ПС-1 и ПС-2 (рис. 3, схема 2).
го вращения тиетанильной группы вокруг связи
Конформеры А и В различаются взаимным
N2-C11. Результаты, приведенные в табл. 3, сви-
расположение атома серы тиетанового цикла и
детельствуют о конформационной жесткости
амидного фрагмента. Их относительные энергии
амидной части молекулы: барьеры внутреннего
во всех использованных приближениях свидетель-
вращения во всех использованных приближениях
ствуют о заметной концентрации последней фор-
составляют 10.1-16.5 ккал/моль.
мы в смеси конформеров при комнатной темпера-
В то же время, барьер вращения тиетанильной
туре (табл. 3).
группы относительно невелик и не превышает 4.5-
В рамках кластерной модели [15, 16] было
4.8 ккал/моль (табл. 3). В этом случае на поверх-
исследовано влияние молекул растворителей на
ности потенциальной энергии помимо главного
величину свободной энергии и потенциальных
(форма А) существуют несколько локальных ми-
барьеров отдельных конформеров, связанных с
нимумов и переходных состояний (формы Б-Г), а
вращением тиетанильного заместителя в ацетами-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ, СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
699
Рис. 4. Кластер 1@5CHCl3 (конформер А).
де 1. Опираясь на предыдущие результаты оцен-
оксо-3-(тиетан-3-ил)-1,2,3,4-тетрагидропирими-
ки воздействия среды на конформационное рав-
дин-1-ил]ацетамида и свидетельствует лишь об
новесие гетероциклических соединений [17-19],
относительно высокой заселенности формы В в
согласно которым оптимальное число молекул
малополярном хлороформе. Учитывая, что рас-
растворителя в ближайшей сольватной оболочке
четные дипольные моменты конформеров А и В
не должно превышать десяти, мы рассмотрели
составляют 3.22 и 3.52 Д соответственно, причина
модель с пятью молекулами (рис. 4); в качестве
такого смещения равновесия не связана с полярно-
растворителей использовали малополярный хло-
стью среды.
роформ (ε 4.8) и полярный диметилсульфоксид
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(ε 46.7).
Рентгеноструктурный анализ проведен на
Для конформационного равновесия изолиро-
автоматическом четырехкружном дифрактоме-
ванной молекулы в рамках всех использованных
тре XCalibur Eos, (графитовый монохроматор,
расчетных приближений характерна высокая засе-
MoKα-излучение, λ 0.71073 Å, ω-сканирование,
ленность форм А и В (табл. 3). В случае кластера
2θmax 62°). Сбор и обработка данных проведены с
1@5CHCl3 происходит дополнительная стабили-
помощью программы CrysAlisPro Oxford Diffraction
зация конформера В, который при использовании
Ltd., версия 1.171.36.20. Структуры расшифрова-
базиса SV(P) становится главным минимумом на
ны прямым методом и уточнены полноматричным
поверхности потенциальной энергии; понижает-
методом наименьших квадратов в анизотропном
ся также и главный потенциальный барьер ПС-
приближении для неводородных атомов. Атомы
2. Однако в кластере 1@5ДМСО форма С замет-
водорода локализованы в разностном синтезе Фу-
но дестабилизируется и, за исключением PBE/
рье и уточнены изотропно. Расчеты выполняли по
cc-pVDZ, растет энергия переходного состояния
программе SHELX97 [20]. Кристаллографические
ПС-2. В целом, однако, присутствие раствори-
данные и детали рентгеноструктурного экспери-
теля в рамках использованной модели не меняет
мента приведены в табл. 1. Соединение 1 заре-
принципиальный характер конформационного по-
гистрировано в Кембриджской базе структурных
ведения N-(2,4-дихлорфенил)-2-[6-метил-2,4-ди-
данных (CCDC 2015447).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
700
КАТАЕВ и др.
Cпектры ЯМР получены на спектрометре
вода, 1:1), Rf (хлороформ-этилацетат, 4:1) 0.85. ИК
Bruker Avance 400 с рабочими частотами 400.13
спектр, ν, см-1: 1572 с (С=С), 1649 c, 1661 c, 1697 c
(1H) и 100.62 (13С) в ДМСО-d6; сигналы приведе-
(C=O), 3209 ш (NH). Спектр ЯМР 1Н, (ДМСО-d6),
ны относительно остаточных протонов раствори-
δ, м. д.: 2.23 с (3Н, ССН3), 3.08-3.14 м [2Н, S(CH)2],
теля. Спектры ИК записаны на приборе Infralum
4.17-4.23 м [2H, S(CH)2], 4.76 c [2H, CH2C(O)],
FT-02 (таблетки KBr).
5.70 с (1Н, С=СН), 6.05-6.11 м (1Н, NСH), 7.37 т
Моделирование конформационных превраще-
(1Н4Ar, 3JНН 8.1 Гц), 7.56, д (2Н3,5Ar, 3JHH 8.0 Гц),
ний ацетамида 1 первоначально проводили с помо-
10.30 уш. с (1Н, NH). Найдено, %: С 48.11; Н 3.70;
щью пакета HyperChem [21] (РМ3), и затем в рам-
Cl 17.72; N 11.95; S 7.96. С16H15Cl2N3O2S. Вычис-
ках методов PBE/3ζ, PBE/cc-pVDZ и PBE/SV(P)
лено, %: С 48.00; H 3.75; Cl 17.75; N 12.00; S 8.00.
(ПРИРОДА) [8]. Для расчета переходного состо-
БЛАГОДАРНОСТЬ
яния моделировали внутреннее вращение вокруг
конкретной связи сканированием соответствую-
Структурные исследования N-(2,4-дихлор-
щего торсионного угла в пределах 360°. Конфор-
фенил)-2-[6-метил-2,4-диоксо-3-(тиетан-3-ил)-
мацию, отвечающую вершине полученной энер-
1,2,3,4-тетрагидропиримидин-1-ил]ацетамида
гетической кривой, рассчитывали далее в режиме
проведены в Центре коллективного пользования
поиска седловой точки (рис. 3). Принадлежность
«Агидель» при Институте нефтехимии и катализа
стационарных точек поверхности потенциальной
РАН.
энергии к минимумам подтверждена отсутствием
КОНФЛИКТ ИНТЕРЕСОВ
мнимых частот, а к переходным состояниям - на-
личием одной мнимой частоты в соответствующем
Авторы заявляют об отсутствии конфликта
гессиане. Аналогично проводили расчет кластеров
интересов.
с молекулами растворителя, первоначально разме-
СПИСОК ЛИТЕРАТУРЫ
щенными в виртуальном пространстве вблизи мо-
лекулы ацетамида 1 случайным образом.
1. Завьялов С.И., Ежова Г.И., Кравченко Н.Е., Ку-
ликова Л.Б., Дорофеева О.В., Румянцева Е.Е., За-
N-(2,6-Дихлорфенил)-2-хлорацетамид (4) по-
возин А.Г. // Хим. фарм. ж. 2003. Т. 37. № 7. С. 3;
лучен по методике [22]. Раствор 8.1 г (0.05 моль)
Zav’yalov S.I., Ezhova G.I., Kravchenko N.E., Kuliko-
2,6-дихлоранилина в 30 мл ацетона охлаждали до
va L.B., Dorofeeva O.V., Rumyantseva E.E., Zavo-
0°С и при перемешивании медленно добавляли по
zin A.G. // Pharm. Chem. J. 2003. Vol. 37. N 7. P. 337.
каплям раствор 5.65 г (0.05 моль) хлорацетилхло-
doi 10.1023/A:1026355105151
рида в 7 мл ацетона. Реакционную смесь переме-
2. Рахимов А.И., Каменева И.Ю., Навроцкий М.Б., Ти-
шивали 2 ч при комнатной температуре и выливали
това Е.С., Кудашев С.В. // ЖОХ. 2008. Т. 78. Вып. 5.
в 100 мл холодной воды. Осадок отфильтровыва-
С. 828; Rakhimov A.I., Kameneva I.Yu., Navrotskii M.B.,
ли, промывали водой и сушили в эксикаторе. Вы-
Titova E.S., Kudashev S.V. // Russ. J. Gen. Chem. 2008.
ход 7.6 г (64%), т. пл. 173-175°С (EtОН). Найдено,
Vol. 78. N 5. P. 971. doi 10.1134/S107036320805023X
%: С 40.33; Н 2.48; Cl 44.58; N 5.78. С8H6Cl3NO.
3. Якупова Л.Р., Иванова А.В., Сафиуллин Р.Л., Ги-
Вычислено, %: С 40.25; H 2.52; Cl 44.65; N 5.87.
мадиева А.Р., Чернышенко Ю.Н., Мустафин А.Г.,
Абдрахманов И.Б. // Изв. АН. Сер. хим. 2010. N 3.
N-(2,6-Дихлорфенил)-2-[6-метил-2,4-диоксо-
С. 507; Yakupova L.R., Ivanova A.V., Safiullin R.L.,
3-(тиетан-3-ил)-1,2,3,4-тетрагидропиримидин-
Gimadieva A.R., Chernyshenko Yu.N., Mustafin A.G.,
1-ил]ацетамид (1). Суспензию 0.5 г (2.5 ммоль)
Abdrakhmanov I.B. // Russ. Chem. Bull. 2010. Vol. 59.
соединения 3, 0.52 г (3.75 ммоль) измельченного и
N 3. P. 517. doi 10.1007/s11172-010-0138-8
прокаленного карбоната калия в 12 мл ацетонитри-
4. Xu J. // Beilstein J. Org. Chem. 2020. Vol. 16. P. 1357.
ла кипятили 30 мин, после чего добавляли 0.72 г
doi 10.3762/bjoc.16.116
(3 ммоль) соединения 4 в 3 мл ацетонитрила. По-
5. Dong J., Du H., Xu J. // J. Org. Chem. 2019. Vol. 84.
лученную смесь кипятили еще 7 ч, горячую реак-
N 17. P. 10724. doi 10.1021/acs.joc.9b01152
ционную массу фильтровали, растворитель отго-
6. Кушнир О.В., Волощук О.Н., Ефтеньева Р.И., Марчен-
няли в вакууме. Остаток перекристаллизовывали.
ко М.М., Вовк М.В. // Хим. фарм. ж. 2014. Т.48. № 4.
Выход 0.82 г (82%), т. пл. 226-228°С (ДМФА-
С. 25; Kushnir O.V., Voloshchuk O.N., Eften’eva R.I.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ, СТРОЕНИЕ И КОНФОРМАЦИОННЫЙ АНАЛИЗ
701
Marchenko M.M., Vovk M.V. // Pharm. Chem. J. 2014.
13.
Wilson A.K., Woon D.E., Peterson K.A., Dunning T.H.,
Vol. 48. N 4. P. 246. doi 10.1007/s11094-014-1087-6
Jr. // J. Chem. Phys. 1999. Vol. 110. N 16. P. 7667. doi
7.
Федоров Б.С., Фадеев М.А., Козуб Г.И., Алдошин С.М.,
10.1063/1.478678
Алиев З.Г., Атовмян Л.О., Коновалова Н.П., Сашен-
14.
Schafer A., Huber C., Ahlrichs R. // J. Chem. Phys.
кова Т.Е., Кондратьева Т.А., Блохина С.В. // Хим.
1994. Vol. 100. N 8. P. 5829. doi 10.1063/1.467146
фарм. ж. 2009. Т. 43. N 3. С. 12; Fedorov B.S., Fade-
15.
Varghese J.J., Mushrif S.H. // React. Chem. Eng. 2019.
ev M.A., Kozub G.I., Aldoshin S.M., Aliev Z.G.,
Vol. 4. N 2. P. 165. doi 10.1039/C8RE00226F
Atovmyan L.O., Konovalova N.P., Sashenkova T.E.,
16.
Sattasathuchana T., Xu P., Gordon M.S. // J. Phys.
Kondrat’eva T.A., Blokhina S.V. // Pharm. Chem. J.
Chem. A. 2019. Vol. 123. N 39. P. 8460. doi 10.1021/
2009. Vol. 43. N 3. P. 134. doi 10.1007/s11094-009-
acs.jpca.9b05801
0256-5
17.
Кузнецов В.В. // ЖСХ. 2018. Т. 59. № 6. С. 1425;
8.
Лайков Д.Н., Устынюк Ю.А. // Изв. АН. Сер. хим.
Kuznetsov V.V. // J. Struct. Chem. 2018. Vol. 59. N 6.
2005. № 3. С. 804; Laikov D.N., Ustynyuk Yu.A. // Russ.
P. 1374. doi 10.1134/S0022476618060173
Chem. Bull. 2005. Vol. 54. N 3. P. 820. doi 10.1007/
18.
Раскильдина Г.З., Спирихин Л.В., Злотский С.С.,
s11172-005-0329-x
Кузнецов В.В. // ЖОрХ. 2019. Т. 55. Вып. 4. С. 601;
9.
Катаев В.А., Мещерякова С.А., Лазарев В.В., Кузне-
Raskildina G.Z., Spirikhin L.V., Zlotskij S.S., Kuzne-
цов В.В. // ЖОрХ. 2013. Т. 49. Вып. 5. С. 760; Kata-
tsov, V.V. // Russ. J. Org. Chem. 2019. Vol. 55. N 4.
ev V.A., Meshcheryakova S.A., Lazarev V.V., Kuzne-
P. 502. doi 10.1134/S1070428019040146
tsov V.V. // Russ. J. Org. Chem. 2013. Vol. 49. N 5.
19.
Хажиев Ш.Ю., Хусаинов М.А., Халиков Р.А., Ката-
P. 743. doi 10.1134/S1070428013050199
ев В.А., Тюмкина Т.В., Мещерякова Е.С., Хали-
10.
Катаев В.А., Мещерякова С.А., Мещерякова Е.С.,
лов Л.М., Кузнецов В.В. // ЖОрХ. 2020. Т. 56. Вып. 1.
Тюмкина Т.В., Халилов Л.М., Лазарев В.В., Кузне-
С. 9; Khazhiev S.Y., Khusainov M.A., Khalikov R.A.,
цов В.В. // ЖОрХ. 2018. Т. 54. Вып. 6. С. 914; Kata-
Kataev V.A., Tyumkina T.V., Meshcheryakova E.S.,
ev V.A., Meshcheryakova S.A., Meshcheryakova E.S.,
Khalilov L.M., Kuznetsov V.V. // Russ. J. Org. Chem.
Tyumkina T.V., Khalilov L.M., Lazarev V.V., Kuzne-
2020. Vol.
56. N
1. P.
1. doi
10.1134/
tsov V.V. // Russ. J. Org. Chem. 2018. Vol. 54. N 6.
S1070428020010017
P. 918. doi 10.1134/S1070428018060143
20.
Sheldrick G. M. // Acta Crystallogr. (A). 2008. Vol. 64.
11.
Perdew J.P., Burke K., Ernzerhof M. // Phys. Rev.
N 1. P. 112. doi 10.1107/S0108767307043930
Lett. 1996. Vol. 77. N 18. P. 3865. doi 10.1103/
21.
PhysRevLett.77.3865
22.
Яшунский В.Г., Лаврова Л.Н., Котельникова Н.В.,
12.
Laikov D.N. // Chem. Phys. Lett. 1997. Vol. 281. N 1-3.
Ковтун В.Ю. Пат. 2042662 (2003). РФ // Б. И. 2003.
P. 151. doi 10.1016/S0009-2614(97)01206-2
№ 9.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
702
КАТАЕВ и др.
Synthesis, Structure and Conformational Analysis of N-(2,4-
Dichlorophenyl)-2-[6-methyl-2,4-dioxo-3-(thietan-3-yl)-1,2,3,4-
tetrahydropyrimidine-1-yl]acetamide
V. A. Kataeva, S. A. Mesheryakovaa, E. S. Mesheryakovab, T. V. Tyumkinab, L. M. Khalilovb,
V. V. Lazarevc, and V. V. Kuznetsovc,d,*
a Bashkirian State Medical University, Ufa, 450008 Russia
b Institute of Petrochemistry and Catalysis of the Russian Academy of Science, Ufa, 450075 Russia
c Ufa State Aviation Technical University, Ufa, 450008 Russia
dUfa State Petroleum Technological University, Ufa, 450062 Russia
*e-mail: kuzmaggy@mail.ru
Received March 26, 2021; revised March 26, 2021; accepted April 15, 2021
The reaction of 6-methyluracil with 2-chloromethyltiiran affords 6-methyl-3-(thietan-3-yl)uracil. Its subsequent
reaction with N-(2,6-dichlorophenyl)-2-chloroacetamide resulted in N-(2,4-dichlorophenyl)-2-[6-methyl-
2,4-dioxo-3-(thietan-3-yl)-1,2,3,4-tetrahydropyrimidin-1-yl]acetamide, proved by X-ray analysis, NMR and
IR spectroscopy. Computer modeling at the PBE/3ζ, PBE/cc-pVDZ and PBE/SV(P) levels showed that its
conformational behavior is determined by internal rotation of the thietanyl group both in the gas phase and in
chloroform or dimethyl sulfoxide solutions.
Keywords: 6-methyl-3-(thietan-3-yl)uracil, 6-methyluracil derivatives, thietanes, computer simulation, cluster
model
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021