ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 5, с. 720-727
УДК 547.541.52;547.412.12
КОНФОРМАЦИОННЫЙ АНАЛИЗ И ИЗУЧЕНИЕ
ВОДОРОДНЫХ СВЯЗЕЙ ИОДБИЦИКЛОГЕПТАНИЛ-N′-
(ТРИФТОРМЕТАНСУЛЬФОНИЛ)АЦЕТИМИДАМИДОВ
© 2021 г. И. В. Стерхова*, Т. Е. Федорова, М. Ю. Москалик
Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*e-mail: irina_sterkhova@irioch.irk.ru
Поступило в Редакцию 12 марта 2021 г.
После доработки 12 марта 2021 г.
Принято к печати 28 марта 2021 г.
Методами рентгеновской дифракции, ИК спектроскопии и квантовой химии изучено строение эпимеров
иодбициклогептанил-N′-(трифторметансульфонил)ацетимидамида, его самоассоциатов в кристалле, рас-
творе и газовой фазе. В изолированной молекуле энергетически предпочтительным является 2S,7R-энан-
тиомер, структура которого реализуется и в кристалле. По данным рентгеноструктурного анализа, в
кристалле молекулы (2S,7R)-N-(7-иодбицикло[2.2.1]гептан-2-ил)-N′-(трифторметансульфонил)-ацетими-
дамида связаны между собой межмолекулярными водородными связями R-NH···O=S. Однако, по данным
квантово-химических расчетов, при образовании димеров на 3 ккал/моль более прочными оказываются
Н-связи Tf-NH···O=S типа. Относительная энергия образования самоассоциатов (2S,7S)-N-7-иодбицик-
ло[2.2.1]гептан-2-ил)-N′-(трифторметансульфонил)ацетимидамида составляет ~10 ккал/моль.
Ключевые слова: (трифторметансульфонил)ацетимидамиды, водородная связь, рентгеноструктурный
анализ, ИК спектроскопия, квантово-химические расчеты
DOI: 10.31857/S0044460X21050085
Сульфонамиды проявляют широкий ряд био-
нейротропной активностью, а именно оказывают
логической активности и интерес к их синтезу и
противосудорожное, транквилизирующее и аналь-
изучению фармакологических свойств не угасает
гезирующее действие [4-6]. Однако изучению
[1-3]. Немаловажную роль в процессах антибакте-
процессов водородного связывания в этих работах
риального воздействия препарата на бактериаль-
уделено недостаточно внимания. Только в недав-
ную оболочку играют слабые невалентные взаимо-
ней статье [4] обсуждаются водородосвязанные
действия типа водородных связей. Теоретически
мотивы, образующиеся в кристаллах циклических
этот процесс изучают методами молекулярного до-
сульфонамидов тиазинового ряда.
кинга, моделируя взаимодействие молекул по типу
Настоящее исследование посвящено изучению
рука-перчатка. Синтез соединений сульфонамид-
строения и водородного связывания в кри-
ного ряда в сочетании с другими фармакофор-
сталле, растворе и изолированном состоянии
ными группами может существенно расширить
сульфонамидных производных, полученных
спектр их применения. Например, сульфонами-
недавно реакцией трифторметансульфонами-
ды, в составе которых присутствуют норборнено-
да с норборненом в присутствии N-иодсукци-
вый или норборнановый фрагменты, близкие по
нимида
[7]:
(2S,7R)-N-(7-иодбицикло[2.2.1]
структуре к растительным терпеноидам, обладают
гептан-2-ил)-N′-(трифторметансульфонил)аце-
720
КОНФОРМАЦИОННЫЙ АНАЛИЗ И ИЗУЧЕНИЕ ВОДОРОДНЫХ СВЯЗЕЙ
721
Схема 1.
H
I
I
H
TfNH2/NXS
NH
NH
NTf
NTf
MeCN
2S,7R-1
2S,7S-1
тимидамида 2S,7R-1 и (2S,7S)-N-7-иодбицикло-
отличается в два раза (V 1401.8 и 723.1 Å3 для
[2.2.1]гептан-2-ил)-N′-(трифторметансульфонил)-
эпимеров 2S,7R-1 и 2S,7S-1 соответственно), как
ацетимидамида 2S,7S-1. Для изучения водород-
и количество молекул в ячейке (Z 4 и 2 для эпиме-
ных связей в данных соединениях использовались
ров 2S,7R-1 и 2S,7S-1 соответственно). Торсион-
методы рентгеноструктурного анализа, ИК спек-
ный угол CNCN в соединениях близок к плоскому
троскопии и квантовой химии, как и для получен-
и составляет -0.89 и 1.88° в структурах эпимеров
ных ранее производных трифламида [8-10]. При
2S,7R-1 и 2S,7S-1. Основные различия в молеку-
получении соединений 2S,7R-1 и 2S,7S-1 образо-
лярных структурах эпимеров 2S,7R-1 и 2S,7S-1
вывалась смесь эпимеров по атому С7 (схема 1) [7].
связаны со взаимным расположением норборне-
Молекулярные структуры соединений 2S,7R-1 и
новых и трифламидных фрагментов. Так, торсион-
2S,7S-1 приведены на рис. 1, длины связей и углы -
ные углы C9C4N1C5 составляют -72.67 и -92.18°
в табл. 1.
в эпимерах 2S,7R-1 и 2S,7S-1 соответственно. Так
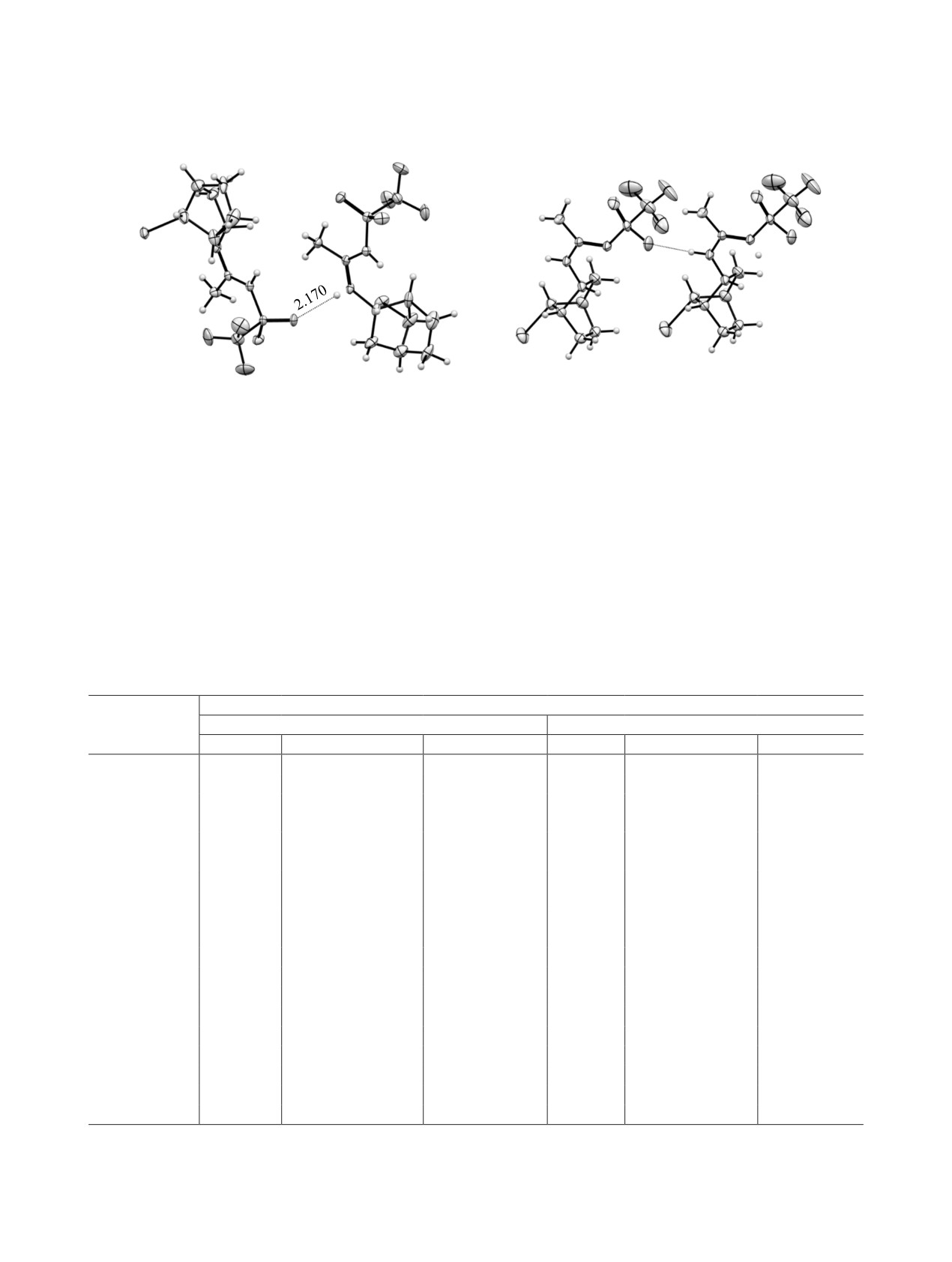
В производных 2S,7R-1 и 2S,7S-1 наблюдается
же как и в изученных нами ранее амидинах [11],
разупорядоченность атома водорода: в молекуле
во фрагменте N=C-N N-(7-иодобицикло[2.2.1]-
изомера 2S,7R-1 атом H разупорядочен между ато-
гептан-2-ил)-N′-(трифторметилсульфонил)ацети-
мами N1 и N2, заселенность позиций составляет
мидамидов 2S,7R-1 и 2S,7S-1 двойная связь С=N
0.80:0.20. В молекуле изомера 2S,7S-1 наблюда-
длиннее одинарной C-N за счет сильного сопря-
ется подобная картина, заселенность позиций со-
жения во фрагменте NH-C(Me)=NHNf (табл. 1).
ставляет 0.87:0.13. В обоих случаях данные РСА
Образование и выделение стереоизомеров
указывают на предпочтительное образование ами-
2S,7R-1 и 2S,7S-1, а также наличие двух таутоме-
диновой, а не амидной формы.
ров, обусловливающих разупорядоченность атома
Молекулы соединения 2S,7R-1 кристаллизу-
водорода, выявленную методом РСА, побудили
ются в моноклинной пространственной группе
нас изучить их относительную устойчивость. Это
P21/c, тогда как молекулы эпимера 2S,7S-1 кри-
было сделано путем расчета таутомеров каждого
сталлизуются в триклинной сингонии, простран-
из двух эпимеров методом B3LYP/DGDZVP. Дан-
ственная группа P-1. Объем элементарных ячеек
ный метод является наиболее подходящим для
Рис. 1. Общий вид молекул (2S,7R)-N-(7-иодбицикло[2.2.1]гептан-2-ил)-N′-(трифторметансульфонил)ацетимидамида
2S,7R-1 и (2S,7S)-N-7-иодбицикло[2.2.1]гептан-2-ил)-N′-(трифторметансульфонил)ацетимидамида 2S,7S-1 в кристалле.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
722
СТЕРХОВА и др.
Таблица 1. Некоторые геометрические характеристики эпимеров 2S,7R-1 и 2S,7S-1
Амид
Связь
d, Å
Валентный угол
φ, град
Торсионный угол
θ, град
2S,7R1
I1-C8
2.178(6)
O2S1O1
118.3(2)
N1C5N2S1
173.0(3)
S1-O2
1.428(3)
O2S1N2
117.9(2)
C7C5N2S1
8.5(6)
S1-O1
1.434(3)
O1S1N2
108.9(2)
O2S1N2C5
16.9(4)
S1-N2
1.574(4)
O2S1C6
103.3(2)
O1S1N2C5
155.2(4)
S1-C6
1.835(5)
F3C6F2
108.4(4)
C6S1N2C5
94.8(4)
F1-C6
1.326(6)
N2S1C6
101.1(2)
C10C1C2C3
68.0(6)
F2-C6
1.327(6)
N1C5N2
116.6(4)
C10C1C2C8
35.7(6)
F3-C6
1.320(6)
N1C5C7
116.0(4)
C8C2C3C4
39.0(6)
C5-N1
1.310(6)
N2C5C7
127.3(4)
C1C2C3C4
62.2(6)
C5-N2
1.334(5)
C5N2S1
124.6(3)
C2C3C4N1
130.1(4)
C5-C7
1.501(6)
C10C1C2
105.7(5)
C2C3C4C9
6.9(5)
C4–N1
1.465(5)
N1C4C3
110.7(4)
N2S1C6F3
61.3(4)
C4-C9
1.546(6)
C9C4C3
102.9(4)
C1C2C8C9
57.2(5)
2S,7S1
I1-C8
2.155(4)
O2S1O1
117.1(2)
C10C1C2C8
32.2(4)
S1-O2
1.422(3)
O2S1N2
118.65(17)
C10C1C2C4
69.8(4)
S1-O1
1.432(3)
O1S1N2
108.21(19)
C3C4C2C1
67.7(4)
S1-N2
1.558(3)
O2S1C7
104.3(2)
C3C4C2C8
37.8(4)
S1-C7
1.812(5)
O1S1C7
103.7(3)
C2C4C3N1
124.6(3)
F1-C7
1.305(6)
N2S1C7
102.6(2)
C2C4C3C9
4.0(4)
F2-C7
1.317(8)
C3C4C2
104.4(3)
C4C3N1C5
92.2(5)
F3-C7
1.313(6)
C2C1C10
103.2(3)
C9C3N1C5
152.3(4)
C5-N1
1.312(4)
C8C2C4
97.4(3)
N1C5N2S1
176.6(3)
C5-N2
1.331(4)
N1C3C4
111.7(4)
C6C5N2S1
5.9(7)
C4-C-
1.521(6)
C1C2C4
107.8(4)
C3N1C5N2
1.9(6)
C4-C2
1.556(6)
C1C2C8
102.3(3)
C3N1C5C6
175.8(4)
Таблица 2. Относительные энергии (E), свободные энергии (ΔG), энергетический зазор между МО энантиомеров и
таутомеров 2S,7R-1, 2S,7R-2, 2S,7S-1 и 2S,7S-2 (R = 7-иод-2-норборнил)
Энантиомер, таутомер
E, ккал/моль
ΔG, ккал/моль
ВЗМО-НСМО, эВ
2S,7R-1, R-NH-C(Me)=NTf
0.0
0.0
1.653
2S,7S-1, R-NH-C(Me)=NTf
1.1
1.2
1.504
2S,7S-2, R-N=C(Me)-NHTf
14.3
13.3
1.179
2S,7R-2, R-N=C(Me)-NHTf
17.3
17.2
1.136
расчета систем, содержащих атом иода [12]. Полу-
Данные NBO-анализа [13, 14] для данных со-
ченные результаты представлены в табл. 2. Уста-
единений также указывают на большую стабиль-
новлено, что наиболее стабильным изомером яв-
ность форм амидинового типа по сравнению
ляется (2S,7R)-эпимер амидина RNH-C(Me)=NTf,
с амидными. Разница энергий между ВЗМО и
что прекрасно согласуется с преобладанием этой
НСМО составила 1.653, 1.136, 1.504 и 1.179 эВ
формы в кристалле (4:1). Трифламидные формы
для структур 2S,7R-1, 2S,7R-2, 2S,7S-1 и 2S,7S-2
2S,7S-2 и 2S,7R-2 оказались на 14-17 ккал/моль
соответственно (табл. 2).
менее стабильными по сравнению с N-трифлила-
Согласно данным РСА, кристаллическая струк-
зометинами 2S,7R-1 и 2S,7S-1 (табл. 2), благодаря
тура соединений 2S,7R-1 и 2S,7S-1 формируется за
отмеченному выше сильному пуш-пульному со-
счет водородных связей R-NH···O=S (рис. 2), од-
пряжению во фрагменте NH-C(Me)=NHNf [11].
нако в растворе и газовой фазе межмолекулярная
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
КОНФОРМАЦИОННЫЙ АНАЛИЗ И ИЗУЧЕНИЕ ВОДОРОДНЫХ СВЯЗЕЙ
723
2.070
Рис. 2. Водородные связи эпимеров 2S,7R-1 и 2S,7S-1 в кристалле.
Н-связь может образовываться и с трифламидным
поэтому использовался соответствующий масшта-
протоном Tf-NH, который обладает более выра-
бирующий коэффициент (0.970) [15]. Сравнение
женными кислотными свойствами по сравнению
расчетных (масштабированных) и эксперимен-
с протоном R–NH за счет электроноакцепторного
тальных данных, проведенное по аналогии с ра-
влияния группы CF3SO2.
ботами [16, 17], показывает хорошее соответствие
(табл. 3).
С целью изучения процессов самоассоциации
соединений 2S,7R-1 и 2S,7S-1 в растворах и газо-
Согласно данным ИК спектроскопии в обла-
вой фазе были проведены спектральные и кван-
сти валентных колебаний NH-групп в спектрах
тово-химические исследования. Вычисленные
эпимеров 2S,7R-1 и 2S,7S-1 наблюдаются две по-
значения частот выше, чем экспериментальные,
лосы поглощения, относящиеся к мономерным
Таблица 3. Анализ ИК спектров эпимеров 2S,7R-1 и 2S,7S-1
Частота, см-1
Отнесение
2S,7R-1
2S,7S-1
расчет
шкалирование
эксперимент
расчет
шкалирование
эксперимент
νs(N-H)своб
3589
3464
3432
3618
3501
3440
νs(N-H)связ
3344
3316
νas(С-H)
3142, 3136
3032, 3027
2971
3148,
3053, 3047
2971
3141
νs(С-H)
3078
2970
2925, 2882
3113,
3019, 2990
2876
3083
δ(N-H)
1612, 1575
1556,1520
1583, 1541
1614,
1565, 1519
1592, 1538
1566
δs(CH, СН3)
1511, 1408
1466, 1366
1442, 1364
1512,
1466, 1360
1431, 1387
1402
νаs(S=O)
1300
1254
1327
1301
1262
1318
νas(С-F3)
1205
1162
1217
1207
1170
1209
νs(С-F3)
1200
1156
1190
1195
1155
1180
νs(S=O)
1099
1061
1138
1111
1070
1131
ω(СH3)
1049
1012
1056
1059
1027
1060
δs(С-F3)
762
735
775
764
741
775
δ(S=O)
658
635
659
655
635
659
δаs(С-F3)
550
531
564
551
532
562
δ(S=O)
455
440
491
455
440
477
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
724
СТЕРХОВА и др.
Таблица 4. Спектральные характеристики Н-связей эпимеров 2S,7R-1 и 2S,7S-1
Амид
KBr
∆νNH, см-1
CCl4
∆νNH, см-1
2S,7R-1
3432, 3344
88
3427, 3330
97
2S,7S-1
3440, 3316
124
3434, 3312
122
и ассоциированным колебаниям NН-групп как в
2S,7S-1 (2.070 Å). Мы попытались зафиксировать
твердом образце (KBr), так и растворе CCl4. Этот
менее стабильный таутомер в растворе гептана
факт, а также близкий спектральный сдвиг ∆NH
при низкой температуре. Однако даже понижение
между частотами колебаний свободных и связан-
температуры раствора до -90°С не приводит к по-
ных групп NH, позволяет предполагать, что само-
явлению дополнительной полосы поглощения,
ассоциаты, образующиеся в твердом состоянии и
принадлежащей трифламидной форме соединений
растворе, идентичны (табл. 4). Бóльшие значения
2S,7R-1 и 2S,7S-1.
спектрального сдвига (∆NH = 122 см-1) для эпимера
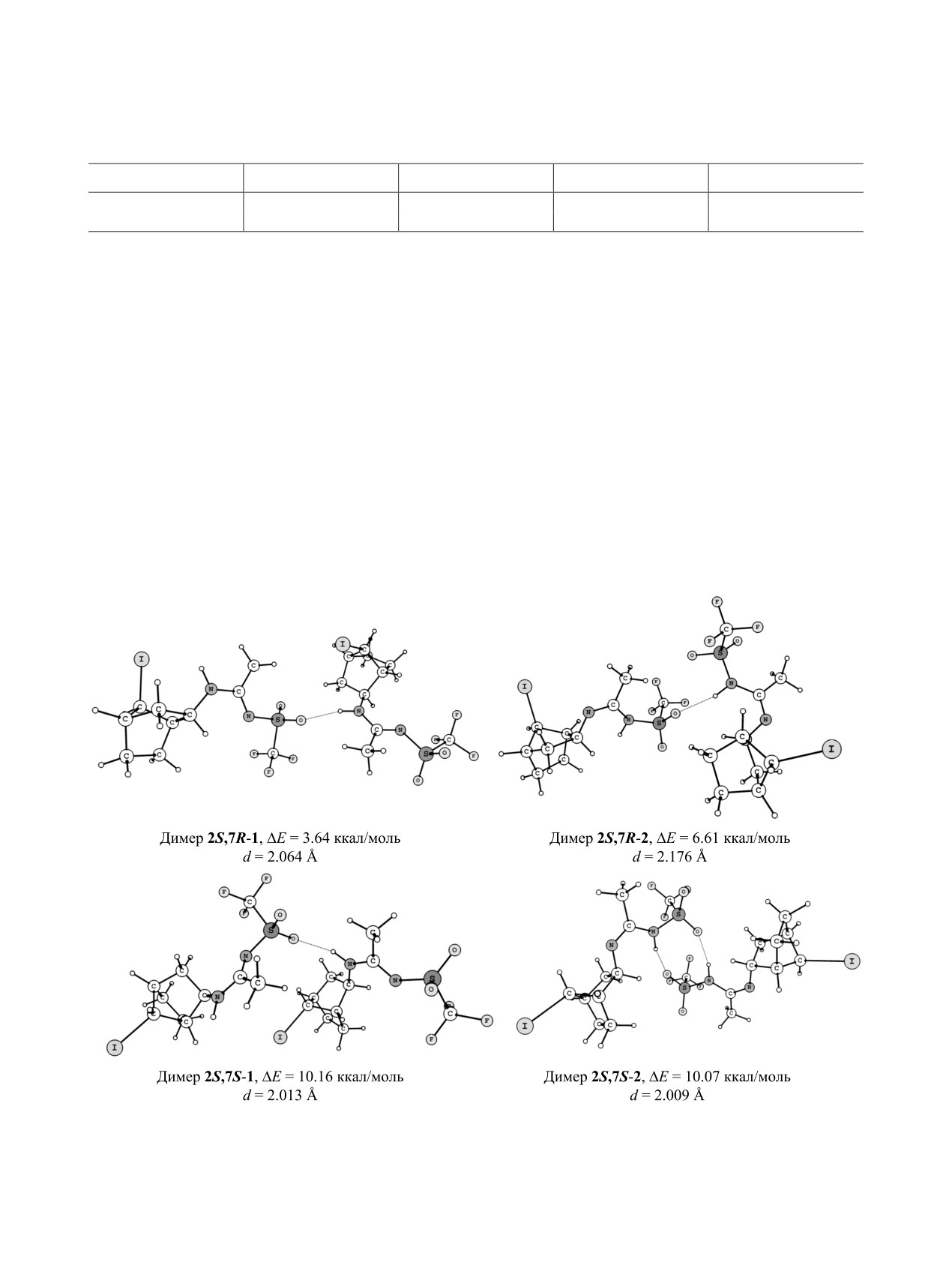
Димеры, образованные формами
2S,7R-1,
2S,7R-1 по сравнению с эпимером 2S,7S-1 (∆NH =
2S,7S-1, 2S,7R-2 и 2S,7S-2, приведены на рис. 3.
97 см-1) говорят о формировании более прочных
Наибольший энергетический выигрыш наблюда-
самоассоциатов первым, хотя длины Н-связей в
ется при формировании димеров из таутомеров
кристалле указывают на обратное. Так, для стере-
2S,7S-1 и 2S,7S-2: относительные энергии обра-
оизомера 2S,7R-1 (2.170 Å) длина межмолекуляр-
зования димеров ∆E, характеризующие прочность
ной водородной связи больше, чем для изомера
водородной связи, составляют
~10 ккал/моль
Рис. 3. Димерные формы эпимеров 2S,7R-1 и 2S,7S-1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
КОНФОРМАЦИОННЫЙ АНАЛИЗ И ИЗУЧЕНИЕ ВОДОРОДНЫХ СВЯЗЕЙ
725
Таблица 5. Энергетические и спектральные характеристики димеров амидов 2S,7R-1 и 2S,7S-1
Изомер
-E, ат. ед.
-Eдимер, ат. ед.
∆E, ккал/моль
ν(NH), см-1
∆ν(NH), см-1
2S,7R-1
8267.0456690
16534.0971360
3.64
3560, 3506
54
2S,7R-2
8267.0733007
16534.1571367
6.61
3580, 3538
42
2S,7S-1
8267.0710900
16534.1583659
10.16
3609, 3534
75
2S,7S-2
8267.0512431
16534.1185337
10.07
(5.04)
3562, 3465
97
(табл. 5). Значения расчетных спектральных сдви-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
гов ∆NH больше для самоассоциатов таутомеров
ИК спектры твердых образцов в KBr и рас-
2S,7S-1 и 2S,7S-2, чем для таутомеров 2S,7R-1 и
творов получены на спектрофотометре FTIR
2S,7R-2. Длины водородных связей короче в диме-
Varian 3100. Квантово-химические расчеты вы-
рах таутомеров 2S,7S-1 и 2S,7S-2 (2.013 и 2.009 Å
полнены с использованием комплекса программ
соответственно), чем в димерах таутомеров 2S,7R-
GAUSSIAN-09 [18].
1 и 2S,7R-2 (2.064 и 2.176 Å).
Рентгеноструктурное исследование соеди-
В газовой фазе эпимеры 2S,7R-1, 2S,7R-2 и
нений 2S,7R-1 и 2S,7S-1 проводили на дифрак-
2S,7S-1 образуют линейные самоассоциаты, в
тометре Bruker D8 Venture (детектор Photon 100,
то время как димер формы 2S,7S-2 при оптими-
MoKα-излучение, λ 0.71073 Å) с использованием
зации геометрии преобразуется в циклический.
сканирования по углам φ и ω. Монокристаллы ами-
Несмотря на то, что таутомер 2S,7R-1 является
дов 2S,7R-1 и 2S,7S-1 были получены кристалли-
более стабильным по сравнению с таутомером
зацией из гексана. Кристаллографические данные
2S,7R-2, энергия образования их водородосвя-
для эпимера 2S,7R-1: 0.02×0.20×0.30 мм, Т 100 K,
занных димеров составляет 3.64 и 6.61 ккал/моль
θ 2.67-30.16°, моноклинная сингония, простран-
соответственно. Это говорит о том, что в газовой
ственная группа P21/c, a 11.583(1), b 11.314(1),
фазе водородная связь Tf-NH···O=S прочнее, чем
c 12.042(1) Å, β 117.34(1)°, dвыч 1.944 г/см3, μ
связь R-NH···O=S из-за большей кислотности
2.467 мм-1, V 1401.8(3) Å3, Z 4. Кристаллогрфи-
NHTf-протона по сравнению с протоном фраг-
ческие данные для эпимера 2S,7S-1: 0.31×0.41×
мента NHR. Обратная картина наблюдается для
0.50 мм, Т 293 K, θ 2.67-30.16°, триклинная син-
димеров таутомеров 2S,7S-1 и 2S,7S-2. Хотя отно-
гония, пространственная группа P-1, a 7.346(2),
сительные энергии формирования их самоассоци-
b 9.784(2), c 10.506(2) Å, α 103.72(1), β 92.27(1), γ
атов близки (~10 ккал/моль), во втором образуется
98.57(1)°, dвыч 1.875 г/см3, μ 2.391 мм-1, V 723.1(2)
две H-связи, и энергия каждой из них составляет
Å3, Z 2. Структуры определены и уточнены прямым
5.04 ккал/моль.
методом по программе SHELX [19]. Данные скор-
Таким образом, проведенное исследование про-
ректированы с учетом эффектов поглощения излу-
цессов водородного связывания в кристалле, рас-
чения методом мультисканирования (SADABS).
творах и газовой фазе указывает на присутствие
Неводородные атомы уточнены в анизотропном
в растворе одной таутомерной формы эпимеров
приближении с помощью программы SHELX [19].
2S,7R-1 и 2S,7S-1, соответствующей амидино-
Кристаллографические данные депонированы в
вой структуре NH-C=NTf, также преобладающей
Кембрибжский банк кристаллоструктурных дан-
в кристалле, согласно данным РСА. По данным
ных [CCDC 1857690 (2S,7R-1) и 1953764 (2S,7S-1)].
квантово-химических расчетов, энергии межмо-
БЛАГОДАРНОСТЬ
лекулярных Н-связей в димерах амидинов 2S,7R-
1 и 2S,7S-1 составляют 3.64 и 10.16 ккал/моль,
Исследования выполнены с использованием
что коррелирует с геометрическими параметрами
оборудования материально-технической базы Бай-
рентгеноструктурного анализа (длины Н-связей
кальского аналитического центра коллективного
равны 2.17 и 2.07 Å соответственно).
пользования Сибирского отделения РАН.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
726
СТЕРХОВА и др.
КОНФЛИКТ ИНТЕРЕСОВ
10.
Стерхова И.В., Никонов А.Ю., Лазарев И.М., Мо-
скалик М.Ю., Лазарева Н.Ф. // ЖОХ. 2015. T. 85.
Авторы заявляют об отсутствии конфликта
№ 7. C. 1138; Sterkhova I.V., Nikonov A.Yu., Laza-
интересов.
rev I.M., Moskalik M.Yu., Lazareva N.F. // Russ. J.
Gen. Chem. 2015. Vol. 85. N 7. P. 1661. doi 10.1134/
СПИСОК ЛИТЕРАТУРЫ
S1070363215070154
1.
Mondal S., Malakar S. // Tetrahedron. 2020. Vol. 76.
11.
Shainyan B.A., Meshcheryakov V.I., Sterkhova I.V. //
P. 131662. doi 10.1016/j.tet.2020.131662
Tetrahedron. 2015. Vol. 71. P. 7906. doi 10.1016/j.
2.
Ghiano D.G., Recio-Balsells A., Bortolotti A., De-
tet.2015.08.008
felipe L.A., Turjanski A., Morbidoni H.R., Labadie G.R. //
12.
Барташевич Е.В., Цирельсон В.Г. // Усп. xим. 2014.
Eur. J. Med. Chem. 2020. Vol. 208. P. 112699. doi
Т. 83. № 12. С. 1182; Bartashevich E.V., Tsirelson V.G. //
10.1016/j.ejmech.2020.112699
Russ. Chem. Rev. 2014. Vol. 83. N 12. P. 1181. doi
3.
Grib I., Berredjem M., Otmane Rachedi K.,
10.1070/RCR4440
Djouad S.-E., Bouacida S., Bahadi R., Ouk T.-S.,
13.
Johnson R.D. III. NIST computational chemistry
Kadrif M., Ben Hadda T., Belhani B. // J. Mol.
comparison and benchmark database, precomputed
Str. 2020. Vol. 1217. P. 128423. doi 10.1016/j.
molstruc.2020.128423
vibscalejust.asp
4.
Миронова Е.В., Лодочникова О.А., Криволапов Д.Б.,
14.
Weinhold F., Landis C. R. // Valency and Bonding:
Веремейчик Я.В., Племенков В.В., Литвинов И.А. //
A Natural Bond Orbital Donor-acceptor Perspective.
ЖСХ. 2014. Т. 55. № 3. C. 566; Mironova E.V.,
Cambridge: University Press, 2005.
Lodochnikova O.A., Krivolapov D.B., Veremeichik Ya.V.,
15.
Glendening E.D., Reed A.E., Carpenter J.E., Weinhold F. //
Plemenkov V.V., Litvinov I.A. // J. Struct. Chem. 2014.
NBO Version 3.1, Gaussian, Inc., Pittsburgh, PA, CT,
Vol. 55. N 3. P. 539. doi 10.1134/S0022476614030238
2003.
5.
Зленко Е.Т., Касьян Л.И., Мамчур В.И., Касьян А.О.,
16.
Fernandez L.E., Ben Altabef A., Fantoni A.C.,
Придьма С.А., Пальчиков В.А., Карат Л.Д. // Ж. орг.
Varetti E.L. // Spectrochim. Acta (A). 1997. Vol. 53.
фарм. хим. 2009. Т. 7. № 1(25). C. 64.
P. 189. doi 10.1016/S1386-1425(97)83025-9
6.
Горпинченко В.А., Яцынич Е.А., Петров Д.В., Кара-
17.
Soldatenko A.S., Sterkhova I.V., Lazareva N.F. // J.
чурина Л.Т., Хисамутдинова Р.Ю., Басченко Н.Ж.,
Organomet. Chem. 2019. Vol. 903. P. 120997. doi
Докичев В.А., Томилов Ю.В., Юнусов М.С., Нефе-
10.1016/j.jorganchem.2019.120997
дов О.М. // Хим.-фарм. ж. 2005. Т. 39. № 6. C. 9;
18.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
Gorpinchenko V.A., Yatsynich E.A., Petrov D.V.,
Robb M.A., Cheeseman J.R., Zakrzewski V.G.,
Karachurina L.T., Hisamutdinova R.Yu., Baschen-
ko N.Zh., Dokichev V.A., Tomilov Yu.V., Yunusov M.S.,
Montgomery J.A., Jr., Stratmann R.E., Burant J.C.,
Dapprich S., Millam J.M., Daniels A.D., Kudin K.N.,
Nefedov O.M. // Pharm. Chem. J. 2005. Vol. 39. N 6.
Strain M.C., Farkas O., Tomasi J., Barone V., Cossi M.,
P. 289. doi 10.1007/s11094-005-0135-7
7.
Moskalik M.Yu., Shainyan B.A., Ushakov I.A., Sterkho-
Cammi R., Mennucci B., Pomelli C., Adamo C., Clif-
ford S., Ochterski J., Petersson G.A., Ayala P.Y., Cui Q.,
va I.V., Astakhova V.V. // Tetrahedron. 2020. Vol. 76.
P. 131018. doi 10.1016/j.tet.2020.131018
Morokuma K., Malick D.K., Rabuck A.D., Raghavacha-
8.
Стерхова И.В., Москалик М.Ю., Шаинян Б.А. //
ri K., Foresman J.B., Cioslowski J., Ortiz J.V., Stefa-
ЖОрХ. 2013. T. 49. № 11. C. 1617; Sterkhova I.V.,
nov B.B., Liu G., Liashenko A., Piskorz P., Komaromi I.,
Moskalik M.Yu., Shainyan B.A. // Russ. J. Org.
Gomperts R., Martin R.L., Fox D.J., Keith T., Al-
Chem. 2013. Vol. 49. N 11. P. 1594. doi 10.1134/
Laham M.A., Peng C.Y., Nanayakkara A., Gonzalez C.,
S1070428013110055
Challacombe M., Gill P.M.W., Johnson B., Chen W.,
9.
Стерхова И.В., Москалик М.Ю., Шаинян Б.А. //
Wong M.W., Andres J.L., Gonzalez C., Head-Gordon M.,
ЖОрХ. 2014. T. 50. № 3. C. 349; Sterkhova I.V.,
Replogle E.S., Pople J.A. GAUSSIAN 09, Revision,
Moskalik M.Yu., Shainyan B.A. // Russ. J. Org.
A.01, Gaussian Inc., Wallingford CT, 2009.
Chem. 2014. Vol. 50. N 3. P. 337. doi 10.1134/
19.
Sheldrick G.M. // Acta Crystallogr. (D). 2008. Vol. 64.
S1070428014030051
P. 112. doi 10.1107/S0108767307043930
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
КОНФОРМАЦИОННЫЙ АНАЛИЗ И ИЗУЧЕНИЕ ВОДОРОДНЫХ СВЯЗЕЙ
727
Conformational Analysis and Study of Hydrogen Bonding
of Iodobicycloheptanyl-N′-(trifluoromethanesulfonyl)-
acetimidamides
I. V. Sterkhova*, T. E. Fedorova, and M. Yu. Moskalik
A.E. Favorsky Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences, Irkutsk, 664033 Russia
*e-mail: irina_sterkhova@irioch.irk.ru
Received March 12, 2021; revised March 12, 2021; accepted March 28, 2021
Structure of iodobicycloheptanyl-N′-(trifluoromethanesulfonyl)acetimidamide epimers and its self-associates
in crystal, solution and gas phase was studied by X-ray diffraction, IR spectroscopy and quantum chemistry
methods. In an isolated molecule, the 2S,7R-enantiomer is energetically preferred, the structure of which is also
realized in the crystal. According to X-ray diffraction analysis, in the crystal, (2S,7R)-N-(7-iodobicyclo[2.2.1]
heptan-2-yl)-N′-(trifluoromethanesulfonyl)acetimidamide molecules are linked by intermolecular hydrogen
bonds R-NH···O=S. However, according to the quantum chemical calculations data, the Tf-NH···O=S type
H-bonds turn out to be stronger by 3 kcal/mol when dimers are formed. The relative energy of formation of
(2S,7S)-N-7-iodobicyclo[2.2.1]heptan-2-yl)-N′-(trifluoromethanesulfonyl)acetimidamide self-associates is
~10 kcal/mol.
Keywords: (trifluoromethanesulfonyl)acetimidamides, hydrogen bonding, X-ray diffraction analysis, IR spec-
troscopy, quantum-chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021