ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 5, с. 758-762
УДК 546.87;547.53.024;548.312.5
СИНТЕЗ И СТРОЕНИЕ ДИКАРБОКСИЛАТОВ
ТРИФЕНИЛВИСМУТА Ph3Bi[OC(O)R]2
(R = СH2C6H4F-3, C6H3F2-2,3, C6HF4-2,3,4,5)
© 2021 г. В. В. Шарутин*, О. К. Шарутина, Л. В. Кощеева
Национальный исследовательский Южно-Уральский государственный университет,
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: sharutin50@mail.ru
Поступило в Редакцию 29 марта 2021 г.
После доработки 9 апреля 2021 г.
Принято к печати 15 апреля 2021 г.
Взаимодействием трифенилвисмута, карбоновой кислоты и гидропероксида третичного бутила (1:2:1
мольн.) в диэтиловом эфире синтезированы соединения висмута Ph3Bi[OC(O)R]2 (R = СH2C6H4F-3,
C6H3F2-2,3, C6HF4-2,3,4,5), особенности строения которых установлены методом рентгеноструктурного
анализа. Атомы висмута в дикарбоксилатах трифенилвисмута имеют искаженную тригонально-бипира-
мидальную координацию с атомами кислорода в аксиальных положениях. Наличие внутримолекулярных
контактов Bi···O(=C) [2.833(8)-3.136(9) Å] обусловливает увеличение одного валентного угла CBiC до
151.07(15), 142.0(3), 138.53(14)° соответственно за счет уменьшения двух других.
Ключевые слова: дикарбоксилаты трифенилвисмута, рентгеноструктурные исследования
DOI: 10.31857/S0044460X21050139
Известным классом органических соединений
различные по электроотрицательности замести-
висмута(V) являются дикарбоксилаты триорга-
тели. Реакции проводили в диэтиловом эфире в
нилвисмута, которые обладают высокой фотоката-
присутствии гидропероксида третичного бутила.
литической [1] и биологической [2], в частности,
Несмотря на различную природу заместителей в
антипаразитарной [3-7] активностью, поэтому ис-
органическом фрагменте карбоновой кислоты, ре-
следования синтеза и строения подобных соедине-
акции протекали с образованием дикарбоксилатов
ний весьма актуальны.
трифенилвисмута с выходом до 83% (схема 1).
В основе одного из эффективных способов по-
Соединения 1-3 - бесцветные кристаллические
лучения дикарбоксилатов триарилвисмута лежит
вещества, устойчивые к действию влаги и кислоро-
реакция триарилвисмута с карбоновой кислотой в
да воздуха, хорошо растворимые в ароматических
присутствии окислителя [8-16].
углеводородах, хлороформе, тетрагидрофуране и
Мы продолжили изучение аналогичных ре-
нерастворимые в алифатических углеводородах.
акций трифенилвисмута с 2-метоксибензойной,
В ИК спектрах соединений 1-3 наблюдают-
3,5-динитробензойной и фенилпропиоловой кис-
ся интенсивные полосы поглощения в области
лотами, содержащими в органическом фрагменте
450 см-1 (442, 440, 447 см-1 соответственно), ко-
Схема 1.
Ph3Bi + 2RC(O)OH + t-BuOOH → Ph3Bi[OC(O)R]2 + H2O + t-BuOH
R = CH2C6H4F-3 (1), C6H4F2-2,3 (2), C6HF4-2,3,4,5 (3).
758
СИНТЕЗ И СТРОЕНИЕ ДИКАРБОКСИЛАТОВ
759
Кристаллографические данные, параметры эксперимента и уточнения структур 1-3
Значение
Параметр
1
2
3
М
746.53
754.47
826.43
Сингония
Моноклинная
Триклинная
Триклинная
-
-
Пространственная группа
C2/c
Р1
Р1
a, Å
22.920(10)
8.990(6)
11.852(9)
b, Å
10.188(5)
11.218(9)
12.163(12)
c, Å
17.517(7)
14.770(13)
12.801(10)
α, град
90.00
69.88(4)
107.20(3)
β, град
135.004(11)
86.56(3)
100.62(2)
γ, град
90.00
82.76(3)
116.62(3)
V, Å3
2892(2)
1387.3(19)(2)
1463(2)
Z
4
2
2
dвыч, г/см3
1.715
1.806
1.876
μ, мм
6.147
6.418
6.112
F(000)
1456.0
728.0
792.0
Размер кристалла, мм
0.32 × 0.3 × 0.2
0.65 × 0.6 × 0.45
0.51 × 0.37 × 0.25
Область сбора данных по 2θ, град
6.496-56.952
5.476-55.49
6.406-54.486
Интервалы индексов отражений
-30 ≤ h ≤ 30,
-11 ≤ h ≤ 11,
-15 ≤ h ≤ 15,
-13 ≤ k ≤ 13,
-14 ≤ k ≤ 14,
-15 ≤ k ≤ 15,
-21 ≤ l ≤ 21
-19 ≤ l ≤ 19
-16 ≤ l ≤ 16
Измерено отражений
22730
33979
35133
Независимых отражений
3369 (Rint 0.0242)
6433 (Rint 0.1075)
6457 (Rint 0.0269)
Отражений с I > 2σ(I)
3191
5343
6007
Переменных уточнения
188
371
415
GOOF
1.124
1.034
1.152
R-Факторы по
R1 0.0198,
R1 0.0448,
R1 0.0225,
F2 > 2σ(F2)
wR2 0.0458
wR2 0.1051
wR2 0.0540
R-Факторы по всем отражениям
R1 0.0223,
R1 0.0612,
R1 0.0259,
wR2 0.0472
wR2 0.1122
wR2 0.0561
Остаточная электронная плотность
1.37/-0.95
2.20/-2.17
0.56/-0.62
(min/max), e/Å3
торые характеризуют валентные колебания связи
щения средней интенсивности при 3055 (1), 3069
Bi-С [17]. Полосы поглощения, соответствующие
(2), 3071 (3) см-1, а внеплоскостным деформаци-
колебаниям связей С=О (1641, 1616, 1622 см-1 в
онным колебаниям этих же связей - высокоинтен-
соединениях 1-3 соответственно), сдвигаются в
сивные полосы при 789, 785, 764 см-1. В ИК спек-
низкочастотную область спектра по сравнению с
трах присутствуют полосы поглощения валентных
этими же полосами поглощения соответствующих
колебаний метильных групп при 2972 (1), 29 (2),
карбоновых кислот (1701, 1694, 1688 см-1). На-
2994 см-1 (3).
личие интенсивных полос при 1230 (1), 1227 (2)
По данным РСА, в кристаллах соединений 1-3
и 1260 (3) см-1 определяет валентные колебания
атомы висмута имеют искаженную тригональ-
связи С-О. Полосы поглощения при 1558, 1470,
но-бипирамидальную координацию с карбокси-
1435 см-1 (1); 1588, 1479, 1436 см-1 (2); 1580, 1479,
латными лигандами в аксиальных положениях
1437 см-1 (3) характеризуют валентные колебания
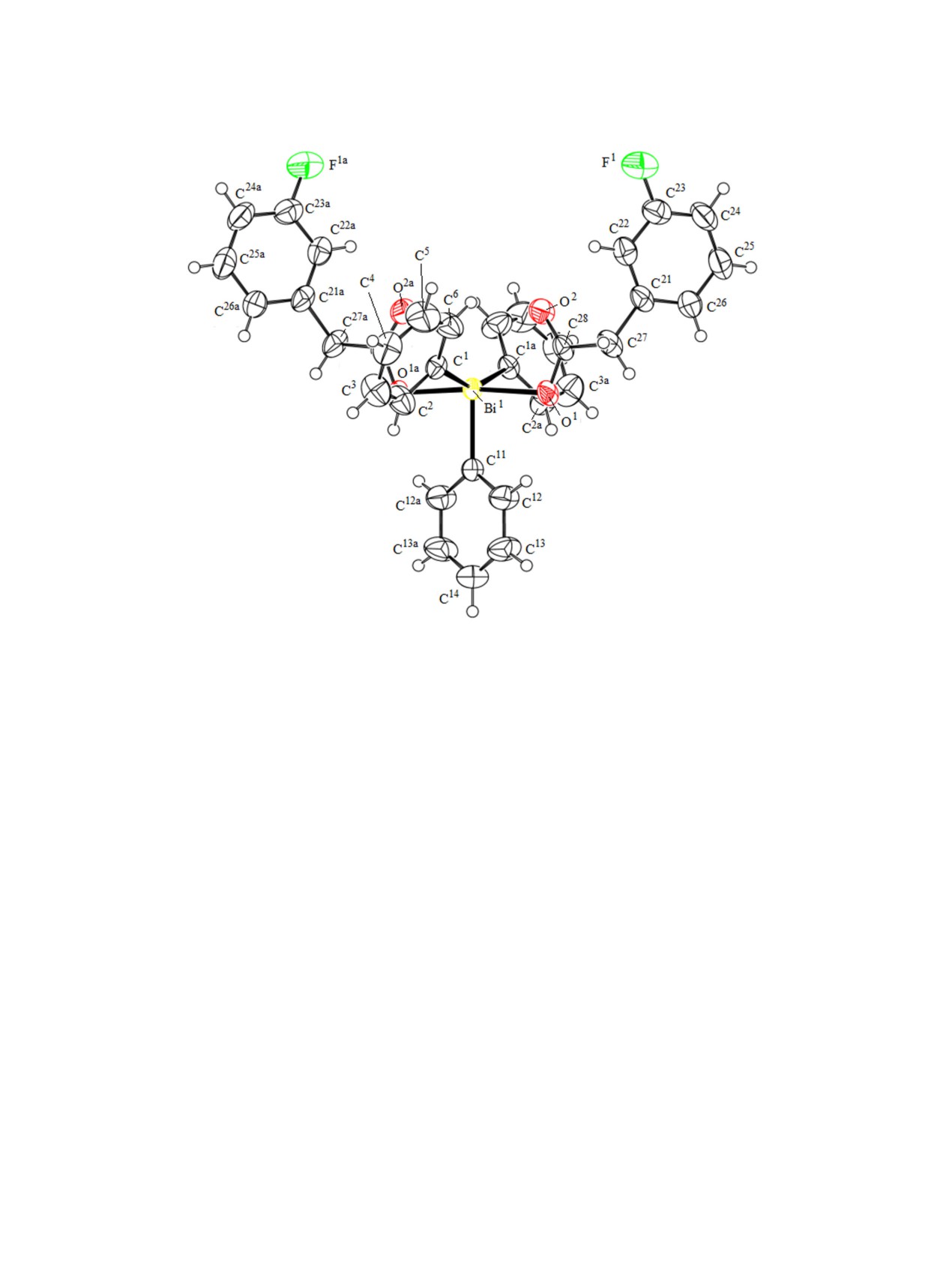
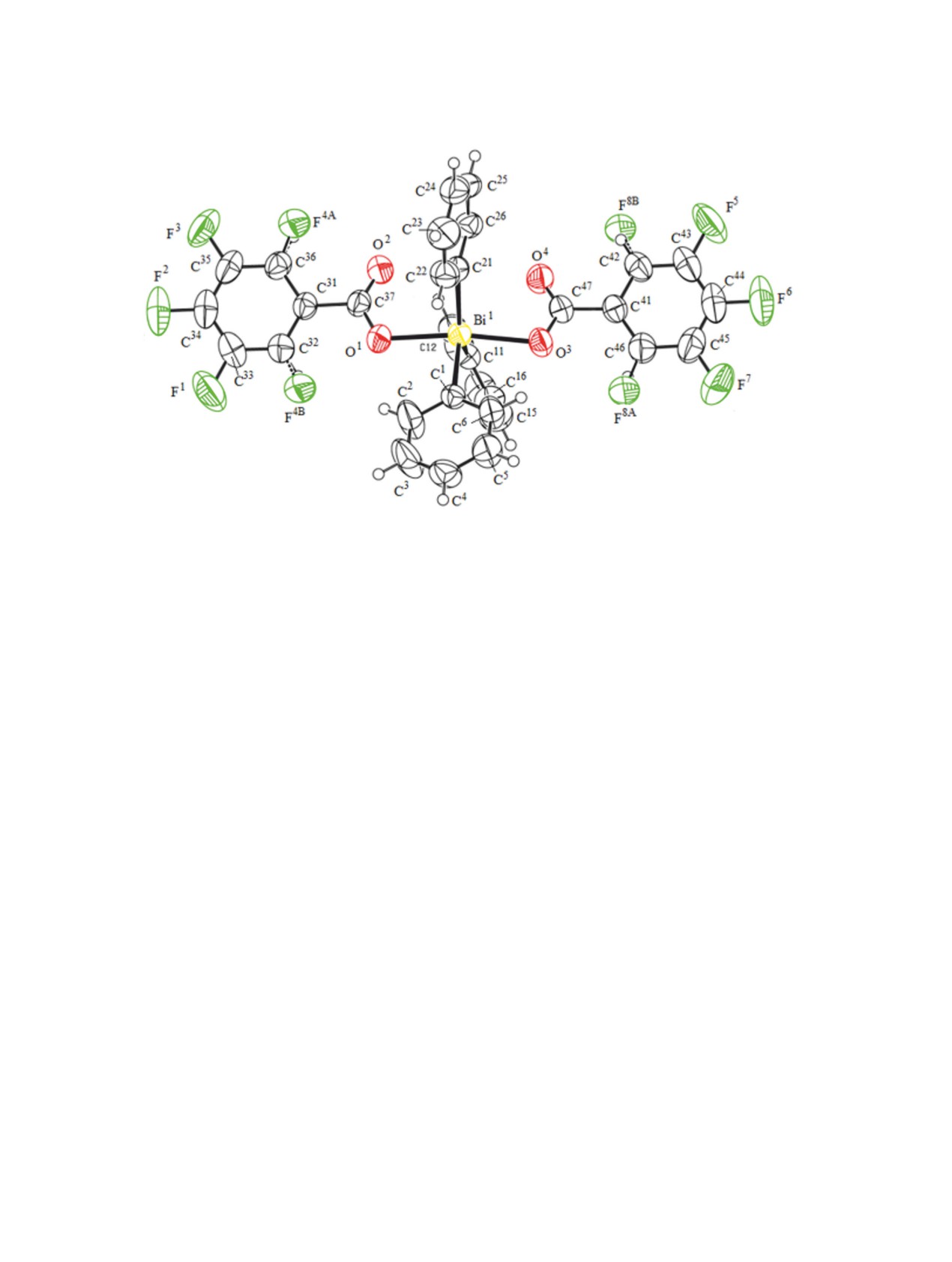
(см. таблицу, рис. 1, 2). Молекулы дикарбоксилата
углеродного скелета арильных колец. Валентным
трифенилвисмута 1 - центросимметричные (центр
колебаниям связей CAr-H отвечают полосы погло-
инверсии - атом металла).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
760
ШАРУТИН и др.
Рис. 1. Общий вид молекулы бис(3-фторфенилацетато)трифенилвисмута 1.
Углы OBiO [171.39(9)-174.10(11)°] несколько
расположены таким образом, что внутримолеку-
отличаются от значения 180°, суммы валентных
лярные контакты Bi···O(=C) формируются внутри
углов в экваториальной плоскости составляют
одного экваториального угла, значение которого
360°. Длины связей Bi-C в соединениях 1-3 изме-
возрастает до 151.07(15), 142.0(3), 138.53(14)° со-
няются в интервалах 2.168(3)-2.331(3) Å, расстоя-
ответственно, при понижении значений двух дру-
ния Bi-O [2.162(2)-2.304(3) Å] приближаются по
гих экваториальных углов.
своему значению к сумме ковалентных радиусов
Наличие различного количества электроотри-
атомов висмута и кислорода (2.31 Å [18]). В мо-
цательных атомов фтора в карбоновой кислоте не
лекулах соединений 1-3 наблюдаются внутримо-
оказывает влияния на схему протекания реакции
лекулярные контакты Bi···O(=C), которые изме-
окислительного присоединения с участием три-
няются в интервале 2.833(8)-3.136(9) Å, поэтому
фенилвисмута. Геометрические характеристики
можно говорить об увеличении координационного
полученных дикарбоксилатов трифенилвисмута
числа центрального атома до 7 (5+2). Двугранные
(длины связей Bi-C, Bi-О, внутримолекулярные
углы между плоскостями карбоксильных групп
контакты Bi···O и величины валентных углов)
в соединениях 1 и 3 составляют 9.07 и 7.27°. В
близки между собой при одинаковом координаци-
кристалле дикарбоксилата трифенилвисмута
2
онном полиэдре атома висмута и его координаци-
плоскости карбоксильных групп компланарны.
онном числе (КЧ = 5+2).
Карбоксилатные лиганды в дикарбоксилатах три-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
фенилвисмута 1-3 имеют относительно фрагмен-
та BiC3 цис-ориентацию, что характерно для боль-
ИК спектры записывали на ИК Фурье спектро-
шинства дикарбоксилатов триорганилвисмута и
метре Shimadzu в таблетках KBr. Рентгенострук-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ И СТРОЕНИЕ ДИКАРБОКСИЛАТОВ
761
Рис. 2. Общий вид молекулы бис(2,3,4,5-тетрафторбензоато)трифенилвисмута 3.
турный анализ проводили на автоматическом че-
211°С. ИК спектр, ν, см-1: 3065, 2935, 1616, 1585,
тырехкружном дифрактометре D8 QUEST Bruker
1574, 1558, 1479, 1437, 1352, 1327, 1271, 1227,
(графитовый монохроматор) при 293 K. Сбор, ре-
1096, 1042, 986, 955, 835, 785, 758, 731, 681, 627,
дактирование данных, уточнение параметров эле-
440. Найдено, %: C 50.85; H 2.82. C32H21O4F4Bi.
ментарной ячейки, учет поглощения, определение
Вычислено, %: C 50.93; H 2.79.
и уточнение структур проведены по программам
Бис(2,3,4,5-тетрафторбензоато)трифе-
[20-22]. Структуры соединений 1-3 определены
нилвисмут (3). Выход 82%, бесцветные кристал-
прямым методом и уточнены методом наименьших
лы, т. пл. 180°С. ИК спектр, ν, см-1: 3071, 2993,
квадратов в анизотропном приближении для нево-
1649, 1623, 1560, 1522, 1479, 1437, 1368, 1310,
дородных атомов. Основные кристаллографиче-
1259, 1192, 1097, 1034, 987, 914, 887, 764, 735, 711,
ские данные и результаты уточнения структур 1-3
приведены в таблице. Полные таблицы координат
679, 650, 624, 521, 447. Найдено, %: C 46.40; H
атомов, длин связей и валентных углов депониро-
2.17. C32H17O4F8Bi. Вычислено, %: C 46.49; H 2.06.
ваны в Кембриджском банке структурных данных
КОНФЛИКТ ИНТЕРЕСОВ
[ССDC 2048155 (1), 2051647 (2), 2041596 (3)].
Авторы заявляют об отсутствии конфликта
Бис(3-фторфенилацетато)трифенилвисмут
интересов.
(1) получали по методике [11]. Выход 81%, бес-
цветные кристаллы, т. пл. 167°С. ИК спектр, ν,
СПИСОК ЛИТЕРАТУРЫ
см-1: 3055, 2945, 1641, 1614, 1575, 1558, 1469,
1. Zhang X.-Y., Wu R.-X., Bi C.-F., Zhang X., Fan Y.-H. //
1435, 1350, 1231, 1138, 1011, 984, 933, 789, 731,
Inorg. Chim. Acta. 2018. Vol. 483. P. 129. doi 10.1016/j.
679, 648, 615, 476, 442. Найдено, %: C 54.54; H
ica.2018.07.02
3.70. C34H27O4F2Bi. Вычислено, %: C 54.62; H 3.61.
2. Oliveira L.G.D., Silva M.M., de Paula F.C.S., Pereira-
Соединения 2 и 3 получали аналогично.
Maia E.C., Donnici C.L., de Simone C.A., Frezard F.,
Бис(2,3-дифторбензоато)трифенилвисмут
da Silva Junior E.N., Demicheli C. // Molecules. 2011.
(2). Выход 83%, бесцветные кристаллы, т. пл.
Vol. 16. P. 10314. doi 10.3390/molecules161210314
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
762
ШАРУТИН и др.
3.
Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. //
13.
Шарутин В.В., Мосунова Т.В. // Вестн. ЮУрГУ.
Dalton Trans. 2018. Vol. 47. P. 971. doi 10.1039/
Сер. Химия. 2020. Т. 12. № 3. С. 7. doi 10.14529/
c7dt04171c
chem200301
4.
Duffin R.N., Blair V.L., Kedzierski L., Andrews P.C. // J.
14.
Сенчурин В.С. // Вестн. ЮУрГУ. Сер. Химия. 2020.
Inorg. Biochem. 2018. Vol. 189. P. 151. doi 10.1016/j.
Т. 12. № 4. С. 72. doi 10.14529/chem200404
jinorgbio.2018.08.015
15.
Шарутин В.В., Шарутина О.К. // ЖОХ. 2021. Т. 91.
5.
Ong Y.C., Blair V.L., Kedzierski L., Andrews P.C. //
№ 4. С. 598; Sharutin V.V., Sharutina O.K. // Russ.
Dalton Trans. 2014. Vol. 43. P. 12904. doi 10.1039/
J. Gen. Chem. Vol. 91. N. 4. In press. doi 10.31857/
c4dt00957f
6.
Ong Y.C., Blair V.L., Kedzierski L., Tuck K.L., And-
S0044460X21040156
rews P.C. // Dalton Trans. 2015. Vol. 44. P. 18215. doi
16.
Шарутин В.В., Поддельский А.И., Шарутина О.К. //
10.1039/c5dt03335g
Коорд. хим. 2020. Т. 46. № 10. С. 579; Sharutin V.V.,
7.
Andleeb S., Imtiaz-ud-Din, Rauf K.M., Azam S.S,
Poddel’sky A.I., Sharutina O.K. // Russ. J. Coord.
Haq I.-u. // Appl. Organomet. Chem. 2019. Vol. 33.
Chem. 2020. Vol. 46. N 10. P. 663. doi 10.1134/
P. e5061. doi 10.1002/aoc.5061
S1070328420100012
8.
Додонов В.А., Гущин А.В., Брилкина Т.Г. // ЖОХ.
17.
Da Silva J.G., Berbet F.M., Da Silva S.M., Rodri-
1985. Т. 55. № 1. С. 73.
gues B.L., Beraldo H., Melo M.N., Frézard F., Demi-
9.
Verkhovykh V.A., Kalistratova O.S., Grishina A.I.,
cheli C. // Molecules. 2014. Vol. 19. P. 6009. doi
Artemova V.G, Gushchin F.V // Bull. South Ural State
10.3390/molecules19056009
University. Ser. Chemistry. 2015. Vol. 7. N 3. P. 61.
10.
Gushchin F.V., Kalistratova O.S., Maleeva A.I.
18.
Бацанов С.С. // ЖНХ. 1991. Т. 36. № 12. С. 3015;
Kuropatov V.A. // Bulletin of the South Ural State
Batsanov S.S. // Russ. J. Inorg. Chem. 1991. Vol. 36.
University. Ser. Chemistry. 2016. Vol. 8. N 1. P. 51. doi
N 12. P. 3015.
10.14529/chem160108
19.
SMART and SAINT-Plus. Version 5.0. Data Collection
11.
Гущин А.В., Шашкин Д.В., Прыткова Л.К., Сомов Н.В.,
and Processing Software for the SMART System.
Баранов Е.В., Шавырин А.С., Рыкалин В.И. // ЖОХ.
Madison (WI, USA): Bruker AXS Inc., 1998.
2011. Т. 81. № 3. С. 397; Gushchin A.V., Shashkin D.V.,
20.
SHELXTL/PC. Version 5.10. An Integrated System for
Prytkova L.K., Somov N.V., Baranov E.V., Shavyrin A.S.,
Solving, Refining and Displaying Crystal Structures
Rykalin V.I. // Russ. J. Gen. Chem. 2011. Vol. 81. N 3. P.
from Diffraction Data. Bruker AXS Inc., Madison,
493. doi 10.1134/S107036321103008X
USA, 1998.
12.
Гусаковская А.А., Калистратова О.С., Андреев П.В.,
21.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Howard K.,
Чупрунов Е.В., Калистратова О.С., Гусаков-
ская А.А. // Кристаллография. 2018. Т. 63. № 2.
Puschmann H. // J. Appl. Cryst. 2009. Vol. 42. P. 339.
С. 203. doi 10.7868/S0023476118020066
doi 10.1107/S0021889808042726
Synthesis and Structure of Triphenylbismuth Dicarboxylates
Ph3Bi[OC(O)R]2 (R = CH2C6H4F-3, C6H3F2-2,3, C6HF4-2,3,4,5)
2021 V. V. Sharutin*, O. K. Sharutina, and L. V. Koscheeva
National Research South Ural State University, Chelyabinsk, 454080 Russia
*e-mail: sharutin50@mail.ru
Received March 29, 2021; revised April 9, 2021; accepted April 15, 2021
The reaction of triphenylbismuth with carboxylic acid and tert-butyl hydroperoxide (1: 2:1 mol.) in diethyl ether
afforded bismuth compounds Ph3Bi[OC(O)R]2 (R = CH2C6H4F-3, C6H3F2-2,3, C6HF4-2,3,4,5), the structural
features of which were established by the single crystal X-ray analysis method. Bismuth atoms in triphenylbis-
muth dicarboxylates have distorted trigonal-bipyramidal coordination with oxygen atoms in axial positions. The
presence of intramolecular contacts Bi···O(=C) [2.833(8)-3.136(9) Å] causes an increase in one bond angle
CBiC to 151.07(15), 142.0(3), 138.53(14)°, respectively, due to a decrease the other two.
Keywords: triphenylbismuth dicarboxylates, X-ray diffraction studies
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021