ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 5, с. 770-777
УДК 542.61 546.65/66
ВЛИЯНИЕ ФОСФОНИЕВЫХ ИОННЫХ ЖИДКОСТЕЙ
НА ЭКСТРАКЦИЮ РЕДКОЗЕМЕЛЬНЫХ
ЭЛЕМЕНТОВ(III)
2,2′-ОКСИБИС(N,N-ДИОКТИЛАЦЕТАМИДОМ)
ИЗ АЗОТНОКИСЛЫХ РАСТВОРОВ
© 2021 г. А. Н. Турановa,*, В. К. Карандашевb , В. Е. Баулинc,d , Д. В. Баулинc
a Институт физики твердого тела Российской академии наук,
ул. Академика Осипьяна 2, Черноголовка, 142432 Россия
b Институт проблем технологии микроэлектроники и особо чистых материалов Российской академии наук,
Черноголовка, 142432 Россия
c Институт физической химии и электрохимии имени А. Н. Фрумкина Российской академии наук,
Москва, 119991 Россия
d Институт физиологически активных веществ Российской академии наук, Черноголовка, 142432 Россия
*e-mail: mager1988@gmail. com
Поступило в Редакцию 18 марта 2021 г.
После доработки 31 марта 2021 г.
Принято к печати 8 апреля 2021 г.
Синтезированы новые фосфониевые ионные жидкости - бис[(трифторметил)сульфонил]имиды алкил-
дифенилэтил фосфония (Alk = С4Н9, С8Н17, С12Н25). Изучено влияние полученных ионных жидкостей на
экстракцию ионов редкоземельных элементов(III) из азотнокислых растворов 2,2′-оксибис(N,N-диокти-
лацетамидом) в 1,2-дихлорэтане. Определена стехиометрия экстрагируемых комплексов, рассмотрено
влияние размера алкильных заместителей в молекуле ионной жидкости и концентрации HNO3 в водной
фазе на эффективность извлечения ионов металлов в органическую фазу. Эффективность и селектив-
ность экстракции ионов редкоземельных элементов(III) значительно увеличивается в присутствии
ионной жидкости в органической фазе.
Ключевые слова: фосфониевые ионные жидкости, 2,2′-оксибис(N,N-диоктилацетамид), экстракция,
редкоземельные элементы(III)
DOI: 10.31857/S0044460X21050152
Экстракционные методы широко исполь-
как тридентатный лиганд [9]. В последнее время
зуются для извлечения, концентрирования и
ионные жидкости используются в экстракционном
разделения актинидов и редкоземельных эле-
концентрировании и разделении органических и
ментов в азотнокислых средах [1]. Высокой экс-
неорганических соединений [10-19]. Экстракция
тракционной способностью по отношению к
актинидов и редкоземельных элементов(III) N-за-
редкоземельным элементам обладают N-замещен-
мещенными диамидами L значительно возрастает
ные 2,2′-оксибис(ацетамиды) [2-7], среди кото-
в присутствии ионных жидкостей - гексафторфос-
рых наиболее детально изучены экстракционные
фатов и бис[(трифторметил)сульфонил]имидов
свойства
2,2′-оксибис(N,N-диоктилацетамида)
1-алкил-3-метилимидазолия (CnmimTf2N) [20-23].
L [8]. При комплексообразовании с ионами ред-
В таких системах для количественного извлече-
коземельных элементов(III) диамид L действует
ния редкоземельных элементов(III) не требуется
770
ВЛИЯНИЕ ФОСФОНИЕВЫХ ИОННЫХ ЖИДКОСТЕЙ
771
Схема 1.
R
O
O
Ph
SO2CF3
C
O
C
P+
-N
Et
N
N
Ph
SO2CF3
C8H17
C8H17
C8H17
C8H17
1-3
L
R = C4H9 (1), C8H17 (2), C12H25 (3).
Схема 2.
R
Ph
R
LiN(SO2CF3)2
Ph
RBr
Ph
-
Et
Br-
N(SO2CF3)2
P
P+
P+
Ph
Ph Et
Et
Ph
1-3
R = C4H9 (1), C8H17 (2), C12H25 (3).
применения значительного избытка ионов NO‒ в
рами HNO3 и растворами в 1,2-дихлорэтане в при-
водной фазе, необходимого при экстракции этими
сутствии этих ионных жидкостей.
экстрагентами в традиционных органических рас-
Фосфониевые ионные жидкости 1-3 получе-
творителях. Для эффективного извлечения актини-
ны по схеме 2. Pеакции дифенилэтилфосфина с
дов и редкоземельных элементов(III) из растворов
бромистым бутилом, бромистым октилом и бро-
в HNO3 и HCl достаточно даже относительно не-
мистым додецилом в безводном ацетонитриле
большой концентрации ионной жидкости в орга-
приводят к соответствующим бромидам, которые
ническом растворителе, содержащем нейтральные
без выделения переводили в алкилдифенилэтил-
донорные экстрагенты [24-31]. Это позволяет рас-
фосфоний бис(трифторметилсульфонил)имиды
сматривать ионные жидкости как активный компо-
1-3 при взаимодействи с бис(трифторметилсуль-
нент синергетической смеси в таких системах.
фонил)имидом лития.
Использование аниона бис[(трифторметил)-
Для сравнения гидрофобности полученных
сульфонил]имида (Tf2N-) в качестве анионного
ионных жидкостей определена их растворимость
компонента ионной жидкости обусловлено его бо-
в воде (2.3×10-4, 7.4×10-5 и 6.8×10-6 моль/л для со-
лее высокой гидрофобностью и гидролитической
единений 1-3 соответственно). Увеличение гидро-
устойчивостью в азотнокислых средах по срав-
фобности в ряду соединений 1 < 2 < 3 соответству-
нению с анионом гексафторфосфата [10]. В боль-
ет увеличению длины алкильных заместителей
шинстве работ по экстракции ионов актинидов и
при атоме фосфора в катионе ионной жидкости.
редкоземельных элементов(III) в качестве ионной
Растворимость фосфониевых ионных жидко-
жидкости использовали жидкость на основе 1-ал-
стей 1-3 в воде ниже, чем растворимость жидко-
кил-3-метилимидазолия.
сти на основе
1-алкил(Сn)-3-метилимидазолия
Нами рассмотрено влияние структуры фосфо-
(4.89×10-2, 1.57×10-2, 0.72×10-2 и 0.41×10-2 при n =
2, 4, 6 и 8 соответственно [32]). Это обусловливает
ниевых ионных жидкостей на экстракцию ионов
редкоземельных элементов(III) растворами 2,2′-ок-
значительно меньшие потери фосфониевых ион-
сибис(N,N-диоктилацетамида) L. С этой целью
ных жидкостей при экстракции.
синтезированы фосфониевые ионные жидкости
Предварительно установлено, что растворы
1-3, различающиеся длиной алкильных замести-
ионных жидкостей 1-3 в дихлорэтане не экстраги-
телей при атоме фосфора (схема 1), и рассмотрены
руют редкоземельных элементов(III) из азотнокис-
некоторые закономерности распределения редко-
лых растворов (величины DLn не превышают 10-2).
земельных элементов(III) между водными раство-
Однако при экстракции редкоземельных элемен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
772
ТУРАНОВ и др.
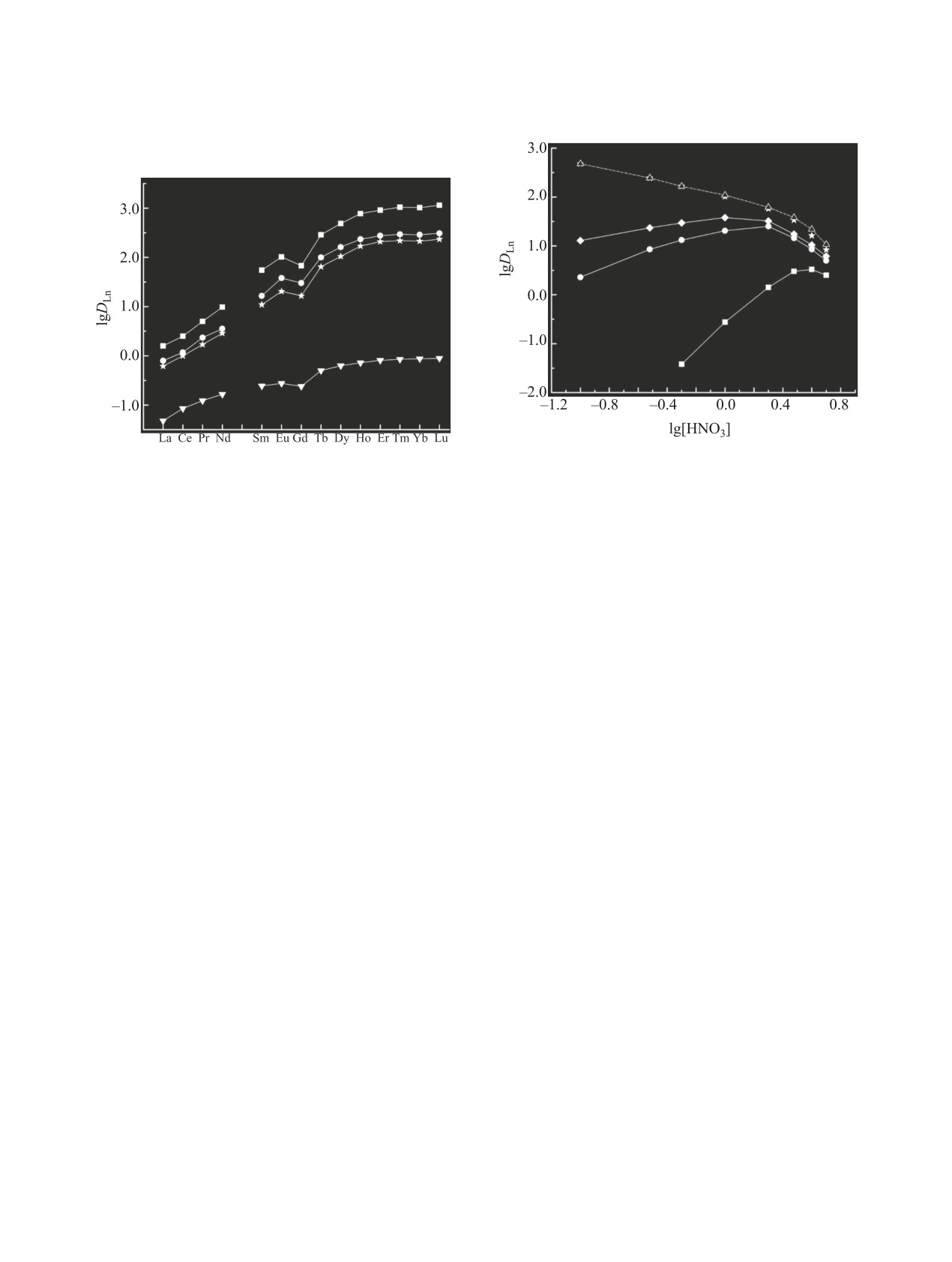
Рис. 2. Зависимость коэффициентов распределения
Eu(III) от концентрации HNO3 в равновесной водной
Рис. 1. Экстракция редкоземельных элементов(III) из
фазе при экстракции 0.01 М. растворами 2,2′-окси-
растворов в 1 М. HNO3 0.01 М. растворами 2,2′-окси-
бис(N,N-диоктилацетамида) L с добавкой 0.05 моль/л
бис(N,N-диоктилацетамида) L с добавкой 0.05 моль/л
ионной жидкости 1 (1), 2 (2) и 3 (3) и без ее добавки
ионной жидкости 1 (1), 2 (2) и 3 (3) и без ее добавки
(4) в дихлорэтане. Сплошная линия (1) - расчет по
(4) в дихлорэтане.
уравнению (5).
тов(III) смесями 2,2′-оксибис(N,N-диоктилацета-
симости коэффициентов распределения редкозе-
мида) L и ионной жидкости 1 в дихлорэтане извле-
мельных элементов(III) от концентрации HNO3 в
чение редкоземельных элементов в органическую
водной фазе (рис. 2). При экстракции растворами
фазу значительно увеличивается (рис. 1). Наблюда-
L в дихлорэтане величины DLn возрастают с уве-
емый синергетический эффект может быть связан с
личением концентрации HNO3 до 4 моль/л, а затем
вхождением гидрофобных анионов Tf2N- в состав
несколько уменьшаются, что связано со снижени-
экстрагируемых комплексов и с увеличением их
ем концентрации свободного экстрагента L в ор-
гидрофобности по сравнению с сольватированны-
ганической фазе вследствие соэкстракции азотной
ми нитратами редкоземельных элементов(III), экс-
кислоты [30]. При экстракции редкоземельных
трагируемыми растворами 2,2′-оксибис(N,N-диок-
элементов(III) растворами L в присутствии ион-
тилацетамида) из азотнокислых растворов. Этим
ных жидкостей 2 и 3 также наблюдаются зависи-
объясняется значительное увеличение экстракции
мости DLn-[HNO3] с максимумами при [HNO3] =
редкоземельных элементов(III), U(VI) и Sr(II) рас-
1.0 и 2.0 моль/л соответственно. Это связано с
творами нейтральных донорных экстрагентов в
высаливающим действием ионов NO‒ и со сни-
присутствии гидрофобных пикрат- [33] или Tf2N-
жением концентрации свободного экстрагента L
[24, 34] анионов в водной фазе.
в равновесной органической фазе вследствие его
Величина синергетического эффекта S
=
взаимодействия как с HNO3, так и с Tf2NН, при-
DLn/DLn(o) [DLn и DLn(o) - коэффициенты распре-
сутствующим в системе вследствие заметного пе-
деления редкоземельных элементов(III) в присут-
рехода ионов Tf2N- в водную фазу.
ствии и в отсутствие ионной жидкости в органи-
Поскольку переход ионов Tf2N- в водную фазу
ческой фазе] увеличивается в ряду соединений
увеличивается со снижением гидрофобности ион-
3 < 2 < 1 с уменьшением их гидрофобности
ных жидкостей, положение максимума на кривой
(рис. 1). Подобные закономерности наблюдались
зависимости DLn-[HNO3] смещается в область
ранее в системах с CnmimTf2N [11].
меньшей концентрации HNO3 при замене ионной
Присутствие ионных жидкостей 1-3 в органи-
жидкости 3 на 2 (рис. 2). При экстракции редко-
ческой фазе существенно изменяет характер зави-
земельных элементов(III) раствором L в присут-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
ВЛИЯНИЕ ФОСФОНИЕВЫХ ИОННЫХ ЖИДКОСТЕЙ
773
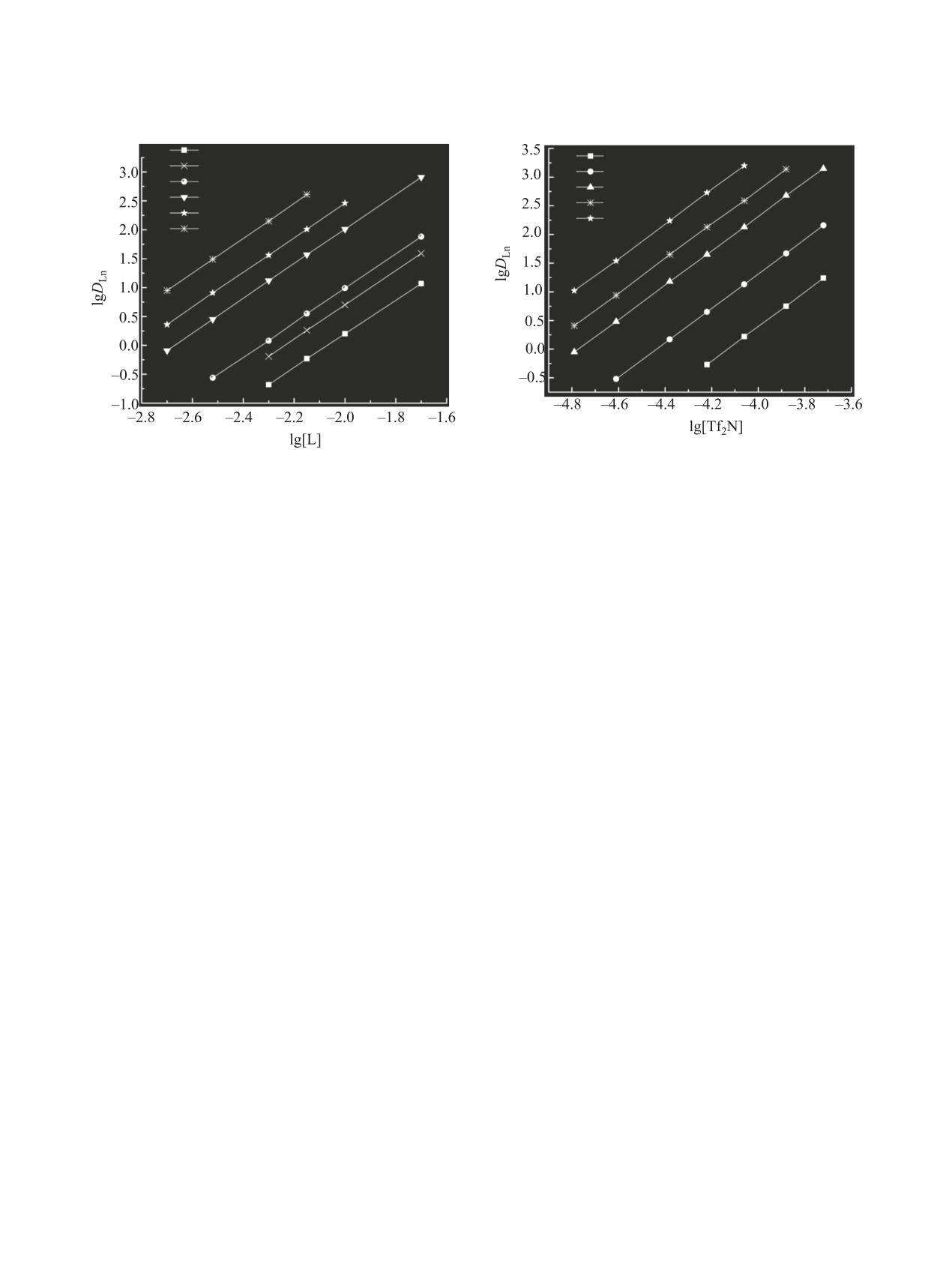
Рис. 4. Зависимость коэффициентов распределения
Рис. 3. Зависимость коэффициентов распределения
редкоземельных элементов(III) от концентрации ио-
редкоземельных элементов(III) от концентрации
нов Tf2N- в равновесной водной фазе при экстракции
2,2′-оксибис(N,N-диоктилацетамида) L в дихлорэтане
из 0.1 М. раствора HNO3 смесью растворов ионной
с добавкой 0.05 моль/л ионной жидкости 1 при экстрак-
жидкости 1 и 0.01 моль/л 2,2′-оксибис(N,N-диоктила-
ции из 1 М. раствора HNO3.
цетамида) L в дихлорэтане.
ствии наименее гидрофобной ионной жидкости 1
замещение в экстрагируемом комплексе анионов
наблюдается снижение DLn с увеличением концен-
NO‒ на более гидрофобные ионы Tf2N- оказывает
трации HNO3 во всем исследованном диапазоне
большее влияние на экстракцию гидратированных
концентраций азотной кислоты, что отмечалось
ионов редкоземельных элементов. Это приводит
ранее при экстракции растворами нейтральных
к значительному увеличению фактора разделения
экстрагентов в присутствии гидрофильных ими-
Lu/La (βLu/La = DLu/DLa) от 18.6 при экстракции рас-
дазолиевых ионных жидкостей CnmimTf2N (n =
твором 2,2′-оксибис(N,N-диоктилацетамида) L в
2-4) [20-23]. Величина синергетического эффекта
дихлорэтане до 724 при экстракции экстрагентом
уменьшается с возрастанием концентрации HNO3
L в присутствии ионной жидкости 1 в органиче-
(рис. 2).
ской фазе (рис. 1).
Эффективность экстракции редкоземельных
Стехиометрическое соотношение редкоземель-
элементов(III) растворами 2,2′-оксибис(N,N-диок-
ных элементов(III)-L в комплексах, экстрагируе-
тилацетамида) L из азотнокислых растворов воз-
мых в присутствии ионной жидкости 1, опреде-
растает с увеличением атомного номера (Z) эле-
лено методом сдвига равновесия. Угловой наклон
мента. Это связано с увеличением устойчивости
зависимостей lgDLn - lg[L] близок к 3 (рис. 3), что
комплексов редкоземельных элементов(III) с жест-
указывает на экстракцию ионов редкоземельных
кими (по Пирсону) лигандами при увеличении
элементов(III) из азотнокислых растворов в виде
плотности заряда ионов Ln3+ вследствие уменьше-
трисольватов. Ранее было показано, что ионы
ния ионного радиуса c возрастанием Z [35].
редкоземельных элементов(III) экстрагируются
При экстракции из раствора в 1 М. HNO3 рас-
растворами L в дихлорэтане из азотнокислых рас-
твором L в присутствии ионной жидкости 1 вели-
творов в виде комплексов с соотношениями ред-
чины S увеличиваются в ряду редкоземельных эле-
коземельных элементов(III)-L 1:2 и 1:3 [30], т. е.
ментов(III) от 33 (La) до 1290 (Lu) (рис. 1) по мере
в системе с ионной жидкостью наблюдается уве-
уменьшения ионных радиусов лантанид-ионов и
личение сольватных чисел в экстрагируемых ком-
увеличения их энергии гидратации. По-видимому,
плексах по сравнению с экстракцией растворами
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
774
ТУРАНОВ и др.
L в дихлорэтане. Это связано со слабой координи-
станты экстракции HTf2N [27] и HNO3[30] раство-
рующей способностью ионов Tf2N- [36], которые
рами L в дихлорэтане, a - активность азотной кис-
находятся, по-видимому, во внешней координаци-
лоты в водной фазе.
онной сфере экстрагируемого комплекса, тогда как
Величины lgK′ex, рассчитанные точностью
в отсутствие ионной жидкости ионы редкоземель-
±0.05-0.07 методом наименьших квадратов по
ных элементов(III) экстрагируются растворами L
уравнению (5) с использованием данных рис. 4:
в виде координационно-сольватированных нитра-
La(III) 18.28, Ce(III) 18.95, Pr(III) 19.25, Nd(III)
тов, в которых ионы NO3- участвуют в координа-
19.54, Sm(III) 20.28, Eu(III) 20.55, Gd(III) 20.41,
ции ионов Ln3+ [8].
Tb(III) 21.01, Dy(III) 21.24, Ho(III) 21.44, Er(III)
Экстракция редкоземельных элементов(III)
21.51, Tm(III) 21.57, Yb(III) 21.56, Lu(III) 21.61.
растворами L в присутствии ионной жидкости 1
Для оценки адекватности предложенной моде-
в органической фазе может быть описана уравне-
ли описания экстракции редкоземельных элемен-
нием (1).
тов(III) растворами экстрагента L в присутствии
Ln3+(в) + (3 - m)NO–(в) +3L(о) + mC+Tf2N-(о)
ионной жидкости 1 по уравнению (5) рассчитаны
(1)
величины DLn при изменении концентрации HNO3
→← LnL3(NO–)(3-m)(Tf2N)m(о) + mC+(в).
в диапазоне 0.1-5 моль/л с использованием най-
Здесь C+ - катион ионной жидкости; символы (о) и
денных K′ex и экспериментально определенных
(в) относятся к компонентам системы в органиче-
концентраций ионов Tf2N- в равновесных водных
ской и водной фазах соответственно.
фазах. Удовлетворительное совпадение рассчи-
Константа экстракции имеет вид (2) или, учи-
танных и экспериментальных величин DLn (рис. 2)
тывая распределение (3) ионной жидкости между
свидетельствует об адекватности предложенной
фазами, - (4).
модели описания экстракции редкоземельных эле-
Kex = DLn[NO–]-(3-m)(в)[L]-3(о)[CTf2N]-m(о)[C+]m(в),
(2)
ментов(III) растворами L в присутствии ионной
C+(в) + Tf2N-(в) ← C+Tf2N-(о) , KИЖ,
(3)
жидкости 1.
Kex = DLn[NO–]-(3-m)(в)[L]-3(о)KИЖ-m[Tf2N-]-m(в).
(4)
Представленные данные показали, что эффек-
При постоянной концентрации L в органи-
тивность и селективность экстракции редкозе-
ческой фазе тангенсы угла наклона линейных
мельных элементов(III) из азотнокислых растворов
участков зависимостей lgDLn-lg[Tf2N-] близки к 3
растворами
2,2′-оксибис(N,N-диоктилацетамида)
(рис. 4), что соответствует извлечению комплексов
L значительно увеличивается в присутствии ион-
редкоземельных элементов(III) с соотношением
ных жидкостей - бис[(трифторметил)сульфонил]-
Ln-Tf2N- 1:3.
имидов алкилдифенилэтил фосфония 1-3 в орга-
нической фазе. С уменьшением гидрофобности
Изменение концентрации ионов NO‒ в интер-
ионных жидкостей эффективность экстракции ио-
вале 0.3-5 моль/л при постоянной кислотности
нов редкоземельных элементов(III) из азотнокис-
водной фазы не приводит к заметному измене-
лых растворов возрастает.
нию DLn при экстракции редкоземельных элемен-
тов(III) растворами экстрагента L в присутствии
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ионной жидкости 1 в органической фазе. Следо-
В качестве исходного вещества для получения
вательно, зависимость DLn от концентрации ком-
соединений 1-3 использовали коммерчески до-
понентов органической и водной фаз описывается
ступный дифенилэтилфосфин (ООО Сорбент-Тех-
уравнением (5).
нологии, Москва). Эксперименты с использовани-
‒
DLn = (Kex K
Ж
3)[L](исх)3[Tf2N-]3(в) f-3
ем соединений трехвалентного фосфора проводили
= K′ex[L](исх)3[Tf2N-]3(в) f -3.
(5)
в атмосфере сухого аргона. Спектры ЯМР 1H, 19F
Здесь [L](исх) - исходная концентрация экстра-
и 31Р записаны на спектрометре Bruker СХР-200 в
гента L в органической фазе, f - поправка на
СDCl3; стандарты - ТМС (внутренний), CF3COOH
связывание экстрагента L кислотами (f = 1 +
и 85%-ная Н3РО4 (внешние). Температуры плавле-
KHTf2N[H+][Tf2N-] + KHNO3a); KHTf2N и KHNO3 - кон-
ния измерены на приборе Boеtius PHMK 05.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
ВЛИЯНИЕ ФОСФОНИЕВЫХ ИОННЫХ ЖИДКОСТЕЙ
775
[Бис(трифторметил)сульфонил]имид бутил-
0.90-2.84 м [26Н, РСН2СН3+4Н, РСН2(СН2)10СН3],
дифенилэтилфосфония (1). К раствору 2.14 г
2.80 м [4Н, РСН2СН3+РСН2(СН2)10СН3], 7.40-7.92
(0.010 моль) дифенилэтилфосфина в 20 мл без-
м (10HAr). Спектр ЯМР 19F: δF -1.09 м. д. Спектр
водного ацетонитрила при 80°С по каплям при
ЯМР 31Р: δP 30.11 м. д. Найдено, %: C 50.49; H
перемешивании добавляли 1.65 г (0.012 моль)
5.91; N 1.99; P 4.58. C28H40F6NO4PS2. Вычислено,
бромистого бутила. Смесь кипятили 5 ч, затем
%: C 50.67; H 6.07; N 2.11; P 4.67.
упаривали в вакууме. К остатку добавляли 20 мл
2,2′-Oксибис(N,N-диоктилацетамид) L син-
диэтилового эфира, выдерживали 2 ч при -8°С и
тезирован и очищен по известной методике [37]. В
декантировали эфирный слой. Остаток растворяли
качестве органического разбавителя использовали
в 25 мл бензола, к полученному раствору добав-
1,2-дихлорэтан (ХЧ) без дополнительной очистки.
ляли раствор 4.32 г (0.015 моль) бис[(трифторме-
Растворы экстрагента L готовили по точным наве-
тил)сульфонил]имида лития в 20 мл дистиллиро-
скам.
ванной воды, смесь перемешивали 2 ч и отделяли
Исходные водные растворы редкоземельных
органический слой. Из водного слоя продукт ре-
элементов(III) готовили растворением соответ-
акции экстрагировали бензолом (3 × 15 мл), полу-
ствующих нитратов в воде с последующим добав-
ченный экстракт объединяли с органическим сло-
лением HNO3. Исходная концентрация ионов ме-
ем и тщательно упаривали в вакууме. Выход 4.13 г
таллов - 2×10-6 моль/л. Фазы перемешивали 1 ч
(76%), вязкое масло, при стоянии превращающее-
при комнатной температуре на роторном аппарате
ся в парафинообразную массу. Спектр ЯМР 1H, δ,
со скоростью 60 об/мин. Этого времени достаточ-
м. д.: 0.91 м (3Н, РСН2СН3), 1.20-1.40 м [5H, 3Н
но для установления постоянных коэффициентов
РCH2CH3+РСН2(СН2)2СН3], 2.80 м [4Н, РСН2С·
распределения элементов в экстракционных си-
Н3+РСН2(СН2)2СН3], 7.42 м (1HAr), 7.30-7.85 м
стемах.
(9НAr). Спектр ЯМР 19F: δF -1.00 м. д. Спектр ЯМР
Концентрацию редкоземельных элементов(III)
31Р: δP 30.17 м. д. Найдено, %: C 43.30; H 4.15; N
в исходных и равновесных водных растворах опре-
2.34; P 5.42. C20H24F6NO4PS2. Вычислено, %: C
деляли методом масс-спектрометрии с индуктивно
43.56; H 4.39; N 2.54; P 5.62.
связанной плазмой с использованием масс-спек-
[Бис(трифторметил)сульфонил]имид октил-
трометра X-7 (Thermo Scientific, США). Количе-
дифенилэтилфосфония
(2) получен аналогич-
ство элементов в органической фазе определяли
но из 2.35 г (0.011 моль) дифенилэтилфосфи-
после реэкстракции 0.1 М. раствором 1-гидрок-
на и 2.32 г (0.012 моль) бромистого октила в
сиэтан-1,1-дифосфоновой кислоты. Коэффициен-
25 мл безводного ацетонитрила. Выход 5.34 г
ты распределения редкоземельных элементов(III)
(80%), вязкое масло, при стоянии превращаю-
рассчитывали, как отношение их концентраций в
щееся в парафинообразную массу. Спектр ЯМР
равновесных органической и водной фазах. По-
1H, δ, м. д.: 0.95 м (3Н, РСН2СН3), 1.20 м [11H,
грешность определения коэффициентов распре-
РCH2CH3+РСН2(СН2)2(СН2)4СН3)],
1.55 м
[4Н,
деления не превышала 5%. Концентрацию HNO3
РСН2(СН2)2(СН2)4СН3], 2.80 м [4Н, РСН2СН3+РС·
в равновесной водной фазе определяли потен-
Н2(СН2)2(СН2)4СН3)], 7.43 м (1HAr), 7.30-7.87 м
циометрическим титрованием раствором NaOH.
(9НAr). Спектр ЯМР 19F: δF -1.05 м. д. Спектр ЯМР
Концентрацию ионов Tf2N- в равновесных водных
31Р: δP 30.21 м. д. Найдено, %: C 47.49; H 4.99; N
фазах определяли атомно-эмиссионным методом с
2.34; P 5.02. C24H32F6NO4PS2. Вычислено, %: C
ионизацией пробы в индуктивно связанной плазме
47.44; H 5.31; N 2.31, P 5.10.
с использованием спектрометра ICAP-61 (Thermo
[Бис(трифторметил)сульфонил]имид доде-
Jarrel Ash, США).
цилдифенилэтилфосфония (3) получен анало-
ФОНДОВАЯ ПОДДЕРЖКА
гично из 2.03 г (0.0095 моль) дифенилэтилфос-
фина и 2.83 г (0.011 моль) бромистого додецила в
Работа выполнена в рамках государственного
25 мл безводного ацетонитрила. Выход 4.45 г (61%),
задания 2020 г. Института физики твердого тела
вязкое масло, при стоянии превращающееся в па-
РАН, Института проблем технологии микроэлек-
рафинообразную массу. Спектр ЯМР 1H, δ, м. д.:
троники и особо чистых материалов РАН, Ин-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
776
ТУРАНОВ и др.
ститута физической химии и электрохимии им.
16.
Riano S., Foltova S.S., Binnemans K. // RSC Adv. 2020.
А.Н. Фрумкина РАН, Института физиологически
Vol. 10. P. 307. doi 10.1039/c9ra08996
17.
Raut D.R., Sharma S., Ghosh S.K., Mohapatra P.K. //
активных веществ РАН (тема № 0090-2019-0008) и
Sep. Sci. Technol. 2017. Vol. 52. P. 1430. doi
при частичной финансовой поддержке Российско-
10.1080/01496395.2017.1290112
го фонда фундаментальных исследований (грант
18.
Khodakarami M., Alagha L. // Sep. Purif. Technol.
№ 18-29-24069).
2020. Vol. 232. P. 115952.
КОНФЛИКТ ИНТЕРЕСОВ
19.
Iqbal M., Waheed K., Rahat S.B., Mehmood T.,
Lee M.S. // J. Radioanal. Nucl. Chem. 2020. Vol. 325.
Авторы заявляют об отсутствии конфликта
P. 1. doi 10.1007/s10967-020-07199-1
интересов.
20.
Shimojo K., Kurahashi K., Naganawa H. // Dalton
Trans. 2008. Р. 5083. doi 10.1039/B810277P
СПИСОК ЛИТЕРАТУРЫ
21.
Mincher M.E., Quach D.L., Liao Y.J., Mincher B.J.,
1.
Myasoedov B.F., Kalmykov S.N., Kulyako Yu.M.,
Wai C.M. // Solvent Extr. Ion Exch. 2012. Vol. 30.
Vinokurov S.E. // Geochem. Int. 2016. Vol. 54. N 13.
P. 735. doi 10.1080/07366299.2012.700583
P. 1156. doi 10.1134/S0016702916130115
22.
Panja S., Mohapatra P.K., Tripathi S.C., Gandhi P.M.,
2.
Narita H., Yaita T., Tamura K., Tachimori S. //
Janardan P. // Sep. Purif. Technol. 2012. Vol. 96. P. 289.
Radiochim. Acta. 1998. Vol. 81. P. 223. doi 10.1524/
doi 10.1016/j.seppur.2012.06.015
ract.1998.81.4.223
23.
Mohapatra P.K. // Chem. Prod. Proc. Model. 2015.
3.
Sasaki Y., Sugo Y., Suzuki S., Tachimori S. // Solvent
Vol. 10. P. 135. doi 10.1515/cppm-2014-0030
Extr. Ion Exch. 2001. Vol. 19. P. 91. doi 10.1081/SEI-
24.
Turanov A.N., Karandashev V.K., Baulin V.E. //
100001376
Solvent Extr. Ion Exch. 2008. Vol. 26. P. 77. doi
4.
Zhui Z.-X, Sasaki Y., Suzuki S., Kimura T. // Anal.
10.1080/07366290801904871
Chim. Acta. 2004. Vol. 527. P. 163. doi 10.1016/j.
25.
Туранов А.Н., Карандашев В.К., Баулин В.Е. // ЖНХ.
aca.2004.09.023
2008. Т. 53. № 6. С. 1045; Turanov A.N., Karanda-
5.
Sasaki Y., Sugo Y., Morita K., Nash K.L. //
shev V.K., Baulin V.E // Russ. J. Inorg. Chem. 2008.
Solvent Extr. Ion Exch. 2015. Vol. 33. P. 625. doi
Vol. 53. N 6. P. 970. doi 10.1134/S0036023608060272
10.1080/07366299.2015.1087209
26.
Туранов А.Н, Карандашев В.К., Баулин В.Е. // Ра-
6.
Campbell E., Holfeltz V.E., Hall G.B., Nash K.L., Lumet-
диохимия. 2008. Т. 50. № 3. С 229; Turanov A.N.,
ta G.J., Levitskaia T.G. // Solvent Extr. Ion Exch. 2018.
Karandashev V.K., Baulin V.E. // Radiochem. 2008.
Vol. 36. P. 331. doi 10.1080/07366299.2018.1447261
Vol. 50. N 3. С. 266. doi 10.1134/S1066362208030090
7.
Ansari S.A., Mohapatra P.K., Leoncini A., Ali S.M.,
27.
Turanov A.N., Karandashev V.K., Baulin V.E. //
Singhadeb A., Huskens J., Verboom W. // Dalton Trans.
Solvent Extr. Ion Exch. 2010. Vol. 28. P. 367. doi
2017. Vol. 46. P. 11355. doi 10.1039/C7DT03831C
10.1080/07366291003684238
8.
Ansari S.A., Pathak P.N, Mohapatra P.K., Manchan-
28.
Turanov A.N., Karandashev V.K., Baulin V.E. //
da V.K. // Chem. Rev. 2012. Vol. 112. P.1751. doi
Solvent Extr. Ion Exch. 2012. Vol. 30. P. 244. doi
10.1021/cr200002f
10.1080/07366299.2011.639248
9.
Antonio M.R., McAlister D.R., Horwitz E.P. // Dalton
29.
Pribilova G., Smirnov I., Novikov A. // J. Radioanal.
Trans. 2015. Vol. 44. P. 515. doi 10.1039/C4DT01775G
Nucl. Chem. 2013. Vol. 295. P. 83. doi 10.1007/s10967-
10.
Kolarik Z. // Solvent Extr. Ion Exch. 2013. Vol. 31.
012-2220-1
P. 24. doi 10.1080/07366299.2012.700589
30.
Turanov A.N., Karandashev V.K., Boltoeva M., Gailard C.,
11.
Billard I. // Handbook on the Physics and Chemistry of
Mazan, V. // Sep. Purif. Technol. 2016. Vol. 164. P. 97.
Rare Earths. 2013. Vol. 43. Ch. 256. P. 213.
doi 10.1016/j.seppur.2016.03.004
12.
Dietz M.L. // Sep. Sci. Technol. 2006. Vol. 41. P. 2047.
31.
Turanov A.N., Karandashev V.K., Khvostikov V.A. //
doi 10.1080/01496390600743144
Solvent Extr. Ion Exch. 2017. Vol. 35. P. 461. doi
13.
Sun X., Luo H., Dai S. // Chem. Rev. 2012. Vol. 112.
10.1016/j.seppur.2016.03.004
P. 2100. doi 10.1021/cr200193x
32.
Luo H., Dai S., Bonnesen P.V., Haverlock T.J.,
14.
Shkrob I.A., Marin T.W., Jensen M.P. // Ind. Eng. Chem.
Moyer B.A., Buchanan III A.C. // Solvent Extr. Ion Exch.
Res. 2014. Vol. 53. P. 3641. doi 10.1021/ie4036719
2006. Vol. 24. P. 19. doi 10.1080/07366290500388624
15.
Janssen C.H.C., Macias-Ruvalcaba N.A., Aguilar-
33.
Naganawa H., Suzuki H., Tachimori S., Nasu A.,
Martinez M., Kobrak M.N. // Int. Rev. Phys. Chem. 2015.
Sekine T. // Phys. Chem. Chem. Phys. 2001. Vol. 3.
Vol. 34. P. 591. doi 10.1080/0144235X.2015.1088217
P. 2509. doi 10.1039/B100073J
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
ВЛИЯНИЕ ФОСФОНИЕВЫХ ИОННЫХ ЖИДКОСТЕЙ
777
34. Туранов А.Н., Карандашев В.К., Яркевич А.Н. // Ра-
комплексных соединений редкоземельных элемен-
диохимия. 2018. Т. 60. № 2. С. 153; Turanov A.N.,
тов. Киев: Наукова думка, 1966. 494 с.
Karandashev V.K., Yarkevich A.N. // Radiochem. 2018.
36. Binnemans K. // Chem. Rev. 2007. Vol. 107. P. 2593. doi
Vol. 60. N 2. P. 170. doi 10.1134/S1066362218020078
10.1021/cr050979c
35. Яцимирский К.Б., Костромина Н.А., Шека З.А., Да-
37. Sasaki Y., Choppin G.R. // Anal. Sci. 1996. Vol. 12.
виденко Н.К., Крисс Е.Е., Ермоленко В.И. Химия
P. 225. doi 10.2116/analsci.12.225
Effect of Phosphonic Ionic Liquids on The Extraction of Rare
Earth Elements(III) with 2,2′-Oxibis(N,N-dioctylacetamide)
from Nitric Acid Solutions
A. N. Turanova,*, V. K. Karandashevb, V. E. Baulinc,d, and D. V. Baulinc
a Institute of Solid State Physics, Russian Academy of Sciences, Chernogolovka, 142432 Russia
b Institute for Problems of Microelectronics Technology and High-Purity Materials, Russian Academy of Sciences,
Chernogolovka, 142432 Russia
c Frumkin Institute of Physical Chemistry and Electrochemistry, Russian Academy of Sciences, Moscow, 119991 Russia
d Institute of Physiologically Active Substances of the Russian Academy of Sciences, Chernogolovka, 142432 Russia
*e-mail: mager1988 @ gmail. com
Received March 18, 2021; revised March 31, 2021; accepted April 8, 2021
New phosphonium ionic liquids alkyldiphenylethyl phosphonium bis[(trifluoromethyl)sulfonyl]imide
(Alk = C4H9, C8H17, C12H25) were synthesized. The effect of the obtained ionic liquids on the extraction of rare
earth elements(III) ions from nitric acid solutions of 2,2′-oxybis(N,N-dioctylacetamide) in 1,2-dichloroethane
was studied. The stoichiometry of the extracted complexes was determined, and the effect of the size of alkyl
substituents in the ionic liquid molecule and the concentration of HNO3 in the aqueous phase on the efficiency of
extraction of metal ions into the organic phase was considered. The efficiency and selectivity of the extraction of
ions of rare earth elements(III) is significantly increased in the presence of an ionic liquid in the organic phase.
Keywords: phosphonium ionic liquids, 2,2′-oxybis(N,N-dioctylacetamide), extraction, rare earth elements(III)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021