ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 5, с. 816-820
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.46.052.2
СИНТЕЗ 4-АРИЛ-6-ОКСО-5-ЦИАНО-
1,6-ДИГИДРОПИРИДИН-2-КАРБОНОВЫХ КИСЛОТ И
ИХ МЕТИЛОВЫХ ЭФИРОВ В РЕАКЦИИ МЕТИЛОВЫХ
ЭФИРОВ АЦИЛПИРОВИНОГРАДНЫХ КИСЛОТ С
МАЛОНОНИТРИЛОМ И ЦИАНОАЦЕТАМИДОМ
© 2021 г. М. А. Марьясов*, Н. П. Ромашов, В. В. Давыдова, О. Е. Насакин, М. П. Осипова
Чувашский государственный университет имени И. Н. Ульянова, Московский пр. 15, Чебоксары, 428015 Россия
*e-mail: marsikprovisor@mail.ru
Поступило в Редакцию 2 апреля 2021 г.
После доработки 2 апреля 2021 г.
Принято к печати 10 апреля 2021 г.
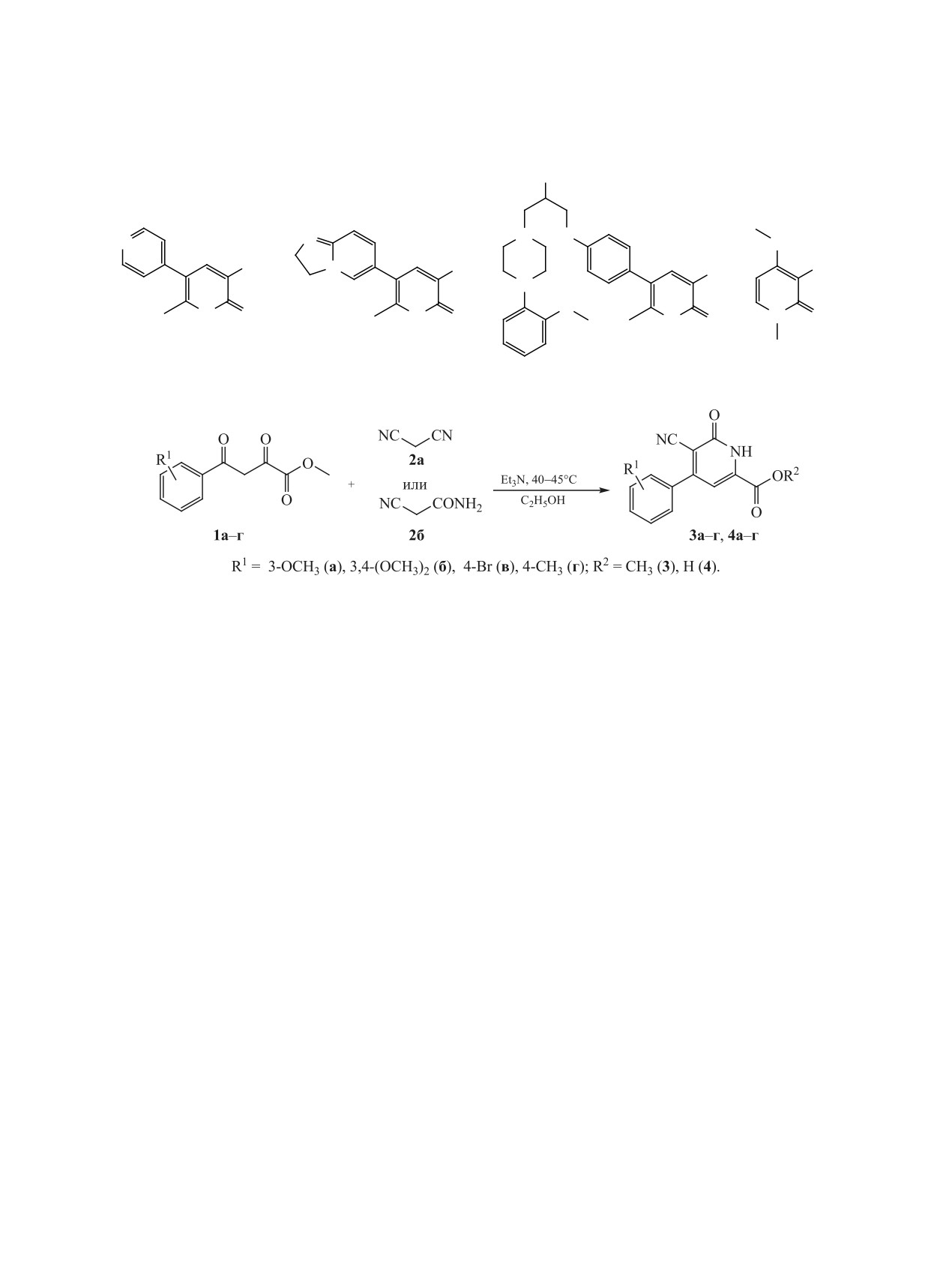
Взаимодействием метиловых эфиров ацилпировиноградных кислот с малононитрилом и цианоацетами-
дом получены метил 4-арил-6-оксо-5-циано-1,6-дигидропиридин-2-карбоксилаты и 4-арил-6-оксо-5-ци-
ано-1,6-дигидропиридин-2-карбоновые кислоты соотвественно.
Ключевые слова: пирид-2-он-3-карбонитрилы, малононитрил, цианоацетамид, ацилпировиноградные
кислоты, пиридин-2-карбоновые кислоты
DOI: 10.31857/S0044460X2105019X
Производные пирид-2-он-3-карбонитрила яв-
связана с ингибированием ряда белков и фермен-
ляются перспективными соединениями для раз-
тов - протеинкиназы Pim-1 [10], фарнезилтрасфе-
работки новых лекарственных препаратов. В на-
разы [11], P-гликопротеина [12]. В данном ряду
стоящее время получены представители данного
применяются также аналоги алкалоида клещеви-
класса с различной биологической активностью.
ны - рицина, обладающие противоопухолевым
действием [13, 14].
Большую группу составляют ингибиторы
фосфодиэстеразы, обладающие положительным
Некоторые пирид-2-он-3-карбонитрилы обла-
инотропным, сосудорасширяющим эффектом и
дают противовирусным [15], противо-судорожным
применяемые при лечении сердечно-сосудистых
[16] действием, а также являются XLR-модулято-
заболеваний. Наиболее известными из них явля-
рами и применяются для коррекции липидного об-
ются Милринон [1], Олпринон [2, 3], Сатеринон
мена [17, 18].
[4], а также их аналоги [5-8] (схема 1).
С целью оптимизации методов синтеза соеди-
Имеются экспериментальные данные о том, что
нений такого типа нами была изучена реакция ме-
пирид-2-он-3-карбонитрилы являются регулятора-
тиловых эфиров ацилпировиноградных кислот 1 с
ми апоптоза клеток [9] - процесса программиру-
малононитрилом и цианоацетамидом (схема 2). Ре-
емой клеточной гибели - и могут применяться в
акция протекает в мягких условиях (этанол, 40°С)
химиотерапии онкологических заболеваний. Ан-
в присутствии триэтиламина и приводит к образо-
типролиферативная активность в данном случае
ванию соответствующих 4-арил-6-оксо-1,6-диги-
816
СИНТЕЗ 4-АРИЛ-6-ОКСО-5-ЦИАНО-1,6-ДИГИДРОПИРИДИН-2-КАРБОНОВЫХ КИСЛОТ
817
Схема 1.
OH
N
N
O
N
O
CN
N
CN
CN
CN
N
O
N
O
N
O
N O
N O
H
H
H
Милринон
Олпринон
Сатеринон
Рицин
Схема 2.
дропиридин-2-карбоновых кислот 4а-г и их мети-
дропиридин-2-карбоновых кислот и их метиловых
ловых эфиров 3а-г с выходами 52-75%.
эфиров на основе производных ацилпировино-
градных кислот.
Установлено, что при взаимодействии метило-
вых эфиров ацилпировиноградных кислот 1а-г с
Общая методика получения соединений 3,
цианоацетамидом 2б протекает гидролиз сложно-
4. К раствору 1 ммоль соответствующего метило-
эфирной группы с образованием соответствую-
вого эфира ацилпировиноградной кислоты в 2 мл
щих кислот 4а-г.
этанола (при необходимости нагретого до 40°C
Строение соединений 3, 4 установлено метода-
для растворения) при постоянном перемешива-
ми ЯМР 1H, 13C, ИК спектроскопии и масс-спек-
нии добавляли раствор 1.1 ммоль малононитри-
трометрии. В ИК спектрах полученных соеди-
ла (цианоацетамида) в 3 мл этанола и 1-2 капли
нений присутствуют полосы поглощения связей
триэтиламина. Полученную смесь перемешивали
N-H (3358-3453 см-1), О-Н (3295-3322 см-1), С=О
при температуре 40-45°C в течение 3-5 ч, затем
(1714-1742 см-1), С=С (1533-1666 см-1), сопря-
охлаждали до 5-10°C и выдерживали 12 ч. Обра-
женных CN-групп (2216-2229 см-1). В спектрах
зовавшийся осадок отфильтровывали, промывали
ЯМР 1H сигналы протонов NH регистрируются
холодным этанолом, при необходимости перекри-
при 6.74-6.93 м. д. Сигналы групп COOСН3 в спек-
сталлизовывали из спирта.
трах соединений 3а-г и групп СООН в спектрах
Метил-4-(3-метоксифенил)-6-оксо-5-циа-
соединений 4а-г наблюдаются в области 3.95-3.96
но-1,6-дигидропиридин-2-карбоксилат (3a). Вы-
и 13.01-13.22 м. д. соответственно. Спектры ЯМР
ход 52%, т. пл. 155-157°C (EtOH). ИК спектр, ν, см-1:
13С соединений 3 и 4 характеризуются наличием
3453 ш (NH), 2226 с (C≡N), 1736 ш (C=O), 1619,
сигналов атомов углерода цианогрупп в области
1597, 1578 ср (C=С). Спектр ЯМР 1H, δ, м. д.: 7.58
113.4-114.9 м. д. и сигналами групп С=О в области
д (1Н, СН, JHH 8.1 Гц), 7.50 с (1Н, СН), 7.48 д (1Н,
150.7-163.5 м. д.
СН, JHH 2.4 Гц), 7.46 с (1Н, СН), 7.20 д. д (1Н, СН,
Таким образом, нами разработан препаратив-
JHH 8.1, 2.4 Гц), 6.85 с (1Н, NH), 3.96 с (3Н, ОСН3),
ный метод получения 6-оксо-5-циано-1,6-диги-
3.84 с (3Н, ОСН3). Спектр ЯМР 13C, δC, м. д.: 163.3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
818
МАРЬЯСОВ и др.
(C4), 159.9 (C3ʹ), 158.5 (COO), 150.8 (C6O), 131.1
Вычислено, %: C 67.16; H 4.51; N 10.44.
(С1ʹ), 130.7 (С5ʹ), 119.7 (С6ʹ, C2), 113.4 (СN), 111.4
4-(3-Метоксифенил)-6-оксо-5-циано-1,6-ди-
(C5, C4ʹ), 101.3 (C3), 99.0 (C2ʹ), 55.6 (OCH3), 53.9
гидропиридин-2-карбоновая кислота (4a). Вы-
(OCH3). Масс-спектр, m/z (Iотн, %): 284(100) [M]+.
ход 63%, т. пл. 214-216°C (EtOH). ИК спектр, ν,
Найдено, %: C 63.55; H 4.42; N 9.61. C15H12N2О4.
см-1: 3401 ш (NH), 3322 ш (ОH), 2220 с (C≡N),
Вычислено, %: C 63.38; H 4.26; N 9.85.
1726, ш (C=O), 1656, 1647, 1600, ср (C=С). Спектр
Метил-4-(3,4-диметоксифенил)-6-оксо-5-ци-
ЯМР 1H, δ, м. д.: 13.16 (1Н, ОН), 7.46 д (1Н, СН,
ано-1,6-дигидропиридин-2-карбоксилат
(3б).
JHH 2.4 Гц), 7.44 с (1Н, СН), 7.42 с (1Н, СН), 7.42
Выход 58%, т. пл. 207-209°C (EtOH). ИК спектр,
с (1Н, СН), 7.42 д (1Н, СН, JHH 8.9 Гц), 7.13 д. д
ν, см-1: 3358 ш (NH), 2229 с (C≡N), 1742, 1717 с
(1Н, СН, JHH 8.9, 2.4 Гц), 6.82 (1H, NH), 3.83 с
(C=O), 1644, 1603, 1576 ср (C=С). Спектр ЯМР 1H,
(3Н, ОСН3). Спектр ЯМР 13C, δC, м. д.: 163.3 (C4),
δ, м. д.: 7.37 с (1Н, СН), 7.33 с (1Н, СН), 7.24 с
162.9 (COO), 162.3 (C6O), 159.6 (C3ʹ), 130.3 (C1ʹ,
(1Н, СН), 7.11 с (1Н, СН), 6.76 с (1Н, NH), 3.96 с
C5ʹ), 120.0 (C6ʹ, C2), 117.8 (C3, C5), 114.7 (CN), 112.6
(3Н, ОСН3), 3.82 с (3Н, ОСН3), 3.76 с (3Н, ОСН3).
(C2ʹ), 112.5 (C4ʹ), 55.5 (OCH3). Масс-спектр, m/z
Спектр ЯМР 13C, δC, м. д.: 162.7 (C4), 158.9 (COO),
(Iотн, %): 270 (100) [M]+. Найдено, %: C 62.47; H
153.3 (C6O), 150.8 (C3ʹ), 148.9 (C4ʹ), 122.2 (С1ʹ),
3.96; N 10.05. C14H10N2О4. Вычислено, %: C 62.22;
121.4 (C2), 120.3 (С6ʹ), 113.8 (СN), 111.8 (C5), 110.6
H 3.73; N 10.37.
(C3), 109.6 (C2ʹ), 109.1 (C5ʹ), 56.0 [(OCH3)2], 52.7
4-(3,4-Диметоксифенил)-6-оксо-5-циа-
(OCH3). Масс-спектр, m/z (Iотн, %): 314 (100) [M]+.
но-1,6-дигидропиридин-2-карбоновая кисло-
Найдено, %: C 61.45; H 4.74; N 8.60. C16H14N2О5.
та (4б). Выход 61%, т. пл. 220-222°C (EtOH). ИК
Вычислено, %: C 61.14; H 4.49; N 8.91.
спектр, ν, см-1: 3389 ш (NH), 3314 ш (ОH), 2223 с
Метил-4-(4-бромфенил)-6-оксо-5-циано-
(C≡N), 1736, 1714 ш (C=O), 1660, 1600, 1571, ср
1,6-дигидропиридин-2-карбоксилат (3в). Выход
(C=С). Спектр ЯМР 1H, δ, м. д.: 13.02 (1Н, ОН),
75%, т. пл. 223-225°C (EtOH). ИК спектр, ν, см-1:
7.51 с (1Н, СН), 7.48 с (1Н, СН), 7.10 д (1Н, СН, JHH
3428 ш (NH), 2224 с (C≡N), 1716 ш (C=O), 1648,
4.8 Гц), 7.08 д (1Н, СН, JHH 4.8 Гц), 6.76 (1H, NH),
1603, 1559 ср (C=С). Спектр ЯМР 1H, δ, м. д.: 7.94
3.85 с (3Н, ОСН3), 3.83 с (3Н, ОСН3). Спектр ЯМР
д (2Н, СН, JHH 8.9 Гц), 7.77 д (2Н, СН, JHH 8.9 Гц),
13C, δC, м. д.: 166.7 (C4), 163.5 (COO), 161.9 (C6O),
7.51 с (1Н, СН), 6.93 с (1Н, NH), 3.96 с (3Н, ОСН3).
148.9 (C3ʹ), 146.6 (C4ʹ), 127.2 (C1ʹ), 123.3 (C6ʹ), 121.3
Спектр ЯМР 13C, δC, м. д.: 164.4 (C4), 158.4 (COO),
(C2), 114.9 (CN), 111.8 (C5), 111.4 (C3ʹ), 110.6 (C2ʹ),
150.7 (C6O), 135.1 (C1ʹ), 132.6 (C3ʹ, C5ʹ), 128.6 (C2ʹ,
110.0 (C5ʹ), 55.8 [(OCH3)2]. Масс-спектр, m/z (Iотн,
C6ʹ), 126.9 (C4ʹ), 118.2 (C2), 113.4 (CN), 112.7 (C5),
%): 300 (100) [M]+. Найдено, %: C 60.22; H 4.38; N
101.4 (C3), 54.0 (OCH3). Масс-спектр, m/z (Iотн, %):
9.01. C15H12N2О5. Вычислено, %: C 60.00 H 4.03;
332 (100) [M]+. Найдено, %: C 50.26; H 2.48; N
N 9.33.
8.32. C14H9BrN2О3. Вычислено, %: C 50.48; H 2.72;
N 8.41.
4-(4-Бромфенил)-6-оксо-5-циано-1,6-диги-
дропиридин-2-карбоновая кислота (4в). Выход
Метил-6-оксо-4-(п-толил)-5-циано-1,6-ди-
68%, т. пл. 248-250°C (EtOH). ИК спектр, ν, см-1:
гидропиридин-2-карбоксилат (3г). Выход 67%,
3412 ш (NH), 3295 ш (ОH), 2226 с (C≡N), 1720 ш
т. пл. 210-212°C (EtOH). ИК спектр, ν, см-1: 3431
(C=O), 1663, 1638, 1603, ср (C=С). Спектр ЯМР 1H,
ш (NH), 2226 с (C≡N), 1736 ш (C=O), 1651, 1609,
1533 ср (C=С). Спектр ЯМР 1H, δ, м. д.: 7.92 д (2Н,
δ, м. д.: 13.22 (1Н, ОН), 7.83 д (2Н, СН, JHH 8.9
СН, JHH 8.1 Гц), 7.44 с (1Н, СН), 7.39 д (2Н, СН,
Гц), 7.72 д (2Н, СН, JHH 8.9 Гц), 7.22 с (1Н, СH),
JHH 8.1 Гц), 6.90 с (1Н, NH), 3.95 с (3Н, ОСН3),
6.74 с (1H, NH). Спектр ЯМР 13C, δC, м. д.: 163.2
2.39 с (3Н, СН3). Спектр ЯМР 13C, δC, м. д.: 162.2
(C4), 163.0 (COO), 162.8 (C6O), 132.6 (C4ʹ), 132.1
(C4), 158.7 (COO), 150.9 (C6O), 136.5 (C4ʹ), 130.2
(C3ʹ, C5ʹ), 130.3 (C1ʹ), 129.7 (C2ʹ, C6ʹ), 129.1 (C2),
(C2ʹ, C6ʹ), 128.5 (C1ʹ), 126.8 (C3ʹ, C5ʹ), 118.3 (C2),
125.3 (C3), 114.6 (CN, C5). Масс-спектр, m/z (Iотн,
115.6 (C5), 113.6 (CN), 100.5 (C3), 53.2 (OCH3), 21.3
%): 319 (100) [M]+. Найдено, %: C 49.12; H 2.44; N
(CH3). Масс-спектр, m/z (Iотн, %): 268 (100) [M]+.
8.45. C13H7BrN2О3. Вычислено, %: C 48.93; H 2.21;
Найдено, %: C 67.34; H 4.82; N 10.31. C15H12N2О3.
N 8.78.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
СИНТЕЗ 4-АРИЛ-6-ОКСО-5-ЦИАНО-1,6-ДИГИДРОПИРИДИН-2-КАРБОНОВЫХ КИСЛОТ
819
6-Оксо-4-(п-толил)-5-циано-1,6-дигидропи-
Chem. 2010. Vol. 45. N 11. P. 4928. doi 10.1016/j.
ридин-2-карбоновая кислота (4г). Выход 70%, т.
ejmech.2010.08.001
6.
Dorigo P., Gaion R. M., Belluco P., Fraccarollo D.,
пл. 217-219°C (EtOH). ИК спектр, ν, см-1: 3410 ш
Maragno I., Bombieri G., Benetollo F., Mosti L.,
(NH), 3304 c (OH), 2216 с (C≡N), 1720 ш (C=O),
Orsini F. // J. Med. Chem. 1993. Vol. 36. N 17. P. 2475.
1666, 1644, 1603, ср (C=С). Спектр ЯМР 1H, δ,
doi 10.1021/jm00069a005
м. д.: 13.01 (1Н, ОН), 7.74 д (2Н, СН, JHH 8.1 Гц),
7.
De Candia M., Fossa P., Cellamare S., Mosti L., Carotti A.,
7.32 д (2Н, СН, JHH 8.1 Гц), 7.04 с (1Н, СH), 6.81
Altomare C. // Eur. J. Pharm. Sci. 2005. Vol. 26. N 1.
c (1H, NH), 2.36 с (3Н, СН3). Спектр ЯМР 13C, δC,
P. 78. doi 10.1016/j.ejps.2005.05.001
м. д.: 162.9 (C4), 162.3 (COO), 153.7 (C6O), 146.9
8.
Bekhit A.A., Baraka A.M. // Eur. J. Med. Chem.
(C4ʹ), 141.8 (C1ʹ), 129.7 (C2ʹ, C6ʹ), 129.5 (C2), 127.6
2005. Vol. 40. N. 12. P. 1405. doi 10.1016/j.
(C3ʹ, C5ʹ), 114.7 (CN), 104.7 (C3, C5), 21.0 (CH3).
ejmech.2005.06.005
Масс-спектр, m/z (Iотн, %): 254 (100) [M]+. Найде-
9.
Li X., Liang X., Song T., Su P., Zhang Z. // Bioorg. Med.
но, %: C 66.50; H 4.12; N 10.86. C14H10N2О3. Вы-
Chem. 2014. Vol. 22. N 21. P. 5738. doi 10.1016/j.
bmc.2014.09.047
числено, %: C 66.14; H 3.96; N 11.02.
10.
Drygin D., Haddach M., Pierre F., Ryckman D.M. // J.
Контроль за ходом реакции и чистотой син-
Med. Chem. 2012. Vol. 55. N 19. P. 8199. doi 10.1021/
тезированных соединений осуществляли мето-
jm3009234
дом тонкослойной хроматографии на пластинках
11.
Hasvold L.A., Wang W., Gwaltney S.L., Rockway T.W.,
Sorbfil (элюент - этилацетат, проявление в УФ све-
Nelson L.T. J., Mantei R.A., Fakhoury S.A., Sullivan G.M.,
те, парами иода или термическим разложением).
Li Q., Lin N.-H., Wang L., Zhang H., Cohen J.,
Температуры плавления определены на приборе
Gu W.-Z., Marsh K., Bauch J., Rosenberg S., Sham H.L. //
Optimelt MPA100. ИК спектры зарегистрирова-
Bioorg. Med. Chem. Lett. 2003. Vol. 13. N 22. P. 4001.
doi 10.1016/j.bmcl.2003.08.058
ны на Фурье-спектрометре ФСМ-1202 в тонком
12.
Krawczyk S., Otto M., Otto A., Coburger C., Krug M.,
слое (суспензия в вазелиновом масле). Спектры
Seifert M., Tell V., Molnár J., Hilgeroth A. // Bioorg.
ЯМР 1Н и 13С зарегистрированы на спектрометре
Med. Chem. 2011. Vol. 19. N 21. P. 6309. doi 10.1016/j.
Bruker DRX-500 (500 и 125 МГц соответственно) в
bmc.2011.09.005
ДМСО-d6, внутренний стандарт - ТМС. Масс-спек-
13.
El-Naggar M.H., Abdel Bar F.M., Choudhary H.,
тры записаны на приборе Bruker Ultraflex MALDI-
Javadi M., Shimizu K., Kunnumakkara A.B.,
TOF. Элементный анализ выполнен на CHN-ана-
Badria F.A. // Nat. Prod. Res. 2019. P. 1. doi
лизаторе varioMicrocube.
10.1080/14786419.2019.1663513
14.
Pham N.K.T., Tran T.T.L., Duong T.H., Trung N.T.,
КОНФЛИКТ ИНТЕРЕСОВ
Phan D.C.T., Mai D.T., Nguyen V.K., Huynh B.L.C.,
Авторы заявляют об отсутствии конфликта
Nguyen T.A.T., Tran T.D., Tran T.N.M., Nguyen T.P. //
интересов.
Nat. Prod. Res.
2020. P.
1. doi
10.1080/
14786419.2020.1839456
СПИСОК ЛИТЕРАТУРЫ
15.
Rashad A.E., Shamroukh A.H., El-Hashash M.A., El-
1. Koster G., Bekema H.J., Wetterslev J., Gluud C., Keus F.,
Farargy A.F., Yousif N.M., Salama M.A., Mostafa A.,
van der Horst I.C.C. // Intensive Care Med. 2016.
El-Shahata M. // J. Heterocycl. Chem. 2012. Vol. 49.
Vol. 42. N 9. P. 1322. doi 10.1007/s00134-016-4449-6
N. 5. P. 1130. doi 10.1002/jhet.966
2. Yukiiri M., Ueda N., Aoyama K. // J. Cardiovasc.
16.
Ulloora S., Shabaraya R., Aamir S., Adhikari A.V. //
Pharmacol. 2001. Vol. 37. N 4. P. 375. doi
Bioorg. Med. Chem. Lett. 2013. Vol. 23. N 5. P. 1502.
10.1159/000072563
doi 10.1016/j.bmcl.2012.12.035
3. Adachi H., Kamata S., Kodama K., Nagakura T. // Eur.
17.
Kick E., Martin R., Xie Y., Flatt B., Schweiger E.,
J. Pharmacol. 2000. Vol. 396. N 1. P. 43. doi 10.1016/
Wang T.-L., Busch B., Nyman M., Gu X.-H., Yan G.,
s0014-2999(00)00190-4
Wagner B., Nanao M., Nguyen L., Stout T., Plonowski A.,
4. Kieback A.G., Baumann G. // Cardiovasc. Drug
Schulman I., Ostrowski J., Kirchgessner T., Wexler R.,
Rev. 2006. Vol. 17. N 4. P. 374. doi 10.1111/j.1527-
Mohan R. // Bioorg. Med. Chem. Lett. 2015. Vol. 25.
3466.1999.tb00026.x
N 2. P. 372. doi 10.1016/j.bmcl.2014.11.029
5. Pietrangelo T., Giampietro L., De Filippis B., La
18.
Bayne C.D., Johnson A.T., Lu S.-P., Mohan R.,
Rovere R., Fulle S., Amoroso R. // Eur. J. Med.
Griffith R.C. Pat. WO 2003/59884 A1 (2003).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021
820
МАРЬЯСОВ и др.
Synthesis of 4-Aryl-6-oxo-5-cyano-1,6-dihydropyridine-
2-carboxylic Acids and Their Methyl Esters By Reacting Methyl
Acylpyruvates with Malononitrile and Cyanoacetamide
M. A. Maryasov*, N. P. Romashov, V. V. Davydova, O. E. Nasakin, and M. P. Osipova
Ulyanov Chuvash State University, Cheboksary, 428015 Russia
*e-mail: marsikprovisor@mail.ru
Received April 2, 2021; revised April 2, 2021; accepted April 10, 2021
A series of new methyl 4-aryl-6-oxo-5-cyano-1,6-dihydropyridine-2-carboxylates and 4-aryl-6-oxo-5-cyano-
1,6-dihydropyridine -2-carboxylic acids were synthesized by reacting methyl esters of acylpyruvic acids with
malononitrile and cyanoacetamide, respectively.
Keywords: pyrid-2-one-3-carbonitriles, malononitrile, cyanoacetamide, acylpyruvic acids, pyridine-2-car-
boxylic acids
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 5 2021