ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 823-840
УДК 547.461.3:547.491.4:547.825:547.818.1
О ВЗАИМОДЕЙСТВИИ ДИМЕРА МАЛОНОНИТРИЛА
С ИЗОТИОЦИАНАТАМИ
© 2021 г. В. В. Доценкоa,b,*, А. В. Беспаловa, А. А. Русскихa, В. К. Киндопa, Н. А. Аксеновb,
И. В. Аксеноваb, С. В. Щербаковb, С. Н. Овчаровb
a Кубанский государственный университет, ул. Ставропольская 149, Краснодар, 350040 Россия
b Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
*е-mail: victor_dotsenko_@mail.ru
Поступило в Редакцию 19 апреля 2021 г.
После доработки 19 апреля 2021 г.
Принято к печати 6 мая 2021 г.
В зависимости от условий реакция 2-амино-1,1,3-трицианопропена (димера малононитрила) с изотио-
цианатами приводит к 1-замещенным 4,6-диамино-2-тиоксо-1,2-дигидропиридин-3,5-дикарбонитрилам
либо к 4,6-диамино-2-(фенилимино)-2H-тиопиран-3,5-дикарбонитрилу. Проведено квантово-химическое
моделирование ИК спектров и реакционных маршрутов для полученных соединений. Проведен предик-
торный анализ in silico потенциальных протеиновых мишеней, соответствия критериям биодоступности
и параметров ADMET.
Ключевые слова: 2-амино-1,1,3-трицианопропен, изотиоцианаты, гетероциклизация, 2Н-тиопираны,
2-тиоксопиридины, квантово-химические расчеты
DOI: 10.31857/S0044460X21060019
2-Амино-1,1,3-трицианопропен
1, легко по-
[5, 9], не позволяют однозначно приписать продук-
лучаемый димеризацией малононитрила [1], яв-
там этих реакций строение соединений 2 либо 4.
ляется полифункциональным реагентом, широко
Продолжая исследования в области химии ди-
используемым в синтетической органической хи-
мера малононитрила [10-12], мы решили детально
мии. Реакции гетероциклизации с использовани-
изучить регионаправленность гетероциклизации
ем димера малононитрила 1 известны с середины
2-амино-1,1,3-трицианопропена 1 с изотиоциана-
ХХ века и достаточно хорошо изучены (обзорные
тами и установить реальное строение образую-
работы см. [2-4]). Тем не менее, в литературе
щихся соединений. Возможные продукты 2 пер-
встречаются противоречивые сведения о регио-
спективны как исходные реагенты для получения
направленности реакций димера малононитрила
производных тиено[2,3-b]пиридина, многие из
1 с изотиоцианатами. Так, в работе [5] описано
которых обладают фармакологическим действием
взаимодействие димера 1 с фенилизотиоцианатом
[13-16]. С другой стороны, соединения 2-4 явля-
в присутствии основания в ДМФА, приводящее к
ются удобными и доступными субстратами для
замещенному пиридину 2. Строение последнего
получения S,N-полигетероциклических ансам-
подтверждается также результатами превращений
блей в условиях реакции Манниха (см., например,
в условиях S-алкилирования, например, в тиено-
[17-21]).
пиридины 3 [6-8] (схема 1). В то же время, ана-
логичная реакция 1 с PhNCS в кипящем пиридине
При воспроизведении методики из работы [5] с
приводит, согласно данным работы [9], к замещен-
выходом 74% был получен продукт, действительно
ному пиримидину 4. Вместе с тем следует указать,
имеющий (по данным ИК и ЯМР спектроскопии)
что спектральные данные, приведенные в работах
строение 4,6-диамино-2-тиоксо-1-фенил-1,2-диги-
823
824
ДОЦЕНКО и др.
Схема 1.
NH2
NH2
H2N
NC
CN
ДМФА, Et3N
CN
∆, 2 ч
HlgCH2EWG
Ph
EWG
[5]
S
N
NH2
N C
S
S
N NH
Ph
+
Ph
2
NH2
CN
3
NC
H
S
N
CN
NC CN
Py, ∆, 2 ч
N
1
Ph
[9]
NH2
4
дропиридин-3,5-дикарбонитрила 2 (табл. 1, оп. № 1;
оп. № 7), однако образующийся продукт требует
схема 2). Дальнейшими исследованиями было
дополнительной очистки. Соединение 2 представ-
установлено, что реакция PhNCS с димером 1, в
ляет собой желтый порошок, не растворимый в
принципе, не требует жестких условий, подоб-
воде и EtOH, умеренно растворимый в ацетоне или
ных тем, что приведены в работе [5]. Так, пи-
смеси AcOH-ДМФА при нагревании. Соединение
ридин 2 был получен с выходами 84-92% при
5 представляет собой бесцветные кристаллы, рас-
взаимодействии 1 с фенилизотиоцианатом при
творимые в ацетоне и горячем EtOH. Результаты
комнатной температуре в EtOH в присутствии Et3N
всех экспериментов суммированы в табл. 1.
(табл. 1, оп. № 2). Аналогичное превращение с уча-
Воспроизведение описанного в работе [9] спо-
стием аллилизотиоцианата дает 1-аллил-4,6-ди-
соба получения пиримидина 4 дало неоднознач-
амино-2-тиоксо-1,2-дигидропиридин-3,5-дикар-
ные результаты. Так или иначе, нам не удалось
бонитрил 5 с выходами 58-73% (табл. 1, оп. № 6;
получить ни соединение 4, ни вообще продукт с
схема 2). Использование более сильных основа-
заявленными в работе [9] физико-химическими
ний не показало явных преимуществ: так, реак-
или спектральными характеристиками. Было уста-
ция димера 1 с аллилизотиоцианатом в сверхос-
новлено, что направление реакции существенно
новной среде (KОН в ДМСО) также приводит к
зависит от условий синтеза. Так, при выдержи-
выделению соединения 5 с выходом 71% (табл. 1,
вании смеси реагентов в пиридине при комнат-
Таблица 1. Условия, выходы и строение продуктов реакции димера малононитрила 1 с изотиоцианатами
Продукт реакции
№ опыта
Реагенты
Условия
(выход, %)
1
1, PhNCS
ДМФА, Et3N (кат.), кипячение 2 ч [5]
2 (74%)
2
1, PhNCS
EtOH, Et3N (1-1.5 экв.), 25°С
2 (84-92%)
3
1, PhNCS
Пиридин, 24 ч 25°С → кипячение 2 ч
6 (8%)
4
1, PhNCS
Пиридин, кипячение 2 ч [9]
2 (48%)
5
1, H2C=CHCH2NCS
EtOH, Et3N (кат.), 25°С
Реакция не идет
6
1, H2C=CHCH2NCS
EtOH, Et3N (1-1.5 экв.), 25°С
5 (58-73%)
7
1, H2C=CHCH2NCS
ДМСО, KОН (1 экв.), 25°С
5 (71%)
8
8, H2C=CHCH2NCS
EtOH, 25 °C
5 (27%)
9
8, PhNCS
EtOH, 25 °C
6 (82%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
825
Схема 2.
NH2
1) пиридин
NC
CN
25°C (24 ч),
затем кипячение 2ч
2) лед, разб. HCl
N
S
NH2
R
N C
S
R
NH2
6 R = Ph, 8%
NC
CN
+
EtOH, Et3N
NH2
25°C, 24 ч
NC
NH2
S
N
NH2
NC
CN
NC CN
R
1) Py, ∆, 2 ч
2) лед, разб. HCl
1
2 (84-92%), 5 (58-73%)
S
N
NH2
R
2 (48%)
NH2
NH2
K
NC
CN
NC
CN
NH2
Ph-N=C=S
CH2=CHCH2NCS
NC
EtOH, 25°C, 24 ч
EtOH, 72 ч, 25°C
S
N
NH2
82%
N
S
NH2
27%
NC
CN
Ph
5
8
6
R = Ph (2, 6), аллил (5).
ной температуре с последующим кипячением с
лосы поглощения, соответствующие валентным
низким выходом (8%) было выделено вещество
колебаниям N-H (3323, 3207 см-1), сопряженной
бежевого цвета с т. пл. > 300°C, не растворимое в
цианогруппы (2197 см-1). Однако полученное со-
кипящем EtOH. Детальный анализ спектральных
единение не удалось охарактеризовать методами
данных показал, что продукт не является пири-
ЯМР 1Н и 13С ввиду низкой растворимости в орга-
мидином 4 - ему соответствует строение 4,6-ди-
нических растворителях, включая ДМСО.
амино-2-(фенилимино)-2H-тиопиран-3,5-дикар-
Калиевая соль димера малононитрила 8 в ре-
бонитрила 6 (схема 2, табл. 1, оп. № 3). В то же
акциях с изотиоцианатами дает иные результаты,
время, реакция димера малононитрила 1 с PhNCS,
нежели димер малононитрила 1. Так, с аллилизо-
проводимая изначально в кипящем пиридине, дает
тиоцианатом соль 8 дает тот же 1-аллил-4,6-диа-
желто-оранжевый продукт (т. разл. > 300°С после
мино-2-тиоксо-1,2-дигидропиридин-3,5-дикар-
очистки, вместо заявленных зеленых кристаллов с
бонитрил 5, но с заметно более низким выходом
т. пл. 225°С [9]), который, по данным ИК и ЯМР
(27%) (схема 2, табл. 1, оп. № 8). В то же время, при
спектроскопии, представляет собой загрязненный
взаимодействии соли 8 с PhN=C=S в аналогичных
4,6-диамино-2-тиоксо-1-фенил-1,2-дигидропири-
условиях с выходом 82% был получен тиопиран 6
дин-3,5-дикарбонитрил 2 (табл. 1, оп. № 4).
(табл. 1, оп. № 9). Следует отметить, что тиопиран
Реакция димера 1 с аллилизотиоцианатом в
6 не удалось рециклизовать в 2-тиоксопиридин 2
даже при длительном кипячении в спиртовом рас-
кипящем пиридине привела к образованию про-
дукта оранжевого цвета (выход 37-47% в расче-
творе KOH.
те на предполагаемый аддукт состава 1:1). В ИК
Тиопиран 6 до настоящего времени не был опи-
спектрах полученного соединения имеются по-
сан в литературе, однако образование 2Н-тиопи-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
826
ДОЦЕНКО и др.
Схема 3.
Ph
PhNCS, Bu4NBr
N
S
O
K2CO3, PhH
+
+
[22]
S
N
N
NC
NC
Ph
NC
Ph
NC CN
NH2
NH2
NH2
20%
35%
33%
PhNH2, Et3N
NC
EtOH
H2C(CN)2, PhH
NC
N
[23]
[24]
H2N
S
SCH3
Ph
O
H
S
N
2N
S
NHPh
MeSO
4
NH2
NH2
CS2, NH3
CS2, NH3
NC
NC
CN
H2O, 20oC
H2O, 20oC
1
NC CN
93%
62%
NC CN
S
S
NH
[25]
[25]
2
ранов близкого строения ранее наблюдалось в ре-
единений 2 и 6 демонстрируют различия в области
акциях циклогексилиденмалононитрила с PhNCS
слабых полей: в первом случае наблюдаются сиг-
[22], при аммонолизе солей тиопирилия [23], в
налы пиридинового цикла при 155.6 и 155.9 м. д.
условиях конденсации малононитрила с енамина-
(С4, С6) и сигнал при 181.0 м. д., указывающий
ми β-кетотиоанилидов [24], при взаимодействии
на наличие фрагмента тиокарбонильной функции
малононитрила или его димера с сероуглеродом в
С2=S, в случае тиопирана 6 наблюдаются сигналы
присутствии щелочи [25] (схема 3).
при 156.7 (С6), 159.3 (С4) и 160.4 (С2) м. д.
Строение 2-тиоксопиридинов 2, 5 и 2-имино-
ИК спектры соединений 2, 5, 6 содержат поло-
тиопирана 6 детально изучено методами ИК, ЯМР
сы валентных колебаний связей N-H и сопряжен-
спектроскопии (1H, 13C DEPTQ, 1H-13C HSQC,
ных С≡N групп (2204-2212 см-1). В то же время,
1H-13C HMBC). Спектры соединений представле-
в спектрах тионов 2, 5 обнаруживаются полосы,
ны в Дополнительных материалах.
соответствующие колебаниям связи С=S (интен-
сивные полосы поглощений при 1344-1348 см-1
В спектрах ЯМР 1Н соединений 2, 5, 6 присут-
ствуют сигналы заместителя R и уширенные пики
и полосы средней интенсивности в области 1180-
1190 см-1).
двух аминогрупп. В спектрах ЯМР 13С DEPTQ всех
соединений обнаруживаются сигналы углеродов
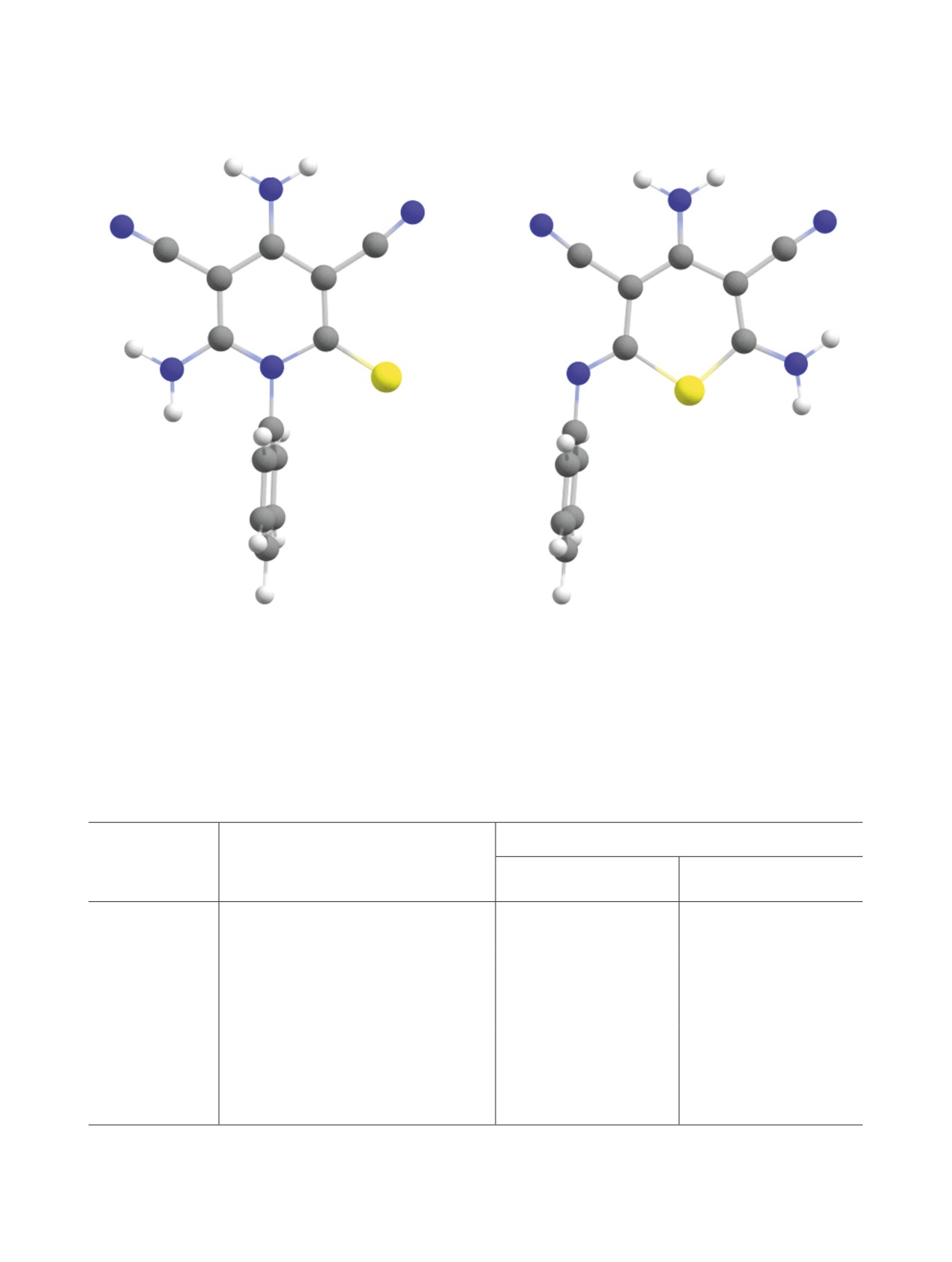
Квантово-химические исследования. До-
двух C≡N и 5 характерных сигналов гетероколь-
полнительное подтверждение строения соедине-
ца. Строение также подтверждаются результатами
ний 2, 5, 6 было получено с привлечением кван-
экспериментов по гетероядерной корреляции. Так,
тово-химических расчетов спектральных частот.
в спектрах 1H-13C HMBC всех трех соединений
Так, расчеты молекулярной геометрии (рис. 1) и
наблюдаются кросс-пики между протонами од-
ИК спектров в программном пакете ORCA 4.2 [26,
ной из аминогрупп и двумя сигналами углеродов
27] с использованием гибридного функционала
гетерокольца в области сильных полей (С3 и С5),
B3LYP [28, 29] с дисперсионной поправкой D3BJ
что однозначно подтверждает наличие фрагмента
[30, 31] в валентно-расщепленном базисном набо-
N≡C-C3=C4(NH2)-C5-C≡N (см. Дополнительные
ре 6-311+G(2d,p) показали хорошую сходимость с
материалы). В то же время, спектры изомерных со-
экспериментальными спектрами (табл. 2, 3). Срав-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
827
N15
N12
N18
N19
N14
C6
C16
C14
C7
C11
N13
C5
C1
C5
C1
C6
C2
C4
N13
N3
S17
N9
4
C
N8
C2
S3
C10
C7
C8
C12
C19
C15
C9
C11
C18
C16
C17
C10
2
6
Рис. 1. Оптимизированные структуры продуктов циклизации [расчет на уровне B3LYP-D3BJ/6-311+G(2d,p)].
нение рассчитанных частот с экспериментальны-
(<1000 см-1)] [32]. Для генерации Input-файлов
ми осуществляли с учетом поправочных коэффи-
применяли программу Gabedit 2.5 [33]. Для визуа-
циентов [0.9679 для высокочастотных (>1000 см-1)
лизации молекулярной геометрии и рассчитанных
и
1.0100
для низкочастотных колебаний
ИК спектров использовали программу ChemCraft 1.8.
Таблица 2. Сравнение основных полос поглощения в экспериментальных и расчетных ИК спектрах 4,6-диами-
но-2-тиоксо-1-фенил-1,2-дигидропиридин-3,5-дикарбонитрила 2
Расчетные полосы поглощения, см-1
Полосы поглощения в
Отнесение
экспериментальных спектрах, см-1
без поправочного
с поправочным
коэффициента
коэффициентом
νas(N-H)
3336.4, 3301.7
3705.4, 3693.3
3586.5, 3574.7
νs(N-H)
3211.1
3583.0, 3569.6
3468.0, 3455.0
ν(C≡N)
2206.3
2297.7, 2283.3
2223.9, 2210.0
δ(NH2)
1635.4
1659.1, 1646.0
1605.9, 1593.2
ν(C=C) скелетные
1564.1, 1523.6, 1485.0
1585.1, 1532.5, 1527.1
1534.2, 1483.3, 1478.1
ν(C-N)
1454.1
1483.6
1436.0
ν(C=S)
1348.1
1366.7
1322.8
Cкелетные
1222.7, 1180.3
1234.3, 1178.2
1194.7, 1140.4
ν(C=S)
1029.9
1052.2
1018.5
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
828
ДОЦЕНКО и др.
Таблица 3. Сравнение основных полос поглощения в экспериментальных и расчетных ИК спектрах 4,6-диами-
но-2-(фенилимино)-2H-тиопиран-3,5-дикарбонитрила 6
Расчетные полосы поглощения, см-1
Полосы поглощения в
Отнесение
экспериментальных спектрах, см-1
без поправочного
с поправочным
коэффициента
коэффициентом
νas(N-H)
3351.8, 3326.8
3700.4, 3694.6
3581.6, 3576.0
νs(N-H)
3234.2
3572.3 , 3570.8
3457.7, 3456.1
ν(C≡N)
2212.1
2291.9 , 2281.6
2218.4, 2208.4
ν(C=N)
1643.1
1681.4
1627.4
δ(NH2)
1604.6
1662.0, 1652.9
1608.6, 1599.9
ν(C=C)
1564.7,
1629.3,
1577.0,
Cкелетные
1521.6, 1488.9
1580.7, 1513.0
1529.9, 1464.5
ν(C-N)
1456.1
1448.4
1401.9
Cкелетные
1282.5, 1153.3
1327.1, 1234.4
1284.5, 1194.8
Полученные экспериментальные результаты, в
стояний подтверждалась наличием мнимой коле-
частности, различную регионаправленность гете-
бательной частоты, соответствующей координате
роциклизации фенилизотиоцианата с димером ма-
реакции. Все расчеты проводили с учетом неспец-
лононитрила, мы попытались интерпретировать с
ифической сольватации в рамках модели СРСМ
привлечением расчетных методов. Квантово-хи-
[37].
мическое исследование предполагаемых механиз-
Для сравнения предпочтительности протекания
мов внутримолекулярной циклизации осущест-
двух вариантов реакции циклизации (в 2-тиоксо-
вляли в программном пакете ORCA 4.2 [26, 27].
пиридин 2 или в 2-иминотиопиран 6) было осу-
Поиск переходного состояния, определение реак-
ществлено квантово-химическое моделирование
ционных траекторий, расчет колебательных частот
реакционных траекторий. Очевидным интермеди-
и свободной энергии Гиббса осуществляли в рам-
атом как для пиридина 2, так и для тиопирана 6
ках теории DFT с помощью композитной расчет-
является анион 9, образующийся при нуклеофиль-
ной схемы Гримме B97-3c [34, 35], основанной на
ной атаке карбаниона димера малононитрила на
комбинации GGA функционала B97 и базисного
центральный атом углерода изотиоцианата (схема 4).
набора def2-mTZVP с дисперсионной поправкой
Поскольку реакцию осуществляли в условиях
D3BJ [36]. Найденная геометрия переходных со-
избытка основания - триэтиламина (в этаноле)
Схема 4.
NH2
NC
CN
R
δ+
PhHN S
N C S
N
S
NH2
NH2
NC
Ph
6
NH2
NC
NH2
NC CN
NC
CN
NC CN
9
S
N
NH2
Ph
2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
829
(a)
N8
H45
C6
S12
H22
N13
(б)
(в)
N13
N8
C6
C6
S12
N8
H22
S12
H22
N13
H45
H45
(г)
(д)
C6
C6
N13
N8
N13
H22
S12
N8
H22
H45
S12
H45
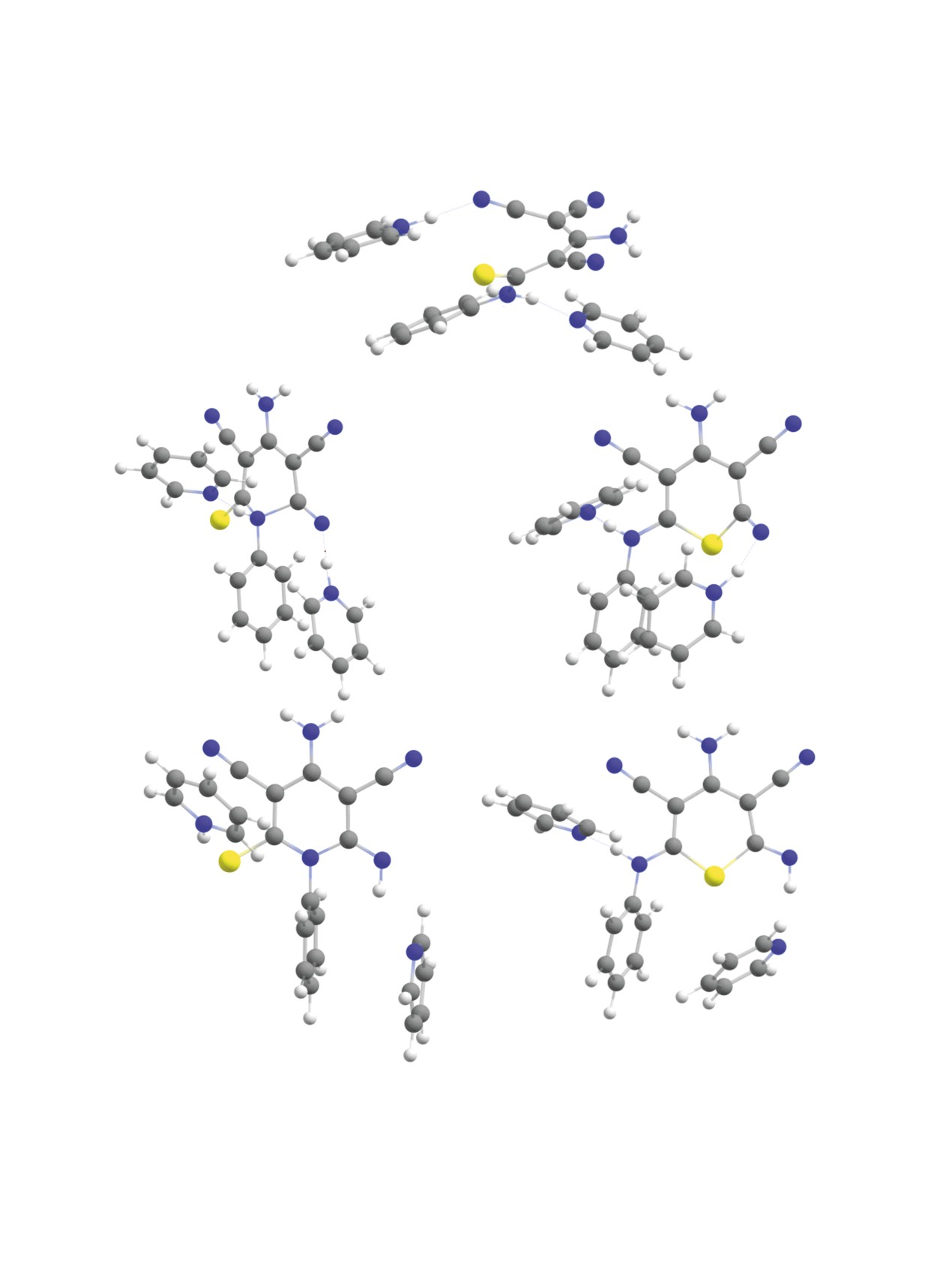
Рис. 2. Молекулярные структуры исходного аниона 9 с двумя молекулами пиридина (a), переходных состояний реакций
циклизации (б, в), а также продуктов циклизации по атому азота N13 (г) и по атому серы S12 (д) (оптимизация геометрии
на уровне B97-3c).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
830
ДОЦЕНКО и др.
либо пиридина, служащего растворителем, - в ка-
увеличивается (-48.2 кДж/моль). Причиной по-
честве исходной структуры рассматривался анион
вышения расчетного значения энергии активации
9 с двумя молекулами основания, одна из которых
этого процесса по сравнению с аналогичным про-
была протонирована и, таким образом, образовы-
цессом в пиридине, по всей видимости, является
вала ионную пару с анионом 9, а вторая была свя-
как взаимное отталкивание двух объемных моле-
зана водородной связью с протоном H22 (рис. 2а).
кул триэтиламина, сближающихся в ходе реакции,
Для определения оптимальной геометрии исход-
так и связанное с этим искажение молекулярной
ного состояния предварительно был осуществлен
структуры реагирующего субстрата. Так, бензоль-
поиск наиболее устойчивой конформации аниона 9.
ное кольцо у атома азота N13 в переходном состоя-
нии располагается практически под прямым углом
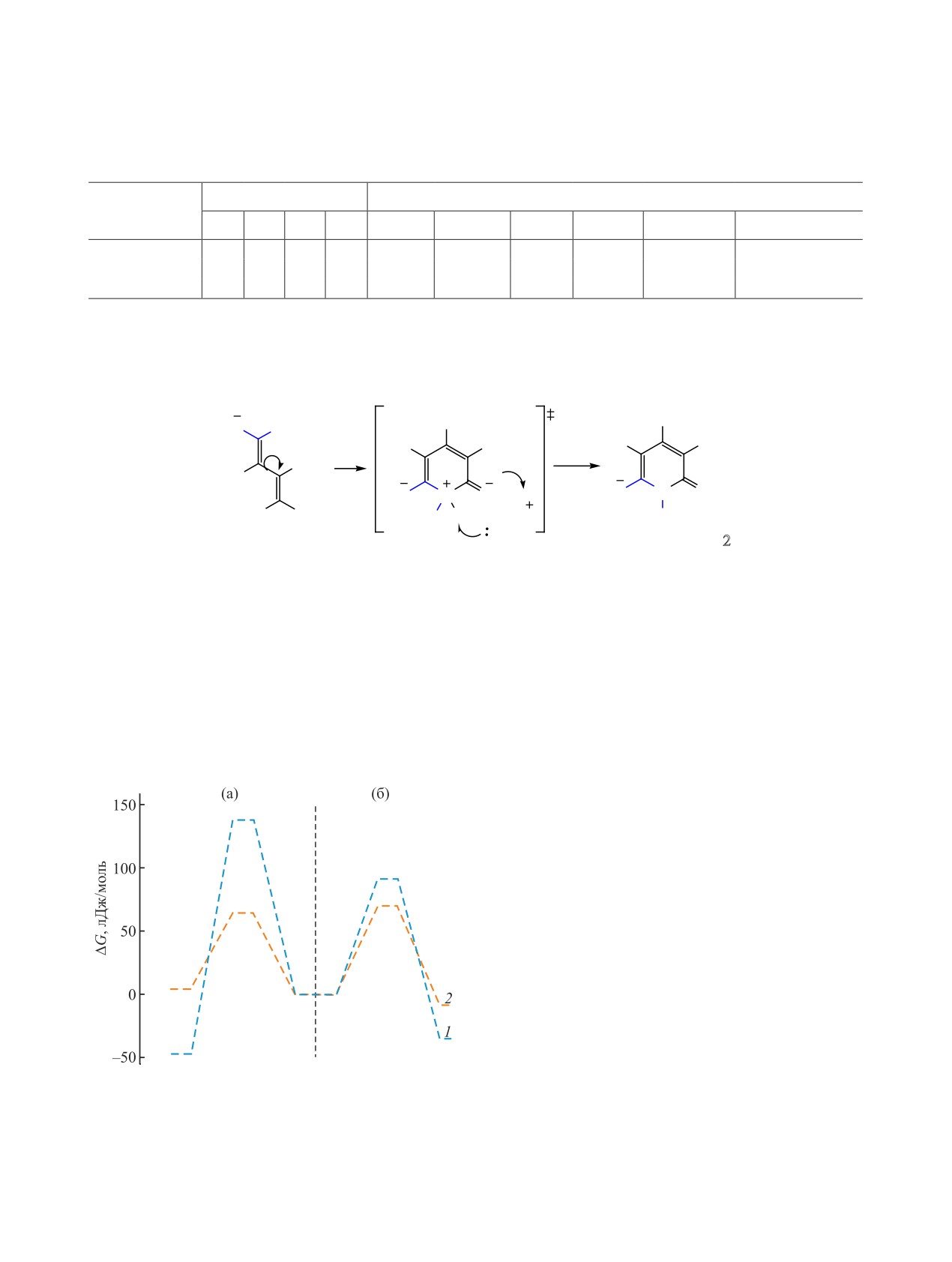
Циклизация, приводящая к образованию 2-ти-
к образующемуся пиридиновому циклу. Цикли-
оксопиридина 2, протекает в результате нуклео-
зация по атому серы, несмотря на некоторое сни-
фильной атаки атома азота N13 на атом углерода
жение активационного барьера до 65.2 кДж/моль,
C6, сопровождающейся переносом протона H45 от
обладает отрицательным тепловым эффектом
молекулы основания к атому азота N8 и депрото-
(+4.5 кДж/моль) и, таким образом, ее протекание
нированием атома азота N13 второй молекулой ос-
в данных условиях маловероятно. Энергетические
нования (триэтиламина или пиридина) (рис. 2б, г).
профили исследуемых циклизаций представлены
Реакция, приводящая к образованию тиопирана
на рис. 4.
6, протекает в результате нуклеофильной атаки
Таким образом, моделирование механизмов
атома серы S12 на атом углерода C6, сопровождаю-
циклизации позволяет сделать заключение, что
щейся переносом протона от молекулы основания
образование 2-иминотиопиранов протекает в ус-
к атому азота N8 (рис. 2в, д). Последующая стадия
ловиях кинетического контроля, тогда как 2-ти-
депротонирования атома азота N13 второй молеку-
оксопиридинов - в условиях термодинамического
лой основания по расчетным данным имеет весь-
контроля. Наблюдаемое образование 2-иминоти-
ма низкую энергию активации и, следовательно,
опирана в среде пиридина (25°С → кипячение)
не является скоростьлимитирующей.
можно объяснить протеканием первоначальным
Молекулярные структуры исходного аниона
(до нагревания, при 25°С) реакции в условиях
9, переходных состояний и конечных продуктов
кинетического контроля и подтвержденной экс-
циклизации представлены на рис. 2 (реакция в
периментально сложностью рециклизации уже
пиридине). В результате проведенных расчетов
образовавшегося 2-иминотиопирана 6 в 2-тиоксо-
было установлено, что циклизация с образовани-
пиридин 2. Различная регионаправленность реак-
ем тиопирана 6 является кинетически контроли-
ции PhNCS с димером малононитрила (Et3N, EtOH,
руемой реакцией. Энергия активации составляет
25°C) и с калиевой солью димера (EtOH, 25°C)
70.2 кДж/моль, в то время как тепловой эф-
может быть объяснена специфической ролью ос-
фект данного процесса невелик и составляет
нования-катализатора. Для успешного образова-
-9.1 кДж/моль. Энергия активации циклизации,
ния 2-тиоксопиридина 2 необходимо участие двух
приводящей к образованию
2-тиоксопиридина
молекул основания - при образовании малоустой-
2, составляет 91.5 кДж/моль, а тепловой эффект
чивого многозарядного переходного состояния 10
существенно выше, чем в предыдущем случае
(схема 5) требуется одновременное депротониро-
(-36.6 кДж/моль). Таким образом, в условиях тер-
вание эндоциклического атома азота свободным
модинамического контроля основным продуктом
основанием, и протонирование экзоциклического
реакции должен быть 2-тиоксопиридин 2.
отрицательно заряженного атома азота катионом
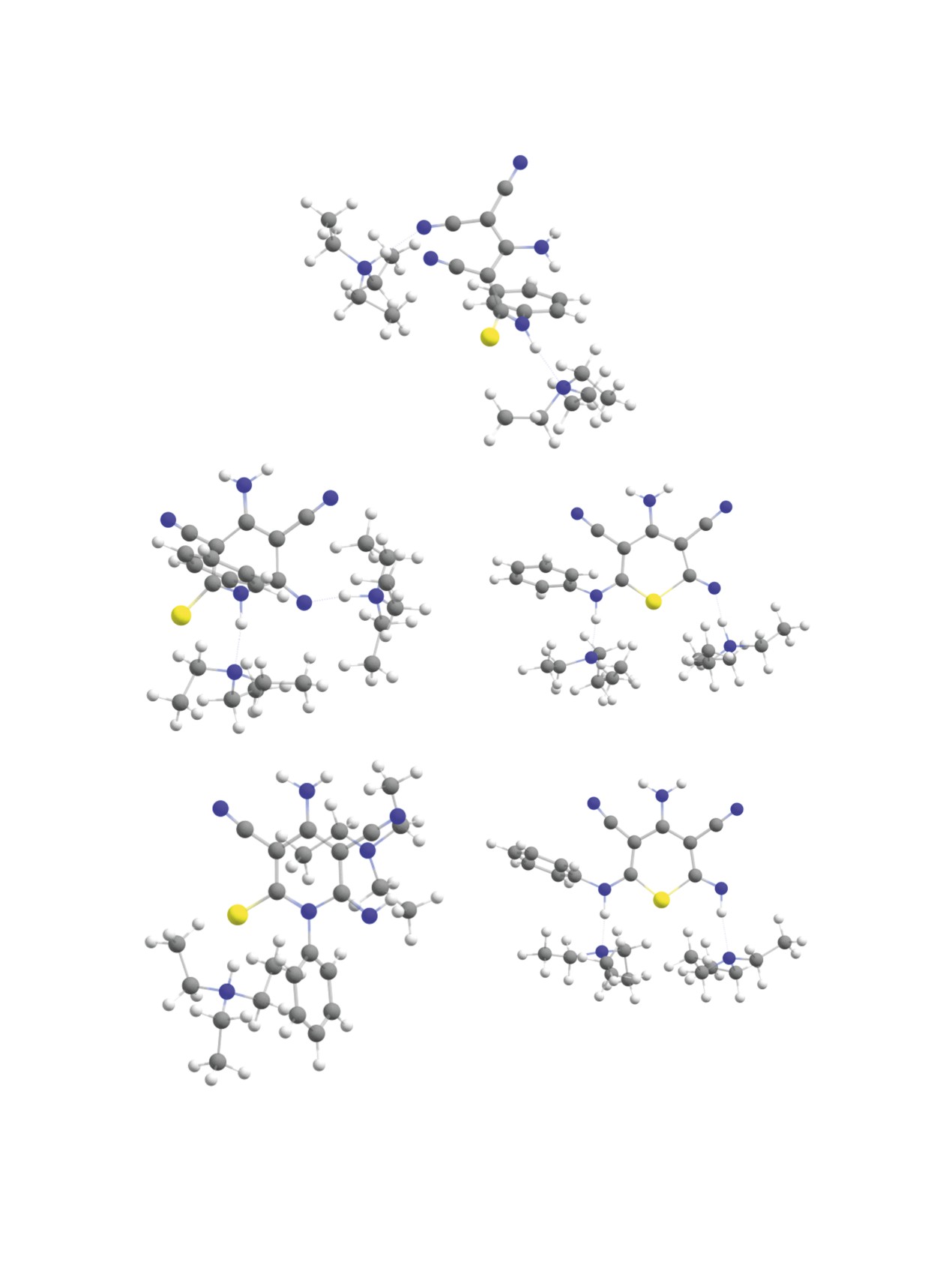
Моделирование аналогичных процессов в сре-
пиридиния (триэтиламмония).
де этанола (молекулярные структуры представле-
Однако такое основание и его протонирован-
ны на рис. 3) с триэтиламином в качестве основа-
ная форма отсутствуют в реакционной среде при
ния показало, что энергия активации циклизации
использовании соли димера малононитрила
8.
по атому азота повышается до 138.2 кДж/моль,
Присутствующие в реакционной массе вода или
вместе с этим тепловой эффект реакции так же
этанол не являются столь же эффективными до-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
831
(а)
C6
N8
H40
N13
H22
S12
(б)
(в)
C6
C6
N8
N8
S12
N13
N13
H40
S12
H22
H40
H22
(г)
(д)
C6
N13
N8
S12
C6
H40
S12
N13
H22
H40
N8
H22
Рис. 3. Молекулярные структуры исходного аниона 9 с двумя молекулами триэтиламина (a), переходных состояний реакций
циклизации (б, в), а также продуктов циклизации по атому азота N13 (г) и по атому серы S12 (д) (оптимизация геометрии
на уровне B97-3c).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
832
ДОЦЕНКО и др.
Таблица 4. Риски токсичности и физико-химические параметры соединений 2, 5, 6, спрогнозированные с помощью
OSIRIS Property Explorer
Риск токсичностиа
Физико-химические параметры
Соединение
А
В
С
D
сLogP
logS
MW
TPSA
drug likeness
drug score
2
-
-
-
-
-0.13
-5.14
267
134.9
-2.83
0.37
5
-
-
-
-
-0.95
-3.81
231
134.9
-4.92
0.44
6
-
-
-
-
-0.23
-2.79
267
137.2
-3.35
0.48
а Знаком «-» обозначено прогнозируемое отсутствие токсичности. A - Мутагенность, B - канцерогенность, С - раздражающее
действие, D - репродуктивные эффекты.
Схема 5.
NH2
NH2
S
NHPh
NC
CN
NC
CN
NH2
NC
S
N
N
S
N
NH
NC CN
BH
Ph H
Ph
9
B
анион молекулы 2
норами/акцепторами протонов, как используемые
требует более тщательного дальнейшего изучения,
основания и сопряженные им кислоты, поэтому в
что составит предмет дальнейших исследований.
данном случае реакция протекает исключительно
Исследования биологической активности
по пути образования кинетического продукта 6.
in silico.
6-Амино-2-тиоксопиридин-3,5-дикар-
По нашему мнению, отличающиеся результаты
бонитрилы и их производные обладают широкой
в случае аллилизотиоцианата могут быть связаны
гаммой биологической активности (см. обзоры
с более легко протекающей рециклизацией 2-ими-
[38-42], а также недавние работы [43-48]), что де-
нотиопиранового продукта. Однако этот вопрос
лает эти соединения перспективными объектами
для исследований. В литературе также имеются
данные о биологическом действии 2-аминотио-
пиран-3,5-дикарбонитрилов
[49-51]. Нами был
проведен предикторный анализ и расчет in silico
возможных мишеней, параметров ADMET и со-
ответствия критериям биодоступности для со-
единений 2, 5 и 6. Анализ структур соединения
2, 5 и 6 на соответствие правилу пяти Липински
[молекулярная масса (MW) ≤ 500, сLogP ≤ 5.0,
TPSA ≤ 140 Å2, число Н-акцепторов ≤ 10, Н-до-
норов ≤ 5] [52-54] произведен с использованием
программного пакета OSIRIS Property Explorer
[55]. Были рассчитаны следующие параметры:
сLogP [логарифм коэффициента распределения
между н-октанолом и водой log(coctanol/cwater)],
растворимость (logS), площадь топологической
Рис. 4. Энергетические профили реакций циклизации
полярной поверхности (Topological Polar Surface
по атому азота N13 (1) и атому серы S12 (2) в среде эта-
Area, TPSA), ряд токсикологических характери-
нола с триэтиламином (a) и в пиридине (б).
стик - рисков побочных эффектов (мутагенные,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
833
Таблица 5. Расчетные параметры ADMET для соединений 2, 5, 6
Острая токсичность (крысы),
Ингибирование цитохромов
LD50, log10 (ммоль/кг)
Р450а
мг/кг
Проникновение
Гастроинтестинальная
№
через ГЭБа
абсорбцияa
IPб
IVб
Oralб
SCб
2
-
+
+
-
+
-
+
-0.054
-0.403
0.316
0.006
235.4
105.4
551.9
270.0
5
-
+
+
-
-
-
-
0.208
-0.178
0.601
0.083
373.0
153.4
922.5
279.7
5
-
+
+
-
-
-
-
0.170
-0.250
0.375
0.413
395.5
150.2
634.5
691.7
a Знаком «+» или «-» показано наличие или отсутствие эффекта.
б IP - внутрибрюшинный способ введения, IV - внутривенный путь введения, Oral - пероральный путь введения, SC - подкожный
путь введения.
онкогенные,
репродуктивные
эффекты),
ингибирующее действие в отношении киназ, для
параметр сходства с известными лекарственными
соединения 5 с вероятностью 0.800 - антиишеми-
препаратами (drug-likeness), а также общая оценка
ческое действие, для тиопирана 6 с вероятностью
фармакологического потенциала соединения
0.800 - антагонизм в отношении предшественника
(drug score). Полученные расчетные данные
бета-амилоида. Лучшее антибактериальное дей-
представлены в табл. 4.
ствие прогнозируется для соединения 6 в отно-
шении патогенных бактерий Campylobacter jejuni
Как следует из приведенных в табл. 4 данных,
(достоверность 0.3158; достоверность > 0, если
значение сLogP для всех структур находится
вероятность активности больше вероятности не-
в диапазоне
-0.95÷-0.13, что указывает на
активности Pa > Pi).
вероятную хорошую абсорбцию и проницаемость
[52-54]. В то же время, значение logS < -4.0 для
Для прогнозирования параметров ADMET
соединения 2 указывает на невысокую раствори-
(Absorption, Distribution, Metabolism, Excretion,
мость (менее 1×10-4 моль/л). Для всех соединений
Toxicity) использовали программные пакеты
параметр TPSA имеет пограничные значения, хотя
SwissADME [59, 60] и GUSAR [61, 62]. Соглас-
формально во всех случаях соответствует крите-
но критериям US EPA, по острой пероральной
риям пероральной биодоступности. Все соедине-
токсичности все соединения можно отнести к
ния демонстрируют полное отсутствие прогнози-
III классу (малотоксичные соединения, 500 мг/
руемых рисков токсичности. Показатели сходства
кг < LD50 < 5000 мг/кг). Для всех соединений
с лекарством (drug-likeness) невысоки, однако сум-
прогнозируется гастроэнтеральная абсорбция и
марная оценка фармакологического потенциала
отсутствие возможности проникновения через
соединения (drug score) за счет формального
гематоэнцефалический барьер (ГЭБ), а также
соответствия критериям биодоступности и
преимущественное отсутствие ингибирующего
прогнозируемой низкой токсичности достаточна
действия в отношении цитохромов Р450 (табл. 5).
высока, и находится в пределах 0.37-0.48.
Возможные протеиновые мишени для получен-
Для
прогнозирования
биологической
ных соединений были спрогнозированы с исполь-
активности также использовали открытые
зованием нового протокола протеин-лигандного
программные продукты PASS Online [56, 57] и
докинга GalaxySagittarius [63] на базе веб-сервера
AntiBac-Pred [58]. По полученным данным, для со-
GalaxyWeb [64, 65]. Оптимизированные по геоме-
единения 2 с вероятностью 0.765 прогнозируется
трии и минимуму энергии 3D-структуры соедине-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
834
ДОЦЕНКО и др.
Таблица 6. Результаты прогнозирования протеин-лигандного взаимодействия для соединений 2, 5, 6
Пре-докинговая
Общая оценка
Идентификатор
оценка проте-
Свободная энергия
Идентификатор
протеин-
Соединение
протеина
ин-лигандного
связывания, ккал/
протеина PDB ID
лигандного
UniProt ID
взаимодействия
моль (Docking score)
взаимодействия
(Predock score)
CN
1c5z
P00749
0.151
-13.995
0.256
5eww
P55201
0.118
-15.877
0.237
H2N
NH
2
5ji8
Q9H8M2
0.113
-15.024
0.226
N
6aaj
O60674
0.108
-15.379
0.223
NC
5up3
Q99683
0.101
-16.102
0.221
S
4awo
P07900,P07900
0.093
-17.078
0.221
2
6n0p
P15056,P15056
0.093
-16.679
0.218
6i8z
Q05397
0.087
-17.038
0.214
2hz0
P00519
0.090
-16.485
0.213
4xs2
Q9NWZ3
0.093
-15.803
0.211
S
1c5z
P00749
0.225
-12.952
0.322
NC
5ji8
Q9H8M2
0.143
-13.354
0.244
N
5eww
P55201
0.129
-13.502
0.230
4ury
P01112,Q07889
0.114
-14.520
0.223
H2N
NH
2
3tiy
P24941
0.116
-13.489
0.217
CN
5v19
Q99683
0.107
-13.663
0.210
5
5l3a
O60674
0.113
-12.772
0.209
3ii5
P15056,P15056
0.108
-13.024
0.206
4xs2
Q9NWZ3
0.110
-12.609
0.205
2hz0
P00519
0.104
-13.084
0.202
CN
1c5z
P00749
0.152
-14.802
0.263
N
NH2
5ji8
Q9H8M2
0.117
-15.045
0.230
5eww
P55201
0.120
-14.435
0.228
S
CN
5up3
Q99683
0.105
-15.935
0.224
4hge
O60674
0.107
-14.178
0.214
NH
2
5hid
P15056,P15056
0.091
-16.337
0.213
6
6i8z
Q05397
0.087
-16.488
0.210
4xs2
Q9NWZ3
0.095
-15.140
0.208
5ax9
Q9UKE5
0.074
-17.164
0.203
4idv
Q99558
0.087
-15.332
0.202
ний 2, 5 и 6 были генерированы с использованием
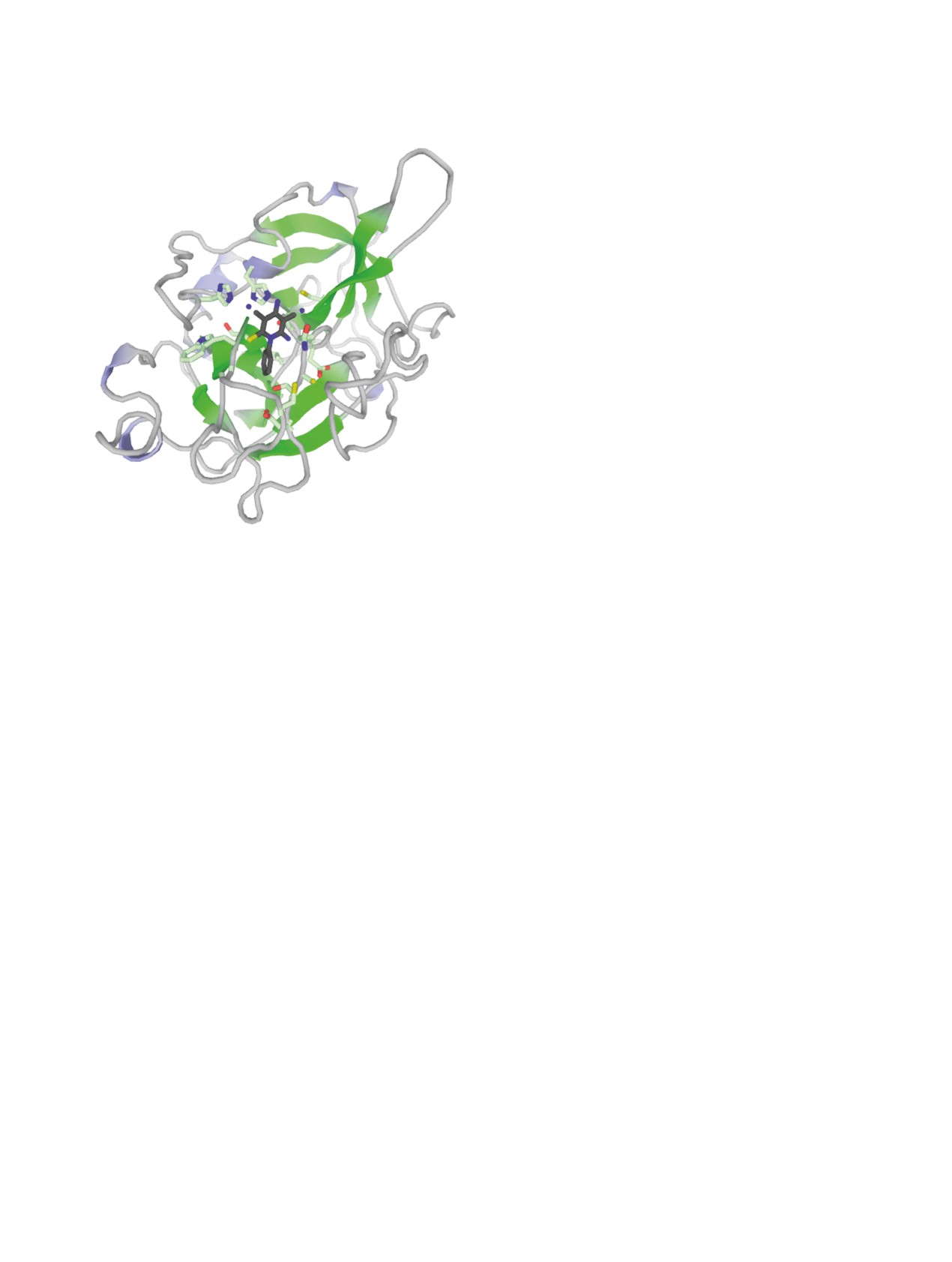
сродство к урокиназному активатору плазминоге-
программного пакета ORCA 4.2 [26, 27]. Докинг с
на (uPA, PDB ID 1c5z, UniProt ID P00749) (рис. 5),
использованием протокола GalaxySagittarius про-
белку BRPF1 (PDB ID 5eww, UniProt ID P55201),
водился в режимах Binding compatability prediction
бромдомен-содержащему протеину 9 BRD9 (PDB
и Re-ranking using docking. В табл. 6 представлены
ID 5ji8, UniProt ID Q9H8M2), регулирующей сиг-
результаты докинга по каждому из соединений 2,
нал к апоптозу киназе-1 ASK1/MAP3K (PDB ID
5 и 6 для 10 комплексов мишень-лиганд с мини-
5up3, UniProt ID Q99683) и ряду других мишеней.
мальной свободной энергии связывания ΔGbind и
Учитывая важную роль uPA [66] и BRD9 [67] в
наилучшей оценкой протеин-лигандного взаи-
онкогенных процессах, а протеинкиназы ASK1/
модействия. Прогнозируемые протеиновые ми-
MAP3K - в иммунном отклике [68], полученные
шени указаны с помощью ID-идентификаторов в
соединения возможно рассматривать как ингиби-
Protein Data Bank (PDB) и в базе данных UniProt.
торы, потенциально пригодные для лечения раз-
Как можно заметить из табл. 6, полученные сое-
личных форм онкозаболеваний, нейродегенера-
тивных процессов, ревматоидного артрита и др.
динения обнаруживают сродство к широкой груп-
пе протеинов. В частности, наиболее выражено
В целом, по результатам исследования мож-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
835
Bruker Vertex 70 с приставкой НПВО методом
нарушенного полного внутреннего отражения на
кристалле алмаза, погрешность ± 4 см-1. Спектры
ЯМР регистрировали на приборе Bruker Avance III
HD 400MHz (400.17 MГц на ядрах 1Н, 100.63 МГц -
13С) в растворе ДМСО-d6, в качестве стандарта
использовали остаточные сигналы растворителя.
Индивидуальность полученных образцов контро-
лировали методом ТСХ на пластинах Сорбфил-А
(«ООО Имид», Краснодар), элюент - ацетон-гек-
сан (1:1), проявитель - пары иода, УФ детектор.
Димер малононитрила 1 получали по методу
Миттельбаха [1]. Калиевую соль димера малоно-
нитрила 8 получали по той же методике (выход
75-90%), но без финального подкисления, и вво-
дили в реакцию без дополнительной очистки. Пи-
ридин сушили над KОН.
4,6-Диамино-2-тиоксо-1-фенил-1,2-диги-
дропиридин-3,5-дикарбонитрил (2). а. Получе-
ние из димера малононитрила 1 в присутствии
Рис. 5. Прогнозируемая структура протеин-лигандного
комплекса соединения 2 и урокиназного активатора
Et3N. К суспензии димера малононитрила 1 (1.0 г,
плазминогена (uPA, PDB ID 1c5z) (получено с исполь-
7.57 ммоль) в 15 мл 96%-ного этанола при переме-
зованием протокола GalaxySagittarius).
шивании добавляли 1.05-1.6 мл (7.57-11.35 ммоль)
Et3N. Смесь перемешивали 3-5 мин до полной или
но заключить следующее. Взаимодействие ди-
частичной гомогенизации, и добавляли PhNCS
мера малононитрила с изотиоцианатами может
(0.91 мл, 7.57 ммоль). Примерно через 5–10 мин
протекать по двум различным направлениям: с
наблюдалось начало образования желтого осадка,
образованием 4,6-диамино-2-тиоксо-1,2-дигидро-
и в течение 3-4 ч смесь полностью загустевала.
пиридин-3,5-дикарбонитрилов или
4,6-диами-
Реакционную массу оставляли на 24 ч, затем оса-
но-2-(фенилимино)-2H-тиопиран-3,5-дикарбони-
док отфильтровывали. Для очистки продукт кипя-
трила. При этом нужно отметить, что описанное
тили 2 мин в EtOH, отфильтровывали и промы-
в работе [9] образование производных пиримиди-
вали теплым EtOH. Выход 1.70-1.86 г (84-92%),
на не находит подтверждения. С использованием
желтый порошок, т. пл. > 300°С {т. пл. 250-252°C
квантово-химических расчетов установлено, что
(АсОН) [5]}. ИК спектр, ν, см-1: 3456 сл, 3414 сл,
образование 2-иминотиопиранов и 2-тиоксопири-
3367 ср, 3336 ср, 3302 с, 3211 с, ш (N-H), 2206 с
(С≡N), 1348 с, 1180 ср (С=S). Спектр ЯМР 1Н, δ,
динов протекает в условиях кинетического и тер-
модинамического контроля соответственно. В слу-
м. д.: 7.19-7.21 м (2Н, H2, H6, Ph), 7.31 уш. с (4H,
NH2), 7.43-7.53 м (3Н, H3-H5, Ph). Спектр ЯМР 13С
чае фенилизотиоцианата взаимодействие является
DEPTQ, δC, м. д.: 67.3 (C5), 88.1 (C3), 114.5 (C≡N),
региоуправляемым, и позволяет, при изменении
116.9 (C≡N), 129.1* (C2H C6H Ph), 129.5* (C4H Ph),
условий, получать исключительно производное
130.1* (C3H C5H Ph), 137.7 (C1 Ph), 155.6 (С4 или
2-(фенилимино)тиопирана или 2-тиоксо-1-фенил-
С6), 155.9 (С6 или С4), 181.0 (С=S). Здесь и далее
пиридина. Предикторный анализ биологической
звездочкой обозначены сигналы в противофазе.
активности указывает на пригодность и перспек-
Найдено, %: C 58.44; H 3.46; N 26.13. C13H9N5S.
тивность полученных соединений как потенциаль-
Вычислено, %: 58.41; H 3.39; N 26.20. M 267.31.
ных фармпрепаратов.
б. Получение из димера малононитрила в кипя-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
щем пиридине. Соединение 2 получали по мето-
ИК спектры получали на спектрофотометре
дике, описанной в работе [9] как способ синтеза
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
836
ДОЦЕНКО и др.
6-амино-2-тиоксо-1-фенил-1,2,3,4-тетрагидропи-
чиналось медленное отделение кристаллического
римидин-4-илиден)малононитрила следующим
осадка. Через 3 сут бледно-розовые кристаллы от-
образом. Смесь PhNCS (1.2 мл, 0.01 моль) и диме-
фильтровывали, промывали EtOH и петролейным
ра малононитрила 1 (1.32 г, 0.01 моль) в 30 мл без-
эфиром. Продукт спектрально идентичен соеди-
водного пиридина кипятили 2 ч, затем охлаждали.
нению 5, полученному по описанной выше мето-
Полученный темный раствор выливали на лед
дике. Выход составил 329 мг (28%). Из маточного
и подкисляли HCl до рН 2. Смесь выдерживали
раствора не удалось осаждением водой или под-
24 ч в холодильнике при 4°С, осадок желтого цве-
кислением получить дополнительные количества
та отфильтровали, промывали водой и EtOH. Для
продукта.
очистки полученный продукт кипятили 3-5 мин в
4,6-Диамино-2-(фенилимино)-2H-тиопи-
EtOH, нерастворимый порошок желто-оранжевого
ран-3,5-дикарбонитрил (6). а. Получение из ди-
цвета отфильтровывали, получали 2-тиоксопири-
мера малононитрила в пиридине. Смесь PhNCS
дин 2. Выход 48%, т. пл. > 300°С. Спектральные
(1.2 мл, 0.01 моль) и димера малононитрила 1
характеристики продукта идентичны представлен-
(1.32 г, 0.01 моль) в 30 мл безводного пиридина вы-
ным выше.
держивали 24 ч при 25°С, затем кипятили 2 ч и ох-
1-Аллил-4,6-диамино-2-тиоксо-1,2-дигидро-
лаждали. Полученный темный раствор выливали
пиридин-3,5-дикарбонитрил (5). а. Получение
на лед и подкисляли HCl до рН 2. Смесь выдержи-
из димера малононитрила 1. К суспензии димера
вали 24 ч в холодильнике при 4°С, отфильтровы-
малононитрила 1 (1.0 г, 7.57 ммоль) в 15 мл 96%-
вали и промывали EtOH. Для очистки полученный
ного этанола при перемешивании добавляли 1.05-
продукт кипятили 3-5 мин в EtOH, нераствори-
1.6 мл (7.57-11.35 ммоль) Et3N. Смесь перемеши-
мый порошок бежевого цвета отфильтровывали,
вали до гомогенизации и добавляли аллилизотио-
получали 0.20 г (8%) соединения 6, т. пл. > 300°С
цианат (0.75 мл, 7.66 ммоль). Полученную смесь
{т. пл. 225°C (EtОН) [9]}. ИК спектр, ν, см-1: 3427
перемешивали 2 ч, затем оставляли на 24 ч, при
сл, 3410 сл, 3371 ср, 3352 ср, 3329 ср, 3234 с, ш
этом реакционная масса полностью закристалли-
(N-H), 2212 с (С≡N), 1643 ср (С=N). Спектр ЯМР
зовывалась. Осадок отфильтровывали и промыва-
1Н, δ, м. д.: 7.11 уш. с (2H, C4NH2), 7.18 уш. с (2H,
ли EtOH. Выход 1.00-1.10 г (58-73%), бесцветные
C6NH2), 7.24-7.27 м (2Н, H2, H6, Ph), 7.48-7.54
игольчатые кристаллы, т. разл. 240°С. ИК спектр,
м (3Н, H3H5, Ph). Спектр ЯМР 13С DEPTQ, δC,
ν, см-1: 3454 сл, 3365 сл, 3306 с, 3213 с, уш (N-H),
м. д.: 62.4 (C5), 69.4 (C3), 115.2 (C≡N), 116.6 (C≡N),
2204 с (С≡N), 1344 с, 1190 ср (С=S). Спектр ЯМР
129.3* (C2H, C6H, Ph), 129.5* (C4H, Ph), 130.0*
1Н, δ, м. д.: 4.95 д. д (1Н, транс =CH2, 3J 17.4, 2J
(C3H, C5H, Ph), 134.1 (C1, Ph), 156.7 (С6), 159.3
1.2 Гц), 5.09 д. д (1Н, цис =CH2, 3J 10.5, 2J 1.2 Гц),
(С4), 160.4 (С2). Найдено, %: C 58.40; H 3.50; N
5.28 уш. с (2Н, NCH2), 5.71-5.81 м (CH2CH=CH2),
26.15. C13H9N5S. Вычислено, %: 58.41; H 3.39; N
7.20 уш. с (2H, C4NH2), 7.97 уш. с (2H, C6NH2).
26.20. M 267.31.
Спектр ЯМР 13С DEPTQ, δC, м. д.: 48.7 (NCH2),
67.4 (C5), 87.7 (C3), 114.5 (C≡N), 115.7 (=CH2),
б. Получение из калиевой соли димера мало-
117.1 (C≡N), 130.6* (CH2CH=CH2), 154.9 (С4 или
нонитрила 8. К суспензии калиевой соли диме-
С6), 155.2 (С6 или С4), 180.0 (С=S). Найдено, %: C
ра малононитрила 8 (9.0 г, 0.0526 моль) в 135 мл
51.94; H 3.97; N 30.23. C10H9N5S. Вычислено, %:
96%-ного этанола при перемешивании добавляли
51.93; H 3.92; N 30.28. M 231.28.
6.3 мл (0.0526 моль) PhNCS. При этом калиевая
б. Получение из калиевой соли димера мало-
соль 8 быстро растворялась, и образовывался рас-
нонитрила 8. Калиевую соль димера малонони-
твор желтого цвета. Через ~ 2 ч наблюдалось нача-
трила 8 (0.87 г, 5.09 ммоль) суспендировали в 10
ло образования осадка. Смесь перемешивали без
мл EtOH, при перемешивании добавляли 0.5 мл
нагревания еще 24 ч. Белый порошок 2-иминотио-
(5.09 ммоль) аллилизотиоцианата и затем 2 мл
пирана 6 отфильтровывали, промывали EtOH. Вы-
воды. Наблюдается легкий экзотермический эф-
ход 11.57 г (82%). Продукт спектрально идентичен
фект, смесь гомогенизируется с образованием
соединению 6, полученному по описанной выше
раствора чайного цвета. На следующий день на-
методике.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
837
ИНФОРМАЦИЯ ОБ АВТОРАХ
4.
Алексеева А.Ю., Бардасов И.Н. // ХГС. 2018. Т. 54.
№ 7. С. 689; Alekseeva A.Yu., Bardasov I.N. // Chem.
Доценко Виктор Викторович, ORCID: http://
Heterocycl. Compd. 2018. Vol. 54. N 7. P. 689. doi
orcid.org/0000-0001-7163-0497
10.1007/s10593-018-2332-9
Беспалов Александр Валерьевич, ORCID: http://
5.
Eldin A.M.S. // Phosphorus, Sulfur, Silicon, Relat. Elem.
orcid.org/0000-0002-9829-9674
2003. Vol. 178. N 10. P. 2215. doi 10.1080/713744561
6.
El-Taweel F.M., Elagamey A.A., El-Kenawy A.A.,
Waly M.A.
// Phosphorus, Sulfur, Silicon,
org/0000-0001-9354-9470
Relat. Elem. 2001. Vol. 176. N 1. P. 215. doi
Киндоп Вячеслав Константинович, ORCID:
10.1080/10426500108055120
7.
Mohareb R.M., Sherif S.M., Samy A.M. // Phosphorus,
Аксенов Николай Александрович, ORCID:
Sulfur, Silicon, Relat. Elem. 1995. Vol. 101. N 1-4.
P. 57. doi 10.1080/10426509508042499
8.
Mohareb R.M. // Monatsh. Chem. 1992. Vol. 123. N 4.
Аксенова Инна Валерьевна, ORCID: http://
P. 341. doi 10.1007/BF00810946
orcid.org/0000-0002-8083-1407
9.
Abdel-Latif E., Mustafa H.M., Etman H.A., Fadda A.A. //
Щербаков Станислав Владимирович, ORCID:
Russ. J. Org. Chem. 2007. Vol. 43. N 3. P. 443. doi
10.1134/S1070428007030219
Овчаров Сергей Николаевич, ORCID: http://
10.
Доценко В.В., Исмиев А.И., Хрусталева А.Н., Фро-
лов К.А., Кривоколыско С.Г., Чигорина Е.А., Сниж-
orcid.org/0000-0002-4638-6098
ко А.П., Громенко В.М., Бушмаринов И.С., Аске-
ФОНДОВАЯ ПОДДЕРЖКА
ров Р.К., Пехтерева Т.М., Суйков С.Ю., Папаяни-
на Е.С., Мазепа А.В., Магеррамов А.М. // ХГС.
Работа выполнена при финансовой поддерж-
2016. Т. 52. № 7. С. 473; Dotsenko V.V., Ismiev A.I.,
ке Кубанского научного фонда в рамках научного
Khrustaleva A.N., Frolov K.A., Krivokolysko S.G.,
проекта МФИ-20.1-26/20 (заявка № МФИ-20.1/45),
Chigorina E.A., Snizhko A.P., Gromenko V.M.,
а также при поддержке Министерства образова-
Bushmarinov I.S., Askerov R.K., Pekhtereva T.M.,
ния и науки Российской Федерации (тема 0795-
Suykov S.Yu., Papayanina E.S., Mazepa A.V.,
2020-0031) с использованием приборного парка
Magerramov A.M. // Chem. Heterocycl. Compd. 2016.
Научно-образовательного центра
«Диагностика
Vol. 52. N 7. P. 473. doi 10.1007/s10593-016-1918-3
структуры и свойств наноматериалов» Кубанского
11.
Семенова А.М., Оганесян Р.В., Доценко В.В., Чи-
государственного университета.
горина Е.А., Аксенов Н.А., Аксенова И.В., Нетре-
ба Е.Е. // ЖОХ. 2019. Т. 89. № 1. С. 23; Semeno-
КОНФЛИКТ ИНТЕРЕСОВ
va A.M., Oganesyan R.V., Dotsenko V.V., Chigori-
Авторы заявляют об отсутствии конфликта
na E.A., Aksenov N.A., Aksenova I.V., Netreba E.E. //
интересов.
Russ. J. Gen. Chem. 2019. Vol. 89. N 1. P. 19. doi
10.1134/S1070363219010043.
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
12.
Доценко В.В., Кривоколыско С.Г., Семенова А.М.
Дополнительные материалы для этой статьи
// ХГС. 2018. Т. 54. № 11. С. 989; Dotsenko V.V.,
Krivokolysko S.G., Semenova A.M. // Chem. Heterocycl.
доступны по doi
10.31857/S0044460X21060019
Compd. 2018. Vol. 54. N. 11. P. 989. doi 10.1007/
для авторизованных пользователей.
s10593-018-2383-y
СПИСОК ЛИТЕРАТУРЫ
13.
Bakhite E.A.-G. // Phosphorus, Sulfur, Silicon,
1. Mittelbach M. // Monatsh. Chem. 1985. Vol. 116. N 5.
Relat. Elem.
2003. Vol.
178. P.
929. doi
P. 689. doi 10.1007/BF00798796
10.1080/10426500390208820
2. Доценко В.В., Кривоколыско С.Г., Семенова А.М. //
14.
Пароникян Е. Г., Арутюнян А. С., Дашян Ш. Ш. //
ХГС. 2018. Т. 54. № 11. С. 989; Dotsenko V.V.,
Хим. ж. Арм. 2017. Т. 70. № 1-2. С. 179.
Krivokolysko S.G., Semenova A.M. // Chem. Heterocycl.
15.
Доценко В.В., Бурый Д.С., Лукина Д.Ю., Кривоколы-
Compd. 2018. Vol. 54. N 11. P. 989. doi 10.1007/
ско С.Г. // Изв. АН. Сер. хим. 2020. № 10. С. 1829;
s10593-018-2383-y
Dotsenko V.V., Buryi D.S., Lukina D.Yu., Krivokolys-
3. Shaabani A., Hooshmand S.E. // Mol. Divers. 2018.
ko S.G. // Russ. Chem. Bull. 2020. Vol. 69. N 10.
Vol. 22. N 1. P. 207. doi 10.1007/s11030-017-9807-y
P. 1829. doi 10.1007/s11172-020-2969-2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
838
ДОЦЕНКО и др.
16.
Sajadikhah S. S., Marandi G. // ХГС. 2019. Т. 55. № 12.
32.
Andersson M.P., Uvdal P. // J. Phys. Chem. (A). 2005.
С. 1171; Sajadikhah S. S., Marandi G. // Chem.
Vol. 109. P. 2937. doi 10.1021/jp045733a
Heterocycl. Compd. 2019. Vol. 55. N 12. P. 1171. doi
33.
Allouche A.-R. // J. Comput. Chem. 2011. Vol. 32.
10.1007/s10593-019-02596-1
P. 174. doi 10.1002/jcc.21600.
17.
Ахметова В.Р., Надыргулова Г.Р., Ниатшина З.Т.,
34.
Brandenburg J.G., Bannwarth C., Hansen A., Grimme S. //
Джемилев У.М. // ХГС. 2009. № 10. С. 1443;
J. Chem. Phys. 2018. Vol. 148. P. 064104. doi
Akhmetova V.R., Nadyrgulova G.R., Niatshina Z.T.,
10.1063/1.5012601
Dzhemilev U.M. // Chem. Heterocycl. Compd. 2009.
35.
Caldeweyher E., Brandenburg J.G. // J. Phys. Condens.
Vol. 45. N 10. P. 1155. doi 10.1007/s10593-010-0403-7
Matter. 2018. Vol. 30. P. 213001. doi 10.1088/1361-
18.
Ахметова В.Р., Рахимова Е.Б. // ЖОрХ. 2014. Т. 50.
648X/aabcfb
№ 12. С. 1727; Akhmetova V.R., Rakhimova E.B. //
36.
Grimme S., Ehrlich S., Goerigk L. // J. Comput. Chem.
Russ. J. Org. Chem. 2014. Vol. 50. N 12. P. 1711. doi
2011. Vol. 32. P. 1456. doi 10.1002/jcc.21759
10.1134/S107042801412001X
37.
Tomasi J., Mennucci B., Cammi R. // Chem. Rev. 2005.
19.
Доценко В.В., Фролов К.А., Кривоколыско С.Г. //
Vol. 105. P. 2999. doi 10.1021/cr9904009
ХГС. 2015. Т. 51. № 2. С. 109; Dotsenko V.V., Fro-
38.
Litvinov V.P., Rodinovskaya L.A., Sharanin Yu.A.,
lov K.A., Krivokolysko S.G. // Chem. Heterocycl.
Shestopalov A.M., Senning A. // J. Sulfur Chem. 1992.
Compd. 2015. Vol. 51. N 2. P. 109. doi 10.1007/s10593-
Vol. 13. N 1. P. 1. doi 10.1080/01961779208048951
015-1668-7
39.
Litvinov V.P. // Phosphorus, Sulfur, Silicon,
20.
Доценко В.В., Фролов К.А., Чигорина Е.А., Хруста-
Relat. Elem. 1993. Vol. 74. N 1. P. 139. doi
лева А.Н., Бибик Е.Ю., Кривоколыско С.Г. // Изв.
10.1080/10426509308038105
АН. Сер. хим. 2019. № 4. С. 691; Dotsenko V.V., Fro-
40.
Литвинов В.П. // Изв. АН. Сер. xим. 1998. № 11.
lov K.A., Chigorina E.A., Khrustaleva A.N., Bibik E.Yu.,
С. 2123; Litvinov V.P. // Russ. Chem. Bull. 1998.
Krivokolysko S.G. // Russ. Chem. Bull. 2019. Vol. 68.
Vol. 47. N 11. P. 2053. doi 10.1007/BF02494257
N 4. P. 691. doi 10.1007/s11172-019-2476-5
41.
Литвинов В.П., Кривоколыско С.Г., Дяченко В.Д. //
21.
Доценко В.В., Кривоколыско С.Г., Чигорина Е.А.
ХГС. 1999. № 5. С. 579; Litvinov V.P., Krivokolysko S.G.,
// ЖОХ. 2020. Т. 90. № 4. С. 522; Dotsenko V.V.,
Dyachenko V.D. // Chem. Heterocycl. Compd. 1999.
Krivokolysko S.G., Chigorina E.A. // Russ. J. Gen.
Vol. 35. N 5. P. 509. doi 10.1007/BF02324634
Chem. 2020. Vol. 90. N 4. P. 590. doi 10.1134/
42.
Литвинов В.П. // Усп. хим. 2006. Т. 75. № 7. С. 645;
S1070363220040052
Litvinov V.P. // Russ. Chem. Rev. 2006. Vol. 75. N 7.
22.
El-Sayed A.M., Abdel-Ghany H. // J. Heterocycl.
P. 577. doi 10.1070/RC2006v075n07ABEH003619
Chem. 2000. Vol. 37. N 5. P. 1233. doi 10.1002/
43.
Attia A.M., Khodair A.I., Gendy E.A., El-Magd M.A.,
jhet.5570370534
Elshaier Y.A.M.M. // Lett. Drug Design Discov. 2020.
23.
Gewald K., Buchwalder M., Peukert M. // J. Prakt.
Vol. 17. N 2. P. 124. doi 10.2174/15701808166661902
Chem. 1973. Bd 315. N 4. S. 679. doi 10.1002/
20123547
prac.19733150413
44.
Catarzi D., Varano F., Varani K., Vincenzi F., Pasquini S.,
24.
Bogdanowicz-Szwed K. // Monatsh. Chem. 1982.
Dal Ben D., Volpini R., Colotta V. // Pharmaceuticals.
Vol. 113. N 5. P. 583. doi 10.1007/BF00800265
2019. Vol. 12. N 4. P. 159. doi 10.3390/ph12040159
25.
Takeshima T., Yokoyama M., Fukada N., Akano M. // J.
45.
Schweda S.I., Alder A., Gilberger T., Kunick C. //
Org. Chem. 1970. Vol. 35. N 7. P. 2438. doi 10.1021/
Molecules. 2020. Vol. 25. N 14. P. 3187. doi 10.3390/
jo00832a085
molecules25143187
26.
Neese F. // WIREs Comput. Mol. Sci. 2011. Vol. 2.
46.
Grigor’ev A.A., Shtyrlin N.V., Gabbasova R.R.,
P. 73. doi 10.1002/wcms.81
Zeldi M.I., Grishaev D. Yu., Gnezdilov O.I.,
27.
Neese F. // WIREs Comput. Mol. Sci. 2017. Vol. 8.
Balakin K.V., Nasakin O.E., Shtyrlin Y.G. //
e1327. P. 1. doi 10.1002/wcms.1327
Synth. Commun. 2018. Vol. 48. N 17. P. 2288. doi
28.
Becke A.D. // Phys. Rev. (A). 1988. Vol. 38. P. 3098. doi
10.1080/00397911.2018.1501487
10.1103/PhysRevA.38.3098
47.
Betti M., Catarzi D., Varano F., Falsini M., Varani K.,
29.
Lee C., Yang W., Parr R.G. // Phys. Rev. (B). 1988.
Vincenzi F., Dal Ben D., Lambertucci C., Colotta V. //
Vol. 37. P. 785. doi 10.1103/PhysRevB.37.785
Eur. J. Med. Chem. 2018. Vol. 150. P. 127. doi
30.
Grimme S., Antony J., Ehrlich S., Krieg H. // J. Chem.
10.1016/j.ejmech.2018.02.081
Phys. 2010. Vol. 132. P. 154104. doi 10.1063/1.3382344
48.
Fugel W., Oberholzer A.E., Gschloessl B., Dzikowski R.,
31.
Goerigk L., Grimme S. // Phys. Chem. Chem. Phys.
Pressburger N., Preu L., Pearl L.H., Baratte B., Ratin M.,
2011. Vol. 13. P. 6670. doi 10.1039/C0CP02984J
Okun I., Doerig C., Kruggel S., Lemcke T., Meijer L.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
О ВЗАИМОДЕЙСТВИИ ДИМЕР
А МАЛОНОНИТРИЛА С ИЗОТИОЦИАНАТАМИ
839
Kunick C. // J. Med. Chem. 2013. Vol. 56. N 1. P. 264.
60.
Gfeller D., Grosdidier A., Wirth M., Daina A., Michie-
doi 10.1021/jm301575n
lin O., Zoete V. // Nucl. Acids Res. 2014. Vol. 42. N W1.
49.
Sanchez M.I., de Vries L.E., Lehmann C., Lee J.T.,
P. W32. doi 10.1093/nar/gku293
Ang K.K., Wilson C., Chen S., Arkin M.R., Bogyo
61.
Lagunin A., Zakharov A., Filimonov D., Poroikov V. //
M., Deu E. // PloS one. 2019. Vol. 14. N 12. Paper
Mol. Informatics. 2011. Vol. 30. N 2-3. P. 241. doi
N e0226270. doi 10.1371/journal.pone.0226270
10.1002/minf.201000151
50.
Zhou P., Warren J.D. Pat. WO2014031759 (2014).
62.
GUSAR Online. Laboratory for Structure-Function
51.
Whitten J.P., Pei Y., Stauderman K.A., Roos J. Pat.
US2010087415 (2010).
Based Drug Design, Institute of Biomedical Chemistry
52.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J.
// Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4.
gusar/references.html
doi 10.1016/S0169-409X(96)00423-1
63.
Yang J., Kwon S., Bae S.H., Park K.M., Yoon C.,
53.
Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
Lee J.H., Seok C. // J. Chem. Inf. Model. 2020. Vol. 60.
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
N 6. P. 3246. doi 10.1021/acs.jcim.0c00104
54.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
64.
GalaxyWEB. A web server for protein structure
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4. doi
prediction, refinement, and related methods.
10.1016/j.addr.2012.09.019.
55.
Sander T. OSIRIS Property Explorer. Idorsia
Computational Biology Lab, Department of Chemistry,
chemistry.org/prog/peo/
seoklab.org/index.html
56.
PASS Online. Laboratory for Structure-Function
65.
Ko J., Park H., Heo L., Seok C. // Nucleic Acids Res.
Based Drug Design, Institute of Biomedical Chemistry
2012. Vol. 40. N W1. P. W294. doi 10.1093/nar/gks493
66.
Katz B.A., Mackman R., Luong C., Radika K., Martelli A.,
ru/passonline/predict.php
Sprengeler P.A., Wang J., Chan H., Wong L. // Chem.
57.
Филимонов Д.А., Лагунин А.А., Глориозова Т.А., Ру-
Biol. 2000. Vol. 7. N 4. P. 299. doi 10.1016/s1074-
дик А.В., Дружиловский Д.С., Погодин П.В., Порой-
ков В.В. // ХГС. 2014. № 3. С. 483; Filimonov D.A.,
5521(00)00104-6
Lagunin A.A., Gloriozova T.A., Rudik A.V., Druzhilovskii
67.
Clark P.G., Vieira L.C., Tallant C., Fedorov O., Single-
D.S., Pogodin P.V., Poroikov V.V. // Chem. Heterocycl.
ton D.C., Rogers C.M., Monteiro O.P., Bennett J.M.,
Compd. 2014. Vol. 50. N 3. P. 444. doi 10.1007/s10593-
Baronio R., Müller S., Daniels D.L., Méndez J.,
014-1496-1
Knapp S., Brennan P.E., Dixon D.J. // Angew. Chem.
58.
Way2Drug. antiBac-Pred. Laboratory for Structure-
Int. Ed. 2015. Vol. 54. N 21. P. 6217. doi 10.1002/
Function Based Drug Design, Institute of Biomedical
anie.201501394
68.
Hayakawa T., Matsuzawa A., Noguchi T., Takeda K.,
com/antibac/
59.
Daina A., Michielin O., Zoete V. // Sci. Rep. 2017.
Ichijo H. // Microbes and Infection. 2006. Vol. 8. N 4.
Vol. 7. Article N 42717. doi 10.1038/srep42717
P. 1098. doi 10.1016/j.micinf.2005.12.001
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
840
ДОЦЕНКО и др.
Reactions of Malononitrile Dimer with Isothiocyanates
V. V. Dotsenkoa,b,*, A. V. Bespalova, A. A. Russkikha, V. K. Kindopa, N. A. Aksenovb,
I. V. Aksenovab, S. V. Shcherbakovb, and S. N . Ovcharovb
a Kuban State University, Krasnodar, 350040 Russia
b North Caucasus Federal University, Stavropol, 355009 Russia
*e-mail: victor_dotsenko_@mail.ru
Received April 19, 2021; revised April 19, 2021; accepted May 6, 2021
Depending on the conditions, the reaction of 2-amino-1,1,3-tricyanopropene (malononitrile dimer) with isothio-
cyanates leads to 1-substituted 4,6-diamino-2-thioxo-1,2-dihydropyridine-3,5-dicarbonitriles either 4,6-diami-
no-2-(phenylimino)-2H-thiopyran-3,5-dicarbonitrile. Quantum-chemical modeling of IR spectra and reaction
routes for the obtained compounds was carried out. In silico predictive analysis of potential protein targets,
compliance with bioavailability criteria and ADMET parameters was carried out.
Keywords: 2-amino-1,1,3-tricyanopropene, isothiocyanates, heterocyclization, 2H-thiopyrans, 2-thioxopyri-
dines, quantum chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021