ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 847-861
УДК 547.822.7;547.461.3;547.594.3;547.659.1
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И
АМИНОМЕТИЛИРОВАНИЕ
4-ИМИНО-2-(ДИЦИАНОМЕТИЛЕН)-3-АЗАСПИРО[5.5]-
УНДЕКАН-1,5-ДИКАРБОНИТРИЛА
© 2021 г. А. О. Курсковаa, В. В. Доценкоb,c, К. А. Фроловa, Н. А. Аксеновc, И. В. Аксеноваc,
С. В. Щербаковc, С. Н. Овчаровc, Д. С. Кривоколыскоd, С. Г. Кривоколыскоa,d,*
a Лаборатория «ХимЭкс», Луганский государственный университет имени В. Даля, кв. Молодёжный 20-А/7,
Луганск, 91034 Украина
b Кубанский государственный университет, Краснодар, 350040 Россия
c Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
d Луганский государственный медицинский университет имени Святителя Луки, Луганск, 91045 Украина
*e-mail: ksg-group-lugansk@mail.ru
Поступило в Редакцию 5 апреля 2021 г.
После доработки 5 апреля 2021 г.
Принято к печати 22 апреля 2021 г.
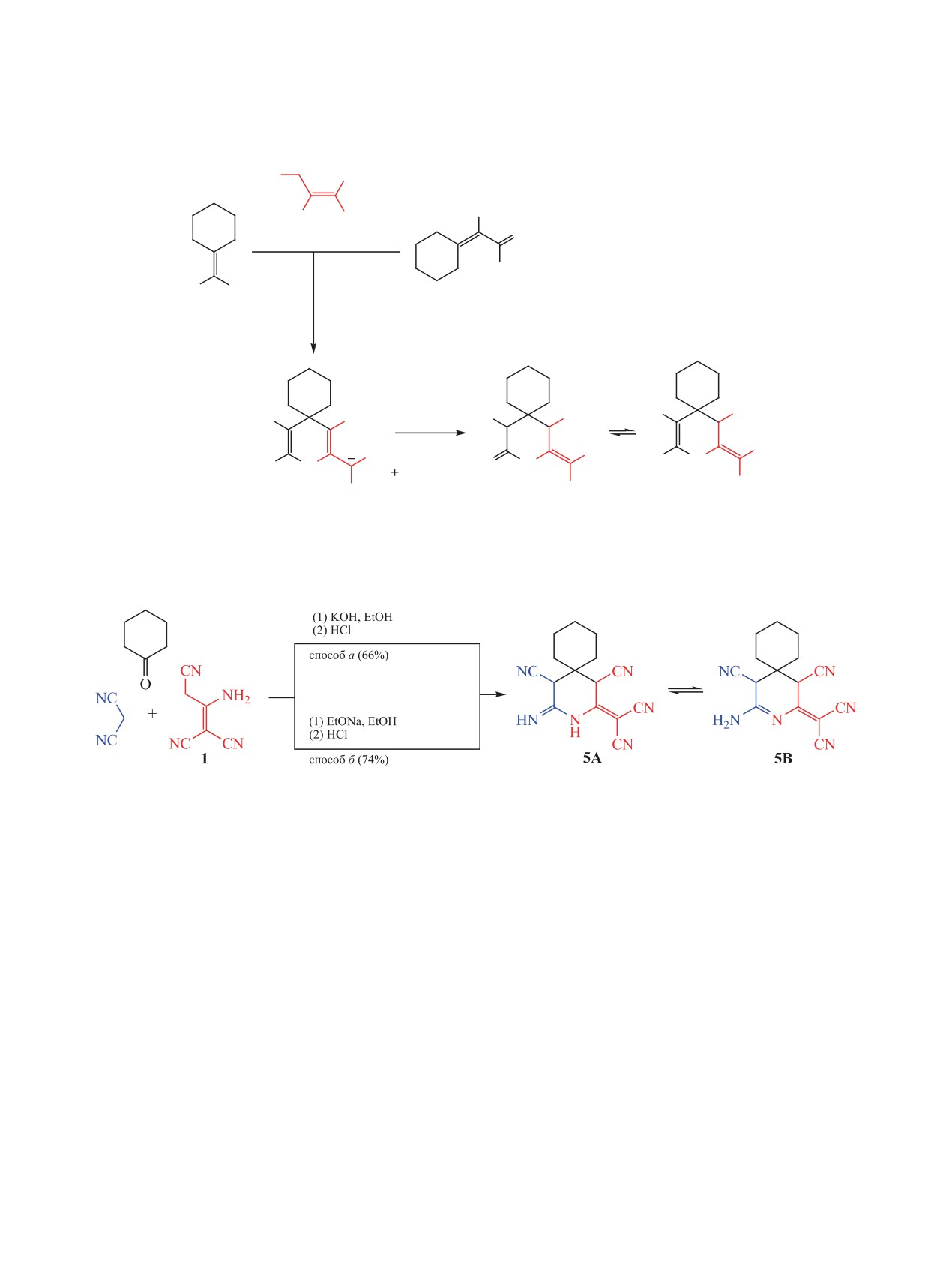
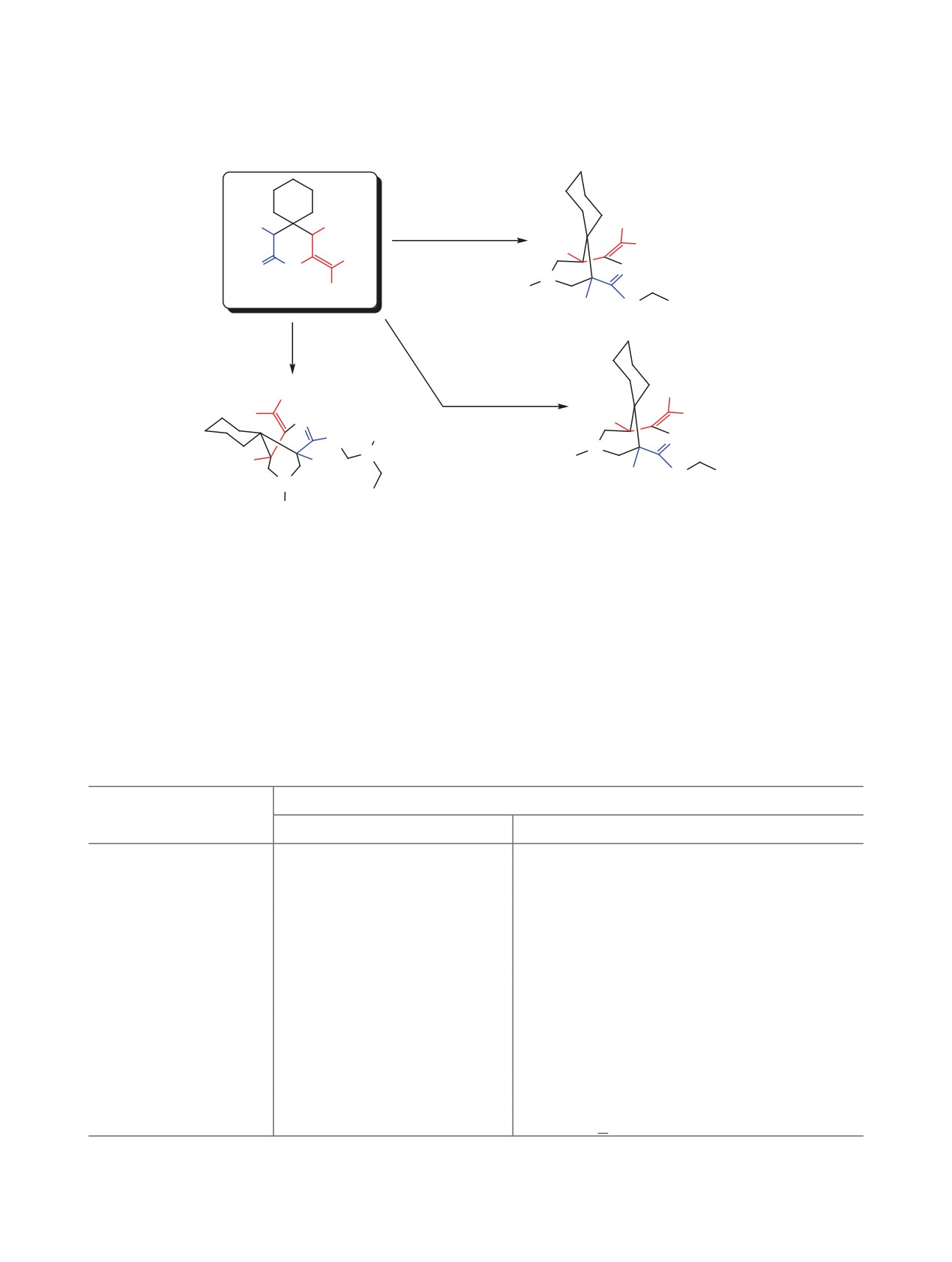
При последовательном взаимодействии циклогексанона с малононитрилом и 2-аминопропен-1,1,3-три-
карбонитрилом в присутствии гидроксида калия или этилата натрия в этаноле получен 4-имино-2-(ди-
цианометилен)-3-азаспиро[5.5]ундекан-1,5-дикарбонитрил. Последний вступает в реакцию аминоме-
тилирования с первичными аминами и избытком формальдегида с образованием новых производных
2-(дицианометилен)-3,7-диазаспиро[бицикло[3.3.1]нон-3-ен-9,1ʹ-циклогексан]-1,5-дикарбонитрила.
Вопреки литературным данным, взаимодействие циклогексанона и 2-аминопропен-1,1,3-трикарбо-
нитрила в бензоле в присутствии пиперидина и ледяной уксусной кислоты приводит к образованию
2,4-диамино-5,6,7,8-тетрагидронафталин-1,3-дикарбонитрила.
Ключевые слова: циклогексанон, малононитрил, 2-аминопропен-1,1,3-трикарбонитрил, 2,4-диами-
но-5,6,7,8-тетрагидронафталин-1,3-дикарбонитрил, 4-имино-2-(дицианометилен)-3-азаспиро[5.5]унде-
кан-1,5-дикарбонитрил, аминометилирование
DOI: 10.31857/S0044460X21060032
Димер малононитрила
(2-аминопропен-
растворе ДМСО в виде смеси иминного и амин-
1,1,3-трикарбонитрил) 1 зарекомендовал себя в ка-
ного таутомеров 5А и 5Б в соотношении ~ 1:1 [3]
честве многофункционального реагента в синтезе
(схема 1).
карбо- и гетероциклических соединений [1, 2]. Ра-
Продолжая наши исследования в области хи-
нее в работе [3] было показано, что производные
мии димера малононитрила [4-7], мы решили раз-
циклогексанона - непредельные нитрилы 2 и 3 -
работать новые удобные подходы к синтезу соеди-
легко вступают в реакцию с димером малонони-
нения 5 и изучить возможность получения новых
трила 1 в этаноле в присутствии N-метилморфо-
полинитрильных соединений на его основе. Нами
лина (NMM) с образованием соли 4 с выходами 84
было установлено, что при последовательном вза-
и 70% соответственно (схема 1). При подкислении
имодействии циклогексанона и малононитрила
соли 4 соляной кислотой был выделен 4-имино-2-
с димером малононитрила 1 в этаноле в присут-
(дицианометилен)-3-азаспиро[5.5]ундекан-1,5-ди-
ствии сильных оснований - KОН (способ а) либо
карбонитрил 5 с выходом 80%, существующий в
EtONa (способ б) - и дальнейшем подкислении ре-
847
848
КУРСКОВА и др.
Схема 1.
NC
CN
CN
H2N
CN
S
1
NH2
NC CN
3
EtOH,
70-84%
NMM
2
NC
CN
NC
CN
HCl
NC
CN
80%
CN
CN
CN
H2N
N
H2N
N
HN
N
H
H
H
NMMH
CN
CN
CN
5A
5Б
4
NMM = N-метилморфолин.
Схема 2.
акционной массы HCl соединение 5 образуется c
ние 5 существует в виде смеси двух таутомеров:
выходами 66 и 74% соответственно (cхема 2). Дан-
4-имино-2-(дицианометилен)-3-азаспиро[5.5]-
ный подход, несомненно, имеет ряд преимуществ
ундекан-1,5-дикарбонитрила 5А и 2-амино-4-(ди-
над известными [3] способами получения соеди-
цианометилен)-3-азаспиро[5.5]ундец-2-ен-1,5-ди-
нения 5, поскольку здесь исключены достаточно
карбонитрила 5В (а не 5А и 5Б, как было указано
трудоемкие предшествующие стадии синтеза, вы-
в работе [3]), при этом каждый из таутомеров 5А
деления и очистки циклогексилиденмалононитри-
и 5В представлен парой диастереомеров в соотно-
ла 2 [8-16] и циклогексилиденцианотиоацетамида
шении ~3:1 (схема 3).
3 [17, 18], а также потери, связанные с этими про-
В спектре 1Н ЯМР наблюдаются парные сиг-
цессами.
налы водородов С5Н и С1Н основных диастерео-
Строение соединения 5 детально изучено с при-
меров в виде синглетов при 4.25, 4.35 и 4.38 м. д.
влечением методов спектроскопии ЯМР на ядрах
Сигналы пары минорных диастереомеров прояв-
1Н и 13С (DEPTQ, 1H-13C HSQC, 1H-13C HMBC,
ляются в виде синглетов при 4.10 и 4.25, 4.49 и
1H-15N HSQC) (табл. 1), а также ИК спектроско-
4.77 м. д. Сигналы водородов NH2-группы диасте-
пии. Наблюдаемая в спектре 1Н ЯМР (ДМСО-d6)
реомеров таутомерной формы 5В представлены в
картина весьма сложна. Установлено, что соедине-
виде пар синглетов при 9.52 и 10.08 м. д., 9.49 и
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И АМИНОМЕТИЛИРОВАНИЕ
849
Таблица 1. Основные корреляции в спектрах ЯМР 1H-13C и 1H-15N HSQC и HMBC соединения 5a
1.36
1.36
H
H
1.74
1.74
H
113.8
H
N
114.3
113.8
114.3
C
35.5
CN
NC
35.3
CN
36.7
32.0
36.7
32.0
4.25
4.35
4.25
4.38
H
H
H
H
157.7
157.7
CN
H
132.6
CN
9.49
(9.52)
168.2
HN
161.5
N
63.0
N
N
63.0
H
CN
H
CN
10.02
(10.08)
5A
5B
δC, м. д.
δN, м. д.
δH, м. д.
1
1H-15
N HSQC
H-13C HSQC
1H-13C HMBC
1.17-2.01 м (10Н, СН2,
20.1 и 20.6, 20.8 и 21.6, 24.2 и
21.6, 24.2, 33.3 (3СН2, цикло-
-
циклогексан)
24.5, 31.7 и 32.2, 32.8 и 33.3
гексан), 35.3 и 35.5 (С, цикло-
(5СН2, циклогексан)
гексан), 36.7*** (2С5)
4.25 уш. с (2H, С5Н)
36.7*** (2С5)
63.0 (С(С≡N)2), 114.3 (C5C≡N),
-
157.7 (C4)
4.35 c (1H, C1H)
32.0*** (C1)
35.3 (C циклогексан), 113.8
-
(С1C≡N), 168.2 (C2)
4.38 (1H, C1H)
32.0*** (C1)
35.5 (C циклогексан), 113.8
-
(С1С≡N), 161.5 (C2)
9.49 c и 10.02 с (2Н,
-
-
132.6 (NH2* и NH2**)
NH2*), 9.52 c и 10.08 с
(2Н, NH2**)
a В спектрах ЯМР 1H-13C HSQC и HMBC обнаруживаются корреляции только основных диастереомеров таутомерных форм 5А
и 5B. Здесь и далее: одной звездочкой обозначены сигналы минорных диастереомеров, двумя - основных диастереомеров тау-
томерных форм 5А и 5В, тремя звездочками обозначены сигналы атомов углерода, находящиеся в противофазе в спектре ЯМР
13C DEPTQ.
Схема 3.
NC
CN
NC
CN
NC
CN
NC
CN
CN
CN
CN
CN
HN
N
HN
N
HN
N
HN
N
H
H
H
H
CN
CN
CN
CN
(1R,5S)-5A
(1S,5R)-5A
(1R,5R)-5A
(1S,5S)-5A
NC
CN
NC
CN
NC
CN
NC
CN
CN
CN
CN
CN
H2N
N
H2N
N
H2N
N
H2N
N
CN
CN
CN
CN
(1R,5R)-5B
(1S,5S)-5B
(1S,5R)-5B
(1R,5S)-5B
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
850
КУРСКОВА и др.
Таблица 2. Основные корреляции в спектрах ЯМР 1H-13C HSQC и HMBC соединения 7
117.3
CN
2.58-2.59
H H
CN
H H
5.90
82.5
144.7
NH2
21.5
H
NH2
28.7
152.2
1.63-1.67
H
77.5
23.0
21.7
H
110.7
153.1
CN
CN
116.0
H
H H
NH2
H H
NH2
2.21-2.22
6.31
δС, м. д.
δH, м. д.
1H-13C HSQC
1H-13C HMBC
1.63-1.67 м (C6H2 и C7H2)
21.5 (C7), 21.7 (C6)
21.5 (C7), 21.7 (C6), 23.0 (C5), 28.7 (C8), 110.7 (C4a), 144.7 (C8a)
2.21-2.22 м (C5H2)
23.0 (C5)
21.5 (C7), 110.7 (C4a), 144.7 (C8a), 153.1 (C4).
2.58-2.59 м (C8H2)
28.7 (C8)
21.5 (C7), 82.5 (C1), 110.7 (C4a), 144.7 (C8a)
5.90 уш. с (C2NH2)
-
77.5 (C3), 82.5 (C1)
6.31 уш. c (C4NH2)
-
77.5 (C3), 110.7 (C4a)
10.02 м. д., на что указывают четыре кросс-пика в
Из литературных данных известно, что про-
спектре 2D ЯМР 1H-15N HSQC при единственном
дукты конденсации Кнёвенагеля димера малоно-
сигнале азота в области 132.6 м. д. Сигналы водо-
нитрила 1 с альдегидами легко доступны [19-24]
рода иминогруппы таутомера 5А не проявляются,
и широко используются для получения разно-
вероятно, вследствие дейтерообмена. В спектрах
образных гетероциклических соединений: произ-
13C ЯМР DEPTQ сигналы основных диастерео-
водных оксирана [25], фуро[3,2-c]изотиазола [26],
мерных форм таутомеров 5А и 5В регистрируются
фуро[3,2-c]изоселеназола [27], циклопропа[c]пир-
удвоенным набором сигналов углеродов циклогек-
рола [28, 29], пиридина [30, 31], 1,8-нафтиридина
санового фрагмента: 20.1 и 20.6, 20.8 и 21.6, 24.2
[32] с широким спектром практически важных
и 24.5, 31.7 и 32.2, 32.8 и 33.3, 35.3 и 35.5 м. д, а
свойств. В то же время, имеются лишь единичные
также атома С2 при 161.5 и 168.2 м. д. Вследствие
сведения о синтезе аналогичных продуктов кон-
отсутствия корреляций протонов групп NH2, HN=
денсации Кнёвенагеля димера малононитрила 1 с
и N3H в спектрах 2D ЯМР 1H-13С и 1H-15N HMBC
кетонами [33-35]. Так, в работе [33] описано полу-
сделать однозначное отнесение сигналов Н и С к
чение с выходом 42% продукта конденсации диме-
конкретному таутомеру не представляется воз-
ра 1 с циклогексаноном - 2-амино-3-циклогекси-
можным.
лиденпроп-1-ен-1,1,3-трикарбонитрила 6, который
Успешное получение соединения 5 по спосо-
мог бы выступить в качестве перспективного ис-
ходного реагента для получения соединения 5.
бам а и б (схема 2) во многом обусловлено стро-
го определенной последовательностью введения
Нами установлено, что при проведении ре-
реагентов в синтез, и предполагает образование
акции димера 1 с циклогексаноном в описанных
циклогексилиденмалононитрила 2 in situ. Нами
условиях (кипячение в бензоле в присутствии
была предпринята попытка осуществить аль-
пиперидина и АсОН в течение 6 ч с насадкой
тернативный синтез соединения 5 в иной после-
Дина-Старка
[33]) образуется продукт вну-
довательности, а именно через первоначальное
тримолекулярной циклизации соединения 6 по
взаимодействие димера малононитрила 1 с ци-
Торпу-Циглеру - 2,4-диамино-5,6,7,8-тетрагидро-
клогексаноном по Кнёвенагелю, и дальнейшую
нафталин-1,3-дикарбонитрила 7 с выходом 40%
реакцию продукта конденсации (2-амино-3-ци-
(схема 4). Строение соединения 7 однозначно до-
клогексилиденпроп-1-ен-1,1,3-трикарбонитрила
казано с привлечением методов двумерной спек-
6) с малононитрилом по Михаэлю с последующей
троскопии ЯМР (1Н-13С HSQC, 1H-13C HMBC)
внутримолекулярной циклизацией аддукта.
(табл. 2). Соединение 7 также было получено с вы-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И АМИНОМЕТИЛИРОВАНИЕ
851
Схема 4.
NH2
NH2
O
пиперидин
CN
CN
AcOH, PhH
CN
CN
CN
CN
1
6
NH2
NH
CN
CN
NH2
NH2
CN
CN
7
Схема 5.
NC
CN
X = S, Se
H2N
N
X
H
NHMMH
RNH2, HCHO
8
EtOH, ∆
X
NC
31-82%
N
N
N
R
R
R = Me, Bn, Ar
N
NC
NC
CN
10
H2N
N
O
H
9
ходом 54% реакцией малононитрила с циклогек-
При аминометилировании соединения 5 в ана-
силиденмалононитрилом [36]. Вследствие этого
логичных условиях (избыток НСНО, 2 экв. пер-
результаты работ [33-35], касающиеся строения и
вичного амина, кипячение в спирте) с использо-
превращений соединения 6 и полинитрилов ана-
ванием различных спиртов (EtOH, i-PrOH или
логичного строения, нуждаются в пересмотре.
n-BuOH) в качестве растворителей нами были
Наличие в структуре азаспирана 5 нескольких
получены ранее не описанные производные 2-(ди-
активных электрофильных центров делает эту мо-
цианометилен)-3,7-диазаспиро[бицикло[3.3.1]-
лекулу перспективным объектом для проведения
нон-3-ен-9,1ʹ-циклогексан]-1,5-дикарбонитрила
реакций аминометилирования [37]. Ранее нами
11-13 с выходами 32-53% (при использовании
было показано [38-40], что из структурных ана-
алифатических аминов) и 74-82% (в случае реак-
логов соединения 5 - спиросочлененных 1,4-ди-
ции с ароматическими аминами) (cхема 6). Инте-
гидропиридинов 8 и азаспирана 9 - в условиях
ресно отметить, что вне зависимости от природы
реакции Манниха образуются трициклические со-
используемых аминов и растворителей ожидаемо-
единения 10 с выходами 31-82% (схема 5).
го замыкания 1,3,5-триазинового цикла не проис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
852
КУРСКОВА и др.
Схема 6.
NC
CN
CN
RNH2, HCHO
CN
NC
CN
EtOH, ∆
HN
N
N
H
N
CN
R
5
NC
N OEt
H
MeNH2, HCHO
11а-г
R = Et, i-Pr
ROH, ∆
CN
CN
MeNH2, HCHO
NC
CN
N
BuOH, ∆
NC
Me
NH
N
N
N
NC
CN
Me
NC
N OBu
N
H
RO
Me
12a, б
13 (30%)
R = Pr (11a, 41%), i-Bu (11б, 32%), Ph (11в, 82%), 4-MeC6H4 (11г, 74%), Et (12a, 53%), i-Pr (12б, 45%).
ходит. По нашему мнению, возможной причиной
Строение полученных соединений доказано
этого может служить сильное электроноакцептор-
с привлечением методов спектроскопии ЯМР на
ное действие дицианометиленового фрагмента и,
ядрах 1Н и 13С (DEPTQ, 1H-13C HSQC, 1H-13C
как следствие, пониженная нуклеофильность со-
HMBC, 1H-15N HSQC) (табл. 3-5), ИК спектроско-
пряженного эндоциклического атома азота.
пии. Помимо этого, строение соединений 11a, г и
Таблица 3. Основные корреляции в HSQC и HMBC 1H-13C 2D ЯМР спектрах соединения 11a
δС, м. д.
δH, м. д.
1H-13C HSQC
1H-13C HMBC
0.70 т (Ме, Pr)
10.9 (Me Pr)
19.0*** (МеСН2, Pr), 55.9*** (NCH2, Pr)
1.10 т (МеСН2О)
15.0 (МеСН2О)
64.5*** (МеСН2О)
1.29 м (МеСН2, Pr)
19.0*** (МеСН2, Pr)
10.9 (Me, Pr), 55.9*** (NCH2, Pr)
1.37-1.96 м (циклогексан)
20.2***, 20.7***, 23.7***, 26.9***,
20.2***, 20.7***, 23.7***, 26.9***, 32.3*** (5CH2,
32.3*** (5CH2, циклогексан)
циклогексан), 39.5*** (С, циклогексан)
2.23 м (циклогексан)
26.9*** (CH2, циклогексан)
39.5*** (С, циклогексан)
2.40 м (NCH2, Pr)
55.9*** (NCH2, Pr)
10.9 (Me, Pr), 19.0*** (МеСН2, Pr), 53.1*** (С8Н2)
2.89 д (С6Н)
52.5*** (С6Н2)
39.5*** (С, циклогексан), 47.3*** (С5), 53.1***
(С8Н2), 116.2*** (C5C≡N)
2.94 д (С8Н)
53.1*** (С8Н2)
39.5*** (С, циклогексан), 46.5*** (С1), 52.5***
(С6Н2), 117.2*** (C1C≡N)
3.18 д (С6Н)
52.5*** (С6Н2)
169.7*** (C4)
3.27 д (С8Н)
53.1*** (С8Н2)
161.5*** (C2)
3.53 к (МеСН2О)
64.5*** (МеСН2О)
15.0 (МеСН2О), 71.7*** (OCH2N)
4.94 уш. с (OCH2N)
71.7*** (OCH2N)
64.5*** (МеСН2О), 161.5*** (C2)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И АМИНОМЕТИЛИРОВАНИЕ
853
Таблица 4. Основные корреляции в HSQC и HMBC 1H-13C и 1H-15N 2D ЯМР спектрах соединения 11б
δС, м. д.
δN, м. д.
δH, м. д.
1
H-15N HSQC
H-13C HSQC
1H-13C HMBC
0.70 т (Ме, i-Bu)
20.1***, 20.4*** (2Ме, i-Bu)
20.1*** (Ме, i-Bu), 25.8***
-
(СН, i-Bu), 62.6 (СН2, i-Bu)
1.10 т (МеСН2О)
15.5*** (МеСН2О)
64.9 (МеСН2О)
-
1.37-2.13 м (циклогексан)
20.7, 21.2, 24.2, 27.3, 32.8
20.7, 21.2, 24.2, 27.3, 32.8
-
(5CH2, циклогексан)
(5CH2, циклогексан), 39.5 (С,
циклогексан)
1.59 м (СН,
25.8*** (СН, i-Bu)
20.1*** (Ме, i-Bu), 62.6 (СН2,
-
i-Bu)
i-Bu)
2.20 м (СН2, i-Bu)
62.6 (СН2, i-Bu)
20.1*** (Ме, i-Bu), 25.8***
-
(СН, i-Bu), 53.4 (С6Н2), 54.2
(С8Н2)
2.25 м (циклогексан)
27.3 (CH2, циклогексан)
20.7, 24.2 (2CH2, циклогексан)
-
2.87 д (С6Н)
53.4 (С6Н2)
39.5 (С, циклогексан), 47.8 (С5),
-
54.2 (С8Н2), 116.6 (C5C≡N),
170.3 (C4)
2.92 д (С8Н)
54.2 (С8Н2)
39.5 (С, циклогексан), 46.9 (С1),
-
53.4 (С6Н2), 117.6 (C1C≡N),
161.9 (C2)
3.21 д (С6Н)
53.4 (С6Н2)
170.3 (C4)
-
3.30 д (С8Н)
54.2 (С8Н2)
161.9 (C2)
-
3.54 к (МеСН2О)
64.9 (МеСН2О)
15.5*** (МеСН2О), 72.1
-
(OCH2NH)
4.94 уш. с (OCH2N)
72.1 (OCH2NH)
64.9 (МеСН2О), 161.9 (C2)
-
9.99 уш. с (NH)
-
-
138.2 (NH)
Таблица 5. Основные корреляции в HSQC и HMBC 1H-13C 2D ЯМР спектрах соединения 11г
δС, м. д.
δH, м. д.
1H-13C HSQC
1H-13C HMBC
0.99 т (МеСН2О)
14.9*** (МеСН2О)
64.6 (МеСН2О)
20.3, 20.7, 23.7, 26.7, 32.4 (5CH2,
20.3, 20.7, 23.7, 26.7, 32.4 (5CH2, циклогексан),
1.22-2.07 м (циклогексан)
циклогексан)
39.8 (С, циклогексан), 46.9 (С5)
2.19 с (Ме, Ar)
20.1*** (Ме, Ar)
129.7*** (С3Н, С5Н, Ar), 145.3 (С4, Ar)
20.3 (CH2, циклогексан), 39.8 (С, циклогексан),
2.36 м (циклогексан)
26.7 (CH2, циклогексан)
46.4 (С1)
3.43 м (МеСН2О)
64.6 (МеСН2О)
14.9*** (МеСН2О), 71.8 (OCH2N)
39.8 (С, циклогексан), 46.9 (С5), 50.9 (С8Н2), 116.0
3.66 д (С6Н)
50.7 (С6Н2)
(C5C≡N), 130.4 (С1, Ar), 168.5 (C4)
39.8 (С, циклогексан), 46.4 (С1), 50.7 (С6Н2), 116.8
3.80 д (С8Н)
50.9 (С8Н2)
(C1C≡N), 130.4 (С1 Ar), 161.1 (C2)
3.91 д (С6Н)
50.7 (С6Н2)
39.8 (С, циклогексан), 46.9 (С5), 168.5 (C4)
3.95 д (С8Н)
50.9 (С8Н2)
39.8 (С, циклогексан), 46.4 (С1), 161.1 (C2)
4.92 к (OCH2N)
71.8 (OCH2N)
64.6 (МеСН2О), 161.1 (C2)
117.1*** (С2Н, С6Н, Ar), 129.7*** (С3Н, С5Н, Ar),
6.77 д (С2Н, С6Н, Ar)
117.1*** (С2Н, С6Н, Ar)
130.4 (С1, Ar), 145.3 (С4, Ar)
20.1*** (Ме, Ar), 117.1*** (С2Н, С6Н, Ar), 129.7***
7.07 д (С3Н, С5Н Ar)
129.7*** (С3Н, С5Н, Ar)
(С3Н, С5Н, Ar), 130.4 (С1, Ar), 145.3 (С4, Ar)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
854
КУРСКОВА и др.
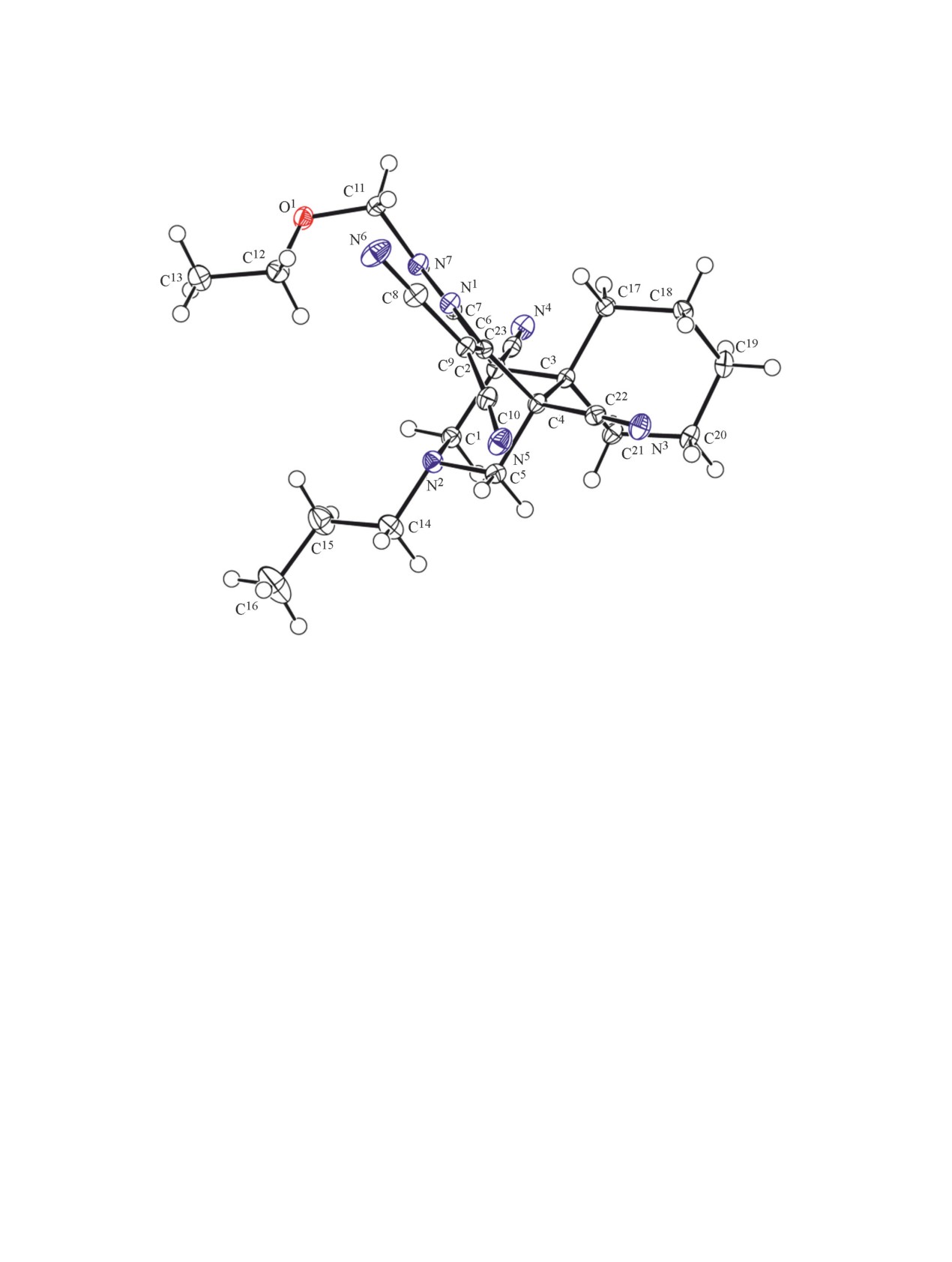
Рис. 1. Общий вид молекулы соединения 11a. Тепловые эллипсоиды неводородных атомов показаны на уровне 50%-ной
вероятности нахождения атома.
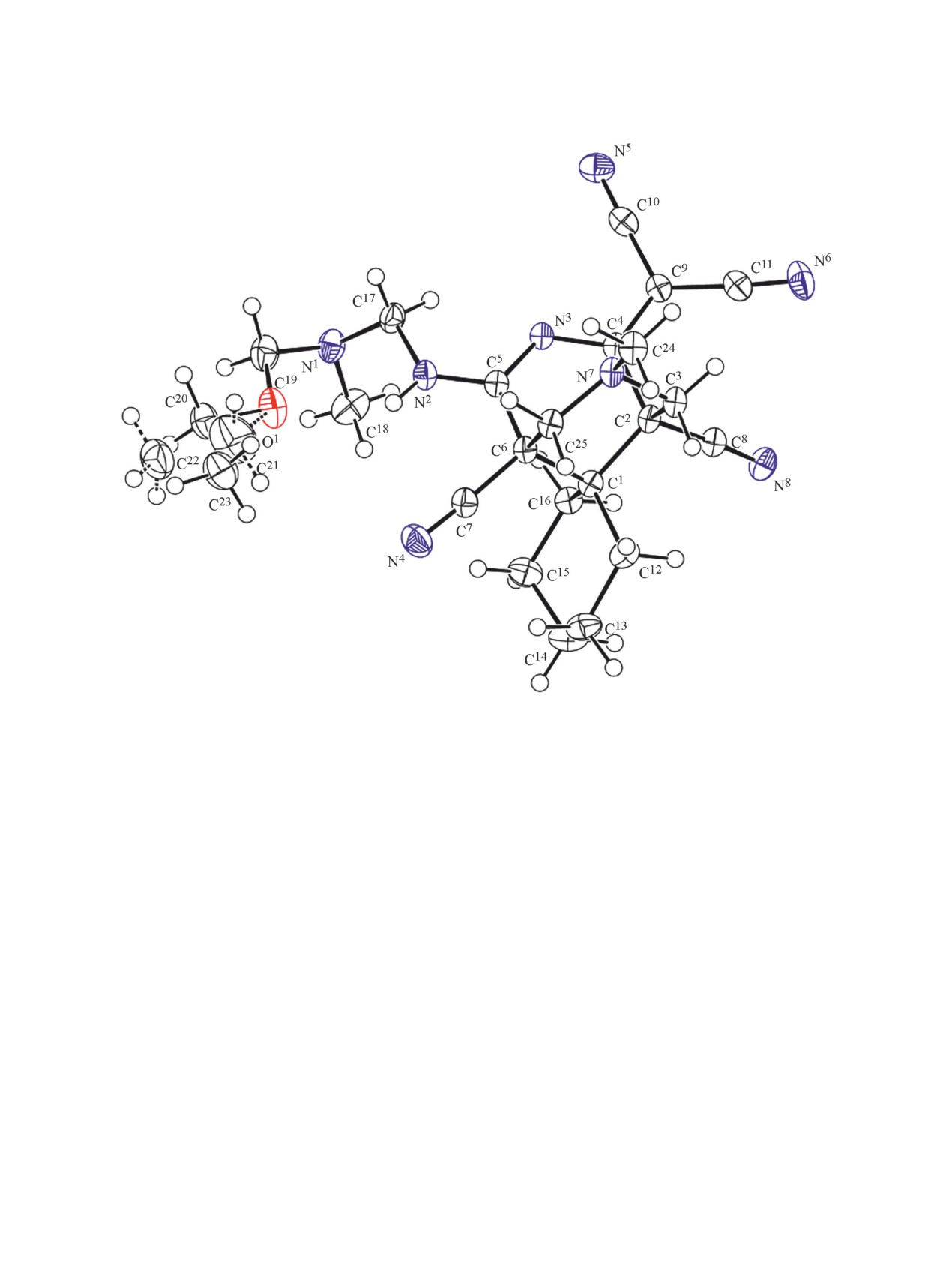
12a, б было изучено с привлечением метода рент-
ров. Показано, что вопреки литературным дан-
геноструктурного анализа (рис. 1, 2). В отличие от
ным, продукт конденсации циклогексанона с ди-
соединения 5, производные 11-13 как в кристалли-
мером малононитрила по Кнёвенагелю не удается
ческом виде, так и в растворах ДМСО существуют
выделить, поскольку он претерпевает дальнейшую
в виде единственной таутомерной формы.
циклизацию по Торпу-Циглеру с образованием
2,4-диамино-5,6,7,8-тетрагидронафталин-1,3-ди-
Таким образом, установлено, что при по-
карбонитрила.
следовательной
обработке
циклогексанона
малононитрилом,
а затем димером малоно-
В результате изучения реакции Манниха с
нитрила в присутствии сильных оснований образу-
первичными аминами и избытком НСНО в раз-
ется4-имино-2-(дицианометилен)-3-азаспиро[5.5]-
личных спиртах установлено, что
4-имино-2-
ундекан-1,5-дикарбонитрил. На основании дан-
(дицианометилен)-3-азаспиро[5.5]ундекан-1,5-ди-
ных спектроскопии ЯМР установлено, что сое-
карбонитрил подвергается аминометилированию
динение существует в виде смеси двух основных
по положениям С1 и С5 с формированием диаза-
таутомерных форм
-
4-имино-2-(дицианомети-
бицикло[3.3.1]нон-3-еновой системы. При этом,
лен)-3-азаспиро[5.5]ундекан-1,5-дикарбонитрила
вопреки ожиданиям, параллельного замыкания
и
2-амино-4-(дицианометилен)-3-азаспиро[5.5]-
1,3,5-триазинового цикла не происходит - реакция
ундец-2-ен-1,5-дикарбонитрила, при этом каждая
останавливается на стадии алкоксиметилирования
из форм представляет собой набор диастереоме-
экзоциклического атома азота. При использовании
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И АМИНОМЕТИЛИРОВАНИЕ
855
Рис. 2. Общий вид молекулы соединения 12a. Тепловые эллипсоиды неводородных атомов показаны на уровне 50%-ной
вероятности нахождения атома.
метиламина в ряде случаев наблюдалось образо-
пластинах Silufol UV254, элюент ацетон-гексан
вание более сложных продуктов (алкоксиметил)-
(1:1), проявитель - пары иода, УФ детектор. Тем-
аминометилирования.
пературы плавления определяли на столике Ко-
флера и не корректировали.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Димер малононитрила 1 получали по методу
Спектры ЯМР записывали на спектрометре
Миттельбаха [41].
Bruker DPX-400 [400.40 MГц (1Н), 100.63 (13С),
4-Имино-2-(дицианометилен)-3-азаспи-
40.55 (15N)] в ДМСО-d6 или CDCl3. Внутренний
ро[5.5]ундекан-1,5-дикарбонитрил (5). а. К рас-
стандарт - ТМС или остаточные сигналы раство-
твору 0.64 г (11.3 ммоль) KОН в 20 мл 96%-ного
рителя. ИК спектры регистрировали на ИК Фурье-
этанола добавляли 1.00 г (7.5 ммоль) димера ма-
спектрометрах Bruker Vertex
70 с приставкой
лононитрила 1. Смесь перемешивали при 40°С
НПВО на кристалле алмаза и Shimadzu IR Affinity-
до полного растворения исходных реагентов. Па-
1S с приставкой НПВО (ZnSe призма) (для со-
раллельно в другом реакционном сосуде к рас-
единения 7). Элементный анализ проводили на
твору 0.32 г (5.7 ммоль) KОН в 15 мл 96%-ного
C,H,N-анализаторе Carlo Erba 1106, погрешность
этанола добавляли 0.78 мл (7.5 ммоль) циклогек-
измерения ±0.4%. Контроль за чистотой получен-
санона и 0.75 г (11.3 ммоль) малононитрила, по-
ных соединений осуществляли методом ТСХ на
лученную смесь перемешивали 10 мин при 20°С.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
856
КУРСКОВА и др.
Далее содержимое обеих сосудов смешивали и
цвета, т. пл. 182-183°С (т. пл. 161°С [33], 181°С
перемешивали 2 ч. К полученному осадку жел-
[36]). ИК спектр, ν, см-1: 1623 ср (C=C), 2200 cр
то-лимонного цвета добавляли 40 мл воды до
(2C≡N), 2938 ш (CH), 3259 ш, 3367 ср, 3459 ш (2
полного растворения. Далее реакционную массу
NH2). Спектр ЯМР 1Н, δ, м. д.: 1.63-1.67 м (4Н,
обрабатывали конц. HCl до рН 3-4. Образовав-
C6H2 и C7H2), 2.21-2.22 м (2Н, C5H2), 2.58-2.59 м
шийся осадок через 12 ч отфильтровывали, про-
(2Н, C8H2), 5.90 уш. с (2Н, C2NH2), 6.31 уш. c (2Н,
мывали холодным этанолом, сушили 3 ч при 60°С.
C4NH2). Спектр ЯМР 13C (DEPTQ), δС, м. д.: 21.5
Поученный продукт представляет собой смесь
(C7), 21.7 (C6), 23.0 (C5), 28.7 (C8), 77.5 (C3), 82.5
(C1), 110.7 (C4a), 116.0 (C≡N), 117.3 (C≡N), 144.7
4-имино-2-(дицианометилен)-3-азаспиро[5.5]-
(C8a), 152.2 (C2), 153.1 (C4). Найдено, %: 67.70; Н
ундекан-1,5-дикарбонитрила
5А и таутомерно-
5.42; N 26.22. C12H12N4. Вычислено, %: С 67.90; Н
го
2-амино-4-(дицианометилен)-3-азаспиро[5.5]
5.70; N 26.40. М 212.3.
ундек-2-ен-1,5-дикарбонитрила 5В. Выход 66%,
лимонно-желтый мелкокристаллический поро-
Производные 2-(дицианометилен)-3,7-диаза-
шок, т. пл. 239-241°С (т. пл. 234-236°С [3]). ИК
спиро[бицикло[3.3.1]нон-3-ен-9,1ʹ-циклогек-
спектр, ν, см-1: 2198 ш, 2220 ш (4 C≡N), 3315
сан]-1,5-дикарбонитрила 11-13 (общая методи-
ш, 3357 ш, 3478 ш (2NH, NH2). Спектр ЯМР 1Н
ка). Смесь 0.56 г (2 ммоль) соединения 5, 4 ммоль
(ДМСО-d6), δ, м. д. (для удобства описания нуме-
соответствующего первичного амина и избыток
рация атомов углерода указана по таутомеру 5В):
(3-4 мл) 37%-ного формалина в 20 мл соответству-
ющего спирта (этанола, изопропанола или бутано-
1.17-2.01 м (10Н, СН2, циклогексан), 4.10 с (1Н,
ла) кипятили в течение 1-5 мин до полной гомоге-
С5Н*), 4.25 уш. с (2Н, С5Н**; 1Н, С5Н*), 4.35 с и
низации. Полученный раствор фильтровали через
4.38 с (2Н, С1Н**), 4.49 с и 4.77 с (2Н, С1Н*), 6.54
бумажный фильтр и выдерживали 24 ч при 20°С.
уш. с (1Н, N3H**), 7.32 c (1H, N3H*), 9.49 c (1H,
Осадок отфильтровывали, промывали этанолом и
NH2*), 9.52 c (1H, NH2**), 10.02 c (1H, NH2*), 10.08
сушили 3 ч при 60°С.
(1H, NH2**). Сигналы водорода иминогруппы та-
утомера 5А не проявляются, вероятно, вследствие
7-Пропил-4-(дицианометилен)-2-[(этокси-
дейтерообмена. Соотношение таутомеров 5А и 5В
метил)амино]-3,7-диазаспиро[бицикло[3.3.1]-
~ 1:1, их диастереомеров - 3:1. Спектр ЯМР 13С
нон-3-ен-9,1ʹ-циклогексан]-1,5-дикарбонитрил
DEPTQ (ДМСО-d6), δС, м. д. (наблюдаются сиг-
(11a). Выход
41%, желтый мелкокристалличе-
ский порошок, т. пл. 181-183°С. ИК спектр, ν,
налы только основных диастереомеров): 20.1 и
см-1: 2226 ш, 2250 ш (C≡N), 3330 ш, 3500 ш (NH).
20.6, 20.8 и 21.6, 24.2 и 24.5, 31.7 и 32.2, 32.8 и 33.3
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.70 т (3Н, Ме,
(5СН2 циклогексан), 32.0*** (С1), 35.3 и 35.5 (С
Pr, 3JHH 7.3 Гц), 1.10 т (3Н, МеСН2О, 3JHH 7.0 Гц),
циклогексан), 36.7*** (С5), 63.0 [С(С≡N)2], 113.7,
1.29 м (2Н, МеСН2, Pr), 1.37-1.96 м (9Н, циклогек-
114.1 [C(C≡N)2], 113.8 (C1C≡N), 114.3 (C5C≡N),
сан), 2.23 м (1Н, циклогексан), 2.40 м (2Н, NCH2,
157.7 (C4), 161.5 и 168.2 (С2). Найдено, %: С 64.58;
Pr), 2.89 д (1Н, С6Н, 2JHH 11.7 Гц), 2.94 д (1Н, С8Н,
H 4.96; N 29.99. C15H14N6. Вычислено, %: C 64.73;
2JHH 12.0 Гц), 3.18 д (1Н, С6Н, 2JHH 11.7 Гц), 3.27 д
H 5.07; N 30.20. M 278.3.
(1Н, С8Н, 2JHH 12.0 Гц), 3.53 к (2Н, МеСН2О, 3JHH
б. Синтез проводят аналогично способу а с теми
7.0 Гц), 4.94 уш. с (2Н, OCH2N), 10.00 уш. с (1Н,
же загрузками, только с использованием абсолю-
NH). Спектр ЯМР 13С (DEPTQ) (ДМСО-d6), δС,
тированного этанола, 0.26 г (11.3 ммоль) натрия
м. д.: 10.9 (Me, Pr), 15.0 (МеСН2О), 19.0*** (МеСН2,
и 0.13 г (5.7 ммоль) натрия. Выход 74%, продукт
Pr), 20.2***, 20.7***, 23.7***, 26.9***, 32.3***
идентичен образцу, полученному по способу а.
(5CH2, циклогексан), 39.5*** (C, циклогексан),
2,4-Диамино-5,6,7,8-тетрагидронафталин-
46.5*** (С1), 47.3*** (С5), 52.5*** (С6Н2), 53.1***
1,3-дикарбонитрил (7) получали по методике
(С8Н2), 55.9*** (NCH2 Pr), 64.5*** [наложение
[33] для
2-амино-3-циклогексилиден-1,1,3-три-
сигналов МеСН2О и C(C≡N)2], 71.7*** (OCH2N),
цианопрорп-1-ена
5б (кипячение в бензоле в
113.5***, 114.4*** [C(C≡N)2], 116.2*** (C5C≡N),
присутствии пиперидина и АсОН в течение 6 ч с
117.2*** (C1C≡N), 161.5*** (C2), 169.7*** (C4).
насадкой Дина-Старка). Выход 40%, мелкокри-
Найдено, %: С 65.59; H 6.84; N 23.18. C23H29N7O.
сталлический порошок вишнево-коричневого
Вычислено, %: C 65.85; H 6.97; N 23.37. M 419.5.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И АМИНОМЕТИЛИРОВАНИЕ
857
7-Изобутил-4-дицианометилен-2-[(этокси-
7-(4-Метилфенил)-4-дицианометилен-2-
метил)амино]диазаспиро[бицикло[3.3.1]-
[(этоксиметил)амино]-3,7-диазаспиро[бици-
нон-3-ен-9,1ʹ-циклогексан]-1,5-дикарбонитрил
кло[3.3.1]нон-3-ен-9,1ʹ-циклогексан]-1,5-ди-
(11б). Выход
32%, желтый мелкокристалличе-
карбонитрил (11г). Выход 74%, желтый мелко-
ский порошок, т. пл. 178-180°С. ИК спектр, ν,
кристаллический порошок, т. пл. 177-179°С. ИК
см-1: 2223 ш, 2245 ш (C≡N), 3330 ш, 3495 ш (NH).
спектр, ν, см-1: 2202 ш, 2220 ш (C≡N), 3270–3345
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.70 т (6Н,
ш, 3495 ш (NH). Спектр ЯМР 1Н (ДМСО-d6), δ,
Ме, i-Bu, 3JHH 6.4 Гц), 1.10 т (3Н, МеСН2О, 3JHH
м. д.: 0.99 т (3Н, МеСН2О, 3JHH 7.0 Гц), 1.22-2.07
7.0 Гц), 1.37-2.13 м (9Н, циклогексан; 1H, СН,
м (9Н, циклогексан), 2.19 с (3Н, Ме, Ar), 2.36 м
i-Bu), 2.20 м (2Н, СН2, i-Bu), 2.25 м (1Н, циклогек-
(1Н, циклогексан), 3.43 м (МеСН2О), 3.66 д (1Н,
сан), 2.87 д (1Н, С6Н, 2JHH 11.9 Гц), 2.92 д (1Н, С8Н,
С6Н, 2JHH 12.7 Гц), 3.80 д (1Н, С8Н, 2JHH 13.0 Гц),
2JHH 11.9 Гц), 3.21 д (1Н, С6Н, 2JHH 11.9 Гц), 3.30 д
3.91 д (1Н, С6Н, 2JHH 12.7 Гц), 3.95 д (1Н, С8Н, 2JHH
(1Н, С8Н, 2JHH 11.9 Гц), 3.54 к (2Н, МеСН2О, 3JHH
13.0 Гц), 4.92 к (2Н, OCH2N, 3JHH 9.9 Гц), 6.77 д
7.0 Гц), 4.94 уш. с (2Н, OCH2N), 9.99 уш. с (1H,
(2Н, С2Н, С6Н Ar, 3JHH 8.3 Гц), 7.07 д (2Н, С3Н,
NH). Спектр ЯМР 13С (DEPTQ) (ДМСО-d6), δС,
С5Н, Ar, 3JHH 8.3 Гц), 10.07 уш. с (1Н, NH). Спектр
м. д.: 15.5*** (МеСН2О), 20.1***, 20.4*** (2Ме,
ЯМР 13С (DEPTQ) (ДМСО-d6), δС, м. д.: 14.9***
i-Bu), 20.7, 21.2, 24.2 (3CH2, циклогексан), 25.8***
(МеСН2О), 20.1*** (Ме, Ar), 20.3, 20.7, 23.7, 26.7,
(СН, i-Bu), 27.3, 32.8 (2CH2, циклогексан), 39.5 (С,
32.4 (5CH2, циклогексан), 39.8 (С, циклогексан),
циклогексан), 46.9 (С1), 47.8 (С5), 53.4 (С6Н2), 54.2
46.4 (С1), 46.9 (С5), 50.7 (С6Н2), 50.9 (С8Н2), 64.6
(С8Н2), 62.6 (СН2, i-Bu), 64.9 [наложение сигналов
[наложение сигналов МеСН2О и C(C≡N)2], 71.8
МеСН2О и C(C≡N)2], 72.1 (OCH2NH), 113.9, 114.7
(OCH2N), 113.4, 114.2 [C(C≡N)2], 116.0 (C5C≡N),
[C(C≡N)2], 116.6 (C5C≡N), 117.6 (C1C≡N), 161.9
116.8 (C1C≡N), 117.1*** (С2Н, С6Н Ar), 129.7***
(C2), 170.3 (C4). Найдено, %: С 66.28; H 7.12; N
(С3Н, С5Н Ar), 130.4 (С1, Ar), 145.3 (С4, Ar), 161.1
22.30. C24H31N7O. Вычислено, %: C 66.49; H 7.21;
(C2), 168.5 (C4). Найдено, %: С 69.09; H 5.99; N
N 22.61. М 433.6.
20.73. C27H29N7O. Вычислено, %: C 69.36; H 6.25;
7-Фенил-4-дицианометилен-2-[(этоксиме-
N 20.97. M 467.6.
тил)амино]-3,7-диазаспиро[бицикло[3.3.1]-
7-Mетил-4-дицианометилен-2-({[(этокси-
нон-3-ен-9,1ʹ-циклогексан]-1,5-дикарбонитрил
метил)(метил)амино]метил}амино)-3,7-диа-
(11в). Выход 82%, желтый мелкокристаллический
заспиро[бицикло[3.3.1]нон-3-ен-9,1ʹ-цикло-
порошок, т. пл. 193-195°С. ИК спектр, ν, см-1: 2183
гексан]-1,5-дикарбонитрил (12a). Выход 53%,
ср, 2200 ш, 2223 ш (C≡N), 3480 ш (NH). Спектр
желтый мелкокристаллический порошок, т. пл.
ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.97 т (3Н, МеСН2О,
133-135°С. ИК спектр, ν, см-1: 2190 сл, 2218 ш
3JHH 7.0 Гц), 1.13-2.13 м (9Н, циклогексан), 2.36
(C≡N), 3330 ш (NH). Спектр ЯМР 1Н (ДМСО-d6),
м (1Н, циклогексан), 3.43 к (2Н, МеСН2О, 3JHH
δ, м. д.: 1.04 т (3Н, МеСН2О, 3JHH 7.0 Гц), 1.37-
7.0 Гц), 3.78 д (1Н, С6Н, 2JHH 12.6 Гц), 3.90 д (1Н,
1.97 м (9Н, циклогексан), 2.25 м (3Н, MeN7; 1Н,
С8Н, 2JHH 13.1 Гц), 3.95 д (1Н, С6Н, 2JHH 12.6 Гц),
циклогексан), 2.88 д (1Н, С6Н, 2JHH 11.6 Гц), 2.89
4.00 д (1Н, С8Н, 2JHH 13.1 Гц), 4.90 к (2Н, OCH2N,
д (1Н, С8Н, 2JHH 12.0 Гц), 3.13 д (1Н, С6Н, 2JHH
3JHH 9.9 Гц), 6.88 м (3Н, Ph), 7.26 м (2Н, Ph),
11.6 Гц), 3.19 д (1Н, С8Н, 2JHH 12.0 Гц), 3.32 с
10.07 уш. с (1Н, NH). Спектр ЯМР 13С (DEPTQ)
(MeN), 3.42 к (2Н, МеСН2О, 3JHH 7.0 Гц), 4.35-4.62
(ДМСО-d6), δС, м. д.: 14.9*** (МеСН2О), 20.3,
м (2Н, NCH2N), 4.90-5.22 м (2H, OCH2N), 9.81 м
20.7, 23.7, 26.6,
32.5
(5CH2, циклогексан), 39.8
(С, циклогексан), 46.3 (С1), 46.8 (С5), 50.2 (С6Н2),
(1Н, NH). Спектр ЯМР 13С (DEPTQ) (ДМСО-d6),
50.6 (С8Н2), 64.6 [наложение сигналов МеСН2О и
δС, м. д.: 15.1*** (МеСН2О), 20.2, 20.7, 23.7, 26.9,
C(C≡N)2], 71.8 (OCH2N), 113.4, 114.2 [C(C≡N)2],
32.2 (5CH2, циклогексан), 39.4*** (С, циклогек-
116.0 (C5C≡N), 116.9 (C1C≡N), 117.4*** (2CH, Ph),
сан), 40.6*** (MeN), 43.1*** (MeN7), 46.5 (С1),
121.7*** (2CH, Ph), 129.3*** (C4H, Ph), 147.5 (C1,
47.1 (С5), 54.5 (С6Н2), 56.0 (С8Н2), 64.4 (МеСН2О),
Ph), 161.1 (C2), 168.4 (C4). Найдено, %: С 68.58; H
66.2 [C(CN)2], 69.1 (NCH2N), 71.8 (OCH2N), 113.4,
5.86; N 21.41. C26H27N7O. Вычислено, %: C 68.85;
114.5 [C(C≡N)2], 116.1 (C5C≡N), 117.2 (C1C≡N),
H 6.00; N 21.62. M 453.55.
161.3 (C2), 169.1 (C4). Найдено, %: С 63.23; H 6.79;
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
858
КУРСКОВА и др.
N 25.55. C23H30N8O (M 434.6). Вычислено, %: C
Основные характеристики эксперимента и па-
63.57; H 6.96; N 25.79.
раметры элементарной ячейки соединения 11a
(C23H29N7O, CCDC 2073621):
0.277
× 0.226 ×
2-({[(Изопропоксиметил)(метил)амино]ме-
0.168 мм, кристаллическая система тетрагональ-
тил}амино)-7-метил-4-дицианометилен-3,7-ди-
ная, пространственная группа P42/n, M 419.53; па-
азаспиро[бицикло[3.3.1]нон-3-ен-9,1ʹ-цикло-
раметры ячейки: а 22.26971(11), с 8.82328(8) Å, T
гексан]-1,5-дикарбонитрил (12б). Выход 45%,
100.00(10) K, V 4375.82(6) Å3, Z 8; dвыч 1.274 г/см3,
желтый мелкокристаллический порошок, т. пл.
μ(CuKα) 0.658 мм-1, F(000) 1792.0; область углов
170-172°С. ИК спектр, ν, см-1: 2205 ш, 2220 ш
съемки θ 7.94-152.75°; интервалы индексов отра-
(C≡N), 3320 ш (NH). Из-за низкой растворимости
жений: -28 ≤ h ≤ 27, -27 ≤ k ≤ 28, -7 ≤ l ≤ 11; число
соединения 12б в ДМСО и хлороформе не удалось
измеренных отражений 24012, число независимых
получить качественные спектры ЯМР 1Н и 13С и
отражений 4531 [Rint 0.0215, Rsigma 0.0145], чис-
провести отнесение всех сигналов. Найдено, %: С
ло отражений с I > 2σ(I) 4531, число уточняемых
63.98; H 6.98; N 24.72. C24H32N8O. Вычислено, %:
параметров 286; R-фактор [I ≥ 2σ(I)]: R1 0.0362,
C 64.26; H 7.19; N 24.98. M 448.6.
wR2 0.0960, R-фактор по всем отражениям: R1
2-[(Бутоксиметил)амино]-7-метил-4-(дици-
0.0403, wR2 0.1013; GOOF по F2 1.055; Δρmax/Δρmin
анометилен)-3,7-диазаспиро[бицикло[3.3.1]-
0.25/-0.28 е/Å3.
нон-3-ен-9,1ʹ-циклогексан]-1,5-дикарбони-
Основные характеристики эксперимента и па-
трил (13). Выход 30%, желтый мелкокристалли-
раметры элементарной ячейки соединения 11г
ческий порошок, т. пл. 205-207°С. ИК спектр, ν,
(C27H29N7O, CCDC 2073619):
0.452
× 0.174 ×
см-1: 2183 ср, 2200 ш, 2223 ш (C≡N), 3480 ш (NH).
0.115 мм, кристаллическая система тетрагональ-
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 0.85 т (3Н, Ме,
ная, пространственная группа P42/n, M 467.05;
Bu, 3JHH 7.3 Гц), 1.24-1.99 м (9Н, циклогексан; 4H,
параметры ячейки: а 23.5325(2), с 8.81620(10) Å,
CН2, Bu), 2.24 (1Н, циклогексан), 2.26 c (3H, MeN),
T 293(2) K, V 4882.22(10) Å3, Z 8, dвыч 1.271 г/см3,
2.87 д (1Н, С6Н, 2JHH 11.7 Гц), 2.89 д (1Н, С8Н,
μ(CuKα) 0.649 мм-1, F(000) 1982.0, область углов
съемки θ 7.514-152.494°; интервалы индексов от-
2JHH 11.8 Гц), 3.14 д (1Н, С6Н, 2JHH 11.7 Гц), 3.20
ражений: -29 ≤ h ≤ 29, -29 ≤ k ≤ 29, -7 ≤ l ≤ 10;
(1Н, С8Н, 2JHH 11.8 Гц), 3.49 т (2Н, ОСН2, Bu, 3JHH
число измеренных отражений 28841, число не-
6.5 Гц), 4.95 к (2Н, OCH2N, 3JHH 9.7 Гц), 10.06 уш.
зависимых отражений
5064
[Rint 0.0218, Rsigma
с (1Н, NH). Спектр ЯМР 13С (DEPTQ) (ДМСО-d6),
0.0129], число отражений с I > 2σ(I) 5064, число
δС, м. д.: 13.5*** (Ме, Bu), 18.7 (СН2, Bu), 20.2, 20.7,
уточняемых параметров 385, R-фактор [I ≥ 2σ(I)]:
23.7, 26.8 (4CH2, циклогексан), 31.0 (СН2, Bu), 32.1
R1 0.0565, wR2 0.1611, R-фактор по всем отраже-
(CH2, циклогексан), 39.2 (С, циклогексан), 43.0***
ниям: R1 0.0611, wR2 0.1657, GOOF по F2 1.055,
(MeN), 46.3 (С1), 47.2 (С5), 54.5 (наложение сиг-
Δρmax/Δρmin 0.36/-0.22 е/Å3.
налов С6Н2 и С8Н2), 60.3 [C(C≡N)2], 68.6 (OCH2,
Основные характеристики эксперимента и
Bu), 71.9 (OCH2N), 113.4, 114.4 [C(C≡N)2], 116.1
параметры элементарной ячейки соединения
(C5C≡N), 117.1 (C1C≡N), 161.3 (C2), 169.1 (C4).
12a (C23H30N8O, CCDC 2073622): 0.423 × 0.21 ×
Найдено, %: С 65.55; H 6.75; N 23.13. C23H29N7O.
0.181 мм, кристаллическая система триклинная,
Вычислено, %: C 65.85; H 6.97; N 23.37. M 419.5.
пространственная группа P-1, M 434.55; параметры
Рентгеноструктурный анализ выполнен на
ячейки: а 8.3571(3), b 11.0756(4), с 13.7015(4) Å,
автоматическом четырехкружном дифрактоме-
α 69.553(3), β 80.697(3), γ 76.869(3)°, T 100.00(10) K,
тре Agilent Super Nova, Dual, Cu at zero, Atlas S2
V 1152.52(7) Å3, Z 2, dвыч 1.252 г/см3, μ(CuKα)
при 100.00(10) K. Структура расшифрована пря-
0.655 мм-1, F(000) 464.0, область углов съемки θ
мым методом в комплексе программ Olex2 [42]
6.914-152.49°; интервалы индексов отражений:
и ShelXD [43], и уточнена с помощью пакета
-10 ≤ h ≤ 8, -13 ≤ k ≤ 13, -17 ≤ l ≤ 17; число из-
SHELXL [44]. Структура уточнена полноматрич-
меренных отражений 22788, число независимых
ным МНК в анизотропном приближении для нево-
отражений 4780 [Rint 0.0540, Rsigma 0.0288], чис-
дородных атомов по F2.
ло отражений с I > 2σ(I) 4780, число уточняемых
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И АМИНОМЕТИЛИРОВАНИЕ
859
параметров 317, R-фактор [I ≥ 2σ(I)]: R1 0.0555,
материалов» Кубанского государственного уни-
wR2 0.1521, R-фактор по всем отражениям: R1
верситета.
0.0593, wR2 0.1565, GOOF по F2 1.048, Δρmax/Δρmin
ФОНДОВАЯ ПОДДЕРЖКА
0.55/-0.33 е/Å3.
Исследование выполнено при финансовой
Основные характеристики эксперимента и па-
поддержке Кубанского научного фонда в рам-
раметры элементарной ячейки соединения 12б
ках научного проекта МФИ-20.1-26/20 (заявка
(C24H32N8O, CCDC 2073623): 0.452 × 0.171 × 0.12
№ МФИ-20.1/45), а также при финансовой под-
мм, кристаллическая система триклинная, про-
держке Министерства образования и науки Рос-
странственная группа P-1, M 448.57; параметры
сийской Федерации (тема 0795-2020-0031).
ячейки: а 11.1006(2), b 11.3043(2), с 11.6275(3) Å,
α 113.959(2), β 94.810(2), γ 103.135(2)°, T 293(2) K,
КОНФЛИКТ ИНТЕРЕСОВ
V 1272.78(5) Å3, Z 2; dвыч 1.170 г/см3, μ(CuKα) 0.608
Авторы заявляют об отсутствии конфликта
мм-1, F(000) 480.0, область углов съемки θ 8.344-
интересов.
152.788°; интервалы индексов отражений: -13 ≤
СПИСОК ЛИТЕРАТУРЫ
h ≤ 13, -10 ≤ k ≤ 14, -14 ≤ l ≤ 14, число измеренных
отражений 26115, число независимых отражений
1.
Доценко В.В., Кривоколыско С.Г., Семенова А.М. //
5310 [Rint 0.0248, Rsigma 0.0194], число отражений с
ХГС. 2018. № 54. С. 989; Dotsenko V.V., Krivokolys-
ko S.G., Semenova A.M. // Chem. Heterocycl. Compd.
I > 2σ(I) 5310, число уточняемых параметров 383,
2018. N 54. P. 989. doi 10.1007/s10593-018-2383-y
R-фактор [I ≥ 2σ(I)]: R1 0.0484, wR2 0.1431, R-фак-
2.
Shaabani A., Hooshmand S.E. // Mol. Divers. 2018.
тор по всем отражениям: R1 0.0531, wR2 0.1502,
N 22. P. 207. doi 10.1007/s11030-017-9807-y
GOOF по F2 1.057, Δρmax/Δρmin 0.22/-0.26 е/Å3.
3.
Дяченко В.Д., Литвинов В.П. // Докл. АН. 1997.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Т. 355. № 1. С. 62; Dyachenko V.D., Litvinov V.P. //
Doklady Chem. 1997. Vol. 355. N 1-3. P. 153.
4.
Доценко В.В., Чигорина Е.А., Кривоколыско С.Г. //
org/0000-0001-9014-3248
ХГС. 2017. № 53. С. 626; Dotsenko V.V., Chigorina
E.A., Krivokolysko S.G. // Chem. Heterocycl. Compd.
Доценко Виктор Викторович, ORCID: http://
2017. Vol. 53. P. 626. doi 10.1007/s10593-017-2103-z
orcid.org/0000-0001-7163-0497
5.
Доценко В.В., Кривоколыско С.Г., Чернега А.Н.,
Фролов Константин Александрович, ORCID:
Литвинов В.П. // Изв. АН. Сер. хим. 2003. № 52.
С. 918; Dotsenko V.V., Krivokolysko S.G., Chernega
Аксенов Николай Александрович, ORCID:
A.N., Litvinov V.P. // Russ. Chem. Bull. 2003. Vol. 52.
P. 969. doi 10.1023/A:1024420930528
6.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П.,
Аксенова Инна Валерьевна, ORCID: http://
Чернега А.Н. // ХГС. 2007. № 43. С. 716; Dotsen-
orcid.org/0000-0002-8083-1407
ko V.V., Krivokolysko S.G., Litvinov V.P., Chernega A.N. //
Щербаков Станислав Владимирович, ORCID:
Chem. Heterocycl. Compd. 2007. Vol. 43. P. 599. doi
10.1007/s10593-007-0094-x
7.
Семенова А.М., Оганесян Р.В., Доценко В.В., Чи-
Овчаров Сергей Николаевич, ORCID: http://
горина Е.А., Аксенов Н.А., Аксенова И.В., Нетре-
orcid.org/0000-0002-4638-6098
ба Е.Е. // ЖОХ. 2019. Т. 89. № 1. С. 25; Semeno-
Кривоколыско Дмитрий Сергеевич, ORCID:
va A.M., Oganesyan R.V., Dotsenko V.V., Chigori-
na E.A., Aksenov N.A., Aksenova I.V., Netreba E.E. //
Russ. J. Gen. Chem. 2019. Vol. 89. N 1. P. 19. doi
Кривоколыско Сергей Геннадиевич, ORCID:
10.1134/S1070363219010043
8.
Rand L., Swisher J.V., Cronin C.J. // J. Org. Chem.
БЛАГОДАРНОСТЬ
1962. Vol. 27. N 10. P. 3505. doi 10.1021/jo01057a024
9.
Prout F. S. // J. Org. Chem. 1973. Vol. 38. N 2. P. 399.
Регистрация ИК спектров проведена с исполь-
doi 10.1021/jo00942a045
зованием оборудования Научно-образовательного
10.
Шаранин Ю.А., Шаранина Л.Г. // ХГС. 1974.
центра «Диагностика структуры и свойств нано-
№ 10. С. 1432; Sharanin Y.A., Sharanina L.G. // Chem.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
860
КУРСКОВА и др.
Heterocycl. Compd. 1974. N 10. P. 1259. doi 10.1007/
26.
Bardasov I.N., Golubev R.V., Ershov O.V., Kayukov Y.S.,
bf00470178.
Nasakin O.E. // Tetrahedron Lett. 2011. Vol. 52. P. 4724.
11.
van der Baan J.L., Bickelhaupt F. // Tetrahedron.
doi 10.1016/j.tetlet.2011.06.083
1974. Vol. 30. N 15. P. 2447. doi 10.1016/s0040-
27.
Bardasov I.N., Mikhailov D.L., Alekseeva A.U., Er-
4020(01)97115-7
shov O.V., Tafeenko V.A. // Tetrahedron Lett. 2016.
Vol. 57. P. 2772. doi 10.1016/j.tetlet.2016.05.032
12.
Cairns T.L., Carboni R.A., Coffman D.D., Engel-
28.
Голубев Р.В., Алексеева А.Ю., Бардасов И.Н., Каю-
hardt V.A., Heckert R.E., Little E.L., McGeer E.G.,
ков Я.С., Ершов О.В., Насакин О.Е. // ЖОрХ. 2011.
McKusick B.C., Middleton W.J., Scribner R.M.,
Т. 47. С. 370; Golubev R.V., Alekseeva A.Y., Bardasov
Theobald C.W., Winberg, H.E. // J. Am. Chem. Soc.
I.N., Kayukov Y.S., Ershov O.V., Nasakin O.E. // Russ.
1958. Vol. 80. N 11. P. 2775. doi 10.1021/ja01544a051
J. Org. Chem. 2011. Vol. 47. P. 363. doi: 10.1134/
13.
Morgenstern J., Mayer R. // J. Prakt. Chem. 1966.
S1070428011030055
Vol. 34. N 1-4. P. 116. doi 10.1002/prac.19660340115
29.
Бардасов И.Н., Алексеева А.Ю., Михайлов Д.Л.,
14.
El-Sakka I.A., El-Kousy S.M., Kandil Z.E. // J. Prakt.
Ершов О.В., Каюков Я.С. // ЖОрХ. 2016. Т. 52.
Chem. 1991. Vol. 333. N 2. P. 345. doi 10.1002/
С. 1374; Bardasov I.N., Alekseeva A.Y., Mikhailov D.L.,
prac.19913330222
Ershov O.V., Kayukov Y.S. // Russ. J. Org. Chem. 2016.
15.
Zohreh N., Tavakolizadeh M., Hosseini S.H., Pourjava-
Vol. 52. P. 1365. doi 10.1134/S1070428016090220.
di A., Bennett C. // Polymer. 2017. Vol. 112. P. 342. doi
30.
Бардасов И.Н., Михайлов Д.Л., Беликов М.Ю., Алек-
10.1016/j.polymer.2017.02.028
сеева А.Ю., Ершов О.В. // ЖОрХ. 2016. Т. 52. С. 1607;
16.
Ranu B.C., Jana R. // Eur. J. Org. Chem. 2006. N 16.
Bardasov I.N., Mikhailov D.L., Belikov M.Yu., Aleksee-
P. 3767. doi 10.1002/ejoc.200600335.
va A.Yu., Ershov O.V. // Russ. J. Org. Chem. 2016.
17.
Elgemeie G.E.H., Regaila H.A., Shehata N. // J. Chem.
Vol. 52. P. 1600. doi 10.1134/S1070428016110087
Soc. Perkin Trans. 1. 1990. N 5. P. 1267. doi 10.1039/
31.
Доценко В.В., Исмиев А.И., Хрусталева А.Н., Фро-
p19900001267
лов К.А., Кривоколыско С.Г., Чигорина Е.А., Сниж-
18.
Dotsenko V.V., Krivokolysko S.G., Litvinov V.P. // J.
ко А.П., Громенко В.М., Бушмаринов И.С., Аске-
Heterocycl. Chem. 2010. Vol. 48. N 1. P. 162. doi
ров Р.К., Пехтерева Т.М., Суйков С.Ю., Папаяни-
10.1002/jhet.493
на Е.С., Мазепа А.В., Магеррамов А.М. // ХГС. 2016.
19.
Junek H., Wolny B. // Monatsh. Chem. 1976. Vol. 107.
T. 52. C. 473; Dotsenko V.V., Ismiev A.I., Khrustale-
P. 999. doi 10.1007/BF00904489.
va A.N., Frolov K.A., Krivokolysko S.G., Chigori-
20.
Fahmy S.M., Abd Allah S.O., Mohareb R.M. // Synthesis.
na E.A., Snizhko A.P., Gromenko V.M., Bushmari-
1984. P. 976. doi 10.1055/s-1984-31045
nov I.S., Askerov R.K., Pekhtereva T.M., Suykov S.Yu.,
21.
Бардасов И.Н., Алексеева А.Ю., Малышкина Н.Л.,
Papayanina E.S., Mazepa A.V., Magerramov A.M. //
Chem. Heterocycl. Compd. 2016. Vol. 52. P. 473. doi
Ершов О.В., Гришанов Д.А. // ЖОрХ. 2016. Т. 52.
10.1007/s10593-016-1918-3
С. 844; Bardasov I.N., Alekseeva A.Y., Malyshkina N.L.,
32.
Алексеева А.Ю., Бардасов И.Н., Михайлов Д.Л.,
Ershov O.V., Grishanov D.A. // Russ. J. Org. Chem.
Ершов О.В. // ЖОрХ. 2017. T. 53. P. 1227; Aleksee-
2016. Vol. 52. P. 830. doi 10.1134/S1070428016060117
va A.Yu., Bardasov I.N., Mikhailov D.L., Ershov O.V. //
22.
Бардасов И.Н., Алексеева А.Ю., Ершов О.В. // ЖОрХ.
Russ. J. Org. Chem. 2017. Vol. 52. P. 1243. doi 10.1134/
2017. Т. 53. С. 1253; Bardasov I.N., Alekseeva A.Y.,
S1070428017080140
Ershov O.V. // Russ. J. Org. Chem. 2017. Vol. 53.
33.
Junek H., Thierrichter B., Wibmer P. // Monatsh. Chem.
P. 1270. doi 10.1134/S107042801708019X
1979. Vol. 110. P. 483. doi 10.1007/BF00911935
23.
Ершов О.В., Бардасов И.Н., Алексеева А.Ю.,
34.
Mohareb R.M., Moustafa H.E. // Acta Pharm. 2011.
Иевлев М.Ю., Беликов М.Ю. // ЖОрХ. 2017. Т. 53.
Vol. 61. P. 51. doi 10.2478/v10007-011-0001-y
С. 1014; Ershov O.V., Bardasov I.N., Alekseeva A.Yu.,
35.
Mohareb R.M., El-Sharkawy K.A., Sherif S.M. // Acta
Ievlev M.Yu., Belikov M.Yu. // Russ. J. Org. Chem. 2017.
Pharm. 2008. Vol. 58. P. 429. doi 10.2478/v10007-008-
Vol. 53. P. 1025. doi 10.1134/S1070428017070107
0030-3
24.
Gazit A., Yaish P., Gilon C., Levitzki A. // J. Med. Chem.
36.
El-Sayed A.M., Abdel-Ghany H. // J. Heterocycl. Chem.
1989. Vol. 32. P. 2344. doi 10.1021/jm00130a020
2000. Vol. 37. P. 1233. doi 10.1002/jhet.5570370534
25.
Голубев Р.В., Беликов М.Ю., Бардасов И.Н.,
37.
Доценко В.В., Фролов К.А., Чигорина Е.А., Хруста-
Ершов О.В., Насакин О.Е. // ЖОрХ. 2010. Т. 46.
лева А.Н., Бибик Е.Ю., Кривоколыско С.Г. // Изв.
С. 1868; Golubev R.V., Belikov M.Y., Bardasov I.N.,
АН. Сер. хим. 2019. Т. 68. № 4. С. 691; Dotsenko
Ershov O.V., Nasakin O.E. // Russ. J. Org. Chem. 2010.
V.V., Frolov K.A., Chigorina E.A., Khrustaleva A.N.,
Vol. 46. P. 1883. doi 10.1134/S1070428010120171
Bibik E.Yu., Krivokolysko S.G. // Russ. Chem. Bull.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НОВЫЕ МЕТОДЫ СИНТЕЗА, СТРОЕНИЕ И АМИНОМЕТИЛИРОВАНИЕ
861
2019. Vol. 68. N 4. P. 691. doi 10.1007/s11172-019-
Dotsenko V.V., Krivokolysko S.G. // Russ. J. Org.
2476-5
Chem. 2016. Vol. 52. N 9. P. 1368. doi 10.1134/
38. Доценко В.В., Кривоколыско С.Г., Литвинов В.П.,
S1070428016090232
Русанов Э.Б. // Докл. АН. 2007. Т. 413. № 3. С. 345;
41. Mittelbach M. // Monatsh. Chem. 1985. Vol. 116. P. 689.
Dotsenko V.V., Krivokolysko S.G., Litvinov V.P., Rusa-
doi 10.1007/BF00798796.
nov E.B. // Doklady Chem. 2007. Vol. 413. Part 1. P. 68.
42. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
doi 10.1134/S0012500807030032
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
39. Orlov A.A., Eletskaya A.A., Frolov K.A., Golinets A.D.,
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Palyulin V.A., Krivokolysko S.G., Kozlovskaya L.I.,
43. Sheldrick G. M. // Acta Crystallogr. (A). 2008. Vol. 64.
Dotsenko V.V., Osolodkin D.I. // Arch. Pharm. 2018.
P. e1700353. doi 10.1002/ardp.201700353
P. 112. doi 10.1107/S0108767307043930
40. Хрусталева А.Н., Доценко В.В., Кривоколыско С.Г. //
44. Sheldrick G. M. // Acta Crystallogr. (C). 2015. Vol. 71.
ЖОрХ. 2016. Т. 52. № 9. С. 1376; Khrustaleva A.N.,
P. 3. doi 10.1107/S2053229614024218
New Methods of Synthesis, Structure and Aminomethylation
of 4-Imino-2-(dycyanomethylene)-3-azaspiro[5.5]undecane-
1,5-dicarbonitrile
A. O. Kurskovaa, V. V. Dotsenkob,c, K. A. Frolova, N. A. Aksenovc, I. V. Aksenovac,
S. V. Shcherbakovc, S. N. Ovcharovc, D. S. Krivokolyskod, and S. G. Krivokolyskoa,d,*
a Laboratory “ChemEx”, V. Dal Lugansk State University, Lugansk, 91034 Ukraine
b Kuban State University, Krasnodar, 350040 Russia
c North Caucasus Federal University, Stavropol, 355009 Russia
d St. Luke Lugansk State Medical University, Lugansk, 91045 Ukraine
*e-mail: ksg-group-lugansk@mail.ru
Received April 5, 2021; revised April 5, 2021; accepted April 22, 2021
Sequential reaction of cyclohexanone with malononitrile and 2-aminopropene-1,1,3-tricarbonitrile in the pres-
ence of potassium hydroxide or sodium ethylate in ethanol gave 4-imino-2-(dicyanomethylene)-3-azaspiro[5.5]-
undecane-1,5-dicarbonitrile. Aminomethylation of the latter reacted with primary amines and an excess of
formaldehyde to form new 2-(dicyanomethylene)-3,7-diazaspiro[bicyclo[3.3.1]non-3-ene-9,1′-cyclohex-
ane]-1.5-dicarbonitrile derivatives. Contrary to the literature data, the reaction of cyclohexanone with 2-amino-
propene-1,1,3-tricarbonitrile in benzene in the presence of piperidine and glacial acetic acid led to the formation
of 2,4-diamino-5,6,7,8-tetrahydronaphthalene-1,3-dicarbonitrile.
Keywords: cyclohexanone, malononitrile, 2-aminopropene-1,1,3-tricarbonitrile, 2,4-diamino-5,6,7,8-tetrahy-
dronaphthalene-1,3-dicarbonitrile, 4-imino-2-(dicyanomethylene)-3-azaspiro[5.5]undecane-1,5-dicarbonitrile,
aminomethylation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021