ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 862-868
УДК 547.793
СИНТЕЗ И ИССЛЕДОВАНИЕ
ФОТОЛЮМИНЕСЦЕНТНЫХ СВОЙСТВ
2-(3-КАРБОКСИМЕТИЛИНДАЗОЛ-1-ИЛ)-АНИЛИНОВ
© 2021 г. А. А. Шетневa,*, В. А. Пановаa, П. М. Кутузоваb, М. В. Тарасенкоa,
М. В. Жмыховаc, С. В. Байковc, С. И. Филимоновd
a Ярославский государственный педагогический университет имени К. Д. Ушинского,
ул. Республиканская 108, Ярославль, 150000 Россия
b Ярославский государственный университет имени П. Г. Демидова, Ярославль, 150003 Россия
c Санкт-Петербургский государственный университет, Санкт-Петербург, 199034 Россия
d Ярославский государственный технический университет, Ярославль, 150023 Россия
*e-mail: a.shetnev@yspu.org
Поступило в Редакцию 15 апреля 2021 г.
После доработки 11 мая 2021 г.
Принято к печати 14 мая 2021 г.
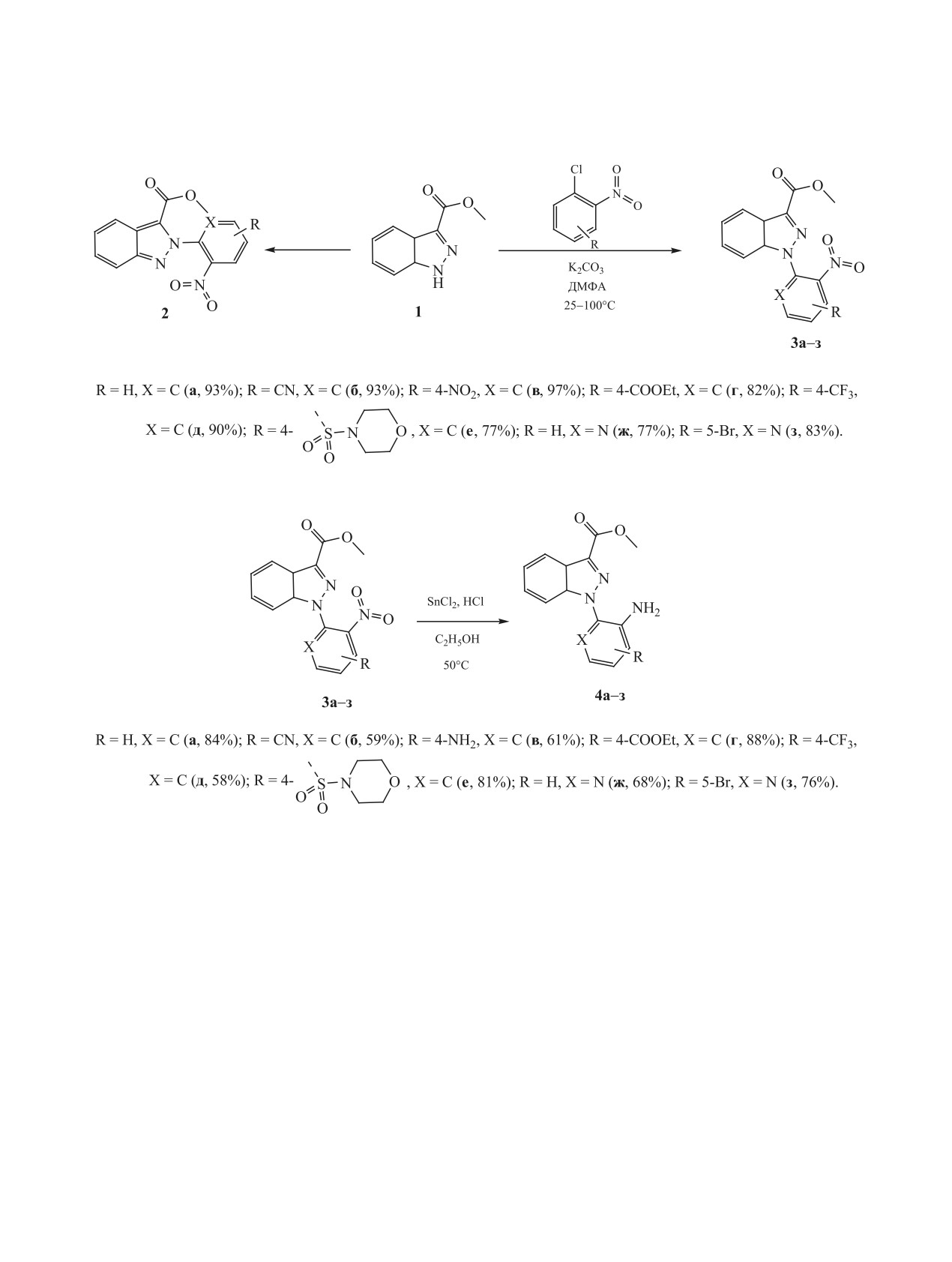
Разработан двухстадийный способ получения 2-(3-карбоксиметилиндазол-1-ил)анилинов с использо-
ванием реакций N-арилирования 3-карбоксиметилиндазолов о-нитрогалогенаренами и последующим
восстановлением нитросодержащих интермедиатов хлоридом олова(II). Результаты исследования фо-
тофизических свойств показали, что синтезированные соединения могут найти применение в качестве
флуорофоров в видимой области спектра.
Ключевые слова: гетероциклы, N-арилирование, восстановление, фотолюминесценция
DOI: 10.31857/S0044460X21060044
N-Замещенные производные индазолов на
Ввиду большой практической значимости
протяжении долгого времени вызывают интерес
N-арилированных индазолов на протяжении по-
исследователей. Они обнаружены среди алкало-
следних двух десятков лет подробно изучены и
идов черного тмина [1, 2], нашли применение в
разработаны методы их конструирования с ис-
качестве противорвотных средств (гранисетрон,
пользованием как основного, так и катализа ком-
трописетрон) [3], противоопухолевых препаратов
плексами переходных металлов [14-19]. Согласно
(нирапариб, пазопаниб) [4], противотивоспали-
литературным данным, 1H-индазолы могут всту-
тельных агентов (бензадак, бензидамин) [5, 6] и
пать в реакции N-арилирования по обоим атомам
многих других биологически активных соедине-
азота [14-16]. Но, как правило, реакция протекает
ний, подробные обзоры по которым опубликованы
региоселективно с участием N1-атома индазоль-
в работах [7-9].
ного цикла, независимо от механизма осущест-
Заслуживает внимание и широкий спектр по-
вляемого взаимодействия [17-19]. В то же время,
несмотря на значительный объем публикаций по
лезных фотофизических свойств N-замещенных
этой тематике, реакции N-арилирования инда-
индазолов, находящих приложение в области све-
зол-3-карбоксилатов посвящена лишь единствен-
тотехники и светоизлучающих устройств и так-
ная публикация [20].
же в исследовательских процессах, связанных с
наблюдением биохимических процессов в живых
Ранее нами была обнаружена необычная ре-
системах с помощью флуоресцентных треккеров
гиоселективность в реакции N-арилирования пи-
[10-13].
разол-3-карбоксилатов в условиях классического
862
СИНТЕЗ И ИССЛЕДОВАНИЕ ФОТОЛЮМИНЕСЦЕНТНЫХ СВОЙСТВ
863
Схема 1.
Схема 2.
активированного нуклеофильного замещения с
Для выполнения поставленной задачи была
участием O-нитрозамещеных галогенаренов [21].
проведена реакция метил индазол-3-карбоксилата
В условиях реакции наблюдалось преимуществен-
с рядом электронодефицитных O-нитрогалогена-
ное замещение по N2-атому пиразольного цикла.
ренов в среде осушенного ДМФА в присутствии
Последующее восстановление нитропроизводного
безводного карбоната калия в качестве депротони-
хлоридом олова(II) и другими реагентами [22] во
рующего агента (схема 1).
всех случаях давало продукты восстановительной
Однако было обнаружено, что реакция N-ари-
циклизации - N-гидроксихиноксалины, проявив-
лирования индазол-3-карбоксилатов, протекает
шие свойства мощных и селективных ингибито-
по атому N1 индазольного цикла с выходами со-
ров моноаминооксидазы человека [23]. В насто-
ответствующих N-арилпроизводных 3а-з, дости-
ящей работе мы предполагали распространить
указанный подход для синтеза конденсированных
гающими 97%. Несмотря на попытки варьировать
систем, содержащих индазольный и хиноксалино-
условия реакции (температура, растворитель), ис-
вый циклы.
пользовать депротонирующие агенты различной
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
864
ШЕТНЕВ и др.
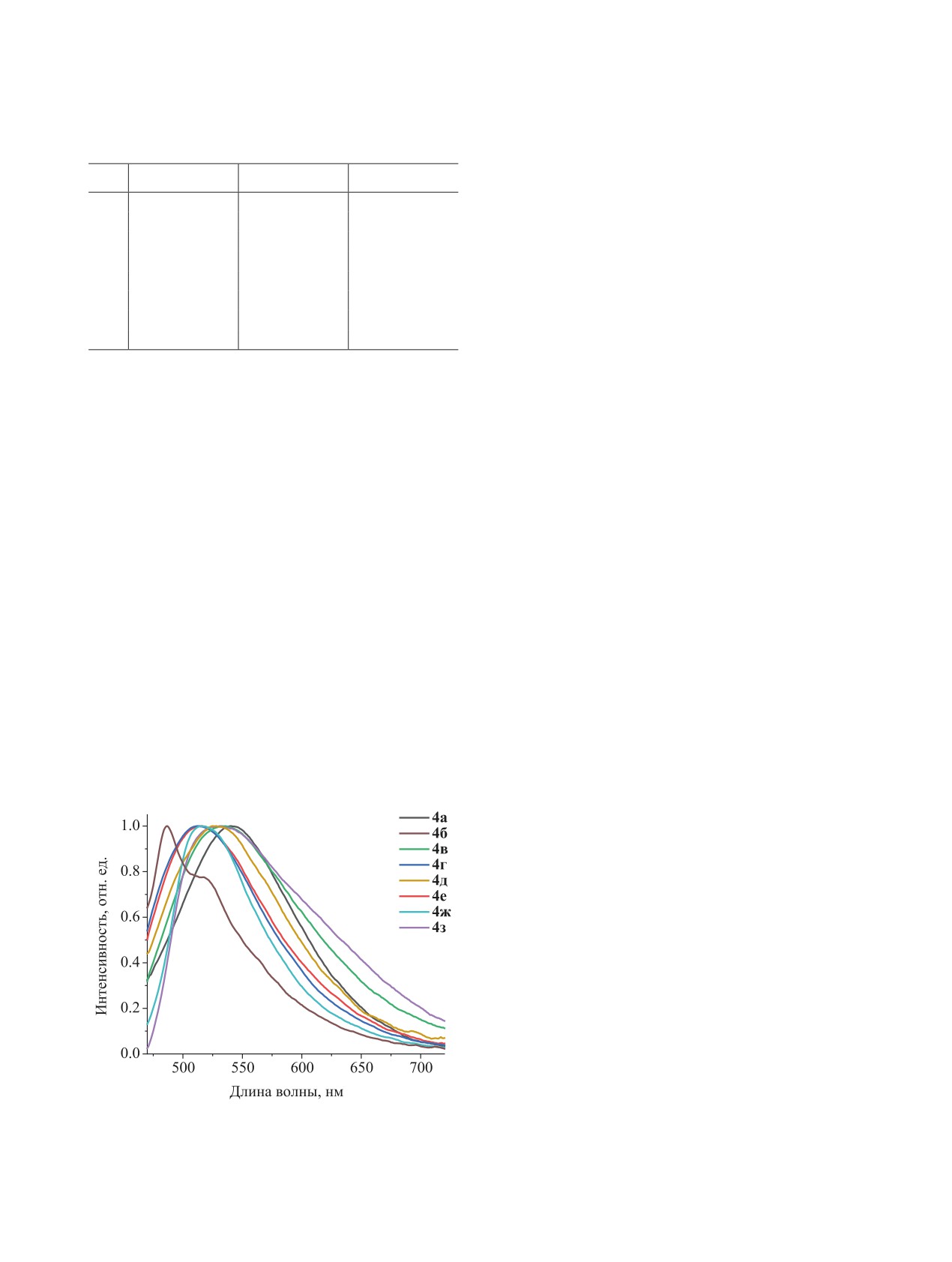
спектрометра Fluorolog 3. Найденные значения
Таблица 1. Фотофизические свойства соединений 4а-з
максимумов спектров испускания (λmax), время
№
λmax, нм
τ, нс
CIE [x;y]
em
em
жизни возбужденного состояния (τ) и значения
4a
540
653
0.40; 0.58
параметров диаграммы цветности (CIE[x;y]) при-
4б
487, 520
0.4
0.35; 0.62
ведены в табл. 1. Зарегистрированные спектры ис-
4в
535
518
0.41; 0.56
пускания при облучении светом λex 450 нм приве-
4г
515
4.4
0.37; 0.60
дены на рис. 1.
4д
530
3.9
0.39; 0.59
4e
515
4.2
0.38; 0.60
Изучение фотофизических свойств получен-
4ж
512
3.3
0.35; 0.62
ных соединений показало, что все они обладают
4з
530
2.8
0.43; 0.56
интенсивной фотолюминесценцией желто-зелено-
го цвета в твердом состоянии. Спектры испуска-
ния в основном представлены широкой бесструк-
природы (трет-бутоксид калия, триэтиламин,
турной полосой. Максимумы свечения находятся
4-N,N-диметиламинопиридин) зафиксировать об-
в пределах от 487 до 540 нм. Наибольший сдвиг
разование изомерных соединений 2 не удалось.
максимума происходит при замене водорода (4a)
Полученная серия нитропроизводных
3а-з
на нитрильную группу (4д) в положении 4. Вре-
была превращена в соответствующие амины 4а-з
мена жизни возбужденного состояния для соеди-
с использованием разработанного нами ранее ме-
нений 4б, 4г-з практически не отличаются друг от
тода восстановления N-нитроарилпиразол-3-кар-
друга и находятся в диапазоне от 0.4 до 4.4 нс. Рез-
боксилатов хлоридом олова(II) в этаноле в присут-
кое отличие наблюдается для соединений 4а и 4в,
ствии соляной кислоты [21] (cхема 2).
для которых время жизни возбужденного состоя-
Полученная с умеренными и отличными вы-
ния составляет 653 и 518 нс соответственно. Такое
ходами 58-88% серия гетероциклических аминов
резкое увеличение времени жизни возбужденного
4а-з, содержащих различную функциональную
состояния может быть связано с более плотной
периферию, обеспечила, на наш взгляд, достаточ-
упаковкой молекул из-за сильного межмолекуляр-
ное разнообразие электронных эффектов для ис-
ного диполь-дипольного взаимодействия [24, 25].
следования фотофизических свойств.
Таким образом, синтезирована серия новых
Полученные аминопроизводные
4а-з были
2-(3-карбоксиметилиндазол-1-ил)анилинов двух-
исследованы на предмет наличия фотолюми-
стадийным методом, заключающимся в N-арили-
несценции в твердом состоянии при комнатной
ровании
3-карбоксиметилиндазолов о-нитрога-
температуре с использованием флуоресцентного
логенаренами с последующим восстановлением
нитросодержащих интермедиатов и обеспечива-
ющим общий выход целевых аминопроизводных
в диапазоне
62-78%. Полученные соединения
представляют интерес в качестве органических
флуорофоров с эмиссией в желто-зеленой области
спектра.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Органические, неорганические реагенты и рас-
творители были получены из коммерческих источ-
ников (Aldrich, Вектон, Экрос) и использовались
без дополнительной очистки. Контроль за проте-
канием реакции проводили методом тонкослойной
хроматографии (ТСХ) на силикагеле на алюми-
ниевых пластинках Silufol UV с использованием
элюента в качестве смеси этилацетат-петролей-
Рис. 1. Спектры фотолюминесценции соединений 4а-з.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
СИНТЕЗ И ИССЛЕДОВАНИЕ ФОТОЛЮМИНЕСЦЕНТНЫХ СВОЙСТВ
865
ный эфир, 1:1. Спектры ЯМР регистрировали на
Метил-1-(2,4-динитрофенил)-1H-инда-
приборе Varian XL-400 (400 МГц) для растворов
зол-3-карбоксилат (3в). Выход 0.332 г (97%),
ДМСО-d6 при 25°С. Температуры плавления опре-
желтый порошок, т. пл. 186-189°С. Спектр ЯМР
деляли на аппарате для определения точки плав-
1Н, δ, м. д.: 3.98 с (3H, СН3), 7.54 т (2H, Ar, J
ления и кипения Büchi M-560. Масс-спектры вы-
7.6 Гц), 7.68 т (1H, Ar, J 7.6 Гц), 7.78 д (1H, Ar, J
сокого разрешения записывали на приборе Bruker
8.0 Гц), 8.24 д (1H, Ar, J 7.6 Гц), 8.37 д (1H, Ar, J
Daltonics MicrOTOF-II, метод ионизации - элек-
8.8 Гц), 8.75 д (1H, Ar, J 8.4 Гц), 9.00 с (1H, Ar).
трораспыление (ESI), температура источника ио-
Спектр ЯМР 13C, δС, м. д.: 52.28, 110.66, 121.80,
низации - 180°С, элюент - метанол. Спектры фо-
122.00, 123.34, 124.85, 128.85, 129.08, 135.22,
толюминесценции, времена жизни возбужденного
138.57, 140.44, 144.26, 146.65, 161.49. Масс-спектр,
состояния получены на флуоресцентном спектро-
m/z:
365.0493
[M
+ Na]+ (вычислено для
метре Fluorolog 3 (Horiba Jobin Yvon).
C15H10N4NaO6: 365.0493).
Общая методика синтеза метил-1-(2-ни-
Метил-1-[4-(этоксикарбонил)-2-нитрофе-
троарил)-1H-индазол-3-карбоксилатов 3а-з. К
нил]-1H-индазол-3-карбоксилат
(3г). Выход
раствору 1H-индазол-3-карбоксилата (1 ммоль)
0.302 г (82%), светло-желтый порошок, т. пл. 158-
в ДМФА (1.5 мл) добавляли соответствующий
161°С. Спектр ЯМР 1Н, δ, м. д.: 1.39 т (3H, СН3,
о-нитрогалогенарен (1 ммоль) и растертый K2CO3
СН3, J 7.2 Гц), 3.97 с (3H, СН3), 4.43 к (2H, СН2,
(1.3 ммоль). Реакционную смесь перемешивали
J 7.2 Гц), 7.52 т (1H, Ar, J 7.6 Гц), 7.64 т (1H, Ar,
12 ч при 70-100°С. По окончании реакции полу-
J 7.6 Гц), 7.71 д (1H, Ar, J 8.4 Гц), 8.22 т (2H, Ar,
ченную суспензию разбавляли 7 мл дистиллиро-
J 8.4 Гц), 8.47 д (1H, Ar, J 8.4 Гц), 8.65 с (1H, Ar).
ванной воды, осадок отфильтровывали и промы-
Спектр ЯМР 13C, δС, м. д.: 14.01, 52.21, 61.95, 110.59,
вали 2 мл воды. Полученный продукт очищали
121.89, 123.23, 124.63, 126.49, 128.66, 128.86, 131.08,
перекристаллизацией из смеси этанол-ДМФА.
134.07, 134.56, 137.99, 140.51, 144.56, 161.65, 163.33.
Метил-1-(2-нитрофенил)-1H-индазол-3-кар-
Масс-спектр, m/z: 392.0850 [M + Na]+ (вычислено
для C18H15N3NaO6: 392.0853).
боксилат (3а). Выход 0.276 г (93%), светло-жел-
тые кристаллы, т. пл. 163-165°С. Спектр ЯМР 1Н,
Метил-1-[4-(трифторметил)-2-нитрофенил]-
δ, м. д.: 3.97 с (3H, СН3), 7.49 д. т (1H, Ar, J 8.4,
1H-индазол-3-карбоксилат (3д). Выход 0.328 г
2.0 Гц), 7.61 д. д (2H, Ar, J 4.0, 2.0 Гц), 7.87 д. т (1H,
(90%), бежевые кристаллы, т. пл.
182-185°С.
Ar, J 8.8, 2.0 Гц), 7.93-8.07 м (2H, Ar), 8.22 д (1H,
Спектр ЯМР 1Н, δ, м. д.: 3.98 с (3H, СН3), 7.53 т
Ar, J 8.4 Гц), 8.27 д (1H, Ar, J 8.4 Гц). Спектр ЯМР
(1H, Ar, J 7.6 Гц), 7.65 т (1H, Ar, J 7.6 Гц), 7.76 д
13C, δ, м. д.: 52.06, 110.43, 121.68, 123.01, 124.26,
(1H, Ar, J 8.0 Гц), 8.24 д (1H, Ar, J 8.0 Гц), 8.32 д
125.92, 128.50, 128.55, 130.64, 130.70, 134.61,
(1H, Ar, J 8.4 Гц), 8.39 д (1H, Ar, J 8.4 Гц), 8.68 с
137.18, 140.78, 145.04, 161.81. Масс-спектр, m/z:
(1H, Ar). Спектр ЯМР 13C, δС, м. д.: 52.92, 111.33,
320.0643 [M + Na]+ (вычислено для C15H11N3NaO4:
122.00, 122.58, 123.92, 125.36, 129.58, 130.82,
320.0642).
131.93, 134.55, 138.83, 145.59, 162.31. Масс-спектр,
m/z:
388.0516
[M
+ Na]+ (вычислено для
Метил-1-(4-циано-2-нитрофенил)-1H-ин-
C16H10F3N3NaO4: 388.0516).
дазол-3-карбоксилат (3б). Выход 0.299 г (93%),
светло-желтый порошок, т. пл. 230-232°С. Спектр
Метил-1-[4-(морфолин-4-сульфонил)-2-ни-
ЯМР 1Н, δ, м. д.: 3.97 с (3H, СН3), 7.53 с (1H, Ar),
трофенил]-1H-индазол-3-карбоксилат (3е). Вы-
7.66 с (1H, Ar), 7.76 с (1H, Ar), 8.23 д (1H, Ar, J
ход 0.343 г (77%), желтый порошок, т. пл. 226-
8.0 Гц), 8.31 д (1H, Ar, J 8.4 Гц), 8.49 д (1H, Ar, J
230°С. Спектр ЯМР 1Н, δ, м. д.: 3.10 с (4H, CH2),
8.4 Гц), 8.87 с (1H, Ar). Спектр ЯМР 13C, δС, м. д.:
3.69 с (4H, CH2), 3.98 с (3H, СН3), 7.54 т (1H, Ar, J
52.36,
110.80,
112.61,
116.51,
121.97,
123.31,
7.6 Гц), 7.66 т (1H, Ar, J 7.6 Гц), 7.81 д (1H, Ar, J
124.86,
128.90,
129.07,
130.36,
134.11,
138.24,
8.4 Гц), 8.18 - 8.34 м (3H, Ar), 8.49 с (1H, Ar) Спектр
138.36, 140.48, 144.66, 161.62. Масс-спектр, m/z:
ЯМР 13C, δС, м. д.: 52.29, 110.86, 121.92, 123.26,
345.0596 [M + Na]+ (вычислено для C16H10N4NaO4:
124.76, 125.33, 128.87, 129.48, 133.10, 134.25,
345.0594).
135.97, 138.22, 140.57, 144.72, 161.64. Масс-спектр,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
866
ШЕТНЕВ и др.
m/z:
469.0787
[M
+ Na]+ (вычислено для
светло-желтый порошок, т. пл. 176-182°С. Спектр
C19H18N4NaO7S: 469.0788).
ЯМР 1Н, δ, м. д.: 3.96 с (3H, СН3), 5.69 с (1H, NH2),
Метил-1-(3-нитропиридин-2-ил)-1H-инда-
7.10 д (1H, Ar, J 8.0 Гц), 7.31 с (1H, Ar), 7.38-7.44
зол-3-карбоксилат (3ж). Выход 0.229 г (77%),
м (3H, Ar), 7.53 т (1H, Ar, J 7.6 Гц), 8.19 д (1H, Ar,
светло-желтые кристаллы, т. пл.
143-146°С.
J 8.0 Гц). Спектр ЯМР 13C, δС, м. д.: 51.91, 111.14,
Спектр ЯМР 1Н, δ, м. д.: 3.97 с (3H, СН3), 7.55 т
112.44,
118.67,
118.83,
119.27,
121.52,
123.18,
(1H, Ar, J 7.6 Гц), 7.70 т (1H, Ar, J 7.6 Гц), 7.78-7.89
123.77, 125.89, 127.78, 128.86, 136.55, 140.73,
м (1H, Ar), 8.23 д (1H, Ar, J 8.0 Гц), 8.27 д (1H, Ar,
145.07, 162.20. Масс-спектр, m/z: 315.0856 [M +
J 8.4 Гц), 8.68 д (1H, Ar, J 8.0 Гц), 8.93 д (1H, Ar,
Na]+ (вычислено для C16H12N4NaO2: 315.0852).
J 4.4 Гц). Спектр ЯМР 13C, δС, м. д.: 52,36, 113.32,
Метил-1-(2,4-диаминофенил)-1H-индазол-
121.76, 123.52, 124.13, 125.13, 129.14, 135.57,
3-карбоксилат (4в). Выход 0.173 г (61%), белый
138.41, 139.51, 139.72, 142.64, 151.82, 161.46.
порошок, т. пл. 176-180°С. Спектр ЯМР 1Н, δ, м. д.:
Масс-спектр, m/z: 321.0598 [M + Na]+ (вычислено
3.95 с (3H, СН3), 4.67 с (2H, NH2), 5.20 с (2H, NH2),
для C14H10N4NaO4: 321.0594).
5.98 д (1H, Ar, J 8.4 Гц), 6.11 с (1H, Ar), 6.83 д (1H,
Метил-1-(5-бром-3-нитро-пиридин-2-ил)-
Ar, J 8.0 Гц), 7.31 д (1H, Ar, J 8.4 Гц), 7.34-7.41 м
1H-индазол-3-карбоксилат (3з). Выход 0.312 г
(1H, Ar), 7.46 т (1H, Ar, J 7.6 Гц), 8.14 д (1H, Ar, J 8.0
(83%), светло-оранжевые кристаллы, т. пл. 159-
Гц). Спектр ЯМР 13C, δС, м. д.: 51.63, 100.61, 101.02,
162°С. Спектр ЯМР 1Н, δ, м. д.: 3.96 с (3H, СН3),
104.03,
111.24,
113.73,
121.16,
122.87,
123.22,
7.54 т (1H, Ar, J 7.2 Гц), 7.69 т (1H, Ar, J 8.0 Гц),
127.01, 127.98, 141.29, 144.76, 148.53, 162.42. Масс-
8.21 д (1H, Ar, J 8.4 Гц), 8.25 д (1H, Ar, J 8.8 Гц),
спектр, m/z: 305.1014 [M + Na]+ (вычислено для
9.02 с (1H, Ar), 9.07 с (1H, Ar). Спектр ЯМР 13C, δС,
C15H14N4NaO2: 305.1009).
м. д.: 52.37, 117.90, 121.80, 123.53, 125.25, 137.53,
Метил-1-[2-амино-4-(этоксикарбонил)фе-
138.74,
139.08,
139.64,
141.44,
161.32. Масс-
нил]-1H-индазол-3-карбоксилат
(4г). Выход
спектр, m/z: 398.9705 [M + Na]+ (вычислено для
0.299 г (88%), бежевый порошок, т. пл. 130-135°С.
C14H9BrN4NaO4: 398.9699).
Спектр ЯМР 1Н, δ, м. д.: 1.35 т (3H, СН3, J 6.8 Гц),
Общая методика синтеза метил-1-(2-амино-
3.97 с (3H, СН3), 4.34 к (2H, СН2, J 7.2 Гц,), 5.49
арил)-1H-индазол-3-карбоксилатов 4а-з. К сме-
с (2H, NH2), 7.28 д (1H, Ar, J 8.0 Гц), 7.33-7.46 м
си SnCl2 (3.5 ммоль) в конц. HCl (2 мл) и этанола
(3H, Ar), 7.53 т (1H, Ar, J 7.6 Гц), 7.61 с (1H, Ar),
(2 мл) прибавляли соответствующий 1-(2-нитро-
8.20 д (1H, Ar, J 8.0 Гц). Спектр ЯМР 13C, δC, м. д.:
арил)-1H-индазол-3-карбоксилат 3 (0.01 моль). Ре-
166.17, 162.94, 145.01, 141.44, 136.95, 131.87, 128.40,
акционную массу перемешивали при 50°C 3-4 ч.
128.35,
126.60,
124.37,
123.84,
122.17,
117.84,
Осадок отфильтровывали, промывали этанолом и
117.06, 111.94, 61.49, 52.54, 14.87. Масс-спектр, m/z:
перекристаллизовывали из смеси этанол-ДМФА.
362.1151 [M + H]+ (вычислено для C18H17N3NaO4:
Метил-1-(2-аминофенил)-1H-индазол-3-кар-
362.1111).
боксилат (4а). Выход 0.225 г (84%), светло-
желтый порошок, т. пл. 128-130°С. Спектр ЯМР
Метил-1-[2-амино-4-(трифторметил)фе-
1Н, δ, м. д.: 3.96 с (3H, СН3), 5.13 с (2H, NH2), 6.72
нил]-1H-индазол-3-карбоксилат
(4д). Выход
т (1H, Ar, J 7.2 Гц), 6.96 д (1H, Ar, J 8.0 Гц), 7.20 д
0.195 г (58%), светло-желтый порошок, т. пл.
(1H, Ar, J 7.6 Гц), 7.26 т (1H, Ar, J 7.6 Гц), 7.34 д
154-157°С. Спектр ЯМР 1Н, δ, м. д.: 3.97 с (3H,
(1H, Ar, J 8.4 Гц), 7.41 т (1H, Ar, J 7.2 Гц), 7.50 т (1H,
СН3), 4.92 с (2H, NH2), 6.99 д (1H, Ar, J 8.4 Гц),
Ar, J 7.6 Гц), 8.18 д (1H, Ar, J 8.0 Гц). Спектр ЯМР
7.29 с (1H, Ar), 7.38-7.45 м (3H, Ar), 7.52 т (1H,
13C, δС, м. д.: 51.75, 111.15, 116.73, 116.93, 121.35,
Ar, J 7.6 Гц), 8.20 д (1H, Ar, J 8.0 Гц). Спектр ЯМР
123.04, 123.48, 127.39, 130.05, 135.76, 140.91,
13C, δC, м. д.: 52.53, 111.82, 112.48, 113.32, 122.17,
143.36, 162.32. Масс-спектр, m/z: 290.0908 [M +
123.85, 124.37, 125.86, 126.09, 128.38, 129.35,
Na]+ (вычислено для C15H13N3NaO2: 290.0900).
130.98,
131.29,
141.52,
145.68,
162.93. Масс-
Метил-1-(2-амино-4-цианофенил)-1H-ин-
спектр, m/z: 358.0775 [M + Na]+ (вычислено для
дазол-3-карбоксилат (4б). Выход 0.169 г (59%),
C16H12F3N3NaO2: 358.0774).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
СИНТЕЗ И ИССЛЕДОВАНИЕ ФОТОЛЮМИНЕСЦЕНТНЫХ СВОЙСТВ
867
Метил-1-[2-амино-4-(морфолин-4-сульфо-
Филимонов Сергей Иванович, ORCID: http://
нил)фенил]-1H-индазол-3-карбоксилат
(4е).
orcid.org/0000-0001-9903-4099
Выход 0.337 г (81 %), светло-желтые кристаллы,
ФОНДОВАЯ ПОДДЕРЖКА
т. пл. 227-231°С. Спектр ЯМР 1Н, δ, м. д.: 2.98 с
(4H, Alk), 3.68 с (4H, Alk), 3.98 с (3H, СН3), 5.75 с
Исследование выполнено при поддержке Рос-
(2H, NH2), 7.00 д (1H, Ar, J 8.0 Гц), 7.35 с (1H, Ar),
сийского научного фонда (проект № 20-73-00203)
7.41-7.57 м (4H, Ar), 8.21 д (1H, Ar, J 7.6 Гц). Спектр
с использованием оборудования ресурсных цен-
ЯМР 13C, δC, м. д.: 45.93, 51.86, 65.35, 111.25,
тров «Методы анализа состава вещества» и «Оп-
114.21,
115.00,
121.47,
123.15,
123.73,
125.65,
тические и лазерные методы исследования веще-
127.70, 128.52, 135.70, 136.47, 140.78, 145.02,
ства» Санкт-Петербургского государственного
162.21. Масс-спектр, m/z: 439.1053 [M + Na]+ (вы-
университета.
числено для C19H20N4NaO5S: 439.1047).
КОНФЛИКТ ИНТЕРЕСОВ
Метил-1-(3-аминопиридин-2-ил)-1H-инда-
Авторы заявляют об отсутствии конфликта
зол-3-карбоксилат (4ж). Выход 0.183 г (68%), бе-
интересов.
жевый порошок, т. пл. 145-149°С. Спектр ЯМР 1Н,
δ, м. д.: 3.99 с (3H, СН3), 5.96 с (2H, NH2), 7.20-7.31
СПИСОК ЛИТЕРАТУРЫ
м (1H, Ar), 7.40 д (1H, Ar, J 8.0 Гц), 7.46 т (1H, Ar, J
1.
Liu Y.M., Yang J.S., Liu Q.H. // Chem Pharm Bull. 2004.
7.2 Гц), 7.57 т (1H, Ar, J 7.6 Гц), 7.86 д. д (1H, Ar, J
Vol. 52. P. 454. doi 10.1248/cpb.52.454
4.4, 2.0 Гц), 8.10 д (1H, Ar, J 8.4 Гц), 8.21 д (1H, Ar,
2.
Atta-ur-Rahman Malik S., Hasan S.S., Choudhary M.I.,
J 8.0 Гц). Спектр ЯМР 13C, δC, м. д.: 51.97, 113.86,
Ni C.-Z., Clardy J. // Tetrahedron Lett. 1995. Vol. 36.
121.19, 122.80, 124.17, 124.24, 124.74, 127.81,
P. 1993. doi 10.1016/0040-4039(95)00210-4
135.16,
136.21,
137.91,
140.29,
162.01. Масс-
3.
Fischer J., Ganellin C.R. // John Wiley & Sons. 2006.
спектр, m/z: 291.0854 [M + Na]+ (вычислено для
P. 448. doi 10.1002/3527608001
C14H12N4NaO2: 291.0852).
4.
Scott L.J. // Drugs. 2017. Vol. 77. P. 1029. doi 10.1007/
s40265-017-0752-y
Метил-1-(3-амино-5-бромпиридин-2-ил)-
5.
Shen T.Y. // Ann. Rep. Med. Chem. 1968. Vol. 3. P. 215.
1H-индазол-3-карбоксилат (4з). Выход 0.264 г
doi 10.1016/S0065-7743(08)61326-3
(76%), желтый порошок, т. пл. 176-180°С. Спектр
6.
Gaikwad D.D., Chapolikar A.D., Devkate C.G.,
ЯМР 1Н, δ, м. д.: 3.99 с (3H, СН3), 6.23 с (2H,
Warad K.D., Tayade A.P., Pawar R.P., Domb A.J. // Eur.
NH2), 7.47 т (1H, Ar, J 7.6 Гц), 7.54-7.65 м (2H,
J. Med. Chem. 2015. Vol. 90. P. 707. doi 10.1016/j.
Ar), 7.92 с (1H, Ar), 8.09 д (1H, Ar, J 8.0 Гц), 8.21
ejmech.2014.11.029
д (1H, Ar, J 7.6 Гц). Спектр ЯМР 13C, δC, м. д.:
7.
Dong J., Zhang Q., Wang Z., Huang G., Li S. //
52.01, 113.76, 119.06, 121.26, 122.80, 124.32, 125.85,
ChemMedChem. 2018. Vol. 13. N 15. P. 1490. doi
128.00, 134.74, 135.04, 135.55, 139.34, 140.23,
10.1002/cmdc.201800253
161.87. Масс-спектр, m/z: 368.9960 [M + Na]+ (вы-
8.
Wan Y.C., He S.Z., Li W., Tang Z.L. // Anti-Cancer
Agents Med. Chem. 2018. Vol. 18. P. 1228.
числено для C14H11BrN4NaO2: 368.9958).
9.
Zhang S.G., Liang C.G., Zhang W.H. // Molecules. 2018.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Vol. 23. N 11. P. 2783. doi 10.3390/molecules23112783
10.
Kim O.S., Jang J.H., Kim H.T., Han S.J., Tsui G.C.,
Joo J.M. // Org. Lett. 2017. Vol. 19. N 6. P. 1450. doi
org/0000-0002-4389-461X
10.1021/acs.orglett.7b00410
Панова Валерия Анатольевна, ORCID: http://
11.
Janardhanan J.C., Mishra R.K., Das G., Sini S.,
orcid.org/0000-0002-4775-5326
Jayamurthy P., Suresh C. H., Praveen V.K., Manoj N.,
Тарасенко Марина Владимировна, ORCID:
Babu B.P. // Asian J. Org. Chem. 2018. Vol. 7. P. 2094.
doi 10.1002/ajoc.201800413
12.
Pakjoo V., Roshani M., Pordel M., Hoseini T. // Arkivoc.
Жмыхова Маргарита Владимировна, ORCID:
2012. Vol. 9. P. 195. doi 10.3998/ark.5550190.0013.917
13.
Cheng Y., Li G., Liu Y., Shi Y., Gao G., Wu D., Lan J.,
Байков Сергей Валентинович, ORCID: http://
You J. // J. Am. Chem. Soc. 2016. Vol. 138. N 14.
orcid.org/0000-0002-8912-5816
P. 4730. doi 10.1021/jacs.5b09241
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
868
ШЕТНЕВ и др.
14.
Ding X., Bai J., Wang H., Zhao B., Li J., Ren F. //
21. Panova V.A., Korsakov M.K., Shetnev A.A., Filimo-
Tetrahedron. 2017. Vol. 73. P. 172. doi 10.1016/j.
nov S.I. // Mendeleev Commun. 2019. Vol. 29. N 1.
tet.2016.11.066
P. 114. doi 10.1016/j.mencom.2019.01.039
15.
Zhang R., Liu Z., Peng Q., Zhou Y., Xu L., Pan X. // Org.
22. Панова В.А., Ивановский С.А., Шетнев А.А., Чиркова
Biomol. Chem. 2018. Vol. 16. P. 1816. doi 10.1039/
Ж.В., Судзиловская Т.Н., Филимонов C.И. // Изв. АН.
c8ob00128f
Сер хим. 2020. № 10. С. 1965; Panova V.A., Ivanov-
16.
Xu L., Du S., Li Z., Tian Z. // Heterocycles. 2018.
skii S.A., Shetnev A.A. Chirkova Zh.V., Sudzilov-
Vol. 96. N 1. P. 74. doi 10.3987/com-17-13826
17.
Liang Y., Zhang X., MacMillan D.W.C. // Nature. 2018.
skaya T.N., Filimonov S.I. // Russ Chem Bull. 2020.
Vol. 559. P. 83. doi 10.1038/s41586-018-0234-8
Vol. 69. P. 1965. doi 10.1007/s11172-020-2986-1
18.
Antilla J.C., Baskin J.M., Barder T.E., Buchwald S.L. //
23. Panova V.A., Filimonov S.I., Chirkova Zh.V., Kabano-
J. Org. Chem. 2004. Vol. 69. N 17. P. 5578. doi 10.1021/
va M.V., Shetnev A. A., Korsakov M.K., Petzer A.,
jo049658b
Petzer J.P. // Bioorg. Chem. 2020. Vol. 108. P. 104563.
19.
Gamonal A., Brunet E., Juanes O., Rodriguez-Ubis J.C. //
doi 10.1016/j.bioorg.2020.104563
J. Photochem. Photobiol. (A). 2017. Vol. 342. P. 53. doi
24. Gierschner J., Park S.Y. // J. Mater. Chem. (C). 2013.
10.1016/j.jphotochem.2017.03.037
Vol. 1. P. 5818. doi 10.1039/C3TC31062K
20.
Reddy A.V., Gogireddy S., Dubey P.K., Reddy M.B.,
Veeresh B. // J. Chem. Sci. 2015. Vol. 127. P. 433. doi
25. Nishio S., Higashiguchi K., Matsuda K. // Asian J. Org.
10.1007/s12039-015-0792-3
Chem. 2014. Vol. 3. P. 686. doi 10.1002/ajoc.201402024
Synthesis and Photoluminescent Properties
of 2-(3-Carboxymethylindazol-1-yl)anilines
A. A. Shetneva,*, V. A. Panovaa, P. M. Kutuzovab, M. V. Tarasenkoa, M. V. Zhmykhovac,
S. V. Baykovc, and S. I. Filimonovd
a K.D. Ushinsky Yaroslavl State Pedagogical University, Yaroslavl, 150000 Russia
b P.G. Demidov Yaroslavl State University, Yaroslavl, 150003 Russia
c Institute of Chemistry, St. Petersburg State University, 198504 Russia
d Yaroslavl State Technical University, Yaroslavl, 150023 Russia
*e-mail: a.shetnev@yspu.org
Received April 15, 2021; revised May 11, 2021; accepted May 14, 2021
A two-stage method for the preparation of 2-(3-carboxymethylindazol-1-yl)anilines using the N-arylation re-
action of 3-carboxymethylindazoles with o-nitrohaloarenes and subsequent reduction of nitro-containing inter-
mediates with tin(II) chloride was developed. The experimental results showed that the use of the synthesized
compounds as fluorophores in the visible region of the spectrum is promising.
Keywords: heterocycles, N-arylation, reduction, photoluminescence
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021