ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 869-887
УДК 547.594.3;544.18
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ
СВОЙСТВА ПИРРОЛИЛ- И ДИАЗОЛИЛЗАМЕЩЕННЫХ
ЦИКЛОАЛКАНОНОВ
© 2021 г. Н. Н. Чипанинаa, Л. П. Ознобихинаa, М. В. Сигаловb,
В. Ю. Серыхa, Б. А. Шаинянa,*
a Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской Академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
b Университет Бен-Гуриона в Негеве, Беэр-Шева, 84105 Израиль
*e-mail: bagrat@irioch.irk.ru
Поступило в Редакцию 20 апреля 2021 г.
После доработки 20 апреля 2021 г.
Принято к печати 6 мая 2021 г.
Для оценки донорно-акцепторных свойств оснóвных и кислотных центров в пирролильных и диазолиль-
ных производных циклоалканонов были рассчитаны энергии и формы граничных молекулярных орби-
талей их таутомеров и конформеров и построены карты распределения зарядовой плотности. Показана
конкуренция указанных центров в образовании водородных и координационных связей и возможность
участия изученных продуктов в качестве лигандов в металлокомплексах. Получены комплексы диазо-
лилпроизводных с CuCl2. Синтезирован 7-амино-2-(пирролидин-2-илметилен)индан-1-он. Методами
ЯМР и ИК спектроскопии изучены его структура и склонность к инициируемой УФ облучением E→Z
изомеризации.
Ключевые слова: пирролил(диазолил)производные циклоалканонов, ЯМР и ИК спектроскопия, теоре-
тические расчеты, распределение зарядовой плотности, комплексы меди(II)
DOI: 10.31857/S0044460X21060056
Химия кросс-сопряженных гетарилиденовых
[12-18] и молекулярного докинга. Образующиеся
производных циклических моно- и дикетонов ак-
координационные соединения могут приобретать
тивно развивается благодаря их широкому приме-
новые физико-химические свойства и биологиче-
нению в различных областях, таких как биология,
скую активность [19-21]. В последние годы мы
медицина, оптика, ракетостроение, в качестве
выполнили ряд исследований новых циклических
строительных блоков в синтезе гетероциклов и по-
халконов, содержащих различные электроно- и
лимерных материалов [1-12], а также для дизайна
протонодонорные центры [22-28], с акцентом на
супрамолекулярных ансамблей, связанных вну-
соединения с пирролильным структурным фраг-
три- и межмолекулярными водородными связями
ментом. Основные результаты можно сформули-
благодаря наличию H-донорных и H-акцепторных
ровать следующим образом:
центров в одной молекуле. Наличие карбонильных
- Z-изомеры 2-пирролилметилиденциклоалка-
кислородов, пиррольных NH групп и, в случае ди-
нонов более стабильны, но в кристалле и в рас-
азолильных производных, пиридиновых атомов
творе соединения существуют в виде E-изомеров
азота позволяет не только формировать супрамо-
благодаря сильной межмолекулярной ассоциации
лекулярные ансамбли за счет Н-связей, но и дела-
за счет связей NH∙∙∙O между пиррольной NH-груп-
ет их пригодными для координации с металлами
пой и карбонильным кислородом [22-25];
869
870
ЧИПАНИНА и др.
Схема 1.
H
H
H
H
H
H
H
N
N
N
O
O
O
N
H
N
1
2-Z
2-E
H
Ac
H
Ac
H
O
H
N
O N
N
O
O N
NH
NH
4-E
3-Z
3-E
4-Z
H
O1
O1
N
H
H
O
H
O
O
O N
NH
NH
O2
O2
5-Z
5-E
6-E
6-Z
– УФ-индуцируемая E→Z изомеризация приво-
Интересным и ранее не рассматривавшимся
дит к образованию внутримолекулярных бифурка-
вопросом является распределение зарядовой плот-
ционных водородных связей;
ности (CDD) на поверхности молекулы и орби-
тальные характеристики, указывающие на области
- 2-диазолилметилиденциклоалканоны как в
накопления и обеднения электронной плотности.
кристалле, так и в растворе существуют в виде
CDD-Анализ важен и для понимания природы
Z-изомеров, но при УФ облучении образуют тау-
водородного связывания и других невалентных
томеры и ротамеры с E-ориентацией групп C=O и
взаимодействий, таких как галогенные или коор-
NH [25];
динационные связи. Эта информация полезна при
- пирролил- и диазолилметилиден-1,3-дионы,
анализе взаимодействий с лекарственными препа-
несмотря на прочную внутримолекулярную во-
ратами, содержащими связывающие группы или
дородную связь NH∙∙∙O=C, могут существовать
металлов с лигандами при образовании комплек-
в равновесии с Н-несвязанными ротамерами, об-
сов [29-33].
разующимися путем вращения вокруг связи C-C
С учетом этого, целью данной работы был
между олефиновым атомом =CH и α-углеродным
анализ количественных характеристик CDD для
атомом пиррольного цикла [26-28]. Такое вра-
серии пирролил- и диазолилзамещенных цикло-
щение может индуцироваться оснóвным раство-
алканонов и -дионов (схемы 1-3) для изучения
рителем, фторид- или ацетат-ионом (указывая на
влияния структуры, включая внутримолекулярные
анион-сенсорные свойства), или УФ облучением.
водородные связи, на кислотные и оснóвные цен-
Электрофильные и нуклеофильные свойства из-
тры. Это открывает путь к оценке сравнительной
ученных соединений определяют прочность об-
способности этих центров к образованию H-свя-
разующихся самоассоциатов, характеризуемую
занных ассоциатов и металлокомплексов. Для по-
энергией димеризации, межатомными расстояни-
лучения данных характеристик, были рассчитаны
ями и энергиями.
положительные и отрицательные молекулярные
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
871
(б)
10.0
5.0
δ, м. д. (t1)
(а)
10.0
5.0
δ, м. д. (t1)
Рис. 1. Спектры ЯМР 1H соединения 2 в CD2Cl2 (a) до облучения и (б) после 30 мин облучения. Значения сигналов в спектре
(а) относятся к неперекрывающимся сигналам изомера 2-Z.
электростатические потенциалы (Vmin и Vmax) на
новых материалов для нелинейной оптики и в мо-
картах MEP, и энергии орбиталей ВЗМО/НСМО,
лекулярном докинге для создания биологически
как электронные дескрипторы реакционной спо-
активных соединений [48-54].
собности. Сопоставление данных для пирролиль-
Мы также синтезировали
(2Z)-7-амино-2-
ных производных 2-5 (схема 1) выявило влияние
(пирролидин-2-илметилен)индан-1-он 2 и срав-
заместителя в бензольном кольце, образующего
нили его вычисленные параметры с таковыми для
внутримолекулярные водородные связи NH∙∙∙O
модельного 7-аминоиндан-1-она 1, не содержа-
или OH∙∙∙O с карбонильным кислородом пятичлен-
щего пиррольной группы, для оценки специфи-
ного цикла, на донорно-акцепторную способность
ки электронного распределения в молекуле 2, где
E- и Z-изомеров.
циклоалканон действует как донор электронов, а
Рассчитанные MEPs позволяют представить
пиррольное кольцо - как донор Н-связи. Влияние
положительные и отрицательные области на кар-
второго карбонила, не вовлеченного во внутри-
тах молекулярной поверхности, а величины Vmin и
молекулярную водородную связь, анализировали
Vmax, соответствующие нуклеофильности и элек-
путем сравнения электронных параметров изо-
трофильности молекулы, коррелируют с характе-
меров соединений 6 и 3. Наличие имидазольно-
ристиками и энергиями образующихся водород-
го или пиразольного остатков в двух таутомерах
ных связей [34-41]. Значения Vmax использовались
кетонов 7-12 позволяет оценить конкуренцию
как дескрипторы в расчетах pKa карбоновых кис-
между оснóвными центрами - атомами азота пи-
лот [42]. Величины Vmin успешно применяли при
ридинового типа и одной из карбонильных групп
изучении комплексных соединений [43, 44]. Ори-
индан-1,3-дионового кольца.
ентация молекул в комплексах часто зависит от
ЯМР- и ИК-спектроскопическое исследова-
контактов между областями MEP с противополож-
ние соединений 1 и 2. Экспериментальное и тео-
ными знаками [45]. Найдена корреляция между
ретическое исследование соединений 1 и 2 выпол-
величинами MEP и энергиями взаимодействия в
нено методами ЯМР, ИК спектроскопии и расчетов
комплексах [46]. Вычисленные дескрипторы реак-
методом DFT. E-Конфигурация молекулы 2 сле-
ционной способности хорошо согласуются с MEP
дует из величины химсдвига олефинового прото-
[39, 47, 48]. Их успешно использовали в дизайне
на (7.38 м. д., рис. 1) [22]. Спектр в CD2Cl2 после
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
872
ЧИПАНИНА и др.
2-E
2-Z
3-E
3-Z
4-E
4-Z
5-E
5-Z
Рис. 2. Карты MEP для изомеров соединений 2-5 и значения Vmin и Vmax (ккал/моль).
30 мин УФ облучения содержит ~20% Z-изоме-
ного и енонового фрагментов. Высокочастотная
ра, как следует из появления новых характерных
полоса ν(NH) при 3455 см-1 в спектре раствора
сигналов при 13.3 (NH), 6.85 (=CH), 5.78 (NH2) и
соединения 2 отвечает свободной NH-группе пир-
3.76 м. д. (CH2).
рольного кольца в E-изомере. Через 30 мин после
В ИК спектрах растворов соединения 2 в
УФ облучения спектр показывает расщепленную
CH2Cl2 полосы νas(NH2) при 3488 и νs(NH2) при
полосу с компонентой при 3446 см-1, принадле-
3367 см-1 проявляются при более низких частотах,
жащей Z-изомеру. Участие его NH группы во вну-
чем те же полосы у соединения 1: νas(NH2) 3493
тримолекулярном H-связывании с карбонильным
и νs(NH2) 3373 см-1, за счет сопряжения пирроль-
кислородом приводит к бифуркационной Н-связи
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
873
6-Z
6-E
Рис. 3. Карты MEP для изомеров соединения 6 и значения Vmin и Vmax (ккал/моль).
NH∙∙∙O∙∙∙HN (схема 1), подобной той, что была до-
спектра в растворе отвечает образованию цикли-
казана для Z-изомера соединения 4 [25]. Максимум
ческих димеров с бифуркационной Н-связью с
полосы ν(C=O) при 1674 см-1 в спектре раствора
внутримолекулярным компонентом NHpyrr∙∙∙Ocycl.
соединения 2 совпадает с таковым у соединения 4
Подобная структура была доказана для соединения
(1672 см-1) и слегка сдвинут по отношению к про-
3 в кристалле методом РСА и ИК спектроскопии [22].
изводному 1 (1679 см-1). После УФ облучения рас-
Распределение зарядовой плотности и элек-
твора гетероцикла 2 в ИК спектре появляется по-
тронные дескрипторы соединений 1-12. Карты
лоса ν(C=O) Z-изомера при более низкой частоте
CDD на поверхности E- и Z-изомеров пиррольных
1653 см-1, подобно тому, что наблюдалось при
производных 2-6 (схема 1) показаны на рис. 2, 3,
E→Z изомеризации соединения 4. В спектре твер-
а численные значения максимальных отрицатель-
дого образца соединения 2, его ассоциаты дают
ного (Vmin) и положительного (Vmax) потенциалов
полосу ν(C=O) при 1666 и полосу ν(NHpyrr) при
приведены в табл. 1. В E-изомерах соединений
3299 см-1. Низкочастотный сдвиг относительно
2-6 кислотным центром с максимальным значе-
Таблица 1. Относительные энергии ΔE, электростатические потенциалы Vmin и Vmax, энергии граничных орбиталей
и энергетическая щель Δ для соединений 1-6
Соединение
ΔE, ккал/моль
-Vmin, ккал/моль
Vmax, ккал/моль
-EВЗМО-1, эВ
-EНСМО-1, эВ
Δ, эВ
1
42.31 OC=O
41.49 NHamid
5.9054
1.5363
4.37
2-Z
0
25.52 OC=O
41.93 NHamid
5.5138
2.2116
3.30
2-E
5.34
40.51 OC=O
51.12 NHpyrrol
5.5990
2.0640
3.54
3-Z
0
34.84 OC=O
24.46 =CHolefin
5.7750
2.4244
3.35
3-E
5.61
44.92 OC=O
52.06 NH
5.9049
2.2827
3.62
4-Z
0
43.03 Oamid
27.35 =CHolefin
5.8935
2.6124
3.28
4-E
4.94
44.53 Oamid
55.24 NH
5.9971
2.4658
3.54
33.03 OC=O
5-Z
0
29.46 OOH
27.28 =CHolefin
5.8690
2.5409
3.33
5-E
5.61
37.04 OOH
54.67 NHpyrrol
5.9928
2.3946
3.60
6-Z
0
40.09 O2
28.84 CHpyrrol
6.2659
2.8124
3.45
0a
39.42a O2
28.16a CHpyrrol
6.2658a
2.7638a
3.50a
28.38 O1
25.40 NH
27.69a O1
26.31a NH
6-E
7.90
39.61 O1
56.71 NH
6.2312
2.7124
3.52
7.26a
38.86a O1
56.36a NH
6.2278a
2.6651a
3.56a
36.06 O2
35.25a O2
a Оптимизация на уровне M06-2X/6-311++G(d,p).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
874
ЧИПАНИНА и др.
Таблица 2. Энергии димеризации Edim, длины внутримолекулярных Н-связей lHB, значения Δν и потенциалы Vmin и
Vmax для Е-изомеров соединений 3-6
Соединение
Edim, ккал/моль
lHB, Å
Δν(C=O), см-1
-Vmin, ккал/моль
Vmax, ккал/моль
3-E
17.66
1.843
15 [26]
44.92 OC=O
52.06 NHpyrrol
2-E
16.99
1.856
11
40.51 OC=O
51.12 NHpyrrol
6-E
15.69
1.856
-б
38.86 O1C=O
56.36 NH-pyrrol
5-E
15.53
1.865
8 [24]
37.04 OC=O
54.67 NHpyrrol
4-E
14.17 [25]
1.871 [25]
3 [25]
33.03 OC=O
55.24 NHpyrrol
a Δν(C=O) = ν(C=O)раствор - ν(C=O)тверд.
б В твердом образце и в растворе присутствует только 6-Z изомер [26].
нием Vmax 51-57 ккал/моль является пиррольный
значение Vmin для карбонильного и амидного ато-
NH атом водорода. Максимальный потенциал
мов кислорода ниже, чем у енона 3-E, а на атоме
56.71 ккал/моль в изомере 6-E обусловлен наличи-
O2 он даже ниже, чем в изомере 5-E с внутримоле-
ем двух карбонильных групп в гетероцикле. Сле-
кулярной связью OH∙∙∙O. Наличие внутримолеку-
дующим является значение Vmax 55.24 ккал/моль
лярной Н-связи NH∙∙∙O с пиррольной NH-группой
в изомере 4-E с ацетамидным заместителем, кото-
в Z-изомерах соединений 2-6 существенно пони-
рый далее понижается до 52.06 ккал/моль для неза-
жает потенциал Vmin на карбонильном кислоро-
мещенного фенильного кольца в изомере 3-E. Наи-
де и в значительной степени - потенциал Vmax на
меньшее значение 51.12 ккал/моль рассчитано для
пиррольном NH-протоне. Таким образом, изомер
изомера 2-E с NH2-группой в фенильном кольце.
2-Z имеет максимальный потенциал Vmax
Потенциал Vmax на NH-водороде этой NH2-группы,
41.93 ккал/моль на свободных водородах NH2-груп-
который не вовлечен во внутримолекулярное водо-
пы, а не на пиррольном NH-водороде. В изомерах
родное связывание с карбонильным кислородом,
3-Z, 4-Z и 5-Z максимальный потенциал Vmax 24.46,
составляет 39.82 ккал/моль, тогда как NH∙∙∙O=C
27.35 и 27.28 ккал/моль локализован на олефино-
водородный атом этой же NH2-группы имеет го-
вом атоме водорода; величины Vmax на пиррольных
раздо меньшее значение Vmax 17.14 ккал/моль.
NH-водородах в этих молекулах не превышают
Величины Vmax у всех метиновых CH протонов в
22 ккал/моль и лишь в изомере 6-Z потенциал Vmax
соединениях 2-6 (опущены в табл. 1, кроме оле-
равен 28.84 ккал/моль на атоме 2-H пиррольного
финовых протонов CH в Z-изомере, в котором они
цикла, а потенциал Vmax 25.40 ккал/моль локализо-
больше соответствующих значений для NH-прото-
ван на его NH-водороде.
нов) лежат в более низком диапазоне 12-20 ккал/
Величины Vmin на карбонильном кислороде,
моль, аналогично таковому у соединения 1.
вовлеченном в связь NH∙∙∙O, в Z-изомерах соеди-
Значения Vmin у карбонильных кислородов в
нений 2-5 ниже, чем у E-изомеров, максимальный
этих изомерах варьируются в диапазоне от -33
потенциал -34.84 ккал/моль получен для изоме-
до -45 ккал/моль. У молекулы 2-E, Vmin составля-
ра 3-Z. В изомере 6-Z, значение -40.09 ккал/моль
ет -40.51 ккал/моль, что на 2 ккал/моль меньше,
характеризует свободный атом кислорода O2, что
чем у молекулы 1 из-за сопряжения с пирроль-
превышает значение -36.06 ккал/моль для этого
ной π-системой. Самый высокий потенциал Vmin
атома в изомере 6-E. В изомерах 4-Z и 5-Z макси-
-44.92 ккал/моль на карбонильном атоме кислоро-
мальные значения Vmin найдены для ацетамидно-
го и гидроксильного атомов кислорода соответ-
да найден для свободной группы C=O у изомера
3-E, а самый низкий, -33.03 ккал/моль, у изоме-
ственно. Величина Vmin на карбонильном атоме
ра 4-E, в котором он внутримолекулярно связан с
кислорода в этих молекулах понижается до -18 и
-21 ккал/моль, что близко к величине Vmin на пир-
ацетамидной группой. Отметим, что ацетамидный
рольной π-системе.
кислород Oac в изомере 4-E имеет высокий потен-
циал Vmin -44.53 ккал/моль, очень близкий к тако-
Образование циклических димеров E-изомеров
вому у C=O группы в изомере 3-E. У изомера 6-E,
пиррольных производных 3-5 путем межмоле-
не имеющего заместителей в фенильном кольце,
кулярного связывания NHpyrrol∙∙∙OC=O было дока-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
875
НСМО-1 -2.42 эВ
НСМО-1 -2.28 эВ
ВЗМО-1 -5.78 эВ
ВЗМО-1 -5.90 эВ
ВЗМО-3 -7.14 эВ
ВЗМО-2 -6.78 эВ
3-Z
3-E
Рис. 4. Молекулярная структура НСМО и ВЗМО для изомеров 3-Z и 3-E. Для изомера 3-Z вместо ВЗМО-2 приведена ВЗМО-3,
так как именно она локализована в основном на НЭП карбонильных атомов кислорода.
зано методом РСА и ИК спектроскопии [22-25].
значение Vmin на карбонильном кислороде, тогда
Внутримолекулярная Н-связь между инданоно-
как наименее стабильным является димер изоме-
вым карбонильным кислородом и 7-NH или 7-OH
ра 4-Е, имеющего минимальную величину Vmin.
группой в E-изомерах соединений 2, 4 или 5 ста-
Это согласуется с экспериментальными частотами
новится компонентом бифуркационных водород-
ν(C=O) в спектрах твердых образцов, состоящих
ных связей в их димерах. Увеличение энергии
из самоассоциатов, и в растворе CH2Cl2, содер-
димеризации Edim 2-6 коррелирует с понижением
жащем мономерные молекулы. Подобно вычис-
длины межмолекулярных Н-связей NH∙∙∙O; в табл.
ленной разности частот Δν(C=O), максимальная
2 эти данные сопоставлены с величинами Vmin и
экспериментальная разность Δν(C=O) = 15 см-1
Vmax кислотных и оснóвных центров, образующих
найдена для соединения 3, а минимальная 3 см-1 -
водородные связи. Как видно из табл. 2, наблюда-
для соединения 4 (табл. 2). Соответствие прочно-
ется хорошая корреляция между стабильностью
сти димеров величинам Vmin и его отсутствие для
димеров и Vmin, варьирующихся в пределах 11.9
значений Vmax четко указывает на определяющую
ккал/моль. Однако такая корреляция отсутству-
роль нуклеофильности молекул при димеризации.
ет с потенциалом Vmax, варьирующимся в преде-
В качестве электронных дескрипторов, опи-
лах 5.6 ккал/моль. Наиболее стабильным являет-
сывающих взаимодействие соединений 1-6 как
ся димер изомера 3-Е, имеющего максимальное
с электрофилами, так и с нуклеофилами, мы ис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
876
ЧИПАНИНА и др.
НСМО-1 -2.81 эВ
НСМО-1 -2.71 эВ
ВЗМО-1 -6.27 эВ
ВЗМО-1 -6.23 эВ
ВЗМО-2 -7.05 эВ
ВЗМО-2 -6.84 эВ
6-Z
6-E
Рис. 5. Молекулярная структура НСМО и ВЗМО изомеров 6-Z и 6-E.
пользовали энергии ВЗМО/НСМО [55] и энерге-
2-5, позволяя оценивать степень переноса заряда
тическую щель Δ = EВЗМО - EНСМО, определяющие
для разных заместителей в фенильном кольце.
жесткость химической системы η = 1/2Δ и связан-
Степень переноса заряда в Z-изомерах, имеющих
ные с ее устойчивостью [56] (табл. 1). Чем больше
меньшую щель Δ, больше чем у E-изомеров. Самая
щель, тем жестче молекула [57]. Энергетическая
широкая щель и, следовательно, индекс жесткости
щель характеризует перенос заряда в сопряжен-
η получены для молекулы 1. Энергии ВЗМО-1,
ных системах, увеличиваясь при сужении щели, и
определяющие ионизационный потенциал и ну-
определяет их биологическую активность [58]. Ве-
клеофильность молекул, выше у Z-, чем у E-изо-
личина щели (Δ) зависит от структуры соединений
меров производных 2-5. Сходная форма ВЗМО-1
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
877
Схема 2.
и НСМО-1 для соединений 2, 4 и 5 показана на
изомере 3-Z (0.88 и 1.36 эВ относительно ВЗМО-1)
рис. 4 для двух изомеров молекулы 3, не имеющих
локализованы в основном на НЭП карбонильных
заместителей в бензольном кольце.
атомов кислорода. ВЗМО-1 и НСМО-1 в Z- и E-и-
зомерах диенона 6 одинаково делокализованы по
ВЗМО-1 в изомерах 3-Z и 3-E делокализованы
всей системе сопряжения, причем НСМО-1 не-
по π-системе сопряжения, включающей фрагмент
сколько больше локализована на бензольном коль-
енона O=C-C=C и пиррольный цикл. В отличие
от этого, НСМО-1 распределена по инданоновому
це (рис. 5). ВЗМО-2 лежит на 0.78 (6-Z) и 0.61 эВ
(6-E) ниже, чем ВЗМО-1 и локализована на НЭП
циклу практически одинаково в обоих изомерах.
атомов кислорода. Значения Vmin локализованы в
Лежащие ниже ВЗМО-2 в изомере 3-E и ВЗМО-3 в
Z-изомерах соединений 2-5 на НЭП карбонильно-
Таблица 3. Относительные энергии, потенциалы Vmin и Vmax, энергии граничных молекулярных орбиталей и энерге-
тическая щель Δ для соединений 7-12
-EВЗМО-1,
-EНСМО-1,
Соединение
ΔE, ккал/моль
-Vmin, ккал/моль
Vmax, ккал/моль
Δ, эВ
ккал/моль
ккал/моль
7a
0
40.96 N
25.27 CHPh
6.1738
2.6323
3.54
22.63 NH
7б
2.95
41.96 O
57.12 NH
6.2787
2.3877
3.89
8a
0
44.19 N
27.30 =CHolefin
6.2105
2.6125
3.60
8б
3.19
47.30 O
61.72 NH
6.2177
2.0615
4.16
9a
0
42.32 N
28.92 =CHolefin
6.5127
2.6922
3.82
9б
1.41
45.45 O
55.74 NH
6.5460
2.2103
4.34
10a
0
37.61 N
31.13 NH
6.6155
3.0542
3.56
37.02 O2
10б
13.03
60.79 N-O1
60.74 NH
6.5700
2.8503
3.72
11a
0
38.04 N
32.99 NH
6.6895
3.0305
3.66
36.50 O2
11б
13.00
61.16 N-O1
63.79 NH
6.5478
2.5224
4.03
12a
0
35.61 N
28.31 CHPh
6.9676
3.1389
3.83
33.90 O2
12б
4.31
33.80 O1
54.97 NH
6.9452
3.0603
3.88
32.17 N
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
878
ЧИПАНИНА и др.
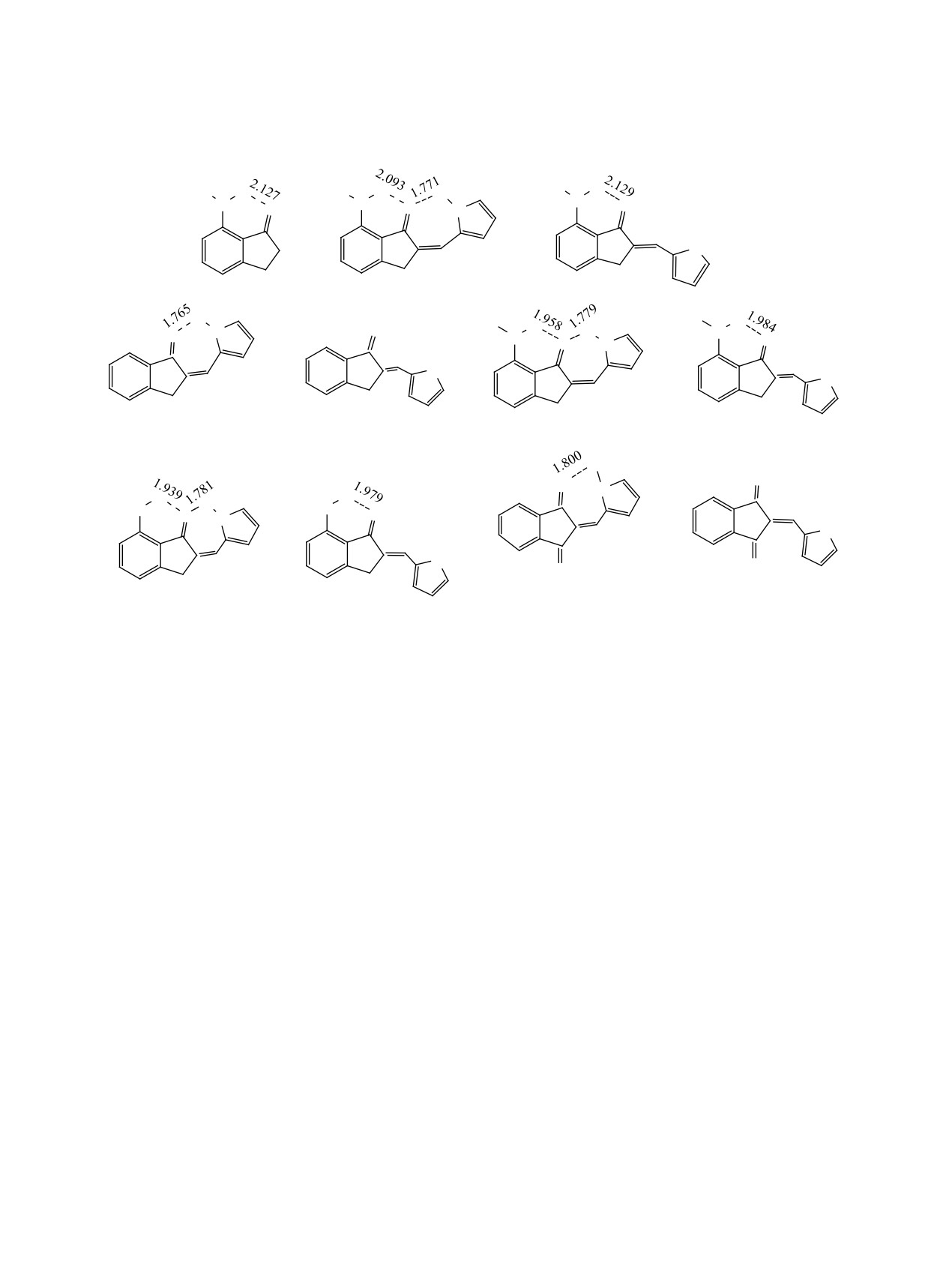
Рис. 6. Карты MEP для изомеров соединений 7-9 и значения Vmin и Vmax (ккал/моль).
го кислорода и заметно меньше, чем у E-изомеров,
В более стабильных Z-изомерах 7a-9a, как и
что не согласуется с более высокими энергиями
в их конформерах и таутомерах 7б-9б (схема 2),
их ВЗМО-1. В то же время нижележащие НСМО в
центром кислотности является NH-группа гетеро-
E-изомерах определяют их бóльшую электрофиль-
цикла, а конкурирующими центрами оснóвности
ность, в согласии с более высокими значениями
являются пиридиновый атом азота и карбониль-
Vmax. Исключением является изомер 6-Z, имею-
ный атом кислорода. Соответствующие карты
щий наинизшую НСМО и низкий потенциал Vmax
MEP приведены на рис. 6, а величины Vmin и Vmax -
на NH-группе.
в табл. 3.
Электрофильные и нуклеофильные свойства
Значение Vmax на свободной NH-группе ими-
изомерных 2-пирролилзамещенных производных
дазольного цикла в
4-имидазолильном про-
2-6 (схема 1), 2- или 4-имидазолил- и 2-пиразо-
изводном 8б (61.72) выше, чем у изомера 7б
лилпроизводных 7-12 (схемы 2, 3) тесно связаны
(57.12 ккал/моль), причем оба значения выше, чем
с их кислотными и основными свойствами. NH
у пиррольной NH-группы в E-изомерах пирроль-
кислотность диазолов (pKa 14.2-14.5) выше, чем у
ных производных 2-5 в отличие от значений pKa
пиррола (pKa 17.5). Основность пиррола намного
соответствующих гетероциклов. Значение Vmax на
ниже, чем у диазолов, содержащих пиридиновый
пиразольной NH-группе в производном 9б ожида-
атом азота; pKa сопряженных кислот имидазола,
емо ниже, чем в имидазольных циклах. В их Z-изо-
пиразола и пиридина составляет 7.0, 2.5 и 5.2 со-
мерах с внутримолекулярными водородными свя-
ответственно [28].
зями NH∙∙∙O, значения Vmax существенно ниже, так
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
879
Схема 3.
O
O
O
NH
N
NH
N
HN
N
7в
8в
9в
∆E
5.52
4.45
2.17
что наибольшие величины Vmax 25-28 ккал/моль
циатов с участием менее стабильных конформеров
найдены на фенильных и олефиновых метиновых
7в-9в (схема 3): Vmin O -42.90, N -41.54 (7в), O
атомах водорода CH. Атом кислорода свободной
-41.59, N -39.51 (8в), O -39.66, N -34.73 ккал/моль
C=O группы в соединениях 7б-9б и свободные пи-
(9в); Vmax NH
59.35
(7в), NH
58.75
(8в), NH
ридиновые атомы азота в Z-изомерах 7a-9a име-
51.28 ккал/моль (9в). Пиридиновый атом азота в
ют близкие значения Vmin в диапазоне от -41 до
последних свободен и имеет значение Vmin в ди-
-47 ккал/моль. Наибольший (-47.30) и наимень-
апазоне от -35 до -42 ккал/моль, близком к диа-
ший потенциалы (-41.96) найдены у 2- и 4-имида-
пазону для свободного атома кислорода от -40 до
золильных производных 7б и 8б соответственно.
-43 ккал/моль.
В 2-пиразолильном производном 9б Vmin пириди-
Z-Изомеры 7a-9a имеют меньшие энергетиче-
нового азота -45.45 ккал/моль является проме-
ские щели Δ и, следовательно, бóльшую степень
жуточным, как и значение Vmin свободного атома
переноса заряда и реакционную способность
азота в Z-изомерах. Благодаря пространственной
(табл. 3). В отличие от Z-изомеров 2a-5a, это мо-
близости, пиридиновые атомы азота в имидазо-
жет быть обусловлено наличием свободного пи-
лильных и пиразолильных производных 7б-9б об-
ридинового атома азота в гетероцикле с большим
разуют внутримолекулярные водородные связи с
потенциалом Vmin. Бóльшая нуклеофильность
метиленовыми CH2-группами пятичленного коль-
соединений 7a-9a находится в согласии с бóль-
ца. Несмотря на большие невалентные расстояния
шей энергией их ВЗМО-1. Более низкая энергия
CH∙∙∙N, значение Vmin на этом атоме намного ниже,
НСМО, а значит и бóльшая электрофильность на-
чем в Z-изомерах, и снижается в ряду 7б (-29.72) >
блюдаются у изомера 7б и таутомеров 8б и 9б, что
8б (-28.03) > 9б (-20.20 ккал/моль), в соответствии
согласуется с их высокими значениями Vmax. Вид
с укорочением H-связей: 2.811 > 2.805 > 2.773 Å.
ВЗМО и НСМО у 2-имидазолильных изомеров 7a
В Z-изомерах, имеющих свободный пиридино-
и 7б, а также их делокализация (рис. 7) такие же,
вый атом азота, порядок другой: 8a (-44.19) < 9a
как у Z- и E-изомеров пиррольного производного 3.
(-42.32) < 7a (-40.96 ккал/моль). Большой потен-
Электронное распределение в изомерах азоль-
циал Vmin на карбонильном кислороде и Vmax на
ных производных 1,3-дионов 10-12 (схема 4) ха-
NH-протоне в производных 7б-9б благоприятны
рактеризуется некоторыми особыми свойствами
для образования циклических димеров с межмо-
(табл. 3, рис. 8). Их более стабильные Z-изомеры
лекулярными водородными связями NH∙∙∙O, по-
в твердом состоянии и в растворе содержат вну-
добными таковым в димерах 2-E-5-E пиррольных
тримолекулярные водородные связи NH∙∙∙O1, по-
производных. Тем не менее, как показывает ИК
добные таковым у Z-изомеров соединений 7-9.
спектроскопия, соединения 7-9 в твердом состо-
Оставшиеся центры основности представлены
янии существуют в виде ассоциатов с межмолеку-
пиридиновым атомом азота гетероцикла и вторым
лярными водородными связями NH∙∙∙N с участи-
карбонильным кислородом C=O2, имеющим зна-
ем пиридинового азота гетероцикла [28]. Низкий
чение Vmin от -34 до -38 ккал/моль. NH-Группа в
потенциал Vmin на этом атоме азота в соединениях
изомерах 10a-Z и 11a-Z, несмотря на то, что она
7б-9б позволяет предположить образование ассо-
вовлечена в водородное связывание, имеет макси-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
880
ЧИПАНИНА и др.
НСМО-1 -2.63 эВ
НСМО-1 -2.39 эВ
ВЗМО-1 -6.17 эВ
ВЗМО-1 - 6.28 эВ
ВЗМО-3 -7.38 эВ
ВЗМО-2 -6.89 эВ
7а
7б
Рис. 7. Молекулярная структура НСМО и ВЗМО изомеров 7a и 7б (ВЗМО-3, см. примечание к рис. 4).).
мальные значения Vmax 31-33 ккал/моль. Однако
мами азота и кислорода. Вторые свободные атомы
в пиразолильном производном 12a значение Vmax
кислорода O2 имеют намного более низкие значе-
NH-группы уменьшается, так что максималь-
ния Vmin -36.50 и -33.90 ккал/моль, т. е. близко к
ный потенциал Vmax 28.3 ккал/моль наблюдает-
свободным атомам кислорода в Z-изомерах. Значе-
ся на CH5 атоме водорода фенильного кольца. В
ния Vmin на свободных атомах кислорода и азота
ротамере 10б и таутомерах 11б, 12б NH-протон
в пиразольном производном 12б мало отличают-
имидазольного цикла имеет значение Vmax 61-
ся друг от друга (-33.80 и -32.17 ккал/моль) и от
64 ккал/моль, что больше, чем у соединений 7б и
Z-изомера (-33.90 и -35.61 ккал/моль).
8б (57 и 62 ккал/моль), а на пиразольной NH-груп-
Наибольшая степень переноса заряда и реакци-
пе, как и в соединении 9б, он равен 55 ккал/моль.
онная способность среди ротамеров и таутомеров
Максимально отрицательные значения Vmin у
1,3-дионов 10-12, согласно меньшей энергетиче-
имидазольных производных 10б и 11б очень вы-
ской щели Δ, наблюдается у 2- и 4-имидазолиль-
соки и достигают -61 ккал/моль. Очевидно, это
ных производных 10a-Z и 11a-Z (табл. 3). Судя по
связано с их положением между свободными ато-
энергиям ВЗМО, ротамер 10б и таутомер 11б име-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
881
10а
10б
11а
11б
12а
12б
Рис. 8. Карты MEP для изомеров соединений 10-12 и значения Vmin и Vmax (ккал/моль).
Схема 4.
H
H
O1
O1
O1
N
N
N
N
NH
N
2
O
2
O2
O
10б
10a
11a
1
H
N
O1
O
O1
N
N
NH
N
NH
O2
O2
O2
12б
11б
12a
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
882
ЧИПАНИНА и др.
НСМО-1 -3.05 эВ
НСМО-1 -2.85 эВ
ВЗМО-1 -6.62 эВ
ВЗМО-1 -6.57 эВ
ВЗМО-2 -7.26 эВ
ВЗМО-2 -6.73 эВ
10а
10б
Рис. 9. Локализация ВЗМО и НСМО ротамеров 10a и 10б.
ют максимальную нуклеофильность. Они также
клеофильностью и электрофильностью ротамеров
имеют самый большой потенциал Vmax NH-групп
и таутомеров. В изомерах пиррольных произво-
и, судя по энергии НСМО, наиболее электрофиль-
дных 2-5 такие корреляции очень ограничены.
ны. ВЗМО-1 и НСМО-1 в производных 10a и 10б,
Это может быть связано с их способностью обра-
как и в Z,E-изомерах соединения 6, локализованы
зовывать самоассоциаты путем водородного свя-
не только на индандионовом и азольном циклах,
зывания с большим вкладом электростатического
но и на фенильном кольце. ВЗМО-2 локализована
взаимодействия.
на НЭП обоих карбонильных атомов кислорода в
В то же время, азолильные производные ено-
производных 10a и 10б, с разницей энергий отно-
нов и 1,3-дионов могут быть прекурсорами при
сительно ВЗМО-1 0.64 и 0.16 эВ соответственно
образовании комплексов с металлами путем об-
(рис. 9).
разования координационных связей с большим
Таким образом, энергии ВЗМО и НСМО диа-
ковалентным вкладом. Так, например, теоретиче-
золильных производных енонов и 1,3-дионов 7-12
скими и электрохимическими методами был изу-
находятся в хорошем согласии с максимальными
чен ряд N-донорных гетероциклических лигандов,
величинами Vmax и Vmin, а следовательно, и с ну-
включая большую группу пиридиновых диенонов
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
883
Схема 5.
стоянии, когда соединения образуют самоассоци-
Cl
Cl
аты за счет межмолекулярных связей NH∙∙∙N [28].
В спектрах медных комплексов с лигандами 7 и 9
Cu
H
H
максимумы этих полос практически не меняются
O
N
N
O
N
N
в сравнении с лигандами в твердом состоянии, а
в спектре комплекса CuCl2∙122 наблюдается даже
коротковолновый сдвиг низкочастотной полосы на
12 см-1. Это указывает на образование координа-
O
O
ционной связи между атомом меди и пиридино-
вым атомом азота гетероцикла в лиганде, подобно
[59, 60]. Была обнаружена корреляция между рас-
образованию межмолекулярной водородной связи
считанными энергиями ВЗМО лигандов в газовой
NH∙∙∙N в самоассоциатах лигандов. Отсутствие
фазе и первым потенциалом электрохимическо-
сдвига ИК полос в спектрах комплексов с лиганда-
го восстановления в растворе. Потенциальными
ми 7 и 9 означает примерно одинаковую прочность
предшественниками для получения комплексов
координационной и водородной связей в комплек-
являются пиридинсодержащие циклогексаноны,
сах и в свободных лигандах, соответственно, тогда
пентаноны и азолы, а также производные амино-
как отмеченный выше высокочастотный сдвиг в
енонов, как полидентатные лиганды, способные к
спектре CuCl2∙122 обусловлен более прочной коор-
образованию моно-, ди- или тридентатных струк-
динационной связью N→Cu по сравнению с водо-
тур с ионами металлов [15, 61-63]. Например,
родной связью NH∙∙∙N в лиганде 12. Наличие не-
лиганды, полученные из 3,7-диазабицикло[3,3,1]-
скольких полос ν(NH) в диапазоне 3300-3100 см-1
нонан-9-она предварительно реорганизуются для
в спектрах комплексов меди с соединениями 7, 9
комплексообразования и очень хорошо сочетают-
и 12 может быть связано с участием этих групп в
ся с катионом двухвалентной меди [64].
образовании межмолекулярных бифуркационных
ИК спектры комплексов диазолильных про-
связей различного типа.
изводных циклоалканонов 7, 9 и 12 с CuCl2. Ди-
По результатам проведенного исследования
азольные производные 7, 9 и 12, как лиганды (L),
можно сделать следующие выводы. Для изомеров,
образуют порошкообразные комплексы с CuCl2.
таутомеров и конформеров пиррольных и диазо-
Их состав CuCl2∙L2 был определен методом ска-
льных производных циклоалканонов рассчитаны
нирующей электронной микроскопии на примере
карты положительного и отрицательного моле-
комплекса CuCl2 с соединением 12 (схема 5). Было
кулярного электростатического потенциала. В
найдено, что соотношение органических и неорга-
сочетании с электронными дескрипторами реак-
нических элементов составляет C:Cl = 4.33 и 4.50,
ционной способности на основе энергий ВЗМО/
C:Cu = 5.26 и 5.37. Рассчитанные соотношения со-
НСМО, они позволяют анализировать влияние
ставляют C:Cl = 4.41 и C:Cu = 4.92 для CuCl2∙L2,
заместителя и внутримолекулярного водородного
тогда как для CuCl2∙L они гораздо ниже (2.20 и
связывания на оснóвные и кислотные центры в мо-
2.46). Использование отношений более корректно,
лекуле.
чем абсолютного процентного содержания, по-
Максимальный потенциал Vmax 56.71 ккал/моль
скольку метод не определяет содержание водорода.
в пиррольных производных 1,3-диона 6-E обу-
ИК спектры комплексов анализировали в
словлен наличием двух карбонильных групп в
сравнении со спектрами лигандов в твердом со-
индандионовом цикле. Максимальный потенци-
стоянии. В спектрах соединений 7-12 в растворе
ал Vmin -44.92 ккал/моль на карбонильном атоме
CH2Cl2, в котором они существуют в виде мо-
кислорода рассчитан для изомера 3-E с незаме-
номерных молекул, имеются две интенсивных
щенным фенильным кольцом, тогда как наимень-
полосы при 1730-1630 см-1, согласно расчетам
ший потенциал -33.03 ккал/моль - для изомера
обусловленные колебаниями νas(C=O, C=C) и
4-E с внутримолекулярной водородной связью
νs(C=O, C=C) [28]. Эти частоты практически не
C=O∙∙∙HNAc. Хорошее соответствие между вели-
меняются при переходе к спектрам в твердом со-
чинами Vmin и энергиями димеризации и длинами
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
884
ЧИПАНИНА и др.
межмолекулярных водородных связей, а также от-
7-Аминоиндан-1-он (1) получен как описано
сутствие такого соответствия для потенциала Vmax
ранее [65]. Спектр ЯМР 13C (CDCl3), δ, м. д.: 208.0
свидетельствуют об определяющей роли нуклео-
(C=O), 156.2 (C7), 147.4 (C9), 136.3 (C5), 120.8 (C8),
фильности молекул при их димеризации. Димеры
113.9 (C4), 112.1 (C6), 36.4 (C2), 25.6 (C3).
образуются за счет водородных связей NH∙∙∙N с
(E)-2-[(1H-Пиррол-2-ил)метилиден]-7-
участием пиридиновых атомов азота менее ста-
амино-2,3-дигидро-1H-инден-1-он (2). К смеси
бильного конформера, который остается свобод-
0.75 г (5.1 ммоль) соединения 1 и 0.5 г (5.3 ммоль)
ным и характеризуется значением Vmin близким к
2-пирролилкарбальдегида в 20 мл абс. этано-
таковому у свободного атома кислорода, варьиру-
ла прибавляли 1 мл 4 M. водного раствора KOH.
ющимся от -40 до -43 ккал/моль.
Смесь кипятили 3 ч и оставляли на ночь. Оса-
док отфильтровывали и промывали холодным
Индексы, полученные из анализа энергети-
этанолом. Выход 0.89 г (78%), желтые кристал-
ческой щели ВЗМО/НСМО для азольных произ-
лы, т. пл. 192-194°C. Спектр ЯМР 1H (CD2Cl2),
водных енонов и 1,3-дионов соответствуют мак-
δ, м. д.: 3.84 м (2H, CH2), 5.73 уш. с (2H, NH2),
симальным отрицательному и положительному
6.44 м (1H, H3′), 6.56 д. д. д (1H, H6, J 8.1, 0.7,
потенциалам и, следовательно, нуклеофильности
0.7 Гц), 6.72 м (1H, H4′), 6.80 д. д. т (1H, H4, J 7.3, 0.9,
и электрофильности таутомеров и ротамеров. В
0.9 Гц), 7.07 м (1H, H5′), 7.35 д. д (1H, H5, J 8.1,
изомерах пиррольных производных 2-5 такое со-
7.3 Гц), 7.42 т (1H, =CH, J 2.0 Гц), 8.80 уш. с (1H,
ответствие весьма ограничено, вероятно, из-за
NH); неперекрывающиеся сигналы Z-изомера по-
возможности образования самоассоциатов за счет
сле облучения: 3.76 м (CH2), 5.78 уш. с (NH2), 6.33
водородных связей преимущественно электроста-
м (1H, H3′), 6.85 м (=CH), 13.30 уш. с (NH). Спектр
тической природы. Диазольные производные ено-
ЯМР 13C, CDCl3, δС, м. д.: 194.4, 149.4, 147.7,
нов и 1,3-дионов могут служить лигандами при
135.8, 130.3, 129.5, 122.5, 122.1, 121.1, 114.3, 113.4,
формировании металлокомплексов за счет образо-
112.6, 111.7, 32.2. Найдено, %: C 75.08; H 5.26; N
вания координационных связей преимущественно
12.58. C14H12N2O. Вычислено, %: C 74.98; H 5.39;
ковалентной природы. Получены медные комплек-
N 12.49.
сы CuCl2∙L2, в которых лиганд является имидазо-
Комплексы CuCl2∙L2 (общая методика).
льным или пиразольным производным циклоал-
0.1 ммоль азола растворяли в 3 мл MeOH, затем
канонов. Сравнение их ИК спектров со спектрами
добавляли 0.05 ммоль CuCl2∙2H2O в 2 мл MeOH
свободных лигандов показало, что, наряду с коор-
при перемешивании. Практически сразу происхо-
динационными связями N→Cu, комплексы вклю-
дит образование зеленого осадка. Смесь переме-
чают межмолекулярные водородные связи различ-
шивали 3-4 ч. Образовавшийся осадок отфиль-
ной силы.
тровывали, промывали небольшим количеством
МеОН и сушили при 15 мм рт. ст. Выход 23-25 мг
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
(83-86%).
Спектры ЯМР 1H и 13C снимали на спектроме-
Квантовохимические расчеты выполнены с
тре Bruker DMX-500 с рабочей частотой 500.13 и
помощью программы Gaussian09 [66] с полной
125.13 МГц соответственно. Химические сдвиги
оптимизацией геометрии и расчетом частот для
измерены относительно остаточных сигналов рас-
соединений 1-6 и их димеров методом B3LYP/6-
творителя и приведены относительно ТМС. УФ об-
311++G(d,p) и методом M06-2X/6-311++G(d,p)
лучение раствора соединения 2 проводили в квар-
для соединений 7-12 [28]. Основные расчетные
цевой кювете в растворе CD2Cl2 при длине волны
характеристики в обоих методах совпадают. При-
365 нм. ИК спектры твердых образцов и растворов
надлежность стационарных точек к минимумам
в CH2Cl2 снимали на спектрометре Varian 3100
доказана положительными значениями гессиана.
FT-IR в режиме ATR-FT-IR и FT-IR. Элементный
Относительные энергии (ΔE) рассчитаны по от-
анализ комплекса CuCl2∙122 выполнен с использо-
ношению к наиболее стабильным формам. Кар-
ванием настольного сканирующего электронного
ты MEP рассчитаны по программе Gaussian’09 с
микроскопа Hitachi TM-3000 (Япония).
контуром электронной плотности 0.001 ат. ед. на
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
885
уровне MP2/aug-cc-pVDZ и проанализированы
5.
Wei A.C., Ali M.A., Yoon Y.K., Ismail R., Choon T.S.,
по программе Multiwfn 3.3.5 [67]. Метод NBO ис-
Kumar R.S., Arumugam N., Almansour A.I., Osman H. //
пользован для оценки энергий и формы орбиталей
Bioorg. Med. Chem. Lett. 2012. Vol. 22. N 15. P. 4930.
doi 10.1016/j.bmcl.2012.06.047
ВЗМО и НСМО [68, 69], рассчитанных на уровне
6.
Вацадзе С.З., Громов С.П. // Макрогетероциклы.
B3LYP/6-311++G(d,p).
2017. Т. 10. С. 432; Vatsadze S.Z., Gromova S.P. //
ИНФОРМАЦИЯ ОБ АВТОРАХ
Macroheterocycles. 2017. Vol. 10. P. 432. doi 10.6060/
mhc171142v
Ознобихина Лариса Петровна, ORCID: http://
7.
Bansal R., Narang G., Zimmer C., Hartmann R.W. //
orcid.org/0000-0003-0499-4842
Med. Chem. Res. 2011. Vol. 20. P. 661. doi 10.1007/
Сигалов Марк Владимирович, ORCID: http://
s00044-010-9368-4
orcid.org/0000-0002-7609-9030
8.
Pati H.N., Das U., De Clercq E., Balzarini J., Dim-
mock J.R. // J. Enzyme Inhib. Med. Chem. 2007.
Vol. 22. P. 37. doi 10.1080/14756360600958057
org/0000-0002-5297-9076
9.
Dimmock J.R., Zello G.A., Oloo E.O., Quail J.W.,
Kraatz H.-B., Perjesi P., Aradi F., Takacs-Novak K.,
org/0000-0002-4296-7899
Allen T.M., Santos C.L., Balzarini J., De Clercq E.,
Stables J.P. // J. Med. Chem. 2002. Vol. 45. P. 3103. doi
БЛАГОДАРНОСТЬ
10.1021/jm010559p
Авторы выражают благодарность Т.Н. Бороди-
10.
Sarjiman S.S., Reksohadiprojio M.S., Hakim L., van der
ной (Иркутский институт химии СО РАН) за эле-
Goot H., Timmerman H. // Eur. J. Med. Chem. 1997.
ментный анализ комплекса CuCl2∙122.
Vol. 32. P. 625.
11.
Kawamata J., Inoue K., Kasatani H., Terauchi H. //
ФОНДОВАЯ ПОДДЕРЖКА
Japan J. Appl. Phys. 1992. Vol. 31. P. 254.
12.
Вацадзе С.З., Голиков A.Г., Kривенькo A.П.,
Работа выполнена при частичной поддержке
Зык Н.В. // Усп. xим. 2008. Т. 77. С. 707; Vatsadze S.Z.,
Российского фонда фундаментальных исследова-
Golikov A.G., Kriven’ko A.P., Zyk N.V. // Russ.
ний с использованием оборудования Байкальского
Chem. Rev. 2008. Vol. 77. P. 661. doi 10.1070/
аналитического центра коллективного пользова-
RC2008v077n08ABEH003771
ния Сибирского отделения РАН (грант № 19-03-
13.
Kone M.G., Affi S.T., Ziao N., Bamba K., Assanvo E.F. //
00036).
J. Chem. Pharm. Res. 2015. Vol. 7. N 12. P. 805.
14.
Zheng S.-L., Tong M.-L., Chen X.-M. // Coord. Chem.
КОНФЛИКТ ИНТЕРЕСОВ
Rev. 2003. Vol. 246. P. 185. doi 10.1016/S0010-
Б.А. Шаинян является членом редколлегии
8545(03)00116-4
Журнала общей химии. Остальные авторы заявля-
15.
Vatsadze S.Z., Kovalkina M.A., Sviridenkova N.V.,
ют об отсутствии конфликта интересов.
Zyk N.V., Churakov A.V., Kuzmina L.G., Ho-
ward J.A.K. // Cryst. Eng. Commun. 2004. Vol. 6.
СПИСОК ЛИТЕРАТУРЫ
P. 112. doi 10.1039/B402418D
1. Perjési P., Takacs-Novak K., Rozmer Z., Sohar P.,
16.
Aly A.A.M., Vatsadze S Z., Walfort B., Ruffer T.,
Bozak R.E., Allen T.M. // Cent. Eur. J. Chem. 2012.
Lang H. // Russ. J. Inorg. Chem. 2017. Vol. 62. N 12.
Vol. 10. P. 1500. doi 10.2478/s11532-012-0088-0
P. 1584. doi 10.1134/S0036023617120038
2. Yamagata N., Demizu Y., Sato Y., Doi M., Tanaka M.,
17.
Aly A.A.M., Vatsadze S.Z., Chernikov A.V., Walfort B.,
Nagasawa K., Okuda H., Kurihara M. Tetrahedron
Ruffer T., Lang H. // Polyhedron 2007. Vol. 26. N 14.
Lett. 2011. Vol. 52. N 7. P. 798. doi 10.1016/j.
P. 3925. doi 10.1016/j.poly.2007.04.045
tetlet.2010.12.030
18.
Utochnikova V.V., Latipov E.V., Dalinger A.I., Nelyubi-
3. Dimmock J.R., Kandepu N.M., Nazarali A.J., Kowal-
na Y.V., Vashchenko A.A., Hoffmann M., Kalyakina S.,
chuk T.P., Motaganahalli N., Quail J.W., Mykytiuk P.A.,
Vatsadze S.Z., Schepers U., Bräse S., Kuzmina N.P. //
Audette G.F., Prasad L., Perjesi P., Allen T.M., Santos
J. Luminesc. 2018. Vol. 202. P. 38. doi 10.1016/j.
C.L., Szydlowski J., De Clercq E., Balzarini J. // J. Med.
jlumin.2018.05.022
Chem. 1999. Vol. 42. P. 1358. doi 10.1021/jm9806695
19.
Ahmad K., Naseem H.A., Parveen S., Shah H.R.,
4. Perjési P., Linnanto J., Kolehmainen E., Osz E.,
Shah S.S.A., Shaheen S., Ashfaq A. // J. Mol.
Virtanen E. // J. Mol. Struct. 2005. Vol. 740. N 1. P. 81.
Struct. 2019. Vol. 1198. P. 126885. doi 10.1016/j.
doi 10.1016/j.molstruc.2004.10.013
molstruc.2019.126885
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
886
ЧИПАНИНА и др.
20.
Green T.L.C., Nelson P.N., Lawrence M.A.W. // J.
37.
Ehresmann B., Martin B., Horn A.H.C., Clark T. // J.
Mol. Struct. 2019. Vol. 1195. P. 426. doi 10.1016/j.
Mol. Model. 2003. Vol. 9. P. 342. doi 10.1007/s00894-
molstruc.2019.06.011
003-0153-x
21.
Далингер А.И., Медведько А.В., Балалаева А.И.,
38.
Galabov B., Bobadova-Parvanova P., Ilieva S.,
Вацадзе И.А., Далингер И.Л., Вацадзе С.З. // ХГС.
Dimitrova V. // J. Mol. Struct. (Theochem). 2003.
2020. Т. 56. № 2. С. 180; Dalinger A.I., Medved’ko A.V.,
Vol. 630. P. 101. doi 10.1016/S0166-1280(03)00149-0
Balalaeva A.I., Vatsadze I.A., Dalinger I.L., Vatsad-
39.
Kecel-Gunduz S., Bicak B., Celik S., Akyuz S., Ozel A.E. //
ze S.Z. // Chem. Heterocycl. Compd. 2020. Vol. 56. N 2.
J. Mol. Struct. 2017. Vol. 1137. P. 756. doi 10.1016/j.
P. 180. doi 10.1007/s10593-020-02643-2
molstruc.2017.02.075
22.
Sigalov M., Shainyan B., Chipanina N., Oznobikhina
40.
Jangir A.K., Mandviwala H., Patel P., Sharma S.,
L., Strashnikova N., Sterkhova I. // J. Org. Chem. 2015.
Kuperkar K. // J. Mol. Liquid. 2020. Vol. 317. P. 113923.
Vol. 80. P. 10521. doi 10.1021/acs.joc.5b01604
doi 10.1016/j.molliq.2020.113923
23.
Sigalov M.V., Shainyan B.A., Sterkhova I.V. // J.
41.
Politzer P., Laurence P.R., Jayasuriya K. // Environ.
Org. Chem. 2017. Vol. 82. P. 9075. doi 10.1021/acs.
Health Persp. 1985. Vol. 61. P. 191. doi 10.1289/
joc.7b01589
ehp.8561191
24.
Chipanina N.N., Oznobikhina L.P., Sigalov M.V.,
42.
Caballero-García G., Mondragón-Solórzano G., Torres-
Shainyan B.A. // J. Phys. Org. Chem. 2019. Vol. 32.
Cadena R., Díaz-García M., Sandoval-Lira J., Barroso-
P. e3924. doi 10.1002/poc.3924
Flores J. // Molecules. 2019. Vol. 24. P. 79. doi 10.3390/
25.
Sigalov M.V., Shainyan B.A., Chipanina N.N.,
molecules24010079
Oznobikhina L.P., Kuzmin A.V. // Tetrahedron 2020.
43.
Bauza A., Mooibroek T.J., Frontera A. // Angew.
Vol. 76. P. 131202. doi 10.1016/j.tet.2020.131202
Chem. Int. Ed. 2013. Vol. 52. P. 12317. doi 10.1002/
26.
Sigalov M., Shainyan B., Chipanina N., Ushakov I.,
anie.201306501
Shulunova A. // J. Phys. Org. Chem. 2009. Vol. 22.
44.
Bauza A., Seth S.K., Frontera A. // Coord. Chem. Rev.
P. 1178. doi 10.1002/poc.1573
2019. Vol. 384. P. 107. doi 10.1016/j.ccr.2019.01.003
27.
Sigalov M.V., Shainyan B.A., Chipanina N.N.,
45.
Grabowski S.J. // Phys. Chem. Chem. Phys. 2014.
Oznobikhina L.P. // J. Phys. Chem. (A). 2013. Vol. 117.
Vol. 16. P. 1824. doi 10.1039/c3cp53369g
P. 11346.
46.
Zierkiewicz W., Michalczyk M. // Theor. Chem. Acc.
28.
Sigalov M.V., Shainyan B.A., Chipanina N.N.,
2017. Vol. 136. P. 125. doi 10.1007/s00214-017-2145-4
Oznobikhina L.P., Sterkhova I.V. // Tetrahedron. 2021.
47.
Vektariene A., Vektaris G., Svoboda J. // Arkivoc. 2009.
Vol. 77. P. 131755. doi 10.1016/j.tet.2020.131755
P. 311.
29.
29 Venil K., Lakshmi A., Balachandran V., Narayana B.,
48.
Kaya A.A., Demircioğlu Z., Kaya E.Ç., Büyükgüngör O. //
Salian V.V. // J. Mol. Struct. 2021. Vol. 1225. P. 129070.
Heterocycl. Commun. 2014. Vol. 20. P. 51.
doi 10.1016/j.molstruc.2020.129070
49.
Boukabcha N., Djafri A., Megrouss Y., Tamer Ö.,
30.
Mehmood A., Fahim A., Ahmed M., Noureen S. // J.
Avci D., Tuna M., Dege N., Chouaih A., Atalay Y.,
Mol. Struct. 2020. Vol. 1217. P. 128483. doi 10.1016/j.
Hamzaoui F. // J. Mol. Struct. 2019. Vol. 1194. P. 112.
molstruc.2020.128483
doi 10.1016/j.molstruc.2019.05.074
31.
Hou M., Zhu Y., Li Q., Scheiner S. // ChemPhysChem.
50.
Sathiya S., Senthilkumar M., Umarani P. // J. Mol.
2020. Vol. 21. P. 212. doi 10.1002/cphc.201901076
Struct. 2021. Vol. 1224. P. 129017. doi 10.1016/j.
32.
Sánchez-Sanz G., Trujillo C., Alkorta I., Elguero J. //
molstruc.2020.129017
ChemPhysChem. 2019. Vol. 20. P. 1572. doi 10.1002/
51.
Sivakumar C., Balachandran V., Narayana B., Salian V.
cphc.201900354
V, Revathi B., Shanmugapriya N., Vanasundari K. // J.
33.
Kalaiarasi C., Sangeetha P., Pavan M.S., Kumarad-
Mol. Struct. 2021. Vol. 1224. P. 129010. doi 10.1016/j.
has P. // J. Mol. Struct. 2018. Vol. 1170. P. 105. doi
molstruc.2020.129010
10.1016/j.molstruc.2018.05.030
52.
Siddiqui N., Javed S. // J. Mol. Struct. 2021. Vol. 1224.
34.
Politzer P., Murray J.S., Concha M.C. // Int. J. Quantum
P.129021. doi 10.1016/j.molstruc.2020.129021
Chem. 2002. Vol. 88. P. 19. doi 10.1002/qua.10109
53.
Custodio J.M.F., Gotardo F., Vaz W.F., D’Oliveira G.D.C.,
35.
Hussein W., Walker C.G., Peralta-Inga Z., Murray J.S. //
Cocca L.H.Z., Fonseca R.D., Perez C.N., Boni L.,
Int. J. Quantum Chem. 2001. Vol. 82. P. 160. doi
Napolitano H.B. // J. Mol. Struct. 2019. Vol. 1198.
10.1002/qua.1031
P. 126896. doi 10.1016/j.molstruc.2019.126896
36.
Murray J.S., Abu-Awwad F., Politzer P. // J. Mol. Struct.
54.
Kirishnamaline G., Magdaline J.D., Chithambarathanu T.,
(Theochem). 2000. Vol. 501. P. 241. doi 10.1016/S0166-
Aruldhas D., Anuf A.R. // J. Mol. Struct. 2021.Vol. 1225.
1280(99)00435-2
P. 129118. doi 10.1016/j.molstruc.2020.129118
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ЭЛЕКТРОНОДОНОРНЫЕ И ПРОТОНОДОНОРНЫЕ СВОЙСТВА
887
55.
Rauk A. Orbital Interaction Theory of Organic
65. Mukhina O.A., Bhuvan Kumar N.N., Arisco T.M.,
Chemistry. New York; Chichester: John Wiley & Sons,
Valiulin R.A., Metzel G.A., Kutateladze A.G. // Angew.
Inc., 2013.
Chem. Int. Ed. 2011. Vol. 50. P. 9423. doi 10.1002/
56.
Pearson R.G. // J. Chem.Sci. 2005. Vol.117. P. 369.
anie.201103597
57.
Pearson R.G. // J. Am. Chem. Soc. 1985. Vol. 107.
66. Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
P. 6801. doi 10.1021/ja00310a009
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
58.
Singh P., Islam S.S., Ahmad H., Prabaharan A. // J.
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Mol. Struct. 2018. Vol. 1154. P. 39. doi 10.1016/j.
Sonnenberg J.L., Hada M., Ehara M., Toyota K., Fuku-
molstruc.2017.10.012
da R., Hasegawa J., Ishida M., Nakajima T., Honda Y.,
59.
Al-Anber M., Vatsadze S., Holze R., Lang H., Thiel W.R. //
Kitao O., Nakai H., Vreven T., Montgomery J.A., Peral-
Dalton Trans. 2005. P. 3632. doi 10.1039/B508314A
ta J.E., Ogliaro F., Bearpark M., Heyd J.J., Brothers E.,
60.
Vatsadze S., Al-Anber M., Thiel W.R., Lang H., Holze R. //
Kudin K.N., Staroverov V.N., Kobayashi R., Normand J.,
J. Solid State Electrochem. 2005. Vol. 9. N 11. P. 764.
Raghavachari K., Rendell A., Burant J.C., Iyengar S.S.,
doi 10.1007/s10008-005-0676-4
Tomasi J., Cossi M., Rega N., Millam N.J., Klene M.,
61.
Nuriev V.N., Zyk N.V., Vatsadze S.Z. // Arkivoc. 2005.
Knox J.E., Cross J.B., Bakken V., Adamo C., Jaramillo J.,
Vol. 4. P. 208. doi 10.3998/ark.5550190.0006.417
Gomperts R., Stratmann R.E., Yazyev O., Austin A.J.,
62.
Kudryavtsev K.V., Shulga D.A., Chupakhin V.I.,
Cammi R., Pomelli C., Ochterski J.W., Martin R.L.,
Sinauridze E.I., Ataullakhanov F.I., Vatsadze S.Z. //
Morokuma K., Zakrzewski V.G., Voth G.A., Salvador P.,
Tetrahedron. 2014. Vol. 70. P. 7854. doi 10.1016/j.
Dannenberg J.J., Dapprich S., Daniels A.D., Farkas O.,
tet.2014.09.009
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
63.
Rocha M., Gil D.M., EchэВerría G.A., Piro O.E.,
Gaussian 09, revision E.01; Gaussian, Inc.: Wallingford,
Jios J.J., Ulic S.E. // J. Fluor. Chem. 2018. Vol. 208.
CT, 2009.
P. 36. doi 10.1016/j.jfluchem.2018.01.001
67. Lu T., Chen F.J. // J. Comput. Chem. 2012. Vol. 33.
64.
Вацадзе C.З., Тюрин В.С., Зык Н. В., Чураков А.В.,
P. 580. doi 10.1002/jcc.22885
Кузьмина Л.Г., Автомонов Е.В., Рахимов Р.Д., Бу-
68. Weinhold F., Landis C.R. Valency and Bonding: A
тин К.П. // Изв. АН. Сер. хим. 2005. Т. 54. № 8.
Natural Bond Orbital Donor-Acceptor Perspective.
C. 1773; Vatsadze S.Z., Tyurin V.S., Zyk N.V., Chura-
Cambridge: Cambridge University Press, 2005.
kov A.V., Kuz’mina L.G., Avtomonov E.V., Rakhi-
69. Glendening E.D., Reed A.E., Carpenter J.E., Weinhold, F.
mov R.D., Butin K.P. // Russ. Chem. Bull. 2005.
NBO Version 3.1. Pittsburg, PA, CT: Gaussian, Inc.
Vol. 54. P. 1825 doi 10.1007/s11172-006-0044-2
2003.
Electronodonor and Protonodonor Properties
of Pyrrolyl- and Diazolyl-Substituted Cycloalkanones
N. N. Chipaninaa, L. P. Oznobikhinaa, M. V. Sigalovb, V. Yu. Serykha, and B. A. Shainyana,*
a Favorsky Irkutsk Institute of Chemistry, Siberian Branch of the Russian Academy of Sciences, Irkutsk, 664033 Russia
b Ben Gurion University of the Negev, Beer Sheva, 84105 Israel
*e-mail: bagrat@irioch.irk.ru
Received April 20, 2021; revised April 20, 2021; accepted May 6, 2021
To assess the donor-acceptor properties of the basic and acid sites in pyrrolyl and diazolyl derivatives of cy-
cloalkanones, the energies and shapes of the boundary molecular orbitals of their tautomers and conformers
were calculated and maps of the charge density distribution were constructed. The competition of these sites in
the formation of hydrogen and coordination bonds and the possibility of participation of the studied products as
ligands in metal complexes were shown. Complexes of diazolyl derivatives with CuCl2 were obtained. Synthesis
of 7-amino-2-(pyrrolidin-2-ylmethylene)indan-1-one was performed. Its structure and tendency to UV-initiated
E→Z isomerization were studied by NMR and IR spectroscopy.
Keywords: cycloalkanones pyrrolyl (diazolyl) derivatives, NMR and IR spectroscopy, theoretical calculations,
charge density distribution, copper(II) complexes
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021