ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 888-895
УДК 547.541.52+547.412.12
N,N-(2,3-ДИМЕТИЛБУТ-2-ЕН-1,4-ДИИЛ)-
ДИБЕНЗОЛСУЛЬФОНАМИД И
N,N′-[(2E)-2,3-ДИМЕТИЛБУТ-2-ЕН-1,4-ДИИЛ]-
БИС(ТРИФТОРАЦЕТАМИД):
ОСОБЕННОСТИ ВОДОРОДНОГО СВЯЗЫВАНИЯ В
КРИСТАЛЛЕ И РАСТВОРАХ
© 2021 г. И. В. Стерхова*, В. В. Астахова, И. М. Лазарев
Иркутский институт химии имени А. Е. Фаворского Сибирского отделения Российской академии наук,
ул. Фаворского 1, Иркутск, 664033 Россия
*e-mail: irina_sterkhova@irioch.irk.ru
Поступило в Редакцию 25 марта 2021 г.
После доработки 25 марта 2021 г.
Принято к печати 15 апреля 2021 г.
Типы межмолекулярных самоассоциатов, образуемых в растворах N,N-(2,3-диметилбут-2-ен-1,4-диил)-
дибензолсульфонамида и N,N′-[(2E)-2,3-диметилбут-2-ен-1,4-диил]бис(трифторацетамида) в CCl4 по-
средством водородного связывания, изучены методами ИК спектроскопии и квантовой химии [B3LYP/6-
311G(d,p)]. Полученные данные сопоставлены с данными рентгеноструктурного анализа. Производное
бензолсульфонамида образует прочные водородосвязанные тетрамеры, которые существуют не только
в кристалле, но и в растворе, в то время как самоассоциаты производного трифторацетамида связаны
более слабыми Н-связями, которые легко разрываются в растворе при разбавлении.
Ключевые слова: N,N-(2,3-диметилбут-2-ен-1,4-диил)дибензолсульфонамид, N,N′-[(2E)-2,3-диметилбут-
2-ен-1,4-диил]бис(трифторацетамид), водородная связь, рентгеноструктурный анализ, самоассоциация,
ИК спектроскопия, квантово-химические расчеты
DOI: 10.31857/S0044460X21060068
Изучение биологических систем, в которых
четные данные представляют значительный инте-
водородное связывание является важнейшим ме-
рес с точки зрения предварительной оценки совме-
жмолекулярным взаимодействием, определяю-
стимости отдельных компонентов, например, при
щим как строение белков и полипептидов, так и
создании новых композиционных материалов на
проникновение молекул через клеточную мембра-
их основе. Синтез и изучение строения и свойств
ну, привлекает особый интерес исследователей
амидов и сульфонамидов является важной фун-
[1, 2]. Водородное связывание часто играет струк-
даментальной задачей, поскольку эти соединения
турообразующую роль и, как следствие, влияет на
проявляют биологическую активность и являются
свойства и реакционную способность [3-5]. Пока-
составной частью многих лекарственных форм, в
зано, что использование методов квантовой химии
том числе антибиотиков нового типа [8-11].
очень полезно для изучения особенностей межмо-
Данная работа является продолжением иссле-
лекулярного взаимодействия на уровне отдельных
дований молекулярной и надмолекулярной струк-
структурных фрагментов макромолекул [6, 7]. Рас-
туры новых карбоксамидов и сульфонамидов, в
888
N,N-(2,3-ДИМЕТИЛБУТ-2-ЕН-1,4-ДИИЛ)ДИБЕНЗОЛСУ
ЛЬФОНАМИД
889
1
2
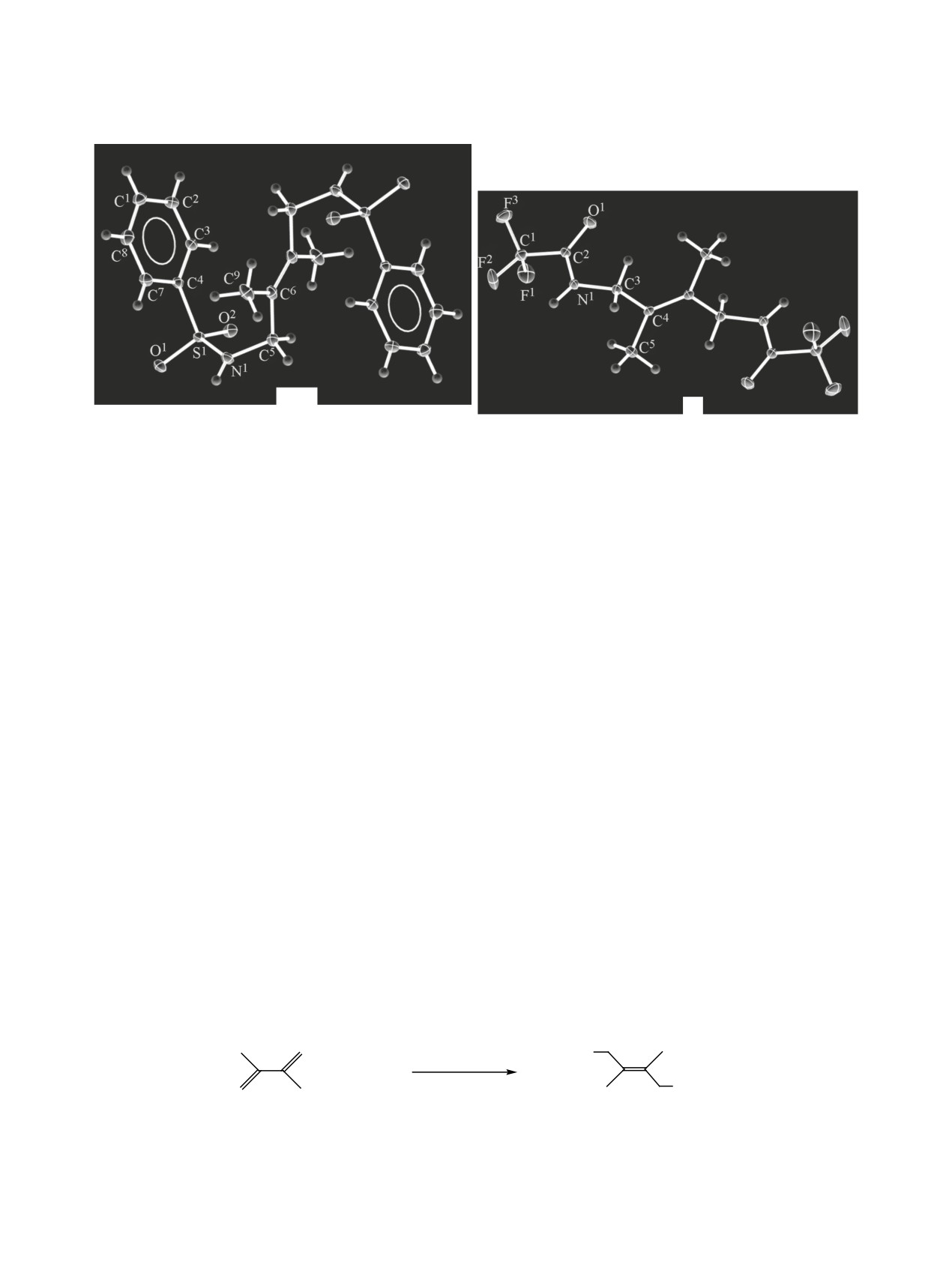
Рис. 1. Общий вид молекул амидов 1 и 2 в представлении тепловыми эллипсоидами (вероятность 50%).
том числе фторзамещенных и силилированных,
стереоэлектронного строения, кислотно-основных
методами рентгеноструктурного анализа, ИК спек-
свойств и процессов самоассоциации в растворе.
троскопии и квантовой химии [12-18]. В рамках
По данным РСА, в независимой части ячейки
данной работы мы изучили и сравнили поведение
амидов 1 и 2 находится половина молекулы. Дие-
в кристалле и растворе полученных нами ранее
новый фрагмент амидов 1 и 2 плоский, как и у их
N,N-(2,3-диметилбут-2-ен-1,4-диил)дибензолсуль-
структурного аналога - N,N′-(2,3-диметилбут-2-
фонамида 1 и N,N′-[(2E)-2,3-диметилбут-2-ен-1,4-
ен-1,4-диил)бис[2-(гидроксиметил)бензолсульфо-
диил]бис(трифторацетамида) 2.
намида] [21]. Геометрия бензолсульфонамидного
Амиды 1 и 2 получены по реакции 1,4-бисами-
и трифторацетамидного фрагментов молекул сое-
дирования 2,3-диметилбута-1,3-диена бензолсуль-
динений 1 и 2 близка к таковой у молекул бензол-
фонамидом и трифторацетамидом соответственно
сульфонамида [22] и трифторацетамида [23].
(схема 1). Детали синтеза и рентгеноструктурно-
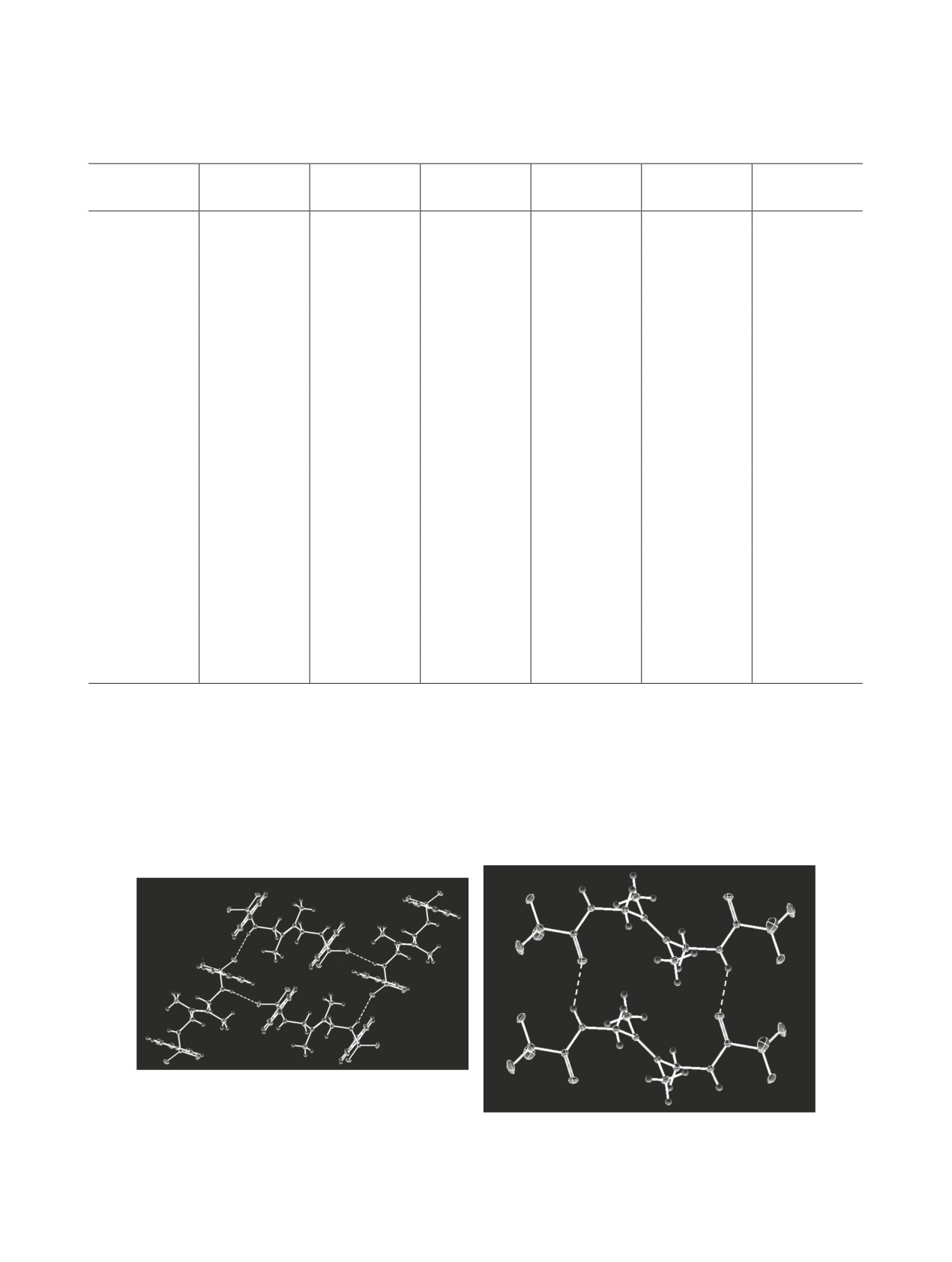
В кристалле молекулы амида 1 формируют во-
го анализа данных соединений приведены в на-
ших предыдущих работах [19, 20]. Молекулярные
дородосвязанные сети, расположенные перпенди-
кулярно оси а, элементарным звеном такой сети
структуры амидов 1 и 2 приведены на рис. 1, ос-
новные длины связей и углы представлены в табл. 1.
является тетрамер, образуемый четырьмя молеку-
лами амида 1 (рис. 2а). Все Н-связи NH···O=S это-
Хотя молекулярное строение этих схожих по
го тетрамера одинаковы и имеют длину 2.331 Å. В
строению симметричных амидов было доказано
методом РСА, однако их кристаллическая структу-
отличие от этого, молекулы амида 2 образуют во-
ра не обсуждалась и процессы их самоассоциации
дородосвязанные цепочки, элементарным звеном
в растворах не изучались. Наличие двух амидных
которых является симметричный циклический ди-
фрагментов и двойной связи C=C делает эти со-
мер (рис. 2б), длины Н-связей NH···O=C в котором
единения интересными объектами исследования
равны 2.068 Å.
Схема 1.
XNH
t-BuOCl, NaI
+
XNH2
MeCN
NHX
1, 2
X = PhSO2 (1), CF3C(O) (2).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
890
СТЕРХОВА и др.
Таблица 1. Некоторые геометрические характеристики амидов 1 и 2
Валентный
Торсионный
Амид
Связь
d, Å
φ, град
θ, град
угол
угол
1
S1-O1
1.443(1)
O1S1N1
105.9(1)
O2S1N1C5
43.8(1)
S1-O2
1.438(1)
O2S1O1
119.4(1)
O1S1N1C5
172.6(1)
S1-N1
1.616(1)
O2S1N1
107.6(1)
C4S1N1C5
-73.1(1)
S1-C4
1.768(1)
O2S1C4
107.7(1)
C8C1C2C3
0.2(2)
N1-C5
1.482(2)
O1S1C4
106.3(1)
C1C2C3C4
1.4(2)
C1-C2
1.388(2)
N1S1C4
109.8(1)
C2C3C4C7
-1.9(2)
C1-C8
1.394(2)
C5N1S1
119.8(1)
C2C3C4S1
174.9(1)
C2-C3
1.395(2)
C2C1C8
120.3(1)
O2S1C4C3
1.7(1)
C3-C4
1.388(2)
C1C2C3
120.3(1)
O1S1C4C3
-127.3(1)
C4-C7
1.396(2)
C4C3C2
118.9(1)
N1S1C4C3
118.5(1)
C5-C6
1.515(2)
C3C4C7
121.4(1)
O2S1C4C7
178.6(1)
C6-C6
1.343(2)
C3C4S1
119.7(1)
O1S1C4C7
49.6(1)
C6-C9
1.508(2)
C7C4S1
118.8(1)
N1S1C4C7
-64.6(1)
C7-C8
1.3890(17)
N1 C5 C6
114.3(1)
N1C5C6C6
-119.2(2)
2
F1-C1
1.336(1)
C2N1C3
121.5(1)
C3N1C2O1
4.5(2)
F3-C1
1.322(1)
F3C1F1
107.2(1)
F3C1C2O1
37.5(1)
N1-C2
1.324(1)
F3C1C2
111.7(1)
F1C1C2O1
-80.9(1)
F2-C1
1.331(1)
F1C1C2
109.3(1)
F2C1C2N1
-22.8(1)
O1-C2
1.227(1)
O1C2C1
118.6(1)
C2N1C3C4
80.3(1)
N1-C3
1.468(1)
N1C3C4
112.2(1)
N1C3C4C5
49.5(1)
C3-C4
1.516(1)
C4C4C5
125.0(1)
C3N1C2C1
-172.3(1)
C1-C2
1.538(2)
C5C4C3
112.8(1)
F2C1C2O1
160.1(1)
C4-C5
1.511(1)
C4C4C3
122.2(1)
F3C1C2N1
-145.5(1)
C4-C4
1.343(2)
O1C2N1
126.6(1)
F1C1C2N1
96.1(1)
В ИК спектре соединения 1 в KBr в области
межмолекулярный самоассоциат посредством во-
NH-колебаний наблюдается одна полоса погло-
дородной связи N-H···O=S. В ИК спектре соедине-
щения при 3302 см-1, которая соответствует ва-
ния 2 полоса поглощения NH-группы наблюдает-
лентным колебаниям NH-группы, связанной в
ся при 3320 см-1. В разбавленных растворах CCl4
(a)
(б)
N
C
O
2.331
N
O
S
O
S
2.331
O
N
O
O
2.068
2.331
O
2.068
S
S
N
O
2.331
O
O
N
N
C
Рис. 2. Тетрамер амида 1 (a) и димер амида 2 в кристалле (б).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
N,N-(2,3-ДИМЕТИЛБУТ-2-ЕН-1,4-ДИИЛ)ДИБЕНЗОЛСУ
ЛЬФОНАМИД
891
Таблица 2. Экспериментальные и расчетные частоты валентных колебаний NH-групп амидов 1 и 2
ν(NH)эксп, см-1
Амид
∆ν(NH)эксп, см-1
ν(NH)выч, см-1
∆ν(NH), см-1
KBr
CCl
4
1
3305
3302
-
3527, 3465
62
2
3320
3343, 3330
113
3626, 3553
73
соединение 1 полностью ассоциировано, полосы
ностью (pKa бензолсульфонамида 16.1 [24], pKa
поглощения свободных NH-групп не наблюдаются
трифторацетамида 17.2 [25]), способствующей об-
даже в очень разбавленных растворах. В отличие
разованию ассоциатов даже в разбавленных рас-
от этого, в спектре амида 2 в CCl4 наблюдается
творах.
слабая полоса поглощения свободных NH-групп
С целью оценки энергии образования самоас-
при 3443 см-1, при увеличении концентрации ве-
социатов соединений 1 и 2 были проведены кван-
щества в растворе появляется полоса поглощения
тово-химические расчеты их мономерных молекул
ассоциатов при 3330 см-1, так что спектральный
и самоассоциатов (табл. 2). В качестве расчетного
сдвиг ∆ν(NH) составляет ~110 см-1. По-видимому,
метода использовали метод функционала матрицы
отсутствие мономерной полосы в спектре раство-
электронной плотности (базис B3LYP/6-311G**),
ра амида 1 обусловлено его большей NH кислот-
показавший хорошее соответствие с эксперимен-
(a)
(б)
1.935
1.993
1.993
1.935
(в)
2.213
2.213
Рис. 3. Изменение геометрии молекулы амида 1 при оптимизации (а), тетрамер амида 1 (б) и димер амида 2 (в).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
892
СТЕРХОВА и др.
Таблица 3. Расчетные характеристики мономеров амидов 1 и 2, их димеров и тетрамера амида 1 (B3LYP/6-311G**)
Молекула
-Е, ат. ед.
-ΔЕ, ккал/моль
μ, Д
d, Åа
1
1906.1432774
0
1.123
Димер 1 (NH···О=S)
3812.3024752
9.99
(4.99)
1.790
2.078, 2.109
Тетрамер 1
7624.6336273
37.97
(9.49)
0
1.935, 1.993
2
1247.6959016
0
0.007
Димер 2 (NH···О=С)
2495.4075416
9.88
(4.94)
0.001
2.213
а Длины межмолекулярных водородных связей.
тальными данными для широкого ряда амидных
блюдаемое разрыхление обусловлено «расправле-
структур при изучении их кислотно-основных
нием» объемных арилсульфонамидных остатков,
свойств и водородных связей [26].
и этот эффект перевешивает небольшое сжатие за
счет укорочения Н-связей.
При оптимизации изолированной молекулы 1
ее геометрия становится подобной таковой у ами-
Энергия ассоциата в ходе оптимизации пони-
да 2, в отличие от S-образной конформации в кри-
жается настолько, что это невозможно объяснить
сталле (ср. рис. 3а и 1). Мы рассчитали тетрамер
упрочнением четырех межмолекулярных водо-
соединения 1, взяв в качестве мономерного звена
родных связей при их укорочении, и, очевидно,
структуру на рис. 2а. Для сравнения, был также
обусловлено снятием отталкивательных взаимо-
рассчитан димер соединения 1, полученный ана-
действий между фрагментами мономеров, сбли-
логичным образом. Структура этого димера схожа
женных в кристалле.
со строением димера амида 2 в кристалле (рис. 2б).
Для расчета энергии взаимодействия ЕВЗ в во-
Расчет выявил существенные различия между
дородосвязанном комплексе используют следую-
структурой и энергией тетрамера в кристалле и в
щую формулу [27]:
газовой фазе. В качестве стартовой была исполь-
ЕВЗ = ЕАВ - (ЕА + ЕВ),
зована геометрия тетрамера, полученная методом
где ЕАВ - энергия комплекса, EA и EB - энергии
РСА. В ходе оптимизации геометрии, объем ассо-
мономеров A и B.
циата, который можно оценить, как объем парал-
Для Н-комплекса, состоящего из четырех моно-
лелепипеда, в который данная структура вписы-
мерных молекул, величина ЕВЗ определяется как
вается, увеличивается в 2-3 раза, т. е. структура
разница (Ететрамер - 4Емономер). В соответствии с
тетрамера в газовой фазе более рыхлая, чем в кри-
этим, выигрыш в энергии при образовании тетра-
сталле. Очевидно, это связано с эффектами кри-
мера амида 1 составил ~9.5 ккал/моль в расчете на
сталлической упаковки, когда взаимодействие с
одну водородную связь (табл. 3), что практически
окружением уплотняет тетрамер. При этом сохра-
вдвое больше, чем при образовании его димера
няется симметричная циклическая структура ассо-
(~5 ккал/моль).
циата - как в кристалле, так и в газовой фазе, ди-
По данным квантово-химических расчетов
польный момент равен нулю. Сохраняются четыре
(B3LYP/6-311G**), энергетический выигрыш
межмолекулярные водородные связи N-H···O=S
при образовании димера амида
2 составляет
между мономерными звеньями, однако, если
9.88 ккал/моль, что в пересчете на одну Н-связь
в кристалле все они имеют одинаковую длину
равно
4.94 ккал/моль. Значение вычисленной
2.331 Å и являются весьма слабыми, то в газовой
длины связи в димере амида 2 коррелирует с экс-
фазе (после оптимизации) они становятся попарно
периментальным (РСА). Дипольные моменты в
равными для противолежащих межмолекулярных
мономере и димере амида 2 по данным расчета
водородных связей и существенно укорачиваются
практически равны нулю (0.007 и 0.001 Д соответ-
(до 1.935 и 1.993 Å), указывая на сильно связанную
структуру Н-комплекса. На первый взгляд, это на-
ственно).
ходится в некотором противоречии с более рыхлой
Таким образом, по данным ИК спектроско-
структурой тетрамера в газовой фазе, однако на-
пии и квантовой химии, поведение N,N-(2,3-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
N,N-(2,3-ДИМЕТИЛБУТ-2-ЕН-1,4-ДИИЛ)ДИБЕНЗОЛСУ
ЛЬФОНАМИД
893
диметилбут-2-ен-1,4-диил)дибензолсульфон-
30.06°, триклинная сингония, пространственная
амида и N,N′-[(2E)-2,3-диметилбут-2-ен-1,4-
группа P-1, a 5.0888(4), b 7.6270(6), c 9.1110(7) Å,
диил]бис(трифторацетамида) в кристалле и рас-
α 112.328(3), β 95.026(3), γ 103.060(3)°, V 312.69(4)
творе CCl4 существенно отличается. Так, самоас-
Å3, Z 2, μ 0.171 мм-1, dвыч 1.626 г/см3. Получено
социат амида N,N-(2,3-диметилбут-2-ен-1,4-диил)-
14733 отражений, из них 1835 независимых, R1
дибензолсульфонамида не диссоциирует даже в
0.0367, S 1.070.
разбавленных растворах, сохраняя структуру те-
ИНФОРМАЦИЯ ОБ АВТОРАХ
трамера, наблюдаемую в кристалле. Энергия Н-свя-
зей в тетрамере по данным квантово-химических
Стерхова Ирина Владимировна, ORCID: http://
расчетов составляет ~ 10 ккал/моль. В отличие от
orcid.org/0000-0001-9660-915Х
этого, N,N′-[(2E)-2,3-диметилбут-2-ен-1,4-диил]-
Астахова Вера Владимировна, ORCID: http://
бис(трифторацетамид) в разбавленных растворах
orcid.org/0000-0001-9716-6004
существует как мономер, а энергия Н-связей в его
Лазарев Игорь Михайлович, ORCID: http://
димере составляет ~ 5 ккал/моль.
orcid.org/0000-0002-8946-6792
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
БЛАГОДАРНОСТЬ
ИК спектры твердых образцов в KBr и рас-
Работа выполнена с использованием оборудо-
творов в CCl4 различной концентрации (0.01-
вания Байкальского центра коллективного пользо-
0.1 моль/л) получены на спектрофотометре FTIR
вания Сибирского отделения РАН.
Varian 3100. Квантово-химические расчеты вы-
КОНФЛИКТ ИНТЕРЕСОВ
полнены с использованием комплекса программ
GAUSSIAN-09 [28] с полной оптимизацией геоме-
Авторы заявляют об отсутствии конфликта
трии.
интересов.
Рентгеноструктурное исследование амидов
СПИСОК ЛИТЕРАТУРЫ
1 и 2 проводили на дифрактометре Bruker D8
1. Kawashima K., Saito K., Ishikita H. // Biochemistry.
Venture (детектор Photon 100, MoKα-излучение, λ
2018. Vol.
57. P.
4997. doi
10.1021/acs.
0.71073 Å) с использованием сканирования по
biochem.8b00574
углам φ и ω. Монокристаллы амида 1 были по-
2. Chanawanno K., Blesener T.S., Schrage B.R., Nemy-
лучены кристаллизацией из изопропанола, ами-
kin V.N., Herrick R.S., Ziegler C.J. // J. Organomet.
да 2 - из хлороформа. Структуры определены и
Chem. 2018. Vol. 870. P. 121. doi 10.1016/j.
уточнены прямым методом по программе SHELX
jorganchem.2018.06.018
[29]. Данные скорректированы с учетом эффектов
3. Altaf A.A., Hamayun M., Lal B., Nawaz Tahir M.,
поглощения излучения методом мультисканирова-
Holder A.A., Badshah A., Crans D.C. // Dalton Trans.
ния (SADABS). Неводородные атомы уточнены в
2018. Vol. 47. P. 11769. doi 10.1039/C8DT01726C
4. Zhang W., Gu K., Hou P., Lyu X., Pan H., Shen Z., Fan
анизотропном приближении с помощью програм-
X. H. // Soft Matter. 2018. Vol. 14. P. 6774. doi 10.1039/
мы SHELX [29]. Полная информация об иссле-
C8SM01037D
дованных структурах депонирована в Кембридж-
5. Rivera A., Rojas J.J., Rios-Motta J., Bolte M. // Acta
скую структурную базу данных [CCDC 995795 (1),
Crystallogr. (E). 2017. Vol. 73. P. 1692. doi 10.1107/
1483559 (2)].
S2056989017014943
Кристаллографические данные для соедине-
6. Zhou Y., Wang Z., Gong S., Yu Z., Xu X. // J. Mol.
ния 1: бесцветные призмы 0.20×0.20×0.30 мм, Т
Struct. 2018. Vol. 1173. P. 321. doi 10.1016/j.
100 K, θ 2.78-30.36°, орторомбическая сингония,
molstruc.2018.07.012
7. Tokar A.V., Chigvintseva O.P. // Bull. Dnipropetrovsk
пространственная группа Pbcn, a 16.6308(9), b
Univ. Ser. Chem. 2017. Vol. 25. P. 9. doi
7.6486(4), c 5.1157(18) Å, V 1862.31(17) Å3, Z 4, μ
10.15421/081702
0.312 мм-1, dвыч 1.407 г/см3. Получено 9086 отраже-
8. Gabr M.T., Abdel-Raziq M.S. // Bioorg. Chem. 2018.
ний, из них 2741 независимых, R1 0.0330, S 1.051.
Vol. 80. P. 245. doi 10.1016/j.bioorg.2018.06.031
Кристаллографические данные для соединения
9. Adsmond D.A., Grant D.J.W. // J. Pharm. Sci. 2001.
2: белые иглы, 0.06× 0.10×0.50 мм, Т 100 K, θ 2.86-
Vol. 90. P. 112. doi 10.1002/jps.1157
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
894
СТЕРХОВА и др.
10.
Genest D., Rochais C., Lecoutey C., Sopkova-
22.
Gowda B.T., Nayak R., Kozisek J., Tokarcik M.,
de Oliveira Santos J., Ballandonne C., Butt-Gueulle S.,
Fuess H. // Acta Crystallogr. (E). 2007. Vol. 63.
Legay R., Since M., Dallemagne P. // Med. Chem.
P. o2967. doi 10.1107/S1600536807024221
Comm. 2013. Vol. 4. P. 925. doi 10.1039/c3md00041a
23.
Kalyanaraman B., Kispert L.D., Atwood J.L. // Acta
11.
Преображенская М.Н., Шаожао В., Лажко Э.И.,
Crystallogr. (B). 1978. Vol. 34. P. 1131. doi 10.1107/
Королев А.М., Поваров Л.С. // Биоорг. xим. 1995.
S0567740878005075
T. 21. № 10. С. 890.
24.
Zhao Y., Bordwell F.G., Cheng J.-P., Wang D. // J.
12.
Стерхова И.В., Москалик М.Ю., Шаинян Б.А. //
Am. Chem. Soc. 1997. Vol. 119. P. 9125. doi 10.1021/
ЖOpХ. 2013. Т. 49. C. 1617; Sterkhova I.V., Moska-
ja971230p
lik M.Yu., Shainyan B.A. // Russ. J. Org. Chem. 2013.
25.
Bordwell F.G. // Acc. Chem. Res. 1988. Vol. 21. P. 456.
Vol. 49. N 11. P. 1594. doi 10.1134/S1070428013110055
doi 10.1021/ar00156a004
13.
Стерхова И.В., Москалик М.Ю., Шаинян Б.А. //
ЖOpХ. 2014. Т. 50. C. 349; Sterkhova I.V., Moska-
26.
Bryantsev V.S., Diallo M.S., Goddard W.A. // J. Phys.
lik M.Yu., Shainyan B.A. // Russ. J. Org. Chem. 2014.
Chem. (A). 2007. Vol. 111. P. 4422. doi 10.1021/
Vol. 50. N 3. P. 337. doi 10.1134/S1070428014030051
jp071040t.
14.
Sterkhova I.V., Nikonov A.Yu., Lazarev I.M., Smir-
27.
Karthika M., Senthilkumar L., Kanakaraju R. // Comp.
nov V.I., Lazareva N.F. // J. Mol. Struct. 2015. Vol. 1098.
Theor. Chem. 2012. Vol. 979. P. 54. doi 10.1007/
P. 408. doi 10.1016/j.molstruc.2015.06.018
s00894-012-1742-3
15.
Стерхова И.В., Никонов А.Ю., Лазарев И.М., Мо-
28.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E.,
скалик М.Ю., Лазарева Н.Ф. // ЖОХ. 2015. T. 85.
Robb M.A., Cheeseman J.R., Scalmani G., Barone V.,
№ 7. C. 1138; Sterkhova I.V., Nikonov A.Yu., Laza-
Mennucci B., Petersson G.A., Nakatsuji H., Caricato M.,
rev I.M., Moskalik M.Yu., Lazareva N.F. // Russ. J.
Li X., Hratchian H.P., Izmaylov A.F., Bloino J., Zheng G.,
Gen. Chem. 2015. Vol. 85. N 7. P. 1661. doi 10.1134/
Sonnenberg J.L., Hada M., Ehara M., Toyota K.,
S1070363215070154
Fukuda R., Hasegawa J., Ishida M., Nakajima T.,
16.
Sterkhova I.V., Shainyan B.A. // J. Phys. Org. Chem.
2015. Vol. 28. P. 485. doi 10.1002/poc.3441
Honda Y., Kita O., Nakai H., Vreven T., Montgo-
17.
Sterkhova I.V., Astakhova V.V, Shainyan B.A. // J.
mery J.A., Peralta J.E., Ogliaro F., Bearpark M.,
Mol. Struct. 2017. Vol. 1141. P. 351. doi 10.1016/j.
Heyd J.J., Brothers E., Kudin K.N., Staroverov V.N.,
molstruc.2017.03.095
Kobayashi R., Normand J., Raghavachari K., Ren-
18.
Стерхова И.В., Астахова В.В., Шаинян Б.А. // ЖОХ.
dell A., Burant J.C., Iyengar S.S., Tomasi J., Cossi M.,
2017. Т. 87. Вып. 8. C. 1266; Sterkhova I.V., Astakho-
Rega N., Millam J.M., Klene M., Knox J.E., Cross J.B.,
va V.V., Shainyan B.А. // Russ. J. Gen. Chem. 2017.
Bakken V., Adamo C., Jaramillo J., Gomperts R.,
Vol. 87. N 8. P. 1680. doi 10.1134/S1070363217080060
Stratmann R.E., Yazyev O., Austin A.J., Cammi R.,
19.
Moskalik M.Yu., Astakhova V.V., Schilde U., Sterkho-
Pomelli C., Ochterski J.W., Martin R.L., Morokuma K.,
va I.V., Shainyan B.A. // Tetrahedron. 2014. Vol. 70.
Zakrzewski V.G., Voth G.A., Salvador P., Dannen-
P. 8636. doi 10.1016/j.tet.2014.09.050
berg J.J., Dapprich S., Daniels A.D., Farkas O.,
20.
Astakhova V.V., Moskalik M.Yu., Sterkhova I.V.,
Foresman J.B., Ortiz J.V., Cioslowski J., Fox D.J.
Shainyan B.A. // Mendeleev Commun. 2017. Vol. 27.
Gaussian 09. Revision A.01. Gaussian Inc. Wallingford.
P. 293. doi 10.1016/j.mencom.2017.05.026
21.
Martinez C., Martinez L., Kirsch J., Escudero-Adan
CT. 2009.
E. C., Martin E., Muniz K. // Eur. J. Org. Chem. 2014.
29.
Sheldrick G.M. // Acta Crystallogr. (D). 2008. Vol. 64.
Vol. 10. P. 2017. doi 10.1002/ejoc.201301805
P. 112. doi 10.1107/S0108767307043930
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
N,N-(2,3-ДИМЕТИЛБУТ-2-ЕН-1,4-ДИИЛ)ДИБЕНЗОЛСУ
ЛЬФОНАМИД
895
N,N-(2,3-Dimethylbut-2-ene-1,4-dienyl)dibenzenesulfonamide
and N,N′-[(2E)-2,3-Dimethylbut-2-ene-1,4-dienyl]-
bis(trifluoroacetamide): Features of Hydrogen Binding
in Crystal and Solutions
I. V. Sterkhova*, V. V. Astakhova, and I. M. Lazarev
Favorsky Irkutsk Institute of Chemistry, Siberian Branch, Russian Academy of Sciences, Irkutsk, 664033 Russia
*e-mail: irina_sterkhova@irioch.irk.ru
Received March 25, 2021; revised March 25, 2021; accepted April 15, 2021
Types of intermolecular self-associates of N,N-(2,3-dimethylbut-2-ene-1,4-diyl)dibenzenesulfonamide and N,N′-
[(2E)-2,3-dimethylbut-2-ene-1,4-diyl]bis(trifluoroacetamide) formed in CCl-4 solutions via hydrogen bonding
were studied by IR spectroscopy and quantum chemistry methods [B3LYP/6-311G(d,p)]. The data obtained
were compared with the X-ray diffraction analysis data. The benzenesulfonamide derivative forms strong hy-
drogen-bonded tetramers, which exist not only in the crystal, but also in solution, while the self-associates of the
trifluoroacetamide derivative are linked by weaker H-bonds, which are easily broken in solution upon dilution.
Keywords: N,N-(2,3-dimethylbut-2-ene-1,4-diyl)dibenzenesulfonamide, N,N′-[(2E)-2,3-dimethylbut-2-ene-
1,4-diyl]bis(trifluoroacetamide), hydrogen binding, X-ray diffraction analysis, self-association, IR spectroscopy,
quantum-chemical calculations
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021