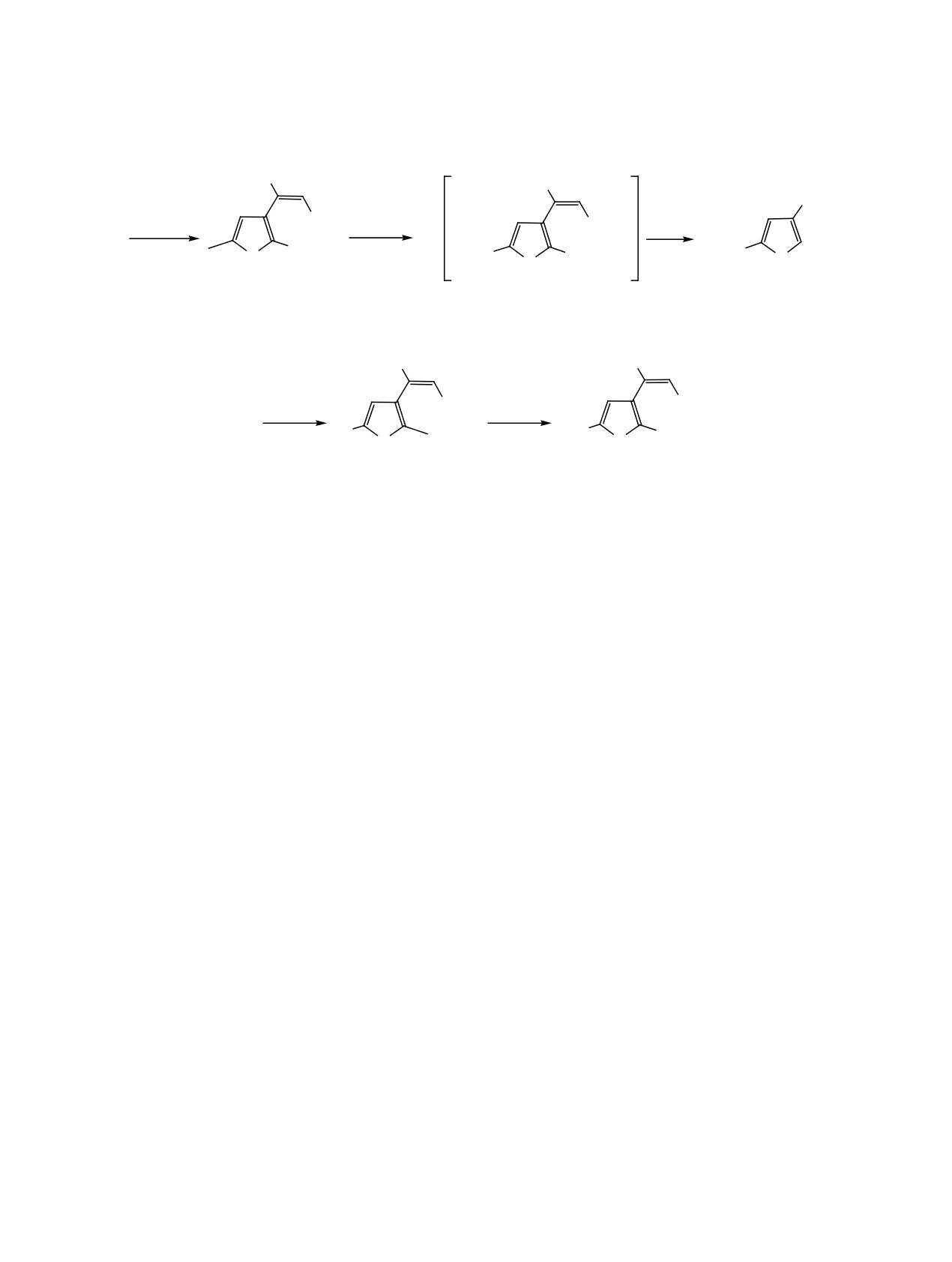ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 896-908
УДК 547.341
НЕКОТОРЫЕ ОСОБЕННОСТИ БРОМИРОВАНИЯ
3-(МЕТИЛФУРИЛ)-3-(ДИЭТОКСИФОСФОРИЛ)-
АКРИЛАТОВ N-БРОМСУКЦИНИМИДОМ В
УСЛОВИЯХ РАДИКАЛЬНОГО ИНИЦИИРОВАНИЯ
© 2021 г. Л. М. Певзнер*
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 31 марта 2021 г.
После доработки 31 марта 2021 г.
Принято к печати 12 апреля 2021 г.
Изучено бромирование 3-(метилфур-2-ил)- и 3-(метилфур-3-ил)-3-(диэтоксифосфорил)акрилатов
N-бромсукцинимидом в тетрахлорметане в присутствии динитрила азобисизомасляной кислоты (AIBN)
в качестве источника радикалов. Установлено, что, если хотя бы одно α-положение фуранового кольца
свободно, первый атом брома вступает именно туда, и только после этого происходит бромирование ме-
тильной группы. Если свободны оба α-положения, атом брома вступает сначала в положение с наиболее
высокой электронной плотностью, затем в оставшееся α-положение, после чего происходит замещение
водорода в метильной группе. Скорости протекания реакций различаются существенно, поэтому удается
выделить в чистом виде соединения, имеющие в своем составе один, два и три атома брома.
Ключевые слова: фурилакрилаты, радикальное бромирование, N-бромсукцинимид
DOI: 10.31857/S0044460X2106007X
Ранее отмечалось, что взаимодействие 3- и
временно увеличивалась электронная плотность
4-функционализованных 2-метилфуранов при вза-
за счет введения в фурановый цикл сильного σ-до-
имодействии с N-бромсукцинимидом в тетрахлор-
нора - трет-бутильной группы.
метане могут бромироваться как в α-положение
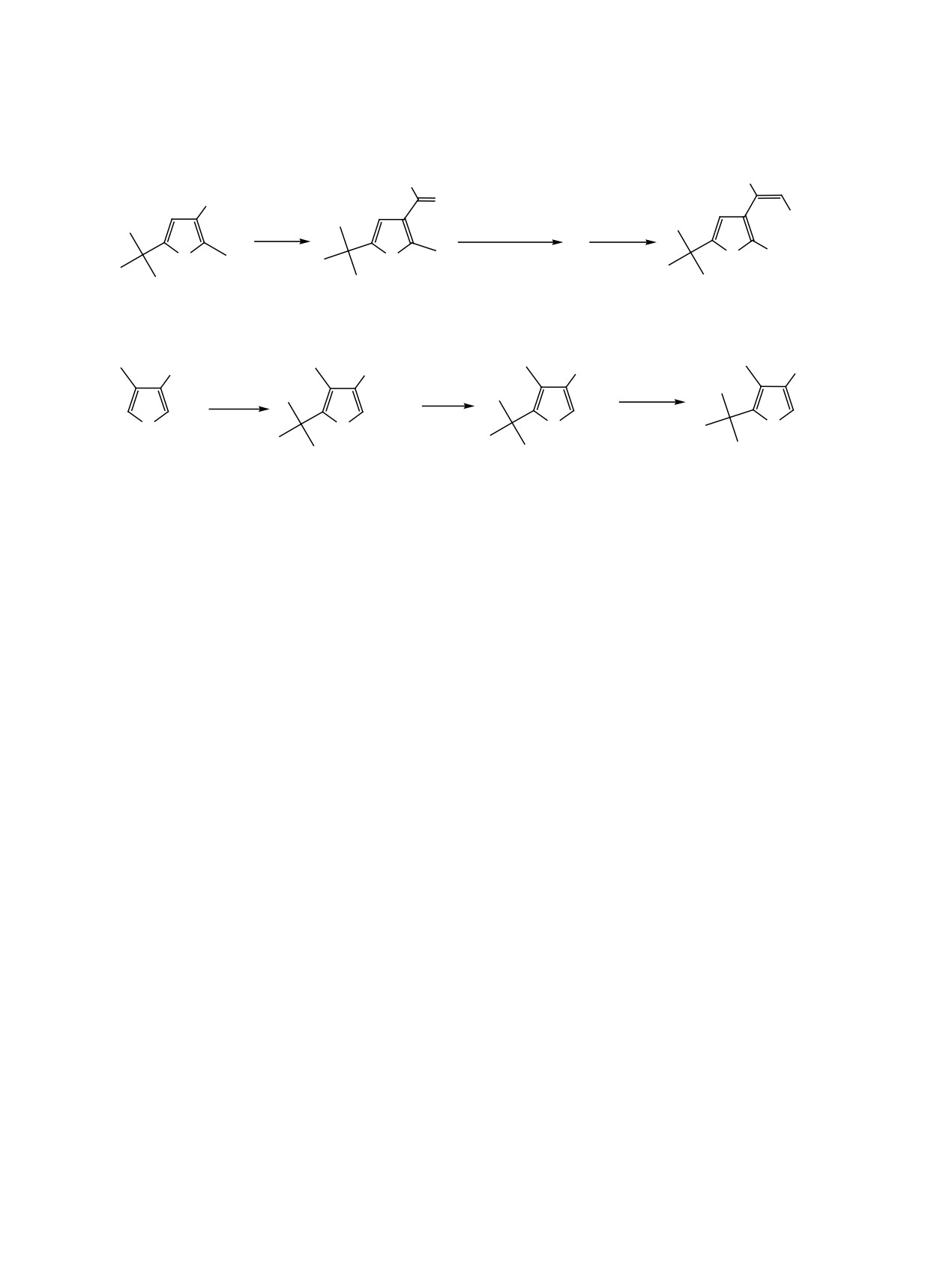
Фурилакрилаты 2, 5 и 6 были синтезированы
фуранового кольца, так и по метильной группе,
ранее [2], трет-бутильные производные 1, 3, 4
причем эти два процесса могут протекать одновре-
получали в несколько стадий исходя из хлоран-
менно [1]. В связи с попытками функционализации
гидридов соответствующим образом замещенных
3-(метилфурил)-3-(диэтоксифосфорил)акрилатов
фуранкарбоновых кислот.
по метильной группе путем последовательного
Реакцией известного хлорангидрида 7 [3] с
бромирования и нуклеофильного замещения нами
триэтилфосфитом в бензоле при 60-70°С в тече-
было подробно изучено взаимодействие серии
ние 3 ч был синтезирован ацилфосфонат 8 с вы-
таких соединений с N-бромсукцинимидом в ус-
ходом 70% (схема 2). Это стабильное соединение,
ловиях радикального инициирования. В качестве
перегоняющееся в вакууме при 152-153°С (1 мм
объектов исследования были выбраны соединения
рт. ст.). Подробности синтеза и данные спектро-
1-6 (схема 1). Их структура изменяется таким об-
скопии ЯМР 1Н, 13С и 31Р приведены в Экспери-
разом, чтобы происходило постепенное высвобо-
ментальной части. Ацилфосфонат 8 далее был
ждение α-положения в фурановом кольце и одно-
введен в реакцию Виттига с этоксикарбонил-
896
НЕКОТОРЫЕ ОСОБЕННОСТИ БРОМИРОВАНИЯ
897
Схема 1.
PO(OEt)2
PO(OEt)2
CO2Et
CO2Et
CO2Et
CO2Et
O
O
O
O
PO(OEt)2
PO(OEt)2
1
2
3
4
PO(OEt)2
PO(OEt)2
PO(OEt)2
CO2Et
CO2Et
CO2Et
O
O
O
5
5a
Схема 2.
O
P(OEt)3
O
Ph3P=CHCO2Et
O
O
1
Cl
PO(OEt)
2
7
8
метилентрифенилфосфораном при 80°С в бензо-
единение 9 было зафиксировано только спектраль-
ле. Процесс продолжался в течение 10 ч. Целевой
но, тогда как бромирование акрилата 1 2 молями
продукт 1 был выделен с выходом 80% (схема 2).
NBS позволило получить дибромид 10 в чистом
Это очень вязкое сиропообразное вещество, раз-
виде с выходом 80% (схема 3).
лагающееся при нагревании в вакууме намного
В спектрах ЯМР сигнал ядра фосфора броми-
ниже температуры кипения. Сигнал ядра фосфо-
да 9 проявляется при 12.46 м. д., сигнал протонов
ра в этом соединении имеет величину 13.96 м. д.,
бромметильной группы наблюдается при 4.30 м. д.,
сигнал протона при двойной связи проявляется в
а сигнал соответствующего ядра углерода - при
виде дублета при 6.82 м. д. (JPH 22.0 Гц). Величина
29.64 м. д. (4JPC 2.1 Гц). Дублет олефинового про-
константы расщепления указывает на транс-рас-
тона располагается при 6.94 м. д. (JPН 21.6 Гц), а
положение фосфонатной и сложноэфирной групп
сигнал протона фуранового кольца проявляет-
относительно двойной связи.
ся при 6.10 м. д. В спектре ЯМР 31Р сигнал ядра
Бромирование акрилата 1 проводили N-бром-
фосфора дибромида 10 сдвигается в слабое поле
сукцинимидом (NBS) при кипячении в тетрахлор-
до 12.02 м. д. Сигнал протона дибромметильной
метане в присутствии динитрила азобисизомас-
группы располагается при 6.74 м. д., сигнал со-
ляной кислоты (AIBN) в качестве инициатора.
ответствующего ядра углерода - при 31.13 м. д.
Бромирование протекает по метильной группе,
(4JPC 1.3 Гц). Сигналы олефинового и фуранового
однако оказалось, что второй атом брома вступает
протонов в спектре дибромида сдвигаются в сла-
в молекулу быстрее, чем первый. При использо-
бое поле до 6.99 (JPН 21.6 Гц) и 6.40 м. д. соответ-
вании 1 моля NBS на 1 моль акрилата образуется
ственно.
смесь исходного соединения 1, монобромида 9 и
дибромида 10 в мольном соотношении 1:0.7:1. Со-
Бромирование акрилата 2 1 молем NBS про-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
898
ПЕВЗНЕР
Схема 3.
Br
CHBr2
CO2Et
CO2Et
NBS
NBS
1
AIBN
AIBN
O
O
PO(OEt)2
PO(OEt)2
9
10
Схема 4.
Br
CO2Et
CO2Et
NBS
NBS
2
Br
Br
AIBN
O
AIBN
O
PO(OEt)2
PO(OEt)2
11
12
текает в течение 6 ч (схема 4). Выход бромида 11
сле этого бромируется метильная группа. Скоро-
составил 90%. Продукт бромирования 11 пред-
сти реакций различаются сильно, поэтому удается
ставляет собой вязкое масло, не перегоняющееся
выделить индивидуальные соединения 11 и 12.
в вакууме. Сигнал атома фосфора в этом соеди-
В случае бромирования 3-(3-фурилакрилатов)
нении сдвигается в слабое поле по сравнению с
количество вариантов относительного расположе-
исходным с 13.33 до 12.42 м. д. Сигнал фурано-
ния заместителей несколько больше. Поскольку
вого протона Н5 исчезает, сигнал ядра углерода
в ряду таких структур возможны варианты, когда
С5 фуранового кольца сдвигается в слабое поле с
свободны оба α-положения фуранового кольца,
142.91 до 144.74 м. д., и константа спин-спинового
большой интерес представляет вопрос, какое из
взаимодействия 4JPC не проявляется. Положение
них будет бромироваться первым и от чего это за-
сигналов протонов метильной группы в фурано-
висит.
вом кольце и соответствующего ядра углерода не
Исследование было начато с соединения 3, в
меняется. Полученные данные показывают, что в
котором положения 2 и 5 заняты, и можно было
соединении 11 атом брома вступает в положение 5
ожидать только бромирования метильной группы.
фуранового кольца.
Синтез исходного соединения начинали с коммер-
Бромирование бромакрилата 11 одним молем
чески доступного 2-метил-5-трет-бутил-3-фуро-
NBS также проводили в тетрахлорметане при
илхлорида 13. Он был введен в реакцию Арбузова
кипячении в течение 6 ч. В спектре ЯМР 1Н по-
с триэтилфосфитом в бензоле при 70°С. Реакция
лученного продукта исчезал сигнал метильной
продолжалась в течение 4 ч. Целевой фуроил-
группы в фурановом кольце и появлялся сигнал
фосфонат 14 выделяли перегонкой в вакууме, его
бромметильной группы при 4.29 м. д. Сигнал со-
выход составил 76% (схема 5). Полученное соеди-
ответствующего ядра углерода проявлялся при
нение вводили в реакцию Виттига с этоксикарбо-
30.95 м. д. Полученные данные позволили припи-
нилметилентрифенилфосфораном. Процесс про-
сать продукту реакции структуру 12 (схема 4). Вы-
водили в бензоле при кипячении в течение 10 ч.
ход этого соединения составил 82%.
Целевой фурилакрилат 3 был выделен с выходом
78%. Методики синтеза и спектральные характе-
Таким образом, можно утверждать, что в случае
ристики полученных соединений подробно приве-
фосфорилированных
3-(2-фурил)акрилатов при
наличии свободного положения 5 бромирование
дены в Экспериментальной части.
направляется в первую очередь туда, и только по-
Бромирование акрилата 3 NBS протекало в те-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НЕКОТОРЫЕ ОСОБЕННОСТИ БРОМИРОВАНИЯ
899
Схема 5.
PO(OEt)2
PO(OEt)2
COCl
O
CO2Et
P(OEt)3
Ph3P=CHCO2Et
NBS
3
AIBN
O
O
O CH2Br
13
14
15
Схема 6.
CO2Et
CO2Et
CO2H
COCl
SOCl2
t-BuCl
KOH
AlCl3
ДМФА
O
O
O
O
16
17
18
19
чение 5 ч и приводило к образованию моноброми-
периментальной части.
да 15 с выходом 83% (схема 5). Сигнал протонов
Взаимодействие хлорангидрида 19 с триэтил-
бромметильной группы в спектре этого соедине-
фосфитом проводили при 60-70°С в бензоле в
ния располагался при 4.41 м. д., а сигнал соответ-
течение 4 ч. Образовавшийся ацилфосфонат 20
ствующего ядра углерода - при 29.19 м. д.
был выделен перегонкой в вакууме с выходом 71%
Следующим шагом были синтез и исследова-
(схема 7). Сигнал ядра фосфора в этом соединении
ние бромирования соединения 4. В этом соеди-
проявлялся при -2.68 м. д., дублет карбонильного
нении положение 1 фуранового кольца находится
углерода - при 194.11 м. д. (1JPC 176.3 Гц), а сигнал
под акцепторным воздействием алкенового фран-
углерода С3 фуранового кольца - при 127.14 м. д.
мента в положении 3 и двух σ-донорных замести-
(2JPC 68.1 Гц).
телей, причем наибольший вклад в повышение
Ацилфосфонат 20 был введен в реакцию Вит-
электронной плотности вносится трет-бутильной
тига с этоксиметилентрифенилфосфораном.
группой.
Процесс проводили течение 10 ч в кипящем бен-
Синтез акрилата 4 начинали с известного 4-ме-
золе, образовавшийся акрилат 4 был выделен с
тил-3-фуроата 16 [3]. Его алкилировали действи-
выходом 97% (схема 7). Сигнал ядра фосфора в
ем трет-бутилхлорида в присутствии хлористо-
спектре этого соединения регистрировался при
го алюминия в дихлорэтане при 2-5°С (схема 6).
14.29 м. д., сигнал углерода С3 алкенового за-
трет-Бутильное производное 17 было выделено с
местителя располагался при 136.27 м. д. (1JPC
выходом 60% в виде бесцветного масла с т. кип.
176.3 Гц), сигнал углерода С2 находился при
88°С (1 мм рт. ст.). Гидролиз его водным раство-
132.98 м. д. (2JPC 10.0 Гц), а сигнал углерода карбо-
ром гидроксида калия приводил к образованию
нильной группы - при 164.48 м. д. (3JPC 28.6 Гц).
кислоты 18 с выходом 86% (т. пл. 85°С). Кисло-
Сигнал протона при двойной связи находился при
ту кипятили в бензоле с хлористым тионилом в
6.88 м. д. (JPН 22.8 Гц), что указывает на транс-рас-
положение фосфонатной и карбонильной групп.
присутствии каталитического количества ДМФА
в течение 8 ч. Образовавшийся хлорангидрид 19
Бромирование акрилата 4 1 молем NBS прово-
выделяли перегонкой в вакууме, собирая фракцию
дили в тетрахлорметане в течение 8 ч при кипя-
с т. кип. 86°С (1 мм рт. ст.). Выход продукта реак-
чении (схема 7). В спектре ЯМР 1Н выделенного
ции составил 63% (схема 6). Подробно методики
продукта исчезал сигнал фуранового протона Н2
синтеза и спектральные данные приведены в Экс-
при 7.22 м. д., сигнал метильной группы сдвигался
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
900
ПЕВЗНЕР
Схема 7.
O
PO(OEt)2
P(OEt)3
Ph3P=CHCO2Et
19
4
O
20
PO(OEt)2
PO(OEt)2
Br
CO2Et
CO2Et
NBS
NBS
O Br
O Br
21
22
в слабое поле, с 1.89 до 1.96 м. д. Сигнал углерода
которого исчезает сигнал протона Н2 фуранового
фуранового кольца С2 оставался на прежнем ме-
кольца, а сигнал метильной группы сохраняется.
сте, тогда как сигналы ядер С4 и С5 сдвигались в
Смещение сигналов ядер углерода С4 и С5 фу-
слабое поле, с 112.26 до 115.56 м. д. и с 157.23 до
ранового кольца аналогично наблюдаемому для
159.33 м. д. соответственно. Подробное отнесение
соединения 21. На основании полученных дан-
сигналов представлено в Экспериментальной ча-
ных продукт бромирования был охарактеризован
сти. Эти данные показывают, что полученному со-
структурой 23, его выход составил 75% (схема 8).
единению можно приписать структуру 21. Выход
Бромирование соединения 23 1 молем NBS в
продукта составил 94%.
аналогичных условиях привело к разрушению ал-
Соединение 21 было введено в реакцию еще с
кеновой части молекулы. В спектре ЯМР 31Р вы-
1 молем NBS в тех же условиях. На этот раз сиг-
деленной смеси веществ наблюдался сигнал ядра
нал метильной группы в спектре ЯМР 1Н продукта
фосфора при 13.09 м. д., характерный для непре-
реакции исчезал, а вместо него появлялись два ду-
дельных фосфонатов, но концентрация фосфорсо-
блета, образовавшие АВ-систему с параметрами:
держащего компонента была очень мала. Поэтому
δНА 4.46 м. д., δНВ 4.50 м. д. и константой расще-
установить принадлежащие ему сигналы в спек-
пления JАВ 11.2 Гц. Это указывает на вступление
трах ЯМР 1Н и 13С не удалось. Основным компо-
второго атома брома в метильную группу, при-
нентом смеси, надежно идентифицированным с
чем из-за стерической загруженности структуры
помощью спектров ЯМР, оказался этиловый эфир
протоны бромметильной группы становятся не-
5-бромметилфуран-3-карбоновой кислоты. По-ви-
эквивалентными. Сдвиг соответствующего ядра
димому, бромирование метильной группы при
углерода имеет характерное значение 23.42 м. д.
фурановом кольце происходит все-таки в соедине-
Соответственно, полученное соединение можно
нии 23, после чего под действием выделившего-
охарактеризовать структурой 22. Выход продукта
ся сукцинимида начинается какая-то структурная
составил 87% (схема 7).
перестройка, приводящая к появлению водорода в
положении 2 фуранового кольца и сложноэфирной
В соединении 5 влияние алкенового фрагмента
группы в положении 3.
на положение 2 фуранового кольца остается тем
же, а в положении 5 располагается более слабый
В соединении 5а свободное α-положение фу-
σ-донор - метильная группа. Тем не менее, бро-
ранового кольца не сопряжено с алкеновым фраг-
мирование 1 молем NBS в аналогичных условиях
ментом, и электронная плотность в нем повышена
приводит к продукту реакции, в спектре ЯМР 1Н
за счет σ-донорного эффекта метильной группы.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НЕКОТОРЫЕ ОСОБЕННОСТИ БРОМИРОВАНИЯ
901
Схема 8.
PO(OEt)2
PO(OEt)2
CO2Et
CO2Et
CO2Et
NBS
NBS
5
AIBN
AIBN
BrH2C
O Br
BrH2C
Br
O
O
23
Схема 9.
PO(OEt)2
PO(OEt)2
CO2Et
CO2Et
NBS
NBS
5a
Br
Br
CH2Br
AIBN
O
AIBN
O
24
25
Бромирование его 1 молем NBS ведет к образова-
кольце, расположенный при 1.82 м. д., и дублет
нию продукта, в спектре ЯМР 1Н которого исче-
при 7.39 м. д. (JPН 2.8 Гц), принадлежащий фура-
зает сигнал протона Н5 фуранового кольца, а сиг-
новому протону Н2. Следовательно, первый атом
нал протонов метильной группы проявляется при
брома вступает в положение 5 фуранового кольца,
2.13 м. д. (JPН 2.4 Гц). Сигналы всех четырех ядер
что приводит к образованию соединения 26 с вы-
углерода фуранового кольца немного сдвигаются
ходом 90% (схема 10).
в слабое поле, а сигнал ядра углерода метильной
Обработка акрилата 26 еще одним молем NBS
группы остается практически на том же месте.
в тех же условиях приводит к новому продукту, в
На основании полученных данных выделенное
спектре ЯМР 1Н которого остается только сигнал
вещество было охарактеризовано структурой 24
метильной группы при 1.89 м. д., сигналы ядер
(схема 9). Выход его составил 92%.
углерода С2 и С4 фуранового кольца немного сдви-
Бромирование акрилата 24 1 молем NBS при-
гаются в слабое поле, но серьезных изменений
вело к исчезновению дублета метильной группы
спектральных характеристик не прослеживается.
и появлению уширенного сигнала при 4.39 м. д.
Выделенному соединению на основании имею-
Сигнал соответствующего ядра углерода прояв-
щихся данных можно приписать структуру 27
лялся при 23.44 м. д. Эти данные позволяют счи-
(схема 10). Выход его составляет 92%.
тать, что на этот раз бромирование протекает по
После обработки еще одним молем NBS обра-
метильной группе с образованием соединения 25
зуется вещество, в спектре ЯМР 1Н которого сиг-
(схема 9). Выход его составил 88%.
нал метильной группы пропадает и появляются
В акрилате 6 положения 2 и 5 фуранового коль-
два сигнала при 4.42 и 4.44 м. д. в соотношении
ца свободны. Они заметно отличаются друг от
1:1 с суммарной интенсивностью, соответству-
друга по величине электронной плотности, по-
ющей двум протонам. Сигнал соответствующего
скольку положение 2 сопряжено с акцепторным
ядра углерода проявляется при 21.46 м. д. Следо-
алкеновым фрагментом, а положение 5 находится
вательно, на этот раз происходит бромирование
под воздействием σ-донора, метильной группы.
метильной группы в фурановом кольце и образу-
Соответственно, сигналы протонов Н2 и Н5 распо-
ется вещество, которое можно охарактеризовать
лагаются при 7.36 (JPН 2.8, JНН 1.6 Гц) и 7.22 м. д.
структурой 28 (схема 10). Соседство атома брома
(уширенный сигнал). При бромировании 1 молем
и бромметильной группы, видимо, создает доста-
NBS в спектре ЯМР 1Н полученного продукта
точные стерические препятствия, что приводит к
остаются сигнал метильной группы в фурановом
образованию двух спектрально различимых кон-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
902
ПЕВЗНЕР
Схема 10.
PO(OEt)2
PO(OEt)2
PO(OEt)2
Br
CO2Et
CO2Et
NBS
CO2Et
NBS
NBS
6
AIBN
AIBN
Br
AIBN
Br
Br
Br
Br
O
O
O
26
27
28
формеров в соотношении 1:1. Выход продукта ре-
м. д.: 11.97 (СН3-фуран), 16.44 д (СН3-фосфонат,
акции составил 95%.
3JРС 5.9 Гц), 28.59 [(СН3)3C], 33.27 [(СН3)3C], 63.51
д (СН2О-фосфонат, 2JРС 7.0 Гц), 110.10 д (С4-фу-
Таким образом, в отношении фуранового коль-
ран, 4JРС 3.0 Гц), 136.53 д (С3-фуран, 3JРС 8.7 Гц),
ца, сопряженного с двойной связью и карбониль-
147.60 д (С2-фуран, 2JРС 59.9 Гц), 170.51 (С5-фу-
ной группой бром-радикал может выступать как
ран), 185.06 д (С=О, 1JРС 182.5 Гц). Спектр ЯМР
электрофил, если хотя бы одно из α-положений
31Р (CDCl3): δP -0.55 м. д.
фуранового кольца не занято. Атака в свободное
β-положение не наблюдалась ни разу, предпочти-
Этиловый эфир (Е)-3-(3-метил-5-трет-
тельным оказывается бромирование метильной
бутилфур-2-ил)-3-(диэтоксифосфорил)акри-
группы. Очередность вступления брома в моле-
ловой кислоты (1). Смесь 2.76 г фосфоната 8,
кулу фуранового производного с двумя свободны-
3.82 г этоксикарбонилметилентрифенилфосфо-
ми α-положениями определяется распределением
рана и 20 мл бензола кипятили 10 ч, после чего
электронной плотности в кольце. Первым атакует-
горячую реакционную смесь разбавляли 70 мл
ся положение с наибольшей величиной эффектив-
гексана, перемешивали 20 мин и оставляли на
ного положительного заряда, потом второе свобод-
ночь. На следующий день отфильтровывали три-
ное α-положение, и только после этого происходит
фенилфосфиноксид, фильтрат пропускали через
бромирование метильной группы. Во всех случаях
слой силикагеля, отгоняли растворители, остаток
скорости реакций различаются настолько сильно,
выдерживали в вакууме (1 мм рт. ст.) 1 ч при ком-
что ди- и трибромпроизводные удается выделить
натной температуре. Получали 2.71 г (80%) акри-
в чистом виде.
лата 1 в виде светло-желтого очень вязкого сиро-
пообразного вещества. Спектр ЯМР 1Н (CDCl3),
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
δ, м. д.: 1.22 т (2Н, СН3-эфир, JHH 7.2 Гц), 1.24
Спектры ЯМР 1Н, 13С, и 31Р получали на
с [9Н, (СН3)3C], 1.27 т (6Н, СН3-фосфонат, JHH
приборе Bruker AVANCE-400
(400.13,
100.16,
7.2 Гц), 1.90 д (3Н, СН3-фуран, JHH 2.0 Гц), 4.05-
161.97 МГц соответственно). Масс-спектры (ESI)
4.11 м (4Н, СН2О-фосфонат), 4.16 к (2Н, СН2О-
получали на приборе Bruker MicrOTOF.
эфир, JHH 7.2 Гц), 5.88 с (1Н, Н4-фуран), 6.82 д (1Н,
Диэтил-3-метил-5-трет-бутил-2-фуроил-
=СН, JHH 22.0 Гц). Спектр ЯМР 13С (CDCl3), δС,
фосфонат (8). К раствору 2.68 г 3-метил-5-трет-бу-
м. д.: 11.66 (СН3-фуран), 14.10 (СН3-эфир), 16.23 д
тил-2-фуроилхлорида в 20 мл бензола прибавля-
(СН3-фосфонат, 3JРС 6.5 Гц), 28.92 [(СН3)3C], 32.62
ли при перемешивании 3.5 мл триэтилфосфита.
[(СН3)3C], 60.88 (СН2О-эфир), 62.58 д (СН2О-фос-
фонат, 2JРС 5.7 Гц), 107.10 (С4-фуран),
123.57
Полученную смесь нагревали 4 ч при перемеши-
вании при 60-70°С. Перегонкой в вакууме выде-
д (С3-фуран, 3JРС 8.7 Гц), 131.62 д (=СН, 2JРС
10.3 Гц), 132.56 д (=СР, 1JРС 173.0 Гц), 140.42 д
ляли 2.84 г (70%) фуроилфосфоната 8 с т. кип.
(С2-фуран, 2JРС 5.7 Гц), 164.99 д (С5-фуран, 4JРС
152-153°С (1 мм рт. ст.). Спектр ЯМР 1Н (CDCl3),
2.0 Гц), 164.76 д (С=О, 3JРС 26.9 Гц). Спектр ЯМР
δ, м. д.: 1.29 с [9Н, (СН3)3C], 1.34 т (6Н, СН3-фос-
31Р (CDCl3): δP 13.96 м. д.
фонат, JHH 7.2 Гц), 2.32 с (3Н, СН3-фуран), 4.25
д. к (4Н, СН2О, JРH 14.8, JHH 7.2 Гц), 6.08 д (1Н,
Бромирование акрилата 1 NBS. Смесь 2.35 г
Н4-фуран, JРH 1.2 Гц). Спектр ЯМР 13С (CDCl3), δС,
акрилата 1, 1.30 г NBS и 0.1 г AIBN в 60 мл те-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НЕКОТОРЫЕ ОСОБЕННОСТИ БРОМИРОВАНИЯ
903
трахлорметана кипятили при перемешивании 6 ч
137.70 д (С2-фуран, 2JРС 9.8 Гц), 163.82 д (С=О,
и оставляли на ночь. На следующий день отфиль-
3JРС 25.5 Гц), 166.21 д (С5-фуран, 4JРС 2.2 Гц).
тровывали сукцинимид, фильтрат пропускали че-
Спектр ЯМР 31Р (CDCl3): δP 12.02 м. д.
рез слой силикагеля, отгоняли растворитель, оста-
Этиловый эфир (Е)-3-(3-метил-5-бромфур-
ток выдерживали в вакууме (1 мм рт. ст.) 1 ч при
2-ил)-3-(диэтоксифосфорил)акриловой
кис-
комнатной температуре. Получали 2.77 г смеси,
лоты (11). Смесь 0.88 г акрилата 2, 0.60 г NBS и
содержащей акрилат 1, бромид 9 и дибромид 10 в
0.05 г AIBN в 30 мл тетрахлорметана кипятили при
соотношении 1:0.7:1.
перемешивании 6 ч и оставляли на ночь. На следу-
Этиловый
эфир
(Е)-3-(3-бромметил-
ющий день отфильтровывали сукцинимид, филь-
5-трет-бутилфур-2-ил)-3-(диэтоксифосфорил)-
трат пропускали через слой силикагеля, отгоняли
акриловой кислоты (9). Спектр ЯМР 1Н (CDCl3),
растворитель, остаток выдерживали в вакууме
δ, м. д.: 1.23-1.31 м (9Н, СН3-эфир, СН3-фос-
(1 мм рт. ст.) 1 ч при комнатной температуре. Полу-
фонат), 1.26 уш. с [9Н, (СН3)3C], 4.07-4.14 м
чали 0.99 г (80%) бромида 11 в виде желтого сиро-
(6Н, СН2О-эфир, СН2О-фосфонат), 4.30 с (2Н,
пообразного вещества. Спектр ЯМР 1Н (CDCl3), δ,
СН2Br), 6.10 c (1Н, Н4-фуран), 6.94 д (1Н, =СН, JPН
м. д.: 1.27 т (3Н, СН3-эфир, JHH 7.2 Гц), 1.33 т (6Н,
21.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
СН3-фосфонат, JHH 7.2 Гц), 1.96 д (3Н, СН3-фуран,
14.00 (СН3-эфир),
16.29 д (СН3-фосфонат, 3JРС
J
2.4 Гц), 4.10-4.17 м (4Н, СН2О-фосфонат),
РH
5.7 Гц),
28.78
[(СН3)3C],
29.64 д (СН2Br, 4JРС
4.18 к (2Н, СН2О-эфир, JHH 7.2 Гц), 6.24 уш. с (1Н,
2.1 Гц), 32.73 [(СН3)3C], 61.21 (СН2О-эфир), 63.03
Н4-фуран), 6.91 д (1Н, =СН, JРH 21.2 Гц). Спектр
д (СН2О-фосфонат, 2JРС 5.8 Гц), 105.70 (С4-фуран),
ЯМР 13С (CDCl3), δС, м. д.: 11.13 уш. с (СН3-фуран),
123.10 д (С3-фуран, 3JРС 6.0 Гц), 132.54 д (=СР, 1JРС
14.05 (СН3-эфир),
16.23 д (СН3-фосфонат, 3JРС
174.9 Гц), 135.67 д (=СН, 2JРС 10.3 Гц), 140.68
6.3 Гц), 61.27 (СН2О-эфир), 63.09 д (СН2О-фосфо-
д (С2-фуран, 2JРС 8.0 Гц), 164.06 д (С=О, 3JРС
нат, 2JРС 5.9 Гц), 115.53 д (С4-фуран, 4JРС 1.2 Гц),
26.2 Гц), 165.66 д (С5-фуран, 4JРС 1.7 Гц). Спектр
124.74 д (С3-фуран, 3JРС 7.1 Гц), 131.91 д (=СР,
ЯМР 31Р (CDCl3): δP 12.46 м. д.
1JРС 177.2 Гц), 132.10 д (=СН, 2JРС 9.9 Гц), 144.05
д (С2-фуран, 2JРС 6.4 Гц), 144.74 (С5-фуран), 164.17
Этиловый эфир (Е)-3-(3-дибромметил-
д (С=О, 3JРС 26.2 Гц). Спектр ЯМР 31Р (CDCl3): δP
5-трет-бутилфур-2-ил)-3-(диэтоксифосфорил)-
12.42 м. д.
акриловой кислоты (10). Смесь 2.35 г акрилата 1,
2.60 г NBS и 0.1 г AIBN в 80 мл тетрахлорметана
Этиловый эфир (Е)-3-(3-бромметил-5-бром-
кипятили при перемешивании 6 ч и оставляли на
фур-2-ил)-3-(диэтоксифосфорил)акриловой
ночь. На следующий день отфильтровывали сук-
кислоты (12). Смесь 0.86 г акрилата 11, 0.43 г
цинимид, фильтрат пропускали через слой сили-
NBS и 0.05 г AIBN в 30 мл тетрахлорметана кипя-
кагеля, отгоняли растворитель, остаток выдержи-
тили при перемешивании 6 ч и оставляли на ночь.
вали в вакууме (1 мм рт. ст.) 1 ч при комнатной
На следующий день отфильтровывали сукцини-
температуре. Получали 2.67 г (80%) дибромида
мид, фильтрат пропускали через слой силикагеля,
10 в виде желто-красного сиропообразного ве-
отгоняли растворитель, остаток выдерживали в
щества. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.17 т
вакууме (1 мм рт. ст.) 1 ч при комнатной темпе-
(3Н, СН3-эфир, JHH 7.2 Гц), 1.28 с [9Н, (СН3)3C],
ратуре. Получали 0.85 г (82%) бромида 12 в виде
1.31 т (6Н, СН3-фосфонат, JHH 7.2 Гц), 4.10-4.16
темно-желтого сиропообразного вещества. Спектр
м (6Н, СН2О-эфир, СН2О-фосфонат), 6.39 c (1Н,
ЯМР 1Н (CDCl3), δ, м. д.: 1.22 т (3Н, СН3-эфир,
Н4-фуран), 6.74 с (1Н, СНBr2), 6.98 д (1Н, =СН, JPН
JHH 7.2 Гц), 1.34 т (6Н, СН3-фосфонат, JHH 7.2 Гц),
21.2 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.98
4.10-4.17 м
(6Н, СН2О-фосфонат,СН2О-эфир),
(СН3-эфир), 16.21 д (СН3-фосфонат, 3JРС 6.2 Гц),
4.29 с (2Н, СН2Br), 6.48 с (1Н, Н4-фуран), 7.02 д
28.71 [(СН3)3C], 31.13 д (СНBr2, 4JРС 1.3 Гц), 32.88
(1Н, =СН, JРH 21.2 Гц). Спектр ЯМР 13С (CDCl3),
[(СН3)3C], 61.52 (СН2О-эфир), 63.35 д (СН2О-фос-
δС, м. д.: 13.91 (СН3-эфир), 16.26 д (СН3-фосфо-
фонат, 2JРС 5.9 Гц),
104.88 д (С4-фуран, 4JРС
нат, 3JРС 6.3 Гц), 30.95 уш. с (СН2Br), 61.59 (СН2О-
1.0 Гц), 127.61 д (С3-фуран, 3JРС 5.0 Гц), 131.59 д
эфир), 63.48 д (СН2О-фосфонат, 2JРС 6.1 Гц), 114.79
(=СР, 1JРС 179.9 Гц), 136.39 д (=СН, 2JРС 9.9 Гц),
д (С4-фуран, 4JРС 1.3 Гц),
124.93 д (С3-фуран,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
904
ПЕВЗНЕР
3JРС 5.8 Гц), 131.62 д (=СР, 1JРС 180.0 Гц), 132.08
1JРС 175.6 Гц), 148.21 д (С2-фуран, 3JРС 12.1 Гц),
д (=СН, 2JРС 10.0 Гц), 144.21 д (С2-фуран, 2JРС
161.91 (С5-фуран), 164.88 д (С=О, 3JРС 28.5 Гц).
8.0 Гц), 145.28 (С5-фуран), 163.52 д (С=О, 3JРС
Спектр ЯМР 31Р (CDCl3): δP 15.11 м. д.
25.5 Гц). Спектр ЯМР 31Р (CDCl3): δP 11.33 м. д.
Этиловый эфир (Е)-3-(2-бромметил-5-
Диэтил-2-метил-5-трет-бутил-3-фуроил-
трет-бутилфур-3-ил)-3-(диэтоксифосфорил)-
фосфонат (14). Раствор 5.77 г хлорангидрида 13 и
акриловой кислоты (15). Смесь 4.10 г акрилата
7.4 мл триэтилфосфита в 50 мл бензола нагревали
3, 2.20 г NBS, 0.1 г AIBN и 70 мл тетрахлорметана
4 ч при перемешивании при 70°С. Перегонкой ре-
кипятили при перемешивании 5 ч и оставляли на
акционной массы в вакууме получали 6.6 г (76%)
ночь. На следующий день отфильтровывали сук-
фуроилфосфоната 14 в виде бесцветной жидко-
цинимид, фильтрат пропускали через слой сили-
кагеля, отгоняли растворитель, остаток выдержи-
сти с т. кип. 150°С (1 мм рт. ст.). Спектр ЯМР 1Н
вали в вакууме (1 мм рт. ст.) 1 ч при комнатной
(CDCl3), δ, м. д.: 1.23 с [9Н, (СН3)3C], 1.37 т (6Н,
температуре. Получали 4.10 г (83%) бромида 15 в
СН3-фосфонат, JHH 7.2 Гц), 2.58 с (3Н, СН3-фуран),
виде желтого сиропообразного вещества. Спектр
4.23 д. к (4Н, СН2О-фосфонат, JРH 14.8, JHH 7.2 Гц),
ЯМР 1Н (CDCl3), δ, м. д.: 1.14 т (3Н, СН3-эфир, JHH
6.65 с (1Н, Н4-фуран). Спектр ЯМР 13С (CDCl3),
7.2 Гц), 1.26 с [9Н, (СН3)3C], 1.29 т (6Н, СН3-фос-
δС, м. д.: 14.88 (СН3-фуран), 16.36 д (СН3-фосфо-
фонат, JHH 7.2 Гц), 4.08-4.13 м (6Н, СН2О-фосфо-
нат, 3JРС 5.8 Гц), 28.71 [(СН3)3C], 32.38 [(СН3)3C],
нат, СН2О-эфир), 4.41 с (2Н, СН2Br), 5.93 с (1Н,
63.66 д (СН2О-фосфонат, 2JРС 7.1 Гц), 102.87 д
Н4-фуран), 6.84 д (1Н, =СН, JHH 22.4 Гц). Спектр
(С4-фуран, 4JРС 1.8 Гц), 120.94 д (С3-фуран, 2JРС
ЯМР 13С (CDCl3), δС, м. д.: 13.88 (СН3-эфир), 16.30
71.4 Гц), 160.34 д (С2-фуран, 3JРС 15.2 Гц), 162.82
д (СН3-фосфонат, 3JРС 6.2 Гц), 28.82 [(СН3)3C],
(С5-фуран), 193.70 д (С=О, 1JРС 179.5 Гц). Спектр
29.19 (СН2Br),
32.75
[(СН3)3C],
61.01 (СН2О-
ЯМР 31Р (CDCl3): δP -1.33 м. д.
эфир), 63.04 д (СН2О-фосфонат, 2JРС 6.0 Гц), 105.17
Этиловый эфир (Е)-3-(2-метил-5-трет-
д (С4-фуран, 4JРС 2.5 Гц), 117.51 д (С3-фуран, 2JРС
бутилфур-3-ил)-3-(диэтоксифосфорил)акрило-
7.4 Гц), 133.72 д (=СН, 2JРС 11.0 Гц), 136.16 д (=СР,
вой кислоты (3). Смесь 6.51 г фуроилфосфоната
1JРС 177.5 Гц), 144.84 д (С2-фуран, 3JРС 10.0 Гц),
14, 9 г этоксикарбонилметилентрифенилфосфо-
164.81 (С5-фуран), 164.32 д (С=О, 3JРС 27.5 Гц).
рана и 40 мл бензола кипятили при перемешива-
Спектр ЯМР 31Р (CDCl3): δP 13.55 м. д.
нии 10 ч. Горячую реакционную массу разбавляли
Этиловый эфир
4-метил-5-трет-бутилфу-
120 мл гексана, перемешивали 30 мин и оставля-
ран-3-карбоновой кислоты (17). К суспензии
ли на ночь. На следующий день отфильтровывали
4.5 г безводного хлористого алюминия в 40 мл
трифенилфосфиноксид, пропускали фильтрат че-
дихлорэтана прибавляли по каплям при пере-
рез слой силикагеля, отгоняли растворитель, оста-
мешивании при 2-5°С раствор 3.58 г этилового
ток выдерживали в вакууме (1 мм рт. ст.) 1 ч при
эфира 4-метилфуран-3-карбоновой кислоты 16 и
комнатной температуре. Получали 6.52 г (78%)
2.5 мл трет-бутилхлорида в 10 мл дихлорэтана.
акрилата 3 в виде желтоватого сиропообразного
Образовавшуюся смесь перемешивали 2 ч при
вещества. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.17
5-10°С и выливали на 100 г битого льда. Органи-
т (3Н, СН3-эфир, JHH 7.2 Гц), 1.27 с [9Н, (СН3)3C],
ческую фазу отделяли, водный слой промывали
1.29 т (6Н, СН3-фосфонат, JHH 7.2 Гц), 2.11 д (3Н,
15 мл дихлорэтана, объединенные вытяжки про-
СН3-фуран, JHH 2.8 Гц), 4.06-4.16 м (6Н, СН2О-фос-
мывали 30 мл воды, 30 мл раствора NaCl и сушили
фонат, СН2О-эфир), 5.93 с (1Н, Н4-фуран), 6.80 д
хлористым кальцием. Перегонкой в вакууме полу-
(1Н, =СН, JHH 22.8 Гц). Спектр ЯМР 13С (CDCl3),
чали 2.92 г (60%) целевого продукта 17 в виде бес-
δС, м. д.: 11.59 д (СН3-фуран, 4JРС 1.4 Гц), 13.99
цветного масла с т. кип. 88°С (1 мм рт. ст.). Спектр
(СН3-эфир), 16.27 д (СН3-фосфонат, 3JРС 6.3 Гц),
ЯМР 1Н (CDCl3), δ, м. д.: 1.34 т (3Н, СН3-эфир,
28.98 [(СН3)3C], 32.35 [(СН3)3C], 60.75 (СН2О-э-
JHH 7.2 Гц), 1.34 с [9Н, (СН3)3C], 2.31 c (3H, СН3-
фир), 62.66 д (СН2О-фосфонат, 2JРС 6.0 Гц), 108.89
фуран), 4.27 к (2Н, СН2О-эфир, JHH 7.2 Гц), 7.81
д (С4-фуран, 3JРС 1.8 Гц), 113.15 д (С3-фуран, 2JРС
с (1Н, Н2-фуран). Спектр ЯМР 13С (CDCl3), δС,
7.6 Гц), 133.00 д (=СН, 2JРС 9.8 Гц), 137.28 д (=СР,
м. д.: 9.57 (СН3-фуран), 14.35 (СН3-эфир), 29.33
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НЕКОТОРЫЕ ОСОБЕННОСТИ БРОМИРОВАНИЯ
905
[(СН3)3C],
33.85
[(СН3)3C], 59.77 (СН2О-эфир),
Этиловый эфир (Е)-3-(4-метил-5-трет-бу-
112.59 (С4-фуран),
119.64 (С3-фуран),
145.09
тилфур-3-ил)-3-(диэтоксифосфорил)акриловой
(С2-фуран), 158.84 (С=О), 164.19 (С5-фуран).
кислоты (4). Смесь 1.49 г фуроилфосфоната 20,
2.06 г этоксикарбонилметилентрифенилфосфо-
4-Метил-5-трет-бутилфуран-3-карбоновая
рана и 20 мл бензола кипятили при перемешива-
кислота (18). Смесь 2.92 эфира 17, 1.00 г гидрок-
сида калия и 15 мл воды кипятили 10 ч при пере-
нии 10 ч. Горячую реакционную массу разбавляли
мешивании, после чего охлаждали и подкисляли
60 мл гексана, перемешивали 30 мин и оставляли
на ночь. На следующий день отфильтровывали
соляной кислотой. Выпавшее масло при затирании
кристаллизовалось. Полученную смесь оставляли
трифенилфосфиноксид, пропускали фильтрат че-
на ночь, а на следующий день отфильтровывали
рез слой силикагеля, отгоняли растворитель, оста-
образовавшийся порошок, промывали его водой
ток выдерживали в вакууме (1 мм рт. ст.) 1 ч при
и сушили на воздухе до постоянной массы. Полу-
комнатной температуре. Получали 1.79 г (97%)
чали 2.17 г (86%) кислоты 18, т. пл. 85°С. Спектр
акрилата 4 в виде желтого сиропообразного веще-
ЯМР 1Н (CDCl3), δ, м. д.: 1.37 с [9Н, (СН3)3C], 2.33
ства. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.16 т (3Н,
с (3Н, СН3-фуран), 7.96 с (1Н, Н2-фуран), 12.08
СН3-эфир, JHH 7.2 Гц), 1.29 т (6Н, СН3-фосфонат,
уш (1Н, ОН). Спектр ЯМР 13С (CDCl3), δС, м. д.:
J
7.2 Гц), 1.33 с [9Н, (СН3)3C], 1.89 с (3Н, СН3-фу-
HH
9.52 (СН3-фуран), 29.33 [(СН3)3C], 33.91 [(СН3)3C],
ран), 4.06-4.14 м (6Н, СН2О-фосфонат, СН2О-
112.73 (С4-фуран),
118.92 (С3-фуран),
146.93
эфир), 6.88 д (1Н, =СН, JHH 22.8 Гц), 7.22 д (1Н,
(С2-фуран), 159.32 (С=О), 170.12 (С5-фуран).
Н4-фуран, JРH 3.2 Гц). Спектр ЯМР 13С (CDCl3), δС,
м. д.: 9.55 (СН3-фуран), 13.86 (СН3-эфир), 16.26 д
Хлорангидрид 4-метил-5-трет-бутилфуран-
(СН3-фосфонат, 3JРС 6.2 Гц), 29.32 [(СН3)3C], 33.77
3-карбоновой кислоты (19). Смесь 2.17 г кисло-
[(СН3)3C], 60.80 (СН2О-эфир), 62.87 д (СН2О-фос-
ты 18, 1.3 мл хлористого тионила, 2 капель ДМФА
фонат, 2JРС 6.1 Гц), 112.26 д (С4-фуран, 3JРС 5.5 Гц),
и 20 мл бензола кипятили при перемешивании
120.46 д (С3-фуран, 2JРС 6.7 Гц), 132.98 д (=СН,
8 ч. Перегонкой в вакууме выделяли 1.51 г (63%)
2JРС 10.0 Гц), 136.27 д (=СР, 1JРС 175.9 Гц), 152.47
хлорангидрида 19 в виде светло-желтого масла с
д (С2-фуран, 3JРС 4.1 Гц), 157.23 (С5-фуран), 164.48
т. кип. 86°С (1 мм рт. ст.). Спектр ЯМР 1Н (CDCl3),
δ, м. д.: 1.36 с [9Н, (СН3)3C], 2.27 с (3Н, СН3-фуран),
д (С=О, 3JРС 28.6 Гц). Спектр ЯМР 31Р (CDCl3): δP
14.29 м. д.
8.09 с (1Н, Н2-фуран). Спектр ЯМР 13С (CDCl3),
δС, м. д.: 9.52 (СН3-фуран), 29.21 [(СН3)3C], 34.07
Этиловый эфир (Е)-3-(2-бром-4-метил-5-
[(СН3)3C], 111.85 (С4-фуран), 124.79 (С3-фуран),
трет-бутилфур-3-ил)-3-(диэтоксифосфорил)-
115.33 (С2-фуран), 159.55 (С=О), 160.73 (С5-фуран).
акриловой кислоты (21). Смесь 1.47 г акрилата
Диэтил-4-метил-5-трет-бутил-3-фуроил-
20, 0.80 г NBS, 0.05 г AIBN и 40 мл тетрахлорме-
фосфонат (20). Смесь 1.51 г хлорангидрида 19,
тана кипятили при перемешивании 8 ч и оставля-
2 мл триэтилфосфита и 15 мл бензола перемешива-
ли на ночь. На следующий день отфильтровыва-
ли 4 ч при 60-70°С и перегоняли в вакууме. Полу-
ли сукцинимид, фильтрат пропускали через слой
чали 1.63 г (71%) фосфоната 20 в виде бесцветного
силикагеля, отгоняли растворитель, остаток вы-
масла с т. кип. 158°С (1 мм рт. ст.). Спектр ЯМР 1Н
держивали в вакууме (1 мм рт. ст.) 1 ч при ком-
(CDCl3), δ, м. д.: 1.31 с [9Н, (СН3)3C], 1.34 т (6Н,
натной температуре. Получали 1.68 г (94%) бро-
СН3-фосфонат, JHH 7.2 Гц), 2.27 с (3Н, СН3-фуран),
мида 21 в виде светло-желтого сиропообразного
4.20 д. к (4Н, СН2О-фосфонат, JРH 14.8, JHH 7.2 Гц),
вещества. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.11
8.61 с (1Н, Н4-фуран). Спектр ЯМР 13С (CDCl3),
т (3Н, СН3-эфир, JHH 7.2 Гц), 1.30 с [9Н, (СН3)3C],
δС, м. д.: 9.82 (СН3-фуран), 16.34 д (СН3-фосфонат,
1.38 т (6Н, СН3-фосфонат, JHH 7.0 Гц), 1.96 с (3Н,
3JРС 5.7 Гц), 29.24 [(СН3)3C], 33.80 [(СН3)3C], 63.78
СН3-фуран), 4.06-4.18 м (4Н, СН2О-фосфонат),
д (СН2О-фосфонат, 2JРС 7.0 Гц), 111.85 д (С4-фу-
4.24 к (2Н, СН2О-эфир, JHH 7.2 Гц), 6.95 д (1Н,
ран, 3JРС 11.4 Гц), 127.14 д (С3-фуран, 2JРС 68.1 Гц),
=СН, JHH 21.6 Гц). Спектр ЯМР 13С (CDCl3), δС,
152.42 д (С2-фуран, 3JРС 4.1 Гц), 159.49 (С5-фуран),
м. д.: 10.24 (СН3-фуран), 13.82 (СН3-эфир), 16.31 д
194.11 д (С=О, 1JРС 176.3 Гц). Спектр ЯМР 31Р
(СН3-фосфонат, 3JРС 5.6 Гц), 29.37 [(СН3)3C], 34.14
(CDCl3): δP -2.68 м. д.
[(СН3)3C], 60.90 (СН2О-эфир), 62.95 д (СН2О-фос-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
906
ПЕВЗНЕР
фонат, 2JРС 6.8 Гц), 115.56 д (С4-фуран, 3JРС 2.6 Гц),
4.26 к (2Н, СН2О-эфир, JHH 7.2 Гц), 6.11 c (1Н,
120.35 д (С3-фуран, 2JРС 6.1 Гц), 132.16 д (=СН,
Н4-фуран), 6.87 д (1Н, =СН, JHH 22.4 Гц). Спектр
2JРС 10.1 Гц), 135.51 д (=СР, 1JРС 181.2 Гц), 152.44
ЯМР 13С (CDCl3), δС, м. д.: 13.77 (СН3-фуран),
д (С2-фуран, 3JРС 4.1 Гц), 159.33 (С5-фуран), 163.99
14.00 (СН3-эфир),
16.30 д (СН3-фосфонат, 3JРС
д (С=О, 3JРС 27.8 Гц). Спектр ЯМР 31Р (CDCl3): δP
6.2 Гц), 61.15 (СН2О-эфир), 62.94 д (СН2О-фосфо-
13.11 м. д.
нат, 2JРС 5.7 Гц), 109.44 д (С4-фуран, 3JРС 1.2 Гц),
118.46 д (С3-фуран, 2JРС 7.6 Гц), 134.56 д (=СН,
Этиловый эфир (Е)-3-(2-бром-4-бромметил-
2JРС 11.2 Гц), 134.97 д (=СР, 1JРС 178.0 Гц), 144.69
5-трет-бутилфур-3-ил)-3-(диэтоксифосфорил)-
д (С2-фуран, 3JРС 7.6 Гц), 154.06 (С5-фуран), 164.14
акриловой кислоты (22). Смесь 1.68 г акрилата
д (С=О, 3JРС 27.6 Гц). Спектр ЯМР 31Р (CDCl3): δP
21, 0.81 г NBS, 0.05 г AIBN и 40 мл тетрахлорме-
13.82 м. д.
тана кипятили при перемешивании 7 ч и оставля-
ли на ночь. На следующий день отфильтровывали
Реакция акрилата (23) с NBS. Смесь 0.46 г
сукцинимид, фильтрат пропускали через слой си-
акрилата 23, 0.23 г NBS, 0.01 г AIBN и 20 мл те-
ликагеля, отгоняли растворитель, остаток выдер-
трахлорметана кипятили при перемешивании 8 ч
живали в вакууме (1 мм рт. ст.) 1 ч при комнатной
и оставляли на ночь. На следующий день отфиль-
температуре. Получали 1.73 г (87%) бромида 22
тровывали сукцинимид, фильтрат пропускали
в виде темно-желтого сиропообразного веще-
через слой силикагеля, отгоняли растворитель,
ства. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.13 т (3Н,
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
СН3-эфир, JHH 7.2 Гц), 1.37 т (6Н, СН3-фосфонат,
при комнатной температуре. Получали 0.20 г жел-
JHH 7.0 Гц), 1.39 с [9Н, (СН3)3C], 4.08-4.26 м (6Н,
то-коричневого масла. В спектре ЯМР 1Н присут-
СН2О-фосфонат, СН2О-эфир), 4.46 д (1Н, СН2Br,
ствовали сигналы при 1.23, 1.34, 1.51, 1.68, 1.80 и
НА, JАВ 11.2 Гц), 4.50 д (1Н, СН2Br, НВ, JАВ 11.2
1.97 м. д., лишенные тонкой структуры. Надежно
Гц), 6.95 д (1Н, =СН, JHH 21.6 Гц). Спектр ЯМР
идентифицируется этиловый эфир 5-бромметил-
13С (CDCl3), δС, м. д.: 13.82 (СН3-эфир), 16.29 д
фуран-3-карбоновой кислоты. Спектр ЯМР 1Н
(СН3-фосфонат, 3JРС 6.3 Гц), 16.36 д (СН3-фосфо-
(CDCl3), δ, м. д.: 1.30 т (3Н, СН3, JHH 7.2 Гц), 4.26
нат, 3JРС 6.8 Гц), 23.42 (СН2Br), 29.10 [(СН3)3C],
к (2Н, СН2О, JHH 7.2 Гц), 4.43 с (2Н, СН2Br), 6.70
34.93
[(СН3)3C],
61.06 (СН2О-эфир),
63.23 д
с (1Н, Н4-фуран), 7.96 с (1Н, Н2-фуран). Cпектр
(СН2О-фосфонат, 2JРС 6.6 Гц), 63.38 д (СН2О-фос-
ЯМР 13С (CDCl3), δС, м. д.: 14.29 (СН3), 23.34
фонат, 2JРС 5.9 Гц), 117.41 д (С4-фуран, 3JРС 2.1 Гц),
(СН2Br), 60.55 (СН2О), 109.45 (С4-фуран), 120.74
119.06 д (С3-фуран, 2JРС 6.7 Гц), 134.14 д (=СР, 1JРС
(С3-фуран), 147.98 (С2-фуран), 151.56 (С5-фуран),
181.4 Гц), 137.38 д (=СН, 2JРС 11.2 Гц), 153.00 д
162.45 (С=О).
(С2-фуран, 3JРС 4.1 Гц), 162.44 (С5-фуран), 163.54
Этиловый эфир (Е)-3-(2-метил-5-бромфур-
д (С=О, 3JРС 27.3 Гц). Спектр ЯМР 31Р (CDCl3): δP
3-ил)-3-(диэтоксифосфорил)акриловой
кис-
12.72 м. д.
лоты (24). Смесь 1.05 г акрилата 5а, 0.65 г NBS,
Этиловый эфир (Е)-3-(2-бром-5-метилфур-
0.02 г AIBN и 30 мл тетрахлорметана кипятили
3-ил)-3-(диэтоксифосфорил)акриловой
кис-
при перемешивании 8 ч и оставляли на ночь. На
лоты (23). Смесь 0.60 г акрилата 5, 0.40 г NBS,
следующий день отфильтровывали сукцинимид,
0.02 г AIBN и 20 мл тетрахлорметана кипятили при
фильтрат пропускали через слой силикагеля, отго-
перемешивании 8 ч и оставляли на ночь. На следу-
няли растворитель, остаток выдерживали в вакуу-
ющий день отфильтровывали сукцинимид, филь-
ме (1 мм рт. ст.) 1 ч при комнатной температуре.
трат пропускали через слой силикагеля, отгоняли
Получали 1.21 г (92%) бромида 24 в виде желто-
растворитель, остаток выдерживали в вакууме
го сиропообразного вещества. Спектр ЯМР 1Н
(1 мм рт. ст.) 1 ч при комнатной температуре. По-
(CDCl3), δ, м. д.: 1.19 т (3Н, СН3-эфир, JHH 7.2 Гц),
лучали 0.62 г (75%) бромида 23 в виде светло-жел-
1.29 т (6Н, СН3-фосфонат, JHH 7.2 Гц), 2.13 д (3Н,
того сиропообразного вещества. Спектр ЯМР 1Н
СН3-фуран, JPН 2.4 Гц), 4.06-4.15 м (6Н, СН2О-фос-
(CDCl3), δ, м. д.: 1.21 т (3Н, СН3-эфир, JHH 7.2 Гц),
фонат, СН2О-эфир), 6.24 уш.c (1Н, Н4-фуран), 6.83
1.31 т (6Н, СН3-фосфонат, JHH 7.2 Гц), 2.28 с (3Н,
д (1Н, =СН, JHH 22.4 Гц). Спектр ЯМР 13С (CDCl3),
СН3-фуран), 4.08-4.21 м (4Н, СН2О-фосфонат),
δС, м. д.: 12.61 д (СН3-фуран, 4JРС 1.1 Гц), 14.00
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
НЕКОТОРЫЕ ОСОБЕННОСТИ БРОМИРОВАНИЯ
907
(СН3-эфир), 16.31 д (СН3-фосфонат, 3JРС 6.0 Гц),
(СН3-фуран), 13.87 (СН3-эфир), 16.32 д (СН3-фос-
61.02 (СН2О-эфир), 62.87 д (СН2О-фосфонат, 2JРС
фонат, 3JРС 6.0 Гц), 61.11 (СН2О-эфир), 63.05 д
6.1 Гц), 112.88 д (С4-фуран, 3JРС 1.8 Гц), 115.60
(СН2О-фосфонат, 2JРС 6.1 Гц), 121.02 д (С4-фуран,
д (С3-фуран, 2JРС 7.2 Гц), 133.53 д (=СН, 2JРС
3JРС 1.3 Гц), 119.77 д (С3-фуран, 2JРС 5.5 Гц), 134.31
11.7 Гц), 135.73 д (=СР, 1JРС 178.0 Гц), 142.89
д (=СН, 2JРС 11.1 Гц), 135.36 д (=СР, 1JРС 178.7 Гц),
(С5-фуран),
151.95 д (С2-фуран, 3JРС 11.3 Гц),
141.07 д (С2-фуран, 3JРС 5.9 Гц), 148.36 (С5-фу-
164.17 д (С=О, 3JРС 28.2 Гц). Спектр ЯМР 31Р
ран), 163.99 д (С=О, 3JРС 28.2 Гц). Спектр ЯМР 31Р
(CDCl3): δP 14.22 м. д.
(CDCl3): δP 13.57 м. д.
Этиловый эфир (Е)-3-(2-бромметил-5-бром-
Этиловый эфир (Е)-3-(2,5-бром-4-метилфур-
фур-3-ил)-3-(диэтоксифосфорил)акриловой
3-ил)-3-(диэтоксифосфорил)акриловой
кис-
кислоты (25). Смесь 1.04 г акрилата 24, 0.52 г
лоты (27). Смесь 1.71 г акрилата 26, 0.90 г NBS,
NBS, 0.02 г AIBN и 30 мл тетрахлорметана кипя-
0.03 г AIBN и 40 мл тетрахлорметана кипятили
тили при перемешивании 8 ч и оставляли на ночь.
при перемешивании 4 ч и оставляли на ночь. На
На следующий день отфильтровывали сукцини-
следующий день отфильтровывали сукцинимид,
мид, фильтрат пропускали через слой силикагеля,
фильтрат пропускали через слой силикагеля, от-
отгоняли растворитель, остаток выдерживали в
гоняли растворитель, а остаток выдерживали в
вакууме (1 мм рт. ст.) 1 ч при комнатной темпера-
вакууме (1 мм рт. ст.) 1 ч при комнатной темпе-
туре. Получали 1.10 г (88%) дибромида 25 в виде
ратуре. Получали 1.89 г (92%) бромида 27 в виде
темно-желтого сиропообразного вещества. Спектр
желтого сиропообразного вещества. Спектр ЯМР
ЯМР 1Н (CDCl3), δ, м. д.: 1.21 т (3Н, СН3-эфир, JHH
1Н (CDCl3), δ, м. д.: 1.17 т (3Н, СН3-эфир, JHH
7.2 Гц), 1.35 т (6Н, СН3-фосфонат, JHH 7.2 Гц), 4.39
7.2 Гц), 1.30-1.39 м (6Н, СН3-фосфонат), 1.89 с
уш. с (2Н, СН2Br), 4.12-4.17 м (6Н, СН2О-фосфо-
(3Н, СН3-фуран), 4.11-4.20 м (6Н, СН2О-фосфонат,
нат, СН2О-эфир), 6.29 c (1Н, Н4-фуран), 6.92 д (1Н,
СН2О-эфир), 6.97 д (1Н, =СН, JHH 21.6 Гц). Спектр
=СН, JHH 22.4 Гц). Спектр ЯМР 13С (CDCl3), δС,
ЯМР 13С (CDCl3), δС, м. д.: 9.80 (СН3-фуран), 13.87
м. д.: 13.95 (СН3-эфир), 16.38 д (СН3-фосфонат,
(СН3-эфир), 16.36 д (СН3-фосфонат, 3JРС 6.1 Гц),
3JРС 5.9 Гц), 23.44 (СН2Br), 61.35 (СН2О-эфир),
61.20 (СН2О-эфир), 63.01 д (СН2О-фосфонат, 2JРС
63.30 д (СН2О-фосфонат, 2JРС 6.3 Гц), 113.99 д
6.1 Гц), 122.92 д (С4-фуран, 3JРС 2.7 Гц), 119.67
(С4-фуран, 3JРС 2.5 Гц), 119.35 д (С3-фуран, 2JРС
д (С3-фуран, 2JРС 9.2 Гц), 134.66 д (=СН, 2JРС
7.0 Гц), 134.94 д (=СН, 2JРС 10.8 Гц), 134.82 д (=СР,
10.8 Гц), 134.76 д (=СР, 1JРС 183.0 Гц), 142.17 д
1JРС 178.0 Гц), 148.86 д (С5-фуран, 3JРС 9.6 Гц),
(С2-фуран, 3JРС 6.3 Гц), 148.64 (С5-фуран), 163.47
149.94 (С5-фуран), 163.76 д (С=О, 3JРС 27.4 Гц).
д (С=О, 3JРС 27.4 Гц). Спектр ЯМР 31Р (CDCl3): δP
Спектр ЯМР 31Р (CDCl3): δP 12.93 м. д.
12.62 м. д.
Этиловый эфир (Е)-3-(4-метил-5-бромфур-
Этиловый эфир (Е)-3-(2,5-бром-4-бромме-
3-ил)-3-(диэтоксифосфорил)акриловой
кис-
тилфур-3-ил)-3-(диэтоксифосфорил)акриловой
лоты (26). Смесь 1.52 г акрилата 6, 0.95 г NBS,
кислоты (28). Смесь 1.59 г акрилата 27, 0.66 г
0.03 г AIBN и 40 мл тетрахлорметана кипятили при
NBS, 0.03 г AIBN и 40 мл тетрахлорметана кипя-
перемешивании 5 ч и оставляли на ночь. На следу-
тили при перемешивании 5 ч и оставляли на ночь.
ющий день отфильтровывали сукцинимид, филь-
На следующий день отфильтровывали сукцини-
трат пропускали через слой силикагеля, отгоняли
мид, фильтрат пропускали через слой силикагеля,
растворитель, остаток выдерживали в вакууме
отгоняли растворитель, остаток выдерживали в
(1 мм рт. ст.) 1 ч при комнатной температуре. Полу-
вакууме (1 мм рт. ст.) 1 ч при комнатной темпе-
чали 1.71 г (90%) бромида 26 в виде желтого сиро-
ратуре. Получали 1.76 г (95%) бромида 28 в виде
пообразного вещества. Спектр ЯМР 1Н (CDCl3), δ,
темно-желтого сиропобразного вещества. Спектр
м. д.: 1.12 т (3Н, СН3-эфир, JHH 7.2 Гц), 1.31 т (6Н,
ЯМР 1Н (CDCl3), δ, м. д.: 1.18 т (3Н, СН3-эфир,
СН3-фосфонат, JHH 7.2 Гц), 1.82 с (3Н, СН3-фуран),
JHH 7.2 Гц), 1.32 т (3Н, СН3-фосфонат, JHH 7.2 Гц),
4.08-4.15 м (6Н, СН2О-фосфонат, СН2О-эфир),
1.37 т (3Н, СН3-фосфонат, JHH 7.2 Гц), 4.15 с
6.88 д (1Н, =СН, JHH 22.4 Гц), 7.39 д (1Н, Н2-фуран,
(1Н, СН2Br), 4.44 с (1Н, СН2Br), 4.11-4.24 м (6Н,
JРH 3.2 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 9.18
СН2О-фосфонат, СН2О-эфир), 6.96 д (1Н, =СН,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
908
ПЕВЗНЕР
JHH 21.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
использованием оборудования инжинирингового
13.92 (СН3-эфир),
16.36 д (СН3-фосфонат, 3JРС
центра Санкт-Петербургского государственного
6.0 Гц), 16.38 д (СН3-фосфонат, 3JРС 6.3 Гц), 21.36
технологического института (технического уни-
(СН2Br), 61.32 (СН2О-эфир), 63.32 д (СН2О-фос-
верситета), а также при поддержке Российского
фонат, 2JРС 6.6 Гц), 63.55 д (СН2О-фосфонат, 2JРС
фонда фундаментальных исследований (грант №
5.9 Гц), 123.54 д (С4-фуран, 3JРС 2.1 Гц), 120.52
19-08-01232).
д (С3-фуран, 2JРС 9.2 Гц), 133.46 д (=СР, 1JРС
КОНФЛИКТ ИНТЕРЕСОВ
183.3 Гц), 137.52 д (=СН, 2JРС 10.9 Гц), 142.17 д
(С2-фуран, 3JРС 6.5 Гц), 149.36 (С5-фуран), 163.12
Автор заявляет об отсутствии конфликта
д (С=О, 3JРС 26.5 Гц). Спектр ЯМР 31Р (CDCl3): δP
интересов.
12.29 м. д.
СПИСОК ЛИТЕРАТУРЫ
ИНФОРМАЦИЯ ОБ АВТОРАХ
1. Певзнер Л.М., Игнатьев В.М., Ионин Б.И. // ЖОХ.
1998. Т. 68. Вып. 4. С. 579.
org/0000-0002-1678-2524
2. Певзнер Л.М. // ЖОХ. 2016. Т. 86. Вып. 7. С. 1147;
Pevzner L.M. // Russ. J. Gen. Chem. 2016. Vol. 86. N 7.
ФОНДОВАЯ ПОДДЕРЖКА
P. 1624. doi 10.1134/S107036321607015X
Работа выполнена в рамках государственного
3. Naganawa A., Ichikawa Y., Isobe M. // Tetrahedron.
задания Министерства науки и высшего образо-
1994. Vol. 50. N 30. P. 8969. doi 10.1016/S0040-
вания Российской Федерации № 785.00.X6019 с
4020(01)85365-5
Some Features of Radical-Induced Bromination
of 3-(Methylfuryl)-3-(dietoxyphosphoryl)acrylates
with N-Bromosuccinimide
L. M. Pevzner*
St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received March 31, 2021; revised March 31, 2021; accepted April 12, 2021
The bromination of 3-(methylfur-2-yl)- and 3-(methylfur-3-yl)-3-(diethoxyphosphoryl)acrylates with
N-bromosuccinimide in tetrachloromethane in the presence of azobisisobutyric acid dinitrile (AIBN) as a source
of radicals was studied. It was found that if at least one α-position of the furan ring is free, the first bromine atom
enters exactly there, and only after that bromination of the methyl group occurs. If both α-positions are free, the
bromine atom enters first into the position with the highest electron density, then into the remaining α-position,
after which the hydrogen is replaced in the methyl group. The reaction rates differ significantly; therefore, it is
possible to isolate in pure form compounds containing one, two, and three bromine atoms.
Keywords: furyl acrylates, radical bromination, N-bromosuccinimide
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021