ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 935-942
УДК 547.022
СИНТЕЗ, СПЕКТРАЛЬНЫЕ, КИСЛОТНО-ОСНОВНЫЕ
И КООРДИНАЦИОННЫЕ СВОЙСТВА
БРОМ- И МЕТОКСИЗАМЕЩЕННЫХ
ТЕТРАФЕНИЛПОРФИРИНОВ
© 2021 г. С. Г. Пуховскаяa, Ю. Б. Ивановаb,*, Н. В. Чижоваb, С. А. Сырбуb
a Ивановский государственный химико-технологический университет, Иваново, 153000 Россия
b Институт химии растворов имени Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153045 Россия
*e-mail: jjiv@yandex.ru
Поступило в Редакцию 19 апреля 2021 г.
После доработки 19 апреля 2021 г.
Принято к печати 6 мая 2021 г.
Получены симметрично замещенные порфирины - 2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра(3,5-ди-
бромфенил)порфирин и 2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра(3,4,5-триметоксифенил)порфирин,
идентифицированные методами электронной абсорбционной спектроскопии, ЯМР 1Н и масс-спектро-
метрии. Спектрофотометрическим методом исследованы их кислотно-основные, а также комплексо-
образующие свойства по отношению к ионам Zn2+ и Pd2+ в ацетонитриле при 298-328 K. Выявлено
влияние заместителей в β-положениях и в мезо-фенильных фрагментах макроцикла на спектральные и
координационные свойства полученных соединений.
Ключевые слова: бром(метокси)замещенные порфирины, металлопорфирины, кислотно-основные
свойства, координационные свойства, спектральные свойства
DOI: 10.31857/S0044460X2106010X
Исследование влияния электронных и стери-
находящимся в растворе. Химическое связывание
ческих эффектов заместителей на свойства пор-
макроцикла и заряженного иона находит сильный
фиринового макроцикла необходимо для созда-
спектрофотометрический отклик в электронных
ния физико-химических основ получения новых
спектрах поглощения и сопровождается цветовой
материалов. Порфирины, замещенные большим
реакцией, что позволяет создавать рецепторы для
числом фенильных фрагментов в мезо-положени-
распознавания ионов различной природы. В связи
ях макроцикла и метоксигруппами и галогенами
с этим необходимо более подробное изучение кис-
в β-положениях, наиболее доступны, хорошо изу-
лотно-основных и комплексообразующих свойств
чены и успешно применяются на практике [1-10].
порфиринов и их аналогов.
Растворы порфиринов и их металлокомплексов в
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-тетра-
органических растворителях способны изменять
(3,5-дибромфенил)порфирин 1 [H2Br8(3,5-BrPh)Р]
свои электронооптические свойства при воздей-
ствии на порфириновую молекулу органических
и
2,3,7,8,12,13,17,18-октабром-5,10,15,20-
оснований и кислот в широком диапазоне рН. Вну-
тетра-(3,4,5-триметоксифенил)порфирин
2
трициклическая полость макроцикла может фор-
[H2Br8(3,4,5-MeOPh)Р] синтезировали по схеме 1.
мировать заряд, обеспечивающий высокое хими-
ПометодуАдлераполучали5,10,15,20-тетра(3,5-ди-
ческое сродство молекулы к катионам и анионам,
бромфенил)порфирин
[11] и
5,10,15,20-те-
935
936
ПУХОВСКАЯ и др.
Схема 1.
R3
R1
R2
R2
CHO
R1
R3
(1) EtCOOH
N
(2) Co(AcO)2, ДМФА
4
+
4
N
Co
N
NH
3
R1
R
N
R2
R1
R3
2
R
R2
R1
R1
R2
R3
R1
R2
Br
Br
R3
R3
(1) NBS, CHCl3_ДМФА
(2) H2SO4_HClO4
N
Br
Br
NH
NH
Br
Br
N
R1
R1
Br
Br
2
R
R2
R3
R3
1, 2
R1 = R3 = Br, R2 = H (1); R1 = R2 = R3 = OMe (2).
тра(3,4,5-триметоксифенил)порфирин
[12], ко-
Природа заместителя и его положение в ма-
торые переводили в кобальтовые комплексы:
кроцикле оказывают значительное влияние на
5,10,15,20-тетра(3,5-дибромфенил)порфиринат
кислотные свойства порфиринов. Исследование
Со(II) 3 и смесь 5,10,15,20-тетра(3,4,5-триметокси-
протонирования и депротонирования порфиринов
фенил)порфиринатов Co(II) и Co(III) (4). Далее по
1 и 2 в системах ацетонитрил-HClO4 (А) и ацето-
нитрил-1,8-диазабицикло[5.4.0]ундец-7-ен (DBU)
оптимизированным методикам [13-16] синтези-
ровали 2,3,7,8,12,13,17,18-октабром-5,10,15,20-те-
(Б) [уравнения (1)-(4)] показало, что модифика-
ция порфиринового макроцикла изменяет кислот-
тра(3,5-дибромфенил)порфиринат Co(II)
5 и
но-основные свойства соединений 1 и 2 по сравне-
2,3,7,8,12,13,17,18-октабром-5,10,15,20-тетра-
нию с β-незамещенными аналогами [H2(3,5-BrPh)P
(3,4,5-триметоксифенил)порфиринат Co(II)
6.
и H2(4-MeO-3- BrPh)P] [17].
Oбработкa комплексов кобальта 4, 6 смесью хлор-
ной и серной кислот приводит к соединениям 1 и
2. При синтезе порфирина 1 кроме N-бромсукци-
2+
k
+
(1)
нимида (NBS) использовали бром.
H
P
←
→H
P++H
,
4
3
Кислотно-основные и комплексообразующие
+
k
+
(2)
H
P
←
→H
P+H
,
свойства соединений 1 и 2 по отношению к ионам
3
3
Zn2+ и Pd2+ изучали спектрофотометрическим ме-
k
(3)
тодом в ацетонитриле при 298-328 K, в качестве
H
2
P←→HP +H+,
объектов сравнения использовали исследованные
-
k
2−
HP
←
→P
+H+.
(4)
ранее β-незамещенные аналоги.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
СИНТЕЗ, СПЕКТР
АЛЬНЫЕ, КИСЛОТНО-ОСНОВНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
937
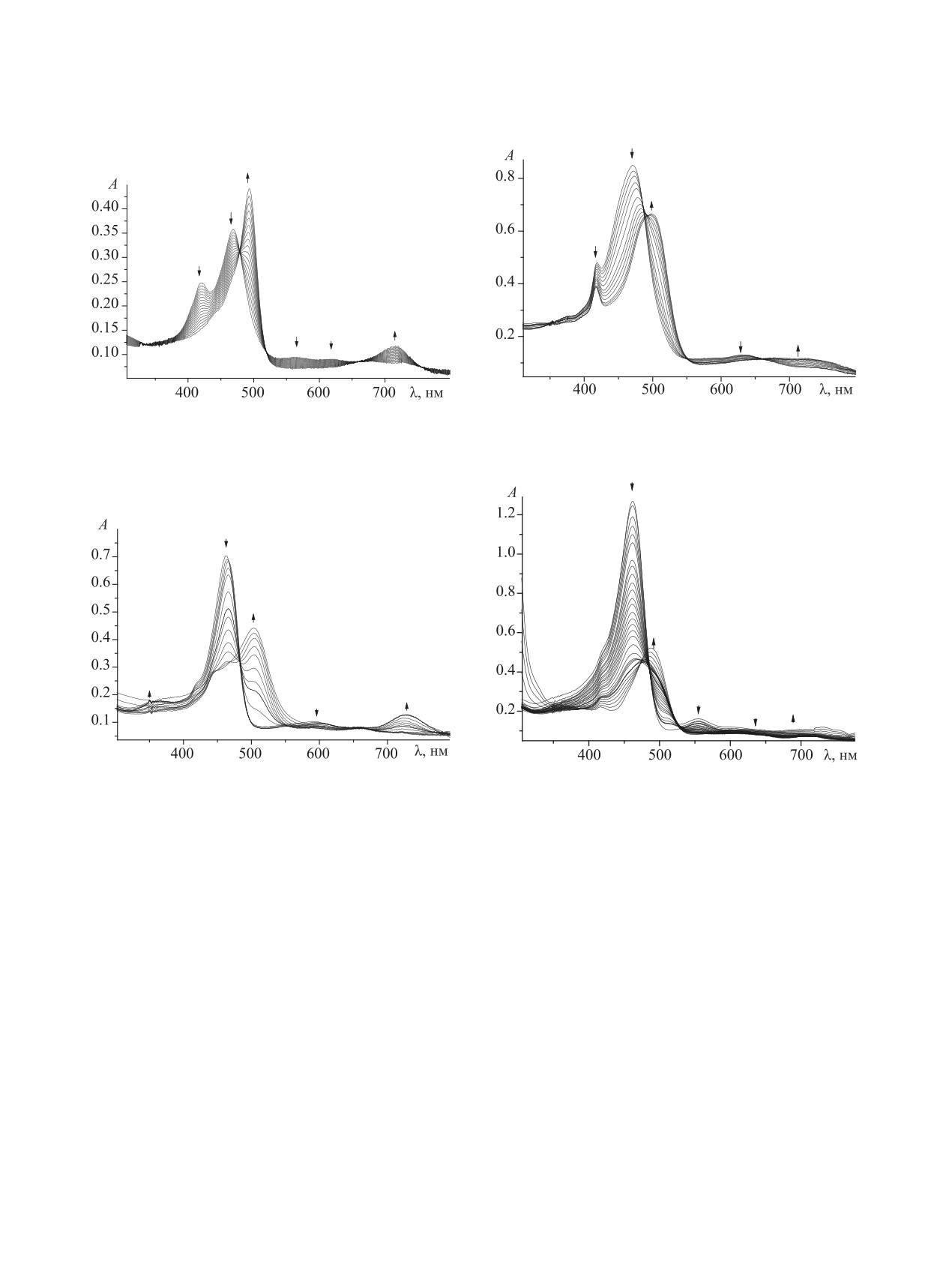
Рис. 1. Изменение ЭСП соединения 1 в системе ацето-
Рис. 2. Изменение ЭСП соединения 1 в системе ацето-
нитрил-HСlO4 при 298 K (спорф 2.49×10-6 моль/л, сHClO4
нитрил-DBU при 298 K (спорф 5.89×10-6 моль/л, сDBU
0-1.41×10-5 моль/л).
0-5.62×10-5 моль/л).
Рис. 3. Изменение ЭСП соединения 2 в системе ацето-
Рис. 4. Изменение ЭСП соединения 2 в системе аце-
нитрил-HClO4 при 298 K (спорф 5.85×10-6 моль/л, сHClO4
тонирил-DBU при 298 K (спорф 1.06×10-5 моль/л, сDBU
0-1.00×10-5 моль/л).
0-3.16×10-3 моль/л).
Здесь Н2Р, HР-, Р2-, H3P+, H4P2+ - молекулярная,
вания. Однако построенные на основании экспе-
моно- и дважды депротонированные и протониро-
риментальных данных кривые спектрофотометри-
ванные формы порфириновой молекулы.
ческого титрования не имели ярко выраженных
На рис. 1-4 приведены электронные спектры
ступеней, что не отрицает ступенчатой ионизации,
поглощения соединений 1 и 2 в ацетонитриле при
но предполагает близкие значения констант прото-
титровании 0.01 М. ацетонитрильными раствора-
нирования в каждой реакции [18]. Изобестические
ми HClO4 и DBU. Анализ спектров поглощения по-
точки и характер изменения спектров поглощения
казывает, что с увеличением концентрации HClO4
свидетельствуют о том, что по мере изменения
и DBU наблюдается образование двух семейств
концентраций двух поглощающих центров пор-
спектральных кривых, каждому из которых соот-
фириновой молекулы соотношение между иони-
ветствует свой набор изобестических точек.
зированными формами при протонировании и
Наличие двух семейств изобестических точек
депротонировании порфиринов не нарушается.
в ЭСП характерно для ступенчатого протониро-
Эффективные коэффициенты экстинкции для всех
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
938
ПУХОВСКАЯ и др.
Таблица 1. Параметры электронных спектров поглощения галогенозамещенных порфиринов в системах А и Б, кон-
станты кислотности и основности в ацетонитриле при 298 K
λ, нм (lgε)
Порфирины и их формы
pKb1,2
pKa1,2
полоса Соре
Q-полосы
H2(3,5-BrPh)P
417 (5.01)
513 (3.91), 546 (3.67), 588 (3.66), 649 (4.59)
17.50 [15]
(3,5-BrPh)P2+
442 (4.95)
492 пл (3.76), 596 пл (3.72), 650 (4.06)
H2(4-MeO-3- BrPh)P
418 (5.03)
515 (3.84), 552 (3.70), 593 (3.62), 651 (3.75)
18.09 [15]
H4(4-MeO-3-BrPh)P2+
452 (4.90)
685 (4.21)
H2Br8(3,5-BrPh)Р (1)
420 (5.01), 469
569 (4.59), 624 (4.57), 682 (4.56), 727 (4.57)
14.00
9.04
(5.16)
H4Br8(3,5-BrPh)Р2+
493 (5.29)
713 (4.70)
Br8(3,5-BrPh)Р2-
489 (5.33)
621 (4.67), 730 (4.67)
Zn2+Br8(3,5-BrPh)Р2-
478 (5.54)
617 (4.76), 680 (4.75)
ZnBr8(3,5-BrPh)Р
467 (5.36)
596 (4.60), 655 (4.58)
Pd2+Br8(3,5-BrPh)Р2-
444 (4.86),
554 (4.06), 594 (3.79)
476 пл (4.31)
H2Br8(3,4,5-MeOPh)Р (2)
463 (5.08)
556 (4.12), 617 (3.94), 709 (3.74)
17.0
11.18
H4Br8(3,4,5-MeOPh)Р2+
442 пл (4.68),
662 (4.15), 728 (4.35)
503 (4.88)
Br8(3,4,5-MeOPh)Р2-
417 пл (4.42)
488 (4.70), 627(4.02), 682 (4.05)
ZnBr8(3,4,5-MeOPh)Р
356 пл (4.50),
585 (4.19), 670 (3.99)
461(5.13)
Zn2+Br8(3,4,5-MeOPh)Р2-
330 пл (5.15),
472 (4.83), 602 (4.14), 664 (4.06)
453 пл (4.73)
Pd2+Br8(3,4,5-MeOPh)Р2-
475(4.75)
609 (4.07), 667(4.14)
форм порфиринов 1 и 2, участвующих в равно-
та DBU, моль/л. Погрешность измерения констант
весиях
(1)-(4), были определены с использо-
не превышала 3-5% (табл. 1).
ванием данных по поглощению и общей кон-
Анализируя данные табл. 1, можно сделать вы-
центрации частиц каждого порфирина (табл. 1).
вод о том, что величины основности соединений 1
Суммарные константы протонирования и депро-
и 2 в системе А уменьшаются на 3.5 и на один поря-
тонирования для реакций (1)-(4) вычисляли по
док соответственно по сравнению с H2(3,5-BrPh)P,
уравнениям (5), (6).
H2(4-MeO-3-BrPh)P. Дополнительное бромиро-
pK
= -lgK
= lg(Ind) + pH.
(5)
вание соединений 1 и 2 приводит к проявлению
b1,2
b1,2
кислотных свойств порфиринов 1 и 2 в систе-
Здесь Kb1,2 - суммарная константа протонирования
ме Б в отличие от соединений H2(3,5-BrPh)P,
по первой и второй ступеням, Ind - индикаторное
H2(4-MeO-3-BrPh)P.
отношение [H2P]/[H4P2+]. Зависимость pH-lgсHClO4
Кинетику образования цинковых и палладие-
[19] использовали при расчете констант протони-
вых комплексов порфиринов 1 и 2 в ацетонитриле
рования.
изучали спектрофотометрическим методом [20] в
системах Zn(ОАс)2-ацетонитрил (В) и Zn(ОАс)2-
pK
= -lgK
= lg(Ind) + lg c
(6)
a1,2
a1,2
DBU
DBU-ацетонитрил (Г), Pd(ОАс)2-ацетонитрил (Д)
и Pd(ОАс)2-DBU-ацетонитрил (Е). Использова-
Здесь K - суммарная константа протонирования по
ние спектрофотометрии возможно благодаря зна-
первой и второй ступеням, Ind - индикаторное от-
чительным различиям в электронных спектрах
ношение [P2-]/[H2P], сDBU - концентрация титран-
поглощения порфиринов и их комплексов.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
СИНТЕЗ, СПЕКТР
АЛЬНЫЕ, КИСЛОТНО-ОСНОВНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
939
Таблица 2. Кинетические параметры образования цинковых и палладиевых комплексов порфиринов в ацетонитриле
[Zn(OAc)2]×103,
kv298×103,
Ea,
ΔS≠,
Порфирины и их формы
моль/л
л∙моль-1·с-1
кДж/моль
Дж/(моль·K)
H2(3,5-BrPh)P
4.5
88±1
78±2
-11±1
H2(4-MeO-3-BrPh)P
4.5
91±1
80±1
-5±1
H2Br8(3,5-BrPh)Р (1)
4.5
40±1
81±1
-8±1
Br8(3,5-BrPh)Р2-
1.5
100±2
60±1
-71±3
H2Br8(3,4,5-MeOPh)Р (2)
4.5
51±1
81±1
-6±1
Br8(3,4,5-MeOPh)Р2-
1.5
110±2
55±1
-87±3
H2(3,5-BrPh)P
4.5
10±1a
92±2
-20±2
H2(4-MeO-3-BrPh)P
4.5
17±2a
88±2
29±2
Br8(3,5-BrPh)Р2-
1.5
60±1a
80±1
-8±1
Br8(3,4,5-MeOPh)Р2-
1.5
80±1a
82±1
-2±1
а kv298×105.
В индивидуальном растворителе - ацетонитри-
комплексы соединений 1 и 2 образуются только в
ле - взаимодействие порфиринов 1 и 2 в системах
системе Е по реакции (8).
В-Е с ацетатами металлов протекает согласно
Из сравнения кинетических параметров коор-
уравнениям (7), (8) [9].
динации Zn(II) и Pd(II) с порфиринами 1, 2 следует,
что введение заместителей в β-положения порфи-
2
H P+[M(OAc) (Solv)
2
n-
2
]
рина изменяет координационные свойства макро-
→
MP
+
2HOAc
+
(n
−
2)Solv,
(7)
цикла, что, по-видимому, связано с электронным
влиянием заместителей и способностью тетрапир-
2−
P
+
[M(OAc)
(Solv)
]
рольного макрокольца к деформации. Активность
2
n−2
−
лигандов в таких системах определяется также
→
MP
+
2OAc
+
(n
−
2)Solv.
(8)
строением образующихся в растворах кислот-
но-основных комплексов, ионизирующая способ-
P и P2- - молекулярная и дважды депрото-
Здесь H2
ность которых зависит от степени переноса про-
нированная формы порфиринов 1 и 2, M2+ - катион
тона от молекулы кислоты к молекуле основания
цинка или палладия, OAc - ацетат ион, Solv - мо-
(растворителя). Природа металла-комплексообра-
лекула растворителя, n - координационное число
зователя значительно влияет на величину констан-
катиона металла.
ты скорости комплексообразования. В системе в
На спектрах реагирующих систем наблюда-
[реакция (7)] скорость образования цинковых ком-
лись четкие изобестические точки, и реакции (7)
плексов для замещенных по β-положениям порфи-
и (8) подчинялась первому порядку по порфирину,
ринов 1 и 2 уменьшается в ~2 раза по сравнению
о чем также свидетельствует прямолинейный ха-
с ранее исследованными незамещенными аналога-
рактер зависимостей lg(с0H
/сH
) от времени τ (с).
ми (табл. 2). В системе Г [реакция (8)] наблюда-
2P
2P
Прямолинейная зависимость lgkэф от lgс
Me(OAc)2
ется увеличение скорости комплексообразования
(тангенс угла наклона 0.999-1.100, коэффициент
в ~2.5 раза по сравнению с реакциями в системе
корреляции 0.999) также указывает на первый по-
В. Ранее было установлено, что незамещенные по
рядок образования палладиевых и цинковых ком-
β-положениям аналоги порфиринов 1 и 2 образуют
плексов. Кинетические параметры образования
палладиевые комплексы в системе Д на несколько
цинковых и палладиевых комплексов в ацетони-
порядков медленее по сравнению с образованием
триле представлены в табл. 2.
их цинковых комплексов в системе В [16]. Порфи-
Образование цинковых комплексов соедине-
рины 1 и 2 образуют палладиевые комплексы толь-
ний 1 и 2 в ацетонитриле протекает двумя путями
ко в системе Е в присутствии органического осно-
[реакции (7) и (8)] в системах В, Г. Палладиевые
вания, способствующего протеканию реакции (8)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
940
ПУХОВСКАЯ и др.
с меньшими энергетическими затратами, обуслов-
Cary 100. Методика эксперимента (препаративная
ленными необходимостью разрыва и сольватации
часть и обработка экспериментальных данных)
связи N-H реакционного центра. В системе Д об-
подробно представлена в работах [22, 23].
разования палладиевых комплексов с порфирина-
5,10,15,20-Тетра(3,5-дибромфенил)порфи-
ми 1 и 2 в условиях эксперимента не происходит.
ринат Со(II) (3). Смесь 0.04 г (0.0322 ммоль)
Вероятно, введение в β-положения атомов брома
тетра(3,5-дибромфенил)порфирина и
0.057 г
приводит к увеличению кислотных и к уменьше-
(0.322 ммоль) Co(OAc)2 в 45 мл ДМФА кипятили
нию комплексообразующих свойств порфиринов
10 мин. Реакционную смесь охлаждали и вылива-
1 и 2 из-за неизбежных энергетических затрат при
ли в воду. Осадок отфильтровывали, промывали
взаимодействии частиц с одноименным зарядом.
водой, сушили и хроматографировали на оксиде
Таким образом, химическая модификация по-
алюминия, элюент - хлороформ. Выход 0.031 г
зволяет направленно изменять основные и ком-
(0.0238 ммоль, 74%). ЭСП (ДМФА), λ, нм (lgɛ): 415
плексообразующие свойства макрогетероцикли-
(5.33), 530 (4.24). Спектр ЯМР 1Н (CDCl3), δ, м. д.:
ческих лигандов и реакционную способность
15.76 уш. с (8Н, пиррол), 13.05 уш. с (8Но), 10.02
порфиринов.
уш. с (4Нп). Масс-спектр, m/z (Iотн, %): 1304.3. (97)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[M + Н]+. С44H20Br8CoN4. М 1302.9.
5,10,15,20-Тетра(3,4,5-триметоксифенил)-
5,10,15,20-Тетра(3,5-дибромфенил)порфирин
порфиринаты Со(II) и Со(III) (4). Смесь 0.04 г
и 5,10,15,20-тетра(3,4,5-триметоксифенил)порфи-
(0.041
ммоль) тетра(3,4,5-триметоксифенил)
рин получены по опубликованным методикам [12,
порфирина и 0.072 г (0.41 ммоль) Cо(OAc)2 в
21]. В работе использовали N-бромсукцинимид,
30 мл ДМФА кипятили 15 с и обрабатывали,
ацетат кобальта, серную кислоту (Acros), оксид
алюминия (Merck), хлороформ, дихлорметан, гек-
как при получении комплекса 3. Выход 0.036 г
сан, диметилформамид, хлорную кислоту, бром
(0.0349 ммоль, 85%). ЭСП (ДМФА), λ, нм [Iотн]:
марки ХЧ.
419 [1.04], 433 [0.178], 535 [0.149]. ЭСП (CHCl3), λ,
нм [Iотн]: 415 [1.31], 434 [1.26], 537 [0.24]. Спектр
Электронные спектры поглощения записы-
ЯМР 1Н (CDCl3), δ, м. д.: Со(II)-порфирин, 16.29
вали на спектрофотометре Cary-100 (Varian).
уш. с (8Н, пиррол), 12.72 уш. с (8Но), 5.57 c (12Н,
Масс-спектры получали на масс-спектрометре
OCH3), 5.01 c (24H, OCH3); Со((III)-порфирин, 9.15
Maldi Tof Shimadzu Biotech Axima Confidence (ма-
трица - дигидроксибензойная кислота). Cпектры
с (8Н, пиррол), 7.48 д (8Но, J 7.70 Гц), 4.20 с (12Н,
OCH3), 3.99 (24Н, OCH3). Масс-спектр, m/z (Iотн,
ЯМР 1Н записывали на приборе Bruker AV III-500
(внутренний стандарт - ТМС). Элементный ана-
%): 1032.08 (98) [M]+. С56Н52CoN4О12. М 1032.05.
лиз выполнен на анализаторе Flash EA 1112.
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-
При исследовании кислотно-основных и коор-
тетра(3,5-дибромфенил)порфиринат Со(II) (5).
динационных свойств порфиринов 1, 2 в качестве
К раствору 0.02 г (0.0154 ммоль) комплекса 3 в
растворителя использовали ацетонитрил (Lab-
cмеси 8 мл хлороформа и 2 мл ДМФА прибавля-
Scan) высокой степени очистки (доля воды менее
ли 0.055 г (0.308 ммоль) NBS, выдерживали при
0.03%), в котором исходные соединения находи-
комнатной температуре 4 ч. К реакционной смеси
лись в молекулярной форме, согласно электрон-
прибавляли 0.04 мл (0.12 г) брома в 2 мл хлоро-
ным спектрам поглощения.
форма, выдерживали 4 ч. Излишки брома нейтра-
Кинетические измерения (спектрофотометр
лизовали раствором тиосульфата натрия. Реакци-
Cary 100 Varian) проводили в термостатируемых
онную смесь тщательно промывали водой, сушили
кюветах на шлифах в интервале температур от 298
Na2SO4 и упаривали. Остаток хроматографировали
до 318 K (три повторности при трех различных
на оксиде алюминия, элюент - дихлорметан, затем
температурах). Колебание температуры не превы-
хлороформ. Выход 0.019 г (0.00982 ммоль, 65%).
шало ±0.1°. Спектрофотометрическое титрование
ЭСП (ДМФА), λ, нм (lgε): 457 (4.96), 566 (4.14).
порфиринов 1, 2 растворами хлорной кислоты в
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 10.22 уш. с (8Но),
ацетонитриле проводили на спектрофотометре
8.13 уш. с (4Нn). Найдено, %: С 27.09; Н 0.58; Br
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
СИНТЕЗ, СПЕКТР
АЛЬНЫЕ, КИСЛОТНО-ОСНОВНЫЕ И КООРДИНАЦИОННЫЕ СВОЙСТВА
941
65.53; N 2.78. С44H12Br16CoN4. Вычислено, %: С
ИНФОРМАЦИЯ ОБ АВТОРАХ
27.33; Н 0.63; Br 66.10; N 2.90. M 1934.01.
Пуховская Светлана Геннадьевна, ORCID:
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-
тетра(3,4,5-триметоксифенил)порфиринат
Со(II) (6). К раствору 0.02 г (0.0194 ммоль) ком-
org/0000-0002-2580-1328
плекса 4 в cмеси 8 мл хлороформа и 2 мл ДМФА
Чижова Наталья Васильевна, ORCID: http://
прибавляли в три приема через каждые 10 мин
orcid.org/0000-0001-5387-5933
0.069 г (0.388 ммоль) NBS. Реакционную смесь
Сырбу Сергей Александрович, ORCID: http://
упаривали до минимального объема, прибавляли
orcid.org/0000-0003-1482-2809
2 мл ДМФА, воду и твердый NaCl. Осадок отфиль-
тровывали, промывали водой, сушили и хромато-
БЛАГОДАРНОСТЬ
графировали на оксиде алюминия, элюент - хло-
Работа выполнена с использованием обору-
роформ. Выход 0.024 г (0.0144 ммоль, 75%). ЭСП
дования Верхневолжского регионального центра
(ДМФА), λ, нм (lgε): 457 (5.02), 572 (4.21). ЭСП
физико-химических исследований.
(CHCl3), λ, нм [Iотн]: 448 [1.23], 566 [0.22]. Спектр
КОНФЛИКТ ИНТЕРЕСОВ
ЯМР 1Н (CDCl3), δ, м. д.: 10.05 уш. с (8Но), 5.32 с
(24Н, ОСН3), 4.18 с (12Н, ОСН3). Найдено, %: С
Авторы заявляют об отсутствии конфликта
40.23; Н 2.54; Br 38.11; N 3.26. С56Н44Br8CoN4О12.
интересов.
Вычислено, %: С 40.44; Н 2.67; Br 38.43; N 3.37. M
СПИСОК ЛИТЕРАТУРЫ
1663.15.
1.
Kim J.B., Adler A.D., Longo F.R., Dolphin D. In: The
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-
Porphyrins / Ed. D.Dolphin. New York: Academic
тетра(3,5-дибромфенил)порфирин (1). К 0.025 г
Press, 1978. Vol. 1. P. 88.
комплекса кобальта 5 в 8 мл хлороформа прибав-
2.
Сырбу С.А.,Агеева Т.А.,Семейкин А.С.,Койфман О.И. //
ляли 3 мл 58 %-ной хлорной и 2.5 мл 96 %-ной
Изв. АН. Сер. хим. 2007. Т. 56. № 4. С. 680;
серной кислот. Полученную смесь перемешивали
Syrbu S.A., Ageeva T.A., Semeikin A.S.., Koifman O.I. //
при комнатной температуре 1 ч. После заверше-
Russ. Chem. Bull. 2007. Vol. 56. N 4. P. 707.
doi 10.1007/s11172-007-0108-y
ния реакции органический слой отделяли, про-
3.
Senge M.O. // Chem. Commun. 2006. N 3. P. 243. doi
мывали водой, раствором аммиака, снова водой,
10.1039/B511389J
сушили Na2SO4 и упаривали до минимального
4.
Campbell W.M., Burrell A.K., Officer D.L., Jolley K.W. //
объема. Остаток хроматографировали на оксиде
Coord. Chem. Rev. 2004. Vol. 248. P. 1363. doi
алюминия, элюент - хлороформ. Выход 0.017 г
10.1016/j.ccr.2004.01.007
(0.0106 ммоль, 70%). ЭСП (СH2Cl2), λ, нм (lgε):
5.
Пуховская С.Г., Гусева Л.Ж., Семейкин А.С., Го-
469 (5.16), 569 (4.21), 624 (4.05), 682 (3.97), 727
лубчиков О.А. // ЖНХ. 2007. Т. 52. № 2. С. 337;
(3.83). Найдено: С 27.65; Н 0.71; Br 67.58; N 2.86.
Pukhovskaya S.G., Guseva L.Zh., Semeikin A.S.,
Golubchikov O.A. // Russ. J. Inorg. Chem. 2007.
С44H14Br16N4. Вычислено: С 28.15; Н 0.75; Br
Vol. 52. N 2. P. 293. doi 10.1134/S0036023607020283
68.11; N 2.98. М 1877.1.
6.
Пуховская С.Г., Гусева Л.Ж., Семейкин А.С., Голуб-
2,3,7,8,12,13,17,18-Октабром-5,10,15,20-
чиков О.А. // Кинетика и катализ. 2007. Т. 48. № 2.
тетра(3,4,5-триметоксифенил)порфирин (2) по-
С. 205; Pukhovskaya S.G., Guseva L.Zh., Semeikin
лучали аналогично из 0.025 г комплекса кобальта
A.S., Golubchikov O.A. // Kinetics and Catalysis. 2007.
Vol. 48. N 2. P. 190. doi 10.1134/S0023158407020024
6, 8 мл хлороформа, 3 мл 58 %-ной хлорной кис-
7.
Порфирины: структура, свойства, синтез / Под. ред.
лоты, 1.5 мл 96 %-ной серной кислоты; время ре-
Н.С. Ениколопяна. М.: Наука, 1985. C. 205.
акции - 1.5 ч. Выход 0.017 г (0.0106 ммоль, 70%).
8.
Березин Д.Б., Иванова Ю.Б., Шейнин В.Б. //
ЭСП (СH2Cl2), λ, нм (lgε): 464 (5.08), 558 (4.12),
ЖФХ. 2007. Т. 81. № 12. С. 2205.; Berezin D.B.,
619 (3.94), 714 (3.75). Найдено, %: С 41.97; Н 2.78;
Ivanova Yu.B., Sheinin V.B. // Russ. J. Phys. Chem.
Br 39.23; N 3.25. С56Н46Br8N4О12. Вычислено, %: С
(A). 2007. Vol. 81. N 12. Р. 1986. doi 10.1134/
41.8; Н 2.89; Br 39.80; N 3.49. М 1606.24.
S003602440712014X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
942
ПУХОВСКАЯ и др.
9. Успехи химии порфиринов / Под ред. О.А. Голуб-
Mamardashvili N.G. // Russ. J. Org. Chem. 2019. Vol.
чикова. СПб: НИИ химии СПбГУ, 2001. Т. 3. С. 47.
55. P. 1878. doi 10.1134/S107042801912011X
10. Koifman O.I., Ageeva T.A., Syrbu S.A. // Macrohet
18. Бернштейн И.Я. Спектрофотометрический анализ в
erocycles. 2020. Vol. 13. N 4. P. 183. doi 10.6060/
органической химии. Л.: Химия, 1986. C. 202.
mhc200814k
11. Adler A.D., Longo F.R., Kampas F., Kim J. // J. Inorg.
19. Пуховская С.Г., Дао Тхе Нам, Чан Динг Фиен, До-
Nucl. Chem. 1970. Vol. 32. P. 2443. doi 10.1016/0022-
манина Е.Н., Иванова Ю.Б., Семейкин А.С. //
1902(70)80535-8
ЖФХ. 2017. Т. 91. № 9. С. 1508; Pukhovskaya S.G.,
12. Alberry W.J., Bartlett P.N., JonesC.C., Milgrom L.R. //
Nam D.T., Fien C.D., Domanina E.N., Ivanova Y.B.,
J. Chem. Res. Synop. 1985. N 12. P. 364.
13. Bhyrappa P., Krishnan V. // J. Inorg. Chem. 1991.
Semeikin A.S. // Russ. J. Phys. Chem. (A). 2017. Vol. 91.
Vol. 30. N 2. P. 239. doi 10.1021/ic00002a018
N 9. P. 1692. doi 10.7868/S0044453717090278
14. Hariprasad G., Dahal S., Maiya B.G. // J. Chem.
20. Berezin B.D. Coordination compounds of porphyrins
Soc. Dalton Trans. 1996. Vol. 16. P. 3429. doi
and phthalocyanines. New York; Toronto: Wiley, 1981.
10.1039dt9960003429
P. 286.
15. Мамардашвили Н.Ж., Иванова Ю.Б., Чижова Н.В. //
Макрогетероциклы. 2019. T. 12. № 1. С. 22.;
21. Семейкин А.С., Койфман О.И., Березин Б.Д. // ХГС.
Mamardashvili N.G., Ivanova Yu.B., Chizhova N.V. //
1986. № 6. С. 798; Semeikin A.S., Koifman O.I., Bere-
Macroheterocycles. 2019. Vol. 12. N 1. P. 22. doi
zin B.D. // Chem. Heterocycl. Compd. 1986. N 6. P. 629.
10.6060/mhc180900m
doi 10.1007/BF00575244
16. Иванова Ю.Б., Чижова Н.В., Мамардашвили Н.Ж. //
ЖОХ. 2019. Т. 55. № С. 1609; Ivanova Y.B., Chizho-
22. Иванова Ю.Б., Чурахина Ю.И., Мамардашвили Н.Ж. //
va N.V., Mamardashvili N.Z. // Russ. J. Org.
ЖОХ. 2008. T. 78. C. 691; Ivanova Yu.B., Churakhi-
Chem. 2019. Vol. 55. N 10. P. 1554. doi 10.1134/
na Yu.I. Mamardashvili N.Zh. // Russ. J. Gen. Chem.
S1070428019100142
2008. Vol. 78. P. 673. doi 10.1134/S1070363208040269
17. Иванова Ю.Б.,Семейкин А.С.,Пуховская С.Г.,Мамар-
23. Ivanova Yu.B., Mamardashvili N.Zh. // J. Fluoresc.
дашвили Н.Ж. // ЖОрХ. 2019. Т. 55. С. 1878; Ivano-
va Yu.B., Semeikin A.S., Pukhovskaya S.G.,
2017. Vol. 27. P. 303. doi 10.1007/s10895-016-1958-1
Synthesis, Spectral, Acid-Basic and Coordination Properties
of Bromine- and Methoxy-Substituted Tetraphenylporphyrins
S. G. Puhovskayaa, Yu. B. Ivanovab,*, N. V. Chizhovab, and S. A. Syrbub
a Ivanovo State University of Chemistry and Technology, Ivanovo, 153000 Russia
b G. A. Krestov Institute of Solution Chemistry of the Russian Academy of Sciences, Ivanovo, 153045 Russia
*e-mail: jjiv@yandex.ru
Received April 19, 2021; revised April 19, 2021; accepted May 6, 2021
The direct synthesis of symmetrically substituted porphyrins - 2,3,7,8,12,13,17,18-octabromo-5,10,15,20-tet-
ra-(3,5-dibromophenyl)porphyrin and 2,3,7,8,12,13,17,18-octabromo-5,10,15,20-tetra-(3,4,5-trimethoxyphe-
nyl)porphyrin - was proposed. The obtained compounds were identified by electron absorption, 1H NMR
spectroscopy and mass spectrometry. The acid-base and coordination properties of 2,3,7,8,12,13,17,18-oc-
tabromo-5,10,15,20-tetra-(3,5-dibromophenyl)porphine and 2,3, 7,8,12,13,17,18-octabromo-5,10,15,20-tet-
ra-(3,4,5-trimethoxyphenyl)porphine with respect to Zn2 + and Pd2 + ions in acetonitrile at 298-328 K were
studied. The effect of substituents in the β-positions and meso-phenyl fragments of the macrocycle on the
spectral and coordination properties of the analyzed compounds was revealed. β-Unsubstituted analogs studied
earlier were used as objects of comparison.
Keywords: bromo(methoxy)-substituted porphyrins, metalloporphyrins, acid-base properties, coordination
properties, spectral properties
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021