ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 959-965
УДК 547.917
ОСОБЕННОСТИ ОБРАЗОВАНИЯ КОМПЛЕКСОВ
ВКЛЮЧЕНИЯ МОНОЗАМЕЩЕННЫХ ПРОИЗВОДНЫХ
β-ЦИКЛОДЕКСТРИНА
© 2021 г. Н. В. Кутяшева*, Г. И. Курочкина, В. В. Глушко, М. К. Грачёв
Московский педагогический государственный университет, Институт биологии и химии,
ул. Кибальчича 6/2, Москва, 119021 Россия
*e-mail: knatali1706@mail.ru
Поступило в Редакцию 26 апреля 2021 г.
После доработки 26 апреля 2021 г.
Принято к печати 11 мая 2021 г.
При попытке получения соединений включения ряда монопроизводных β-циклодекстрина, содержащих
сложные и простые эфирные связи, с некоторыми ароматическими и алифатическими карбоновыми
кислотами неожиданно были получены соединения включения гость-хозяин, предположительно, вслед-
ствие предварительного включения гостя в полость β-циклодекстрина. Строение и состав комплексов
включения подтверждены методом спектроскопии ЯМР 1Н и 13С.
Ключевые слова: β-циклодекстрин, простые и сложные эфиры, гидролиз, соединения включения,
гость-хозяин, спектроскопия ЯМР
DOI: 10.31857/S0044460X21060135
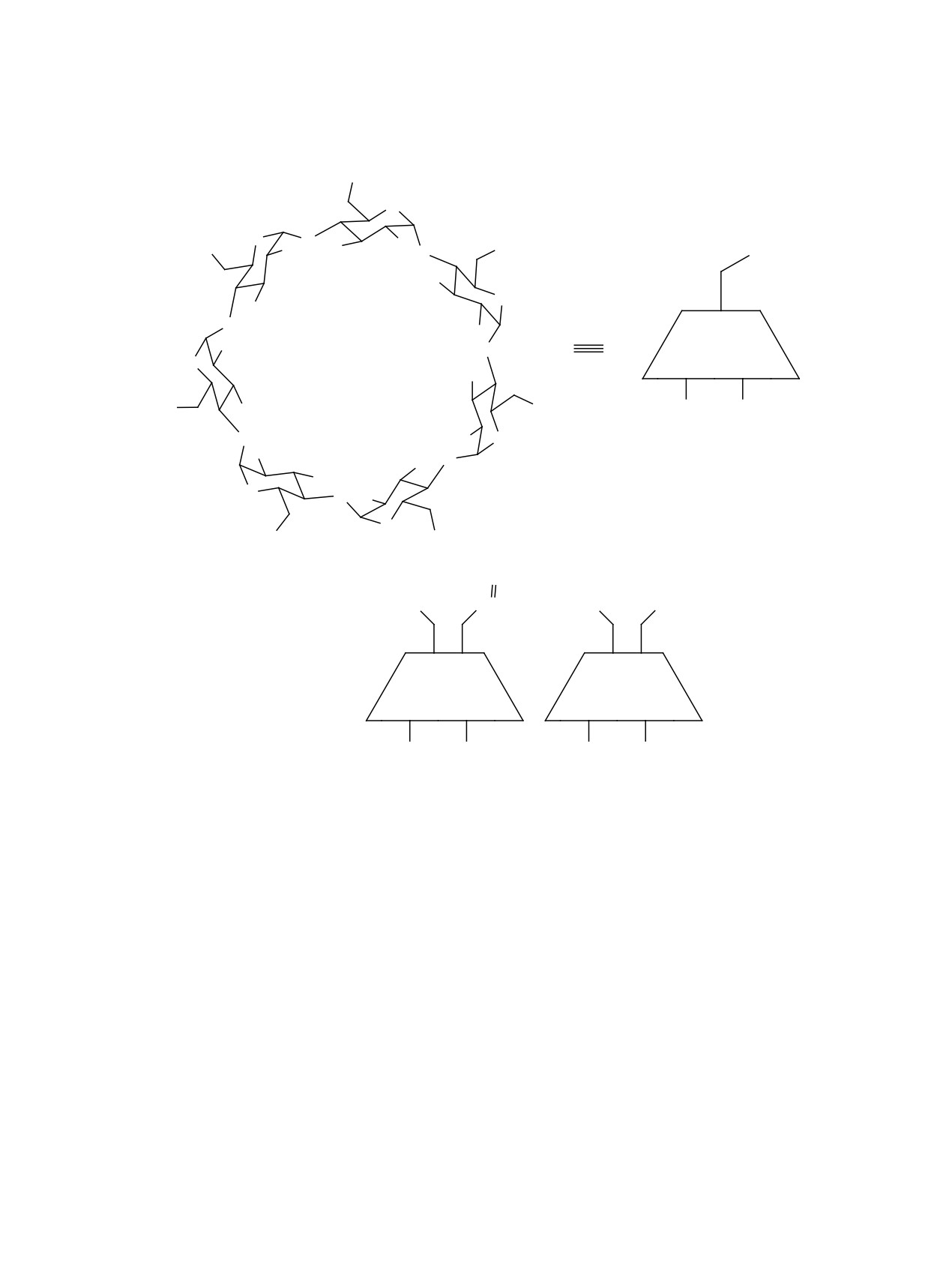
Важнейшая особенность циклодекстринов -
нопроизводных β-циклодекстрина 1 с фрагмента-
способность к легкому образованию комплексов
ми сложных А [3] или простых B [4] эфиров при
включения гость-хозяин - нашла самое широкое
первичном атоме углерода С6 (схема 1).
практическое применение в фармакологии, глав-
Предполагается, что производные β-цикло-
ным образом для применения циклодекстринов в
декстрина с фармакологически важными монокар-
качестве «контейнеров» лекарственных соедине-
боновыми кислотами могут быть потенциальны-
ний (см., например, монографию [1]). При этом
ми носителями (в виде соединений включения и
такие важные свойства циклодекстринов, как рас-
конъюгатов) различных лекарственных соедине-
творимость в воде и способность к образованию
ний. Образование соединений включения гость-
комплексов включения с различными органиче-
хозяин с гидрофобными гостями часто приводит к
скими субстратами, могут быть направленно изме-
нарушению обычного хода реакций циклодекстри-
нены путем селективной модификации их струк-
нов [5-8]. Так, например, попытки более глубокого
туры [2].
ацилирования β-циклодекстрина монокарбоновы-
Регионаправленная функционализация цикло-
ми ароматическими кислотами оказались неудач-
декстринов представляет собой сложную в экс-
ными из-за того, что ацилированию предшествует
периментальном отношении задачу из-за присут-
предварительное включение (предорганизация)
ствия в их молекулах трех типов различных по
кислоты в гидрофобную полость циклодекстрина.
природе гидроксильных групп - два набора вто-
Предполагается [3, 9], что у моноацилированного
ричных гидроксильных групп (при атомах С2 и
β-циклодекстрина его полость уже занята своим
С3) и один набор первичных гидроксильных групп
же заместителем (self-inclusion), как это отмечено
(при атомах С6). Ранее мы предложили удобные в
и для некоторых других подобных случаев [10, 11],
практическом отношении методы получения мо-
что препятствует его дальнейшему ацилированию.
959
960
КУТЯШЕВА и др.
Схема 1.
OH
O
O
O
HO
HO
OH
OH
OH
O
(OH)7
6
HO
O
HO
O
OH
OH
O
O
3
2
OH
HO
OH
OH
(OH)7
(OH)7
O
O
OH
OH
1
O
1
3
OH
2
5
OH
O
OH
O
4
6
O
HO
OH
O
(HO)6
OCR
(HO)6
OR
6'
6'
(OH)7
(OH)7
(OH)7
(OH)7
A
B
Ряд современных лекарственных препаратов
хозяина (монопроизводного β-циклодекстрина 2
включает два лекарственных соединения, напри-
или 3) прибавляли соответствующее количество
мер, ибупрофен и парацетамол в соотношении 2:1
гостя 4 или 5. Полученный раствор нагревали
(препарат «НЕКСТ»), что приводит к более эффек-
при 70°С и оставляли на сутки при 20°С. Состав
тивному и разнообразному фармакологическому
и соотношение твердых продуктов реакции 6, 7
действию. Нами рассмотрена возможность образо-
определяли методом спектроскопии ЯМР 1Н и 13С
вания соединений включения гость-хозяин β-ци-
(схема 2).
клодекстрином, конъюгированным (ковалентно
Неожиданно оказалось, что при обработке бен-
связанным) с остатками 2-(4-изобутилфенил)про-
зойной кислотой 4 соединений 2 и 3 происходит
пионовой кислоты 2 - действующего соединения
полный гидролиз сложноэфирной связи соедине-
препарата ибупрофен - и никотиновой кислоты 3,
ния 3 и частичный гидролиз соединения 2 с образо-
с некоторыми монокарбоновыми ароматическими
ванием соединений включения β-циклодекстрина
кислотами: бензойной кислотой 4 и 2-(4-изобутил-
с бензойной кислотой (1:1, комплекс 6). Обработка
фенил)пропионовой кислотой 5.
соединения 2 кислотой 5 в тех же условиях также
Образование соединений включения проводи-
приводит к полному гидролизу сложноэфирной
ли по стандартной методике. К водному раствору
связи, , при этом образуется соединение включе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ОСОБЕННОСТИ ОБР
АЗОВАНИЯ КОМПЛЕКСОВ
961
Схема 2.
(OH)7
O
(OH)7
(HO)6
OCR1(R2)
6'
O
O
HOCR1
HOCR2
(OH)7
(OH)7
4
4+2,3
2+5
5
(OH)7
(OH)7
(OH)7
(OH)7
(OH)7
(OH)7
6
2, 3
(OH)7
7
N
(3),
(4);
R2 = (CH)3C
R1 =
Bu-i (2, 5).
ние β-циклодекстрина с кислотой 5 (2:1, комплекс
Схема 3.
7). Гидролиз сложноэфирной связи у соединений
H
O
2 и 3 подтверждается исчезновением в спектрах
ЯМР 13С слабопольных сигналов атомов углерода
H
6C
H
O
O
C1
H
С6′ 1 при 65.3 м. д., связанных со сложноэфирным
5C
4C
H
C2
остатком у соединений 2 и 3 [3, 9]. Отдельным
H
O
H
3C H
экспериментом было показано, что в аналогич-
HO
H
ных условиях гидролиз в отсутствие гостей 4 и
5 не происходит. Следовательно, легкий гидролиз
сложноэфирных связей производных β-цикло-
декстрина 2 и 3 протекает после предварительно-
го включения соответствующего гостя в полость
Нами рассмотрено поведение в аналогичных
циклодекстрина. Согласно данным работ [12-17],
условиях более прочных соединений - простых
на включение в гидрофобную полость β-цикло-
эфиров Б (схема 1). Mонобутил- (8) и моногек-
декстрина молекулы гостя в спектрах ЯМР 1Н
силпроизводные (9) β-циклодекстрина [6] обра-
сильнее всего реагируют протоны НС3 и НС5 глю-
батывали в тех же условиях ароматическими кис-
козидных фрагментов циклодекстриного каркаса,
лотами 4, 5, 10, 11 и валериановой кислотой 12
так как именно они ориентированы внутрь цикло-
(схема 4). Несмотря на то, что простая эфирная
декстриновой полости. Сигналы других протонов
связь в соединениях 8 и 9 намного прочнее, чем
НС1, НС2, НС4 и НС6 практически не изменяют
сложноэфирная связь в соединениях 2 и 3, также
своих положений в спектрах ЯМР 1Н соединений
наблюдался легкий гидролиз простой эфирной
включения. Аналогичное смещение сигналов про-
связи с образованием соединений включения 6, 7 и
тонов положений НС3 и НС5 мы наблюдали в спек-
подобных соединений включения 13, 15 с гостями
трах соединений включения 6 и 7 (схема 3).
10 и 12 соответственно.
При обработке соединения 8 никотиновой кис-
1 Штрихом отмечены атомы углерода С6 углеводных фрагмен-
тов циклодекстрина, несущие заместитель.
лотой 11 наблюдалось образование соединения
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
962
КУТЯШЕВА и др.
Схема 4.
(OH)7
(OH)7
(HO)6
OR1(R2)
6'
R1OH
R1OH
4, 5, 10, 12
8 + 11
(OH)7
(OH)7
R1OH
11
(OH)7
(OH)7
(OH)
7
(OH)7
(OH)7
(OH)7
6, 7, 13, 14, 16
8, 9
(OH)7
14
R1= -(CH2)3CH3 (8);
C
(10, 13) ; -C(O)(CH2)3CH3 (12, 15);
R2= -(CH2)5CH3 (9);
O
H3C(O)CO
N
R1OH = HOC(O)
включения 14 с соотношением гость:хозяин = 1:2.2
мание возможность легкого гидролиза эфирных
Гидролиз простой эфирной связи у соединений 8 и
связей в производных циклодекстрина, что огра-
9 подтверждается исчезновением в спектрах ЯМР
ничивает возможности их практического исполь-
13С слабопольных сигналов углеродов С6′ при
зования в качестве хозяев.
66.5 м. д., связанных с простым эфирным остатком
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
[3]. Отдельным экспериментом мы показали, что
в аналогичных условиях гидролиз простой эфир-
Спектры ЯМР 1Н и 13С регистрировали на при-
ной связи без участия гостей 4, 5, 10-12 не про-
боре Jeol ECX-400 на частотах 399.78 и 100.52 МГц
исходит. Следовательно, гидролиз простой эфир-
соответственно. Химические сдвиги 1Н и 13С приве-
ной связи в производных β-циклодекстрина 8 и 9
дены относительно сигнала SiMe4, растворитель -
также происходит в результате предварительного
ДМСО-d6. Для тонкослойной хроматографии при-
включения соответствующего гостя в полость ци-
меняли алюминиевые пластины с закрепленным
клодекстрина.
слоем силикагеля (Silufol UV-254), элюент - аце-
Таким образом, нами обнаружено, что при по-
тонитрил-хлороформ, 1:1. В работе использовали
лучении соединений включения монозамещенных
β-циклодекстрин фирмы «ООО Кемикал Лайн».
β-циклодекстринов с ароматическими и алифа-
Гидролиз простых эфиров 2 и 3. К раствору
тическими кислотами следует принимать во вни-
0.5 г (0.38 ммоль) сложного эфира 3 добавляли
5 мл воды и нагревали до 70°С. После полного рас-
2 Ранее мы уже получили и охарактеризовали комплексы вклю-
чения 6, 7, 16 и 14 незамещенного β-циклодекстрина 1 с
творения при перемешивании добавляли 0.0461 г
бензойной кислотой 4, с 2-(4-изобутилфенил)пропионовой
(0.38 ммоль) бензойной кислоты 4. Полученный
кислотой 5 и с никотиновой кислотой 11 (с таким же соотно-
раствор перемешивали 4 ч при 70°С. Выпав-
шением, 1:2) [18-20], но получены они были путем прямого
ший осадок, отфильтровывали, промывали водой
взаимодействия β-циклодекстрина 1 с соответствующим
гостем.
(2×5 мл), ацетоном (2×5 мл) и сушили в вакууме
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ОСОБЕННОСТИ ОБР
АЗОВАНИЯ КОМПЛЕКСОВ
963
над Р2О5 (1 мм рт. ст.). Выход комплекса 6 0.40 г
(СООН), 172.5 (СОСН3). Найдено, %: С 46.11; Н
(73%), т. пл. 245-248°С (разл.)3, Rf 0.60.
5.92. С51Н78О39. Вычислено, %: С 46.58; Н 5.98.
Аналогично получали комплекс 7 из 0.5 г
Аналогично из 0.5 г (0.42 ммоль) простого эфи-
(0.38 ммоль) сложного эфира 2 и 0.0461 г (0.38
ра 8 и 0.0517 г (0.42 ммоль) кислоты 11 получали
ммоль) кислоты 5. Выход 0.55 г (59%), т. пл. 281-
комплекс 14. Выход 0.29 г (52%), т. пл. 273-275°С
284°С (разл.), Rf 0.62. Спектр ЯМР 1Н, δ, м. д.: 0.82
(разл.), Rf 0.69 (А). Спектр ЯМР 1Н, δ, м. д.: 3.03-
с [6Н, (СН3)2], 1.26 с (3Н, СН3), 1.77 с (1Н, СН), 2.37
3.31 м (14Н, С6Н2), 3.57-3.59 м (28Н, С2Н-С5Н),
с (2Н, СН2), 3.27-3.31 м (28Н, С6Н2), 3.54-3.59 м
4.39 уш. с (6Н, С6ОН), 4.78-4.79 м (7Н, С1Н), 5.68
(56Н, С2Н-С5Н), 4.43 уш. с (12Н, С6ОН), 4.74-4.79
уш. с (14Н, С2ОН, С3ОН), 7.51 м (1Н, СмН), 8.22
м (14Н, С1Н), 5.68 уш. с (28Н, С2ОН, С3ОН), 7.01
м (1Н, С1оН), 8.74 м (1Н, СпН), 9.02 м (1Н, С4оН),
т (2Н, Но, J 7.0), 7.10 т (2Н, Hм, J 7.0), 11.08 с (1Н,
11.92 с (1Н, СООН). Спектр ЯМР 13С, δС, м. д.:
СООН). Спектр ЯМР 13С, δС, м. д.: 22.7 (СН3), 30.2
60.4 (С6), 72.5-73.6 м (С2, С3, С5), 82.0 (С4), 102.5
(СН), 44.7 (СН2), 60.4 (С6), 72.5-73.6 м (С2, С3, С5),
(С1), 124.3 (См), 127.4 (Си), 137.5 (С1о), 150.7 (С4о),
82.0 (С4), 102.5 (С1), 127.4 (С3,5Ar), 127.6 (С2,6Ar),
153.7 (Сп), 166.9 (СООН). Найдено, %: С 44.72; Н
129.5 (С1Ar), 140.0 (С4Ar), 174.6 (СООН). Найдено,
6.05. С90Н145NО72. Вычислено, %: С 45.17; Н 6.10.
%: С 46.58; Н 6.37. С97Н158О72. Вычислено, %: С
Аналогично из 0.1920 г (0.16 ммоль) простого
47.05; Н 6.43.
эфира 8 и 0.0164 г (0.16 ммоль) кислоты 12 полу-
Гидролиз простых эфиров 8 и 9. К раствору
чали комплекс 15. Выход 0.04 г (19%), т. пл. 263-
0.5 г (0.4 ммоль) простого эфира 8 добавляли 5 мл
266°С (разл.), Rf 0.59. Спектр ЯМР 1Н, δ, м. д.: 0.84
воды и растворяли при 70°С. После полного рас-
т (3Н, СН3, J 7.0), 1.24 д (2Н, СН3СН2, J 7.0), 1.43 д
творения при перемешивании добавляли 0.0512 г
(2Н, СН2СН2СООН, J 7.0), 2.17 д (2Н, СН2СООН,
(0.4 ммоль) бензойной кислоты 4. Раствор переме-
J 7.0), 3.30-3.58 м (14Н, С6Н2), 3.59-3.62 м (28Н,
шивали 4 ч при 70°С. Осадок отфильтровывали,
С2Н-С5Н), 4.44 уш. с (6Н, С6ОН), 4.78-4.79 м (7Н,
промывали водой (2×5 мл) и ацетоном (2×5 мл),
С1Н), 5.67 уш. с (14Н, С2ОН, С3ОН), 11.95 с (1Н,
сушили в вакууме над Р2О5 (1 мм рт. ст.). Выход
СООН). Спектр ЯМР 13С, δС, м. д.: 14.2 (СН3), 22.2
комплекса 6 0.40 г (73 %), т. пл. 245-248°С (разл.),
(СН2СН3), 27.1 (СН2СН2СООН), 33.9 (СН2СООН),
Rf 0.60.
60.4 (С6), 72.5-73.6 м (С2, С3, С5), 82.0 (С4), 102.4
Аналогично из 0.5 г (0.41 ммоль) простого эфи-
(С1), 175.1 (СООН). Найдено, %: С 45.17; Н 6.45.
ра 9 и 0.0500 г (0.41 ммоль) кислоты 4 получали
С47Н80О37. Вычислено, %: С 45.63; Н 6.52.
комплекс 6. Выход 0.40 г (73%), т. пл. 245-248°С
Аналогично из 0.3 г (0.25 ммоль) простого эфи-
(разл.), Rf 0.60.
ра 9 и 0.0507 г (0.25 ммоль) кислоты 5 получали
Аналогично из 0.5 г (0.42 ммоль) простого эфи-
комплекс 16. Выход 0.23 г (77%), т. пл. 219-221°С
ра 8 и 0.0756 г (0.42 ммоль) кислоты 10 получали
(разл.), Rf 0.56.
комплекс 13. Выход 0.09 г (16%), т. пл. 239-242°С
ИНФОРМАЦИЯ ОБ АВТОРАХ
(разл.), Rf 0.71. Спектр ЯМР 1Н, δ, м. д.: 2.02 с (3Н,
СН3), 3.03-3.31 м (14Н, С6Н2), 3.57-3.59 м (28Н,
Глушко Валентина Витальевна, ORCID: http://
С2Н-С5Н), 4.43 уш. с (6Н, С6ОН), 4.78-4.79 м (7Н,
orcid.org/0000-0002-2452-9414
С1Н), 5.68 уш. с (14Н, С2ОН, С3ОН), 6.89 м (1Н,
КОНФЛИКТ ИНТЕРЕСОВ
СмН), 7.17 д (1Н, СмН, J 7.0), 7.75 м (1Н, СпН), 7.89
Авторы заявляют об отсутствии конфликта
д (1Н, СоН, J 7.0), 11.02 с (1Н, СООН). Спектр ЯМР
интересов.
13С, δС, м. д.: 21.4 (СН3), 60.4 (С6), 72.5-73.6 м (С2,
С3, С5), 82.0 (С4), 102.5 (С1), 113.5 (С1и, С3м), 117.6
СПИСОК ЛИТЕРАТУРЫ
(С5м), 119.6 (С6о), 130.8 (С4п), 136.1 (С2о), 161.6
1. Cyclodextrin Fundamentals, Reactivity and Analysis.
Inserious of Environmental Chemistry for a Sustainable
3 Спектры ЯМР 1Н и 13С и температуры плавления (разл.)
соединений включения 6, 13 и 15 полностью совпадали с
World / Eds Е. Lichtfouse, S. Fourmentin, G. Crini,
описанными нами ранее в работах [16-18].
Springer, 2018. 262 р. doi 10.1007/978-3-319-76159-6
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
964
КУТЯШЕВА и др.
2.
Khan A.R., Forgo P., Stine K.J., D’Souza V.T. // Chem.
Edunov A.V., Kurochkina G.I., Soboleva N.O., Vasyani-
Rev. 1998. Vol. 98. N 5. P. 1977.
na L.K., Nifant’ev E.E. // Russ. Chem. Bull. 2012. Vol.
3.
Шипилов Д.А., Курочкина Г.И., Расадкина Е.Н., Ва-
61. N 1. P. 181. doi 10.1007/S11172-012- 0025-6
сянина Л.К., Соболева Н.О., Грачев М.К. // ЖОХ.
11.
Coates J.H., Easton C.J., Fryer N.L., Lincoln S.F. //
2015. T. 85. Вып. 11. С. 1864 ; Shipilov D.A., Kurochki-
Chem. Lett. 1994. P. 1153. doi 10.1246/cl.1994.1153
na G.I., Rasadkina E.N., Vasyanina L.K., Grachev M.K.,
12.
Wood D.J., Hruska F.E., Saenger W. // J. Am. Chem.
Soboleva N.O. // Russ. J. Gen. Chem. 2015. Vol. 85.
Soc. 1977. Vol. 99. P. 1735. doi 10.1021/ja00448a009
N 11. P. 2605. doi 10.1134/S107036321511016X
13.
Smith C.Z., Utley J.H.P. // Chem. Commun. 1981.
4.
Кутяшева Н.В, Курочкина Г.И., Соломатин Е.А.,
P. 492. doi 10.1039/C39810000492
Грачев М.К. // ЖОрХ. 2021. Vol. 57. Вып. 1. P. 121;
14.
Schneider H.-J., Hacket F., Rüdiger V. // Chem. Rev.
Kutyasheva N.V., Kurochkina G.I., Solomatin E.A.,
1998. Vol. 98. P. 1755. doi 10.1021/cr970019t
Grachev M.K.// Russ. J. Org. Chem. 2021. Vol. 57. N 1.
15.
Степанов А.А., Володин Ю.Ю., Грачев М.К., Куроч-
P. 92. doi 10.31857/S0514749221010146
кина Г.И., Сырцев А.Н., Гринберг В.А. // Электрохи-
5.
Glazyrin A.E., Kurochkina G.I., Crachev M.K., Nifan-
мия. 2002. T. 38. № 12. С. 1487; Stepanov A.A., Volo-
t’ev E.E. // Mendeleev Commun. 2001. N. 6. P. 218. doi
din Yu.Yu., Grachev M.K., Kurochkina G.I., Syr-
10.1070/MC2001v011n06ABEH001487
tsev A.N., Grinberg V.A. // Russ. J. Electrochem. 2002.
6.
Грачев М.К., Глазырин А.Е., Курочкина Г.И., Ни-
Vol. 38. N 12. P. 1346. doi 10.1023/A:1021629007747
фантьев Э.Е. // ЖОX. 2004. Т. 74. Вып. 5. С. 877;
16.
Курочкина Г.И., Кудрявцева Н.А., Грачев М.К.,
Grachev M.K., Glazyrin A.E., Kurochkina G.I.,
Лысенко С.А., Васянина Л.К., Нифантьев Э.Е. //
Nifant’ev E.E. // Russ. J. Gen. Chem. 2004. Vol. 74.
ЖOX. 2007. T. 77. Вып. 3. С. 477; Kurochkina G.I.,
P. 808.
Kudryavtseva N.A., Grachev M.K., Lysenko S.A.,
7.
Глазырин А.Е., Сырцев А.Н., Курочкина Г.И., Ко-
Vasyanina L.K., Nifant’ev E.E. // Russ. J. Gen.
нонов Л.О., Грачев М.К., Нифантьев Э.Е. // Изв.
Chem. 2007. Vol. 77. N 3. P. 442. doi 10.1134/
АН. Сер. хим. 2003. № 1. C. 225; Glazyrin A.E., Syr-
S1070363207030188
tsev A.N., Kurochkina G.I., Kononov L.O., Cra-
17.
Грачев М.К., Сенюшкина И.А., Курочкина Г.И.,
chev M.K., Nifant’ev E.E. // Russ. Chem. Bull. 2003.
Лысенко С.А., Васянина Л.К., Нифантьев Э.Е. //
Vol. 52. P. 237. doi 10.1023/A:1022485407440
ЖОрХ. 2010. Т. 46. Вып. 10. С. 1501; Grachev M.K.,
8.
Грачев M.К. // Усп. хим. 2013. T. 82. № 11. C. 1034;
Senyushkina I.A., Kurochkina G.I., Lysenko S.A.,
Grachev M.K. // Russ. Chem. Rev. 2013. Vol. 82.
Vasyanina L.K., Nifant’ev E.E. // Russ. J. Org.
P. 1034. doi 10.1070/RC2013v082n11ABEH004381
Chem. 2010. Vol. 46. N 10. P. 1506. doi 10.1134/
9.
Шипилов Д.А., Курочкина Г.И., Баталова Т.А., Гра-
S1070428010100118
чев М.К. // ЖОрХ. 2015. T. 51. Вып. 10. C. 1426;
18.
Сенюшкина И.А., Курочкина Г.И., Грачев
Shipilov D.A., Kurochkina G.I., Batalova T.A., Gra-
М.К., Гринберг В.А., Баталова Т.А., Нифан-
chev M.K. // Russ. J. Org. Chem. 2015. Vol. 51. N 10.
тьев Э.Е. // ЖОХ. 2009. Т. 79. Вып. 6. С. 995;
P. 1395. doi 10.1134/S1070428015100061
Senyushkina I.A., Kurochkina G.I., Grachev M.K.,
10.
Грачев М.К., Едунов А.В., Курочкина Г.И., Соболева
Grinberg V.A., Batalova T.A., Nifant’ev E.E. // Russ. J.
Н.О., Васянина Л.К., Нифантьев Э.Е. // Изв. АН.
Gen. Chem. 2009. Vol. 79. N 6. P. 1167. doi 10.1134/
Сер. хим. 2012. T. 61. № 1. C. 178; Grachev M.K.,
S1070363209060231
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ОСОБЕННОСТИ ОБР
АЗОВАНИЯ КОМПЛЕКСОВ
965
Features of Formation of Inclusion Complexes
of Mono-Substituted β-Cyclodextrin Derivatives
N. V. Kutyasheva*, G. I. Kurochkina, V. V. Glushko, and M. K. Grachev
Moscow State Pedagogical University, Institute of Biology and Chemistry, Moscow, 119021 Russia
*e-mail: knatali1706@mail.ru
Received April 26, 2021; revised April 26, 2021; accepted May 11, 2021
In an attempt to obtain inclusion compounds of a number of mono derivatives of β-cyclodextrin containing
ester and ether bonds with certain aromatic and aliphatic carboxylic acids, unexpected guest-host inclusion
compounds were obtained, presumably due to the preliminary inclusion of the guest into the of β-cyclodextrin
cavity. Structure and composition of the inclusion complexes were confirmed by 1H and 13C NMR spectroscopy.
Keywords: β-cyclodextrin, ethers, esters, hydrolysis, inclusion complexes, guest-host compounds, NMR
spectroscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021