ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 6, с. 981-984
КРАТКИЕ
СООБЩЕНИЯ
УДК 547.721/729
ИЗОМЕРИЗАЦИЯ ПРОПАРГИЛОВЫХ ЭФИРОВ
2-ГИДРОКСИОКСИРАНОВ В ПРОИЗВОДНЫЕ
ФУРАНА НА СЕРЕБРЯНЫХ КАТАЛИЗАТОРАХ
© 2021 г. Г. М. Талыбов*
Азербайджанский технический университет, пр. Г. Джавида 2, Баку, AZ 1073 Азербайджан
*e-mail: gtalibov61@gmail.com
Поступило в Редакцию 25 марта 2021 г.
После доработки 6 апреля 2021 г.
Принято к печати 15 апреля 2021 г.
Показано, что пропаргиловые эфиры 2-гидроксиоксиранов в присутствии серебряной соли молибденовой
гетерополикислоты в качестве катализатора приводит к образованию производных фурана с выходом до
69.3% с высокой региоселективностью.
Ключевые слова: пропаргиловые эфиры 2-гидроксиоксиранов, серебряная соль молибденовой
гетерополикислоты, региоселективность
DOI: 10.31857/S0044460X21060160
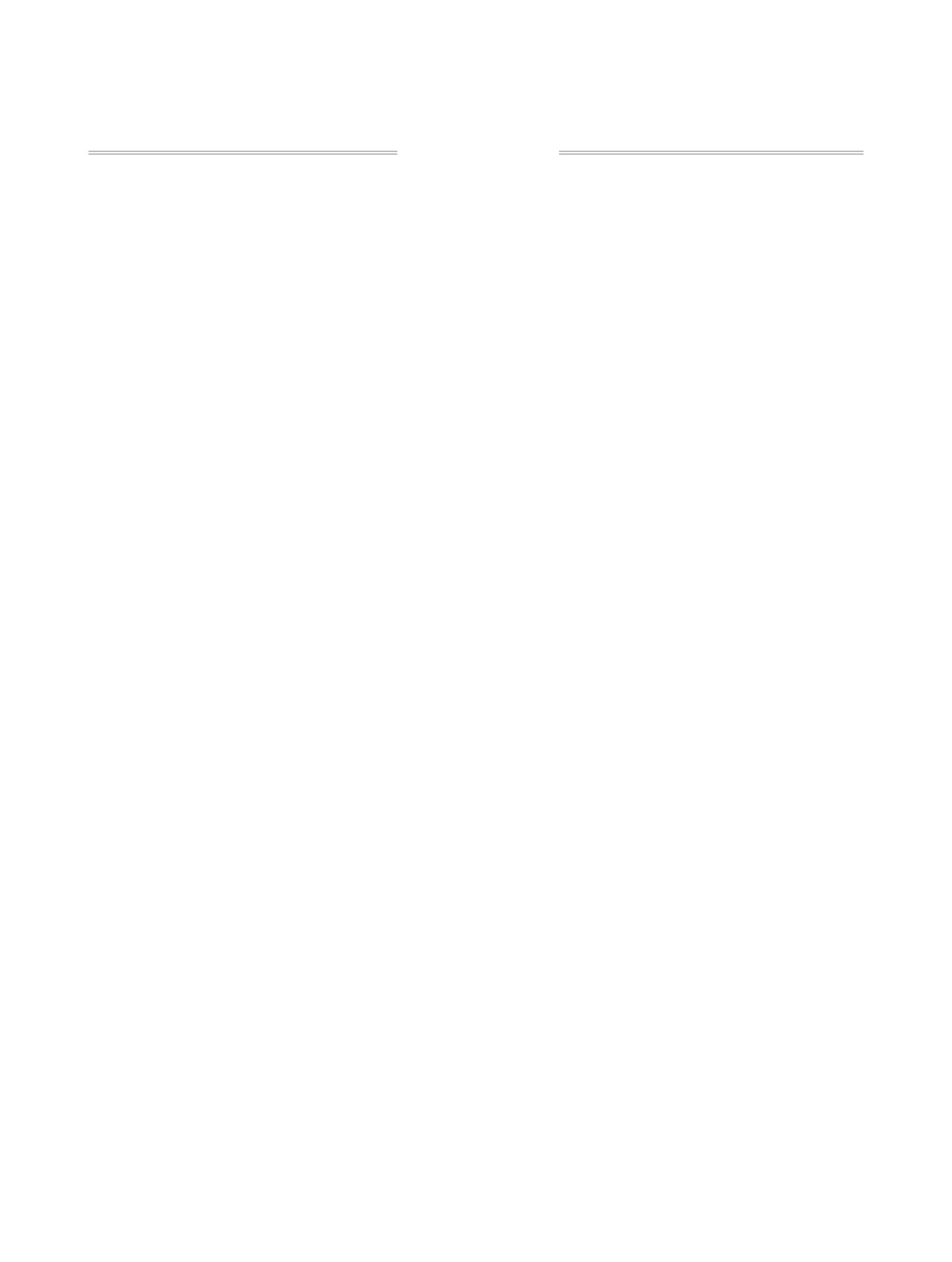
Многие арилзамещенные фураны являются
шести-, семи- и восьмичленных гетероциклов с
структурными фрагментами физи-ологически ак-
высокой степенью диастероселективности.
тивных органических соединений, обладающих
Нами показано, что полученные ранее [12, 13]
широким спектром биоло-гической активности,
пропаргиловые эфиры 2-гидрокси-оксиранов 1-5
в частности, противотуберкулезной и антифунги-
могут быть использованы как исходные соеди-
цидной активностью [1-3]. Производные фурана
нения для синтеза произ-водных фурана 6-10. В
также широко используются в органическом син-
качестве эффективного катализатора была исполь-
тезе [4]. В связи с этим, разработка оригинальных
зована серебряная соль молибденовой гетеропо-
методов синтеза соединений, содержащих фурано-
ликислоты (Ag3PMo12O40). Данный катализатор
вый фрагмент, представляется актуальной задачей.
получают реакцией солей серебра с фосфорно-
Известны превращения алкинилоксиранов в за-
молибденовой гетерополикислотой. Он часто ис-
мещенные фураны в присутствии каталитических
пользуется для синтеза кислородсодержащих гете-
количеств комплексных солей серебра, золота
роциклических соединений [14]. В нашем случае
[5-7] и индия [8]. Использование данных катали-
Ag3PMo12O40 хорошо растворяется в реакционной
заторов позволяет получать целевые продукты с
среде (дихлорметане) и позволяет довести выход
высокой степенью регио- и диастереоселективно-
целевых продуктов до 69.3% (cхема 1). Реакцию
сти. Авторы [5] объясняют образование произво-
проводили при интенсивном перемешивании за-
дных фуранов раскрытием оксиранового кольца и
мещенных 2-оксиранолов 1-5 в присутствии ка-
последующей внутримолекулярной циклизацией
тализатора и Et3N в дихлорметане при 25°С в те-
путем деалкоксилирования промежуточных про-
чение 17 ч. Целевые продукты реакции очищали
дуктов. Данная реакция, как показано в работах
с помощью колоночной хроматографии. Выходы
[9-11], может успешно использоваться в синтезе
пропаргиловых эфиров 2-гидроксиоксиранов 8-10
981
982
ТАЛЫБОВ
Схема 1.
R1
HO
Ag3PMo12O40
R2
1
O
CH2Cl2, 25oC
R
O
O
R2
1-5
6-10
R1= H (3-5, 8-10), Ph (1, 2, 6, 7); R2 = H (1, 6), Me (2, 7); CH=CHMe (3, 8), C(Ph)=CH2 (4, 9), C(Bu)=CH2 (5, 10).
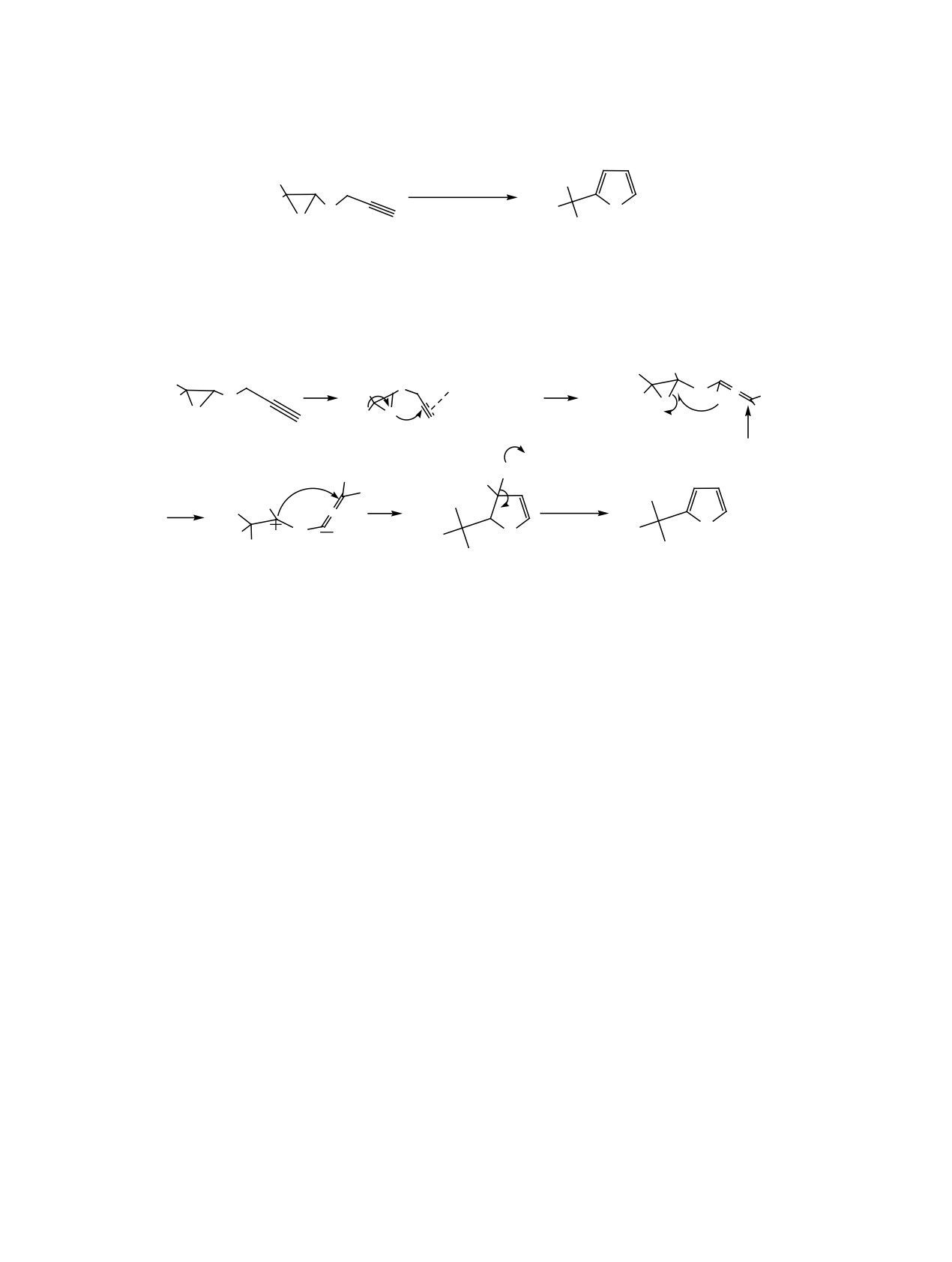
Схема 2.
1
H
R
R1
O
Ag3PMo12O
R1
40
•
O
H
O
H
R2
R2
O
O
O
H
R2
:NEt3
Ag3PMo12O40
H
H
H
H
HO
H
HO
R1
•
HNEt3
O
O
O
R1
R2
R1
OH
2
R2
R
с кратными связами в боковой цепи оказались
Сигналы диастеротопных метиленовых гем-про-
выше, чем в случае предельных аналогов 6, 7.
тонов регистрируются в области 5.76 (д, J 1.8),
Вероятный механизм образования производных
6.07 м. д. (д, J 1.8) для 1-(фуран-2-ил)-2-фенил-
фуранов в изученных нами реакциях включает
проп-2-ен-1-ола 9 и при 5.74 (д, J 1.8), 6.08 м. д.
промежуточное образование продуктов раскрытия
(д, J 1.8) для 1-(фуран-2-ил)-2-метилиденгексан-
оксиранового цикла и последующую циклизацию
1-ола 10.
за счет внутримолекулярного нуклеофильного
(Фуран-2-ил)(фенил)метанол (6). К раство-
присоединения атома кислорода к ацетилен-ме-
ру 0.12 г Ag3PMo12O40 в 1.2 мл хлористого ме-
таллическому π-комплексу, активированному ка-
тилена при 25°С добавляли 0.043 г (0.25 ммоль)
тализатором, через промежуточную алленовую
1-фенил-1,2-эпокси-2-пропаргилоксиэтана 1 и 0.8
форму (cхема 2).
мл раствора Et3N в 0.5 мл дихлорметана. Реакци-
Строение и состав полученных целевых соеди-
онную смесь перемешивали при 25°С в течение
нений 6-10 подтверждены данными ИК, ЯМР 1Н
17 ч, затем удаляли растворитель в вакууме и оста-
и 13C спектроскопии, элементного анализа. Так, в
ток очищали с помощью колоночной хроматогра-
ИК спектрах соединения 6 наблюдаются полосы
фии (силикагель 100-160, элюент - этилацетат-
поглощения валентных колебаний связи О-Н при
гексан, 4:1). Выход 0.027 г (62.3%), бесцветное
3338 см-1, а также полосы поглощений валентных
масло. ИК спектр, ν, см-1: 700, 770, 850, 985, 1016
колебаний связи С-О при 1016 см-1, характерных
(C-O-C), 1450, 1600, 1645 (Ph), 3030 (Ph), 3080
для вторичных спиртов. Две полосы деформаци-
(Ph), 3338 (O-H). Спектр ЯМР 1H (ДМСО-d6), δ,
онных колебаний связи О-H при 1420 и 1330 см-1
м. д.: 1.92 уш. с (1H, OH), 5.11 с (1H, CHO), 5.93
присутствуют в спектрах третичного спирта 7.
д. д (1H, H3-фуран, 3JHH 3.2, 5JHH 1.0 Гц), 6.25 д. д
В спектре ЯМР 1H сигналы фурановых про-
(1H, H4-фуран, 3JHH 3.2, 4JHH 1.8 Гц), 7.23 д. т (1H,
тонов проявляются в виде дублета дублетов при
Ph, 4JHH 4.0, 3JHH 7.2 Гц), 7.25д. д (1H, H5-фуран,
~5.93 (H3, 3JHH 3.2, 5JHH 1.0 Гц), ~6.25 (H4, 3JHH 3.2,
4JHH 1.8, 5JHH 1.0 Гц), 7.33 т (2H, Ph, 3JHH 7.3 Гц),
4JHH 1.8 Гц) и ~7.25 м. д. (H5, 4JHH 1.8, 5JHH 1.0 Гц).
7.45 д (2H, Ph, 3J 7.9 Гц). Спектр ЯМР 13C (ДМ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
ИЗОМЕРИЗАЦИЯ ПРОПАРГИЛОВЫХ ЭФИРОВ
983
СО-d6), δС, м. д.: 70.21 (COH), 105.24 (C4-фуран),
2JHH 1.8 Гц), 5.94 д. д (1H, H3-фуран, 3JHH 3.2, 4JHH
110.52 (C3-фуран), 124.46 (2C, Ph), 126.45 (Ph),
1.0 Гц), 6.07 д (1H, PhC=CH2, 2JHH 1.8 Гц), 6.26 д. д
128.21 (2C, Ph), 140.40 (C5-фуран), 145.43 (Ph),
(1H, H4-фуран, 3JHH 3.2, 4JHH 1.8 Гц), 7.25 д. д (1H,
146.57 (C2-фуран). Найдено, %: C 75.65; H 5.83.
H5-фуран, 4JHH 1.8, 5JHH 1.0 Гц), 7.31-7.47 м (5H,
C11H10O2. Вычислено, %: C 75.84; H 5.79.
Ph). Спектр ЯМР 13C (ДМСО-d6), δС, м. д.: 97.24
1-(Фуран-2-ил)-1-фенилэтан-1-ол
(7) полу-
(=СН2),
104.24 (C4-фуран),
110.33 (С3-фуран),
чали аналогично из 1-метил-1-фенил-1,2-эпокси-
118.72 (=C), 120.28 (2C, Ph), 126.30 (Ph), 128.43
2-пропаргилоксиэтана 2. Выход 61.6%, бесцвет-
(2C, Ph), 134.43 (=C), 140.47 (C5-фуран), 146.32
ное масло. ИК спектр, ν, см-1: 685, 770, 850, 985,
(Ph), 146.91 (C2-фуран). Найдено, %: C 78.11; H
1010, 1330, 1420, 1600, 1645 (Ph), 3030, 3065, 3080
6.12. C13H12O2. Вычислено, %: C 77.98; H 6.04.
(Ph), 3385 (O-H). Спектр ЯМР 1H (ДМСО-d6), δ,
1-(Фуран-2-ил)-2-метилиденгексан-1-ол
м. д.: 1.04 с (3Н, СН3), 1.91 уш. с (1H, OH), 5.93
(10) получали аналогично из
2-(гепт-2-ен-3-
д. д (1H, H3-фуран, 3JHH 3.2, 4JHH 1.0 Гц), 6.25 д. д
ил)-3-[(проп-2-ин-1-ил)окси]оксирана
5. Выход
(1H, H4-фуран, 3JHH 3.2, 4JHH 1.8 Гц), 7.21 д. т (1H,
69.3%, бесцветное масло. ИК спектр, ν, см-1:
Ph, 4JHH 4.0, 3JHH 7.2 Гц), 7.25 д. д (1H, H5-фуран,
1110 (C-O-C), 1250, 1330, 1420, 2983, 3391 (O-H).
3JHH 1.8, 4JHH 1.0 Гц), 7.33 т (2H, Ph, 3J 7.3 Гц), 7.45
д (2H, Ph, 3J 7.9 Гц). Спектр ЯМР 13C (ДМСО-d6),
Спектр ЯМР 1H (ДМСО-d6), δ, м. д.: 0.91 т (3H,
δС, м. д.: 21.36 (CH3), 71.15 (COH), 105.29 (C4-
СН3, 3JHH 7.2 Гц), 1.27-1.57м (4H, CH2), 1.87-2.01
фуран), 110.50 (C3-фуран), 123.63 (2C, Ph), 125.57
м (2H, CH2C=C), 2.18 уш. с (1H, OH), 3.44 д (1H,
(Ph), 128.26 (2C, Ph), 140.45 (C5-фуран), 146.54
HСО, 3JHH 2.0 Гц), 5.74 д (1H, PhC=CH2, 2JHH
(Ph), 152.87 (C2-фуран). Найдено, %: C 76.63; H
1.8 Гц), 5.92 д. д (1H, H3-фуран, 3JHH 3.2, 4JHH
6.31. C12H12O2. Вычислено, %: C 76.57; H 6.43.
1.0 Гц), 6.08 д (1H, PhC=CH2, 2J 1.8 Гц), 6.26 д. д
(2E)-1-(Фуран-2-ил)бут-2-ен-1-ол (8) получа-
(1H, H4-фуран, 3JHH 3.2, 4JHH 1.8 Гц), 7.24 д. д (1H,
ли аналогично из 2-(проп-1-ен-1-ил)-3-[(проп-2-
H5-фуран, 4JHH 1.8, 5JHH 1.0 Гц). Спектр ЯМР 13C
ин-1-ил)окси]оксирана 3. Выход 68.6%, бесцвет-
(ДМСО-d6), δС, м. д.: 13.85 (CH3), 22.23 (CH2), 22.49
ное масло. ИК спектр, ν, см-1: 950, 1170, 1330, 1420,
(CH2), 29.59 (CH2), 71.40 (COH), 97.74 (=СН2),
1615 (C=C), 3031 (C=C), 3381 (O-H). Спектр ЯМР
103.23 (C4-фуран), 110.44 (С3-фуран), 118.74 (C=),
1H (ДМСО-d6), δ, м. д.: 1.71 д. д (3H, СН3, 3JHH 6.8,
140.43 (C5-фуран), 146.51 (C2-фуран). Найдено, %:
4JHH 1.6 Гц), 1.98 уш. с (1H, OH), 3.41 д (1H, HСО,
C 73.22; H 8.91. C11H16O2. Вычислено, %: C 73.30;
4JHH 2.0 Гц), 5.41 д. д. к (1H, CH3CH=CH, 3JHH 15.6,
H 8.95.
3JHH 8.0, 4JHH 1.6 Гц), 5.93 д. д (1H, H3-фуран, 3JHH
ИК спектры соединений в тонком слое сняты
3.2, 4JHH 1.0 Гц), 6.08-6.22 м (1H, CH3CH=CH),
на приборе Specord 75 IR. Спектры ЯМР 1Н и 13C
6.25 д. д (1H, H4-фуран, JHH 3.2, JHH 1.8 Гц), 7.25
записаны на приборе Вruker SF-300 [300.13 (1H),
д. д (1H, H5-фуран, 3JHH 1.8, 4JHH 1.0 Гц). Спектр
75 (13C) МГц], внутренний стандарт - ГМДС. Эле-
ЯМР 13C (ДМСО-d6), δС, м. д.: 17.77 (СН3), 73.22
ментный анализ выполнен на приборе EURO EA
(СОН), 110.14 (С4-фуран), 118.25 (=СН), 119.17
3000. Контроль за протеканием реакций проведен
(С3-фуран),
134.47
(=СН), 140.54 (С5- фуран),
142.11 (С2-фуран). Найдено, %: C 69.51; H 7.38.
на хроматографе Хромос 1000 [колонка 1 м × 3
C8H10O2. Вычислено, %: C 69.54; H 7.30.
мм, неподвижная фаза SE-30 (5%) на хроматоне
N-AW-DMCS (0.16-0.20 мм), рабочая температу-
1-(Фуран-2-ил)-2-фенилпроп-2-ен-1-ол
(9)
получали аналогично из
2-[проп-2-ин-1-ил)ок-
ра 50-300°С, детектор пламенно-ионизационный,
си]-3-(2-фенилпроп-1-ен-2-ил)оксирана 4. Выход
газ-носитель - гелий. Хроматографическое разде-
65.6%, бесцветное масло. ИК спектр, ν, см-1: 703,
ление соединений проведено на колонках с сили-
756, 845, 985, 1110 (C-O-C), 1253, 1330, 1349,
кагелем MN Kieselgel 60 (0.063-0.2 мкм).
1420, 1490, 1600, 1625 (Ph), 1640 (Ph), 3010, 3030,
ИНФОРМАЦИЯ ОБ АВТОРАХ
3065, 3080, 3085 (Ph), 3389 (O-H). Спектр ЯМР
1H (ДМСО-d6), δ, м. д.: 2.02 уш. с (1H, OH), 3.45
Талыбов Гюльахмед Мирахмед оглы, ORCID:
д (1H, HСО, 4JHH 2.0 Гц), 5.76 д (1H, PhC=CH2,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021
984
ТАЛЫБОВ
КОНФЛИКТ ИНТЕРЕСОВ
7. Hashmi A.S.K., Sinha P. // Adv. Synth. Catal. 2004.
Vol. 346. P. 432. doi 10.1002/adsc.200303201
Автор заявляет об отсутствии конфликта
интересов.
8. Kang J.Y., Connell B.T. // J. Org. Chem. 2011. Vol. 76.
P. 2379. doi 10.1021/jo2001353
СПИСОК ЛИТЕРАТУРЫ
9. McDonald F.E., Schultz C.C. // J. Am. Chem. Soс. 1994.
1.
Flynn B. L., Hamel E., Katherine M.J. // J. Med. Chem.
Vol. 116. P. 9363. doi 10.1021/ja00099a077
2002. Vol. 45. P. 2670. doi 10.1021/jm020077t
10. Banerjee B., Roy S.C. // Eur. J. Org. Chem. 2006.
2.
Rahmathullah S.M., Hall J.E., Bender B.C., McCurdy
Vol. 2. P. 489. doi 10.1002/ejoc.200500483
D.R., Tidwell R.R., Boykin D.W. // J. Med. Chem. 1999.
Vol. 42. P. 3994. doi 10.1021/jm990237+
11. Mandal S.K., Roy S.C. // Tetrahedron. 2007. Vol. 63.
3.
Pour M., Spulak M., Buchta V., Kubanova P., Voprsalo-
P. 11341. doi 10.1016/j.tet.2007.08.072
va M., Wsol V., Fa´kova H., Koudelka P., Pourova H.,
12. Талыбов Г.М., Джафарова Н.В., Байрамова С.Т. //
Schiller R. // J. Med. Chem. 2001. Vol. 44. P. 2701. doi
ЖОрХ. 2015. T. 51. № 7. C. 1045; Talybov G.M.,
10.1021/jm010155x
Dzhafarova N.V., Bairamova S.T. // Russ. J. Org.
4.
Певзнер Л.М. // ЖОХ. 2018. Т. 88. № 10. С. 1626. doi
Chem. 2015. Vol. 51. N 7. P. 1028. doi10.1134/
10.1134/S0044460X18100074; Pevzner L.M. // Russ. J.
S1070428015070234
Gen. Chem. 2017. Vol. 88. N 10/ P. 2072. doi 10.1134/
13. Талыбов Г.М. // ЖОрХ. 2017. Т. 53. № 11. С. 1704;
S1070363218100079
Talybov G.M. // Russ. J. Org. Chem. 2017. Vol. 53.
5.
Blanc A., Tenbrink K., Weibel J.-M., Pale P. // J. Org.
N 11. P. 1742. doi 10.1134/S1070428017110239
Chem. 2009. Vol. 74. N 15. P. 5342. doi 10.1021/
jo900483m
14. Katritzky A.R., Ramsden C.A., Joule J.A., Zhdankin
6.
Dai L.Z., Qi M.J., Shi Y.L., Liu X.G., Shi M. // Org. Lett.
V.V. Handbook of Heterocyclic Chemistry. Amsterdam:
2007. Vol. 9. N 16. P. 3191. doi 10.1021/ol0713640
Elsevier Ltd., 2010, P. 981.
Isomerization of Propargyl Ethers of 2-Hydroxyoxiranes
to Furan Derivatives on Silver Catalysts
G. M. Talybov*
Azerbaijan Technical University, Baku, AZ 1073 Azerbaijan
*e-mail: gtalibov61@gmail.com
Received March 25, 2021; revised April 6, 2021; accepted April 15, 2021
It was shown that propargyl ethers of 2-hydroxyoxiranes in the presence of a silver salt of a molybdenum
heteropoly acid as a catalyst leads to the formation of furan derivatives with a yield of up to 62.3% and high
regioselectivity.
Keywords: 2-hydroxyoxiranes propargyl ethers, molybdenum heteropoly acid silver salt, regioselectivity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 6 2021