ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 998-1009
УДК 547.785.5;547.772.1
ЧЕТВЕРТИЧНЫЕ СОЛИ 1-АЛЛИЛ-
И 1-(2-БРОМПРОПИЛ)-2-АМИНО-
3-КАРБОКСИ(КАРБАЛКОКСИ)-
МЕТИЛБЕНЗИМИДАЗОЛИЯ В СИНТЕЗЕ
ПРОИЗВОДНЫХ ИМИДАЗО[1,2-a]БЕНЗИМИДАЗОЛА
© 2021 г. О. Н. Жуковская, А. С. Морковник*, Г. С. Бородкин
Научно-исследовательский институт физической и органической химии Южного федерального университета,
пр. Стачки 194/2, Ростов-на-Дону, 344090 Россия
*e-mail: asmork@mail.ru
Поступило в Редакцию 22 мая 2021 г.
После доработки 22 мая 2021 г.
Принято к печати 7 июня 2021 г.
Cинтезированы галогениды 1-аллил(2-бромпропил)-3-карбалкокси(карбокси)метил-2-аминобензими-
дазолия и их 2-иминобензимидазолиновые формы. Изучена их циклизация в функционализированные
производные имидазо[1,2-a]бензимидазола, а также некоторые дальнейшие трансформации полученных
имидазобензимидазолов с участием реакционноспособных заместителей и активированной метиленовой
группы.
Ключевые слова: четвертичные соли бензимидазолия, 2-иминобензимидазолины, циклизация, имида-
зо[1,2-a]бензимидазолы, 2,3-дигидроимидазо[1,2-a]бензимидазолы, имидазо[1,2-a]бензимидазол-2-оны
DOI: 10.31857/S0044460X21070039
Соли бензимидазолия обладают на удивление
В настоящей работе описан синтез и некоторые
разнообразной биологической активностью [1-9],
трансформации ряда новых, отвечающих указан-
а также способностью, при наличии необходимых
ным критериям, производных имидазо[1,2-a]-
структурных предпосылок, циклизоваться, обычно
бензимидазола, а также 2-оксо-2,3-дигидро-1H-
через промежуточное образование основных форм,
имидазо[1,2-a]бензимидазола, основанных на
в трициклические бензимидазолы. Таким путем
имидазольной циклизации четвертичных солей
получают, в частности, различные имидазо[1,2-a]-
1-аллил(2-бромпропил)-2-амино-3-карбалкок-
бензимидазолы, среди которых обнаружено немало
си(карбокси)метилбензимидазолия и их 2-имино-
фармакологически активных структур. Некоторые
бензимидазолиновых форм. Данный синтетиче-
из них рекомендованы к клиническим испытани-
ский подход позволяет существенно расширить
ям, а 9-диэтиламино-2,3-дигидроимидазо[1,2-a]-
ряд имидазо[1,2-a]бензимидазолов, представля-
бензимидазол (диабенол) [10], уже успешно про-
ющих интерес для проведения их дальнейших
шел их. В плане дальнейшей диверсификации
трансформаций с сохранением трициклической
доступных для исследований имидазо[1,2-a]-
системы.
бензимидазолов существенный интерес представ-
ляют его производные, содержащие те или иные
Исходные четвертичные соли, а также их ос-
реакционноспособные либо специфически акти-
новные
2-иминобензимидазолиновые формы,
вирующие трициклическую систему функцио-
были получены из 1-аллил-2-аминобензимидазола
нальные группы (заместители).
1 [11]. Вначале его подвергали кватернизации под
998
ЧЕТВЕРТИЧНЫЕ СОЛИ
999
Схема 1.
CH2COOR
N
N
NH2
NH2
+
XCH2COOR
N
N
X-
All
All
1
2а-в
3а-в
Х = Br, R = Me (3а), Et (3б); X = Cl, R = n-Bu (3в).
Схема 2.
CH2COOH
CH2COOH
O
Br-
N
N
N
[OH-]
N
NH2
NH
N
N
N
All
All
All
4
6
8
HBr, AcOH
CH2COOH
CH2COOH
Br-
O
N
N
N
HBr
[OH-]
N
3а-в
NH2
NH
N
N
N
CH2CHBrCH3
CH2CHBrCH3
CH2CHBrCH3
Ac2O,
AcONa
5
9
7
CH
3
∆
N
N
R
O
ROOC
N
O
CH3
O
CH2COOH
10
N
N
CH3
N
N
N
N
All
All
11а, б
Х = Br, R = Me (3а), Et (3б); X = Cl, R = n-Bu (3в); R = Me (11а), Et (11б).
действием алкилбром(хлор)ацетатов 2а-в с обра-
хлорацетатов. Получаемые таким путем соли 3а-в
зованием соответствующих бромидов (хлоридов)
с целью расширения ряда циклизуемых структур
предварительно подвергали некоторым превраще-
3а-в с выходами 83-99% (схема 1).
ниям. Они включали O-дезалкилирование солей
Реакция с бромацетатами протекает легко, при
либо само по себе при действии кипящей смеси
комнатной температуре в ацетоне, и значительно
48%-ной HBr и ледяной уксусной кислоты (1:4, по
труднее (105-110°С, без растворителя) в случае
объему), либо с одновременно протекающим при-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1000
ЖУКОВСКАЯ и др.
Схема 3.
O
Cl
O
N
ClCH2COCl
N
N
ДМФА, K2CO3
NH2
NH
N
N
C6H6, ∆
N
∆
N
All
All
All
1
12
8
соединением HBr по аллильной группе (по прави-
дроимидазобензимидазол-9-илуксусная кислота
лу Марковникова) при кипячении растворов солей
10 (выход 60%).
в 48%-ной HBr. Продуктами этих реакций, обра-
Для структур 3а-в возможен еще один путь
зующимися с выходами около 87-90%, являются
построения
имидазо[1,2-a]бензимидазольно-
четвертичная соль 4 и ее 2-бромпропильный ана-
го трицикла, предполагающий предварительное
лог 5. Действием водного аммиака эти соли были
N-ацилирование отвечающих этим структурам
превращены в соответствующие 2-иминобензими-
2-иминобензимидазолиных форм, - точно также,
дазолиновые формы 6 и 7 (схема 2). 2-Бромпро-
как и для N-фенацилсодержащих аналогов этих
пилсодержащие субстраты 5 и 7 интересны в том
иминов[12]. Такая циклизация основана на взаи-
отношении, что имеющаяся в них бромпропильная
модействии активированной метиленовой группы
группа при подходящих условиях может служить
CO-группой ацилиминового фрагмента. Реакция
альтернативным реакционным центром по отно-
объединяет стадии генерирования 2-иминоформ,
шению к карбалкокси(карбокси)метильной груп-
N-ацилирования и циклизации в составе однореак-
пе, тоже участвуя в построении дополнительного
торного процесса [13]. Таким образом реагируют
имидазольного цикла, а также (при ее сохранении
соли 3а, б при нагревании в среде уксусного ан-
в условиях циклизации) в различных трансформа-
гидрида в присутствии безводного ацетата натрия
циях с модификацией указанного галогеналкиль-
(5 ч). При этом образуются функционализиро-
ного заместителя.
ванные аллилсодержащие имидазобензимида-
Имины 6 и 7, подобно их N-фенацильным
золы 11а, б выходами 78 и 85% соответственно
аналогам [12], легко циклизуются под действием
(схема 2).
уксусного ангидрида (3-5 мин, кипячение) с об-
Имидазобензимидазолон 8, как и другие ими-
разованиемN9-аллил-(2-бромпропил)имидазо[1,2-a]-
дазобензимидазолоны [14], может быть получен
бензимидазол-2-онов 8 и 9 с выходом 76-78%
термической циклизацией соответствующего
(схема 2).
2-хлорацетаминобензимидазола 12 в среде ДМФА
2-Бромпропилсодержащий имин 7, действи-
в присутствии K2CO3 (схема 3). Однако в этом слу-
тельно, способен и к альтернативной имидазо-
чае выход конечного продукта существенно ниже
льной циклизации по механизму внутримолеку-
(42%).
лярного SN2-алкилирования
2-бромпропильной
Строение полученных соединений подтверж-
группой аналогично N-фенацилсодержащим ана-
дено данными ИК и ЯМР 1Н и 13C спектроскопии.
логам [13]. В этом случае циклизация протекает в
Так, в ИК спектрах солей 3-5 наблюдаются поло-
отсутствие Ac2O и в довольно жестких условиях
сы поглощения валентных колебаний групп C=O
(расплав соединения 7, 215-220°С, 3.5 ч), что мож-
(1760-1765) и NH2 (3170 и 3220 см-1). В спектрах
но объяснить стерической жесткостью переходно-
ЯМР 1Н этих солей наряду с сигналами четырех
го состояния алкилирования, препятствующей до-
протонов ароматического ядра присутствуют весь-
стижению оптимального для SN2-процессов, либо
ма характерные сигналы аллильной (либо 2-бром-
достаточно близкого к нему угла нуклеофильной
пропильной) группы, а также синглеты первичной
атаки. Продуктом циклизации является 2,3-диги-
аминогруппы (9.04-9.45 м. д.), а в случае солей 3
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ЧЕТВЕРТИЧНЫЕ СОЛИ
1001
Схема 4.
Cl
Cl
Cl
N
OHC
Cl
O
N N
13
O NO2
NO2
N
O
O AcOH
OHC
N
O
N N
∆
N N
14
p-FC6H4
p-FC6H4
N
8
N
NH
NH
OHC
N
O
N N
15
еще и сигналы алкоксигрупп в области 0.85-4.2 м. д.
жении 2 трицикла (2.62 и 2.63 м. д.) и мультипле-
Спектры иминов 6 и 7 по числу и мультиплетно-
ты аллильной группы при 4.8 (NCH2), 5.2 (=CH2) и
сти сигналов аналогичны спектрам солей 4, 5. В
5.9-6.0 м. д. (СН=).
спектрах ЯМР 1H имидазобензимидазолонов 8 и
ИК спектры соединений 9 и 10 содержат поло-
9 трициклический каркас представлен сигналами
сы поглощения карбонильной группы в области
с химическими сдвигами, близкими к таковым
1710 и 1750 см-1. В спектрах ЯМР 1Н присутству-
для родоначальника ряда, незамещенного 2,3-ди-
ют, в частности, сигналы протонов бромпропиль-
гидроимидазо[1,2-a]бензимидазол-2-она
[15]. В
ной и аллильной групп, а также циклической ме-
спектрах ЯМР 1Н дигидропроизводного 10 при-
тиленовой группы при 4.36 м. д.
сутствует сигнал циклической метиленовой груп-
По сравнению с уже известными производны-
пы в виде двух однопротонных триплетов при 3.46
ми пиримидо[1,6-b][1,2,4]триазепин-5-онов
[16]
и 4.05 м. д. В ИК спектрах имидазобензимидазо-
и пиримидо[5,4-e][1,2,4]триазин-5,7-дионов [17]
лов 11а, б присутствуют полосы валентных ко-
активность метиленовой группы в соединениях
лебаний CO-группы при 1700-1705 см-1, а также
9 и 10 понижена. Так, они не реагируют с диме-
одинарных связей С-О в области около 1100 см-1.
тилацеталем диметилформамида при кипяче-
Кроме того, имеются также полосы связей С=С и
нии реакционной смеси в диметилформамиде.
С=N трициклического ядра в областях 1455-1595
В то же время с более реакционноспособными
и 1600-1615 см-1 соответственно. В их спектрах
агентами, альдегидами (4-нитробензальдегидом,
ЯМР 1Н наряду с другими ожидаемыми сигналами
3,4-дихлорбензальдегидом, 5-нитрофурфуролом и
присутствуют синглеты метильной группы в поло-
пиразол-4-альдегидом), реакция по метиленовой
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1002
ЖУКОВСКАЯ и др.
Схема 5.
NO2
OHC
NO2
O
N
N
N
All
16
p-ClC6H4
N
N COCH3
CH2COOH
p-ClC6H
4
N
NH
N
Ac2O
OHC
O
NH
N
N
∆
N
R
N
17
6, 7
All
S
S
N
NH
OHC
N
N
N
N
N O
COCH3
Br
18
R= All (6); CH2CHBrCH3 (7).
группе протекает достаточно легко при кипячении
Ее не удается заместить аминогруппой при дей-
в уксусной кислоте в течение 0.5 ч. В результате
ствии аммиака, как на холоду, так и при нагревании.
образуются 3-арилиден-9R-2-оксоимидазо[1,2-a]-
Не реагирует она и с пиперидином и морфолином,
бензимидазолоны 14-16 (схема 4). Их можно по-
даже в отсутствие растворителя и при кипячении
лучить и непосредственно из иминов 6 и 7 (схема
реакционных смесей. Инертность данной группы
5), объединив стадии циклизации и конденсации
можно связать со значительным снижением ее
по Кнёвенагелю в однореакторный процесс, на-
электрофильности, обусловленным энергичным
гревая смесь имина с альдегидом в среде уксуно-
электронодонорным [18] влиянием соседнего ими-
го ангидрида. В случае пиразол-4-карбальдегидов
дазобензимидазол-3-ильного заместителя. В то же
реакция сопровождается N-ацетилированием пи-
время с более нуклеофильным гидразингидратом
разольного цикла с образованием соединений 18
реакция протекает достаточно легко, приводя к об-
и 19.
разованию гидразида 19 с выходом 54% (схема 6).
Алкоксигруппа в эфирах 11а, б довольно инерт-
Структура полученного гидразида подтверждает-
на по отношению к нуклеофильному замещению.
ся данными ИК спектроскопии. В спектре присут-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ЧЕТВЕРТИЧНЫЕ СОЛИ
1003
Схема 6.
N
HN
CHO
O
Me
N
N
H2NHNOC
N
Me
All
20
NH2NH2
N
11a
N
Me
Me
N
N N
All
O
19
CH2(COMe)2
Me
N
N
N
All
21
ствуют полосы валентных колебаний групп С=О
наблюдается образование пиразол-1-ил производ-
(1648 см-1) и NH2 в области 3323-3264 см-1). В
ного 21 (схема 6). В его ИК спектре отсутствуют
спектре ЯМР 1Н эти группы проявляются в виде
присущие гидразиду 19 характеристические поло-
двух- и однопротонных синглетов при 4.50 и 8. 96
сы поглощения, отвечающие валентным колеба-
м. д. соответственно.
ниям карбогидразидного фрагмента CONHNH2. В
спектре ЯМР 1Н помимо других ожидаемых сиг-
Полученный гидразид 19 при кипячении в
налов наблюдаются трехпротонные синглеты ме-
спирте с формиларенами легко образует потенци-
тильных групп при 2.10, 2.19 м. д. и однопротон-
ально биологически активные гидразоны типа 20.
ный синглет протона в положении 4 пиразольного
В спектре ЯМР 1Н гидразона 20 соединений на-
цикла при 6.25 м. д.
ряду с другими сигналами присутствуют сингле-
Таким образом, галогениды 1-аллил(2-бром-
ты протона альдиминовой группы при 8.09 м. д. и
пропил)-3-(карбокси)алкоксикарбонилметил-2-
NH-группы при 11.34 м. д.
аминобензимидазолия и их 2-иминобензимида-
Поскольку пиразольный цикл в составе слож-
золиновые формы при взаимодействии с рядом
ных структур в фармакологическом отношении
циклизующих агентов являются удобными пред-
весьма привлекателен [19-21], гидразид 19 был
шественниками для синтеза производных имида-
использован в качестве предшественника для по-
зо[1,2-a]бензимидазола, содержащих либо легко
строения на основе его гидразинового остатка
трансформируемые боковые группы, либо входя-
пиразольного цикла. Достаточно успешно это уда-
щую в состав имидазо[1,2-a]бензимидазольного
ется сделать, используя в качестве циклизующего
трицикла реакционноспособную метиленовую
реагента 2,4-пентандион, при реакции с которым
группу. Такие соединения представляют, в част-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1004
ЖУКОВСКАЯ и др.
ности, интерес для получения привлекательных
4.19 к (2Н, ОСН2, J 7.1 Гц), 4.92 д (2H, CH2CH=,
в фармакологическом отношении гетарилирован-
J 5.0 Гц), 5.09 д. д (1Н, Hтранс, СН2=, J 17.2 Гц),
ных имидазо[1,2-a]бензимидазолов.
5.24 с (2H, CH2CO), 5.24 д (1Н, Hцис, =СН2, J
9.3 Гц), 5.94 д. д. д (1H, CH=CH2, J 17.2, 9.3,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
4.9 Гц), 7.29-7.40 м (2H, H6,7), 7.54 д. д (1 H, H5(8), J
ИК спектры регистрировали на приборе Varian
6.4, 2.4 Гц), 7.62 д. д (1 H, Н8(5), J 6.4, 2.4 Гц), 9.07 c
Excalibur 3100 FT-IR в твердой фазе в суспензии
(2H, NH2). Спектр ЯМР 13C, δС, м. д.: 13.91, 44.16,
с вазелиновым маслом. Спектры ЯМР 1Н снима-
44.49, 61.74, 110.51, 110.56, 117.54, 123.74, 123.87,
ли на спектрометрах Varian Unity 300 (300 МГц)
129.16, 129.70, 130.30, 150.03, 166.52. Найдено, %:
для соединений 3а, 12-19 в растворе ДМСО-d6 и
С 49.22; Н 5.12; Br 23.34; N 12.48. C14H18BrN3O2.
Bruker Avance 600 N (600 МГц) для соединений 8,
Вычислено, %: С 49.43; Н 5.33; Br 23.49; N 12.35.
9, 11а, б в CDCl3, для остальных - в ДМСО-d6. Тем-
Хлорид 2-амино-3-(2-бутокси-2-оксоэтил)-1-
пературы плавления определяли на приборе Fisher
(проп-2-ен-1-ил)-1Н-бензимидазол-3-илия (3в).
Johns Melting Point Apparatus. Элементный анализ
Смесь 0.87 г (5 ммоль) амина 1 и 2 мл бутилового
проводили классическим методом микроанализа.
эфира монохлоруксусной кислоты нагревали при
Контроль за ходом реакции и индивидуальность
105-110°С в течение 15 мин. Полученный плав
синтезированных соединений осуществляли ме-
охлаждали до 30-35°С и обрабатывали ацетоном
тодом тонкослойной хроматографии (пластины
(15 мл). Осадок отфильтровывали, промыва-
с Аl2O3 III степени активности, элюент - СНСl3,
ли многократно ацетоном для удаления избытка
проявление парами иода во влажной камере).
эфира монохлоруксусной кислоты. Выход чет-
Все использованные в работе реагенты коммер-
вертичной соли 3в 1.35 г (83.3%). Хлорид пере-
чески доступны.
кристаллизовывали из 25 мл ацетонитрила с не-
сколькими каплями воды, которую прибавляли в
Cинтез бромидов бензимидазолия
3а, б
кипящую суспензию соли в ацетонитриле до рас-
(общая методика). К раствору амина 1 (10 ммоль)
творения осадка, затем сушили при 100-105°С,
в 30 мл ацетона прибавляли 12 ммоль метилового
т. пл. 240-241°С. ИК спектр, ν, см-1: 3215, 3170
или этилового эфира монобромуксусной кислоты.
(NH2), 1760 (C=O), 1665 (C=N), 1605, 1480 (C=C),
Полученную смесь перемешивали до начала обра-
1230 (C-O-C). Спектр ЯМР 1Н, δ, м. д.: 0.85 т
зования белого осадка и оставляли при комнатной
(3H, Me, J 7.4 Гц), 1.29 секстет (2Н, СН2СН2Me, J
температуре на ночь. Осадок отфильтровывали,
7.7 Гц), 1.55 квинтет (2Н, СН2СН2СН2Me, J 7.5 Гц),
промывали ацетоном и сушили.
4.12 т (2Н, ОСН2, J 6.5 Гц), 4.97 д (2H, CH2CH=, J
Бромид 2-амино-3-(2-метокси-2-оксоэтил)-1-
4.9 Гц), 5.12 д (1Н, Hтранс, CH2=, J 17.2 Гц), 5.23 д
(проп-2-ен-1-ил)-1Н-бензимидазол-3-илия (3а).
(1H, Hцис, CH2=, J 11.2 Гц), 5.93 д. д. д (1H, CH=CH2,
Выход 3.2 г (98.1%), т. пл. 237-238°С (EtOH). ИК
J 17.2, 11.2, 4.9 Гц,), 7.37-7.28 м (2H, H6,7), 7.52 д.
спектр, ν, см-1: 3215, 3170 (NH2), 1760 (C=O), 1675
д (1H, H5(8), J 6.5, 2.4 Гц), 7.57 д. д (1H, H8(5), J
(C=N), 1600, 1475 (C=C), 1230 (C-O-C). Спектр
6.4, 2.5 Гц), 9.49 c (2H, NH2). Спектр ЯМР 13C, δС,
ЯМР 1Н, δ, м. д.: 3.8 с (3Н, OMe), 4.92 д ( 2Н, СН2, J
м. д.: 13.39, 18.35, 29.94, 44.22, 44.49, 65.23, 110.38,
5.3 Гц), 5.12-5.30 м (4Н, =СН2, СН2СО), 5.95-6.02
110.50,
117.61,
123.64,
123.77,
129.26,
129.79,
м (1Н, СН), 7.23-7.63 м (4НAr), 9.08 c (2H, NH2)
130.43, 150.19, 166.63. Найдено, %: C 59.08; H
Найдено, %: С 48.07; Н 4.74; Br 24.35; N 13.01.
7.05; Cl 10.80; N 12.85. C16H22ClN3O2. Вычислено,
C13H16BrN3O2. Вычислено, %: С 47.86; Н 4.94; Br
%: C 59.30; H 6.85; Cl 10.95; N 12.98.
24.50; N 12.88.
Бромид 2-амино-3-(карбоксиметил)-1-(проп-
Бромид
2-амино-3-(2-этокси-2-оксоэтил)-1-
2-ен-1-ил)-1Н-бензимидазолия (4). Смесь 1.63 г
(проп-2-ен-1-ил)-1Н-бензимидазол-3-илия (3б).
(5 ммоль) бромида 3а, 10 мл уксусной кислоты и
Выход 1.7 г (100%), т. пл. 234-235°С (EtOH). ИК
2.5 мл 48%-ной НBr (т. кип. 128°С.) кипятили 1 ч.
спектр, ν, см-1: 3220, 3175 (NH2), 1765 (C=O),
На следующий день осадок бромида 4 отфиль-
1670 (C=N), 1600, 1480 (C=C), 1235 (C-O-C).
тровывали, тщательно отмывали от кислоты аце-
Спектр ЯМР 1Н, δ, м. д.: 1.23 т (3H, Me, J 7.1 Гц),
тоном и сушили на воздухе. Выход 1.47 г (90%),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ЧЕТВЕРТИЧНЫЕ СОЛИ
1005
т. пл. 258-259°С (EtOH, 1 г/30 мл). ИК спектр, ν,
уш. м (1H, НAr), 7.43 уш. м (1H, НAr), 8.90 уш. с
см-1: 3265, 3200 (NH2), 3125 (ОН), 1765 (C=O),
(1Н, OH или =NH). Спектр ЯМР13 С δС, м. д.:
1670 (C=N), 1600 (C=C). Спектр ЯМР 1Н, δ, м. д.:
44.14, 47.00, 109.99, 110.52, 117.69, 122.90, 123.22,
4.92 д (2Н, NCH2, J 4.9 Гц,), 5.12 c (2H, CH2cycl),
129.25, 130.56, 130.65, 150.03, 165.71. Найдено, %:
5.12 д (1Н, Hтранс, =CH2, J 17.0 Гц), 5.24 д (1H,
C 62.11; H 5.84; N 18.45. C12H13N3O2. Вычислено,
Hцис, =CH2, J 10.4 Гц), 5.93 м (1H, СН=, J 5.4, 10.4,
%: C 62.33; H 5.67; N 18.32.
17.0 Гц), 7.29-7.34 м (2Н, НAr), 7.51-7.55 м (1Н,
[3-(2-Бромпропил)-2-имино-2,3-дигидро-
НAr), 7.58-7.62 м (1Н, НAr), 9.05 с (2Н, NH2).
1Н-бензимидазол-1-ил]уксусная кислота (7). К
Спектр ЯМР 13C, δC, м. д.: 39.50, 44.25, 44.51,
горячему раствору 1.58 г (4 ммоль) бромида 5 в
110.47,
110.54,
117.71,
123.73,
123.77,
129.17,
10 мл воды прибавляли 22%-ный раствор аммиака
129.85, 130.35, 150.0, 167.79. Найдено, %: C 46.08;
до рН 9-10 и охлаждали на ледяной бане. Через
H 4.74; Br 25.22; N 13.64. С12Н14BrN3O2. Вычисле-
2 ч выпавший осадок имина 7 отфильтровывали и
но, %: C 46.30; H 4.54; Br 25.37; N 13.51.
промывали холодной водой. Выход 1.08 г (70%),
Бромид
2-амино-1-(2-бромпропил)-3-(кар-
т. пл. 215-216°С (EtOH-Н2О). ИК спектр, ν, см-1:
боксиметил)-1Н-бензимидазол-3-илия
(5).
3245 (NH), 3125 (ОН), 1750 (C=O), 1673 (C=N),
Смесь 1.63 г (5 ммоль) бромида 3а и 20 мл 48%-ной
1609 (C=C). Спектр ЯМР 1Н, δ, м. д.: 1.62 д (3Н,
НBr кипятили 8 ч, затем охлаждали. Осадок бро-
Me, J 6.0 Гц), 3.96-4.08 м (2Н, NCH2CHBrMe),4.23
мида 5 отфильтровывали, тщательно промывали
c (2H, NCH2), 4.44-4.54 м (1Н, NCH2CHBrMe),
ацетоном до достижения рН 7 промывной жидко-
7.15-7.23 м (2H, НAr), 7.61-7.63 м (1Н, НAr), 7.73-
сти и сушили. Выход 1.7 г (87%), т. пл. 220-221°С
7.76 м (1Н, НAr), 8.63 уш. с (2Н, OH, NH). Найде-
(EtOH). ИК спектр, ν, см-1: 3245, 3190 (NH2), 3125
но, %: C 46.09; H 4.73; Br 25.22; N 13.38. С12H14Br
(OH), 1750 (C=O), 1675 (C=N), 1600 (C=C). Спектр
N3O2. Вычислено, %: C 46.30; H 4.54; Br 25.37; N
ЯМР 1Н, δ, м. д.: 1.75 д (3Н, Me, J 5.6 Гц), 4.53-4.62
13.51.
м (1Н, СНMe), 4.64 д (2H, CH2CH, J 8.6 Гц), 5.08 д
9-(Проп-2-ен-1-ил)-3Н-имидазо[1,2-а]бенз-
(2H, CH2CO, J 18.7 Гц), 7.30-7.38 м (2Н, H5,6), 7.59
имидазол-2(9H)-он (8). а. Смесь 0.92 г (4 ммоль)
д (1H, Н4(7), J 7.6 Гц), 7.71 д (1H, Н7(4), J 7.7 Гц),
[2-амино-3-(проп-2-ен-1-ил)-2,3-дигидро-1Н-бен-
9.11 с (2Н, NH2), 13.5 уш. с. (1Н, ОН). Спектр ЯМР
зимидазол-1-ил]уксусной кислоты 6 и 6 мл уксус-
13C, δС, м. д.: 22.74, 44.19, 46.27, 49.35, 110.41,
ного ангидрида кипятили 5 мин. При этом вначале
111.18,
123.68,
123.81,
129.24,
129.64,
150.20,
происходило растворение исходного соединения,
167.64. Найдено, %: C 36.62; H 3.73; Br 40.05; N
а затем начинал выделяться слегка желтоватый
10.62. C12H15Br2N3O2. Вычислено, %: C 36.83; H
крупнокристаллический осадок. Его отфильтро-
3.87; Br 40.37; N 10.75.
вывали после охлаждения реакционной массы,
[2-Имино-3-(проп-2-ен-1-ил)-2,3-дигидро-
тщательно промывали от избытка уксусного анги-
1Н-бензимидазолинил-1-ил]уксусная кислота
дрида диэтиловым эфиром и сушили. Выход 0.65 г
(6). Растворяли при нагревании 1.25 г (4 ммоль)
(76%), т. пл. 192-193°С. ИК спектр, ν, см-1: 1710
бромида 5 в 10 мл воды. Раствор подщелачивали
(С=О), 1610, 1555, 1500 (C=C, C=N). Спектр
ЯМР 1Н, δ, м. д.: 4.37 с (2Н, СН2cycl), 4.72 уш. д
22%-ным раствором аммиака до рН 9-10, филь-
тровали в горячем виде от механических при-
(2Н, NCH2, J 6.7 Гц), 5.32 д (1H, Hтранс, =СН2, J
месей и охлаждали на ледяной бане. Через 2 ч
10.1 Гц), 5.33 д (1H, Hцис, =СН2, J 17.2 Гц), 5.95
выпавший осадок соединения 6 отфильтровы-
д. д. д (1Н, СН=CH2, J 17.2, 10.1, 6.7 Гц), 7.14 д
(1H, H5(8), J 7.8 Гц), 7.18 уш. д (1Н, Н8(5), J 7.7 Гц),
вали, промывали холодной водой и сушили при
100-105°С. Выход 0.79 г (85%), т. пл. 245-246°С
7.21-7.27 м (2H, H6,7). Спектр ЯМР 13C, δС, м. д.:
(EtOH ). ИК спектр, ν, см-1: 3245 (NH), 3125 (ОН),
46.05, 50.74, 109.06, 110.88, 119.38, 122.37, 123.67,
128.97, 130.27, 132.49, 168.04, 185.36. Найдено, %:
1750 (C=O), 1675 (C=N), 1600 (C=C). Спектр
С 67.38; H 5.41; N 19.58. C12H11N3O. Вычислено,
ЯМР 1Н δ, м. д.: 4.46 уш. с (2Н, NСН2CH=CH2),
4.82 уш. c (2Н, СН2CO), 5.13 д (1H, Hтранс, CH2=,
%: С 67.59; H 5.20; N 19.71.
J 17.1 Гц,), 5.20 д (1H, Нцис, CH2=, J 9.5 Гц), 5.89
б. Предварительно из амина 1 и хлорацетилхло-
уш. м (1Н, СН=CH2), 7.25 уш. м (2Н, НAr), 7.38
рида получали 2-хлор-N-[1-(проп-2-ен-1-ил)-1Н-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1006
ЖУКОВСКАЯ и др.
бензимидазол-2-ил]ацетамид 12. Для этого к те-
той пробирке нагревали 1.25 г (4 ммоль) 2-ими-
плому раствору 5.19 г (30 ммоль) амина 1 [11] и
нобензимидазолина 7 при 215-220°С 3.5 ч. По-
4.2 мл (30 ммоль) триэтиламина в 100 мл aбсолют-
сле охлаждения плав растирали с 15 мл ацетона.
ного бензола при перемешивании прибавляли в
Осадок отфильтровывали и промывали ацетоном.
течение 30 мин 2.39 мл (30 ммоль) хлорацетилхло-
Полученный гидробромид (2-метил-2,3-дигидрок-
рида в 10 мл бензола. Реакционную смесь кипяти-
си-9Н-имидазо[1,2-a]бензимидазол-9-ил)уксусной
ли 4 ч и охлаждали. Волокнистый осадок амида 12
кислоты 10 растворяли в 10 мл 22%-ного раство-
отфильтровывали и промывали гексаном. Выход
ра аммиака и образовавшийся раствор упаривали
амида 3.36 г (50%), т. пл. 161.0-161.5°С (i-PrOH).
досуха. Остаток кристаллизовали из этанола. Вы-
ИК спектр, ν, см-1: 3210 (NH),
1623 (C=O).
ход 60%, т. пл. 265-267°С. ИК спектр, ν, см-1: 1670
Спектр ЯМР 1Н, δ, м. д.: 4.24 c (2H, CCH2), 4.76
(С=О), 2200–3500 (ОН, N+H). Спектр ЯМР 1Н, δ,
д (2Н, NCH2, J 5.1 Гц), 5.07 д (1Н, Hтранс, СН2=, J
м. д.: 1.68 д (3Н, Me, J 6.0 Гц), 3.46–3.66 м (2Н,
17.3 Гц), 5.17 д (1Н, Hцис, СН2=, J 10.3 Гц), 5.92 д.
3-СН2cycl), 4.6-4.71 м (1Н, СН), 5.43 с (2Н, NСН2),
д. д (1H, J 17.3, 10.3, 5.1 Гц), 7.17-7.26 м (2H, H5,6),
7.20-7.31 м (2Н, Н6,7), 7.35-7.53 м (2Н, Н5,8), 9.03
7.33-7.43 м (1H, H4(7)), 7.55-7.47 м (1H, H7(4)), 12.62
уш. с ( 1Н, ОН). Найдено, %: C 62.23; H 5.75; N
с (1Н, NH). Найдено, %: C 57.01; H 5.04; Cl 14.05;
18.04. C12H13N3O2. Вычислено, %: C 62.33; H 5.67;
N 16.70. C12H12ClN3O. Вычислено, %: C 57.22; H
N 18.17.
4.84; Cl 14.20; N 16.83.
Синтез имидазо[1,2-a]бензимидазол-3-кар-
Для проведения циклизации полученный амид
боксилатов
11а, б (общая методика). Смесь
12 (1.0 г, 4 ммоль) растворяли в 10 мл ДМФА,
5 ммоль бромида 3a или 3б, 2 г безводного ацета-
добавляли 1.0 г безводного K2СО3. Полученную
та натрия и 15 мл уксусного ангидрида кипятили
смесь кипятили в течение 4 ч, затем неорганиче-
5 ч. Реакционную массу охлаждaли, выливали в
ский осадок отфильтровывали и промывали 2 мл
50 мл воды и после разложения избытка уксусного
ДМФ. Остаток после упаривания ДМФА при по-
ангидрида раствор нейтрализовали содой. Выде-
ниженном давлении промывали водой и сушили
лившееся масло экстрагировали хлороформом и
при 100°С. Выход 0.36 г (42%), т. пл. 190-191°С
очищали на хроматографической колонке (h 12 cм,
(i-PrOH). Проба смешения с образцом соединения
d 2 см) с γ-Al2O3, элюент - CHCl3.
8, полученным по способу а, плавится без депрессии.
Метилимидазо[1,2-a]бензимидазол-3-кар-
9-(2-Бромпропил)-3Н-имидазо[1,2-a]бенз-
боксилат (11а). Выход 2.1 г (78%), т. пл. 103–104°С
имидазол-2(9Н)-он (9). Раствор 0.94 г (3 ммоль)
(MeCN). ИК спектр, ν, см-1:1700 (С=О), 1615, 1585,
[3-(2-бромпропил)-2-имино-2,3-дигидро-1Н-бен-
1455 (C=C, C=N), 1100 (С-О-С). Спектр ЯМР 1Н,
зимидазол-1-ил]уксусной кислоты 7 в 8 мл уксус-
δ, м. д.: 2.62 c (3H, СMе), 3.94 c (3H, OMe), 4.82 д.
ного ангидрида кипятили 5 мин, затем охлаждали.
т (2H, NCH2, J 5.4, 1.6 Гц), 5.21 д (1H, Нтранс, CH2=,
Осадок отфильтровывали, промывали диэтиловым
J 17.1 Гц), 5.24 д (1H, Hцис, CH2=, J 10.3 Гц), 5.97 д.
эфиром и сушили. Выход 0.68 г (78%), т. пл. 175-
д. д (1H, J 17.1, 10.3, 5.4 Гц), 7.18-7.32 м (3H, HAr),
176°С (i-PrOH). ИК спектр, ν, см-1: 1725 (С=О),
8.44 д (1H, H5, J 8.2 Гц). Спектр ЯМР 13C, δС, м. д.:
1635, 1570, 1510 (C=C, C=N). Спектр ЯМР 1Н, δ,
м. д.: 1.77 д (3Н, Me, J 6.7 Гц), 4.36 д (2H, NCH2CH,
16.42, 45.36, 51.11, 109.91, 115.18, 118.18, 121.04,
J 6.7 Гц), 4.36 д (1Н, СН2cycl, J 16.5 Гц), 4.38 д
123.49, 123.67, 125.87, 131.13, 134.73, 149.28,
(1Н, СН2cycl, J 16.5 Гц), 4.59 секстет (1H, CHBr, J
152.51, 161.43. Найдено, %: C 66.69; H 5.80; N
6.9 Гц), 7.11-7.14 м (1Н, Н5(8)), 7.21 т. д (1H, Н6(7),
15.47. С15Н15N3O2. Вычислено, %: C 66.90; H 5.61;
J 7.5, 1.6 Гц), 7.24 т. д (1H, Н7(6), J 7.7, 1.5 Гц), 7.35
N 15.60.
д. д (1H, Н8(5), J 7.7, 1.5 Гц). Спектр ЯМР 13C, δС,
Этилимидазо[1,2-a]бензимидазол-3-карбок-
м. д.: 23.46, 44.53, 50.78, 51.56, 109.26, 110.80,
силат (11б). Выход 1.2 г (85%). Кристаллизовали
122.57, 123.92, 128.76, 132.81, 168.22, 185.43. Найде-
из легкокипящего петролейного эфира и сушили
но, %: C 48.79; H 4.31; Br 27.01; N 14.16. С12Н12N3O.
при 60°С. Т. пл. 70-72°С. ИК спектр, ν, см-1:1705
Вычислено, %: C 49.00; H 4.11; Br 27.16; N 14.29.
(С=О), 1615, 1595, 1455 (C=C, C=N), 1100 (С-О-С).
(2-Метил-2,3-дигидро-9Н-имидазо[1,2-a]бенз-
Спектр ЯМР 1Н, δ, м. д.: 1.43 т (3H, CH2Me, J
имидазол-9-ил)уксусная кислота (10). В откры-
7.1 Гц), 2.64 c (3H, 2-Me), 4.42 к (2Н, ОCH2, J
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ЧЕТВЕРТИЧНЫЕ СОЛИ
1007
7.1 Гц),4.82 д (2H, NCH2, J 5.3 Гц), 5.21 д (1H,
(2Н, NСН2, J 4.6 Гц ), 5.24 д (1H, Нтранс, =СН2, J
Hтранс, CH2=, J 17.2 Гц), 5.24 д (1H, Hцис, CH2=, J
16.6 Гц), 5.25 д (1H, Нцис, =СН2, J 10.8 Гц), 5.98 д.
9.9 Гц), 5.97 д. д. д (1H, СН, J 17.2, 9.9, 5.3 Гц),
д. д (1H, СН=CH2, J 16.6, 10.8, 4.6 Гц), 7.09 с (1H,
7.18-7.30 м (3H, HAr), 8.49 д (1Н, H5, J 8.1 Гц).
=CHHet), 7.15-7.36 м (3H, H 6,7 + H5(8)), 7.40 т (2H,
Спектр ЯМР 13C, δС, м. д.: 14.60, 16.55, 45.34,
H3ʹ,5, J 8.7 Гц), 7.48 д (1H, H8(5), J 7.4 Гц), 7.71 д. д
60.10, 109.86, 112.99, 115.27, 118.14, 120.96, 123.42,
(2H, H2ʹ,6ʹ, J 8.1, 5.7 Гц), 9.02 с (1Н, NН), 13.5 уш. с
125.91, 131.17, 134.75, 149.26, 152.38, 161.08. Най-
(1Н, NH). Найдено, %: %: C 68.35; H 4.38; N 18.05.
дено, %: C 67.71; H 6.18; N 14.70. C16H17N3O2. Вы-
C22H16FN5O. Вычислено, %: C 68.56; H 4.18; F
числено, %: C 67.83; H 6.05; N 14.83.
4.93; N 18.17.
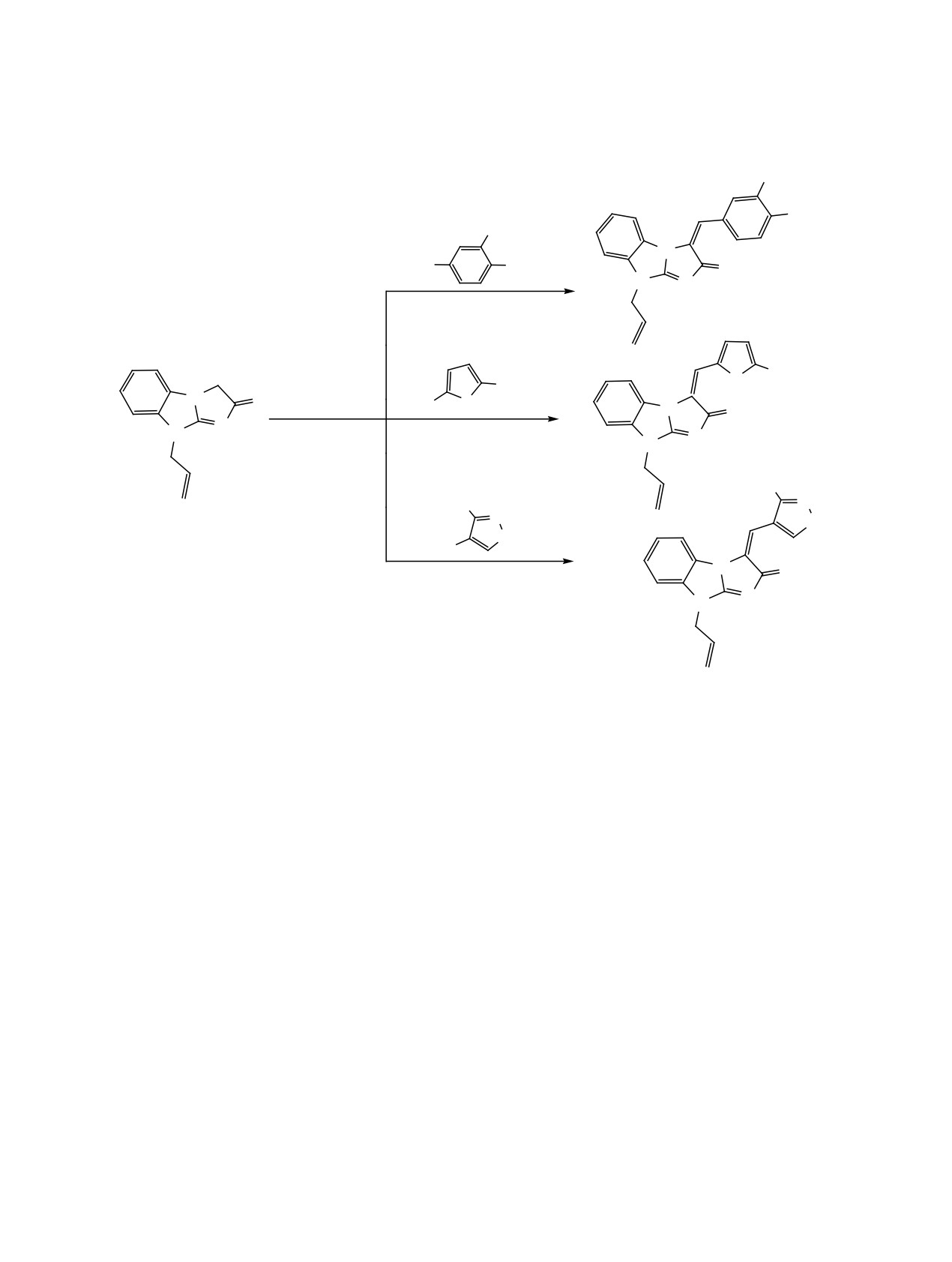
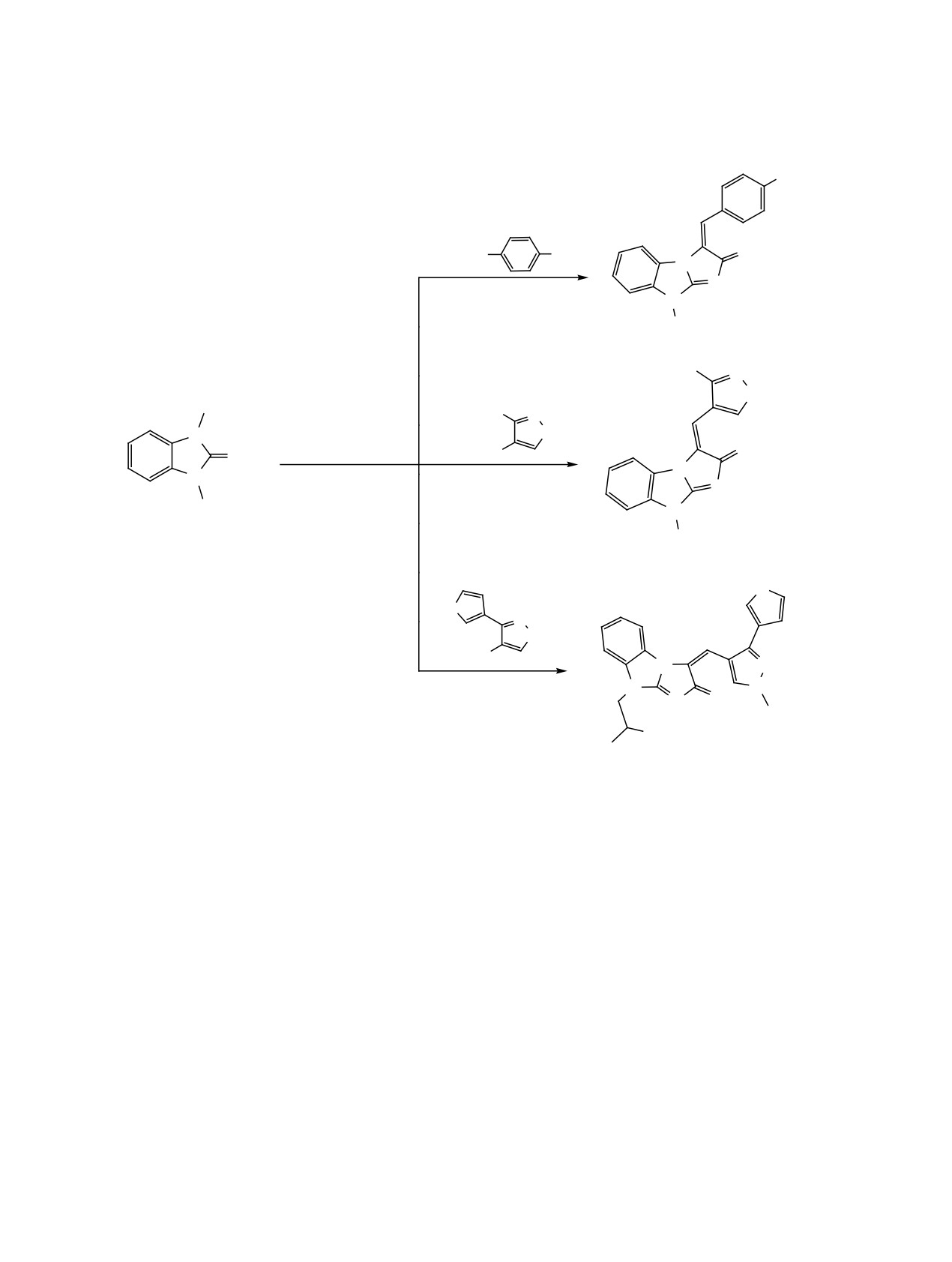
Синтез3-арилиден-2-оксоимидазо[1,2-a]бенз-
Синтез
3-арилиден-2-оксо-имидазо[1,2-a]-
имидазолонов 13-15 (общая методика). Смесь
бензимидазолонов
16-18 (общая методика).
2 ммоль
9-(проп-2-ен-1-ил)-3Н-имидазо[1,2-а]-
Смесь 2 ммоль имина 6 или 7 и 2 ммоль соответ-
бензимидазол-2(9H)-она 8 и 2 ммоль соответству-
ствующего альдегида в 2 мл уксусного ангидрида
ющего альдегида в 3 мл ледяной уксусной кислоте
кипятили в течение 25 мин, затем охлаждали. Ярко
кипятили 30 мин. Выделившийся после охлаж-
окрашенный осадок арилиденового производного
дении осадок отфильтровывали, промывали ди-
отфильтровывали, промывали диэтиловым эфи-
этиловым эфиром и сушили.
ром и сушили.
(3Е)-3[(3,4-Дихлорфенил)метилиден]-9-
3-[(4-Нитрофенил)метилиден]-9-(проп-2-ен-
(проп-2-ен-1-ил)-3Н-имидазо[1,2-а]бензимида-
1-ил)-3Н-имидазо[1,2-а]бензимидазол-2(9Н)-он
зол-2(9Н)-он (13). Выход 70%, т. пл. 205-207°С
(16). Выход 61%, желто-красные кристаллы, т. пл.
(MeNO2). ИК спектр, ν, см-1: 1715 (С=О). Спектр
251-252°С (MeNO2). ИК спектр, ν, см-1:
1715
ЯМР 1Н, δ, м. д.: 4.69 с (2Н, NСН2, J 5.1 Гц), 5.26 д
(С=О). Спектр ЯМР 1Н, δ, м. д.: 4.72 д (2Н, СН2, J
(1Н, Нцис, =СН2, J 9.4 Гц), 5.28 д (1Н, Нтранс, =СН2,
2.6 Гц), 5.29 д (2Н, =СН2, J 6.3 Гц), 5.95-6.02 м (1Н,
J 17.7 Гц), 5.98 д. д. д (1H, J 17.7, 9.4, 5.1 Гц), 7.32
СН=), 7.26-7.50 м (4Н, НAr), 8.04 с (1H, CHC6H4)
с (1H, ArC=CH), 7.18-7.33 м (2H, H6,7), 7.46 д (1 H,
8.21-8.30 м (4Н, НAr). Спектр ЯМР 13С, δС, м.
H5(8), J 7.9 Гц), 7.64 д (1H, H3ʹ, J 8.5 Гц), 8.00 д (1Н,
д.: 46.02 (CH2), 109.98, 111.45, 118.31 (=CC6H4),
Н8(5), J 7.4 Гц), 8.29 д. д (1H, H2ʹ, J 8.5, 1.7 Гц), 8.68
119.94 (CH2=),
123.51,
123.81,
124.21,
126.69,
д (1H, H6ʹ, J 1.7 Гц). Найдено, %: C 61.43; H 3.75;
129.84 (=CHCH2), 131.43, 133.16, 133.25, 138.53,
Cl 19.02; N 11.22. С19H13Cl2N3O. Вычислено, %: C
147.75, 164.39, 175.30 (C=O). Найдено, %: C 65.68;
61.64; H 3.54; Cl 19.15; N 11.35.
H 4.27; N 16.05. Вычислено, %: С19Н14N4O3. Вы-
числено, %: C 65.89; H 4.07; N 16.18.
(3Е)-3[(5-Нитрофуран-2-ил)метилиден]-9-
(проп-2-ен-1-ил)-3Н-имидазо[1,2-а]бензимид-
(3Е)-3-{[1-Ацетил-3-(4-хлорфенил)-1Н-пира-
азол-2(9Н)-он (14). Выход 50%, т. пл. 217-219°С
зол-4-ил]метилиден}-9-(проп-2-ен-1-ил)-3Н-и-
(ДМФА). ИК спектр, ν, см-1: 1727 (С=О). Спектр
мидазо[1,2-a]бензимидазол-2(9Н)-он (17). Выход
ЯМР 1Н, δ, м. д.: 4.72 д (2H, NCH2, J 5.1 Гц), 5.21-
45%, ярко-желтые кристаллы, т. пл. 210-212°С
5.39 м (2H, CH2=), 5.99 д. д. д (1H, СН=CH2, J
(MeNO2). ИК спектр, ν, см-1: 1737, 1709 (С=О).
15.4, 9.9, 4.8 Гц) 7.34-7.26 м (2H, H6,7), 7.71 с (1H,
Спектр ЯМР 1Н, δ, м. д.: 2.71 с (3Н, Me), 4.71 д (2Н,
=CHHet), 7.45-7.55 м (1H, H5(8)), 7.81 д (1H, H3ʹ, J
NCH2, J 5.4 Гц), 5.23-5.28 м (2Н, CH2), 5.93-6.02
3.9 Гц), 8.08-8.15 м (1H, H8(5), 8.17 д (1H, H4,
м (1Н, СН=), 6.96 с (1Н, =СН), 7.20-7.78 м (8Н,
J 3.9 Гц). Найдено, %: C 60.50; H 3.81; N 16.53.
НAr), 9.54 c (1H, НAr). Найдено, %: C 64.73; H 4.29;
С17Н12N4O4. Вычислено, %: C 60.71; H 3.60; N
Cl 7.85; N 15.65. С24H18ClN5O2. Вычислено, %: C
16.66.
64.94; H 4.09; Cl 7.99; N 15.78.
(3Е)-3{[3-(4-Фторфенил)-1Н-пиразол-4-ил]-
(3Е)-3-{[1-Ацетил-3-(тиен-3-ил)-1Н-пиразол-
метилиден}-9-(проп-2-ен-1-ил)-3Н-имида-
4-ил]метилиден}-9-(2-бромпропил)-3Н-ими-
зо[1,2-а]бензимидазол-2(9Н)-он
(15).
Выход
дазо[1,2-a]бензимидазол-2(9Н)-он (18). ЯВыход
55%, т. пл. 247-248°С (ДМФА). ИК спектр, ν,
45%, ярко-желтые кристаллы, т. пл. 231.5-233.5°С
см-1: 1695 (С=О). Спектр ЯМР 1Н, δ, м. д.: 4.72 д
(MeNO2). ИК спектр, ν, см-1: 1737, 1709 (С=О).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1008
ЖУКОВСКАЯ и др.
Спектр ЯМР 1Н, δ, м. д.: 1.78 д (3Н, Me, J 6.6 Гц),
134.67, 139.33, 141.32, 145.56, 146.16, 148.68. Най-
2.7 с (3Н, MeСО), 4.45 д (2H, NCH2, J 6.7 Гц),
дено, %: 74.60; H 5.57; N 14.73. С27H23N5O. Вычис-
4.76 секстет (1H, CHMe), 7.24 c (1H, =CHHet),
лено, %: C 74.81; H 5.35; N 14.86.
7.26-7.37 м (3H, Н6,7 + Hтиенил), 7.54 д (1H, H5(8), J
(3,5-Диметил-1Н-пиразол-1-ил)[2-метил-9-
7.7 Гц), 7.68 д. д (1H, Hтиенил, J 3.7, 1.1), 7.73 д (1H,
(проп-2-ен-1-ил)-9Н-имидазо[1,2-а]бензимида-
H8(5), J 7.8 Гц), 7.78 д (1H, Hтиенил, J 5.2 Гц), 9.55
зол-3-ил]метанон (21). Смесь 0.54 г (2 ммоль)
с (1H, Hпиразол). Найдено, %: C 53.02; H 3.86; Br
гидразида 19 и 0.21 мл (2 ммоль) 2,4-пентандиона
15.89; N 13.98; S 6.21. С22H18BrN5O2S. Вычислено,
кипятили в 3 мл этанола в течение 9-9.5 ч. Реак-
%: C 53.23; H 3.66; Br 16.10; N 14.11; S 6.46.
ционную массу охлаждали, осадок отфильтро-
2-Метил-9-(проп-2-ен-1-ил)-9H-имида-
вывали, промывали холодным спиртом и сушили
зо[1,2-a]бензимидазол-3-карбогидразид
(19).
на воздухе. Выход 0.4 г (60%), т. пл. 132-133°С
Раствор 2.5 г (9.2 ммоль) эфира 11а в 10 мл этанола
(EtOH). ИК спектр, ν, см-1: 1657 (С=О). Спектр
и 5 мл гидразингидрата кипятили 10 ч. Выделив-
ЯМР 1Н, δ, м. д.: 2.11 с (3Н, Me), 2.20 с (3Н, Me),
шийся осадок после охлаждения отфильтровыва-
2.51 с (3Н, Me), 4.91 д (1H, NCH2, J 5.2 Гц), 5.17
ли, промывали ледяной водой и сушили. Выход
д (1H, Hтранс, CH2=, J 17.2 Гц ), 5.22 д (1H, Hцис,
1.36 г (54%), бесцветные волокнистые кристаллы,
CH2=, J 10.2 Гц), 6.03 д. д. д (1Н, СН=CH2, J 17.2,
т. пл. 179-180°С (EtOH). ИК спектр, ν, см-1: 3323,
10.2, 5.2 Гц), 6.24 с (1Н, Н4пиразол), 7.20 т (1H, H5(8),
3264, 3021(NH2, NH), 1647 (C=O). Спектр ЯМР
J 7.8 ), 7.35 т (1 H, Н8(5), J 7.7 Гц), 7.52 д (1H, H6(7),
1Н, δ, м. д.: 2.45 c (3Н, Me), 4.51 с (2Н, NH2), 4.82
J 8.1 Гц), 7.58 д (1H, J 8.1, H7(6)). Найдено, %: C
д (2Н, NСН2, J 4.8 Гц), 5.11 д (1H, Hтранс, СН2, J
68.24; H 5.94; N 20.88. С19H19N5O. Вычислено, %:
17.8 Гц), 5.17 д (1H, Hцис, CH2, J 10.5 Гц), 5.98 д.
C 68.45; H 5.74; N 21.01.
д. д (1H, J 17.8, 10.5, 4.8 Гц), 7.18 т (1H, Н6(7), J
ИНФОРМАЦИЯ ОБ АВТОРАХ
7.6 Гц), 7.29 т (1H, H7(6), J 7.7 Гц), 7.47 д (1H, H8,
J 8.0 Гц), 8.17 д (1H, H5, J 8.0 Гц), 8.96 с (1Н, NH).
Жуковская Ольга Hиколаевна, ORCID: http://
Найдено, %: С 62.23; Н 5.81; N 25.88. С14H15N5O.
orcid.org/0000-0003-2485-2139
Вычислено, %: С 62.44; Н 5.61; N 26.01.
Морковник Анатолий Савельевич, ORCID:
2-Метил-N′-[(1,1′-бифенил-4-ил)метили-
ден]-9-(проп-2-ен-1-ил)-9H-имидазо[1,2-a]бен-
Бородкин Геннадий Сергеевич, ORCID: http://
зимидазол-3-карбогидразид (20). Раствор 0.39 г
orcid.org//0000-0002-5886-7825
(1.4 ммоль) карбогидразида 19 и 0.27 г (1.4 ммоль)
бифенил-4-карбальдегида в 7 мл этанола кипяти-
БЛАГОДАРНОСТИ
ли в течение 3.5-4 часов. По окончании реакции
Работа выполнена с использованием оборудо-
(контроль ТСХ) реакционную смесь охлаждали,
вания Центра коллективного пользования Южного
гидразон отфильтровывали, промывали спиртом и
федерального университета.
сушили на воздухе. Выход 0.4 г (64%), т. пл. 219-
221°С (ДМФА). ИК спектр, ν, см-1: 3227 (NH), 1661
ФОНДОВАЯ ПОДДЕРЖКА
(C=O). Спектр ЯМР 1Н, δ, м. д. 2.53 c (3H, Me),
Работа выполнена при финансовой поддержке
4.87 уш. д (2Н, NСН2, J 5.7 Гц), 5.5 д (1Н, Hтранс,
Министерства науки и высшего образования РФ в
СН2=CH, J 17.1 Гц), 5.20 д (1H, Hцис, СН2=CH, J
рамках государственного задания (№ БАЗ 0110/20-
10.2 Гц), 6.02 д. д. д (1 H, СН, J 17.1, 10.2, 5.5 Гц),
3-11ИХ).
7.38 т (1H, НAr, J 7.2 Гц), 7.33 т (1H, НAr, J 7.6 Гц),
7.21 т (1H, НAr, J 7.7 Гц), 7.47 т (2H, НAr, J 7.4 Гц),
КОНФЛИКТ ИНТЕРЕСОВ
7.53 д (1H, НAr, J 8.0 Гц), 7.74 д (2H, НAr, J 7.8 Гц),
Авторы заявляют об отсутствии конфликта
7.78 д (2H, НAr, J 7.3 Гц), 8.09 уш. д (1H, H5, J
интересов.
8.3 Гц), 8.38 с (1H, CH=N), 11.34 с (1Н, NH). Спектр
СПИСОК ЛИТЕРАТУРЫ
ЯМР 13C, δС, м. д.: 16.40, 44.71, 110.62, 114.10,
114.70,
117.53,
120.47,
123.37,
124.70,
126.63,
1. Gravel J., Schmitzer A.R. // Org. Biomol. Chem. 2017.
127.02, 127.45, 127.82, 129.00, 132.07, 133.53,
Vol. 15. P. 1051. doi 10.1039/C6OB02293F
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
ЧЕТВЕРТИЧНЫЕ СОЛИ
1009
2.
Sangeeta G.P.V., Purna N.K., Risy N.J., Murali M.,
11.
Анисимова В.А., Толпыгин И.Е. // ЖОрХ. 2011.
Kumarn K. // Microb. Pathogen. 2018. Vol. 124. P. 258.
T. 47. С. 1326; Anisimova V.A., Tolpygin I.E. Russ.
doi 10.1016/j.micpath.2018.08.046
J. Org.Chem. 2011. Vol. 47. P. 1346. doi 10.1134/
3.
Zarubaev V.V., Morkovnik A. S., Divaeva L.N.,
S1070428011090156
Karpinskaya L.A. Borodkin G.S. // Bioorg. Med. Chem.
12.
Cимонов А.М., Анисимова В.А., Борисова Т.А. // ХГС.
2016. Vol. 24. P. 5796. doi 10.1016/j.bmc.2016.09.036
1973. С. 111; Simonov A.M., Anisimova V.A., Boriso-
4.
Shelton K.L., DeBord M.A., Wagers P.O., Souther-
va T.A. // Chem. Heterocycl. Compd. 1973. Vol. 9. Р. 99.
land M.R., Williams T.M., Robishaw N.K., Shriver L.P.,
doi 10.1007/BF00476162
Tessier C.A., Panzner M.J., Youngs W.J. // Bioorg.
13.
Анисимова В.А., Кузьменко Т.А., Спасов А.А., Боча-
Med. Chem. 2017. Vol. 25. P. 421. doi 10.1016/j.
рова И.А., Оробинская Т.А. // Хим.-фарм. ж. 1999.
bmc.2016.11.009
Т. 33. С. 21; Anisimova V.A., Kuz’menko T.A., Spa-
5.
Yigit M., Yigit B., Taslimi P., Ozdemir I., Karaman M.,
sov A.A., Bocharova I.A., Orobinskaya T.A. // Pharm.
Gulçin L. // J. Mol. Struct. 2020. Vol. 1207. P. 127802.
Chem. J. 1999. Vol. 33. Р. 361.
doi 10.1016/j.molstruct.2020.127802
14.
Descours D., Festa D. // Synthesis. 1983. Vol. 12.
6.
Spasov A.A, Kucheryavenko A.F., Gaidukova K.A.,
Р. 1033. doi 10.1055/s-1983-30617
Kosolapov V A., Zhukovskayа O.N. // Res. Results
15.
Mobinikhaledi A., Foroughifar N., Kalhor M.,
Pharmacol. 2020. Vol. 6. N 1. P. 1. doi 10.3897/
Mirabolfathy M. // J. Heterocycl. Chem. 2010. Vol. 47.
rrpharmacology.6.503732
Р. 77. doi 10.1002/jhet.264
7.
Спасов А.А., Жуковская О.Н., Бабков Д.А., Брига-
16.
Riyadh S.M., Farghaly T.A., Gomha S. M. // Arch.
дирова А.А., Бабкова В.А., Морковник А.С., Литви-
Pharm. Res. 2010. Vol. 33. Р. 1721. doi 10.1007/s12272-
нов Р.Л., Соколова Е.В. // Изв. АН. 2020. T. 4.
010-1102-8
C. 774; Spasov A.A., Zhukovskaya O.N., Babkov D.A.,
17.
El-Kalyoubi S.A. // Chem. Central J. 2018. Vol. Vol. 12.
Brigadirova A.A., Babkova V.A., Morkovnik A.S.,
Article 64. doi 10.1186/s13065-018-0424-3
Litvinov R.A., Sokolova E V. // Rusы. Chem. Bull. 2020.
18.
Анисимова В.А., Симонов А.М., Пожарский А.Ф. //
Vol. 4. P. 774. doi 10.1007/s11172-020-2832-5
ХГС. 1973. Vol. 6. Р. 797; Anisimova V.A., Simo-
8.
Анисимова В.А., Жуковская О.Н., Петров В.И., Спа-
nov A.M., Pozharskii A.F. // Chem. Heterocycl. Compd.
сов А.А., Косолапов В.А., Кучерявенко А.Ф., Гайду-
1973. Vol. 9. Р. 731. doi 10.1007/BF00472318
кова К.А., Сороцкий Д.В. Пат. 2623439 (2017). РФ //
19.
Karrouchi K., Radi S., Ramli Y.,Taoufik J., Mab-
Б. И. 2017. № 18.
khot Y.N., Al-aizari F.A., Ansar M. // Molecules. 2018.
9.
Спасов А.А., Анисимова В.А., Гурова Н.А., Тимофе-
Vol. 23. N 1. Р. 134. doi 10.3390/molecules23010134
ева А.С., Федорчук В.Ю., Минкин В.И. Пат. 2526902
20.
Rizk S.A., El-Sayed A.A., Mounier M.M. // J. Heterocycl.
(2014). РФ // Б. И. 2014. № 24.
Chem. 2017. Vol. 54. P. 3358. doi 10.1002/jhet.2956
10.
Anisimova V.A., Balabolkin M.I., Vdovina G.P.,
21.
El-Sehemi A.G., Bondock S., Ammar Y.A. // Med. Chem.
Dedov I.I., Minkin V.I., Petrov V.I., Spasov A.A. Пат.
Res. 2014. Vol. 23. P. 827. doi 10.1007/s00044-013-
2386634C2 (2010). РФ // Б. И. 2010. № 11.
0650-0
1-Allyl- and 1-(2-Bromopropyl)-2-amino-3-carboxy(carbalkoxy)-
methylbenzimidazolium Quaternary Salts in the Synthesis
of Imidazo[1,2-a]benzimidazole Derivatives
O. N. Zhukovskaya, A. S. Morkovnik*, and G. S. Borodkin
Research Institute of Physical and Organic Chemistry, Southern Federal University, Rostov-on-Don, 344090 Russia
*e-mail: asmork@mail.ru
Received May 22, 2021; revised May 22, 2021; accepted June 7, 2021
1-Allyl(2-bromopropyl)-3-carboxy(carbalkoxy)methyl-2-aminobenzimidazolium halides and their 2-imino-
benzimidazoline forms were synthesized. Their cyclization into functionalized imidazo[1,2-a]benzimidazole
derivatives was studied. Some further transformations of obtained imidazobenzimidazoles with the participation
of reactive substituents and an activated methylene group were studied.
Keywords: benzimidazolium quaternary salts, 2-iminobenzimidazolines, cyclization, imidazo[1,2-a]benzim-
idazoles, 2,3-dihydroimidazo[1,2-a]benzimidazoles, imidazo[1,2-a]benzimidazol-2-ones
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021