ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1010-1020
УДК 547.26’118
СИНТЕЗ ГЛИКОКОНЪЮГАТОВ
ТРИАЗОЛИЛИЗАТИНОВ И НЕКОТОРЫХ
АММОНИЕВЫХ ГИДРАЗОНОВ НА ИХ ОСНОВЕ
© 2021 г. А. В. Богдановa,*, О. В. Андрееваa, М. Г. Беленокa, А. Д. Волошинаa,
К. И. Еникееваb, А. В. Самородовb, В. Ф. Мироновa
a Институт органической и физической химии имени А. Е. Арбузова Федерального исследовательского центра
«Казанский научный центр Российской академии наук», ул. Академика Арбузова 8, Казань, 420088 Россия
b Башкирский государственный медицинский университет, Уфа, 450008 Россия
*e-mail: abogdanov@inbox.ru
Поступило в Редакцию 29 апреля 2021 г.
После доработки 29 апреля 2021 г.
Принято к печати 23 мая 2021 г.
С использованием клик-реакции пропаргилизатинов с некоторыми азидо-сахарами осуществлен синтез
новых производных изатина, в которых углеводный остаток связан с 2,3-диоксиндольной платформой
через 1,2,3-триазольный цикл. На их основе получен ряд водорастворимых ацилгидразонов с различным
строением катионного центра. Показано, что полученные соединения не проявляют гемотоксического
действия и обладают выраженной антиагрегационной и антикоагулянтной активностью на уровне пре-
паратов сравнения - ацетилсалициловой кислоты и пентоксифиллина.
Ключевые слова: изатин, гликоконъюгаты, клик-реакции, гидразоны, антимикробная активность,
гемотоксичность
DOI: 10.31857/S0044460X21070040
Одной из самых популярных современных
тическую и др. [12-17]. С другой стороны также
стратегий разработки новых лекарственных пре-
известно, что подход, основанный на введении
паратов является объединение в одной молекуле
углеводного остатка в целевую молекулу, являет-
нескольких фармакофорных фрагментов
[1-4].
ся одним из перспективных путей направленного
Наличие трех высокореакционноспособных цен-
синтеза биоактивных веществ [18-26]. К настоя-
тров - лактамного атома азота, кетонной группы и
щему времени имеется небольшое число работ по
положения 5 гетероцикла - делает изатин удобной
синтезу и исследованию биологической активно-
платформой для такой молекулярной модифика-
сти производных изатина, содержащих моносаха-
ции с целью получения на его основе новых типов
ридный остаток как при эндоциклическом атоме
структур, обладающих различной физиологиче-
азота, так и на периферии заместителя (схема 1)
ской активностью [5-11]. В соответствии с этой
[27-34].
концепцией, в последние годы стало развиваться
Основываясь на полученных ранее данных по
направление поиска биоактивных соединений, в
особенностям получения и исследованию биоло-
которых связующим звеном изатина с фармако-
гической активности водорастворимых гидразо-
форным фрагментом является 1,2,3-триазол. Пока-
нов изатина [35-40], в данной работе предложен
зано, что многие соединения этого типа проявля-
двухстадийный синтез новых производных иза-
ют различные виды активности: противораковую,
тина, содержащих фрагменты рибозы и глюкуро-
антитуберкулезную, антимикробную, антидиабе-
новой кислоты. На первом этапе по реакции азид-
1010
СИНТЕЗ ГЛИКОКОНЪЮГАТОВ ТРИАЗОЛИЛИЗАТИНОВ
1011
Схема 1.
S
Ar
NHR
NH
OSO3
N
N
NH
N
O
OAc
S
O
O
O
R
O
OAc
N
N
O
OH
N
O
O
OAc
N
AcO
N N
AcO
H
OH
HO
OAc
HO
AcO
Антималярийная активность
Глюкоизатизины (алкалоиды)
Антибактериальная активность
Схема 2.
AcO
O
O
N3
R
AcO
OAc
OAc
O
O
O
N
R
CuSO4 (1 экв.),
OAc
AscNa (1 экв.)
N
O
t-BuOH, H2O (1:1),
N N
OAc
N
OAc
40°C, 24 ч
AcO
OAc
O
4-6
R
1-3
N3
O
COOMe
OAc
O
AcO
OAc
N
N O
COOMe
N N
7-9
R = H (1, 4, 7), OMe (2, 5, 8), F (3, 6, 9).
алкинного циклоприсоединения были получены с
этот сигнал смещен в более слабое поле (8.47 м. д.).
высокими выходами гликотриазолилизатины 4-9,
О сохранении в молекулах соединений 4-6 и 7-9
содержащие в положении 5 заместители различ-
всех ацетильных групп и метоксикарбонильной
ной природы (схема 2).
группы свидетельствует наличие трех сингле-
Строение и состав новых соединений одно-
тов в области 2.05-2.11 м. д. и четырех в области
значно доказан с помощью спектроскопии ЯМР,
1.54-2.07 м. д. соответственно. Аномерные прото-
ИК спектроскопии и масс-спектрометрии, состав
ны полученных соединений резонируют в области
подтвержден элементным анализом. Так, в спек-
5.88-6.34 м. д. в виде единственных дублетов с
трах ЯМР 1Н изатинов 4-9 в области слабого поля
КССВ 3JНН 3.5-3.6 Гц в случае рибофуранозиль-
присутствуют сигналы протонов бензофрагмента
ных и 8.9-9.3 Гц в случае глюкопирануронатных
и интенсивный синглет, относящийся к единствен-
производных, что говорит о сохранении β-ори-
ному протону триазольного цикла. Следует отме-
ентации аномерного центра всех полученных со-
тить, что в спектрах производных 4-7, 9, зареги-
единений. Кроме того, в спектрах ЯМР 13С при-
стрированных в дейтерохлороформе, этот сигнал
сутствуют слабопольные сигналы атомов углерода
проявляется в области 7.81-7.95 м. д., а в спектре
карбонильных групп: пять для рибозильных про-
соединения 8, зарегистрированном в ДМСО-d6,
изводных и шесть для глюкуроновых.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1012
БОГДАНОВ и др.
Схема 3.
O
O
O NR23
R1
OAc
NR23
Cl
O
H2NHN
N
NH Cl
O
N
EtOH, 78°C
R
OAc
OAc
N
TFA
O
O
N N
OAc
N
OAc
4-6
N
N N
OAc
10-13
R1 = H, NR23 = NMe3 (10); R1 = OMe, NR23 = NMe3 (11); R1 = F, NR23 = NMe3 (12); R1 = H, NR23 =
N
(13).
Схема 4.
O
O
O NR23
R1
COOMe
NR23 Hlg
O
H2NHN
N
NH Hlg
N
O
OAc
R
EtOH, 78°C
COOMe
N
TFA
O
OAc
O
N N
N
OAc
AcO
7-9
N
OAc
N N
AcO
14-17
R1 = H, NR23 = NMe3, Hlg = Cl (14); R1 = OMe, NR23 = NMe3, Hlg = Cl (15); R1 = F, NR23 = NMe3, Hlg = Cl (16);
R1 = H, NR23 = NMeEt2, Hlg = Br (17).
С целью получения водорастворимых произ-
связи C=N [41-43], их соотношение установить не
водных изатина по реакции конденсации регентов
представилось возможным по причине совпаде-
Жирара Т и Р с триазолилизатинами 4-6 нами был
ния химических сдвигов всех сигналов в спектрах
осуществлен синтез ацилгидразонов 10-13, содер-
ЯМР 1Н и 13С. О наличии обоих изомеров свиде-
жащих фрагмент ацилированной рибозы (схема 3).
тельствует лишь уширение некоторых сигналов:
Для оценки взаимосвязи строения углеводного
метиленовых протонов гидразонного заместителя,
остатка с биологической активностью в описан-
протона триазола и в положении 4 оксиндольного
ных выше условиях были получены производные
цикла.
14-17, содержащие метилглюкуронатный фраг-
К нашему удивлению, полученные соли 10-17
мент (схема 4). Здесь следует отметить, что по
не проявили значимой антимикробной активно-
сравнению с рибозильными производными рас-
сти как в отношении грамположительных и гра-
творимость соединений 14-17 в воде оказалась
мотрицательных бактерий (Staphylococcus aureus,
значительно ниже.
Bacillus cereus, Escherichia coli, Pseudomonas
Несмотря на возможность существования со-
aeruginosa,
Aspergillus
niger,
Trichophyton
единений 10-17 в растворе в виде смеси цис- и
mentagrophytes), так и против дрожжеподобно-
транс-изомеров относительно экзоциклической
го патогенного гриба Candida albicans. Вместе с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СИНТЕЗ ГЛИКОКОНЪЮГАТОВ ТРИАЗОЛИЛИЗАТИНОВ
1013
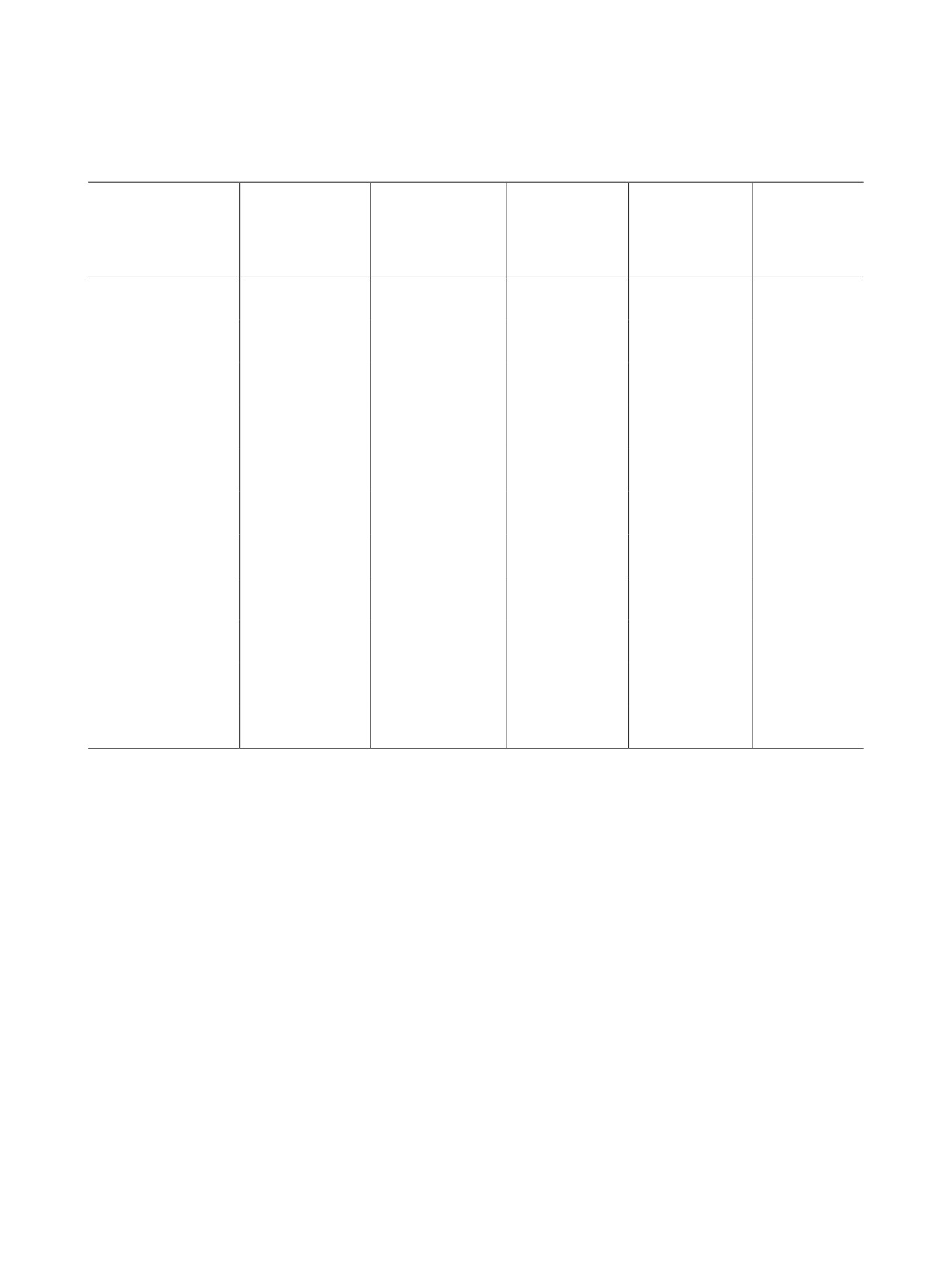
Таблица 1. Влияние соединений 10-17 на показатели агрегации тромбоцитов и коагуляционное звено гемостаза
(медианаа 0.25-0.75)
Время
Максимальная
Скорость
достижения
Удлинение
АПТВб, % к
Соединение
амплитуда, % к
агрегации, % к
максимальной
lag-периода, с
контролю
контролю
контролю
амплитуды, % к
контролю
10
-13.7
-27.1
-62.5
+83.3 (76.4-89.2)
+7.5 (3.7-9.6)в, и
д, е, з
(12.5-16.4)в, г, д
(22.3-30.2)г, е, ж
(58.7-65.3)д, е, з
11
-6.4 (5.3-8.2)в, г, д
-4.3
–12.5
+14.7 (12.5-16.1)
+4.2 (3.1-5.7)и
в, ж
(3.2-5.3)г, д
(8.4-14.3)в, ж
12
-2.3 (1.4-4.2)д
-3.3
–18.7
+38.9 (35.4-42.3)
+3.1 (2.5-4.8)и
(1.7-6.4)г, д
(14.5-23.1)в, г, ж
е, з
13
-23.6
–42.8
-61.7
-35.9 (31.4-40.2)
+8.7
д, е, з
(20.1-28.9)д, е, з
(38.5-44.3)е, з
(56.9-64.2) д, е, з
(6.4-10.5)в, и
14
-3.4 (2.7-4.5)д
-1.5
–24.1 (20.4-25.6)
+43.5 (40.1-47.6)
+2.7 (1.9-3.4)и
г, е, ж
е, з
(1.1-3.4) д, з
15
-21.4 (20.8-24.6)
–34.2
-44.9
+35.1 (32.4-39.7)
+9.2
д, е, з
е, з
(31.2-37.6)е, ж, з
(40.3-46.2)е, ж, з
(7.5-12.6)в, и
16
-3.1 (2.7-4.5)д
-1.7
–32.3 (30.1-37.5)
+55.7 (47.4-60.3)
+8.5
е, з
е, ж, з
(1.2-2.6)д, з
(6.7-11.9)в, и
17
-12.5 (9.4-15.3)в, г, д
-22.2
–36.4 (34.5-38.9)
+11.6 (8.7-13.5)в, ж
+11.3
е, з
(18.7-24.3)г, е, ж
(8.7-13.4)в, и
Ацетилсалициловая
–2.1 (1.1-2.6)
-13.7 (10.8-16.4)в
-10.5 (7.6-12.3)в
+10.5 (8.7-13.4)в
-
кислота
Пентоксифиллин
+32.4 (28.7-35.6)е, з
-48.4 (42.7-56.5)е, з
-34.9 (28.7-39.6)е
+32.1 (27.6-36.4)
-
г,е
Гепарин натрия
-
-
-
-
+20.3
(19.7-21.4)
а Медиана - среднее значение. б АПТВ - активированное парциальное тромбопластиновое время, число повторностей n = 6. в p ≤
0.05 в сравнении с контролем. г p ≤ 0.05 в сравнении с ацетилсалициловой кислотой. д p ≤ 0.001 в сравнении с пентоксифилли-
ном. е p ≤ 0.001 в сравнении с контролем. ж p ≤ 0.05 в сравнении с пентоксифиллином. з p ≤ 0.001 в сравнении с ацетилсалици-
ловой кислотой. и p ≤ 0.05 в сравнении с гепарином натрия.
тем, исследование гемолитической активности
не включали определение их влияния на систему
изатинов 4-9 и ацилгидразонов 10-17 указало на
гемостаза [44, 45]. Таким образом, при определе-
отсутствие гемотоксичности, за исключением ме-
нии целевого типа биологической активности но-
токсильных производных 11 и 15. Для этих соеди-
вых соединений представлялось целесообразным
нений максимальная степень гемолиза составила
также изучить их антиагрегационную и антикоа-
7.8% при концентрации 125 мк/мл.
гулянтную активности. Нами были исследованы
При поиске и разработке новых кандидатов в
антиагрегационная и антикоагулянтная активно-
сти аммониевых солей 10-17. Полученные данные
лекарственные средства важны не только их эф-
(табл. 1) указали на отсутствие негативного влия-
фективность и низкая токсичность, но и определе-
ние возможности проявления побочных эффектов.
ния новых соединений на систему гемостаза.
Имеются данные об изъятии с рынка некоторых
Соединения 10, 15, 17 проявили антиагрегаци-
препаратов, клинические исследования которых
онную активность бóльшую, чем у ацетилсалици-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1014
БОГДАНОВ и др.
ловой кислоты, а пиридиниевая соль 13 превосхо-
гилизатина 1-3 и соответствующего азида в сме-
дила по уровню антиагрегационной активности
си трет-бутанол-вода (1:1) прибавляли последо-
и пентоксифиллин. Следует отметить, что аце-
вательно раствор CuSO4 (5 ммоль) в 2 мл воды и
тилсалициловая кислота не влияет на латентный
аскорбата Na (5 ммоль) в 2 мл воды. Реакционную
период агрегации тромбоцитов, индуцированной
массу перемешивали 24 ч на водяной бане при
коллагеном, однако все активные из впервые син-
40°С. Затем раствор концентрировали при пони-
тезированных соединений сокращали lag-период
женном давлении, остаток обрабатывали водой
в диапазоне значений 12.4-21.5% относительно
и экстрагировали дихорметаном. Органический
контроля (т. е. влияют на реакцию высвобождения
слой сушили MgSO4. Соединения 4-9 получали в
тромбоцитов). При этом все изученные соедине-
чистом виде после удаления растворителя.
ния снижают скорость агрегации тромбоцитов,
1-{[1-(2′,3′,5′-Три-O-ацетил-β-D-рибофура-
увеличивая время достижения максимальной ам-
нозил)-1H-1,2,3-триазол-4-ил]метил}-1H-ин-
плитуды (за исключением соединения 13). Соеди-
дол-2,3-дион (4). Выход 82%, т. пл. 90°С. ИК спектр,
нения 10, 13, 15, 17 проявили антикоагуляционную
ν, см-1: 3245, 2939, 1742, 1614, 1471, 1436, 1371,
активность, однако она составила меньше 10, и по
1227, 1108, 1042. Спектр ЯМР 1Н (СDCl3), δ, м. д.:
данной активности они уступали гепарину натрия.
2.05 с (3Н, CH3), 2.10 с (3Н, CH3), 2.11 с (3Н, CH3),
Таким образом, отсутствие гемотоксичности
4.22 д. д (1Н, CH2O, А-часть АВ-системы, 2JНН
и высокая антиагрегационная и антикоагулянт-
12.4, 3JНН 4.4 Гц), 4.34 д. д (1Н, CH2O, В-часть
ная активности новых гликозилсодержащих иза-
АВ-системы, 2JНН 12.4, 3JНН 3.0 Гц), 4.44-4.48
тин-3-ацилгидразонов создают предпосылки для
м (1Н, CH), 5.03 с (2Н, NCH2, АВ-система, 2JНН
дальнейшего поиска эффективных антираковых
20.8 Гц), 5.56 д. д (1Н, CH, 3JНН 5.4, 3JНН 5.4 Гц), 5.78
или противовирусных агентов на основе данных
д. д (1Н, CH, 3JНН 5.3, 3JНН 3.6 Гц), 6.11 д (1Н, CH,
гликоконъюгатов. Кроме того, для улучшения ан-
3JНН 3.6 Гц), 7.12 д. д. д (1Н, Н5, 3JНН 7.5, 3JНН 7.5,
тимикробной активности подобных водораствори-
4JНН 0.6 Гц), 7.31 д. д (1Н, Н7, 3JНН 8.5, 4JНН 0.6 Гц),
мых аммониевых солей стала очевидна необходи-
7.58-7.60 м (2Н), 7.83 с (1Н, СН=). Спектр ЯМР
мость глубокого дизайна их структур путем более
13С (СDCl3), δC, м. д.: 20.38 (СН3), 20.41 (СН3), 20.6
широкого варьирования как заместителей в бензо
(СН3), 35.2 (СН2), 62.7 (СН), 70.6 (СН), 74.4 (СН),
фрагменте гетероцикла, так и строения углеводно-
90.3 (СН), 111.4 (СН), 117.6, 122.5 (СН), 124.1
го остатка.
(СН), 125.4 (СН), 138.6 (СН), 142.3, 150.1, 158.0,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
169.2, 169.4, 170.3, 182.9. Масс-спектр (MALDI),
m/z: 509 [M + Na]+. Найдено, %: C 54.23; H 4.39; N
ИК спектры записывали на спектрометре
11.42. C22H22N4O9. Вычислено, %: C 54.32; H 4.56;
Bruker Vector-22 для суспензий веществ в пластин-
N 11.52.
ках KBr. Спектры ЯМР 1H и 13C регистрировали
на приборе Bruker Avance-400 (400 и 100.6 МГц
5-Метокси-1-{[1-(2′,3′,5′-три-O-ацетил-β-D-
соответственно) и Bruker Avance-600
(600 и
рибофуранозил)-1H-1,2,3-триазол-4-ил]метил}-
150 МГц соответственно). Значения химических
1H-индол-2,3-дион (5). Выход 93%, т. пл. 153°С.
сдвигов приведены относительно остаточных сиг-
ИК спектр, ν, см-1: 3240, 2941, 1740, 1616, 1474,
налов дейтерированного растворителя. Масс-спек-
1436, 1377, 1222, 1111, 1040. Спектр ЯМР 1Н
тры MALDI регистрировали на масс-спектро-
(СDCl3), δ, м. д.: 2.06 с (3Н, CH3), 2.11 с (6Н, 2CH3),
метре UltraFlex III TOF/TOF. Масс-спектры ESI
3.79 с (3Н, ОCH3), 4.22 д. д (1Н, CH2O, А-часть
регистрировали на масс-спектрометре Amazon X
АВ-системы, 2JНН 12.4, 3JНН 4.4 Гц), 4.36 д. д
(Bruker Daltonik GmbH, Bremen, Germany). Тем-
(1Н, CH2O, В-часть АВ-системы, 2JНН 12.4, 3JНН
пературы плавления измеряли на приборе SMP10
3.0 Гц), 4.45-4.48 м (1Н, CH), 5.03 с (2Н, NCH2,
Stuart, элементный анализ проведен с использова-
АВ-система, 2JНН 21.5 Гц), 5.56 д. д (1Н, CH, 3JНН
нием анализатора CHNS-3.
5.5, 3JНН 5.5 Гц), 5.78 д. д (1Н, CH, 3JНН 5.2, 3JНН
Общая методика синтеза изатинов 4-9. К
3.6 Гц), 6.10 д (1Н, CH, 3JНН 3.6 Гц), 7.13-7.16 м
смеси эквимольных (5 ммоль) количеств пропар-
(2Н), 7.24 д (1Н, Н7, 3JНН 9.0 Гц), 7.81 с (1Н, СН=).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СИНТЕЗ ГЛИКОКОНЪЮГАТОВ ТРИАЗОЛИЛИЗАТИНОВ
1015
Спектр ЯМР 13С (ДМСО-d6), δC, м. д.: 20.16 (СН3),
5-Метокси-1-{[1-(2′,3′,4′-три-O-ацетил-
20.22 (СН3), 34.8 (СН3), 40.0 (СН2), 55.9 (СН3), 62.4
5′-метоксикарбонил-β-D-глюкопиранозил)-
(СН2), 70.1 (СН), 73.3 (СН), 79.8 (СН), 89.0 (СН),
1H-1,2,3-триазол-4-ил]метил}-1Н-индол-2,3-ди-
109.2 (СН), 112.2 (СН), 118.1, 123.7 (СН), 123.8
он (8). Выход 87%, т. пл. 171°С. ИК спектр, ν, см-1:
(СН), 142.1, 143.9, 155.8, 157.8, 169.1, 169.4, 169.8,
3135, 2955, 1753, 1627, 1600, 1492, 1439, 1376,
183.2. Масс-спектр (MALDI), m/z: 517 [M + H]+,
1223, 1112, 1041. Спектр ЯМР 1Н (ДМСО-d6),
539 [M + Na]+, 555 [M + K]+. Найдено, %: C 53.34;
δ, м. д.: 1.68 с (3Н, CH3), 1.94 с (3Н, CH3), 1.98 с
H 4.50; N 10.69. C23H24N4O10. Вычислено, %: C
(3Н, CH3), 3.59 с (3Н, CH3), 3.73 с (3Н, CH3), 4.73
53.49; H 4.68; N 10.85.
д (1Н, CH, 3JНН 10.0 Гц), 4.94 с (2Н, NCH2), 5.17 д.
д (1Н, CH, 3JНН 9.7, 3JНН 9.6 Гц), 5.54 д. д (1Н, CH,
5-Фтор-1-{[1-(2′,3′,5′-три-O-ацетил-β-D-
рибофуранозил)-1H-1,2,3-триазол-4-ил]ме-
3JНН 9.5, 3JНН 9.2 Гц), 5.60 д. д (1Н, CH, 3JНН 9.6,
тил}-1Н-индол-2,3-дион (6). Выход 83%, т. пл.
3JНН 9.1 Гц), 6.31 д (1Н, CH, 3JНН 8.9 Гц), 6.97 д (1Н,
Н7, 3JНН 8.6 Гц), 7.13 д (1Н, Н4, 4JНН 2.6 Гц), 7.18 д.
113°С. ИК спектр, ν, см-1: 3223, 2945, 1750, 1618,
1468, 1434, 1370, 1228, 1123, 1040. Спектр ЯМР
д (1Н, Н5, 3JНН 8.6, 4JНН 2.6 Гц), 8.47 с (1Н, СН=).
1Н (СDCl3), δ, м. д.: 2.07 с (3Н, CH3), 2.11 с (6Н,
Спектр ЯМР 13С (ДМСО-d6), δC, м. д.: 20.0 (СН3),
20.4 (СН3), 20.5 (СН3), 35.2 (СН2), 53.0 (СН3), 56.3
2CH3), 4.22 д. д (1Н, CH2O, А-часть АВ-системы,
2JНН 12.4, 3JНН 4.5 Гц), 4.36 д. д (1Н, CH2O, В-часть
(СН3), 68.7 (СН), 70.1 (СН), 71.7 (СН), 73.2 (СН),
АВ-системы, 2JНН 12.4, 3JНН 3.0 Гц), 4.45-4.49
84.0 (СН), 109.6 (СН), 112.5 (СН), 118.3, 123.4
м (1Н, CH), 5.03 с (2Н, NCH2, АВ-система, 2JНН
(СН), 124.3 (СН), 142.7, 144.0, 156.2, 158.2, 166.9,
20.4 Гц), 5.56 д. д (1Н, CH, 3JНН 5.5, 3JНН 5.5 Гц),
168.7, 169.8, 169.9, 183.6. Масс-спектр (MALDI),
5.78 д. д (1Н, CH, 3JНН 5.2, 3JНН 3.5 Гц), 6.11 д (1Н,
m/z: 597 [M + Na]+. Найдено, %: C 52.09; H 4.43; N
CH, 3JНН 3.5 Гц), 7.29-7.34 м (3Н), 7.83 с (1Н, СН=).
9.67. C25H26N4O12. Вычислено, %: C 52.27; H 4.56;
Масс-спектр (MALDI), m/z: 527 [M + Na]+. Найде-
N 9.75.
но, %: C 52.23; H 4.09; N 11.00. C22H21FN4O9. Вы-
5-Фтор-1-{[1-(2′,3′,4′-три-O-ацетил-5′-ме-
числено, %: C 52.38; H 4.20; N 11.11.
токсикарбонил-β-D-глюкопиранозил)-1H-1,2,3-
1-{[1-(2′,3′,4′-Три-O-ацетил-5′-метоксикар-
триазол-4-ил]метил}-1Н-индол-2,3-дион
(9).
бонил-β-D-глюкопиранозил)-1H-1,2,3-триа-
Выход 84%, т. пл. 230°С. ИК спектр, ν, см-1: 3117,
зол-4-ил]метил}-1Н-индол-2,3-дион (7). Выход
2958, 1749, 1622, 1488, 1465, 1375, 1216, 1168,
91%, т. пл. 210°С. ИК спектр, ν, см-1: 3116, 2959,
1119, 1046. Спектр ЯМР 1Н (СDCl3), δ, м. д.: 1.79 с
1750, 1760, 1613, 1472, 1438, 1375, 1246, 1217,
(3Н, CH3), 2.05 с (3Н, CH3), 2.07 с (3Н, CH3), 3.77
1114, 1042. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
с (3Н, CH3), 4.32 д (1Н, CH, 3JНН 9.8 Гц), 5.02 д
1.69 с (3Н, CH3), 1.96 с (3Н, CH3), 2.00 с (3Н, CH3),
(1Н, NCHa, 2JНН 15.7 Гц), 5.07 д (1Н, NCHa, 2JНН
3.61 с (3Н, CH3), 4.77 д (1Н, CH, 3JНН 10.0 Гц),
15.7 Гц), 5.36 д. д (1Н, CH, 3JНН 9.6, 3JНН 9.5 Гц),
4.98 с (2Н, NCH2), 5.19 д. д (1Н, CH, 3JНН 9.7, 3JНН
5.37 д. д (1Н, CH, 3JНН 9.4, 3JНН 9.3 Гц), 5.48 д. д
9.6 Гц), 5.57 д. д (1Н, CH, 3JНН 9.4, 3JНН 9.3 Гц),
(1Н, CH, 3JНН 9.3, 3JНН 9.2 Гц), 5.88 д (1Н, CH, 3JНН
5.62 д. д (1Н, CH, 3JНН 9.3, 3JНН 9.2 Гц), 6.34 д (1Н,
9.3 Гц), 7.21 д. д (1Н, Н7, 3JНН 8.7, 4JFН 3.7 Гц),
CH, 3JНН 9.1 Гц), 7.06 д (1Н, Н7, 3JНН 7.9 Гц), 7.13 д.
7.30-7.33 м (2Н, Н4, Н6), 7.95 с (1Н, СН=). Спектр
д (1Н, Н5, 3JНН 7.4, 3JНН 7.4 Гц), 7.57 д (1Н, Н4, 3JНН
ЯМР 13С (СDCl3), δC, м. д.: 20.0 (СН3), 20.4 (СН3),
7.1 Гц), 7.61 д. д (1Н, Н6, 3JНН 7.6, 3JНН 7.3 Гц), 8.52
20.5 (СН3), 35.4 (СН2), 53.2 (СН3), 68.9 (СН), 70.3
с (1Н, СН=). Спектр ЯМР 13С (ДМСО-d6), δC, м.д.:
(СН), 71.6 (СН), 75.0 (СН), 85.6 (СН), 112.3 д (С4,
19.8 (СН3), 20.2 (СН3), 20.3 (СН3), 35.0 (СН2), 52.7
2JFC 24.3 Гц), 112.7 д (С7, 3JFC 7.1 Гц), 118.3 д (С3a,
(СН3), 68.5 (СН), 69.9 (СН), 71.5 (СН), 73.0 (СН),
3JFC 7.1 Гц), 121.8 (СН), 124.7 д (С6, 2JFC 24.0 Гц),
83.8 (СН), 111.1 (СН), 117.7, 123.2 (СН), 123.6 (СН),
142.4, 146.1 д (С7a, 4JFC 1.7 Гц), 157.7 д (С2, 5JFC
124.6 (СН), 138.2 (СН), 142.4, 150.0, 157.9, 166.6,
1.1 Гц), 159.5 д (С5, 1JFC 246.1 Гц), 166.0, 168.6,
168.4, 169.4, 169.6, 183.1. Масс-спектр (MALDI),
169.2, 169.6, 182.3 д (С3, 4JFC 1.8 Гц). Масс-спектр
m/z: 567 [M + Na]+, 583 [M + K]+. Найдено, %: C
(MALDI), m/z: 585 [M + Na]+, 601 [M + K]+. Найде-
52.89; H 4.36; N 10.19. C24H24N4O11. Вычислено,
но, %: C 51.02; H 4.01; N 9.79. C24H23FN4O11. Вы-
%: C 52.94; H 4.44; N 10.29.
числено, %: C 51.25; H 4.12; N 9.96.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1016
БОГДАНОВ и др.
Общая методика синтеза ацилгидразонов
Хлорид
2-[2-(1-{[1-(2′,3′,5′-три-O-ацетил-β-
10-17. К смеси эквимольных (5 ммоль) количеств
D-рибофуранозил)-1H-1,2,3-триазол-4-ил]ме-
производного изатина и
1,2,3-тиадиазолилкар-
тил}-5-фтор-2-оксоиндолин-3-илиден)гидрази-
богидразида в 5 мл свежеперегнанного над BaO
нил]-N,N,N-триметил-2-оксоэтиламмония (12).
этанола добавляли 3 капли трифторуксусной кис-
Выход 90%, т. пл. 138-140°С. ИК спектр, ν, см-1:
лоты. Реакционную массу нагревали при кипении
3354, 3231, 3024, 2929, 1749, 1692, 1624, 1483,
растворителя в течение 3 ч. После самопроизволь-
1373, 1232, 1158, 1044. Спектр ЯМР 1Н (СDCl3), δ,
ного охлаждения раствора до комнатной темпера-
м. д.: 1.97 с (3Н, CH3), 1.98 с (3Н, CH3), 2.06 с (3Н,
туры осадок отфильтровывали, промывали абсо-
CH3), 3.63 с (9Н, 3CH3), 4.33 д (2Н, ОCH2, 3JНН
лютным диэтиловым эфиром и сушили в вакууме
11.5 Гц), 4.42 c (2Н, NCH2), 4.92-4.96 м (1Н, CH),
12 мм рт. ст.
5.35-5.39 м (1Н, CH), 5.56-5.58 м (1Н, CH), 5.75-
Хлорид
2-[2-(1-{[1-(2′,3′,5′-три-O-ацетил-
5.80 м (1Н, CH), 6.13 c [2Н, CH2С(О)], 7.05-7.09 м
β-D-рибофуранозил)-1H-1,2,3-триазол-4-ил]-
(2Н, Н7, Н6), 7.42-7.46 м (1Н, Н4), 7.97 с (1Н, СН=),
метил}-2-оксоиндолин-3-илиден)гидрази-
12.46 с (1Н, NН). Спектр ЯМР 13С (ДМСО-d6), δC,
нил]-N,N,N-триметил-2-оксоэтиламмония (10).
м. д.: 20.2 (СН3), 20.3 (СН3), 21.0 (СН3), 34.5 (СН2),
Выход 82%, т. пл. 168°С. ИК спектр, ν, см-1: 3368,
53.5 (СН3), 61.7 (СН2), 62.4 (СН2), 70.1 (СН), 73.3
3219, 3025, 2939, 1721, 1685, 1615, 1470, 1370,
(СН), 79.8 (СН), 89.0 (СН), 108.1 (СН), 112.1 (CH),
1231, 1154, 1106, 1042. Спектр ЯМР 1Н (ДМСО-d6),
118.4 (СН), 120.1, 123.9 (СН), 134.5, 139.3, 141.6,
δ, м. д.: 1.91 с (3Н, CH3), 1.96 с (3Н, CH3), 2.00 с
158.8 д (С5, 1JFC 239.6 Гц), 160.1, 166.3, 169.2,
(3Н, CH3), 3.36 с (9Н, 3CH3), 4.34 д (2Н, ОCH2,
169.4, 169.8. Масс-спектр (MALDI), m/z: 618 [M -
3JНН 5.3 Гц), 4.70-4.71 м (1Н, CH), 4.77-4.78 м (1Н,
Cl]+. Найдено, %: C 49.41; H 4.88; Cl 5.37; N 14.87.
CH), 4.88-4.89 м (1Н, CH), 4.92 уш. д (1Н, CH, 3JНН
C27H33ClFN7O9. Вычислено, %: C 49.58; H 5.09; Cl
4.6 Гц), 5.02 c [2Н, CH2С(О)], 5.07 c (2Н, NCH2),
5.42; N 14.99.
7.19 д. д (1Н, Н5, 3JНН 7.7, 3JНН 7.7 Гц), 7.24 д (1Н,
Хлорид
1-{2-[2-(1-{[1-(2′,3′,5′-три-O-ацетил-
Н7, 3JНН 7.8 Гц), 7.44-7.49 м (1Н, Н6), 7.63-7.66 м
β-D-рибофуранозил)-1H-1,2,3-триазол-4-ил]-
(1Н, Н4), 8.19 с (1Н, СН=), 12.64 с (1Н, NН). Масс-
метил}-2-оксоиндолин-3-илиден)гидрази-
спектр (MALDI), m/z: 600 [M - Cl]+. Найдено, %: C
нил]-2-оксоэтил}пиридиния (13). Выход 90%,
50.80; H 5.20; Cl 5.41; N 15.29. C27H34ClN7O9. Вы-
т. пл. 168°С. ИК спектр, ν, см-1: 3403, 3227, 3138,
числено, %: C 50.98; H 5.39; Cl 5.57; N 15.41.
2969, 1747, 1691, 1636, 1615, 1490, 1470, 1374,
Хлорид
2-(2-{1-[1-(2′,3′,5′-три-O-ацетил-
1230, 1154, 1105, 1043. Спектр ЯМР 1Н (СDCl3), δ,
β-D-рибофуранозил)-1H-1,2,3-триазол-4-ил]-
м. д.: 2.01 с (3Н, CH3), 2.09 с (3Н, CH3), 2.10 с (3Н,
метил}-5-метокси-2-оксоиндолин-3-илиден)-
CH3), 4.15-4.19 м (1Н, CH), 4.37-4.40 м (2Н, CH2),
гидразинил]-N,N,N-триметил-2-оксоэтил-
4.94 c (2Н, NCH2), 5.59-5.61 м (1Н, CH), 5.79 уш. с
аммония (11). Выход 97%, т. пл. 210°С (разл.). ИК
(1Н, CH), 6.24 уш. с (1Н, CH), 6.67 c [2Н, CH2С(О)],
спектр, ν, см-1: 3402, 3186, 3016, 2963, 1749, 1685,
7.02-7.08 м (2Н, Н7, Н5), 7.25-7.27 м (1Н, Н6), 7.55-
1620, 1488, 1460, 1368, 1293, 1232, 1160, 1040.
7.58 м (1Н, Н4), 7.92-7.99 м (2Н, 3-Py), 8.31-8.37 м
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 1.91 с (3Н,
(1Н, 4-Py), 9.46-9.48 м (2Н, 2-Py), 8.05 с (1Н, СН=),
CH3), 1.94 с (3Н, CH3), 2.03 с (3Н, CH3), 3.34 с (9Н,
12.57 с (1Н, NН). Спектр ЯМР 13С (ДМСО-d6), δC,
3CH3), 3.80 с (3Н, CH3), 4.61-4.62 м (2Н, ОCH2),
м. д.: 20.2 (СН3), 20.6 (СН3), 21.0 (СН3), 34.5 (СН2),
4.98 c [2Н, CH2С(О)], 5.05 c (2Н, NCH2), 5.19-5.21
60.6 (СН2), 61.1 (СН2), 70.1 (СН), 73.3 (СН), 83.7
м (1Н, CH), 5.54 д. д (1Н, CH, 3JНН 5.9 Гц, 3JНН
5.8 Гц), 5.69 д. д
(1Н, CH, 3JНН 5.1 Гц, 3JНН
(СН), 91.7 (СН), 110.8 (СН), 118.6, 120.6 (СН),
5.0 Гц), 5.94 д (1Н, CH, 3JНН 5.3 Гц), 7.13 д. д (1Н,
123.4 (СН), 127.67, 127.70 (СН), 132.1 (СН), 135.1,
Н6, 3JНН 8.6, 4JНН 2.5 Гц), 7.20-7.23 м (2Н, Н7, Н4),
143.0, 146.2 (CH), 146.5 (CH), 146.6 (CH), 160.2,
8.38 с (1Н, СН=), 12.64 с (1Н, NН). Масс-спектр
167.5, 169.2, 169.6, 171.9. Масс-спектр (MALDI),
(MALDI), m/z: 630 [M - Cl]+. Найдено, %: C 50.32;
m/z: 620 [M - Cl]+. Найдено, %: C 52.90; H 4.47;
H 5.29; Cl 5.27; N 14.63. C28H36ClN7O10. Вычисле-
Cl 5.26; N 14.73. C29H30ClN7O9. Вычислено, %: C
но, %: C 50.49; H 5.45; Cl 5.32; N 14.72.
53.09; H 4.61; Cl 5.40; N 14.95.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СИНТЕЗ ГЛИКОКОНЪЮГАТОВ ТРИАЗОЛИЛИЗАТИНОВ
1017
Хлорид N,N,N-триметил-2-оксо-2-[2-(2-ок-
122.8 (СН), 135.0, 136.2, 141.9, 155.7, 159.8, 166.2,
со-1-{[1-(2′,3′,4′-три-O-ацетил-5′-метоксикар-
167.9, 168.9, 169.1, 169.2. Масс-спектр (MALDI),
бонил-β-D-глюкопиранозил)-1H-1,2,3-триазол-
m/z: 688 [M - Cl]+. Найдено, %: C 49.59; H 5.15;
4-ил]метил}индолин-3-илиден)гидразинил]-
Cl 4.78; N 13.46. C30H38ClN7O12. Вычислено, %: C
этиламмония (14). Выход 93%, т. пл. 200-202°С.
49.76; H 5.29; Cl 4.90; N 13.54.
ИК спектр, ν, см-1: 3400, 3215, 3128, 3009, 2960,
Хлорид N,N,N-триметил-2-оксо-2-[2-(2-оксо-
1760, 1680, 1616, 1471, 1455, 1367, 1290, 1222, 1152,
1-{[1-(2′,3′,4′-три-O-ацетил-5′-метоксикар-
1106, 1042. Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
бонил-β-D-глюкопиранозил)-1H-1,2,3-триа-
1.66 с (3Н, CH3), 1.94 с (3Н, CH3), 1.98 с (3Н,
зол-4-ил]метил}-5-фториндолин-3-илиден)-
CH3), 3.22 с (9Н, 3CH3), 3.59 с (3Н, CH3), 4.74 д
гидразинил]этиламмония (16). Выход 86%, т. пл.
(1Н, CH, 3JНН 10.1 Гц), 4.94 c [2Н, CH2С(О)], 5.04
192°С. ИК спектр, ν, см-1: 3402, 3233, 3122, 3022,
c (2Н, NCH2), 5.18 д. д (1Н, CH, 3JНН 9.8, 3JНН
2958, 1758, 1688, 1624, 1484, 1443, 1373, 1226,
9.7 Гц), 5.54 д. д (1Н, CH, 3JНН 9.5, 3JНН 9.5 Гц),
1157, 1106, 1042. Спектр ЯМР 1Н (ДМСО-d6), δ,
5.63 д. д (1Н, CH, 3JНН 9.4, 3JНН 9.3 Гц), 6.33 д (1Н,
м. д.: 1.67 с (3Н, CH3), 1.93 с (3Н, CH3), 1.96 с (3Н,
CH, 3JНН 9.2 Гц), 7.09 д (1Н, Н7, 3JНН 7.6 Гц), 7.16
CH3), 3.49 с (9Н, 3CH3), 3.61 с (3Н, CH3), 4.57 д
д. д (1Н, H5, 3JНН 7.5, 3JНН 7.4 Гц), 7.42 д. д (1Н,
(1Н, CH, 3JНН 10.1 Гц), 4.96 д (1Н, NCHa, 2JНН
H6, 3JНН 8.2, 3JНН 7.6 Гц), 7.64 уш. с (1Н, H4), 8.49 с
(1Н, СН=), 12.57 с (1Н, NН). Спектр ЯМР 13С (ДМ-
15.9 Гц), 5.01 д (1Н, NCHa, 2JНН 15.9 Гц), 5.15 c
СО-d6), δC, м. д.: 20.1 (СН3), 20.5 (СН3), 21.4 (СН3),
[2Н, CH2С(О)], 5.21 д. д (1Н, CH, 3JНН 9.7, 3JНН
34.8 (СН2), 53.1 (СН3), 54.1 (СН3), 63.3 (СН2), 68.8
9.6 Гц), 5.48 д. д (1Н, CH, 3JНН 9.3, 3JНН 9.2 Гц), 5.53
(СН), 70.1 (СН), 71.8 (СН), 73.3 (СН), 84.0 (СН),
д. д (1Н, CH, 3JНН 9.5, 3JНН 9.4 Гц), 6.21 д (1Н, CH,
110.9 (СН), 119.0, 121.5 (СН), 123.6 (СН), 123.9
3JНН 9.1 Гц), 7.01-7.05 м (2Н, Н6, Н7), 7.37-7.40 м
(СН), 132.6 (СН), 142.5, 143.1, 160.5, 166.5, 167.0,
(1Н, H4), 8.15 с (1Н, СН=), 12.60 с (1Н, NН). Масс-
168.8, 169.9, 170.0, 172.8. Масс-спектр (MALDI),
спектр (MALDI), m/z: 676 [M - Cl]+. Найдено, %:
m/z: 658 [M - Cl]+. Найдено, %: C 51.20; H 5.19;
C 48.80; H 4.78; Cl 4.87; N 13.59. C29H35ClFN7O11.
Cl 5.02; N 14.30. C29H36ClN7O10. Вычислено, %: C
Вычислено, %: C 48.91; H 4.95; Cl 4.98; N 13.77.
51.37; H 5.35; Cl 5.23; N 14.46.
Хлорид N,N-диэтил-N-метил-2-оксо-2-[2-(2-
Хлорид N,N,N-триметил-2-оксо-2-[2-(2-ок-
оксо-1-{[1-(2′,3′,4′-три-O-ацетил-5′-метокси-
со-1-{[1-(2′,3′,4′-три-O-ацетил-5′-метоксикар-
карбонил-β-D-глюкопиранозил)-1H-1,2,3-три-
бонил-β-D-глюкопиранозил)-1H-1,2,3-триа-
азол-4-ил]метил}индолин-3-илиден)гидрази-
зол-4-ил]метил}-5-метоксииндолин-3-илиден)-
нил]этиламмония (17). Выход 81%, т. пл. 168°С.
гидразинил]этиламмония (15). Выход 98%, т.
ИК спектр, ν, см-1: 3425, 3229, 3151, 2982, 2955,
пл. 161-163°С (разл.). ИК спектр, ν, см-1: 3434,
1758, 1717, 1690, 1616, 1470, 1441, 1377, 1219,
3215, 3010, 2957, 1758, 1688, 1551, 1488, 1439,
1156, 1106, 1040. Спектр ЯМР 1Н (ДМСО-d6), δ,
1370, 1293, 1218, 1168, 1124, 1041. Спектр ЯМР 1Н
м. д.: 1.30 т (6Н, 2N+СН2CH3, 3JНН 6.8 Гц), 1.70 с
(ДМСО-d6), δ, м. д.: 1.70 с (3Н, CH3), 1.96 с (3Н,
(3Н, CH3), 1.97 с (3Н, CH3), 2.01 с (3Н, CH3), 3.18-
CH3), 1.99 с (3Н, CH3), 3.25 с (9Н, 3CH3), 3.60 с
3.23 м (4Н, 2N+СН2CH3), 3.59-3.66 м (6Н, ОCH3,
(3Н, CH3), 3.77 с (3Н, CH3), 4.78 д (1Н, CH, 3JНН
N+CH3), 4.79 д (1Н, CH, 3JНН 10.0 Гц), 4.83 c [2Н,
9.9 Гц), 4.99 уш. c [2Н, CH2С(О)], 5.03 c (2Н,
CH2С(О)], 5.05-5.11 м (2Н, NCH2), 5.22 д. д (1Н,
NCH2), 5.20 д. д (1Н, CH, 3JНН 9.5, 3JНН 9.4 Гц), 5.57
CH, 3JНН 9.8, 3JНН 9.6 Гц), 5.59 д. д (1Н, CH, 3JНН
д. д (1Н, CH, 3JНН 9.6, 3JНН 9.5 Гц), 5.67 д. д (1Н,
9.9, 3JНН 9.4 Гц), 5.68 д. д (1Н, CH, 3JНН 9.7, 3JНН
CH, 3JНН 9.0, 3JНН 8.8 Гц), 6.37 д (1Н, CH, 3JНН 8.5
9.5 Гц), 6.38 д (1Н, CH, 3JНН 9.9 Гц), 7.14-7.21 м
Гц), 6.99-7.07 м (2Н, Н7, Н6), 7.15-7.22 м (1Н, H4),
8.52 с (1Н, СН=), 12.63 с (1Н, NН). Спектр ЯМР
(2Н, Н5, Н7), 7.45-7.47 м (1Н, Н6), 7.69 уш. с (1Н,
13С (ДМСО-d6), δC, м. д.: 19.5 (СН3), 19.89 (СН3),
H4), 8.54 с (1Н, СН=), 12.61 с (1Н, NН). Масс-
19.93 (СН3), 34.3 (СН2), 52.4 (СН3), 55.3 (СН3), 61.7
спектр (MALDI), m/z: 686 [M - Br]+. Найдено, %:
(СН2), 68.1 (СН), 69.5 (СН), 71.1 (СН), 72.6 (СН),
C 48.41; H 5.19; Br 10.22; N 12.67. C31H40BrN7O11.
83.4 (СН), 106.6 (СН), 111.3 (СН), 117.3 (СН), 119.2,
Вычислено, %: C 48.57; H 5.26; Br 10.42; N 12.79.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1018
БОГДАНОВ и др.
ИНФОРМАЦИЯ ОБ АВТОРАХ
6.
Brandao P., Marques C., Carreiro E.P., Pineiro M.,
Burke A.J. // Chem. Rec. 2021. Vol. 21. P. 1. doi
Богданов Андрей Владимирович, ORCID: http://
10.1002/tcr.202000167
orcid.org/0000-0002-2483-4742
7.
Xu Zh., Zhang Sh., Gao Ch., Fan J., Zhao F.,
Андреева Ольга Валерьевна, ORCID: http://
Lv Z.-Sh., Feng L.-Sh. // Chinese Chem. Lett. 2017.
Vol. 28. P. 159. doi 10.1016/j.cclet.2016.07.032
orcid.org/0000-0001-5518-8395
8.
Zhang Y.-Zh., Du H.-Zh., Liu H.-L., He Q.-S., Xu Z. //
Arch. Pharm. Chem. Life Sci. 2020. Vol. 353. e1900299.
org/0000-0002-0906-8226
doi 10.1002/ardp.201900299
Волошина Александра Дмитриевна, ORCID:
9.
Ding Zh., Zhou M., Zeng Ch. // Arch. Pharm. Chem.
Life Sci. 2020. Vol. 353. e1900367. doi 10.1002/
ardp.201900367
Еникеева Кадрия Ильдаровна, ORCID: http://
10.
Xu Zh., Zhang Sh., Gao Ch., Fan J., Zhao F.,
orcid.org/0000-0002-5995-2124
Lv Z.-Sh., Feng L.-Sh. // Chinese Сhem. Lett.
Самородов Александр Владимирович, ORCID:
2017. Vol. 28. P. 159. doi 10.1016/j.cclet.2016.07.032
11.
Guo H., Diao Q.-P. // Curr. Top. Med. Chem. 2020.
Vol. 20. P. 1499. doi 10.2174/1568026620666200310
БЛАГОДАРНОСТИ
124416
12.
Jiang D., Wang G.-Q., Liu X., Zhang Zh., Feng L.-Sh.,
Авторы выражают благодарность Коллектив-
Liu M.-L. // J. Heterocycl. Chem. 2018. Vol. 55. P. 1263.
ному спектро-аналитическому центру физико-
doi 10.1002/jhet.3189
химических исследований строения, свойств и со-
13.
Dhameja M., Gupta P. // Eur. J. Med. Chem. 2019.
става веществ и материалов Федерального иссле-
Vol. 176. P. 343. doi 10.1016/j.ejmech.2019.04.025
довательского центра «Казанский научный центр
14.
Xu Zh., Zhao Sh.-J., Liu Y. // Eur. J. Med. Chem. 2019.
Vol. 183. P. 111700. doi 10.1016/j.ejmech.2019.111700
Российской академии наук» за техническую под-
15.
Surur A.Sh., Huluka S.A., Mitku M.L., Asres K. // Drug
держку. Работа выполнена в рамках соглашения
Des. Dev. Ther. 2020. Vol. 14. P. 4855. 10.2147/DDDT.
о сотрудничестве между Федеральным исследо-
S278588
вательским центром «Казанский научный центр
16.
Hou Y., Shang C., Wang H., Yun J. // Arch. Pharm.
РАН» и Башкирским государственным медицин-
Chem. Life. Sci. 2020. Vol. 353. P. 1900272. doi
ским университетом Министерства здравоохране-
10.1002/ardp.201900272
ния Российской Федерации.
17.
Song F., Li Zh., Bian Yu., Huo X., Fang Ju., Shao L.,
Zhou M. // Arch. Pharm. 2020. Vol. 353. P. e2000143.
КОНФЛИКТ ИНТЕРЕСОВ
doi 10.1002/ardp.202000143
В.Ф. Миронов является членом редколлегии
18.
He X.-P., Zeng Y.-L., Zang Y., Li J., Field R.A.,
Chen G.-R. // Carbohydrate Res. 2016. Vol. 429. P. 1.
Журнала общей химии. Остальные авторы заявля-
doi 10.1016/j.carres.2016.03.022
ют об отсутствии конфликта интересов.
19.
Jefferis R. // Nature Rev. Drug Discov. 2009. Vol. 8.
CПИСОК ЛИТЕРАТУРЫ
P. 226. doi 10.1038/nrd2804
20.
Jefferis R. // mAbs. 2009. Vol. 5. P. 638. doi 10.4161/
1. Design of hybrid molecules for drug development / Ed.
mabs.25631
M. Decker. Amsterdam: Elsevier, 2017. 352 p.
21.
Bednarska N.G., Wren B.W., Willcocks S.J. // Drug
2. Bosquesi P.L., Ferreira Melo Th.R., Vizioli E.O., dos
Discov. Today. 2017. Vol. 22. P. 919. doi 10.1016/j.
Santos J.L., Chung M.Ch. // Pharmaceuticals. 2011.
drudis.2017.02.001
Vol. 4. P. 1450. doi 10.3390/ph4111450
22.
Moradi Sh.V., Hussein W.M., Varamini P., Simerska P.,
3. Berube G. // Expert Opin. Drug Discov. 2016. Vol. 11.
Toth I. // Chem. Sci. 2016. Vol. 7. P. 2492. doi 10.1039/
P. 281. doi 10.1517/17460441.2016.1135125
c5sc04392a
4. Viegas-Junior C., Danuello A., da Silva Bolzani V.,
23.
Andreeva O.V., Belenok M.G., Saifina L.F., Shulae-
Barreiro E.J., Fraga C.A.M. // Curr. Med. Chem. 2007.
va M.M., Dobrynin A.B., Sharipova R.R., Voloshina A.D.,
Vol. 14. P. 1829. doi 10.2174/092986707781058805
Saifina A.F., Gubaidullin A.T., Khairutdinov B.I.,
5. Brandao P., Marques C., Burke A.J., Pineiro M. // Eur.
Zuev Y.F., Semenov V.E., Kataev V.E. // Tetrahedron
J. Med. Chem. 2021. Vol. 211. P. 113102. doi 10.1016/j.
Lett. 2019. Vol. 60. P. 151276. doi 10.1016/j.
ejmech.2020.113102
tetlet.2019.151276
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СИНТЕЗ ГЛИКОКОНЪЮГАТОВ ТРИАЗОЛИЛИЗАТИНОВ
1019
24.
Andreeva O.V., Garifullin B.F., Zarubaev V.V., Slita A.V.,
Sapunova A.S., Kulik N.V., Mironov V.F. // Russ.
Yesaulkova I.L., Saifina L.F., Shulaeva M.M., Bele-
J. Gen. Chem. 2019. Vol. 89. P. 1368. doi 10.1134/
nok M.G., Semenov V.E., Kataev V.E. // Mol. Divers.
S107036321907003X
2021. Vol. 25. P. 473. doi 10.1007/s1103 0-020-10141-y
36.
Богданов А.В., Зарипова И.Ф., Волошина А.Д.,
25.
Andreeva O.V., Garifullin B.F., Sharipova R.R.,
Стробыкина А.С., Кулик Н.В., Бухаров С.В., Миро-
Strobykina I.Yu., Sapunova A.S., Voloshina A.D.,
нов В.Ф. // ЖОХ 2018. Т. 88. С. 61; Bogdanov A.V.,
Belenok M.G., Dobrynin A.B., Khabibulina L.R., Kataev
Zaripova I.F., Voloshina A.D., Strobykina A.S.,
V.E. // J. Nat. Prod. 2020. Vol. 83. P. 2367. doi 10.1021/
Kulik N.V., Bukharov S.V., Mironov V.F. // Russ.
acs.jnatprod.0c00134
J. Gen. Chem. 2018. Vol. 88. P. 57. doi 10.1134/
26.
Андреева О.В., Сайфина Л.Ф., Беленок М.Г., Семе-
S1070363218010097
нов В.Э., Катаев В.Е. // ЖОрХ. 2021. Т. 57. С. 291.
37.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., Sapuno-
doi 10.31857/S0514749221020166; Andreeva O.V.,
va A.S., Kulik N.V., Voronina Ju.K., Mironov V.F. //
Saifina L.F., Belenok M.G., Semenov V.E., Kataev V.E. //
Chem. Biodiversity 2018. Vol. 15. P. 1800088. doi
Russ. J. Org. Chem. 2021. Vol. 57. P. 292. doi 10.1134/
10.1002/cbdv.201800088
S1070428021020226
38.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., Sapuno-
27.
Thakur R.K., Joshi P., Baranwal P., Sharma G.,
va A.S., Kulik N.V., Bukharov S.V., Voronina Ju.K.,
Shukla S.K., Tripathi R., Tripathi R.P. // Eur. J.
Vandyukov A.E., Mironov V.F. // ChemistrySelect 2019.
Med. Chem. 2018. Vol. 155. P. 764. doi 10.1016/j.
Vol. 4. P. 6162. doi 10.1002/slct.201901708
ejmech.2018.06.042
39.
Pashirova T.N., Bogdanov A.V., Zaripova I.F., Burilo-
28.
Blazevic I., Montaut S., Burcul F., Olsen C.E.,
va E.A., Vandyukov A.E., Sapunova A.S., Vandyuko-
Burow M., Rollin P., Agerbirk N. // Phytochemistry
va I.I., Voloshina A.D., Mironov V.F., Zakharova L.Ya. //
2020. Vol.
169. P.
112100. doi
10.1016/j.
J. Mol. Liq. 2019. Vol. 290. P. 111220. doi 10.1016/j.
phytochem.2019.112100
molliq.2019.111220
29.
Messaoudi S., Sancelme M., Polard-Housset V., Aboab B.,
40.
Богданов А.В., Кадомцева М.Е., Бухаров С.В., Во-
Moreau P., Prudhomme M. // Eur. J. Med. Chem. 2004.
лошина А.Д., Миронов В.Ф. // ЖОрХ. 2020. Т. 56.
Vol. 39. P. 453. doi 10.1016/j.ejmech.2004.01.001
С. 488; Bogdanov A.V., Kadomtseva M.E., Bukha-
30.
Kleeblatt D., Cordes Ch.A., Lebrenz Ph., Hein M.,
rov S.V., Voloshina A.D., Mironov V.F. // Russ. J.
Feist H., Matin A., Raza R., Iqbal J., Munshi O.,
Org. Chem. 2020. Vol. 56. P. 555. doi 10.1134/
Rahman Q., Villinger A., Langer P. // RSC Adv. 2014.
S107042802003032X
Vol. 4. P. 22828. doi 10.1039/c4ra02627f
41.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., Stroby-
31.
Kleeblatt D., Becker M., Plotz M., Schonherr M.,
kina A.S., Kulik N.V., Bukharov S.V., Voronina Ju.K.,
Villinger A., Hein M., Eberle J., Kunz M., Rahman Q.,
Khamatgalimov A.R., Mironov V.F. // Monatsh. Chem.
Langer P. // RSC Adv. 2015. Vol. 5. P. 20769. doi
2018. Vol. 149. P. 111. doi 10.1007/s00706-017-2049-y
10.1039/c4ra14301a
42.
Богданов А.В., Волошина А.Д., Хаматгалимов А.Р.,
32.
Kassab Sh.E., Hegazy G.H., Eid N.M., Amin K.M.,
Терехова Н.В., Миронов В.Ф. // Докл. Акад. наук.
El-Gendy A.A. // Nucleos. Nucleot. Nucl. Acids 2010.
2020. Т. 494. С. 15; Bogdanov A.V., Voloshina A.D.,
Vol. 29. P. 72. doi 10.1080/15257770903459267
Khamatgalimov A.R., Terekhova N.V., Mironov V.F. //
33.
Thakur R.K., Joshi P., Upadhyaya K., Singh K., Sharma G.,
Doklady Chem. 2020. Vol. 494. Part 1. P. 136. doi
Shukla S.K., Tripathi R., Tripathi R.P. // Eur. J.
10.1134/S0012500820090013
Med. Chem. 2019. Vol. 162. P. 448. doi 10.1016/j.
43.
Китаев Ю.П., Бузыкин Б.И., Троепольская Т.В. //
ejmech.2018.11.008
Усп. хим. 1970. Т. 39. С. 961; Kitaev Yu.P., Buzykin B.I.,
34.
Silva M., Goncalves J.C.O., Oliveira-Campos A.M.F.,
Troepol’skaya T.V. // Russ. Chem. Rev. 1970. Vol. 39.
Rodrigues L.M., Esteves A.P. // Synth. Commun. 2013.
P. 441. doi 10.1070/RC1970v039n06ABEH001999
Vol. 43. P. 1432. doi 10.1080/00397911.2011.637655
44.
Greener M. // EMBO Reports. 2005. Vol. 6. P. 202. doi
35.
Богданов А.В., Зарипова И.Ф., Мустафина Л.К.,
10.1038/sj.embor.7400353
Волошина А.Д., Сапунова А.С., Кулик Н.В., Миро-
45.
Schultze A.E., Walker D.B., Turk J.R., Tarrant J.M.,
нов В.Ф. // ЖОХ. 2019. Т. 89. С. 1004; Bogdanov A.V.,
Brooks M.B., Pettit S.D. // Toxicol. Pathol. 2013.
Zaripova I.F., Mustafina L.K., Voloshina A.D.,
Vol. 41. P. 445. doi 10.1177/019262331246092
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1020
БОГДАНОВ и др.
Synthesis of Triazolylisatins Glycoonjugates and Some
Ammonium Hydrazones on Their Basis
A. V. Bogdanova,*, O. V. Andreevaa, M. G. Belenoka, A. D. Voloshinaa, K. I. Enikeevab,
A. V. Samorodovb, and V. F. Mironova
a A.E. Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center
“Kazan Scientific Center of Russian Academy of Sciences”, Kazan, 420088 Russia
b Bashkir State Medical University, Ufa, 450000 Russia
*e-mail: abogdanov@inbox.ru
Received April 29, 2021; revised April 29, 2021; accepted May 23, 2021
The click reaction of propargylisatins with some azido-sugars was used to synthesize new isatin derivatives, in
which the carbohydrate residue is linked to the 2,3-dioxindole platform via the 1,2,3-triazole ring. A number
of water-soluble acylhydrazones with different structures of the cation center were obtained on their basis.
It was shown that the newly obtained compounds do not exhibit hemotoxic action and have a significant
antiaggregatory and anticoagulant activity at the level of reference drugs such as acetylsalicylic acid and
pentoxifylline.
Keywords: isatin, glycoconjugates, click reactions, hydrazones, antimicrobial activity, hemotoxicity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021