ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1027-1035
УДК 547.816;547.753
СТРОЕНИЕ И СВОЙСТВА 1,3,3-ТРИМЕТИЛ-
6′-ХЛОРСПИРО[ИНДОЛИНО-2, 2′-2Н-ХРОМЕНА]
© 2021 г. А. Д. Пугачевa,*, В. В. Ткачевb,c, С. М. Алдошинb, Н. И. Макароваa,
И. А. Ростовцеваa, А. В. Метелицаa, Н. В. Станкевичa, Г. В. Шиловb, Б. С. Лукьяновa
a Научно-исследовательский институт физической и органической химии Южного федерального университета,
пр. Стачки 194/2, Ростов-на-Дону, 344090 Россия
b Институт проблем химической физики Российской академии наук, Черноголовка, 142432 Россия
c Институт физиологически активных веществ Российской академии наук, Черноголовка, 142432 Россия
*e-mail: artem_d_pugachev@mail.ru
Поступило в Редакцию 6 мая 2021 г.
После доработки 2 июня 2021 г.
Принято к печати 5 июня 2021 г.
Осуществлен синтез и исследована структура спиропирана индолинового ряда, содержащего в качестве
σ-акцепторного заместителя атом хлора в положении 6′ 2Н-хроменовой части молекулы. Использование
перхлората 1,2,3,3-тетраметил-3H-индолия в качестве исходного соединения позволило достичь более
высоких значений выхода продукта по сравнению предыдущими исследованиями. Молекулярная струк-
тура соединения установлена методом рентгеноструктурного анализа. С использованием программного
пакета CrystalExplorer17 исследованы особенности кристаллического строения и межмолекулярных
взаимодействий. Впервые исследовано фотохромное поведение в растворе ацетонитрила. Установлено,
что мероцианиновая форма спиропирана характеризуется максимумом поглощения при 592 нм, что на
37 нм ближе к диапазону «биологического окна» по сравнению с нитрозамещенным аналогом.
Ключевые слова: спиропиран, фотохромизм, рентгеноструктурный анализ, индолин, 2Н-хромен
DOI: 10.31857/S0044460X21070064
Спиропираны представляют один из наиболее
исследования фотохромного поведения спиропи-
интересных классов органических соединений,
ранов были сосредоточены на спиропиранах, со-
молекулы которых могут претерпевать обратимую
держащих нитрогруппу в пара-положении к атому
изомеризацию между бесцветной спироцикличе-
кислорода 2H-хроменового фрагмента. Однако на-
ской и яркоокрашенной мероцианиновой форма-
личие в молекуле спиропирана нитрогруппы при-
ми под действием различных внешних факторов.
водит к вовлечению низколежащих триплетных
Этот процесс, в случае воздействия на спиропира-
возбужденных состояний молекулы в фотофизи-
ны светового излучения различного спектрального
ческий механизм фотоиндуцированных превра-
состава, получил название фотохромизма [1]. Фо-
щений и обусловливает их склонность к фото-
тохромные спиропираны могут быть использова-
деградации [8]. Поэтому поиск и исследование
ны в качестве легко настраиваемых молекулярных
спироциклических структур, модифицированных
переключателей в разных передовых отраслях на-
электроноакцепторными заместителями отличны-
уки и техники [2-4].
ми от нитрогруппы, является перспективным на-
правлением исследований [9].
Известно, что введение электроноакцептор-
ных заместителей в 2H-хроменовую часть моле-
Настоящая работа посвящена исследованию
кулы облегчает процессы фотоинициированного
индолинового спиропирана 1, содержащего в ка-
разрыва связи Cспиро-O [5-7]. Поэтому многие
честве σ-акцепторного заместителя в положении
1027
1028
ПУГАЧЕВ и др.
Схема 1.
O
OH
CH3
CH3
4
CH3
CH3
3'
4'
5
3
9
5'
CH3
+
2
2'
10'
+
∆
8
1
_
N
6
9'
ClO4
Et3N, i-PrOH
N
O
Cl
7
6'
CH
3
CH3
Cl
8'
7'
2
3
1
6′ атом хлора. Как известно, спиропираны с гало-
фрагмента, а атом водорода в положении 7′ прояв-
генными заместителями могут быть использованы
ляется дублетным сигналом при 6.63 м. д. с КССВ
в качестве прекурсоров для проведения реакций
9.3 Гц.
кросс-сочетания [10-13].
В спектре ЯМР 13С присутствуют сигналы
Целевое соединение было получено по моди-
всех атомов углерода. Их отнесение выполнено с
фицированному классическому методу синтеза
использованием методов HMBC и HSQC 1Н-13C.
спиропиранов, предложенному Вицингером [14].
Спектр ЯМР HSQC 1Н-13C позволил отнести ато-
Такой метод синтеза заключается в использовании
мы углерода, связанные с атомами водорода. Так,
перхлората 1,2,3,3-тетраметил-3H-индолия 2 вме-
сигналы атомов углерода при 25.12 и 25.83 м. д.
сто 1,3,3-триметил-2-метилениндолина (схема 1)
соответствуют гем-метильным группам, а при
[15], что позволило избежать образования побоч-
28.87 м. д. - метильной группе при атоме азота.
ного диконденсированного продукта [16] и приве-
Сигналы атомов углерода в положениях 3′ и 4′ рас-
ло к более высокому выходу (91.2% против 34%).
положены при 120.73 и 128.43 м. д. соответствен-
но. Ароматические атомы углерода индолинового
Строение соединения 1 подтверждено данными
фрагмента обнаруживаются при 106.83, 119.27,
ИК и ЯМР спектроскопии с применением двумер-
121.48 и 127.64 м. д., а 2H-хроменового - при
ных методик. В ИК спектре соединения 1, помимо
129.31, 126.13, 120.04 и 116.33 м. д. Четвертич-
характерных для спироциклических соединений
ные атомы углерода отнесены с помощью спектра
[17] полос поглощения C=C (1608 см-1), CAr-N
HMBC 1Н-13C.
(1261 см-1) и Cспиро-О (926 см-1), присутствует по-
лоса поглощения связи С-Сl (746 см-1).
В спектре ЯМР 15N имеется сигнал атома азо-
та при 91.14 м. д. Исследование методом HMBC
Исследование строения соединения 1 методом
1Н-15N позволило обнаружить корреляцию сигна-
ЯМР 1Н показало, что ввиду выраженной магнит-
ной неэквивалентности гем-диметильных групп
ла атома азота с сигналами ароматических атомов
водорода в положениях 3′, 4′, 4, 6 и 7, а также с
гетареновой части их атомы водорода проявляют-
трехпротонным сигналом N-метильной группы
ся двумя трехпротонными синглетными сигнала-
ми (1.16 и 1.29 м. д.). Характерные сигналы прото-
при 2.71 м. д.
нов в положениях 3′ и 4′ наблюдаются при 5.73 и
Молекулярная структура спиропирана 1 уточ-
6.78 м. д. в виде дублетных сигналов с константой
нена методом рентгеноструктурного анализа и
спин-спинового взаимодействия (КССВ) 10.2 Гц,
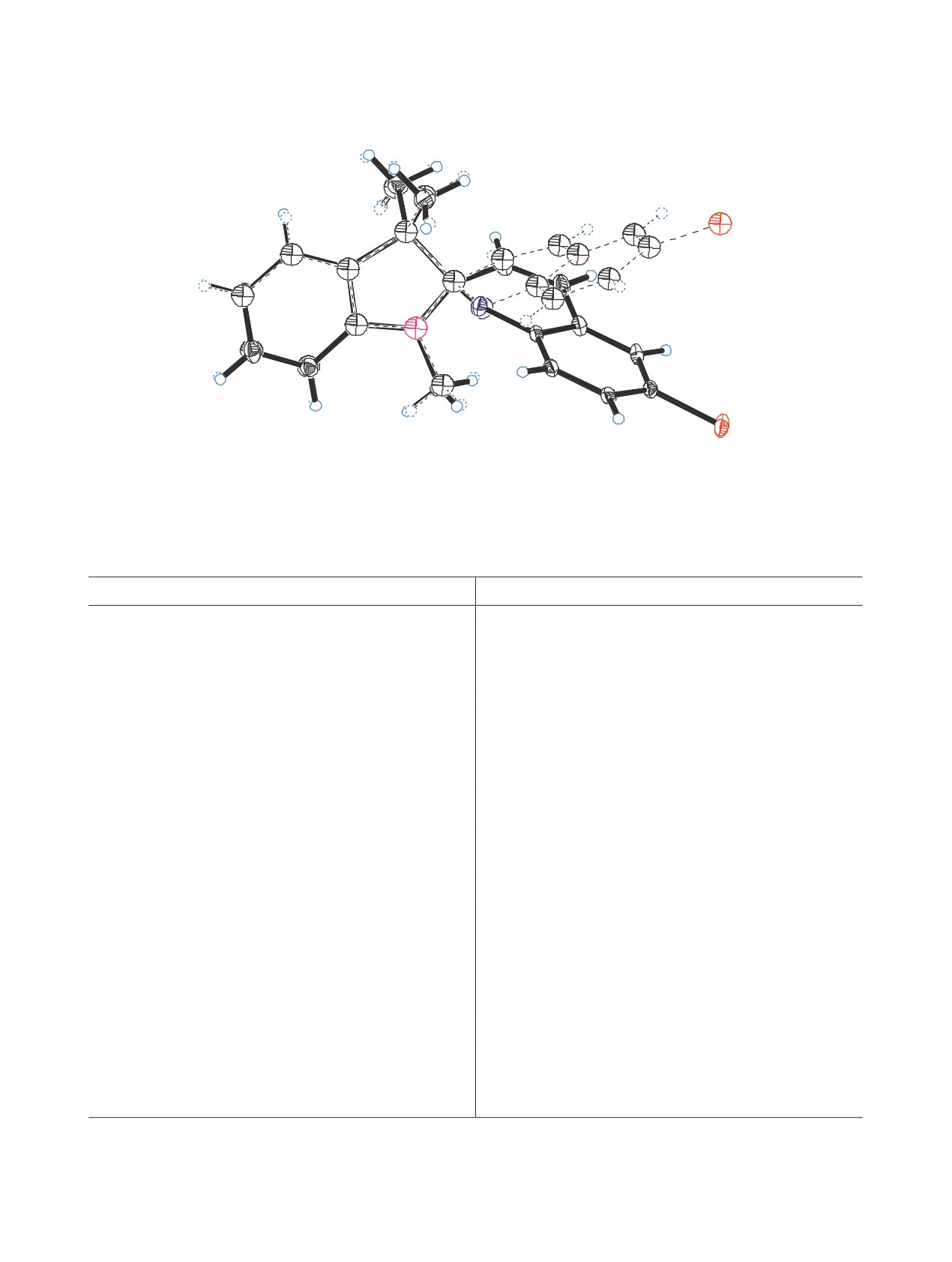
представлена на рис. 1. Кристаллографические
что свидетельствует о цис-конфигурации виниль-
данные приведены в табл. 1. В независимой части
ного фрагмента С3′=С4′. Трехпротонный синглет-
элементарной ячейки присутствуют две молекулы,
ный сигнал NCH3-группы присутствует в спектре
спироциклический узел обеих реализуется в уста-
ЯМР 1Н при 2.71 м. д. Отнесение сигналов арома-
новке R. На рисунке представлены две независи-
тических протонов выполнено с помощью метода
мые молекулы, совмещенные по левому на рисун-
ЯМР COSY 1Н-1Н. Установлено, что мультиплет-
ке фрагменту, при этом в правой части молекулы
ный сигнал при 6.99-7.04 м. д. относится к атомам
отклоняются друг от друга под углом 23.9° для
водорода в положениях 5′ и 8′ 2Н-хроменового
одной молекулы и 25.3° для второй (номера ато-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СТРОЕНИЕ И СВОЙСТВА 1,3,3-ТРИМЕТИЛ-6′-ХЛОРСПИРО...
1029
C11
C12
C
4
C3
3′
C
Cl1Α
C9
C29B
C5
C4′
1′
O
1
O21A
C6
N
C8
C9′
10
7
C
C6′
C
Cl1′
Рис. 1. Общий вид молекулы спиропирана 1 в кристалле (CCDC 2079252).
Таблица 1. Кристаллографические данные для спиропирана 1
Параметр
Значение
Брутто-формула
C19H18ClNO
Цвет кристалла
Розовый
М, г/моль
311.79
Т, K
100
Симметрия кристалла
Триклинная
Пространственная группа
P-1
a, Å
10.7301(7)
b, Å
11.5782(6)
с, Å
13.6543(8)
α, град
75.269(5)
β, град
90.268(5)
γ, град
76.352(6)
V, Å3
1590.49(17)
Z
4
d, г/см3
1.302
F(000)
656
μ(МоKα), мм-1
0.241
Размеры кристалла, мм
0.30×0.25×0.20
Диапазон θ, град
3.00 < θ < 31.57
Измерено отражений
8507
Независимых отражений
3706
Отражений с F > 4σ(F)
6147
Диапазон индексов
-13 < h < 14; -15 < k < 14; -18 < l <16
Количество уточненных параметров
398
R-Фактор
wR2 0.166
Конечное значение R
0.0601
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1030
ПУГАЧЕВ и др.
Таблица 2. Основные длины связей, углы и торсионные углы в молекуле спиропирана 1 по результатам РСА
Связь
d, Å
Угол
ω, град
Торсионный угол
τ, град
O1'-C9'
1.365(2)
C9'O1'C2'2
120.83(16)
C8N1C2'2C3'
-152.82(18)
O1'-C2'2
1.476(2)
C8N1C2'2
108.87(17)
C9C3C2'2O1'
-90.42(18)
N1-C8
1.393(3)
C3'C2'2O1'
110.65(18)
C2'2C3'C4'C10'
-4.2(4)
N1-C2'2
1.451(3)
C2'2C3C9
101.21(17)
C12C3C2'2O1'
29.8(3)
C3-C2'2
1.572(3)
C2'2C3'C4'
122.2(2)
C2'2-C3'
1.492(3)
C5'C6'C7'
121.1(2)
C3'-C4'
1.331(3)
C4C5C6
120.9(2)
Cl1'-C6'
1.745(2)
C3'C2'2N1
111.11(18)
C3C2'2N1
103.07(17)
N1C2'2O1'
109.50(17)
Cl1'C6'C7'
119.07(17)
мов второй молекулы увеличены на 20) в разные
Для обнаружения межмолекулярных взаимо-
стороны относительно линии, мысленно соединя-
действий в кристалле соединения 1 были вычисле-
ющие совпадающие (на рисунке) атомы О1′ (O21A)
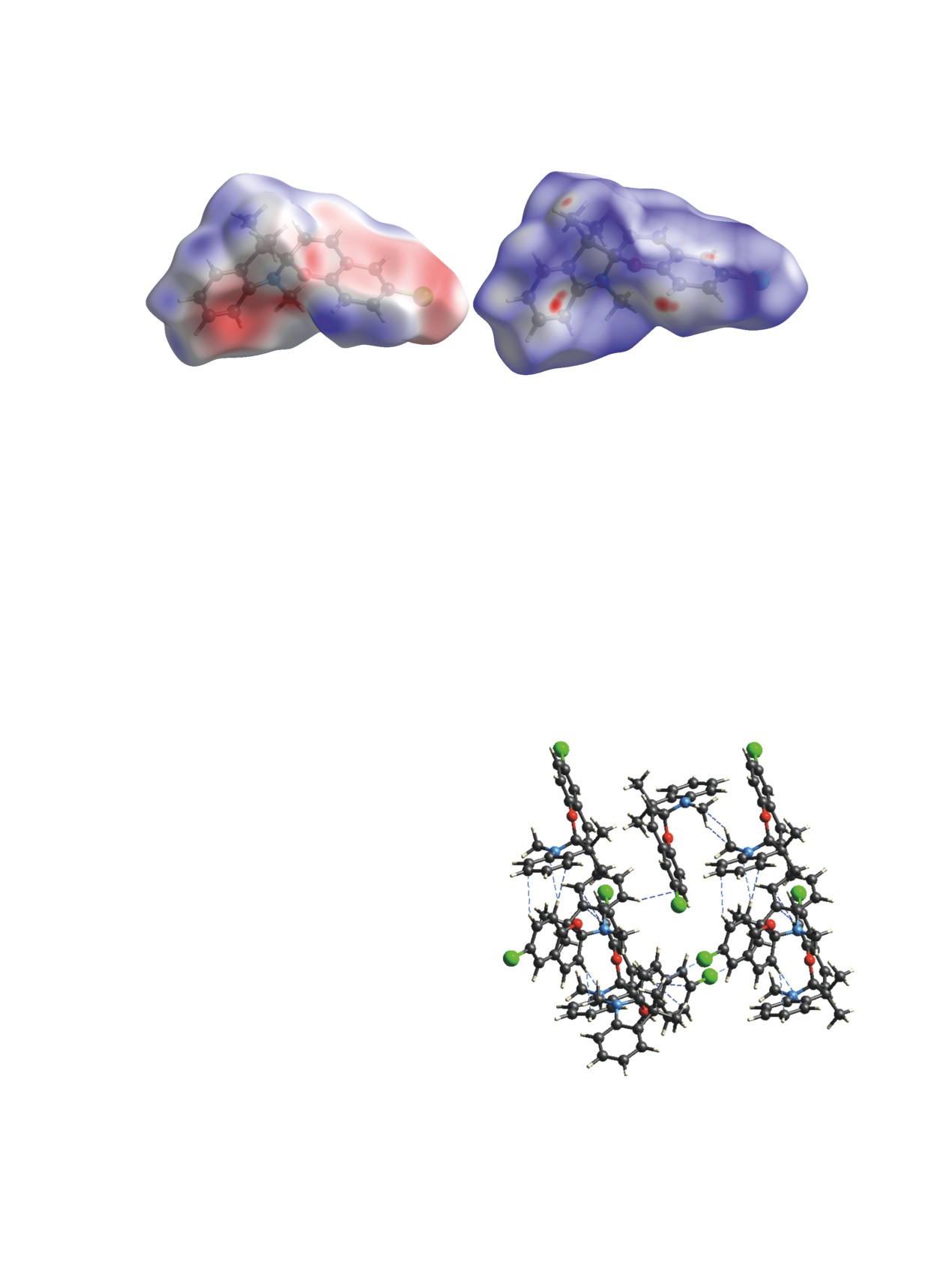
ны и получены поверхности Хиршфельда. «Индекс
и C3′ (C23B). Классические межмолекулярные водо-
формы» чувствителен к очень незначительным из-
родные связи не образуются, атомы азота в обоих
менениям формы поверхности (рис. 2а). Красные
случаях приближены к плоским, сумма углов при
непрерывные области на поверхности, близкие к
атоме N1 равна 349.91°, а при атоме N21А - 351.52°.
треугольной и прямоугольной форме, обозначают
В табл. 2 приведены значения длин основных свя-
вогнутые области и представляют атомы, вовлечен-
зей, углов и торсионных углов.
ные в π-π-взаимодействие молекул над ней. Синие
непрерывные области на поверхности, близкие к
треугольной и прямоугольной форме, обознача-
ют выпуклые области, обозначающие вовлечен-
ные в π-π-взаимодействие в этой молекуле атомы.
Большая плоская область, очерченная синим кон-
туром на изображении изогнутости поверхности
(рис. 2б), также указывает на π-π-взаимодей-
ствие молекул [18]. На рис. 2в показано расстоя-
ние (3.554 Å) между плоскостями, проведенными
через вовлеченные в π-π-взаимодействие атомы
C5′-C10′, а угол между плоскостями равен 0°, т. е.
они параллельны. Следовательно, в кристалле на-
блюдается смещенный π-π-стекинг [18, 19].
Донорные и акцепторные группы в кристал-
лической упаковке могут быть классифицирова-
ны по поверхности Хиршфельда, построенной
по электростатическому потенциалу [19]. На этой
поверхности доноры и акцепторы водородной
связи представлены синими и красными участ-
Рис. 2. Поверхность Хиршфельда (a), построенная по
ками поверхности Хиршфельда соответственно
индексу формы в диапазоне от -1 до 1 а. е., изображе-
ние изогнутости поверхности Хиршфельда в диапазоне
(рис. 3а). Из рис. 3а видно, что акцепторами могут
от -4 до 0.4 а. е. (б) и расстояние между плоскостями
выступать атомы углерода C6-C8 π-системы индо-
атомов C5′-C10′ молекул соединения 1 в кристалле (в).
линового фрагмента, атомы кислорода и хлора, а
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СТРОЕНИЕ И СВОЙСТВА 1,3,3-ТРИМЕТИЛ-6′-ХЛОРСПИРО...
1031
(а)
(б)
Рис. 3. Поверхность Хиршфельда (a) по электростатическому потенциалу в диапазоне от -0.0398 до 0.0509 а. е.,
поверхность Хиршфельда, построенная по нормализованному контактному расстоянию dnorm, в диапазоне от -0.1235 до
1.3405 а. е. (б).
также углерод метильной группы при атоме азота.
единения 1 реализуется укладка молекул в слои
Донорами водородной связи могут выступать ато-
(рис. 5).
мы H4-H7, H3′, H7′ и H8′, а также некоторые атомы
Полученное соединение 1 в ацетонитриле на-
водорода гем-метильных групп. Поверхность Хир-
ходится преимущественно в спироциклической
шфельда (рис. 3б), построенная по нормализован-
форме А, характеризующейся тремя полосами с
ному контактному расстоянию dnorm, показывает
максимумами при 205, 222 и 297 нм. Воздействие
вовлеченные в межмолекулярные водородные свя-
на раствор спиропирана УФ излучения (λобл 313
зи атомы одной из молекул в кристалле (помечены
нм) приводит к разрыву связи Cспиро-O и превра-
красными точками). Для этой молекулы удалось
обнаружить, что донорами водородных связей
выступают атом водорода гем-метильной группы
H11C, образуя связь с атомом хлора Cl1′ другой мо-
лекулы, а также атом водорода H8′, реализующий
бифуркатный тип взаимодействия с атомами угле-
рода C4 и C9 другой молекулы. Атом углерода С7′
является акцептором в неклассической межмоле-
кулярной водородной связи с H7′, как и углеродные
атомы C5 и C6, которые образуют неклассическую
межмолекулярную водородную связь с атомом H3′.
Исследуя другие молекулы в кристалле, уда-
лось обнаружить и другие межмолекулярные вза-
имодействия (рис. 4). Интересно, что метильные
группы при атоме азота взаимодействуют друг с
другом, образуя неклассические межмолекуляр-
ные водородные связи по типу C-H···H. Помимо
этих взаимодействий, молекулы в кристалле удер-
живают 22 укороченных контакта. Обнаруженные
межмолекулярные водородные связи и π–π-взаи-
Рис. 4. Межмолекулярные водородные связи в кри-
сталле спиропирана 1.
модействия приводят к тому, что в кристалле со-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1032
ПУГАЧЕВ и др.
b
c
c
a
a
b
b
c
a
Рис. 5. Расположение молекул в кристалле соединения 1 в проекциях на три основные плоскости.
Схема 2.
Cl
UV
∆
N O
Cl
N+
O-
А
Б
щению молекулы в мероцианиновый изомер Б
ванному изомеру Б (рис. 6). После прекращения
(схема 2). Вследствие фотоизомеризации под воз-
облучения в результате термической реакции ре-
действием УФ излучения появляется новая полоса
циклизации наблюдалось обесцвечивание раство-
поглощения в видимой области спектра с максму-
ра. Время жизни изомера Б (τБ) при комнатной
мом при 592 нм, относящаяся к фотоиндуциро-
температуре составило 19.6 с.
Спектрально-кинетические
характеристики
изомеров А и Б приведены ниже.
A
1.6
Форма
λ, нм
А
205 (3.76), 222 (3.56), 248 пл (1.61), 297
(0.52), 330 пл (0.24)
Б
592
0.8
0.009
Таким образом, по модифицированной ме-
0.006
тодике был получен 1,3,3-триметил-6′-хлорспи-
0.003
ро[индолин-2,2′-2Н-хромен] с выходом 91.2%. Его
строение было исследовано с помощью ИК, ЯМР
550
650
1Н, 13С и 15N спектроскопии (с использованием
250
350
450
550
650
ряда двумерных методик), а также элементного
λ, нм
анализа. Молекулярная структура
1,3,3-триме-
тил-6′-хлорспиро[индолин-2,2′-2Н-хромена] уточ-
Рис. 6. Изменения спектров поглощения соединения 1
при облучении УФ светом (λобл 313 нм) в ацетонитриле
нена с помощью рентгеноструктурного анализа,
с интервалом 5 с, с 4.3×10-5 М., 293 K.
который выявил наличие в структуре неклассиче-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СТРОЕНИЕ И СВОЙСТВА 1,3,3-ТРИМЕТИЛ-6′-ХЛОРСПИРО...
1033
ских межмолекулярных водородных связей и сме-
данные депонированы в Кембриджский банк кри-
щенного π-π-стекинга в области 2Н-хроменового
сталлоструктурных данных (CCDC 2079252) и мо-
фрагмента. Установлено, что в кристалле 1,3,3-три-
гут быть свободно получены по адресу: www.ccdc.
метил-6′-хлорспиро[индолин-2,2′-2Н-хромена] ре-
cam.ac.uk/data_request/cif.
ализуется укладка молекул в слои. Исследования
Поверхности Хиршфельда вычислены методом
фотохромного поведения показали, что получен-
MP2 с использованием базиса 6-311G(d, p) в про-
ный спиропиран с атомом хлора в положении 6′
грамме CrystalExplorer v17.5 [23].
2Н-хроменового фрагмента характеризуется мак-
1,3,3-Триметил-6′-хлорспиро[индолин-
симумом поглощения мероцианинового изомера
2,2′-2Н-хромен]
(1).
К раствору
0.313 г
при 592 нм, что на 37 нм ближе по сравнению с
(0.002 моль) 5-хлорсалицилового альдегида 3 в
нитрозамещенным по этому положению соедине-
20 мл пропан-2-ола при кипячении добавляли
нием [20] к диапазону «биологического окна», а
0.547 г (0.002 моль) перхлората 1,2,3,3-тетраме-
также функционирования устройств записи и счи-
тил-3Н-индолия 2, затем по каплям вносили 0.28 мл
тывания информации.
(1 экв.) триэтиламина. Реакционную смесь кипя-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тили при перемешивании 25 мин, затем охлаж-
дали, добавляли 15 мл дистиллированной воды и
Спектры ЯМР регистрировали на спектрометре
экстрагировали хлороформом. Экстракт сушили
Bruker AVANCE-600 (600 МГц) в CDCl3. ИК спектр
безводным Na2SO4 и отгоняли растворитель. По-
записывали на приборе Varian Excalibrum 3100 FT-I
лученное вещество перекристаллизовывали из
методом неполного внутреннего отражения. Элек-
этанола. Выход 0.567 г (91.2%), т. пл. 90°С (этанол)
тронные спектры поглощения регистрировали на
(т. пл. 79°С [15]). ИК спектр, ν, см-1: 1608 (C=C),
спектрофотометре Agilent 8453 с приставкой для
1261 (CAr-N), 926 (Cспиро-О), 746 (C-Cl). Спектр
термостатирования образцов. Фотолиз растворов
ЯМР 1H, δ, м. д. (J, Гц): 7.17 т (1H, H6, J 7.6), 7.06 д
осуществляли с помощью системы Newport, обо-
(1H, H4, J 7.2), 7.04-6.99 м (2H, H5′, H8′), 6.84 д (1H,
рудованной ртутной лампой мощностью 200 Вт
H5, J 7.4), 6.78 д (1H, H4′, J 10.2), 6.63 д (1H, H7′, J
с набором интерференционных светофильтров.
9.3), 6.52 д (1H, H7, J 7.7), 5.73 д (1H, H3′, J 10.2),
Для приготовления растворов использовали аце-
2.71 с (3H, NCH3), 1.29 с (3H, C3CH3), 1.16 с (3H,
тонитрил (Aldrich) спектральной степени чистоты.
C3CH3). Спектр ЯМР 13C, δC, м. д.: 153.04 (C9′),
Элементный анализ проводили методом классиче-
148.04 (C8), 136.55 (C9), 129.31 (C8′), 128.43 (C4′),
ского микроанализа [21]. Температуру плавления
127.64 (C6), 126.13 (C5′), 124.62 (C10′), 121.48 (C4),
определяли с помощью прибора Фишера-Джонса
120.73 (C3′), 120.04 (C6′), 119.27 (C5), 116.33 (C7′),
(ThermoFisher Scientific, США).
106.83 (C7), 104.51 (C2′2), 51.86 (C3), 28.87 (NCH3),
Параметры элементарной ячейки кристалла
25.83 (C3CH3), 20.12 (C3CH3). Спектр ЯМР 15N, δN,
и трехмерный набор интенсивностей получены
м. д.: 91.14 (NCH3). Найдено, %: С 73.42; Н 5.79; Cl
на автодифрактометре Xcalibur, Eos (MoKα-из-
11.33; N 4.44. С19Н18ClNО. Вычислено, %: С 73.35;
лучение, графитовый монохроматор). Проведен
Н 5.83; Cl 11.40; N 4.50.
эмпирический учет поглощения по процедуре
Multiscan. Структура расшифрована прямым ме-
ИНФОРМАЦИЯ ОБ АВТОРАХ
тодом и уточнена полноматричным методом наи-
Пугачев Артем Дмитриевич, ORCID: http://
меньших квадратов (МНК) по F2 по программе
orcid.org/0000-0002-8624-027X
SHELXTL в анизотропном приближении для не-
Ткачев Валерий Владимирович, ORCID: http://
водородных атомов. В кристаллической структуре
orcid.org/0000-0002-1348-1363
большинство атомов Н локализованы в синтезе
Алдошин Сергей Михайлович, ORCID: http://
Фурье разностной электронной плотности, далее
orcid.org/0000-0003-3555-7442
координаты и изотропные тепловые параметры
всех атомов Н вычисляли в процедуре МНК по
Макарова Надежда Ивановна, ORCID: http://
модели наездника
[22]. Кристаллографические
orcid.org/0000-0002-7196-9842
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1034
ПУГАЧЕВ и др.
Ростовцева Ирина Александровна, ORCID:
Chemistry / Eds J.C. Crano, R.J. Guglielmetti. Boston:
Springer, 2002. P. 11. doi 10.1007/0-306-46911-1_2
6.
Aldoshin S. In: Organic Photochromic and
Метелица Анатолий Викторович, ORCID: http://
Thermochromic Compounds. Topics in Applied
orcid.org/0000-0003-3645-5528
Chemistry / Eds J.C. Crano, R.J. Guglielmetti. Boston:
Станкевич Наталья Викторовна, ORCID: http://
Springer, 2002. P. 297. doi 10.1007/0-306-46912-X_8
orcid.org/0000-0001-6354-4732
7.
Дороган И.В., Минкин В.И. // ХГС. 2016. Т. 52. № 9.
С. 730; Dorogan I. V., Minkin V. I. // Chem. Heterocycl.
Шилов Геннадий Викторович, ORCID: http://
Compd. 2016. Vol. 52. N. 9. P. 730. doi 10.1007/s10593-
orcid.org/0000-0001-5279-7283
016-1956-x
8.
Chibisov A.K., Görner H. // J. Phys. Chem. (A). 1997.
org/0000-0001-9965-0828
Vol. 101. P. 4305. doi 10.1021/jp962569l
9.
Pugachev A.D., Ozhogin I.V., Lukyanova M.B.,
БЛАГОДАРНОСТЬ
Lukyanov B.S., Kozlenko A.S., Rostovtseva I.A.,
Экспериментальные данные по ИК и ЯМР
Makarova N.I., Tkachev V.V., Aldoshin S.M., Meteli-
спектроскопии, фотохимическим исследованиям
tsa A.V. // J. Mol. Struct. 2021. Vol. 1229. P. 129615. doi
10.1016/j.molstruc.2020.129615
получены с использованием оборудования Центра
коллективного пользования Южного федерально-
10.
Schmidt S.B., Kempe F., Brügner O., Walter M., Som-
mer M. // Polym. Chem. 2017. Vol. 8. N 35. P. 5407. doi
го университета «Молекулярная спектроскопия».
10.1039/C7PY00987A
ФОНДОВАЯ ПОДДЕРЖКА
11.
Qu L., Xu X., Song J., Wu D., Wang L., Zhou W., Zhou X.,
Xiang H.// Dyes Pigm. 2020. Vol. 181. P. 108597. doi
Исследование выполнено при финансовой под-
10.1016/j.dyepig.2020.108597
держке Министерства науки и высшего образова-
12.
Ma Z., Meng X., Ji Y., Li A., Qi G., Xu W., Zou B.,
ния РФ в рамках государственного задания в сфере
Ma Y., Kuang G.-C., Jia X. // Dyes Pigm. 2019.
научной деятельности № 0852-2020-00-19. Рентге-
Vol. 162. P. 136. doi 10.1016/j.dyepig.2017.11.036
ноструктурное исследование выполнено в соответ-
13.
Meng X., Chen C., Qi G., Li X., Wang K., Zou B.,
ствии с государственным заданием, государствен-
Ma Y. // ChemNanoMat. 2017. Vol. 3. N. 8. P. 569. doi
ная регистрация № АААА-А19-119092390076-7
10.1002/cnma.201700120
(В.В. Ткачев, С.М. Алдошин).
14.
Wizinger B., Wennig H. // Helv. Chim. Acta. 1940.
Vol. 23. N. 1. P. 247. doi 10.1002/hlca.19400230133
КОНФЛИКТ ИНТЕРЕСОВ
15.
Silvia T.R., Ana V.S.L., González E.A.S. // Synth.
Авторы заявляют об отсутствии конфликта
Commun. 1995. Vol. 25. N. 1. P. 105. doi
интересов.
10.1080/00397919508010795
16.
Keum S.R., Ku B.S., Shin J.T., Ko J.J., Buncel E. //
СПИСОК ЛИТЕРАТУРЫ
Tetrahedron. 2005. Vol. 61. N 28. P. 6720. doi 10.1016/j.
tet.2005.05.005
1. Bouas-Laurent H., Dürr H. // Pure Appl. Chem. 2001.
Vol. 73. N 4. P. 639. doi 10.1351/pac200173040639
17.
Джапаридзе К.Г. Спирохромены. Тбилиси: Мецни-
ереба, 1979. 112 с.
2. Klajn R. // Chem. Soc. Rev. 2014. Vol. 43. P. 148. doi
10.1039/c3cs60181a
18.
Luo Y.H., Yang L.J., Han G., Liu Q.L., Wang W., Ling Y.,
Sun B.W. // J. Mol. Struct. 2014. Vol. 1076. P. 679. doi
3. Feringa B.L. // Angew. Chem. Int. Ed. 2017. Vol. 56.
10.1016/j.molstruc.2014.07.069
P. 11060. doi 10.1002/anie.201702979
19.
Kargar H., Behjatmanesh-Ardakani R., Fallah-
4. Пугачев А.Д., Муханов Е.Л., Ожогин И.В., Козлен-
Mehrjardi M., Torabi V., Munawar K.S., Ashfaq M.,
ко А.С., Метелица А.В., Лукьянов Б.С. // ХГС. 2021.
Tahir M.N. // J. Mol. Struct. 2021. Vol. 1233. P. 130105.
Т. 57. № 2. С. 122; Pugachev A.D., Mukhanov E.L.,
doi 10.1016/j.molstruc.2021.130105
Ozhogin I.V., Kozlenko A.S., Metelitsa A.V., Lukyanov
20.
Ширинян В.З., Барачевский В.А., Шимкин А.А.,
B.S. // Chem. Heterocycl. Compd. 2021. Vol. 57. N 2.
Краюшкин М.М., Маилян А.К., Цыганов Д.В., Вин-
P. 122. doi 10.1007/s10593-021-02881-y
тер О.А., Венидиктова О.В. // Изв. АН. Сер. хим.
5. Bertelson R.C. In: Organic Photochromic and
2010. № 4. С. 811; Shirinian V.Z., Barachevsky V.A.,
Thermochromic Compounds. Topics in Applied
Shimkin A.A., Krayushkin M.M., Mailian A.K., Tsyga-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СТРОЕНИЕ И СВОЙСТВА 1,3,3-ТРИМЕТИЛ-6′-ХЛОРСПИРО...
1035
nov D.V., Vinter O.A., Venidiktova O.V. // Russ. Chem.
22. Sheldrick G.M. SHELXTL v. 6.14, Structure
Bull. 2010. Vol. 59. N 4. P. 828. doi 10.1007/s11172-
Determination Software Suite, Bruker AXS, Madison,
Wisconsin (USA), 2000.
010-0168-2
23. Turner M.J., McKinnon J.J., Wolff S.K., Grimwood
21. Гельман Н.Э., Терентьева Е.А., Шанина Т.М., Кипа-
D.J.,. Spackman P.R, Jayatilaka D., Spackman M.A.
ренко Л.М. Методы количественного органического
Crystal Explorer 17, University of Western (Australia),
элементного анализа. М.: Химия, 1987. 296 с.
2017.
Structure and Propeties of 1,3,3-Trimethyl-
6′-chlorospiro[indoline-2,2′-2H-chromene]
A. D. Pugacheva,*, V. V. Tkachevb,c, S. M. Aldoshinb, N. I. Makarovaa, I. A. Rostovtsevaa,
A. V. Metelitsaa, N. V. Stankevicha, G. V. Shilovb, and B. S. Lukyanova
a Institute of Physical and Organic Chemistry, Southern Federal University, Rostov-on-Don, 344090 Russia
b Institute of Problems of Chemical Physics of the Russian Academy of Sciences, Chernogolovka, 142432 Russia
c Institute of Physiologically Active Substances of the Russian Academy of Sciences, Chernogolovka, 142432 Russia
*e-mail: artem_d_pugachev@mail.ru
Received May 6, 2021; revised June 2, 2021; accepted June 5, 2021
Indoline spiropyran containing a σ-acceptor chlorine atom in position 6′ of the 2H-chromene part of the molecule
was synthesized and studied. The use of 1,2,3,3-tetramethyl-3H-indolium perchlorate as a starting compound
made it possible to achieve higher product yields as compared to previous studies. The molecular structure of
the compound was established by single crystal X-ray diffraction analysis. The features of the crystal structure
and intermolecular interactions were investigated using CrystalExplorer17 software package. The photochro-
mic behavior in acetonitrile solution was studied for the first time. It was found that the merocyanine form of
spiropyran is characterized by an absorption maximum at 592 nm, which is 37 nm closer to the range of the
“biological window” in comparison with the nitro-substituted analog.
Keywords: spiropyran, photochromism, single crystal X-Ray analysis, indoline, 2H-chromene
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021