ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1068-1077
УДК 547.481:546.183.548.737
КАРБОКСИЛАТНЫЕ ФОСФАБЕТАИНЫ,
СОДЕРЖАЩИЕ ОПТИЧЕСКИ АКТИВНЫЙ АТОМ
УГЛЕРОДА: СИНТЕЗ И ДАННЫЕ СПЕКТРОСКОПИИ
ЯМР
© 2021 г. С. Р. Романов*, Ю. В. Бахтиярова, М. В. Морозов, Ф. Х. Каратаева, В. В. Клочков,
И. В. Галкина, В. И. Галкин
Казанский (Приволжский) федеральный университет, ул. Кремлевская 18, Казань, 420008 Россия
*e-mail: Semyonromanov@yandex.ru
Поступило в Редакцию 16 мая 2021 г.
После доработки 8 июня 2021 г.
Принято к печати 10 июня 2021 г.
В результате реакций нуклеофильного присоединения третичных фосфинов к непредельным карбоно-
вым кислотам получены моно- и дикарбоксилатные фосфабетаины, содержащие оптически активный
атомом углерода. Данные одно- и двумерной спектроскопии ЯМР показали для всех соединений наличие
диастереотопных геминальных протонов СН2-группы рядом с хиральным центром. Значение констант
вицинальных атомов водорода, согласно данным РСА, соответствует величинам двугранных углов.
Ключевые слова: карбоксилатный фосфабетаин, третичный фосфин, непредельная карбоновая кислота,
фосфониевая соль, диастереотропные протоны
DOI: 10.31857/S0044460X21070118
Бетаиновые структуры привлекают внимание
ствия, полученных на основе данных спектроско-
исследователей ввиду широкого спектра практиче-
пии ЯМР, от величины двугранного угла, данные о
ски полезных свойств. Они активно используются
котором получены с помощью рентгеноструктур-
в медицине в качестве лекарственных препаратов
ного анализа.
[1, 2]. В последнее время цвиттер-ионные структу-
В последние годы нашей группой были прове-
ры стали применяться в качестве гемодиализных
дены систематические исследования по синтезу,
мембран [3-5]. Карбоксилатные бетаины фосфо-
а также изучению строения, химических свойств
ра, в свою очередь, будучи аналогами природных
моно- и дикарбоксилатных фосфабетаинов
аминокислот, являются удобными лигандами в
[15-17]. Одна из методик позволяет осуществить
синтезе металлокомплексов [6, 7], применяются в
синтез карбоксилатных бетаинов по реакции ну-
качестве катализаторов [8-10] и дифторметилиру-
клеофильного присоединения третичного фосфи-
ющих агентов [11]. Известны работы по изучению
на к непредельной карбоновой кислоте. По данной
противораковой [12, 13] и противомикробной [14]
методике нами были проведены реакции трифе-
активности соединений, содержащих трифенил-
нилфосфина с метакриловой, кротоновой и корич-
фосфониевые фрагменты. В связи с этим пред-
ной кислотами, в результате которых были синте-
ставляется крайне актуальным изучение строения
зированы фосфабетаины 1a-в (схема 1).
подобных структур. В данной работе конфигура-
Интересно, что реакции трифенилфосфина с
ция заместителей будет определяться с помощью
замещенными коричными кислотами не сопрово-
зависимости констант вицинального взаимодей-
ждаются образованием соответствующего фосфа-
1068
КАРБОКСИЛАТНЫЕ ФОСФАБЕТАИНЫ
1069
Схема 1.
+
COOH
Ph3P
R2
Ph3P
+
R1
R2
R1
COO-
1a-в
R1 = H, R2 = CH3 (1a); R1 = CH3, R2 = H (1б); R1 = Ph, R2 = H (1в).
Схема 2.
Ph
Ph
P
R4
HOOC
Ph
HCl
Ph3P
+
R3
R1
Cl-
COOH
R2
R1
R4
R2
R3
1г-и
R1 = Cl, R2 = R3 = R4 = H (г); R1 = COOH, R2 = R3 = R4 = H (1д); R1 = R2 = R4 = H, R3 = OCH3 (1е); R1 = R3 = R4 = H,
R2 = NO2 (1ж); R1 = H, R2 = R3 = R4 = OCH3 (1з); R1 = H, R2 = R4 = C(CH3)3, R3 = OH (1и).
Схема 3.
2
COOH
Ph
R
Ph
Ph2PCH2CH2COOH +
P
OOC
COOH
R1
R2
R1
2а-ж
R1 = H, R1 = CH3 (2a); R1 = CH3, R2 = H (2б); R1 = 3-ClC6H4, R2 = H (2в); R1 = 2-тиенил, R2 = H (2г); R1 = 3,4,5-(CH3O)3C6H2,
R2 = H (2д); R1 = NO2-C6H4, R2 = H (2е); R1 = 3,5-[C(CH3)3]2-4-OHPh, R2 = H (2ж).
бетаина, в качестве продукта реакции образуется
творителей, в том числе и в воде. С целью уста-
фосфиноксид. В связи с этим, нами был предло-
новления структуры синтезированных ранее
жен метод синтеза данных структур через образо-
соединений были зарегистрированы спектры ЯМР
вание фосфониевых солей 1г-и на первой стадии
для соответствующих фосфониевых солей 3 и 4г-ж
(схема 2) [18].
(схема 4). Помимо спектроскопии ЯМР, структура
Дикарбоксилатные фосфабетаины 2a-ж можно
соединений 3 и 4е была доказана с помощью рент-
получить на основе 3-(дифенилфосфино)пропи-
геноструктурного анализа (рис. 1, 2).
оновой кислоты, которая используется как тре-
Строение всех синтезированных соединений
тичный фосфин, имея в своей структуре помимо
было подтверждено с помощью спектроскопии
третичного атома фосфора еще и карбоксильную
ЯМР 1Н, 13С и 31Р. Характеристики спектров моно-
группу, выступающую как дополнительный донор
карбоксилатных фосфабетаинов и фосфониевых
протонов (схема 3) [13].
солей представлены в табл. 1. Соединения 1а, б и
Стоит отметить, что соединения 1в и 2г-е не-
3 содержат асимметричный атом углерода С*НС в
растворимы в большинстве органических рас-
α- (1б, 3) и β-положениях (1а) относительно атома
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1070
РОМАНОВ и др.
Схема 4.
+
+
Ph3P
Ph3P
HCl
CH CH2
CH CH2
Cl
Ph
COO
Ph
COOH
1в
3
Ph Ph
R2
Ph Ph
R2
P
HCl
P
OOC
+
COOH
HOOC
+
COOH
Cl
2г-ж
R1
4г-ж
R1
R1 = 2-тиенил, R2 = H (2г); R1 = 3,4,5-(CH3O) 3C6H2, R2 = H (2д); R1 = NO2-C6H4, R2 = H (2е); R1 =
3,5-[C(CH3)3]2-4-OHPh, R2 = H (2ж).
фосфора (схема 5), что приводит к неэквивалент-
взаимодействия друг с другом (2JАВ) и с протоном
ности протонов соседней метиленовой группы
НС (3JАС и 3JВС). В соединениях 1а и 1б сигнал про-
(НА и НВ), которые вместе с протоном НС образуют
тона НС, испытывающего, кроме того, спин-спи-
трехспиновую систему. Из-за достаточно большой
новое взаимодействие с протонами группы СН3,
разницы в значениях химических сдвигов прото-
представляет собой дублет дублетов квартетов.
нов НА, НВ с протоном НС эта система может быть
Отнесение сигналов к протонам НА и НВ сделано
классифицирована как АВХ. Так, для соединения
на основе анализа величин вицинальных констант
1а величины ∆δАС и ∆δВС равны 0.55 и 0.93 м. д.
спин-спинового взаимодействия 3JАС и 3JВС в соот-
соответственно (табл. 1). Для соединений 1б и 3
ветствии с графиком Карплуса 3JHH = f(θ) [19]. Так,
эта разница существенно выше.
константам 3JАС 3.7-4.5 Гц (табл. 1) соответству-
Каждый из протонов НА и НВ проявляется в
ет двугранный угол θ ~ 60° между связями С*-НС
спектре дублетом дублетов за счет спин-спинового
и С-НА, т. е. протоны НА и НС имеют взаимную
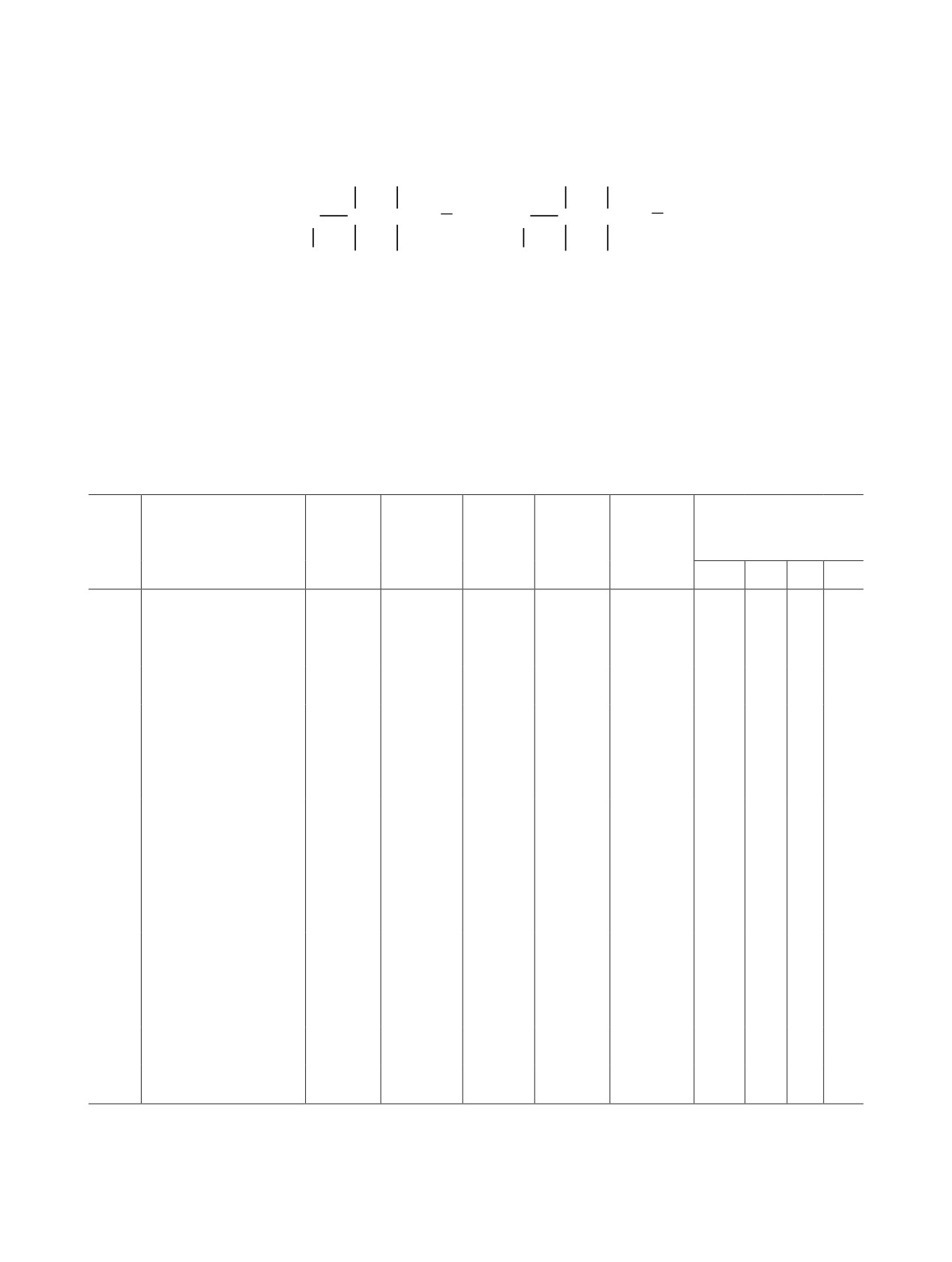
Рис. 2. Общий вид молекулы [2-карбокси-1-(3-нитро-
Рис. 1. Общий вид молекулы (2-карбокси-1-фенилэтил)-
фенил)этил](2-карбоксиэтил)дифенилфосфонийхло-
трифенилфосфонийхлорида 3.
рида 4е.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КАРБОКСИЛАТНЫЕ ФОСФАБЕТАИНЫ
1071
Схема 5.
HC
HA
HA
HC
+
+
R12P
C C Y
R12P
C C Y
R2
X
R2
Me
HB
HB
R1 = R2 = Ph; R1 = Ph, R2 = CH2CH2COOH/CH2CH2COO; X = Me, Ar; Y = COOH/COO.
гош-ориентацию. Вицинальным константам 3JВС
Отметим, что положение сигналов протонов
9.3-10.9 Гц соответствует угол θ ~180°, и протоны
в спектрах зависит от α- или β-положения асим-
НВ и НС имеют взаимную транс-ориентацию. Это
метричного центра относительно атома фосфора.
подтверждается данными РСА для соединения 3
Наиболее чувствителен здесь сигнал протона НС.
(рис. 1).
Так, в соединении 1а (β-положение С*НС) δ(НС)
Таблица 1. Данные спектроскопии ЯМР 1Н (δ, м. д.) для соединений 1a, б, г-и и 3 (в растворах D2O)
Константы спин-
спинового
№
R
HA
HB
HC
Ph3 (Ph2)
CHCR
взаимодействия, Гц
2JAB
3JAC
3JBC
3JНН
1aa
CH3
3.18 д. д
3.56 д. д
2.63 д. д.
7.64 м
1.1 д (3H)
14.5
3.8
9.3
5.7
(1H)
(1H)
к (1H)
(15H)
1бб
CH3
2.01 д. д.
2.74 д. д. д
4.07 д. д.
7.65 м
1.24 д. д
15.4
4.5
10.9
6.9
д (1H)
(1H)
д q (1H)
(10H)
(3H)
3a
Ph
3.24 д. д
3.43 д. д
5.23 д. д
6.97-7.85
6.97-7.37
15.6
4.7
10.9
-
(1H)
(1H)
(1H)
м (15H)
м (5H)
1г
2-ClPh
3.2 д. д
3.3 д. д
5.48 д. д
7.34-7.63
6.81 д
13.9
3.9
10.0
-
(1H)
(1H)
(1H)
м (15H)
(1H), 7.02-
7.15 м
(1H), 7.26
д (2H)
1д
2-COOHPh
2.81 д. д
3.10 д. д
5.90 д. д
7.40-7.59
7.60 т (1H),
16.8
4.2
12.6
-
(1H)
(1H)
(1H)
м (15H)
7.71 т (1H)
7.76 т (1H),
7.80 т (1H)
1е
4-OCH3Ph
3.08 д. д
3.27 д. д
5.10 д. д
7.40-7.64
6.75 д
15.6
4.7
10.9
-
(1H)
(1H)
(1H)
м (15H)
(2H), 6.82
д (2H)
1ж
3-NO2Ph
3.19 д. д
3.35 д. д
5.37 д. д
7.52-7.74
7.35 т (1H),
15.3
4.9
10.4
-
(1H)
(1H)
(1H)
м (15H)
7.37 д
(1H), 7.61 с
(1H), 8.09
д (1H)
1з
3,4,5-(OCH3)3Ph
3.40 д. д
4.33 д. д
5.5 д. д
7.44-7.98
6.8s (2H)
14.5
4.2
10.3
-
(1H)
(1H)
(1H)
м (15H)
1и
3,5-[C(CH3)3]2-4-OHPh
3.52 д. д
4.07 д. д
5.38 д. д
7.23-7.72
7.85s (2H)
-26.7
16.8
9.9
-
(1H)
(1H)
(1H)
м (15H)
а Спектр снят в условиях двойного резонанса1Н{31P}. б 3JPHА 13.3 Гц, 3JPHB 13.2 Гц, 2JPHC- 11.7 Гц, 3JPСMe 18.7 Гц.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1072
РОМАНОВ и др.
Таблица 2. Данные спектроскопии ЯМР 1Н (δ, м. д.) для соединений 2a-в и 4г-ж (в растворах D2O)a
Константы спин-
спинового
№
R
HA
HB
HC
1-CH2
2-CH2
Ph2
CHCR
взаимодействия, Гц
2JAB
3JAC
3JBC
3JНН
2a
CH3
3.0 д. д
3.32 д. д
2.61 д. д к
3.2 д. д
2.5 м
7.74 м
1.24 д
15.6
3.2
9.8
7.0
(1H)
(1H)
(1H)
(2H)
(2H)
(10H)
(3H)
2б
CH3
2.66 д.
1.96 д. д
3.64 д. д к
3.06 т
2.35 т
7.74 м
1.16 д. д
15.4
4.5
10.6
6.5
д (1H)
(1H)
(1H)
(2H)
(2H)
(10H)
(3H)
2в
2-ClPh
3.01
2.75 д. д
4.91 д. д
2.62 м
2.29 д. д
6.65 м
7.05 м
15.6
2.6
9.9
-
д. д
(1H)
(1H)
(2H)
(2H)
(10H)
(4H)
(1H)
4г
2-Тиенил
3.1 д. д
2.68 д. д
5.3 д. д (1H)
2.8 т
2.32 т
7.56 м
6.45 с
16.2
2.5
11.5
-
(1H)
(1H)
(2H)
(2H)
(10H)
(1H),
6.78 с
(1H),
7.2 s
(1H)
4д
3,4,5-(OCH3)3Ph
3.28 д.
2.94 д. д
5.08 д. д
3.05 т
2.53 т
7.79 м
3.56 с
16.5
2.6
11.5
-
д (1H)
(1H)
(1H)
(2H)
(2H)
(10H)
(6H),
3.7 с
(3H),
6.26 с
(2H)
4е
3-NO2Ph
3.36
2.92 д. д
5.33 д. д
5.33
2.52 м
7.5-8.2
16.7
2.7
11.0
-
д. д
(1H)
(1H)
д. д
(2H)
м
(1H)
(1H)
(14H)
4ж
3,5-[C(CH3)3]2-4-OHPh
3.13
3.01 д. д
5.18 д. д
2.39
2.54 м
6.25-
1.25 с
16.2
4.2
11.6
-
д. д
(1H)
(1H)
д. д
(2H)
8.1 м
(t-Bu),
(1H)
(2H)
(12H)
5.54 с
(ОН)
а Спектры сняты в условиях двойного резонанса 1Н{31P}.
2.63 м. д., а в случае α-положении сигнал НС бла-
С1Н2С2Н2С(О)О- (2a-в) [или С(О)ОН в случае
годаря влиянию индуктивного эффекта аромати-
соединений 4д-ж]. Здесь протоны двух метиле-
ческого кольца сдвигается в слабое поле [1б, δ(НС)
новых групп, имеющих различное химическое
4.07 м. д.]. Этот эффект усиливается при замене
окружение и достаточно большую разницу хи-
метильной группы на фенильную [3, 1г-и, δ(НС)
мических сдвигов (табл. 2), образуют четырех-
5.10-5.90 м. д., табл. 1]. Спектры ЯМР 13С соеди-
спиновую систему типа АА′XX′. Для соедине-
нений 1а и 1б полностью подтверждают их строе-
ний 2a-в величина ∆δ(СН2) составляет 0.7, 0.71,
ние. Каждый из них содержит по 3 дублета (за счет
0.46 м. д. соответственно. Более точная классифи-
спин-спинового взаимодействия с ядром фосфора)
кация спиновых систем проведена с учетом вли-
в алкильной области и 4 дублета в резонансной об-
яния (или его отсутствия) соседней с протонами
ласти эквивалентных ароматических колец. Сиг-
С2Н2 магнитно анизотропной группы С=О. Так,
налы орто- и мета- атомов углерода удвоены по
спектр фрагмента С1Н2С2Н2 в соединении 2a со-
интенсивности.
ответствует системе А2XX′, т. е. протоны С2Н2
Дикарбоксилатные фосфабетаины 2a-в, 4д-ж
проявляют неэквивалентность и регистрируются
содержат второй заместитель у атома фосфора -
в спектре мультиплетом при 2.5 м. д., а протоны
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КАРБОКСИЛАТНЫЕ ФОСФАБЕТАИНЫ
1073
С1Н2 - дублетом дублетов (табл. 2). Аналогичные
J 14.5, 3.8 Гц), 2.63 д. д. к (1H, CH, HC, J 9.3, 3.8
протоны в соединениях 2б, 4г и 4д регистрируют-
Гц), 1.15 д (3H, CH3, J 5.7 Гц). Спектр ЯМР 13С
(D2О), δС, м. д.: 180.26 (СOO-), 134.89 д (Ph, 4JCР
1.9 Гц), 133.39 д (Ph, 3JCР 9.9 Гц), 129.90 д (Ph, 2JCР
Анализ данных табл. 2 показывает, что замена
12.6 Гц), 117.97 д (Ph, 1JCР 86.6 Гц), 36.77 (СН),
заместителя у атома С* в соединениях 2в–ж при-
водит к слабопольному сдвигу сигнала протона
25.56 д (РСН2, 1JCР 52.3 Гц), 20.27 д (СН3, 3JCР
НС, что, вероятнее всего, связано с его попаданием
13.1 Гц). Спектр ЯМР 31Р (D2О): δP 22.06 м. д. Най-
дено, %: С 75.36; Н 5.96; Р 8.90. C22H21O2Р. Вычис-
в дезэкранирующую область фенильного кольца
и, наоборот, попадание протонов группы С1Н2 в
лено, %: С 75.86; Н 6.03; Р 8.91.
экранирующую область фенильного кольца приво-
3-(Трифенилфосфоний)бутаноат (1б). К рас-
дит к сильнопольному сдвигу ее сигналов в спек-
твору 1.066 г (0.0041 моль) трифенилфосфина в
трах этих соединений.
5 мл ацетонитрила при постоянном перемеши-
Идентификация сигналов протонов НА, НВ и
вании прибавляли раствор 0.381 (0.0044 моль) г
НС, а также метиленовых протонов С1Н2С2Н2 была
кротоновой кислоты в 5 мл ацетонитрила. Реак-
проведена с помощью двумерных экспериментов
ционную смесь выдерживали в течение 1 месяца.
2D NOESY. В спектрах имеются кросс-пики меж-
Растворитель отгоняли в вакууме. К реакционной
ду сигналами трех протонов, протона НС и группы
смеси приливали абсолютный диэтиловый эфир,
СН3, а также между сигналами протонов двух ме-
осадок отфильтровывали на воронке Шотта, про-
тиленовых групп. Данные спектров ЯМР 13С пред-
мывали эфиром и сушили в вакууме. Выход 1.076 г
ставлены в экспериментальной части.
(56.5%), бесцветные кристаллы, т. пл. 131-133°С.
ИК спектр, ν, см-1: 1634 с (СOO-). Спектр ЯМР 1H
Таким образом, с помощью одно- и двумерной
(D2O), δ, м. д.: 7.83-7.50 м (15H, Ph3P), 4.07 д. д. к
спектроскопии ЯМР охарактеризованы карбокси-
(1H, CH, HC, J 10.9, 4.5 Гц), 2.74 д. д (1H, CH2, HB,
латные фосфабетаины и фосфониевые соли, со-
J 15.4, 10.9 Гц), 2.01 д. д. д (1H CH2, HА, J 15.4,
держащие хиральный атом углерода. Данные кон-
4.5 Гц), 1.24 д. д (3H, CH3, J 18.7, 6.9 Гц). Спектр
стант вицинальных атомов водорода согласуются
ЯМР 13С (D2О), δС, м. д.: 176.06 д (СОО-, 3JCР
с величинами двугранных углов.
2.4 Гц), 133.51 д (Ph,
16.70 Гц), 134.96 д (Ph, 4JCР
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
3JCР 9.0 Гц), 130.19 д (Ph, 2JCР 12.3 Гц), 116.87 д
ИК спектры записаны на ИК Фурье-спектроме-
(Ph, 1JCР 84.4 Гц), 37.28 (СН), 23.86 д (СН2,1JCР
тре PerkinElmer Spectrum Two. Спектры ЯМР за-
50.2 Гц), 13.55 (СН3). Спектр ЯМР 31Р (D2О): δP
регистрированы на приборе Bruker Avance III 400
29.00 м. д. Найдено, %: С 75.36; Н 5.96; Р 8.90.
Nanobay. Химические сдвиги определяли относи-
C22H21O2Р. Вычислено, %: С 75.86; Н 6.03; Р 8.91.
тельно внешних стандартов в D2O и CDCl3.
(2-Карбокси-1-фенилэтил)трифенилфос-
2-Метил-3-(трифенилфосфоний)пропаноат
фонийхлорид (3). К раствору 0.5 г (0.0019 моль)
(1а). К раствору 2.4 г (0.0092 моль) трифенил-
трифенилфосфина в 5 мл ацетонитрила при по-
фосфина в 7 мл ацетонитрила при постоянном
стоянном перемешивании добавляли по каплям
перемешивании добавляли по каплям раствор
раствор 0.28 г (0.0019 моль) коричной кислоты в
0.81 г (0.0094 моль) метакриловой кислоты в 5 мл
5 мл диэтилового эфира. Реакционную смесь вы-
ацетонитрила. Реакционную смесь выдержива-
держивали в течение одного месяца при комнат-
ли две недели при комнатной температуре, затем
ной температуре. С целью более эффективного
растворитель отгоняли в вакууме. К реакционной
выделения фосфабетаина в реакционную смесь
смеси приливали абсолютный диэтиловый эфир,
добавляли небольшой избыток раствора соляной
осадок отфильтровывали на воронке Шотта, про-
кислоты. После удаления осадка непрореагиро-
мывали эфиром и сушили в вакууме. Выход 1.76 г
вавшего трифенилфосфина из фильтрата высажи-
(57.11%), бесцветные кристаллы, т. пл. 175-182°С.
вали белый кристаллический продукт с т. пл. 227-
ИК спектр, ν, см-1: 1605 с (СOO-). Спектр ЯМР
229°C. Выход 0.615 г (78.85%). ИК спектр, ν, см-1:
1H (D2O), δ, м. д.: 7.64 м (15H, Ph3P), 3.56 д. д
1720 с (СOOH). Спектр ЯМР 1H (D2O), δ, м. д.:
(1H, CHB, J 14.5, 9.3 Гц), 3.18 д. д (1H, CH2, HA,
6.97-7.85 м (15H, Ph3P), 6.97-9.37 м (5H, Ar), 5.23
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1074
РОМАНОВ и др.
д. д (1H, CH, HС, J 10.9, 4.7 Гц), 3.43 д. д (1H, CH2,
PhP), 7.60 т [1H, C(COOH)CHCH, J 8.1 Гц],
HB, J 15.6, 10.9 Гц), 3.24 д. д (1H, CH2, HА, J 15.6,
7.71 т [1H, C(PPh3)CHCH, J 6.8 Гц], 7.76 т [1H,
4.7 Гц). Спектр ЯМР 13С (D2О), δС, м. д.: 35.51 с
C(COOH)CHCH, J 6.3 Гц], 7.80 т [1H, C(PPh3)
(СН2), 38.72 д (РСН2, 1JCР 48.9 Гц), 116.26 д (Ph,
CHCH, J 8.3 Гц]. Спектр ЯМР 13С (D2О), δС, м. д.:
1JCР 84.5 Гц), 130.01 д (Ph, 2JCР 12.4 Гц), 134.49 д
34.54 (PCHCH2), 38.91 д (PCHCH2, 1JPC 48.9 Гц),
(Ph, 3JCР 9.4 Гц), 135.33 д (Ph,4JCР 2.5 Гц), 173.1 д
116.87 д (Cipso, 1JPC 84.3 Гц), 122.16 д (Cp, 5JPC
(СООH, 3JCР 20.0 Гц), 130.69 д (Ar, J 5.4 Гц), 130.31
5.9 Гц), 129.89 д (Cm, 4JPC 12.5 Гц), 131.87 д (Co,
д (Ar, J 5.5 Гц), 129.54 д (Ar, J 2.7 Гц), 129.18 д
3JPC 10.5 Гц), 133.12 д (Co, 2JPC 10.8 Гц), 134.54 д
(Ar, J 1.4 Гц). Спектр ЯМР 31Р (D2О): δP 24.2 м.
(Cm, 3JPC 9.4 Гц), 135.18 д (Cp, 4JPC 4.3 Гц), 148.35 д
д. Найдено, %: С 71.36; Н 5.21; Р 6.90; Cl 8.15.
(Cipso, 2JPC 11.3 Гц), 167.74 д (167.74 4JPC 19.4 Гц),
C27H24O2РCl. Вычислено, %: С 72.56; Н 5.38; Р
172.54 д [C(O)OH, 3JPC 20.5 Гц]. Спектр ЯМР 31Р
6.94; Cl 7.95.
(D2О): δP 27.3 м. д. Найдено, %: C 68.97; H 4.59; Cl
7.88; P 6.21. C28H24ClO4P. Вычислено, %: C 68.51;
Общая методика синтеза соединений 1г-и.
H 4.92; Cl 7.22; P 6.31.
Навески третичных фосфинов (0.38 ммоль) и за-
мещенных коричных кислот (0.38 ммоль) раство-
[2-Карбокси-1-(4-метоксифенил)этил]три-
ряли в хлороформе и добавляли 1 каплю концен-
фенилфосфония хлорид (1е). Выход 81%, бес-
трированного раствора соляной кислоты. Реакции
цветные кристаллы, т. пл. 198-201°C. ИК спектр,
ν, см-1: 1728 с (СООН). Спектр ЯМР 1H (D2O),
проводили при 80°C на водяной бане в течение
δ, м. д.: 3.08 д. д (1H, CHCH2, HA, J 15.6, 4.7 Гц),
10 ч. По завершении реакции растворитель отго-
3.27 д. д (1H, CHCH2, HB, J 15.6, 10.9 Гц), 3.69 с
няли на воронке Шотта. Осадок промывали диэти-
(3H, OCH3), 5.10 д. д (1H, CH, HС, J 10.9, 4.7 Гц),
ловым эфиром и сушили в вакууме.
6.75 д [2H, C(OCH3)CHCH, J 7.1 Гц], 6.82 д [2H,
[2-Карбокси-1-(2-хлорфенил)этил]трифе-
C(OCH3)CHCH, J 7.2 Гц], 7.40-7.64 м (15H, PhP).
нилфосфония хлорид (1г). Выход 79%, бесцвет-
Спектр ЯМР 13С (D2О), δС, м. д.: 35.64 (PCHCH2),
ные кристаллы, т. пл. 120-121°C. ИК спектр, ν, см-1:
37.91 д (PCHCH2, 1JPC 48.7 Гц), 55.22 (OCH3),
1719 с (COOH). Спектр ЯМР 1H (D2O), δ, м. д.: 3.2
116.09 д (Cipso, 1JPC 84.1 Гц), 122.48 д (Cp, 5JPC
д. д (1H, CHCH2, HA, J 13.9, 10.0), 3.30 д. д (1H,
5.4 Гц), 129.97 д (Cm, 4JPC 12.3 Гц), 131.56 д (Co,
CHCH2, HB, J 13.9, 10.0 Гц), 5.48 д. д (1H, CH, HС,
3JPC 5.4 Гц), 132.98 д (Co, 2JPC 10.6 Гц), 134.34 д
J 10.0, 3.9 Гц), 7.40-7.59 м (15H, Ph3P), 6.81 д [1H,
(Cm, 3JPC 9.2 Гц), 135.27 д (Cp, 4JPC 2.3 Гц), 159.55
C(Cl)CHCH, J 7.8 Гц], 7.15-7.02 м [1H, C(PPh3)
д (Cipso, 2JPC 11.3 Гц), 173.04 д [C(O)OH, 3JPC
CHCH], 7.26 д [2H, C(Cl)CHCHCH, J 4.0 Гц],
20.0 Гц]. Спектр ЯМР 31Р (D2О): δP 27.09 м. д.
7.63-7.34 м (15H, PhP). Спектр ЯМР 13С (D2О),
Найдено, %: C 70.97; H 5.59; Cl 7.88; P 6.21.
δС, м. д.: 35.63 (PCHCH2), 39.61 д (PCHCH2, 1JPC
C28H26ClO3P. Вычислено, %: C 70.51; H 5.49; Cl
48.6 Гц), 116.34 д (Cipso, 1JPC 85.4 Гц), 123.19 д (Cp, 5JPC
7.43; P 6.49.
5.6 Гц), 129.77 д (Cm, 4JPC 12.6 Гц), 130.87 д (Co,
[2-Карбокси-1-(2-нитрофенил)этил]трифе-
3JPC 10.3 Гц), 133.25 д (Co, 2JPC 10.8 Гц), 134.67 д
нилфосфония хлорид (1ж). Выход 82.5%, бес-
(Cm, 3JPC 9.3 Гц), 135.47 д (Cp, 4JPC 4.5 Гц), 149.45
цветные кристаллы, т. пл. 178-179°C. ИК спектр,
д (Cipso, 2JPC 11.6 Гц), 172.54 д [C(O)OH, 3JPC
ν, см-1: 1726 с (COOH). Спектр ЯМР 1H (D2O),
20.3 Гц]. Спектр ЯМР 31Р (D2О): δP 24.12 м. д.
δ, м. д.: 3.19 д. д (1H, CHCH2, HA, J 15.3, 14.9 Гц),
Найдено, %: C 68.12; H 4.59; Cl 17.98; P 6.21.
3.35 д. д (1H, CHCH2, HB, J 15.3, 10.4 Гц), 5.37 д.
C27H22Cl2O2P. Вычислено, %: C 67.51; H 4.62; Cl
д (1H, CH, HС, J 10.4, 4.9 Гц), 7.35 т [1H, C(NO2)
17.76; P 6.45.
CHCH, J 8.8 Гц], 7.37 д [1H, C(NO2)CHCH, J
[2-Карбокси-1-(2-карбоксифенил)этил]три-
8.7 Гц], 7.61 с [1H, C(CH)CHC(NO2)], 7.52-7.74
фенилфосфония хлорид (1д). Выход 79%, бес-
м (15H, PhP), 8.09 д [1H, C(CH)CHCH, J 7.5 Гц].
цветные кристаллы, т. пл. 140-143°C. ИК спектр,
Спектр ЯМР 13С (D2О), δС, м. д.: 35.02 (PCHCH2),
ν, см-1: 1755 с (COOH). Спектр ЯМР 1H (D2O),
38.07 д (PCHCH2, 1JPC 49.5 Гц), 115.41 д (Cipso, 1JPC
δ, м. д.: 2.81 д. д (1H, CHCH2, HA, J 16.8, 4.2 Гц),
84.9 Гц), 124.65 д (Cp, 5JPC 57.8 Гц), 130.10 д (Cm,
3.10 д. д (1H, CHCH2, HB, J 16.8, 12.6 Гц), 5.90 д.
4JPC 12.6 Гц), 132.98 д (Co, 3JPC 5.2 Гц), 134.44 д
д (1H, CH, HС, J 12.6, 4.2 Гц), 7.40-7.59 м (15H,
(Co, 2JPC 9.5 Гц), 135.52 д (Cm, 3JPC 2.4 Гц), 136.77
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КАРБОКСИЛАТНЫЕ ФОСФАБЕТАИНЫ
1075
д (Cp, 4JPC 5.2 Гц), 147.78 д (Cipso, 2JPC 68.5 Гц),
кислоты в 5 мл ацетонитрила прибавляли раствор
172.74 д [C(O)OH, 3JPC 19.5 Гц]. Спектр ЯМР 31Р
0.17 г (0.0020 моль) метакриловой кислоты. Реак-
(D2О): δP 25.62 м. д. Найдено, %: C 57.41; H 5.12;
ционную смесь выдерживали в течение недели при
Cl 9.86; N 3.01; P 7.75. C19H21ClNO4P. Вычислено,
комнатной температуре. Растворитель отгоняли в
%: C 57.95; H 5.37; Cl 9.00; N 3.56; P 7.86.
вакууме. Осадок промывали диэтиловым эфиром,
[2-Карбокси-1-(3,4,5-триметоксифенил)этил]-
сушили на воронке Шотта. Выход 0.45 г (67.16%),
трифенилфосфония хлорид (1з). Выход 64%, бес-
бесцветные кристаллы, т. пл. 78-79°C. ИК спектр,
цветные кристаллы, т. пл. 129-130°C. ИК спектр,
ν, см-1:
1620 (COO-),
1680 (COOH). Спектр
ν, см-1: 1706 с (COOH). Спектр ЯМР 1H (D2O), δ,
ЯМР 13С (D2O) δC, м. д: 17.48 д (PCH2CH2, 1JРС
м. д.: 3.40 д. д (1H, CHCH2, HA, J 14.5, 4.2 Гц), 3.82
52.9 Гц), 19.66 д (J 13.6 Гц), 24.46 д (PCH, 1JРС 51 Гц),
с [3H, C(OCH3)COCH3], 3.92 д (6H, CHCOCH3, J
19.66 д (CH3, 2JPC 9.0 Гц), 27.25 д (CH2COOH),2JРС
2.9 Гц), 4.33 д. д (1H, CHCH2, HB, J 14.5 10.3 Гц),
3.0 Гц), 35.64 (CH2COO-), 172.80 д [С(О)О, 3JPC
5.50 д. д (1H, CHCH2, HC, J 10.3, 4.2 Гц), 6.8 c [2H,
3.75 Гц], 179.32 д (СОOH, 3JPC 3.7 Гц), 175.70 д
P(Ph3)CHCHCH)], 7.98-7.44 м (15H, PhP). Спектр
(СОO-, 3JPC 13.9 Гц), 116.96 (1JРС 84.2 Гц), 129.93
ЯМР 13С (D2О), δС, м. д.: 36.80 (PCHCH2), 40.33
д. д (2JPC 12.4, 4.0 Гц), 133.05 д (3JPC 9.7 Гц), 135.05.
д (PCHCH2, 1JPC 47.5 Гц), 56.10 д (OCH3, 5JPC
Спектр ЯМР 31P (D2O): δP 25.77 м. д. Найдено, %:
15.2 Гц), 60.95 д (OCH3, 6JPC 9.9 Гц), 116.49 д (Cipso,
С 69.48; Н 5.19; Р 7.76. C19H21O4Р. Вычислено, %:
1JPC 62.8), 125.15 д (Cp, 5JPC 5.6 Гц), 130.52 д (Cm,
С 69.70; Н 5.13; Р 7.89.
4JPC 12.3 Гц), 132.15 д (Co, 3JPC 6.6 Гц), 134.55 д (Co,
3-[(2-Карбоксипропил)дифенилфосфоний]-
2JPC 9.2 Гц), 135.51 д (Cm, 3JPC 2.3 Гц), 138.50 д (Cp,
пропаноат (2б). К раствору 0.5 г (0.0019 моль)
4JPC 3.6 Гц), 146.46 д (Cipso, 2JPC 11.3 Гц), 170.38 д
3-(дифенилфосфино)пропионовой кислоты в
[C(O)OH, 3JPC 18.7 Гц]. Спектр ЯМР 31Р (D2О): δP
5 мл ацетонитрила прибавляли раствор 0.17 г
26.26 м. д. Найдено, %: C 67.15; H 5.79; Cl 6.58; P
(0.0016 моль) кротоновой кислоты в 3 мл ацето-
5.65. C30H30ClO5P. Вычислено, %: C 67.10; H 5.63;
нитрила. Реакционную смесь выдерживали при
Cl 6.6; P 5.76.
комнатной температуре в течение недели, после
[2-Карбокси-1-(4-гидрокси-3,5-диметокси-
чего отфильтровывали кристаллы, промывали
фенил)этил]трифенилфосфония хлорид
(1и).
их на воронке Шотта диэтиловым эфиром и су-
Выход 64%, бесцветные кристаллы, т. пл. 198-
шили в вакууме. Выход 0.496 г (74.03%), бес-
199°C. ИК спектр, ν, см-1: 1738 с (COOH). Спектр
цветные кристаллы, т. пл. 174-176°C. ИК спектр,
ЯМР 1H (D2O), δ, м. д.: 1.35 д [18H, 2C(CH3)3, J
ν, см-1: 1630 с (COO-), 1710 с (COOH). Спектр
99.5 Гц], 3.52 д. д (1H, CHCH2, HA, J 26.7, 16.8 Гц),
ЯМР 13С (D2О), δС, м. д.: 12.5 д (СНСН3, 2JPC
4.07 д. д (1H, CHCH2, HB, J 26.7, 9.9 Гц), 5.38 д. д
2.0 Гц), 15.96 д (РСН2,1JPC 52.0 Гц), 23.56 д
(1H, CHCH2, HC, J 16.8, 9.9 Гц), 7.72-7.23 м (15H,
(РСНСН3,1JPC 72.0 Гц), 26.30 д (РСН2СН2,2JPC
PhP), 7.85 с {1H, C[C(CH3)3]CH}. Спектр ЯМР 13С
3.0 Гц), 27.05 д (РСНСН2,2JPC 3.0 Гц), 175.3 д
(D2О), δС, м. д.: 29.87-30.23 м [C(CH3)3], 34.27
[С(О)О,
3JPC
17.0 Гц],
176.42 д
[С(О)О,3JPC
[C(CH3)3], 37.38 с (PCHCH2), 40.03 д (PCHCH2,
15.0 Гц] 114.26 д (1JPC 84.0 Гц), 129.75 д (2JPC
1JPC 46.9 Гц), 117.08 д (Cipso, 1JPC 83.2 Гц), 127.66 д
12.0 Гц), 130.08 д (3JPC 11.0 Гц), 132.93 д (4JPC 3.0
(Cp, 5JPC 5.8 Гц), 130.45 д (Cm, 4JPC 12.2 Гц), 132.15
Гц). Спектр ЯМР 31P (D2O): δP 35.0 м. д. Найдено,
д (Co, 3JPC 9.9 Гц), 134.46 д (Co, 2JPC 9.1 Гц), 135.36
%: С 65.43; Н 5.34; Р 8.84. C19H21O4Р. Вычислено,
д (Cm, 3JPC 2.5 Гц), 136.85 д (Cp, 4JPC 2.2 Гц), 147.50
%: С 66.28; Н 6.1; Р 9.01.
д (Cipso, 2JPC 11.2 Гц), 170.34 д [C(O)OH, 3JPC
3-{[2-Карбокси-1-(3-хлорфенил)этил]дифе-
17.9 Гц]. Спектр ЯМР 31Р (D2О): δP 26.08 м. д.
нилфосфонио}пропаноат (2в). К раствору 0.5 г
Найдено, %: C 68.11; H 7.79; Cl 7.58; P 6.65.
(0.0019 моль) 3-(дифенилфосфино)пропионовой
C27H37ClO3P. Вычислено, %: C 68.13; H 7.83; Cl
кислоты в 5 мл ацетонитрила прибавляли раствор
7.45; P 6.51.
0.35 г (0.0019 моль) 3-хлоркоричной кислоты в
3-[(1-Карбоксипропан-2-ил)дифенил-
5 мл ацетонитрила. Реакционную смесь выдер-
фосфонио]пропаноат
(2a). К раствору
0.5 г
живали при комнатной температуре в течение не-
(0.0019 моль) 3-(дифенилфосфино)пропионовой
дели. Растворитель отгоняли в вакууме. Осадок
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1076
РОМАНОВ и др.
промывали диэтиловым эфиром, сушили на во-
[2-Карбокси-1-(3-нитрофенил)этил[(2-кар-
ронке Шотта. Выход 0.74 г (87.05%), бесцветные
боксиэтил)дифенилфосфонийхлорид (4е). Вы-
кристаллы, т. пл. 156-158°C. ИК спектр, ν, см-1:
ход 81%, бесцветные кристаллы, т. пл. 222-224°С.
1620 с (COO-), 1720 с (COOH). Спектр ЯМР 13С
ИК спектр, ν, см-1: 1710 с (COOH). Спектр ЯМР
(D2О), δС, м. д.: 16.30 д (1JPC 58.0 Гц), 36.70 д (1JPC
13С (D2О), δС, м. д.: 15.96 д (РСН2,1JCР 54.5 Гц),
70.0 Гц), 27.10 д (2JPC 3.0 Гц), 34.80 д (2JPC 53.0 Гц),
36.21 д (СН,1JCР 47.6 Гц), 26.07 (РСН2СН2), 33.21
174.70 (3JPC 18.0 Гц),175.00 (3JPC 18.0 Гц), 116.40
(РСНСН2), 173.76 д (СООH, 3JCР 13.5 Гц), 172.64 д
(1JPC 85.0 Гц), 135.50 (2JPC 15.0 Гц), 133.30 (3JPC
(СООH,3JCР 18.1 Гц), 113.34 д (1JCР 80.6 Гц), 130.49
10.0 Гц), 135.70 (4JPC 3.0 Гц), 138.80 (2JPC 89.0 Гц),
д (2JCР 12.7 Гц), 133.93 д (3JCР 9.3 Гц), 135.88 д
129.40 (3JPC 15.0 Гц), 130.50 (3JPC 10.0 Гц), 130.70
(4JCР 2.3 Гц), 124.47, 124.02 д (J 4.6 Гц), 132.49 д
(4JPC 3.0 Гц), 134.60
(4JPC 3.0 Гц), 129.00
(5JPC
(J 5.1 Гц), 134.40 д (J 8.9 Гц), 136.17 д (J 1.1 Гц),
2.0 Гц). Спектр ЯМР 31P (D2O): δP 30.3 м. д. Най-
148.01 д (J 1.8 Гц). Спектр ЯМР 31P (D2O): δP 32.0
дено, %: С 64.50; Н 4.54; Р 6.56. Вычислено, %: С
м. д. Найдено, %: С 58.64; Н 4.57; Р 6.29; Cl 7.44.
65.38; Н 4.99; Р 7.03.
C24H23O6РNCl. Вычислено, %: С 59.02; Н 4.71; Р
Дикарбоксилатные фосфабетаины 2г-ж рас-
6.35; N 2.87; Cl 7.27.
творяли в избытке 1 М. раствора соляной кислоты
ИНФОРМАЦИЯ ОБ АВТОРАХ
НСl. Растворитель отгоняли в вакууме. Бесцвет-
ные кристаллы промывали диэтиловым эфиром и
сушили на воронке Шотта.
org/0000-0002-9270-8932
3-{[2-Карбокси-1-(тиен-2-ил)этил]дифенил-
Бахтиярова Юлия Валерьевна, ORCID: http://
фосфонио}пропаноат (4г). Выход 88.75%, бес-
orcid.org/0000-0002-1865-274X
цветные кристаллы, т. пл. 195-197°C. ИК спектр,
Морозов Максим Вячеславович, ORCID: http://
ν, см-1: 1680 с (COOH). Спектр ЯМР 13С (D2О),
orcid.org/0000-0002-6686-2725
δС, м. д.: 16.5 д (1JPC 60.0 Гц), 46.0 д (1JPC 75.0 Гц),
Каратаева Фарида Хайдаровна, ORCID: http://
25.3 д (2JPC 3.0 Гц), 31.7 д (2JPC 53.0 Гц), 176.1 д
orcid.org/0000-0003-1788-8061
(3JPC 20.0 Гц), 177.0 д (3JPC 20.0 Гц), 116.7 д (1JPC
Клочков Владимир Васильевич, ORCID: http://
80.0 Гц), 130.1 д (2JPC 15.0 Гц), 129.7 д (3JPC
orcid.org/0000-0001-5283-5710
10.0 Гц), 135.3 д (4JPC 2.0 Гц), 138.6 д (2JPC 15.0 Гц),
124.3 д (3JPC 20.0 Гц), 123.9 д (4JPC 3.0 Гц), 125.0 д
Галкина Ирина Васильевна, ORCID: http://
(4JPC 3.0 Гц). Спектр ЯМР 31P (D2O): δP 32.4 м. д.
orcid.org/0000-0002-7899-555X
Найдено, %: С 63.96; Н 5.09; Р 7.52. Вычислено, %:
Галкин Владимир Иванович, ORCID: http://
С 64.88; Н 4.87; Р 7.58.
orcid.org/0000-0003-1035-3427
3-{[2-Карбокси-1-(3,4,5-триметоксифенил)-
КОНФЛИКТ ИНТЕРЕСОВ
этил]дифенилфосфонио}пропаноат (4д). Выход
82.75%, бесцветные кристаллы, т. пл. 174-176°C.
Авторы заявляют об отсутствии конфликта
ИК спектр, ν, см-1: 1710 с (COOH). Спектр ЯМР
интересов.
13С (D2О), δС, м. д.: 17.00 д (1JPC 61.0 Гц), 36.70 д
СПИСОК ЛИТЕРАТУРЫ
(1JPC 68.0 Гц), 27.30 д (2JPC 3.0 Гц), 34.80 д (2JPC
1. Cooney C.A., Dave A.A., Wolff G.L. // J. Nutr. 2002.
50.0 Гц), 174.80 д (3JPC 20.0 Гц), 175.70 д (3JPC
Vol. 132. N. 8. P. 2393S. doi 10.1093/jn/132.8.2393s
18.0 Гц), 117.00 д (1JPC 80.0 Гц), 135.50 д (2JPC
2. Waterland R.A., Jirtle R.L. // Mol. Cell. Biol. 2003.
10.0 Гц), 133.00 д (3JPC 10.0 Гц), 136.00 д (4JPC
Vol. 23. N. 15. P. 5293. doi 10.1128/mcb.23.15.5293-
2.0 Гц), 130.00 д (2JPC 35.0 Гц), 103.90 д (3JPC
5300.2003
15.0 Гц), 153.20 д (4JPC 10.0 Гц), 138.30 д (5JPC
3. Irfan M., Idris A. // Mater. Sci. Eng. 2015. Vol. 56.
7.0 Гц), 58.20 д (6JPC 3.0 Гц), 61.30 д (7JPC 2.0 Гц).
P. 574. doi 10.1016/j.msec.2015.06.035
Спектр ЯМР 31P (D2O): δP 29.0 м. д. Найдено, %:
4. Mollahosseini A., Abdelrasoulab A., Shoker A. //
С 64.45; Н 5.45; Р 5.98. Вычислено, %: С 65.32; Н
Mater. Today Chem. 2020. Vol. 15. P. 1. doi 10.1016/j.
5.85; Р 6.25.
mtchem.2019.100227
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КАРБОКСИЛАТНЫЕ ФОСФАБЕТАИНЫ
1077
5.
He M., Gao K., Zhou L., Jiao Z., Wu M., Cao J., You X.,
Vol. 20. P. 286. doi 10.2174/18715206196661910141
Cai Z., Su Y., Jiang Z. // Acta Biomater. 2016. Vol. 40.
53554
P. 142. doi 10.1016/j.actbio.2016.03.038
14. Galkina I.V., Bakhtiyarova Yu.V., Shulaeva M.P.,
6.
Galkina I., Tufatullin A., Krivolapov D., Bakhtiyarova Y.,
Pozdeev O.K., Egorova S.N., Cherkasov R.A.,
Chubukaeva D., Stakheev V., Galkin V., Cherkasov R.,
Galkin V.I. // J. Chem. 2013. Vol. 2013. P. 1. doi
Büchnerc B., Kataeva O. // CrystEngComm. 2014.
10.1155/2013/302937
Vol. 16. P. 9010. doi 10.1039/c4ce01361a
15. Бахтиярова Ю.В., Миннуллин Р.Р., Галкина И.В.,
7.
Galkina I., Romanov S., Gerasimov A., Bakhtiyaro-
Черкасов Р.А., Галкин В.И. // ЖОХ. 2015. Т. 85.
va Yu., Galkin V. // J. Organomet. Chem. 2020. Vol. 910.
Вып. 9. С. 1453; Bakhtiyarova Yu.V., Minnullin R.R.,
P. 121131. doi 10.1016/j.jorganchem.2020.121131
Galkina I.V., Cherkasov R.A., Galkin V.I. // Russ. J.
8.
Xu D., Wei H., Zhen Y., Gao Y., Li R., Li X., He Y.,
Gen. Chem. 2015. Vol. 85 N 9. P. 2037. doi 10.1134/
Zhang Z., Xie W. // Org. Chem. Front. 2019. Vol. 6.
S1070363215090042
P. 1681. doi 10.1039/C9QO00304E
9.
Il’in A.V., Gubaev A.F., Islamov D.R. Islamov K.R.,
16. Бахтиярова Ю.В., Аксунова А.Ф., Миннуллин Р.Р.,
Galkin V.I. // Chem. Heterocycl. Compd. 2020. Vol. 57.
Галкина И.В., Галкин В.И. // Изв. АН. Сер. хим.
P. 175. doi 10.1007/s10593-021-02890-x
2016. Т. 5. С. 1308; Bakhtiyarova Y.V., Aksunova A.F.,
10.
Il’in A., Gubaev A., Antonova A., Khannanov A., Gal-
Minnullin R.R., Galkina I.V., Galkin V.I. // Russ. Chem.
kin V. // Synth. Commun. 2020. Vol. 50. N 21. P. 3287.
Bull. 2016. V. 65. P. 1308. doi 10.1007/s11172-016-
doi 10.1080/00397911.2020.1799015
1453-5
11.
Tian P., Xiao H., Wang L., Yu Y., Huang Y. //
17. Bakhtiyarova Yu. V., Minnullin R.R., Morozov M.V.,
Tetrahedron Lett. 2019. Vol. 60. P. 1015. doi 10.1016/j.
Bakhtiyarov D.I., Islamov D.R., Dobrynin A.B., Katae-
tetlet.2019.03.015
va O.N., Cherkasov R.A., Galkina I.V., Galkin V.I. //
12.
Nedopekina D.A., Gubaidullin R.R., Odinokov V.N.,
Phosphorus, Sulfur, Silicon, Relat. Elem. 2016.
Maximchik P.V., Zhivotovsky B., Bel’skii Y.P., Khaza-
Vol. 191. P. 1633. doi 10.1080/10426507.2016.1223660
nov V.A., Manuylova A.V., Gogvadze V., Spivak A.Yu. //
18. Romanov S., Aksunova A., Bakhtiyarova Y., Shulae-
MedChemComm. 2017. Vol. 8. N 10. P. 1934. doi
10.1039/c7md00248c
va M., Pozdeev O., Egorova S., Galkina I,. Galkin V. //
13.
Tsepaeva O.V., Nemtarev A.V., Salikhova T.I., Abdul-
J. Organomet. Chem. 2020. Vol. 910. P. 121130. doi
lin T.I., Grigor’eva L.R., Khozyainova S.A., Miro-
10.1016/j.jorganchem.2020.121130
nov V.F. // Anti-Cancer Agents Med. Chem. 2020.
19. Karplus M. // J. Chem. Phys. 1960. Vol. 33. P. 1842.
Carboxylate Phosphabetains Containing Optically Active
Carbon Atom: Synthesis and NMR Spectroscopy Data
S. R. Romanov*, Yu. V. Bakhtiyarova, M. V. Morozov, F. Kh. Karataeva,
V. V. Klochkov, I. V. Galkina, and V. I. Galkin
Kazan (Volga Region) Federal University, Kazan, 420008 Russia
*e-mail: Semyonromanov@yandex.ru
Received May 16, 2021; revised June 8, 2021; accepted June 10, 2021
The nucleophilic addition reactions of tertiary phosphines and unsaturated carboxylic acids lead to the formation
of mono- and dicarboxylate phosphabetaines, containing asymmetric carbon atom. For all substances diastereo-
topic geminal protons of methylene groups were identified by 1D and 2D NMR spectroscopy.
Keywords: carboxylate phosphabetaine, tertiary phosphine, unsaturated carboxylic acid, phosphonium salt,
diastereotopic protons
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021