ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1078-1091
УДК 544.424.2
О РОЛИ ПРОТОНИРОВАНИЯ
ФЕРРОЦЕНИЛМЕТАНОЛА ПРИ ЕГО ОКИСЛЕНИИ
п-БЕНЗОХИНОНОМ В ПРИСУТСТВИИ ХЛОРНОЙ
КИСЛОТЫ
© 2021 г. В. М. Фомин*, Н. Н. Шуклина
Нижегородский государственный университет имени Н. И. Лобачевского,
пр. Гагарина 23, Нижний Новгород, 603950 Россия
*e-mail: niih325@bk.ru
Поступило в Редакцию 31 марта 2021 г.
После доработки 30 мая 2021 г.
Принято к печати 3 июня 2021 г.
В системе FcCH2OH-HClO4-п-бензохинон (Fc - ферроценил) имеет место окисление металлокомплек-
са не только п-бензохиноном, но и ионом водорода в результате его протонирования. Необходимость
участия кислоты в обоих процессах обусловливает влияние каждого из них на скорость протекания
другого, что подтверждается характером установленных зависимостей скорости накопления катиона
ферроцения при протонировании и окислении FcCH2OH п-бензохиноном от концентрации реагентов и
кинетическими уравнениями, описывающими эти процессы. Степень их влияния друг на друга зависит
от сольватирующих свойств растворителей и соотношения начальных концентраций металлокомплекса
и кислоты, влияющих на выход карбокатиона FcC+H2 и его способность к редокс-изомерии при прото-
нировании металлокомплекса.
Ключевые слова: ферроценилметанол, п-бензохинон, редокс-изомерия, катион ферроцения, окисление,
кинетические закономерности
DOI: 10.31857/S0044460X2107012X
Известно, что окисление производных ферро-
в комплекс FcC+H2∙∙∙OOR и тем самым дезактиви-
цена с различными функциональными группами
рует их. Впоследствии карбокатион FcC+H2 был
кислородом [1] или гидропероксидами [2] в при-
зафиксирован при протонировании FcCH2OH по
сутствии сильных кислот осложняется процессом
полосе поглощения с λmax 600 нм в электронном
протонирования металлокомплексов, приводящим
спектре реакционной смеси [Фомин В.М. и др.,
к образованию ферроценилкарбениевых ионов.
ЖОХ, 2016, т. 86, вып. 5].
Ранее нами было показано, что протонирование
Влияние протонирования на кинетику окис-
ферроценилметанола FcCH2OH и ферроценилук-
ления формил- и ацетилферроцена [2], а также
сусной кислоты FcCH2СООН хлорной кислотой
ферроценилуксусной кислоты [Фомин В.М. и др.,
приводит к ингибированию процессов их окис-
ЖОХ, 2008, т. 78, вып. 7] пероксидом водорода
ления кислородом по радикально-цепному меха-
проявляется в виде экстремальной зависимости
низму, которое имеет место в присутствии более
скорости реакции от концентрации HClO4 или
слабых кислот или вообще в их отсутствие. На-
блюдаемый эффект сильной кислоты объяснялся
CF3COOH, которая, по нашему мнению, обуслов-
образованием карбокатиона FcC+H2 при протони-
лена образованием карбокатионов, более устойчи-
ровании указанных соединений, который связы-
вых к окислению, чем нейтральные металлоком-
вает пероксидные радикалы RO2, ведущие цепь,
плексы.
1078
О РОЛИ ПРОТОНИРОВАНИЯ ФЕРРОЦЕНИЛМЕТАНОЛА
1079
Говоря о влиянии процесса протонирования
такого разделения зарядов нет, причем сольвата-
металлокомплексов на процесс их окисления в
ция карбокатионов стабилизирует их [8];
присутствии сильных кислот, необходимо учиты-
- как сказывается и насколько велико влияние
вать еще один и возможно самый важный фактор
процесса протонирования металлокомплекса на
этого влияния, связанный со склонностью образу-
кинетические закономерности их окисления?
ющихся при протонировании металлокомплексов
- можно ли разделить процессы протонирова-
ферроценилкарбениевых ионов к редокс-изоме-
ния и окисления металлокомплекса по результатам
рии с образованием катионов ферроцения. Досто-
кинетических исследований, и каковы их относи-
верно это установлено для ферроценилметанола
тельные скорости?
FcCH2OH [3, 4], его метильного производного
Исходя из изложенного, целью настоящего
FcCHCH3OH [5, 6] и винилферроцена FcCH=CH2
[4]. Для FcCH2OH процесс протонирования опи-
исследования явилось изучение кинетики и ме-
ханизма окисления ферроценилметанола п-бензо-
сывается уравнением (1).
хиноном в присутствии хлорной кислоты (НХ) и
роли протонирования металлокомплекса в этом
процессе. Выбор FcCH2OH в качестве объекта ис-
следования обусловлен, прежде всего, возможно-
(1)
стью раздельной фиксации карбокатиона FcC+H2
(λmax 600 нм) и катиона ферроцения в составе
димера (FcC+H2)2 (λmax 628 нм), что позволяет
Не вызывает сомнения, что его протекание бу-
проследить динамику появления и превращения
дет сказываться на кинетике окисления металло-
первого во второй в различных условиях. Выбор
комплекса окислителем, который проявляет свои
п-бензохинона в качестве окислителя обусловлен
свойства или усиливает их в присутствии кис-
его высоким стандартным редокс-потенциалом,
лот. Поэтому в работах, посвященных окислению
равным 0.72 В в кислой среде [9], и молекулярным
COOH пероксидом водорода,
FcCH2OH и FcCH2
характером процессов с его участием [Фомин В.М.
для уменьшения влияния протонирования метал-
и др., ЖОХ, 2018, т. 88, вып. 10].
локомплекса изучение кинетики процесса прово-
В начале настоящего исследования актуальным
дилось в присутствии более слабой трифторуксус-
являлся вопрос о выборе растворителя, использо-
ной кислоты [2].
вание которого позволяло бы достичь поставлен-
Между тем несомненный интерес представляет
ной цели. Для этого растворитель должен обладать
изучение процесса окисления производных ферро-
свойствами, которые обеспечивали бы не только
цена в присутствии именно сильных кислот, если
высокий выход карбокатиона FcC+H2, но и не пре-
оно протекает не по радикально-цепному механиз-
пятствовали его редокс-изомерии, которая априо-
му, поскольку только в этом случае появляется воз-
ри должна зависеть от сольватирующих свойств
можность получить ответы на вопросы, проливаю-
растворителя.
щие свет на суть протекающих процессов. Среди
Ранее нами было показано, что выход карбока-
этих вопросов наиболее очевидными, по нашему
тиона при протонировании FcCH2OH существен-
мнению, являются следующие:
но зависит от соотношения начальных концен-
- какое влияние оказывает природа раство-
траций металлокомплекса и кислоты и природы
рителей на параллельно протекающие процессы
растворителя [Фомин В.М. и др., ЖОХ, 2016, т. 86,
протонирования и окисления металлокомплекса,
вып. 5]. При [FcCH2OH]0 >> [HClO4]0 влияние по-
поскольку оно может оказаться диаметрально про-
следнего характеризуется рядом: Diox ≈ MeCN >>
тивоположным, принимая во внимание, что окис-
Diox-H2O(1:1) ≥ EtOH ≥ ДМФА ≈ ДМСО, причем
ление металлокомплекса протекает с разделением
ни в диоксане, ни в ацетонитриле, в которых вы-
зарядов и ему способствуют растворители с высо-
ход FcC+H2 самый высокий в этих условиях, ре-
кой диэлектрической проницаемостью [7], а при
докс-изомерия не наблюдается. По этой причине
редокс-изомерии ферроценилкарбениевых ионов
мы изучили влияние этих же растворителей на
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1080
ФОМИН, ШУКЛИНА
редокс-изомерию карбокатиона FcC+H2, но уже
при [HClO4]0 >> [FcCH2OH]0. Полученные данные
свидетельствуют о том, что в приведенном ряду
растворителей, редокс-изомерия карбокатиона на-
блюдается только в диоксане, отличающегося от
всех других членов ряда низкой диэлектрической
проницаемостью.
Точно такой же ряд влияния природы раство-
рителей на редокс-изомерию ферроценилкарбени-
евых ионов, образующихся при протонировании
ферроценилкарбоновой и ферроценилуксусной
кислот, был установлен ранее в работе [10].
Это говорит о существенном вкладе неспеци-
фической сольватации в стабилизацию карбокати-
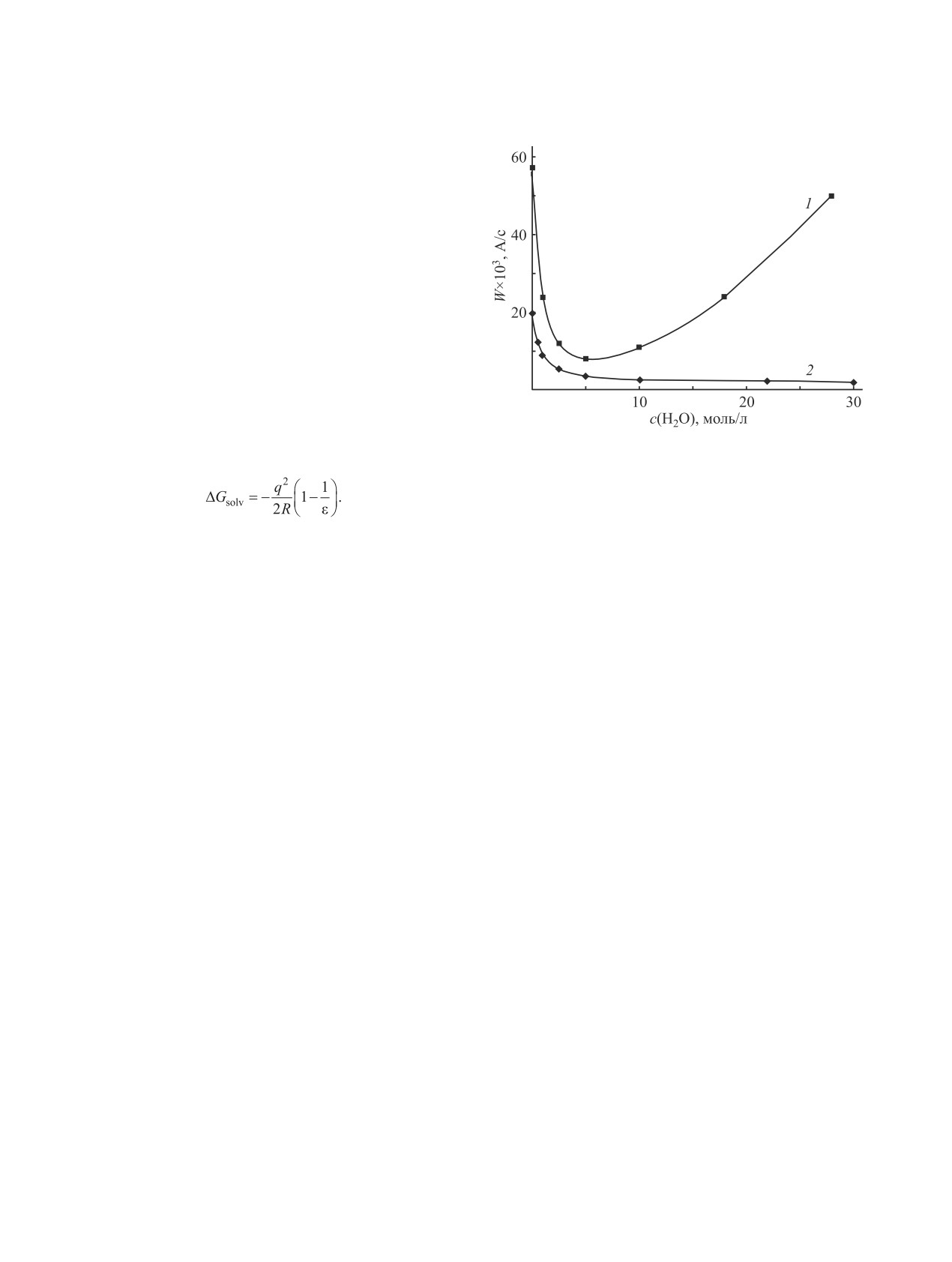
Рис. 1. Влияние концентрации воды в смешанном
она, которую можно оценить по уравнению (2) [8].
растворителе Diox-H2O на скорость редокс-изо-
мерии FcC+H2 (1) и окисление FcCH2OH п-бен-
(2)
зохиноном (2) при 23°С. c0FcCH2OH 0.001 M., c0HClO4
0.1 M., c0ПХ 0.005 M.
Здесь ΔGsolv - изменение свободной энергии при
λ 600 нм в MeCN или диоксане соответствен-
переносе иона из газовой фазы в среду с диэлек-
но, полученного при условии [FcCH2OH]0 >>
трической проницаемостью ε, R - радиус иона.
[HClO4]0 при внесении в раствор добавок ДМФА
Отметим, что роль неспецифической сольва-
или ДМСО в количестве 3% от его объема. Этот
тации в стабилизации карбокатиона особенно
результат объясняет ранее установленный факт,
показательна при сравнении диоксана и MeCN, в
что в ДМФА и ДМСО фиксируемая концентрация
которых, как было показано выше, выходы кар-
FcC+H2 близка к нулю.
бокатиона при протонировании FcCH2OH близки
Добавки воды приводят к такому же, но бо-
между собой, а его редокс-изомерия наблюдается
лее слабому эффекту. Этанол и вода (ROH) могут
только в диоксане. Поэтому в дальнейшем кинети-
взаимодействовать с FcC+H2 по уравнению
(4)
ка процессов, протекающих в системе FcCH2OH-
[Фомин В.М. и др., ЖОХ, 2016, т. 86, вып. 5], из-
HClO4-п-бензохинон, изучалась преимуществен-
вестному и для карбокатионов иной природы [8].
но в этом растворителе.
Влияние специфической сольватации на выход
+
FcC
H
+ROH
→FcCH
OR+H+
(4)
FcC+H2 особенно заметно в высокоосновных ди-
2
←
2
полярных ДМФА и ДМСО, а также в гидроксил-
содержащих растворителях, и связано оно с осо-
Влияние воды в составе смешанного раство-
бенностями их взаимодействия с карбокатионом,
рителя Diox-H2O на процессы редокс-изомерии
приводящим к изменению его природы. Взаимо-
FcC+H2 и окисления металлокомплекса п-бензохи-
действие ДМФА и ДМСО с карбокатионом может
ноном следует отметить особо. В соответствии с
приводить к миграции катионного центра на один
уравнениями (1) и (4), наличие воды в реакцион-
из атомов молекулы растворителя S (3).
ной смеси должно снижать выход карбокатиона,
а следовательно, и скорость его редокс-изомерии.
+
FcC+H
+S→
FcCH
S
2
←
[
2
]
(3)
Это подтверждается данными, приведенными на
рис. 1, из которого следует, что в отсутствие п-бен-
В пользу такого взаимодействия FcC+H2
зохинона увеличение концентрации воды в диок-
с растворителем говорит значительное сни-
сане приводит к снижению скорости образования
жение в
~1.7 и
~2.2 раза интенсивно-
катиона ферроцения WFc+1 до некоторого мини-
сти полосы поглощения карбокатиона с
мального значения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
О РОЛИ ПРОТОНИРОВАНИЯ ФЕРРОЦЕНИЛМЕТАНОЛА
1081
Рис. 2. Влияние природы растворителя на скорость образования катиона ферроцения при окислении FcCH2OH п-бен-
зохиноном при 23°С. (а) - электронные спектры реакционных смесей, (б) - кинетические кривые накопления катиона
ферроцения. 1 - Diox, 2 - Diox-H2O (1:1), 3 - MeCN, 4 - EtOH, 5 - Diox-H2O (29:1), 6 - ДМФА, c0FcCH2OH 0.001 M., c0HClO4
0.1 M., c0ПХ 0.005 M, t 10 с.
В присутствии п-бензохинона характер за-
центрациях воды, показателем которой является
висимости общей скорости накопления катиона
диэлектрическая проницаемость среды ε, уско-
ферроцения WFc+ от концентрации воды претер-
ряющей его. В нашем случае ниспадающая ветвь
певает существенные изменения. При увеличении
зависимости 2 на рис. 1 обусловлена еще и сниже-
концентрации воды наблюдается сначала быстрое
нием выхода FcC+H2 в присутствии воды, а следо-
уменьшение скорости накопления катиона ферро-
вательно, и скорости его редокс-изомерии.
цения, а затем ее возрастание, хотя и более мед-
Вышеизложенное находит свое подтверждение
ленное. Аналогичная зависимость характеризует
и в наблюдаемой зависимости скорости образова-
и влияние воды на скорость окисления 1,1′-ди-
ния катиона ферроцения при окислении FcCH2OH
этилферроцена п-бензохиноном в ацетонитриле
п-бензохиноном от природы растворителя
[Фомин В.М. и др., ЖОХ, 2018, т. 88, вып. 10],
(рис. 2а), которая представлена рядом: ДМФА
т. е. в условиях, исключающих образование кар-
(ε 36.71) < Diox-H2O (29:1, ε 4.30) ˂ EtOH (ε 24.30) ˂
бокатиона в реакционной смеси, что говорит об
MeCN (ε 36.60) ˂ Diox-H2O (1:1, ε 49) ≤ Diox
общности причин, обусловливающих характер
(ε 2.4), и кажется, на первый взгляд, весьма нео-
этих зависимостей. Точка минимума на получен-
бычной, если сравнивать диэлектрические прони-
ной экстремальной зависимости разделяет обла-
цаемости растворителей.
сти преимущественного влияния специфической
сольватации реагентов при низких концентраци-
Если же учесть различие в способности раство-
ях воды, затрудняющей протекание исследуемого
рителей к специфической сольватации реагентов,
процесса (речь идет об образовании водородных
то их последовательность в приведенном ряду
связей между водой и п-бензохиноном, блокиру-
становится понятной. В диоксане, для которого
ющих его взаимодействие с другими реагентами),
специфическая сольватация п-бензохинона неха-
и неспецифической сольватации при высоких кон-
рактерна, скорость окисления металлокомплекса
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1082
ФОМИН, ШУКЛИНА
Схема 1.
вать их суммарное количество в процессе реакций,
H
протекающих в системе FcCH2OH-HClO4-п-бен-
K1
+
FcCH2OH + H+
FcCH2O
(1.1)
зохинон, а общую скорость накопления катионов
H
ферроцения WFc+ можно представить в виде кине-
H
тического уравнения (5), в котором первое слагае-
K2
+
FcCH2O
FcC+H2 + H2O
(1.2)
мое характеризует скорость образования катиона
H
ферроцения в результате редокс-изомерии Fc+CH2,
а второе - в результате окисления FcCH2OH п-бен-
k
•
FcC+H2
Fc+CH2
1/2(Fc+CH2)2
(1.3)
зохиноном.
оказывается самой высокой, несмотря на низкое
значение ε, что свидетельствует о преобладающем
(5)
вкладе редокс-изомерии FcC+H2 в этот процесс.
В пользу этого говорит и более высокая скорость
Выражение для скорости окисления FcCH2OH
окисления ферроцена п-бензохиноном в ацетони-
п-бензохиноном в общем виде принимается анало-
триле по сравнению с диоксаном [Фомин В.М. и
гичным выражению для скорости окисления фер-
др., ЖОХ, 2018, т. 88, вып. 10]. В смешанном рас-
роцена тем же окислителем [Фомин В.М. и др.,
творителе Diox-H2O (29:1) с небольшим содержа-
ЖОХ, 2018, т. 88, вып. 10]. Если концентрацию
нием воды специфическая сольватация преобла-
Fc+CH2, выразить через константу равновесия K
дает, что вкупе с малым значением ε приводит к
первичной стадии в уравнении (1), то уравнение
низкой скорости реакции. При переходе от него к
(5) трансформируется в уравнение (6), характери-
EtOH, MeCN и далее к смешанному растворителю
зующее зависимость WFc+ от концентрации исход-
Diox-H2O с высоким содержанием воды, т. е. по
ных реагентов.
мере увеличения ε начинает сказываться влияние
неспецифической сольватации, что проявляется в
увеличении скорости окисления симбатно увели-
(6)
чению диэлектрической проницаемости раствори-
теля. ДМФА не входит в этот ряд растворителей,
несмотря на высокое значение этого параметра,
Оно позволяет рассматривать исследуемый
поскольку скорость реакции в нем даже ниже, чем
процесс, как окисление ферроценилметанола по
в смешанном растворителе Diox-H2O со значени-
двум параллельным маршрутам, поскольку про-
ем ε 4.30. Для объяснения этого факта необходимо
тонирование металлокомплекса по своему конеч-
учитывать специфическое взаимодействие ДМФА
ному результату можно рассматривать, как его
не с исходными реагентами, а с карбокатионом
окисление ионом водорода по нетривиальному ме-
FcC+H2, что приводит к связыванию последнего
ханизму. Особенность этого механизма заключа-
[уравнение (3)] и влечет за собой снижение теку-
ется в том, что ион водорода выступает не в роли
щей концентрации FcCH2OH в растворе, а следо-
одноэлектронного окислителя и не восстанавлива-
вательно, и скорости его окисления п-бензохино-
ется до молекулярного, что по определению невоз-
ном.
можно, поскольку его стандартный редокс-потен-
Данные, приведенные на рис. 2, иллюстрируют
циал существенно ниже, чем потенциал FcCH2OH
еще один важный результат: хотя катионы ферро-
(который близок к потенциалу ферроцена, 0.59 В
цения (FcC+H2)2
и Fc+CH2OH, образующиеся в ре-
[11]), а является акцептором электронной пары ги-
зультате протонирования FcCH2OH и его окисле-
дроксильной группы в металлокомплексе и входит
ния п-бензохиноном в диоксане, и отличаются по
в дальнейшем в состав одного из продуктов реак-
своему составу друг от друга, их электронные спек-
ции, а именно воды. Это отражено на приведенной
тры в видимой области практически неразличимы,
ниже схеме протонирования
FcCH2OH, включа-
и потому фиксируются в виде одной полосы по-
ющей в качестве его первичной стадии образова-
глощения с λmax 628±1 нм. Это позволяет фиксиро-
ние оксониевого иона FcCH2O+H2, существование
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
О РОЛИ ПРОТОНИРОВАНИЯ ФЕРРОЦЕНИЛМЕТАНОЛА
1083
которого показано в работах ранее, и что вообще
бинации катион радикала Fc+C•H2, затрудняющей
характерно для протонирования спиртов [11].
не только изучение его свойств, но и фиксацию ме-
Следуя логике схемы, становится понятным,
тодом ЭПР с помощью спиновой ловушки [17, 18].
что именно стадия (1.1) определяет возможность
Приближенно оценить обратимость стадии ре-
протекания стадии (1.2), а, следовательно, и конеч-
докс-изомерии FcC+H2 (8) можно, если в качестве
ный результат всего процесса, поскольку образо-
меры обратимости процесса рассматривать вели-
вание оксониевого иона протекает с выделением
чину отношения констант скоростей прямой k1 и
значительного количества энергии вследствие вы-
обратной k2 реакций, которая, в свою очередь, свя-
сокого сродства к протону спиртовых гидроксиль-
зана со значением ΔrG° процесса в соответствии с
ных групп [12] (которое даже выше, чем сродство
уравнением изотермы (9).
воды, равное 170 ккал/моль [13]). Эта избыточная
энергия компенсирует в дальнейшем затраты энер-
(8)
гии на разрыв связи С-О в оксониевом ионе (~80-
90 ккал/моль), в результате которого образуются
вода и карбокатион FcC+H2. Потери энтропии на
(9)
стадии (1.1) компенсируются ее возрастанием на
стадии (1.2). Это позволяет говорить о том, что
Если принять, что для обратимого процес-
суммарный процесс (7), включающий стадии (1.1)
S° ≈ 0, то получим, что
са переноса электрона Δ
r
и (1.2), характеризуется суммарным значением
Δ
G° ≈ ΔrH° < 0 и уравнение (9) преобразуется в
r
∆G0<0, т. е. является самопроизвольным.
уравнение (10), где Е1 и Е2 - энергии активации
прямой и обратной реакций, из которого следует,
(7)
что энергия активации обратной реакции больше
энергии активации прямой на величину энтальпии
Протеканию реакции способствуют сольва-
реакции, которая таким образом и определяет ее
тация карбокатиона, увеличивающая его ста-
обратимость.
бильность, и протонирование Н2О. Необходимо
подчеркнуть, что высокое сродство к протону ха-
(10)
рактерно и для других функциональных групп -
карбонильной и карбоксильной [12], и потому не
случайно, что протонирование производных фер-
Если теперь априори задать приемлемые зна-
роцена с этими функциональными группами так-
чения ΔrH°, то на основании полученных величин
отношения k1/k2 можно сделать интересующий нас
же приводит к образованию соответствующих ка-
вывод, справедливый для конкретной температу-
тионов ферроцения [10, 14].
ры реакции (296 K).
В приведенной схеме 1 и во всех обсуждае-
мых ниже, стадия редокс-изомерии FcC+H2, яв-
ляющаяся заключительной в процессе окисления
-ΔrH°, ккал/моль
k1/k2
FcCH2OH
ионом водорода, рассматривается как
5.0
5.01×103
необратимый процесс. Основанием для этого по-
10.0
2.51×107
служила высокая скорость самопроизвольного
протекания этой элементарной реакции при ком-
15.0
1.26×1011
натной температуре, что возможно при низком
значении энергии активации и ΔrG < 0. Отме-
Из приведенных данных видно, что при |ΔrH°| ≥
тим, что вопрос об обратимости реакции, имею-
10 ккал/моль скоростью обратного превращения
щий принципиальное значение для установления
FcC+H2
можно фактически пренебречь и считать
свойств ферроценилкарбениевых ионов в химии
стадию редокс-изомерии практически необрати-
ферроцена, поднимался в работах [15, 16], одна-
мой. При понижении температуры реакции не-
ко эта тема не получила своего продолжения, что
обратимость становится еще более выраженной,
связано, скорее всего, с высокой скоростью реком-
при увеличении - наоборот.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1084
ФОМИН, ШУКЛИНА
В принципе, значение ΔrH° можно рассчитать
по значениям потенциалов ионизации атома желе-
за и углеродцентрированного радикала в молекуле
ферроценилметильного радикала FcC•H2, при ус-
ловии, что удастся определить эти потенциалы.
(11)
Однако можно не сомневаться в том, что второй
потенциал ионизации должен быть заметно выше
первого. При их разнице всего в 0.5 эВ ΔrH° =
-11/5 ккал/моль. Для подтверждения сказанного
можно сравнить потенциалы ионизации FcC2H5 и
CH3C•H2, равные 155.4 и 202.5 ккал/моль соответ-
ственно [12].
Для полноты картины отметим, что протон
все-таки может выступать в роли одноэлектрон-
ного окислителя ферроценовой системы, как это
имеет место при протонировании 1,1-ферроцефа-
на, приводящем к образованию двух металлоги-
Рис. 3. Зависимости скорости накопления катиона
дридных положительно заряженных фрагментов
ферроцения от концентрации FcCH2OH (1, 3) и НХ
Fc-H, пространственная сближенность которых
(2, 4) при редокс-изомерии FcC+H2 (1, 2) и окислении
FcCH2OH п-бензохиноном (3, 4) при 23°С. Отнесение
обеспечивает их взаимодействие, заканчивающее-
кривых 41 и 42 см. в тексте. c0FcCH2OH 0.001 M. (2, 4),
ся образованием молекулы водорода и двух кати-
0
c
HClO
0.001 M. (1, 3), c0ПХ 0.005 M.
4
онов ферроцения в составе одной молекулы [19].
Для оценки вклада процесса протонирования
Не менее важно и то, что стабилизированный
FcCH2OH
в брутто-процесс его окисления необхо-
таким образом карбокатион не склонен к редокс-и-
димо учитывать не только влияние природы рас-
зомерии ни в диоксане, ни в ацетонитриле, и мо-
творителя на выход карбокатиона FcC+H2
и его
жет существовать без каких-либо изменений в те-
способность к редокс-изомерии, но и влияние на
чение достаточно длительного времени.
эти же процессы соотношения начальных концен-
траций металлокомплекса и кислоты, которое ра-
Результаты изучения кинетики редокс-изоме-
нее было установлено [Фомин В.М. и др., ЖОХ,
рии карбокатиона в диоксане, приведенные на
2016, т. 86, вып. 5]. Согласно этим данным выход
рис. 3 свидетельствуют о том, что зависимости
FcC+H2
при [FcCH2OH]0>[HClO4]0 в десятки раз
скорости накопления катиона ферроцения от кон-
выше, чем при [HClO4]0>[FcCH2OH]. Это объясня-
центраций металлокомплекса и кислоты суще-
ется тем, что при избытке FcCH2OH относительно
ственно отличаются друг от друга. При небольших
HClO4 образующийся карбокатион стабилизиру-
концентрациях реагентов начальная скорость ре-
ется путем координации с материнским соедине-
акции WFc+1
линейно увеличивается с их ростом,
нием, причем координационный комплекс может
что соответствует первому порядку процесса по
существовать в виде вырожденного равновесия
концентрации каждого из них.
двух структур, что вносит дополнительный вклад
(13)
в стабилизацию карбокатиона.
При более высоких концентрациях кислоты
H
H
скорость реакции стремится к предельному зна-
FcC+H2···O-CH2Fc
FcCH2-O···+CH2Fc.
чению WFc+max.1 (рис. 3, кривая 1), в то время как
при увеличении концентрации FcCH2OH она рас-
(12)
тет до некоторого максимального значения, после
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
О РОЛИ ПРОТОНИРОВАНИЯ ФЕРРОЦЕНИЛМЕТАНОЛА
1085
щение полосы поглощения реакционных смесей в
коротковолновую область, это говорит о наличии
в них наряду с катионом ферроцения карбокатио-
на FcC+H2 (λmax 600 нм). При c0FcCH2OH 0.04 моль/л
Δλmax ≈ 10 нм, при c0FcCH2OH 0.05 моль/л Δλmax ≈
21 нм. Все это затрудняет определение реальной
скорости редокс-изомерии при этих концентраци-
ях металлокомплекса. При концентрациях послед-
него, равных 0.08 и 0.1 моль/л, электронный спектр
содержит в видимой области только полосу по-
глощения карбокатиона высокой интенсивности,
что позволяет принять скорость редокс-изомерии
FcC+H2 в этих условиях равной нулю. С учетом
изложенного скорости WFc+1, определенные по ки-
нетическим кривым, обозначены на зависимости 2
(рис. 3) заштрихованными кружками, вероятные -
Рис. 4. Зависимость скорости накопления катиона фер-
незаштрихованными, а кривая, соединяющая их, -
OH п-бензохиноном в
роцения при окислении FcCH2
пунктирной линией. В пользу стабилизации карбо-
различных растворителях от концентрации окислителя.
катиона путем координации с металлокомплексом,
1, 4 - Diox, 2 - Diox-H2O (1:1), 3 - MeCN, c0FcCH2OH
0.001 (1-3), 0.1 M. (4), c0HClO4 0.1 (1-3), 0.001 M. (4).
определяющей характер полученной зависимости
2, свидетельствуют результаты кинетического ана-
лиза схемы протонирования FcCH2OH, включаю-
чего начинает уменьшаться практически до нуля
щей равновесную стадию образования комплекса
(кривая 2). Принимая во внимание данные рабо-
FcC+H2· FcCH2OH, которые приведены ниже. В
ты [Фомин В.М. и др., ЖОХ, 2016, т. 86, вып. 5],
анализируемой схеме 2 стадия (2.1) суммирует
можно считать, что ингибирование процесса ре-
стадии (1.1) и (1.2) в схеме 1. Соответственно, K
докс-изомерии
FcC+H2
при больших концентра-
= K1·K2.
циях FcCH2OH относительно кислоты является
+
W
= k[FcC
H ].
(14)
следствием дезактивации образующегося карбока-
+
2
Fc
1
тиона за счет координации с металлокомплексом.
При [FcCH2OH]0 >> [HClO4]0 для получения за-
Получение зависимости 2, рис. 3 и ее вид тре-
висимости WFc+1 от начальной концентрации кис-
буют пояснения. Анализ спектров реакционных
лоты необходимо учитывать баланс по ее концен-
смесей свидетельствует о том, что фиксация кати-
трации, который определяется соотношением (15).
она ферроцения по полосе поглощения с λmax 628
нм и определение скорости его накопления по ки-
нетическим кривым возможны при концентраци-
ях металлокомплекса не выше 0.035 моль/л. При
более высоких концентрациях наблюдается сме-
(15)
Схема 2.
FcCH2OH + H+
K FcC+H2 + H2O
(2.1)
Ka
FcC+H
(2.2)
FcC+H2 + FcCH2OH
2·FcCH2OH
k
•
FcC+H2
Fc+CH
(2.3)
2
•
Fc+CH2
1/2(Fc+CH2)2
(2.4)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1086
ФОМИН, ШУКЛИНА
Равновесную концентрацию FcC+H2
найдем из
материального баланса по концентрации метал-
выражения для константы равновесия K, подстав-
локомплекса в виде соотношения (20) приводит к
ляя в него выражение для текущей концентрации
выражениям для концентрации FcC+H2
и скорости
кислоты из соотношения (15)
его редокс-изомерии (21), (22).
K[FcCH
2
OH]
0
[H+]
0
[FcC+H
]
=
,
(21)
2 0
[H
2
O]
+
K
[H+]
0
(16)
+
kK[FcCH
OH]
[H
]
2
0
0
W
=
(22)
+
Тогда скорость накопления катиона ферроцения
Fc 1
[H
O]
+
K
[H+]
2
0
в результате редокс-изомерии FcC+H2
будет равна:
При низких концентрациях кислоты уравнение
[H
] [FcCH
OH]
kK
2 0
2
0
(22) преобразуется в уравнение, идентичное урав-
W
=
+
2
Fc 1
[H
2
O]+
K[FcCH
2
OH]
0
+
KK
a
[FcCH
2
OH]
0
нению (18), при больших концентрациях - в урав-
(17)
нение (23), соответствующее достижению макси-
мальной скорости реакции WFc+1
Следует отметить, что поскольку не только
здесь, но и далее речь идет о начальных скоростях
W
+
=
k[FcCH
2
OH]
0
(23)
реакции, то в уравнениях (16) и (17) и во всех по-
Fc 1max
следующих можно пользоваться начальными кон-
При введении п-бензохинона в реакционную
центрациями металлокомплекса и других реаген-
смесь, содержащую FcCH2OH
и НClO4, на про-
тов.
цесс редокс-изомерии FcC+H2
накладывается
При небольших концентрациям металлоком-
процесс образования катионов ферроцения в ре-
плекса уравнение (17) принимает вид, соответству-
зультате окисления металлокомплекса введенным
ющий восходящей ветви, приведенной на рис. 4
окислителем. Тем не менее, зависимости общей
зависимости WFc+1 = f([FcCH2OH]0), уравнение (18).
скорости накопления катионов ферроцения WFc+1
+
от концентрации FcCH2OH
и НClO4, приведенные
kK[FcCH
2
OH]
0
[H
]
0
=
(18)
на рис. 3, имеют много общего с зависимостями
W +
Fc 1
[H
O]
2
WFc+1от концентрации этих же реагентов в отсут-
ствие п-бензохинона.
При больших концентрациях металлокомплек-
Из рис. 3 видно, что зависимость 3 WFc+ =
са уравнение (17) преобразуется в уравнение (19),
f([FcCH2OH]0) имеет такой же экстремальный
описывающее ниспадающую ветвь этой же зави-
характер и необычный вид, как и зависимость 2
симости.
WFc+1 = f([FcCH2OH]0). Причина экстремально-
+
го характера одна и та же - полное расходование
k[H
]
0
W
=
(19)
+
кислоты на протонирование ферроценилметанола
Fc 1
1+
K
[FcCH
OH]
a
2
0
по мере роста его концентрации, при отсутствии
которой (кислоты) п-бензохинон теряет свои окис-
Таким образом, именно учет стадии (2.2) при
лительные свойства. Одни и те же причины, рас-
анализе схемы процесса приводит к уравнению (17),
смотренные выше, обусловливают и необычный
адекватно описывающему зависимость WFc+1 =
вид этих зависимостей. Из этого же рисунка вид-
f([FcCH2OH]0) во всем диапазоне изменения кон-
но, что зависимость WFc+ = f([HClO4]0) (кривая 4)
центрации металлокомплекса.
на начальном участке имеет вид, аналогичный за-
Зависимость WFc+1 от концентрации кислоты
висимости 1, полученной при отсутствии п-бензо-
предполагает избыток кислоты относительно ме-
хинона в реакционной смеси. Далее скорость про-
таллокомплекса, когда стадия (2.2) в схеме его про-
цесса практически линейно растет с возрастанием
тонирования не играет существенной роли. Учет
концентрации кислоты в выбранном интервале ее
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
О РОЛИ ПРОТОНИРОВАНИЯ ФЕРРОЦЕНИЛМЕТАНОЛА
1087
значений. Совершенно очевидно, что начальный
висимости к оси абсцисс, зависит, как нетрудно
участок этой зависимости описывается уравнени-
видеть, от значений начальных концентраций ме-
ем (22), поскольку в первом приближении скоро-
таллокомплекса и кислоты, эффективной констан-
стью накопления катиона ферроцения в результате
ты скорости реакции металлокомплекса с п-бен-
окисления FcCH2OH бензохиноном на этом участ-
зохиноном, которые, в свою очередь, зависят от
ке можно пренебречь.
природы используемого растворителя.
Характерный вид зависимости 4 на рис. 3 по-
Зависимость 1 не сохраняет свою линейность
зволяет легко выделить из нее предполагаемые
при изменении концентрации п-бензохинона в ши-
составляющие суммарного процесса окисления
роком диапазоне ее значений и скорость реакции,
металлокомплекса, относящиеся к его протониро-
достигнув своего максимального значения, начи-
ванию и окислению п-бензохиноном, в виде кри-
нает уменьшаться с ростом концентрации окисли-
вых 41 и 42 соответственно, из сравнения которых
теля.
можно прийти к однозначному выводу о том, что
Если выход FcC+H2 при карбонилировании
при
[НClO4]0>[FcCH2OH]0 начальная скорость
FcCH2OH свести до минимума, равно как и ско-
образования катиона ферроцения в результате
рость его редокс-изомерии, путем разбавления
протонирования металлокомплекса существенно
диоксана водой или замены его ацетонитрилом, в
выше скорости образования катиона ферроцения
котором хотя и наблюдается образование FcC+H2,
за счет его окисления п-бензохиноном. Из этих же
однако последний не склонен к редокс-изомерии,
зависимостей следует, что в диоксане вклад про-
то слагаемое a в уравнении (24) можно, либо умень-
цесса протонирования металлокомплекса в общий
шить, либо свести практически к нулю. В этом
процесс его окисления не является постоянным, а
случае зависимости WFc+ = f([п -бензохинон]0)
меняется с изменением соотношения начальных
выходят из более низкой точки на оси ординат или
концентраций ферроценилметанола и хлорной
из начала координат (зависимости 2 и 3 соответ-
кислоты, а также концентрации п-бензохинона.
ственно).
Картина исследуемого процесса была бы непол-
Характерно, что в ацетонитриле и в этаноле,
ной без результатов изучения зависимости скоро-
где выход FcC+H2 близок к нулю, скорость окис-
сти окисления FcCH2OH от концентрации п-бензо-
ления FcCH2OH стремится к предельному значе-
хинона и влияния на нее природы растворителей
нию при высоких концентрациях окислителя, что
и соотношения концентраций ферроценилмета-
можно рассматривать как косвенное доказатель-
нола и хлорной кислоты, которые приведены на
ство образования координационного комплекса
рис. 4. Зависимость 1, которая при небольших кон-
центрациях п-бензохинона является линейной, по-
HOCH2Fc∙OC6H4O в процессе реакции.
лучена в диоксане в условиях стократного избытка
Если соотношение начальных концентраций
концентрации кислоты по сравнению с концен-
кислоты и металлокомплекса, используемое при
трацией металлокомплекса. Начальный участок
получении зависимости 1 на рис. 4, поменять на
этой зависимости в общем виде можно описать
обратное ([FcCH2OH]0/[НClO4]0 = 100), то окис-
кинетическим уравнением (24), в котором отрезок
ления FcCH2OH и образования катиона ферроце-
a на оси ординат характеризует скорость образо-
ния в реакционной смеси, содержащей те же ре-
вания катиона ферроцения при протонировании
агенты, вообще не происходит (зависимость 4), а
металлокомплекса и ее вклад в общую скорость
в электронном спектре реагирующей системы в
его окисления, который, как это видно из рисун-
видимой области фиксируется только полоса по-
ка, снижается по мере увеличения концентрации
глощения карбокатиона FcC+H2 с λmax 600
нм при
п-бензохинона.
любой концентрации п-бензохинона. Причина на-
блюдаемой инертности п-бензохинона в качестве
(24)
окислителя вполне очевидна: при избытке метал-
локомплекса по сравнению с кислотой, последняя
Значение коэффициента b в уравнении (24),
полностью расходуется на его протонирование,
равное тангенсу угла наклона анализируемой за-
приводящее к образованию стабильного комплек-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1088
ФОМИН, ШУКЛИНА
Схема 3.
FcCH2OH + H+
K FcC+H2 + H2O
(3.1)
k
•
FcC+H2
Fc+CH2
1/2(Fc+CH2CHFc+)
(3.2)
K1
HOCH2Fc + C6H4O2
HOCH2Fc·C6H4O2(KK1)
(3.3)
KK1 + H+K2
HOCH2Fc·C6H4O2···H+ (KK2)
(3.4)
k1
•
•
KK2
Fc+CH2OH + OC6H4OH (RO)
(3.5)
k1
•
FcCH2OH + RO
Fc+CH2OH + RO-
(3.6)
RO- + Η+
HOC6H4OH
(3.7)
[Η+] = [HClO4]
са FcC+H2·FcCH2OH, в результате чего п-бензохи-
В соответствии со схемой, общая скорость об-
нон остается незадействованным.
разования катионов ферроцения будет соответ-
ствовать выражению (25).
Исходя из вышеизложенного, можно вполне
обоснованно утверждать, что в реагирующей си-
стеме FcCH2OH-НClO4-п-бензохинон в зависи-
мости от условий проведения процесса, т. е. при-
роды используемого растворителя и соотношения
начальных концентраций металлокомплекса и
(25)
кислоты, реально возможно протекание многочис-
ленных реакций, описать которые в рамках единой
Текущую концентрацию FcCH2OH найдем из
схемы не представляется возможным. В диоксане
выражения материального баланса по концентра-
при [НClO4]0 >> [FcCH2OH]0 общую схему можно
ции металлокомплекса, концентрацию радикала
упростить, включив в нее только параллельно про-
RO• - из условия его стационарности.
текающие процессы протонирования FcCH2OH и
его окисления п-бензохиноном, не осложненные
вторичными реакциями (схема 3).
Приведенная схема в части, касающейся ме-
(26)
ханизма окисления FcCH2OH п-бензохиноном,
и включающая образование тройного комплекса
KK2 как необходимого условия реализации это-
го процесса, не отличается от схемы окисления
(27)
ферроцена этим же окислителем [Фомин В.М.
и др., ЖОХ, 2018, т. 88, вып. 10]. Координация
(28)
п-бензохинона с металлокомплексом, как и при
окислении ферроцена, происходит в результате
взаимодействия высшей занятой молекулярной ор-
битали FcCH2OH, локализованной на атоме железа
(dx2-y2, dxy), с вакантной разрыхляющей π*-орбита-
(29)
лью С=О связи.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
О РОЛИ ПРОТОНИРОВАНИЯ ФЕРРОЦЕНИЛМЕТАНОЛА
1089
Комбинируя уравнения (25), (27) и (29), полу-
чим выражения для WFc+1 и WFc+2.
(30)
(31)
Полученные выражения свидетельствуют о
(34), свидетельствующим о линейной зависимости
том, что процессы протонирования и окисления
WFc+ от концентрации реагентов.
FcCH2OH
оказывают взаимное влияние друг на
друга, и это влияние обусловлено участием кис-
лоты в образовании FcC+H2 и комплекса KK2, кон-
центрации которых определяют скорость каждого
(34)
процесса в отдельности.
Если сравнить это уравнение с уравнением (6),
О влиянии второго процесса на первый говорит
то получим, что kэфф в нем равно 2k1K1K2.
наличие в знаменателе уравнения для WFc+1 слага-
емого K1K2[п-бензохинон][H+] = [KK2]/[FcCH2OH],
При постоянстве концентраций металлоком-
характеризующего выход комплекса KK2 в резуль-
плекса и кислоты уравнение (34) можно предста-
тате реакций (3.3) и (3.4) в схеме 3. Об обратном
вить в виде уравнения (35), которое полностью
влиянии говорит наличие в знаменателе уравнения
идентично уравнению (24), описывающему на-
для WFc+2 слагаемого K[H+]/[H2O], равного отно-
чальный участок зависимости 1 на рис. 4.
шению [FcC+H2]/[FcCH2OH] и характеризующего,
(35)
таким образом, степень протонирования металло-
комплекса.
+
kK[FcCH
OH]
[H
]
2
0
(36)
При малых концентрациях п-бензохинона урав-
a'=
,
[H
O]
2
нения (30) и (31) преобразуются в уравнения (32) и
(33) соответственно.
b' =
2k
K
K
[FcCH
OH]
[H+]
(37)
1
1
2
2
0
0
+
kK[FcCH
OH]
[H
2
0
W
=
],
(32)
Выражения (36) и (37) раскрывают физический
+
Fc 1
[H
O]+
K[H+]
2
смысл коэффициентов a и b в уравнении (24) и их
зависимость от концентраций металлокомплекса и
кислоты.
(33)
При больших концентрациях п-бензохинона
уравнение (30) переходит в уравнение (38), а урав-
нение (31) в уравнение (39).
Причем уравнение (32) аналогично уравне-
нию (22), полученному при анализе схемы 2 про-
(38)
тонирования FcCH2OH, что говорит об основном
вкладе этого процесса в общий процесс окисле-
2k
K
K
[FcCH
OH]
[H+]
1
1
2
2
0
(39)
ния металлокомплекса. Этот вывод полностью
W
=
+
Fc
2
1+
K
[H+]
соответствует данным, приведенным на рис. 3.
2
Если анализируемый процесс проводить при ма-
Уравнение (38) свидетельствует об усилении
лых концентрациях кислоты, то его суммарная
скорость реакции будет описываться уравнением
влияния процесса окисления FcCH2OH п-бензо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1090
ФОМИН, ШУКЛИНА
хиноном на скорость редокс-изомерии FcC+H2,
При малых и больших концентрациях п-бензо-
которое проявляется в виде обратно пропорцио-
хинона оно преобразуется в уравнения (45) и (46)
нальной зависимости WFc+ от концентрации п-бен-
соответственно.
зохинона, сохраняющейся как при малых, так и
(45)
при больших концентрациях кислоты, уравнения
(40) и (41) соответственно.
2k
K
K
[FcCH
OH]
[H+]
1
1
2
2
0
W
+
=
(46)
Fc
1+
K
[H+]
2
(40)
Уравнение (45) свидетельствует о первом по-
(41)
рядке процесса по концентрации окислителя,
уравнение (46) - о нулевом, что соответствует до-
Уравнение (39) является уравнением нулевого
стижению максимальной скорости процесса при
порядка по концентрации п-бензохинона и харак-
заданных значениях кислоты и металлокомплекса.
теризует, таким образом, максимальную скорость
Уравнение (46) аналогично уравнению (39), полу-
этой реакции, зависящую, в то же время, от кон-
ченному при окислении FcCH2OH п-бензохино-
центрации кислоты, увеличение которой приводит
ном в диоксане при больших концентрациях окис-
к ее предельному значению WFc+2,max, зависящему
лителя.
только от концентрации металлокомплекса.
Таким образом, взаимное влияние процессов
W
=
2k
[FcCH
OH]
(42)
протонирования и окисления FcCH2OH п-бензо-
+
1
2
0
Fc
2 max
хиноном друг на друга, имеющие место в системе
Комбинация уравнений (38) и (39) приводит к
FcCH2OH-HClO4-п-бензохинон приводит к мно-
уравнению (43) для суммарной скорости процесса
гообразию режимов и кинетических закономерно-
при больших концентрациях п-бензохинона, кото-
стей протекающих в ней реакций, которые можно
рое, в принципе, объясняет появление ниспадаю-
регулировать путем изменения концентраций реа-
щей ветви зависимости 1 на рис. 4 в этих условиях.
гентов, их соотношений и природы растворителя.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Электронные спектры поглощения реакци-
онных смесей снимали в области 200-1100 нм в
(43)
атмосфере аргона на спектрометре Shimadzu UV-
1280 с использованием кварцевых кювет 10 мм.
Из уравнения (43) видно, что увеличение кон-
Работа проводилась в спектральном режиме, ко-
центрации п-бензохинона уже не влияет на ско-
торый предполагает сканирование по длине волны
рость его реакции с металлокомплексом, которая в
с последующей обработкой спектра (определение
этом случае является предельной при постоянстве
положения максимумов и минимумов, расчет ин-
концентраций HClO4 и FcCH2OH, но приводит к
тенсивности полосы поглощения, арифметиче-
снижению скорости редокс-изомерии
FcC+H2, а
ские операции). Использованные растворители
значит и скорости суммарного процесса в целом.
имели квалификацию ХЧ и ЧДА и дополнитель-
ной очистке не подвергались. Содержание основ-
Для сравнения отметим, что в этаноле и ацето-
ного вещества в образцах ферроценилметанола
нитриле, в которых скоростью редокс-изомерии
составляло не менее 99%. п-Бензохинон имел ква-
можно пренебречь, а концентрацию FcC+H2 ис-
лификацию ХЧ.
ключить из выражения для баланса по концентра-
ции FcCH2OH, уравнение для скорости окисления
ИНФОРМАЦИЯ ОБ АВТОРАХ
металлокомплекса п-бензохиноном, будет иметь
Фомин Владимир Михайлович, ORCID: http://
вид (44).
orcid.org/0000-0001-6915-7776
Шуклина Наталья Николаевна, ORCID: http://
(44)
orcid.org/0000-0002-4297-989X
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
О РОЛИ ПРОТОНИРОВАНИЯ ФЕРРОЦЕНИЛМЕТАНОЛА
1091
БЛАГОДАРНОСТЬ
8.
Бетел Д., Голд В. Карбениевые ионы. М.: Мир, 1970.
344 с.
Авторы выражают благодарность ООО «Синор»
9.
Clark W.M. Oxidation-Reduction Potentials in Organic
за предоставленный образец ферроценилметанола.
Systems. Baltimore: Williams and Wilkins, 1960.
10.
Castagnola M., Floris B., Illuminati G. // J. Organomet.
КОНФЛИКТ ИНТЕРЕСОВ
Chem. 1973. Vol. 60. N 1. Р. 17. doi 10.1016/S0022-
Авторы заявляют об отсутствии конфликта
328X(00)85420-0
интересов.
11.
Энергии разрыва химических связей. Потенциа-
лы ионизации и сродство к электрону / Под ред.
СПИСОК ЛИТЕРАТУРЫ
В.Н. Кондратьева. М.: Наука, 1974. С. 333.
1.
Фомин В.М., Широков А.Е. // ЖОХ. 2009. Т. 89.
12.
Белл Р. Протон в химии. М.: Мир, 1977. С. 33.
Вып. 5. С. 1782; Fomin V.M., Shirokov A. E. // Russ.
13.
Фомин В.М., Маркин А.В., Шуклина Н.Н. // ЖОХ.
J. Gen. Chem. 2009. Vol. 89. N 5. P. 928. doi 10.1134/
2020. Т. 90. Вып. 6. С. 896. Fomin V.M., Markin A.V.,
S1070363209050119
Shuklina N.N. // Russ. J. Gen. Chem. 2020. Vol. 90. N
2.
Фомин В.М., Орлова Е.А., Зайцева К.С. // ЖОХ.
6. P. 994. doi 10.31857/S0044460X20060091
2014. Т. 84. Вып. 4. С. 645; Fomin V.M., Orlova E.A.,
14.
Фомин В.М., Шуклина Н.Н., Климова М.Н. // ЖФХ.
Zaitseva K.S. // Russ. J. Gen. Chem. 2014. Vol. 84. N 4.
2020. Т. 94. № 9. С. 1; Fomin V.M., Shuklina N.N.,
P. 722. doi 10.1134/S1070363214040215
Klimova M.N. // Russ. J. Phys. Chem. 2020. Vol. 94.
3.
Rinehart K.L., Jr., Michejda C.J., Kittle P.A. // J.
N 9. P. 1791. doi 10.31857/S0044453720090071
Am. Chem. Soc. 1959. Vol. 81. P. 3162. doi 10.1021/
15.
Kondo T., Yamamoto K., Kumada M. // J. Organomet.
ja01521a082
Chem. 1972. Vol. 35. N 1. P. 30. doi 10.1016/S0022-
4.
Фомин В.М., Кочеткова Е.С., Ключевский К.В. //
328X(00)86870-9
ЖОХ. 2018. Т. 88. Вып. 5. С. 805. Fomin V.M.,
16.
Kondo T., Yamamoto K., Kumada M. // J. Organomet.
Kochetkova E.S., Klyuchevskii K.V. // Russ. J. Gen.
Chem. 1973. Vol. 61. N 16. P. 1245. doi 10.1016/S0022-
Chem. 2018. Vol. 88. N 5. P 948. doi 10.1134/
328X(00)86565-1
S1070363218050183
17.
Ashkenazi P., Catz M. // Angew. Chem. 1972. Bd 84.
5.
Weinmayr V. // J. Am. Chem. Soc. 1955. Vol. 77.
P. 1106. doi 10.1002/ange.19720842210
P. 3009. doi 10.1021/ja01616a026
18.
Catz M., Ashkenazi P., Dani S., Gottlieb Y. // J.
6.
Несмеянов А.Н., Сазонова В.А., Дрозд В.Н., Роди-
Organomet. Chem. 1977. Vol. 124. N 1. P. 49. doi
онова Н.А. // Докл. АН СССР. 1965. Т. 160. Вып. 2.
0.1016/S0022-328X(00)90048-2
С. 355.
19.
Bitterwolf T.E., Ling A.C. // J. Organomet. Chem.
7.
Матье Ж., Панико Р. Курс теоретических основ
1971. Vol. 40. N 1. P. 29. doi 10.1016/S0022-
органической химии. М.: Мир, 1975. С. 530.
328X(00)86974-0
Effect of Protonation in Ferrocenylmethanol Oxidation
with p-Benzoquinone in the Presense of Perchloric Acid
V. M. Fomin* and N. N. Shuklina
N. I. Lobachevsky State University of Nizhny Novgorod, Nizhny Novgorod, 603950 Russia
*e-mail: niih325@bk.ru
Received March 31, 2021; revised May 30, 2021.; accepted June 3, 2021
In the system FcCH2OH-HX-p-benzoquinone, there is oxidation of metal complexes not only with p-benzo-
quinone, but also with a hydrogen ion as a result of its protonation. The need for acid to participate in both
processes determines the effect of each of them on the rate of the other. This is confirmed by the characteristics
of ferrocenium cations during protonation and the use of FcCH2OH with p-benzoquinone from the action of
reagents and by the kinetic equations describing these processes. The degree of their effect on each other de-
pends on the solvating properties of the solvents and the ratio of the initial concentrations of metal complexes
and acid, which affect the yield of the carbocation FcC+H2 upon protonation of metal complexes and its ability
to redox isomerism.
Keywords: ferrocenylmethanol, p-benzoquinone, redox isomerism, ferrocenium cation, oxidation, kinetic
regularities
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021