ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1092-1099
УДК546.98; 577.175.523
КОМПЛЕКСЫ ПАЛЛАДИЯ(II) С
КАТЕХОЛАМИНАМИ: СИНТЕЗ И
ЦИТОТОКСИЧЕСКАЯ АКТИВНОСТЬ in vitro
© 2021 г. М. С. Денисов*, О. Н. Гагарских
Институт технической химии Уральского отделения Российской академии наук - филиал Пермского федерального
исследовательского центра Уральского отделения Российской академии наук,
ул. Академика Королёва 3, Пермь, 614013 Россия
*e-mail: denisov.m@itcras.ru
Поступило в Редакцию 22 апреля 2021 г.
После доработки 25 мая 2021 г.
Принято к печати 27 мая 2021 г.
Изучено взаимодействие хлорида палладия(II) с катехоламинами (гидрохлоридами 3-метокситирамина,
норметанефрина, норадреналина и дофамина) и пиридин-2-карбальдегидом. Получено четыре новых
комплекса палладия различного типа (пиридиниминовые, пиридиноксазолидиновый, катионно-анионный
комплексы), строение которых подтверждено данными спектроскопии ЯМР и рентгеноструктурного
анализа. Оценена цитотоксическая активность комплексов на клеточных линиях PC-3 (рак простаты) и
HEK-293 (эмбриональные клетки почки человека).
Ключевые слова: катехоламины, комплексы палладия(II), цитотоксическая активность
DOI: 10.31857/S0044460X21070131
В последнее время активно исследуются ком-
си-3-метоксифенильного фрагмента, получен ряд
плексы палладия на предмет противоопухолевой
новых комплексов палладия из катехоламинов из-
активности в качестве альтернативы цисплатину
вестным методом [8]. Исследована цитотоксиче-
[1]. Соединения палладия и платины отличаются
ская активность полученных комплексов на линии
своей фармакодинамикой, несмотря на их хими-
PC-3 классическим МТТ-тестом [9], в качестве
ческое сходство [2, 3]. Известно, что соединения
контроля использовали цисплатин. В работе [10]
палладия обладают низкой токсичностью, в част-
продемонстрирована применимость этой методи-
ности в опыте на крысах полулетальная доза LD50
ки к комплексам палладия с NOPS координацион-
для PdCl2 составляет 2.7 г/кг, что близко к LD50
ным окружением и цисплатину. Также исследована
для KCl (2.6 г/кг), использованного в качестве
цитотоксичность в отношении нормальных клеток
препарата-сравнения [4]. В работе [5] показана
HEK-293 (эмбриональные клетки почки человека)
актуальность применения комплексов палладия с
по примеру работы [11]. Задачей настоящей рабо-
4-гидрокси-3-метоксифенильным заместителем в
ты являелся синтез комплексов палладия(II) из ка-
лиганде на линиях опухолевых клеток простаты,
техоламинов.
в том числе PC-3. Кроме того, некоторые комплек-
В связи с тем, что попытки получить основания
сы палладия (в частности, с 2,2′:6,2′′-трипириди-
Шиффа из пиридин-2-карбальдегида и катехола-
ном в качестве лиганда) демонстрируют большую
минов как индивидуальные соединения не увенча-
цитотоксическую активность на данной линии
лись успехом, мы выбрали однореакторный метод
в сравнении с цисплатином [6, 7]. В связи с тем,
синтеза [8], позволяющий избегать необходимости
что катехоламины являются источником 4-гидрок-
выделения как промежуточного образующегося
1092
КОМПЛЕКСЫ ПАЛЛАДИЯ(II) С КАТЕХОЛАМИНАМИ
1093
Схема 1.
OH
OH
(1) MeCN, ∆, 1 ч
H3N
(2) PdCl2, MeCN, ∆, 1 ч
N
O
N
O
N Pd
O
Cl-
Cl
Cl
1 (54%)
Схема 2.
OH
HO
O
O
(1) MeCN, D, 1 ч
OH
(2) PdCl2, MeCN, ∆, 1 ч
H3N
N
O
N
N
O
H
Cl-
Pd
Cl
Cl
2 (56%)
основания Шиффа, так и комплекса палладия с
В аналогичных условиях взаимодействием хло-
ацетонитрилом - PdCl2 нацело растворялся в кипя-
рида палладия(II) с пиридин-2-карбальдегидом и
щем ацетнитриле. Однако из четырех выбранных
рацематом гидрохлорида норметанефрина полу-
нами для исследования катехоламинов только ги-
чен комплекс 2 (схема 2).
дрохлорид 3-метокситирамина дал новый пири-
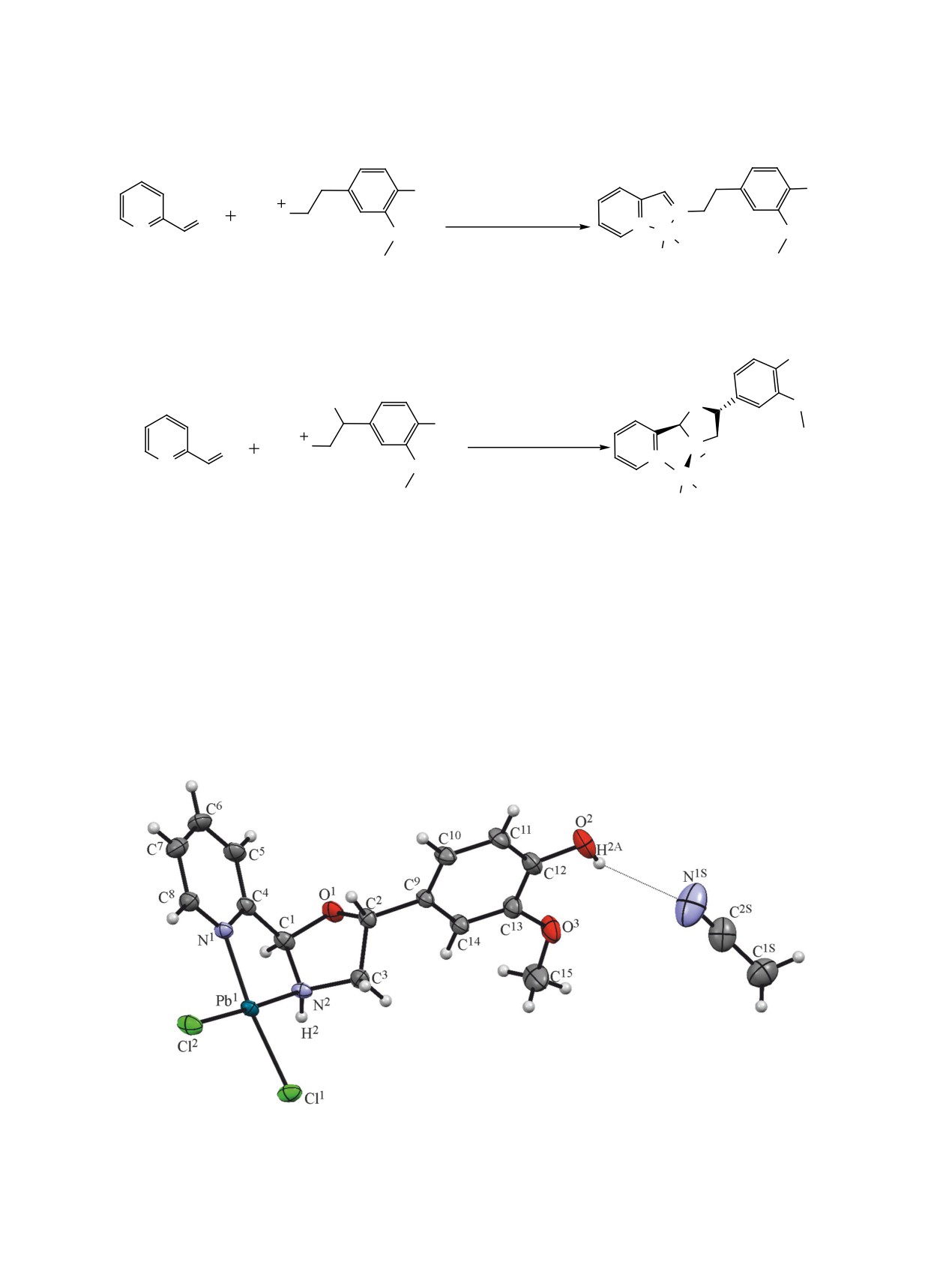
Для установления пространственной структу-
диниминовый комплекс 1 (схема 1). Химические
ры соединения 2 был осуществлен рентгенострук-
сдвиги ядер 1Н и 13С гетероцикла пиридина и ими-
нового фрагмента соединения 1 соответствуют
турный анализ. Выявлена редкая пиридиноксазо-
описанным ранее [12, 13].
лидиновая структура координационного узла, как
Рис. 1. Общий вид сольвата соединения 2 по данным РСА в представлении тепловыми эллипсоидами (вероятность 30%).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1094
ДЕНИСОВ, ГАГАРСКИХ
Таблица 1. Данные термического анализа комплекса 3 и предполагаемые брутто-составы промежуточных твердых
продуктов
Температура эффекта, °С
Δm, %
Соединение твердой
№ стадии
T, °С
ДТГ
ДСК
эксперимент
расчет
фазы
1
136-172
156.1
155.6
6.15
6.12
C16H20Cl4N2O4Pd
2
202-320
271.2
273.4
20.80
22.79
C8H14Cl4N2O2Pd
3
351-546
479.1
483.0
49.49
46.99
ClPd
m твердого остатка
23.61
24.10
у 2-(1,3-оксазолидин-2-ил)пиридина. Нам не уда-
ятия структуры в целом. Атом палладия имеет
лость найти ссылок на работы, в которых описан
плоскоквадратное окружение. Как и в комплек-
метод получения 2-(1,3-оксазолидин-2-ил)пириди-
се с аналогичным координационным узлом [15],
на из пиридин-2-карбальдегида и этанолмамина -
часть валентных углов вокруг атома Pd заметно
реакция приводит к получению основания
отклоняется от 90° [Cl2Pd1N1 95.20(6)°, N1Pd1N2
Шиффа с высоким выходом [14]. Комплекс 2 полу-
82.67(9)°]. В отличие от комплекса, описанного
чен впервые, но, следует отметить, что соединения
в работе [14], длины связей Pd1-N1 2.027(2) Å и
с таким координационным узлом были описаны
Pd1-N2 2.026(2) Å в соединении 2 практически
ранее [15]. Как данные РСА, так и параметры ЯМР
одинаковы. Пятичленный палладацикл находится
показывают наличие сокристаллизации соедине-
в конформации конверт, атом N2 отклоняется от
ния 2 с ацетонитрилом (рис. 1), который удаляется
плоскости остальных четырех атомов на 0.31 Å.
в процессе хранения. Осуществленные через ме-
Оксазолидиновые циклы обоих диастереомеров
сяц ИК-спектроскопический и элементный анализ
принимают конформацию полукресло. Молекулы
не зафиксировали наличие ацетонитрила. С ана-
ацетонитрила стабилизированы межмолекулярной
логичным противоречием между данными РСА
водородной связью O2-H2A∙∙∙N1S [O2-H2A 0.76(6) Å,
и элементного анализа комплексов палладия(II)
H2A∙∙∙N1S 2.47(6) Å, O2∙∙∙N1S 3.075(6) Å, угол
сталкивались авторы работы [16], что также связа-
138(6)°]. Сигналы обоих диастереомеров соедине-
но с удалением ацетонитрила.
ния 2 видны в спектре ЯМР 1Н при 30°С, но при
75°С набор сигналов один.
По данным РСА, соединение 2 кристаллизуется
в центросимметричной пространственной группе
В аналогичных условиях реакции с хлоридом
моноклинной сингонии. Фрагмент, включающий
палладия(II) и пиридин-2-карбальдегидом рацемат
метиновый атом C2 и связанный с ним арильный
гидрохлорида норадреналина дает новый катион-
заместитель, разупорядочен по двум позициям с
но-анионный комплекс 3 (схема 3). В спектрах
соотношением заселенностей
0.682(7):0.318(7).
ЯМР соединения 3 присутствуют только сигна-
Минорная компонента разупорядочения пред-
лы катиона норадреналина. Показано, что сигнал
ставляет собой другой диастереомер соединения
OH-группы спирта (4.68 м. д.) сильно уширен. В
2 с противоположной конфигурацией атома C2, и
свою очередь, фенольные гидроксильные группы
не изображена на рис. 1 для облегчения воспри-
соединений 1-3 не регистрируются в спектрах
Схема 3.
HO
2-
HO
Cl
OH
(1) MeCN, ∆, 1 ч
OH
(2) PdCl2, MeCN, ∆, 1 ч
H3N
Cl
Pd
Cl
O
H3N
N
OH
Cl-
OH
Cl
2
3 (78%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КОМПЛЕКСЫ ПАЛЛАДИЯ(II) С КАТЕХОЛАМИНАМИ
1095
Таблица 2. Электропроводность растворов комплекса 3
Таблица 3. Цитотоксическая активность комплексов
1-4 и цисплатина на клеточных линиях PC-3 и HEK-293
m, ммоль/л СH3CN
κ×106, Cм/cм
IC50, мкМ.
0.0
4.7
Соединение
PC-3
HEK-293
0.2
4.4
1
>200
>200
2
>200
>200
0.3
5.7
3
80.57±4.87
100.9±1.79
0.4
13.8
4
>100, <200
>200
Цисплатин
~120
-
ЯМР 1Н вследствие интенсивного протонного
0.4 ммоль/л. По этой причине кондуктометриче-
обмена, но обнаруживаются в ИК спектрах 3375-
ские испытания комплекса 3 были осуществлены
3422 см-1.
в растворах диметилсульфоксида. Для всех рас-
творов электропроводность мала и соизмерима с
Несмотря на то, что пиридинкарбальдегид не
погрешностью измерения (табл. 2); в связи с этим
включается в структуру продукта реакции, его на-
нами предположено, что электролитическая дис-
личие необходимо, так как в его отсутствие гидрох-
лорид норадреналина не растворяется в ацетони-
социация катионно-анионного комплекса 3 отсут-
ствует. Однако на основании работы [17] можно
триле и не образует комплексы. Мы предполагаем,
предположить наличие электролитической диссо-
что пиридинкарбальдегид дает промежуточную
неустойчивую пиридиноксазолидиновую струк-
циации соединений палладия с катехоламинами в
разбавленных водных растворах.
туру, разлагающуюся при комплекообразовании
далее. Элементный анализ комплекса 3 указывает
Комплексообразование PdCl2 с гидрохлоридом
на соотношение катиона и аниона 9:5, что близ-
дофамина и пиридинкарбальдегидом приводило
ко к теоретическому соотношению 2:1. Дополни-
к осмолению реакционной массы и образованию
тельным подтверждением состава и структуры
палладиевой черни. Образование черни также на-
является термогравиметрический анализ (табл. 1).
блюдалось и при синтезе соединения 1, что неуди-
Согласно данным анализа, разложение комплекса
вительно, поскольку 3-метокситирамин является
протекает в три стадии, сопровождающиеся двумя
метилированым метаболитом дофамина. По этой
эндо- (первая и вторая стадия), а затем двумя эк-
причине гидрохлорид дофамина был заменен на
зоэффектами (третья стадия). Вероятно, на первой
амантадин - вещество с дофаминергической ак-
стадии происходит удаление двух молекул воды, а
тивностью
[18]. Комплекообразование привело
на второй - 4-этинилбензол-1,2-диола. На финаль-
к каркасному пиридиниминовому комплексу
4
ной стадии происходит выгорание органической
(схема 4). Соединение 4 синтезировано впервые,
части комплекса и разложение координационного
но похожие комплексы палладия(II), полученные
узла. Плавление не было зарегистрировано мето-
из каркасных аминов, были описаны ранее [19].
дом термогравиметрии.
Cпектры ЯМР всех полученных соединений за-
Соединение 3 растворяется и в ацетонитри-
писаны в ДМСО-d6. Не наблюдалось химического
ле, и в воде, но растворимость не превышает
сдвига 13С, характерного для ДМСО, координиро-
Схема 4.
(1) MeCN, ∆, 1 ч
, MeCN, ∆, 1 ч
(2) PdCl2
N
O
H2N
N Pd
N
Cl
Cl
4 (63%)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1096
ДЕНИСОВ, ГАГАРСКИХ
ванного на палладий [20], что подтверждает устой-
0.4 ммоль). Полученную реакционную массу
чивость комплексов по отношению к ДМСО.
кипятили в течение 1 ч. Методики выделения ком-
плексов представлены ниже.
Цитотоксическую активность полученных сое-
динений 1-4 исследовали с помощью МТТ-теста
(2-Метокси-4-{(2-[(пиридин-2-илметилил-
на клеточных линиях PC-3 (рак простаты) и HEK-
иден)амино]этил}фенол)-цис-дихлоридопалла-
293 (эмбриональные клетки почки человека). По
дий(II) (1). Горячий раствор отделяли от палла-
данным исследований (табл. 3), ни одно из полу-
диевой черни фильтрованием, фильтрат медленно
упаривали в вытяжном шкафу. Коричневый оса-
ченных соединений не проявило цитотоксичной
док промывали 5 мл CH3CN. Выход 93 мг (54%),
активности на линиях PC-3 и HEK-293. Поскольку
т. пл. 212-213°С (CH3CN). ИК спектр, ν, см-1: 3412,
результат не оправдал ожиданий, мы планируем
3065, 3026, 2958, 1599, 1517 с, 1475, 1449, 1430,
продолжить поиск цитотоксических комплексов
1373, 1271 с, 1235 с, 1208, 1154, 1122, 1030, 870,
палладия иного строения.
820, 800, 770, 655, 627, 573, 561, 511, 462. Спектр
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ЯМР 1Н, δ, м. д. (J, Гц): 3.05 т (2Н, СН2N, 3J 7.2),
В работе использовали реактивы чистотой не
3.73 с (3Н, СН3), 3.96 т (2Н, СН2СН2N, 3J 7.2), 6.70
д (1НAr, 3J 1.6), 6.71 c (1HAr), 6.89 д (1НAr, 3J 1.6),
ниже ХЧ: PdCl2 и 2-пиридинкарбальдегид (Alfa
7.88 д. д. д (1Н, Н5, 3J 7.6, 4.8, 4J 1.6), 8.04 д. д (1Н,
Aesar, Великобритания); 3-метокситирамина ги-
Н3, 3J 7.6, 4J 1.2), 8.34 д. д. д (1Н, Н4, 3J 7.6, 7.6,
дрохлорид, рацемат норметанефрина гидрохло-
4J 1.6), 8.34 с (1Н, N=CH), 9.02 д (1Н, Н6, 3J 4.6).
рид, рацемат норадреналина гидрохлорида, до-
Спектр ЯМР 13С, δС, м. д.: 36.2, 56.2, 61.1, 114.1,
фамина гидрохлорид и амантадин (Sigma-Aldrich,
116.1, 122.0, 128.4, 129.0, 129.0, 141.8, 145.8, 148.1,
США); остальные вещества отечественного про-
150.7, 156.1, 171.4. Найдено, %: С 41.64; Н 4.45; N
изводства.
6.62. C15H16Cl2N2O2Рd. Вычислено, %: С 41.55; Н
Спектры ЯМР 1Н, 13С записывали в ДМСО-d6
3.72; N 6.46.
на приборе Bruker Avance Neo 400 (при 400 и
(±)-{[2-Метокси-4-[2-(пиридин-2-ил)-1,3-ок-
100 МГц) при 30-75°С; в качестве внутренне-
сазолилидин-5-ил]фенол}-цис-дихлоридопал-
го стандарта в спектрах ЯМР 1Н использовали
ладий(II)
(2). Раствор медленно упаривали в
гексаметилдисилазан, в спектрах ЯМР 13С - сиг-
вытяжном шкафу. Кристаллы (желтые призмы)
налы растворителя. ИК спектры снимали на Фу-
промывали 5 мл CH3CN. Выход 100 мг (56%), т.
рье-спектрометре Bruker FT-IR Vertex 80v в тонкой
пл. 211-212°С (CH3CN). ИК спектр, ν, см-1: 3422 с.
пленке после испарения растворов в CHCl3 (ве-
ш, 3107, 2962, 1605, 1517 c, 1451, 1435, 1365, 1347,
щества 1-3) или в вазелиновом масле (вещество
1276 c, 1239 c, 1205, 1158 c, 1122, 1076, 1054, 1031,
4) в диапазоне 4000-400 см-1. Элементный анализ
935, 919, 870, 850, 771. Спектр ЯМР 1Н, δ, м. д.
(C, H, N) проводили на приборе CHNS Vario El
(J, Гц): 3.39 д (1Н, NHСНН, 3J 8.8), 3.41 д. д (1Н,
Cube (Германия). Термогравиметрический анализ
NHСНН, 3J 9.2, 2J 0.8), 3.89 (3Н, СН3), 4.31 д. д. д
вещества 3 проведен на приборе Mettler Toledo
(1Н, О-СН, 3J 10.9, 4J 2.7, 4J 1.1), 5.09 д. д (1Н, NH,
TGA/DSC 1 LF нагревом до 800°С со скоростью
3J 9.2, 4J 2.8), 6.79 д (1НAr, 3J 8.1), 6.91 д. д (1HAr,
10 град/мин. Все комплексы 1-4 плохо раствори-
3J 8.1, 4J 1.9), 7.08 д (1НAr, 4J 1.9 Гц), 7.89 д. д. д
мы в хлороформе (недостаточно для записи ЯМР
(1Н, Н5, 3J 7.4, 3J 5.6, 4J 1.4), 7.89 д. д (1Н, Н3, 3J
спектров), хорошо в ДМСО (достаточно для запи-
7.8, 4J 1.0), 8.18 д. д. д (1Н, Н4, 3J 7.8, 3J 7.4, 4J 1.6),
си спектров ЯМР и проведения биологических и
8.36 с (1Н, N=CH), 9.07 д. д (1Н, Н6, 3J 5.6, 4J 0.8).
кондуктометрических испытаний).
Спектр ЯМР 13С, δС, м. д.: 55.6, 67.0, 69.6, 110.0,
Общая методика синтеза комплексов пал-
115.2, 117.9, 128.1, 128.6, 133.2, 141.4, 145.8, 147.4,
ладия 1-4. К раствору 2-пиридинкарбальдегида
150.2, 155.8, 171.8. Найдено, %: С 40.12; Н 3.70; N
(0.038 мл, 0.4 ммоль) в ацетонитриле (20 мл) до-
6.96. C15H16Cl2N2O3Рd. Вычислено, %: С 40.07; Н
бавляли соответствующее количество амина или
3.59; N 6.23.
гидрохлорида амина (0.4 ммоль). Смесь кипяти-
(±)-Бис[2-гидрокси-2-(3,4-дигидроксифенил)-
ли в течение 1 ч, затем добавляли PdCl2 (0.071 г,
этиламиний]тетрахлорпалладат (3). Раствор ох-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КОМПЛЕКСЫ ПАЛЛАДИЯ(II) С КАТЕХОЛАМИНАМИ
1097
лаждали. Коричневый осадок отфильтровывали и
CO2 во влажной атмосфере. Синтезируемые ком-
промывали 5 мл CH3CN. Выход 92 мг (78%), т. пл.
плексы растворяли в ДМСО и вносили в монос-
202-203°С (CH3CN). ИК спектр, ν, см-1: 3375 c. ш,
лой клеток в концентрациях от 100 до 3.125 мкМ.
2925, 2853, 1711, 1604 c, 1507, 1473, 1445, 1370,
Выживаемость клеток оценивали через 72 ч ин-
1293 c, 1252 c, 1203, 1162, 1114, 1079, 1057, 1034,
кубации с исследуемыми соединениями путем
942, 821, 765 c, 694, 670, 668, 613, 564, 510, 476,
добавления раствора MTT и последующего опре-
464. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 2.86 д. д (1Н,
деления оптической плотности образовавшего-
H3NСНН, 2J 10.0, 3J 9.2), 2.98 д. д (1Н, NHСНН, 2J
ся формазана при 544 нм на спектрофотометре
12.0), 4.68 д. д (1Н, НОСН, 3J 9.2, 3J 3.6), 4.84 уш.
FLUOstar Optima (BMG Labtech, Германия). В
с (1Н, НОСН), 6.66 д. д. д (1НAr, 3J 8.0, 4J 2.0, 4J
качестве количественного показателя цитотоксич-
0.4), 6.76 д (1HAr, 3J 8.0), 6.81 д (1НAr, 4J 2.0), 7.78
ности рассчитывали концентрацию тестируемого
с (3Н, NH3). Спектр ЯМР 13С, δС, м. д.: 45.8, 68.8,
соединения, которая вызывает гибель 50% клеток
113.5, 115.4, 116.7, 132.6, 144.9, 145.1. Найдено, %:
(IC50) [9].
С 31.34; Н 3.16; N 4.80. C16H24Cl4N2O6Рd. Вычис-
Рентгеноструктурный анализ выполняли на
лено, %: С 32.65; Н 4.11; N 4.76.
дифрактометре Xcalibur Ruby с ССD-детектором по
[N-(Пиридин-2-илметилилиден)адаман-
стандартной методике [MoKα-излучение, 295(2) K,
тан-1-амин]-цис-дихлоридопалладий(II)
(4).
ω-сканирование с шагом 1°]. Поглощение учи-
тывали эмпирически с использованием алгорит-
В ходе реакции образовался желтый осадок. Го-
ма SCALE3 ABSPACK [20]. Сингония кристалла
рячий раствор фильтровали, осадок промывали
(C15H16Cl2N2O3Pd∙C2H3N, M 490.65) моноклинная,
5 мл CH3CN. Выход 105 мг (63%), т. пл. >320°C
пространственная группа I2/a, a 14.1870(18), b
(CH3CN). ИК спектр, ν, см–1: 1689, 1593, 1517,
9.3409(10), c29.625(3)Å,β94.218(11)°,V3915.2(8)Å3,
1448 c, 1345, 1302 c, 1244, 1166, 1077, 1032, 974,
Z 8, dвыч 1.665 г/см3, μ 1.242 мм-1. Структуру рас-
924, 817, 758 c, 499, 424. Спектр ЯМР 1Н, δ, м. д.
шифровывали с помощью программы SHELXT
(J, Гц): 1.70 с (6Н, СН2), 2.19 с (3Н, СН), 2.28 д (6Н,
[22] и уточняли полноматричным МНК по F2 в ани-
СН2, 3J 2.4), 7.85 д. д. д (1Н, Н5, 3J 7.6, 5.5, 4J 1.4),
зотропном приближении для всех неводородных
8.20 д. д (1Н, Н3, 3J 7.6, 4J 1.2), 8.37 д. д. д (1Н, Н4,
атомов с использованием программы SHELXL [23]
3J 7.6, 7.6, 4J 1.2), 8.39 с (1Н, N=CH), 9.14 д (1Н, Н6,
с графическим интерфейсом OLEX2 [24]. Рисунок
3J 5.5). Спектр ЯМР 13С, δС, м. д.: 29.1, 35.2, 40.8,
создан в программе Mercury 3.3 (Build RC5) [25].
66.2, 127.8, 128.7, 141.1, 149.9, 156.8, 167.4. Най-
Атомы водорода групп OH и NH уточняли незави-
дено, %: С 45.69; Н 5.12; N 6.66. C16H20Cl2N2Рd.
симо в изотропном приближении. При уточнении
Вычислено, %: С 46.01; Н 4.83; N 6.71.
остальных атомов водорода использовали модель
Кондуктометрия. Электропроводность рас-
наездника. Окончательные параметры уточнения:
творов комплекса 3 в ДМСО определяли в кон-
R1 0.0337 [для 4260 отражений с I > 2σ(I)], wR2
дуктометрической ячейке с гладкими платиновы-
0.0739 (для всех 4826 независимых отражений), S
ми электродами (постоянная сосуда составляет
1.095. Результаты РСА зарегистрированы в Кем-
0.3653 см-1), для измерений использовали автома-
бриджском центре кристаллографических данных
тизированный прибор Solartron-1280C. Амплитуда
(CCDC 2077949) и могут быть запрошены по адре-
переменного сигнала составляла 20 мВ, диапазон
частот - от 10000 до 80 Гц. Ячейку термостати-
ИНФОРМАЦИЯ ОБ АВТОРАХ
ровали при 295 K с точностью ±1°С. Полученные
данные приведены в табл. 3.
Денисов Михаил Сергеевич, ORCID: http://
MTT-тест. Цитотоксическую активность со-
orcid.org/0000-0002-2261-8122
единений 1-4 исследовали на клеточных линиях
Гагарских Ольга Николаевна, ORCID: http://
PC-3 (рак простаты) и HEK-293 (эмбриональные
orcid.org/0000-0001-6802-5384
клетки почки человека). Культуры клеток выращи-
БЛАГОДАРНОСТЬ
вают в среде DMEM с добавлением 10% эмбрио-
нальной телячьей сыворотки, 2 мM. L-глутамина
Работа выполнена с использованием оборудо-
и 1% пенициллина-стрептомицина при 37°C и 5%
вания Центра коллективного пользования
«Ис-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1098
ДЕНИСОВ, ГАГАРСКИХ
следования материалов и вещества» Пермского
7.
Ulukaya E., Ari F.,·Dimas K.,·Sarimahmut M., Guney E.,
федерального исследовательского центра Ураль-
Sakellaridis N.,· Yilmaz V.T. // J Cancer Res. Clin. Oncol.
ского отделения РАН. Авторы также выражают
2011. Vol. 137. P. 1425. doi 0.1007/s00432-011-1021-1
8.
Денисов М.С., Глушков В.А. // Изв. АН. Сер. хим.
благодарность О.А. Майоровой (Институт техни-
2020. № 10. С. 2013; Denisov M.S., Glushkov V.A. //
ческой химии УрО РАН) за получение спектров
Russ. Chem. Bull. Vol. 69. N 10. P. 2013. doi 10.1007/
ЯМР, Д.К. Трухинову и Д.М. Киселькову (Инсти-
s11172-020-2993-2
тут технической химии УрО РАН) за регистрацию
9.
Gonçalves B.M.F., Salvador J.A.R., Marín S., Cascante M. //
ИК спектров, М.В. Дмитриеву (Пермский государ-
Eur. J. Med. Chem. 2016. Vol. 114. P. 101. doi 10.1016/j.
ственный национальный исследовательский уни-
ejmech.2016.02.057
верситет) за выполнение рентгеноструктурного
10.
Haribabu J., Srividya S., Mahendiran D., Gayathri D.,
анализа, Т.Е. Ошепковой (Институт технической
Venkatramu V., Bhuvanesh N., Karvembu R. // Inorg.
химии УрО РАН) за выполнение термогравиме-
Chem. 2020. Vol. 59. N 23. P. 17109. doi 10.1021/acs.
трического анализа, С.П. Шавкунову (Пермский
inorgchem.0c02373
государственный национальный исследователь-
11.
Gichumbi J.M., Friedrich H.B., Omondi B., Singh M.,
ский университет) за выполнение кондуктометри-
Naidoo K., Chenia H.Y. // J. Coord. Chem. 2016. Vol. 69.
N 23. P. 3531. doi 10.1080/00958972.2016.1243238
ческих исследований, Ю.А. Белоглазовой и А.О.
12.
Reddy E.R., Trivedi R., Sarma A.V.S., Sridhar B., Anan-
Ворониной (Институт технической химии УрО
taraju H.Sh., Sriram D., Yogeeswarid P., Nagesh N. //
РАН) за помощь в проведении МТТ-теста.
Dalton Trans. 2015. Vol. 44. P. 17600. doi 10.1039/
ФОНДОВАЯ ПОДДЕРЖКА
C5DT03266K
13.
Денисов М.С., Гагарских О.Н., Утушкина Т.А. //
Исследование выполнено при финансовой под-
Вестн. Пермск. унив. Сер. Химия. 2021. Т. 11. № 1.
держке Российского фонда фундаментальных ис-
С. 30. doi 10.17072/2223-1838-2021-1-30-58
следований и Министерства образования и науки
14.
Striegler S., Dittel M. // Inorg. Chem. 2005. Vol. 44.
Пермского края в рамках научного проекта № 19-
N 8. P. 2728. doi 10.1021/ic048724p
43-590003
15.
Molaeea H., Moghadama M., Mirkhania V. Tanges-
taninejada Sh., Mohammadpoor-Baltorka I., Kajania A.A.,
КОНФЛИКТ ИНТЕРЕСОВ
Kia R. // Polyhedron. 2019. Vol. 160. N 1. P. 130. doi
Авторы заявляют об отсутствии конфликта
0.1016/j.poly.2018.11.0370277-5387/Ó2018
интересов.
16.
Motswainyana W.M., Onani M.O., Madiehe A.M.,
Saibu M., Jacobs J., van Meervelt L. // Inorg. Chimica
СПИСОК ЛИТЕРАТУРЫ
Acta. 2013. Vol. 400. N 1. P. 197. doi 10.1016/j.
1. Денисов М.С., Глушков В.А. // Вестн. Пермск.
ica.2013.02.029
унив. Сер. Химия. 2018. Т. 4. № 4. С. 388. doi
17.
Шайдароваa Л.Г., Челноковаa И.А., Лексинаa Ю.А.,
10.17072/2223-1838-2018-4-388-411
Гедминаa А.В., Будников Г.К. // ЖАХ. 2020. Т. 75.
2. Serratrice M., Maiore L., Zucca A., Stoccoro S., Landini I.,
№. 8. С. 736. doi 10.31857/S0044450220080137;
Mini E., Massai L., Ferraro G., Merlino A., Messori L.,
Shaidarova L.G., Chelnokova I.A., Leksina Y.A.,
Cinellu M.A. // Dalton Trans. 2016. Vol. 45. P. 579. doi
Gedmina A.V., Budnikov H.C. // J. Anal. Chem. 2020.
10.1039/C5DT02714D
Vol. 75. N 8. P. 1059. doi 10.1134/S1061934820080134
3. Mitra I., Mukherjee S., Reddy B. V.P., Misini B., Das P.,
18.
Ossola B., Schendzielorz N., Chen Sh.-H., Bird G.S.,
Dasgupta S., Linert W., Moi S.Ch. // New J. Chem.
Tuominen R.K., Männistö P.T., Hong J.-Sh. //
2018. Vol. 42. P. 2574. doi 10.1039/C7NJ05173E
Neuropharmacology. 2011. Vol. 61. N 4. P. 574. doi
4. Egorova K.S., Galushko A.S., Ananikov V.P. // Angew.
10.1016/j.neuropharm.2011.04.030
Chem. Int. Ed. 2020. Vol. 59. P. 22296. doi 10.1002/
19.
Залевская О.А., Гурьева Я.А., Кучин А.В. // Усп. хим.
anie.202003082
2019. Т. 88. № 10. C. 979. Zalevskaya O.A., Gur’e-
5. Valentini A., Conforti F., Crispini A., Martino A.D.,
va Ya.A., Kutchin A.V. // Russ. Chem. Rev. 2019.
Condello R., Stellitano C., Rotilio G., Ghedini M.,
Vol. 88. N 10. P. 979. doi 10.1070/RCR4880
Federici G., Bernardini S., Pucci D.// J. Med. Chem.
20.
Денисов М.С., Дмитриев М.В., Ерошенко Д.В., Слепу-
2009. Vol. 52. N 2. P. 484. doi 10.1021/jm801276a
хин П.А., Шавкунов С.П., Глушков В.А. // ЖНХ. 2019.
6. Büyükekşi S.I., Erkısa M., Şengül A., Ulukaya E.,
Т. 64. № 1 С. 38. doi 10.1134/S0044457X19010057;
Oral A.Y. // Appl. Organometal. Chem. 2018. Vol. 32.
Denisov M.S., Dmitriev M.V., Eroshenko D.V.,
N 8. P. e4406. doi 10.1002/aoc.4406
Slepukhin P.A., Shavkunov S.P., Glushkov V.A. // Russ.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КОМПЛЕКСЫ ПАЛЛАДИЯ(II) С КАТЕХОЛАМИНАМИ
1099
J. Inorg. Chem. 2019. Vol. 64. N 1. P. 56. doi 10.1134/
24. Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
S0036023619010054
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
21. CrysAlisPro, Agilent Technologies, Version 1.171.37.33
(release 27-03-2014 CrysAlis171 .NET).
Vol. 42. P. 339. doi 10.1107/S0021889808042726
22. Sheldrick G.M. // Acta Crystallogr. (A). 2015. Vol. 71.
25. Mercury 3.3 (Build RC5). Cambridge: Cambridge
P. 3. doi 10.1107/S2053273314026370
23. Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
P. 3. doi 10.1107/S2053229614024218
cam.ac.uk/mercury/
Palladium(II) Complexes with Catecholamines:
Synthesis and Cytotoxic Activity In Vitro
M. S. Denisov* and O. N. Gagarskikh
Institute of Technical Chemistry of Ural Branch, Russian Academy of Sciences, Perm, 614013 Russia
*e-mail: denisov.m@itcras.ru
Received April 22, 2021; revised May 25, 2021; accepted May 27, 2021
The reactions of palladium(II) chloride with catecholamine (hydrochlorides of 3-methoxytyramine, normeta-
nephrine, norepinephrine and dopamine) and pyridine carbaldehyde were afforded four new palladium complex-
es of various types (pyridine-imine, oxazolidine-imine, and cation-anionic). Structures of the obtained complexes
were confirmed by NMR spectroscopy and X-ray diffraction analysis. Cytotoxic activity of the complexes was
estimated on the prostate cancer cell line PC3 (prostate cancer cells) and on the non-cancer cell line HEK-293
(human epithelial kidney cells).
Keywords: catecholamines, palladium(II) complexes, cytotoxic activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021