ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1100-1107
УДК 547.1’1;54.386;539.26;546.151;546.492;546.87
СИНТЕЗ И СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
СУРЬМЫ [(4-N,N-Me2C6H4)3MeSb]I
И [(4-N,N-Me2C6H4)3MeSb]2[Hg2I6]·2DMSO
© 2021 г. И. В. Егороваa,*, В. В. Жидковa, И. П. Гринишакa, Н. А. Родионоваa,
И. Ю. Багрянскаяb, Н. В. Первухинас
a Благовещенский государственный педагогический университет, ул. Ленина 104, Благовещенск, 675000 Россия
b Новосибирский институт органической химии имени Н. Н. Ворожцова Сибирского отделения
Российской академии наук, Новосибирск, 630090 Россия
c Институт неорганической химии имени А. В. Николаева Сибирского отделения Российской академии наук,
Новосибирск, 630090 Россия
*e-mail: bgpu.chim.egorova@mail.ru
Поступило в Редакцию 26 апреля 2021 г.
После доработки 25 мая 2021 г.
Принято к печати 27 мая 2021 г.
Впервые установлено, что алкилирование трис(4-N,N-диметиламинофенил)стибина метилиодидом
приводит к образованию иодида трис(4-N,N-диметиламинофенил)метилстибония. Данный комплекс
разлагается в горячей воде до трис(4-N,N-диметиламинофенил)стибина. Взаимодействием [(4-N,N-
Me2C6H4)3MeSb]I с HgI2 в ДМСО получен комплекс [(4-N,N-Me2C6H4)3MeSb]2[Hg2I6]·2DMSO, в котором
значительное искажение тетраэдрической координации катиона обусловлено дополнительным взаимо-
действием атома кислорода молекулы ДМСО с атомом сурьмы.
Ключевые слова: трис(4-N,N-диметиламинофенил)стибин, метилиодид, иодид ртути(II), рентгено-
структурный анализ, спектроскопия ЯМР
DOI: 10.31857/S0044460X21070143
Галогениды тетраорганилстибония общей фор-
ния [ArAlk3Sb]Hlg, содержащих арильный и ал-
мулы R4SbHlg, среди которых наиболее изучен-
кильные заместители при атоме сурьмы, является
ными являются фенильные производные пятива-
взаимодействие ArAlk2Sb с галогеналканами [9].
лентной сурьмы, находят применение в различных
Однако долгое время не удавалось присоединить
областях аналитической химии и обладают боль-
галоидные алкилы к соединениям сурьмы(III) c
шим синтетическим потенциалом, в частности га-
двумя или тремя ароматическими заместителями
логениды тетраалкилстибония взаимодействуют
[3, 8]. Поэтому для синтеза стибониевых соедине-
с альдегидами, образуя продукты присоединения,
ний [Аr3МеSb]Х (Аr = Ph, Tol, Mes, (3,4-Me)2C6H3,
гидролиз которых дает соответствующие спирты
(2,4-Me)2C6H3, Х = BF4) в качестве алкилирующе-
[1-7]. Вследствие этого представляет интерес из-
го агента применяют борфториды триметилоксо-
учение синтеза и строения соединений данного
ния [10-12].
типа.
Впервые присоединение галоидных алкилов
Реакция пентаарилсурьмы с галогеноводо-
к триарилстибину было установлено в реакциях
родной кислотой - основной способ получения
с участием (2,6-(MeO)2C6H3)3Sb. Для доказатель-
галогенидов тетраарилстибония [3, 8]. Одним из
ства строения галогенидов тетраорганилстибония
методов синтеза галогенидов тетраорганилстибо-
[Аr3RSb]Hlg [Аr = 2,6-(MeO)2C6H3; R = Me, Et,
1100
СИНТЕЗ И СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ СУРЬМЫ
1101
Схема 1.
CH3I, CHCl3
N
Sb
N
Sb
I
H2O, t
3
3
1
HgI2, DMSO
N
Sb
[Hg2I6]·2DMSO
3
2
2
n-Bu, СН2СН=СН2; Hlg = Cl, Br, I] авторы приво-
метилом, является атом азота аминогруппы, ос-
дят данные элементного анализа и спектроскопии
новность которого, вследствие р-π-сопряжения
ЯМР [13]. Нами исследовано алкилирование три-
его неподеленной электронной пары с π-электро-
с(2,6-диметоксифенилстибина) этиловым эфиром
нами бензольного кольца, уменьшается. Известно,
иодуксусной кислоты и 1,4-дииодбутаном. Строе-
что нуклеофильность атомов в ряду N-P-As-Sb-
ние соединений [Ar3RSb]n+I–, Ar = 2,6-(MeO)2C6H3;
Bi снижается и метилиодид как мягкий реагент в
n = 1, R = Me, (CH2)4I, CH2C(O)OEt; n = 2, R =
нуклеофильных реакциях, предпочитает мягкие
(CH2)4SbAr3
и
[Ar3SbCH2C(O)OEt]2[Hg2I6],
нуклеофилы [8, 15]. Можно ожидать, что алкили-
[Ar3MeSb]2[HgI4]∙DMSO подтверждено методами
рование молекулы трис(4-N,N-диметиламинофе-
РСА и спектроскопии ЯМР [14].
нил)стибина, имеющего два конкурирующих ну-
Таким образом, к настоящему времени возмож-
клеофила (атомы азота и сурьмы), метилиодидом
ность алкилирования триарилстибина галоидны-
будет протекать по атому сурьмы с образованием
ми алкилами и этилиодацетатом показана лишь
иодида трис(4-N,N-диметиламинофенил)метил-
на примере [2,6-(MeO)2C6H3]3Sb [13, 14]. В связи
стибония.
с этим, изучение взаимодействия галоидных ал-
Алкилирование трис(4-N,N-диметиламинофе-
килов с другими полностью замещенными аро-
нил)стибина метилиодидом проводили в хлоро-
матическими соединениями сурьмы(III) и уста-
форме при комнатной температуре. Установлено,
новление строения полученных алкиларильных
что независимо от мольного соотношения реаген-
стибониевых соединений является актуальной за-
тов (от 1:1 до 1:10) и времени проведения экспери-
дачей.
мента (24-120 ч) алкилирование протекает по ато-
Цель данной работы заключается в исследова-
му сурьмы с образованием бесцветных кристаллов
нии алкилирования трис(4-N,N-диметиламинофе-
комплекса [(4-N,N-Me2C6H4)3MeSb]I 1 (схема 1).
нил)стибина метилиодидом, направленном синтезе
Для установления пространственного строения
комплексов с трис(4-N,N-диметиламинофенил)-
соединения 1 медленной кристаллизацией из хло-
метилстибониевым катионом, изучении их строе-
ния и свойств.
роформа были получены монокристаллы, пригод-
ные для рентгеноструктурного анализа. Отметим,
Трифенилстибин не вступает в реакцию с гало-
что производные тетраорганилстибония, содер-
идными алкилами [3]. Присутствие в фенильных
жащие заместитель 4-N,N-Me2C6H4, структурно
заместителях, в целом, сильных электронодо-
не охарактеризованы. По данным РСА, комплекс
норных N(Me)2-групп, предполагает увеличение
1 состоит из ионов I- и [(4-N,N-Me2C6H4)3MeSb]+.
основности (соответственно нуклеофильности)
молекулы трис(4-N,N-диметиламинофенил)сти-
Атом сурьмы в катионе имеет искаженную тетраэ-
бина по сравнению с трифенилстибином, и, как
дрическую координацию. Величины углов СSbC
следствие, возможности алкилирования по атому
находятся в интервале 106.0(1)-114.6(1)° (рис. 1).
сурьмы. Другим нуклеофильным центром моле-
Основные кристаллографические характеристи-
кулы трис(4-N,N-диметиламинофенил)стибина,
ки, данные эксперимента и параметры уточнения
способным подвергаться электрофильной атаке
структуры приведены в табл. 1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1102
ЕГОРОВА и др.
Таблица 1. Кристаллографические характеристики соединений 1 и 2, данные эксперимента и параметры уточнения
структур
Параметр
1
2
Формула
C25H33IN3Sb
C54H78Hg2I6N6O2S2Sb2
М
624.19
2313.42
Температура, K
296(2)
120(2)
Сингония
Триклинная
—
—
Пространственная группа
P1
P1
a, Å
9.1698(3)
10.3319(6)
b, Å
10.9934(4)
12.4940(7)
c, Å
14.3748(5)
14.1746(8)
α, град
71.618(2)
84.2800(10)
β, град
79.193(2)
73.0820(10)
γ, град
84.026(2)
82.8230(10)
V, Å3
1349.19(8)
1732.98(17)
Z
2
1
dвыч, г/cм3
1.536
2.217
μ(MoKα), мм-1
2.182
7.959
F(000)
616
1072
Размеры кристалла, мм
0.60 × 0.20 × 0.15
0.21 × 0.18 × 0.16
Диапазон сбора данных по θ, град
2.51-30.06
2.071-33.715
Число измеренных рефлексов
49040
26246
Число независимых рефлексов
7901 (Rint 0.0299)
12568 (Rint 0.0413)
Пропускание, min/mаx
0.354/0.736
0.273/0.375
GOOF по F2
1.097
0.954
R-Факторы по I > 2σ(I)
R1 0.0296, wR2 0.0790
R1 0.0402, wR2 0.0570
R-Факторы по всем отражениям
R1 0.0385, wR2 0.0844
R1 0.0734, wR2 0.0659
Остаточная электронная плотность, max/min, е/Å3
1.069/-1.219
1.052/-1.200
Галогениды тетрафенилстибония устойчивы
при хранении, нелетучи, хорошо растворимы в
воде, поэтому могут быть очищены перекристал-
лизацией из водного раствора. В то же время га-
логениды тетраалкилстибония гигроскопичны, в
горячих водных растворах разлагаются с выделе-
нием галоидного алкила и триалкилстибина [3].
Поскольку в комплексе 1 присутствуют арильные
и метильный заместители при атоме сурьмы, пред-
ставляет интерес изучение его стабильности и воз-
можности разложения до триарилстибина.
Нагревание при 80°C водного раствора сое-
динения 1 приводит к образованию нераствори-
мого продукта, строение которого установлено
методом спектроскопии ЯМР, согласуется с дан-
ными элементного анализа, ИК спектроскопии и
соответствует трис(4-N,N-диметиламинофенил)-
Рис. 1. Общий вид катиона и аниона соединения 1
(CCDC 2067967).
стибину. По данным ЯМР 1Н, в спектре получен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СИНТЕЗ И СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ СУРЬМЫ
1103
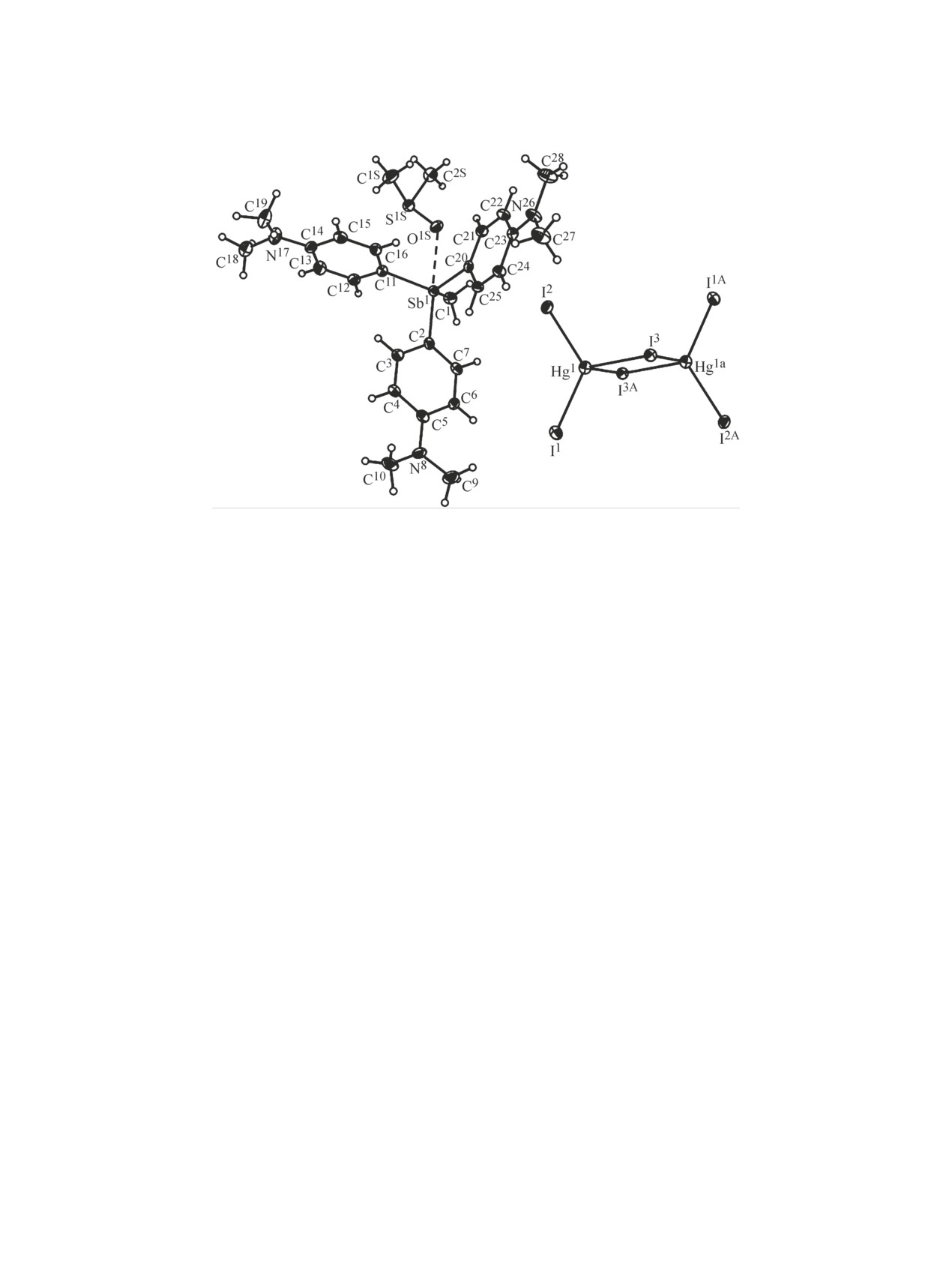
Рис. 2. Общий вид аниона и катиона, координированного с молекулой ДМСО, соединения 2 (CCDC 2059337).
ного соединения имеются сигналы восемнадцати
связей метильной группы, связанной с атомом
метильных протонов в области 2.80 м. д., шести
азота, при 2798, 1433 см-1. Полосу при 1594 см-1
ароматических протонов в области 6.67 м. д. и
можно отнести к валентным колебаниям аромати-
шести ароматических протонов в области 7.21 м.
ческих связей С-С. В ИК спектре комплекса 2 на-
д. Спектры ЯМР 13С содержат сигналы в области
блюдается полоса валентных колебаний ν(SO) при
113.6, 135.8, 137.1, 153.9 м. д., соответствующие
1016 см-1, смещение которой в длиноволновую
химическим сдвигам ядер углерода в бензольном
область спектра по сравнению со свободной мо-
кольце, и сигнал атомов углерода метильных фраг-
лекулой ДМСО, свидетельствует о координации
ментов в области 39.1 м. д. Полученный результат
ДМСО через атом кислорода [20]. Данные ИК
свидетельствует о разложении стибониевой соли
спектроскопии согласуются с результатами РСА.
с образованием трис(4-N,N-диметиламинофенил)
В кристалле соединения 2 присутствует до-
стибина (схема 1).
полнительная координация Sb···O1S
(2.831 Å)
Галогениды органилсурьмы(III, V), взаимо-
между атомами сурьмы стибониевого катиона и
действуя с галогенидами тяжелых металлов (Hg,
кислорода сольватной молекулы ДМСО (сумма
Cd, Bi), образуют комплексные соединения, в
ван-дер-ваальсовых радиусов 3.58 Å [21]), обу-
которых выступают лигандом или стибониевым
словливающая конфигурацию стибониевого кати-
катионом [14, 16, 17]. Изучено взаимодействие
она как промежуточную между тетраэдрической и
комплекса 1 с иодидом ртути(II) (1:1 мольн.)
тригонально-бипирамидальной (рис. 2, 3). В псев-
в ДМСО (схема 1). Продукт реакции [(4-N,N-
доаксиальной плоскости располагаются атомы O1S
Me2C6H4)3MeSb]2[Hg2I6]·2DMSO 2 представляет
молекулы ДМСО и С2 одного из арильных заме-
собой кристаллы, хорошо растворимые в ацетоне,
стителей (угол C2Sb1O1S равен 171.97°). Псевдоэк-
хлороформе, ДМСО. Полосы поглощения в ИК
ваториальные положения занимают атомы C1, C11,
спектрах соединений 1, 2 относили в соответcтвии
C20 метильного и двух арильных заместителей;
с данными работ [18, 19]. В ИК спектрах соеди-
величины углов CeqSbСeq составляют 107.21(15)-
нений 1, 2 имеются полосы поглощения в области
119.50(17)°,
СaxSbСeq
101.92(16)-103.09(16)°
валентных и деформационных колебаний С-Н
(рис. 2, 3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1104
ЕГОРОВА и др.
Риc. 3. Фрагмент кристаллической упаковки соединения 2 (CCDC 2059337). Пунктирной линией обозначены межмолеку-
лярные контакты между катионом и сольватной молекулой ДМСО.
Длина связи Sb-CМе составляет 2.097(3) (1),
1.373(5)-1.381(5) Å (2) по сравнению с расстояни-
2.104(4) Å (2), расстояния Sb-CAr находятся в ин-
ем N-CМе 1.420(6)-1.454(4) (1), 1.445(6)-1.458(6) Å
тервале
2.078(2)-2.087(3)
(1),
2.087(4)-2.091(4)
(2) (сумма ковалентных радиусов 1.47 Å).
Å (2) (сумма ковалентных радиусов атомов Sb и
Центросимметричные биядерные анионы
Csp3, Csp2 2.15, 2.12 Å) [22]. В тригонально-бипи-
[Hg2I6]2- представлены в виде сочлененных по ре-
рамидальной молекуле иодида тетрафенилстибо-
бру тетраэдров; углы IHgI составляют 94.128(10)-
ния связи Sb-CPh длиннее и составляют: Sb-Cax
123.833(12)°. Цикл Hg2I2 плоский, торсионный
2.141(3) Å, Sb-Ceq 2.103(3)-2.117(3) Å, а расстоя-
угол I3Hg1I3аHg1а равен 0.00(1)°. Концевые ато-
ние Sb-I 3.341(1) Å [23]. Сокращение расстояний
мы иода связаны с атомами ртути более прочно
Sb-CAr в соединении 1 связано с присутствием в
[расстояния 2.7063(4), 2.7118(4) Å] по сравне-
фенильном заместителе аминогруппы, атом азота
нию с двухкоординированными мостиковыми
которой может участвовать в p-π-d-сопряжении.
атомами иода [Hg-I-μ2 2.8691(4), 3.0011(4) Å].
В комплексах 1, 2 атомы азота аминогрупп
Данные величины сравнимы с параметрами ани-
имеют sp2-гибридизацию [углы CNC составляют
она [Hg2I6]2- комплексов, содержащих катионы
116.7(4)-121.7(3)° (1), 116.9(4)-120.9(4)° (2)]. За-
{[(2,6-MeO)2C6H3]3SbCH2C(O)OEt}+,
[Ph4Sb]+,
местители при всех атомах азота образуют пло-
[p-Tol4Sb]+, где данные расстояния варьируются в
скости; максимальный выход атома азота из соот-
интервалах 2.6874(4)-2.7222(3) Å для терминаль-
ветствующих среднеквадратичных плоскостей не
превышает 0.02 Å. Сопряжение свободной элек-
ных и 2.8250(4)-3.0748(5) Å для мостиковых ато-
тронной пары атома азота с ароматическим коль-
мов иода [14]. Плоскости Hg1I3Hg1аI3а и I1I2I1аI2а
цом приводит к уменьшению длин связей N-CAr,
практически перпендикулярны, угол между ними
находящихся в интервале 1.359(4)-1.374(6) (1),
составляет 86.31°.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СИНТЕЗ И СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ СУРЬМЫ
1105
Атомы иода участвуют в формировании струк-
атомов водорода (кроме водорода метильной груп-
туры кристалла 1 посредством образования сла-
пы при атоме С1 в комплексе 2) рассчитаны гео-
бых контактов I···H-СAr (2.985 Å), I···H-СМе-Sb
метрически и уточнены в модели наездника (па-
(2.991 Å). Потенциальные координирующие цен-
раметры атомов водорода рассчитывали в каждом
тры - атомы азота аминогрупп - участвуют в
цикле уточнения по координатам соответствую-
слабых межмолекулярных взаимодействиях с
щих атомов углерода). Атомы водорода метильной
молекулой ДМСО (N···Н-СМе 2.628 Å) 2. Сумма
группы при атоме С1 2 выявлены из разностного
ван-дер-ваальсовых радиусов атомов иода (азота)
Фурье-синтеза электронной плотности. Макси-
и водорода 3.08 (2.65) Å [21].
мальная величина пика остаточной электронной
Таким образом, предложен метод син-
плотности в окрестности атома С1 комплекса 2 не
теза
триарилалкилстибониевых
комплек-
превышает 0.5е. Параметры РСА соединений 1, 2
сов
[(4-N,N-Me2C6H4)3MeSb]I,
[(4-N,N-
депонированы в Кембриджском центре кристал-
Me2C6H4)3MeSb]2[Hg2I6]·2DMSO,
в
основе
лографических данных (CCDC 2067967, 2059337).
которого лежит реакция алкилирования трис-
Все расчеты проведены по комплексу программ
(4-N,N-диметиламинофенил)стибина по атому
SHELX-97, SHELXL [24-26].
сурьмы. Кристаллическая структура комплек-
Иодид трис(4-N,N-диметиламинофенил)-
сов подтверждена методом РСА. В сольвате
метилстибония (1). К 4.82 г (10.00 ммоль) трис-
[(4-N,N(Me)2C6H4)3MeSb]2[Hg2I6]·2DMSO имеет
(4-N,N-диметиламинофенил)стибина [3] в 50 мл
место увеличение координационного числа атома
хлороформа при перемешивании по каплям при-
сурьмы до 5, обуславливающего конфигурацию
бавляли раствор 9.00 г (53.41 ммоль) метилио-
катиона как промежуточную между тетраэдриче-
дида в 30 мл хлороформа. Смесь выдерживали в
ской и тригонально-бипирамидальной.
темноте при комнатной температуре в закрытой
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ампуле 48 ч. Растворитель испаряли. Кристал-
лы промывали диэтиловым эфиром (3×15 мл).
Спектры ЯМР записаны на спектрометре
Выход 6.18 г (99%), т. пл. 220°С (разл.). ИК
Bruker Avance AV-300 с частотой протонного ре-
спектр, ν, см-1 3029 (CAr-H), 2951 [νas(СH3)], 2924
зонанса 300 МГц. Для ядра 13C использовалась
[νas(СH3)],
2853
[νs(СH3)],
2798 (NC-H),
1594
методика кросс-поляризации с подавлением ди-
(СAr-СAr), 1460 [δ(СH3)], 1433 [δ(NC-H)], 1396
поль-дипольных взаимодействий и вращением
[δ(СH3)], 1202 (СNC), 1165 (СNC), 947 [δ(СH3)],
под магическим углом. Длительность 90° импуль-
939 [δ(СH3)], 549 (Sb-С). Найдено, %: С 49.21; Н
са для протонов составляла 4 мкс, время переноса
5.76; N 5.98. C25H33IN3Sb. Вычислено, %: С 48.10;
поляризации - 500-3000 мс, скорость вращения -
Н 5.33; N 6.73.
5, 7, 16 кГц, диаметр образца - 4 мм, время между
импульсами - 20 с, количество накоплений 512.
Разложение иодида трис(4-N,N-диметилами-
Регистрацию сигналов водорода производили при
нофенил)метилстибония. 3.00 г соединения 1 в
помощи одноимпульсной последовательности,
30 мл воды нагревали при 80°С в течение 0.5 ч.
межимпульсная задержка составляла 3 с. Ошибка
Осадок фильтровали, последовательно промыва-
определения химического сдвига не превышала
ли водой (25 мл), диэтиловым эфиром (2×15 мл),
1 м. д. Спектры записывали при 300 K. ИК спек-
сушили и перекристаллизовывали (хлороформ-
тры соединений записаны на Фурье-спектрометре
спирт). Выход трис(4-N,N-диметиламинофенил)-
ФСМ 2202 в таблетках с KBr. Элементный анализ
стибина составляет 1.39 г (60%), т. пл. 229°C
выполнен на CHN-анализаторе Carlo Erba (модель
(т. пл. 229°C [3]). ИК спектр, ν, см-1: 3056 (CAr-H),
1106).
2797 (NC-H), 1588 (СAr-СAr), 1199 [νs(СNC)], 1167
РСА выполнен на дифрактометре Bruker APEX
(СNC), 944 [δ(СH3)], 519 (Sb-С). Спектр ЯМР 1H,
II CCD (MoKα-излучение, графитовый монохрома-
δ, м. д.: 7.21 д (6H, 2,6-H, J 9.0 Гц), 6.67 д (6H,
тор, ω-сканирование). Структуры расшифрованы
3,5-H, J 9.0 Гц), 2.80 с (18H, Me). Найдено, %: С
прямым методом и уточнены МНК в анизотропном
58.82; Н 6.69; N 9.03. C24H30N3Sb. Вычислено, %:
полноматричном приближении по F2. Положения
С 58.93; Н 6.82; N 9.16.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1106
ЕГОРОВА и др.
Бис[трис(4-N,N-диметиламинофенил)метил-
5.
Huang Y.-Z., Zhang L.-J., Chen C., Guo G.-Z. //
сурьмы]бис(μ2-иодо)тетраиододимеркурат(II),
J. Organometal. Chem. 1991. Vol. 412. P. 47. doi
сольват с диметилсульфоксидом (2). К 0.50 г
10.1016/0022-328X(91)86040-W
(0.80 ммоль) соединения 1, растворенного в 20 мл
6.
Zhang L.-J., Huang Y.-Z., Huang Z.-H. // Tetrahedron
ДМСО, прибавляли раствор 0.36 г (0.80 ммоль)
Lett. 1991. Vol. 32. N 45. P. 6579. doi 10.1016/0040-
иодида ртути(II) в 20 мл ДМСО. Смесь выдер-
4039(91)80226-V
живали при комнатной температуре 12 ч. Раство-
7.
Zhang L.-J., Mo X.-S., Huang J.-L, Huang Y.-Z. //
ритель удаляли. Выход 0.81 г (87%), т. пл. 163°С.
Tetrahedron Lett. 1993. Vol. 34. N 10. P. 1621. doi
ИК спектр, ν, см-1: 3032 (CAr-H), 2952 [νas(СH3)],
10.1016/0040-4039(93)85024-Q
2924 [νas(СH3)], 2853 [νs(СH3)], 2798 (NC-H), 1594
8.
Rochow E.G., Hurd D.T., Lewis R.N. The Chemistry of
(СAr-СAr), 1458 [δ(СH3)], 1433 [δ(NC-H)], 1399
Organometallic compounds. New York: John Wiley &
[δ(СH3)], 1197 (СNC), 1161 (СNC), 1016 (SO), 954
Sons, 1957. P. 344. doi 10.1002/jps.3030461026
[δ(СH3)], 944 [δ(СH3)], 549 (Sb-С). Найдено, %: С
26.94; Н 2.99; N 4.12. C54H78Hg2I6N6O2S2Sb2. Вы-
9.
Brinnand M.E., Dyke W.J.C., Jones W.H., Jones W.J. // J.
числено, %: С 28.02; Н 3.40, N 3.63.
Chem. Soc. 1932. Р. 1815. doi 10.1039/JR9320001815
10.
Henry M.C., Wittig G. // J. Am. Chem. Soc. 1960.
ИНФОРМАЦИЯ ОБ АВТОРАХ
Vol. 82. N 3. P. 563. doi 10.1021/ja01488a017
Егорова Ирина Владимировна, ORCID: http://
11.
Henning D., Kempter G., Ahrens E., Benecke K.D.,
orcid.org/0000-0001-8799-608X
Paul P. // Z. Chem. 1967. Vol. 7. N 12. P. 463. doi
10.1002/zfch.19670071213
org/0000-0003-2547-1629
12.
Henning D., Kempter G., Worlitzer K.-D. // Z. Chem.
Багрянская Ирина Юрьевна, ORCID: http://
1969. Vol. 9. N 8. P. 306. doi 10.1002/zfch.19690090813
orcid.org/0000-0001-7760-5540
13.
Wada M., Miyake S., Hayashi S., Ohba H., Nobuki S.,
Первухина Наталья Викторовна, ORCID: http://
Hayase S., Erabi T. // J. Organometal. Chem. 1996.
orcid.org/0000-0001-6200-5657
Vol. 507. P. 53. doi 10.1016/0022-328X(95)05716-3
БЛАГОДАРНОСТЬ
14.
Егорова И.В., Жидков В.В., Гринишак И.П., Багрян-
ская И.Ю., Первухина Н.В., Ельцов И.В., Куратье-
Авторы работы выражают благодарность Цен-
ва Н.В. // ЖНХ. 2019. Т. 64. № 1. С. 15; Egorova I.V.,
тру исследования строения молекул Института
Zhidkov V.V., Grinishak I.P., Bagryanskaya I.Yu,
элементоорганических соединений им. А.Н. Нес-
Pervukhina N.V., El’tsov I.V., Kurat’eva N.V. // Russ.
меянова РАН, Химическому сервисному центру
J. Inorg. Chem. 2019. Vol. 64. N 1. P. 28. doi 10.1134/
коллективного пользования СО РАН за проведение
рентгеноструктурного анализа.
S0036023619010078
15.
Pearson R.G. // J. Chem. Educ. 1968. Vol. 45. N 9.
КОНФЛИКТ ИНТЕРЕСОВ
P. 581. doi 10.1021/ed045p581
Авторы заявляют об отсутствии конфликта
16.
Egorova I., Zhidkov V., Zubakina I., Rodionova N.,
интересов.
Eltsov I. // J. Organometal. Chem. 2020. Vol. 907.
СПИСОК ЛИТЕРАТУРЫ
P. 121077. doi 10.1016/j.jorganchem.2019.121077
17.
Burt J., Levason W., Reid G. // Coord. Chem. Rev. 2014.
1. Potratz H.A., Rosen J.M. // Anal. Chem. 1949. Vol. 21.
N 10. P. 1276. doi 10.1021/ac60034a037
Vol. 260. Р. 65. doi 10.1016/j.ccr.2013.09.020
2. Willard H.H., Perkins L.R. // Anal. Chem. 1953. Vol. 25.
18.
Smith B.C. Infrared Spectral Interpretation: A Systematic
N 11. P. 1634. doi 10.1021/ac60083a016
Approach. Boca Raton: CRC Press, 1998. 288 рр.
3. Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Ме-
19.
Nakamoto K. Infrared and Raman Spectra of Inorganic
тоды элементоорганической химии. Сурьма, висмут.
and Coordination Compounds. New York: J. Wiley &
М.: Наука, 1976. С. 184.
Sons, 1986. 484 рр.
4. Huang Y.-Z., Liao Y. // J. Org. Chem. 1991. Vol. 56.
20.
Cotton F.A., Francis R., Horrocks W.D., Jr. // J. Phys.
P. 1381. doi 10.1021/jo00004a010
Chem. 1960. Vol. 64. Р. 1534. doi 10.1021/j100839a046
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
СИНТЕЗ И СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ СУРЬМЫ
1107
21.
Mantina M., Chamberlin A.C., Valero R., Cramer C.J.,
24. Sheldrick G.M. SHELX-97, Programs for Crystal
Truhlar D.G. // J. Phys. Chem. 2009. V. 113. P. 5806.
Structure Analysis. Göttingen University, Göttingen,
doi 10.1021/jp8111556
1997.
22.
Cordero B., Gomez V., Platero-Prats A.E., Reves M.,
Echeverria J., Cremades E., Barragan F., Alvarez S. //
25. Sheldrick G.M. // Acta Crystallogr. 2007. Vol. 64. P. 112.
J. Chem. Soc., Dalton Trans. 2008. Vol. 21. P. 2832. doi
doi 10.1107/S0108767307043930
10.1039/B801115J
26. Sheldrick G.M. // Acta Crystallogr. (С). 2015. Vol. 71.
23.
Baker L.-J., Rickard C.E.F., Taylor M.J. // J. Chem. Soc.,
Dalton Trans. 1995. Р. 2895. doi 10.1039/dt9950002895
P. 3. doi 10.1107/S2053229614024218
Synthesis and Structure of Antimony Complex Compounds
[(4-N,N-Me2C6H4)3MeSb]I
and [(4-N,N-Me2C6H4)3MeSb]2[Hg2I6]·2DMSO
I. V. Egorovaa,*, V. V. Zhidkova, I. P. Grinishaka, N. А. Rodionovaa,
I. Y. Bagryanskayab, and N. V. Pervukhinaс
a Blagoveschensk State Pedagogical University, Blagoveschensk, 675000 Russia
b N.N. Vorozhtsov Novosibirsk Institute of Organic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
c A.V. Nikolaev Institute of Inorganic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
*e-mail: bgpu.chim.egorova@mail.ru
Received April 26, 2021; revised May 25, 2021; accepted May 27, 2021
For the first time tris(4-N,N-dimethylaminophenyl)methylstibonium iodide was prepared as a result of the alkyla-
tion of tris(4-N,N-dimethylaminophenyl)stibane with methyliodide. Decomposition of this complex in hot water
has led to tris(4-N,N-dimethylaminophenyl)stibane formation. [(4-N,N-(Me)2C6H4)3MeSb]2[Hg2I6]·2DMSO was
obtained. A significant distortion of the tetrahedral cation coordination is caused by the additional interaction
of the oxygen atom of the DMSO molecule with the antimony atom.
Keywords: tris(4-N,N-dimethylaminophenyl)stibane, methyliodide, mercury(II) iodide, X-ray diffraction
analysis, NMR spectroscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021