ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 7, с. 1108-1119
УДК 544.431.22
КИНЕТИКА ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ
ГИДРОКСИДОВ Y И Sm И СОЕДИНЕНИЯ
Sm(OH)3@Y(OH)3 C НАНОСТРУКТУРОЙ
ЯДРО-ОБОЛОЧКА
© 2021 г. А. В. Сотников*, В. В. Баковец, П. Е. Плюснин
Институт неорганической химии имени А. В. Николаева Сибирского отделения Российской академии наук,
пр. Академика Лаврентьева 3, Новосибирск, 630090 Россия
*е-mail: sotnikov@niic.nsc.ru
Поступило в Редакцию 5 мая 2021 г.
После доработки 15 мая 2021 г.
Принято к печати 20 мая 2021 г.
Исследованы механизмы разложения гидратированных гидроксидов редкоземельных металлов
Sm(OH)3·(H2O)gel·nH2O и Y(OH)3·(H2O)gel·nH2O, а также соединения с наноструктурой ядро-оболочка
[Sm(OH)3·(H2O)gel·nH2O]q@[Y(OH)3·(H2O)gel·nH2O]p. При термической обработке гидроксидов в ин-
тервале температур 25-900°C наблюдаются стадии последовательных фазовых превращений. Модель
топохимических реакций по Авраами-Ерофееву описывает образование фаз в исследуемых системах с
наибольшим коэффициентом корреляции. Изучена кинетика последовательных процессов дегидратации
и дегидроксилирования указанных соединений с представлением кинетических уравнений топохимиче-
ских реакций и расчетом кажущихся энергий активации и предэкспонент реакций. Энергия активации
поликонденсации соединения с наноструктурой ядро-оболочка меньше, чем энергия активации поли-
конденсации индивидуальных гидратов гидроксидов Sm и Y.
Ключевые слова: кинетика дегидроксилирования, модели топохимических реакций, гидроксиды ред-
коземельных металлов
DOI: 10.31857/S0044460X21070155
Исследование кинетики химических реакций
ственно снизить коэффициент теплопроводности
позволяет рассчитать необходимое и достаточное
за счет дополнительного рассеяния тепла на де-
время проведения реакций, определить условия
формациях решетки [14, 16, 18].
достижения наибольшего выхода [1, 2], описать
В ближайшем будущем термоэлектрические
механизм реакций и выявить последовательность
устройства смогут выиграть конкуренцию по эф-
стадий сложного химического процесса [3-6].
фективности и стоимости у традиционных электро-
Халькогениды редкоземельных металлов об-
механических преобразователей энергии [19-21].
ладают потенциалом для широкого применения,
Один из основных путей получения высоких зна-
например, в качестве высокотемпературных тер-
чений термоэлектрической добротности (ZT) -
моэлектрических материалов [7-11]. Среди них
уменьшение коэффициента теплопроводности (κ)
известны соединения на основе твердых растворов
[22]. Альтернативный подход к повышению пара-
сульфидов со структурой Th3P4 [12-18]. Введение
метра ZT предполагает увеличение коэффициента
в полуторный сульфид диспрозия γ-модификации
Зеебека (S) [23]. Сочетание обоих подходов в одном
(γ-Dy2S3) ионов гадолиния Gd3+ позволяет суще-
материале представляется более перспективным.
1108
КИНЕТИКА ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ ГИДРОКСИДОВ
1109
электропроводность (~3600 См/м [26]), но низкую
ЭДС. Сочетание таких особенностей различных
компонентов может повысить термоэлектриче-
скую добротность ZT композита за счет контакта
наноразмерных слоев с высокими значениями ко-
эффициента Зеебека и электропроводности.
Оксиды редкоземельных металлов получа-
ют в виде порошков или пленок, но для синтеза
наносоединений со структурой ядро-оболочка
золь-гель метод имеет ряд преимуществ: низкая
температура синтеза, простота и доступность про-
ведения эксперимента [16, 18]. При использовании
золь-гель метода на первом этапе формируется
золь и созревает гель гидроксидов [27], в данном
случае гидроксидов редкоземельных металлов, с
последующей их дегидратацией до оксидов. Обе-
звоживание гидроксидов металлов - рутинный
процесс получения нанооксидных материалов, од-
нако термическое разложение гидроксида редкозе-
мельного металла представляет собой сложный и
многостадийный процесс.
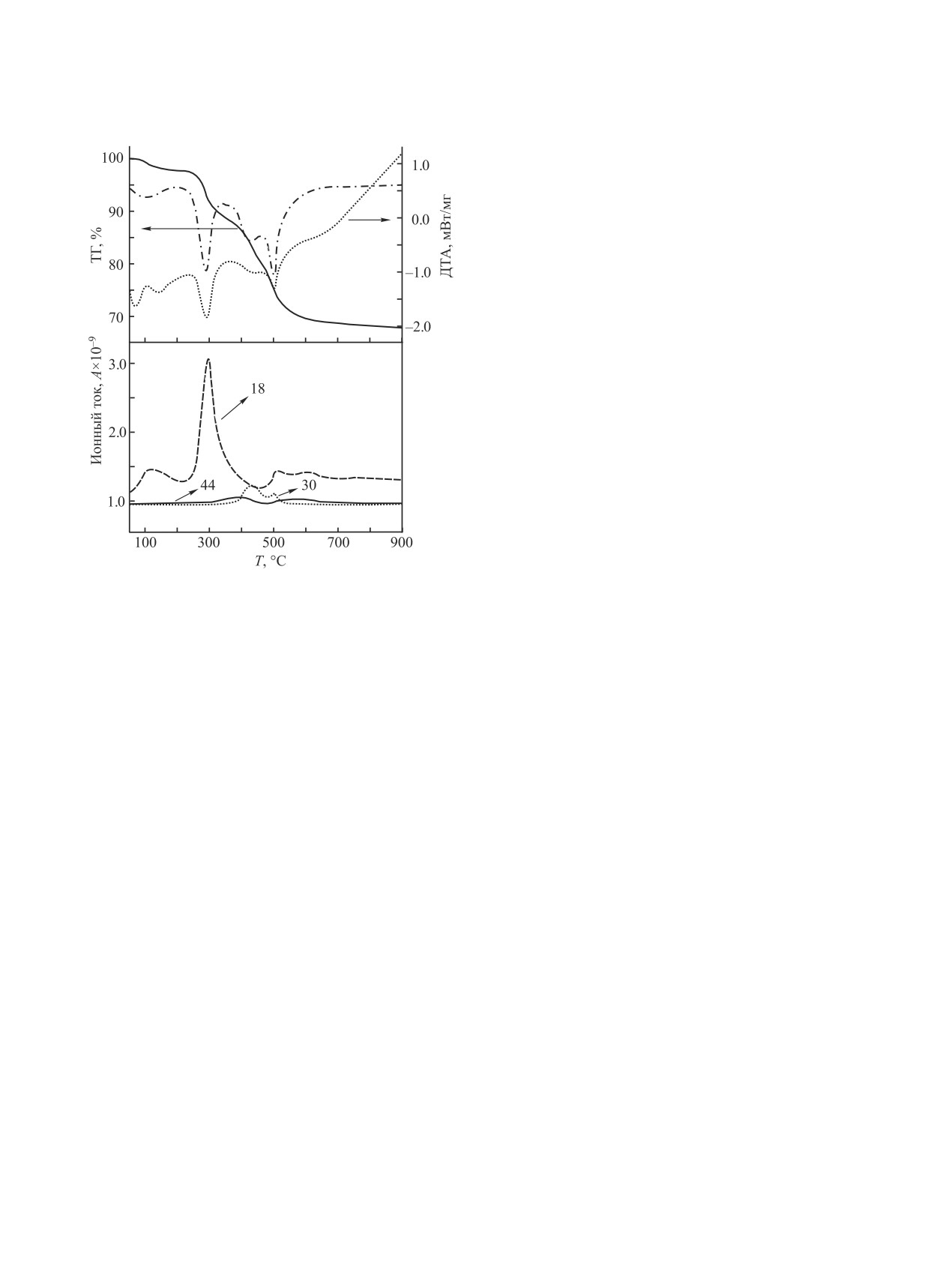
Рис. 1. Кривые термического анализа c МС-кривыми
При получении композитов ядро-оболочка с
свежеприготовленного образца Y(OH)3·(H2O)gel·nH2O 2.
заданными размерами ядер и толщины оболочек
важен поиск оптимальных условий синтеза исход-
ных нанооксидов для последующего получения
сульфидных фаз необходимого состава. На пер-
Это было успешно осуществлено на образцах PbS,
вом этапе необходимо изучить кинетику стадий
допированных натрием, при введении нанострук-
поликонденсации гидратов гидроксидов редкозе-
турированных включений SrS и CaS [24].
мельных металлов до соответствующих оксидов и
провести комплексное исследование термической
Синтез керамических высокотемпературных
стабильности и кинетических параметров после-
композитов с наноструктурой ядро-оболочка на
довательного превращения фаз при термической
основе оксидов и сульфидов редкоземельных ме-
обработке индивидуальных гидроксидов Sm и Y и
таллов ведется по принципу гость-хозяин. Гость
их соединений с наноструктурой ядро-оболочка.
имеет высокий коэффициент Зеебека и выполня-
Известно немного работ по изучению кинети-
ет роль фононного стекла с низкой теплопрово-
ки дегидроксилирования гидроксидов редкозе-
дностью, а сетчатая оболочка (хозяин) обладает
мельных металлов, например, установлен меха-
полупроводниковым или металлическим типом
низм разложения Gd(OH)3·0.64H2O и рассчитаны
проводимости и выполняет роль электронного
соответствующие кинетические параметры [28].
кристалла. В качестве хозяина выступают суль-
Подобных исследований для соединений Sm и
фидные фазы, а в качестве гостя - оксиды и оксо-
Y не проводилось. Нами исследованы механиз-
сульфиды редкоземельных металлов.
мы и кинетика разложения индивидуальных ги-
В качестве объектов исследования нами вы-
дратов гидроксидов Sm(OH)3·(H2O)gel·nH2O
1,
браны оксиды самария и иттрия. Оксид иттрия
Y(OH)3·(H2O)gel·nH2O 2 и композита на их основе -
имеет очень высокий коэффициент Зеебека
[Sm(OH)3·(H2O)gel·nH2O]q@[Y(OH)3·(H2O)gel·nH2O]p
(~2500 мкВ/K [25]), достаточно низкую тепло-
3 с наноструктурой ядро-оболочка, найдены кине-
проводность и высокое удельное сопротивление.
тические параметры некоторых стадий поликон-
Моносульфид самария имеет достаточно высокую
денсации этих соединений, полученных золь-гель
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1110
СОТНИКОВ и др.
(а)
(б)
Sm(OH)3
SmOOH
*SmO
Y(OH)3
YOOH Y2O3
Sm O23
5
*
5
4
4
*
3
3
2
2
1
1
10
30
50
70
10
30
50
70
2θ, град
2θ, град
Рис. 2. РФА отожженных образцов Sm(OH)3·(H2O)gel·nH2O 1 (а), Y(OH)3·(H2O)gel·nH2O 2 (б), выдержка 5 мин при 50 (1),
200 (2), 300 (3), 500 (4), 700°С (5).
синтезом. Фазовые превращения подтверждены
зафиксированы методом РФА при определенных
методом РФА.
температурах (рис. 2) при удалении воды из ма-
Соединения Sm(OH)3·(H2O)gel·nH2O
(1) и
триц геля, ксерогеля, гидроксида и т. д.
Y(OH)3·(H2O)gel·nH2O (2). Гидроксидам редко-
Разложение гидратов гидроксидов 1 и 2, полу-
земельных металлов свойственно присоединять
ченных золь-гель методом, протекает в несколько
большое количество воды в процессе их синтеза
ступеней. На рис. 1 представлены кривые тер-
[28]. Кроме того, возможно поглощение углекис-
мического анализа c масс-спектрометрией (МС-
лого газа с образованием примесей гидратиро-
кривыми) свежеприготовленного образца 2. Со-
ванных фаз гидроксокарбонатов редкоземельных
гласно данным синхронного термического анали-
металлов [29]. На кривых ТГ наблюдается потеря
за, на первой ступени разложения при нагревании
массы при нагревании образцов в интервале тем-
до температуры порядка 200°С удаляется гидрат-
ператур до 200°С (рис. 1). Температурный диапа-
ная вода. Вторая ступень разложения в интервале
зон потери гидратной воды зависит от природы
температур 200-400°C сопровождается эндоэф-
катиона Ln3+ [30, 31] и времени предварительной
фектом. Основной газообразный продукт, выделя-
сушки золь-геля.
ющийся на первых двух ступенях, - вода. Кроме
Разложение
гидратов
гидроксидов
этого, на второй ступени наблюдается выделение
Ln(OH)3·(H2O)gel·nH2O - сложный многоступен-
незначительного количества CO2 в результате раз-
чатый процесс, в котором при увеличении тем-
ложения остаточных количеств карбонатов, обра-
пературы образуются как достаточно устойчивые
зующихся при синтезе золь-геля [32]. Потеря мас-
оксогидроксиды и оксиды лантанидов, так и менее
сы на второй ступени и количество выделяющейся
устойчивые промежуточные фазы - переходные
воды свидетельствует об удалении молекул воды,
гидратные формы гидроксидов, карбонатов и т. д.
прочно связанной с матрицей гидроксида в объеме
[30, 31]. Это затрудняет проведение корректного
геля, и об образовании оксогидроксидов редкозе-
кинетического анализа для некоторых ступеней
мельных металлов.
разложения вследствие протекания параллельного
Дальнейшее разложение при нагревании выше
разложения промежуточных или побочных фаз.
400°C протекает в две перекрывающиеся ступени:
Нами определены кинетические параметры
происходит образование фаз полуторных окси-
стадий удаления гидратной воды из соединений
дов из оксогидроксидов. Основное газообразное
Ln(OH)3·(H2O)gel·nH2O и дегидроксилирования
выделяющееся вещество - это вода, причем ее
их до LnOOH и Ln2O3. Конденсированные фазы
количество значительно меньше, чем на второй
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КИНЕТИКА ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ ГИДРОКСИДОВ
1111
(а)
(б)
1
1
100
100
-1
-1
90
90
-3
80
-3
-5
80
70
-5
-7
200
600
1000
200
600
1000
T, °C
T, °C
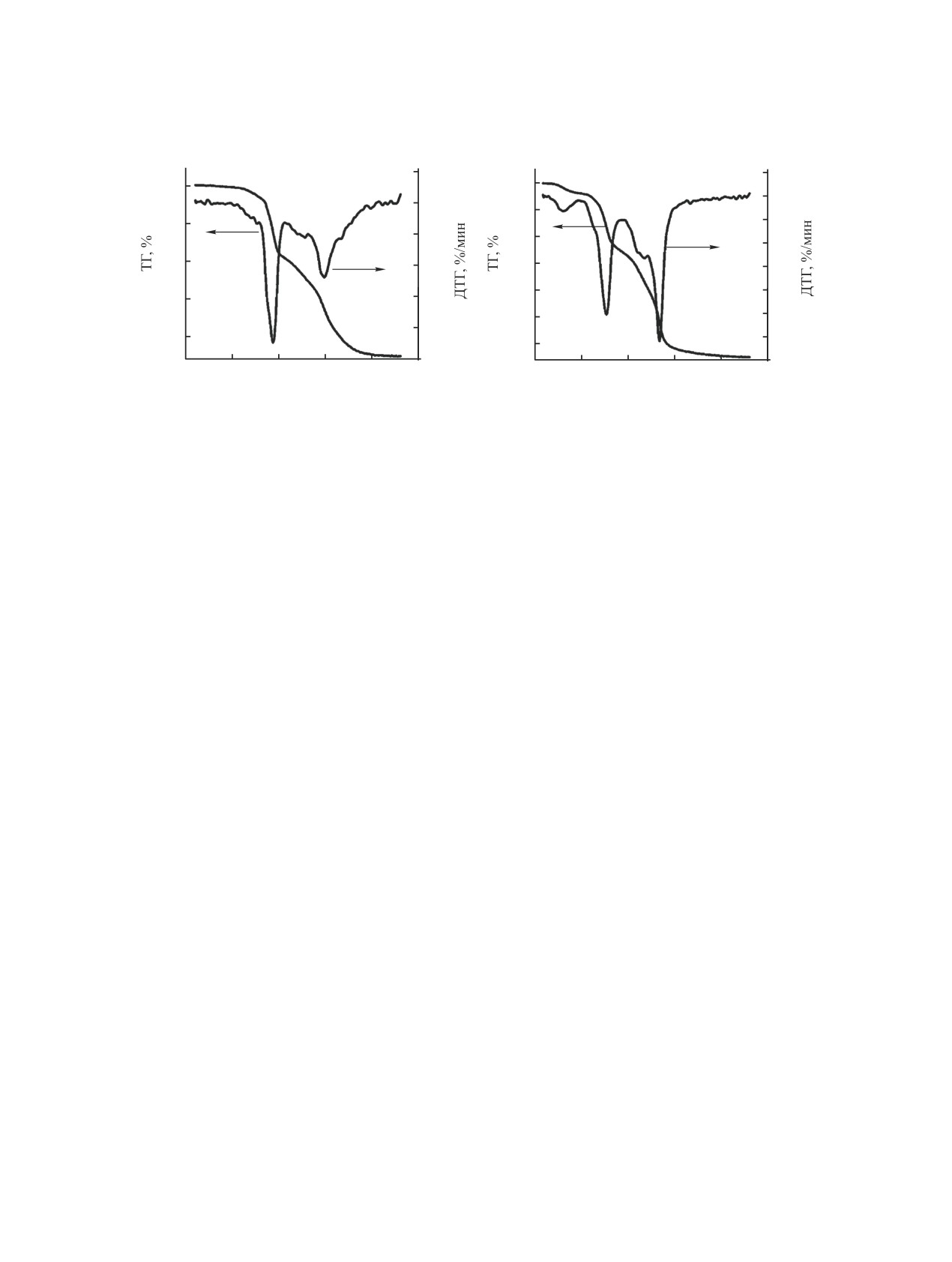
Рис. 3. ТГ- и ДТГ-кривые разложения гидроксидов самария (а) и иттрия (б). Скорость нагрева - 20 град/мин.
ступени. Кроме этого, выделяется незначительное
В области температур
200-400°С для
количество NO и CO2. Выделение NO может быть
Sm(OH)3·(H2O)gel и 180-350°С для Y(OH)3·(H2O)
вызвано неполным удалением нитрат-ионов при
gel
на кривых ТГ и ДТГ наблюдаются ступени по-
промывании осадков гидроксидов редкоземель-
тери массы с максимумами при 360 и 300°C. По-
ных металлов.
теря массы на этих ступенях вызвана удалением
Поскольку количество гидратной воды в исход-
воды, связанной в наноструктуре геля (2), и одно-
временным разложением гидроксидов с образова-
ном гидроксиде изменяется от образца к образцу,
что зависит от условий созревания гелей и их хра-
нием оксогидроксидов редкоземельных металлов
(3). Кроме этого, в этом температурном интерва-
нения, для проведения кинетических эксперимен-
ле возможно образование промежуточных фаз,
тов образцы сушили 2 ч при 250°С в атмосфере
аргона до постоянной массы.
аналогичных Gd2O(OH)4 [28], а также частичное
разложение примесей карбонатов редкоземельных
При нагревании образца 1 до температуры
металлов.
180°С (рис. 3а) не наблюдается значительного
Ln(OH)3·(H2O)gel → Ln(OH)3 + H2O,
(2)
изменения массы образца, в отличие от образца
2 (рис. 3б). Потеря массы образца 1 составляет
Ln(OH)3 → LnOOH + H2O.
(3)
0.4%, а образца 2 - 1.6%. Наблюдаемая потеря мас-
Суммарная потеря массы на данном этапе со-
сы связана с удалением воды, адсорбированной из
ставляет 9.5% для образца 1 и 10.4% для образца
воздуха свежепрокаленными образцами. Различие
2. Для этого температурного интервала разложе-
в количестве адсорбированной воды может быть
ния гидроксидов произведен расчет кинетических
связано со способностью гидроксида иттрия более
параметров.
прочно связывать молекулы воды по сравнению с
В области температур 410-650°С (образец 1)
гидроксидом самария.
и 380-570°С (2) на представленных кривых ТГ и
Таким образом, первая стадия поликонденса-
ДТГ наблюдаются ступени, относящиеся к форми-
ции предварительно высушенного гелеобразного
рованию фаз полуторных оксидов Sm2O3 и Y2O3 с
образца при нагревании до ~200°С соответствует
максимумами при 580 и 520°C, а также несколько
дегидратации с потерей молекул гидратной воды
плохо разделенных ступеней в области температур
(1). Остающиеся гидроксиды содержат значитель-
410-530 и 370-480°C соответственно, возможно,
ное количество воды, связанной в пористой нано-
связанных с разложением примесных фаз, содер-
структуре геля (H2O)gel.
жащих карбонат- и нитрат-ионы. При термолизе
Ln(OH)3·(H2O)gel·nH2O →Ln(OH)3·(H2O)gel + nH2O. (1)
образца 1 наблюдается образование фазы моноок-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1112
СОТНИКОВ и др.
(а)
(б)
100
100
90
90
3
80
2
3
2
4
1
4
80
1
70
200
600
1000
200
600
1000
T, °C
T, °C
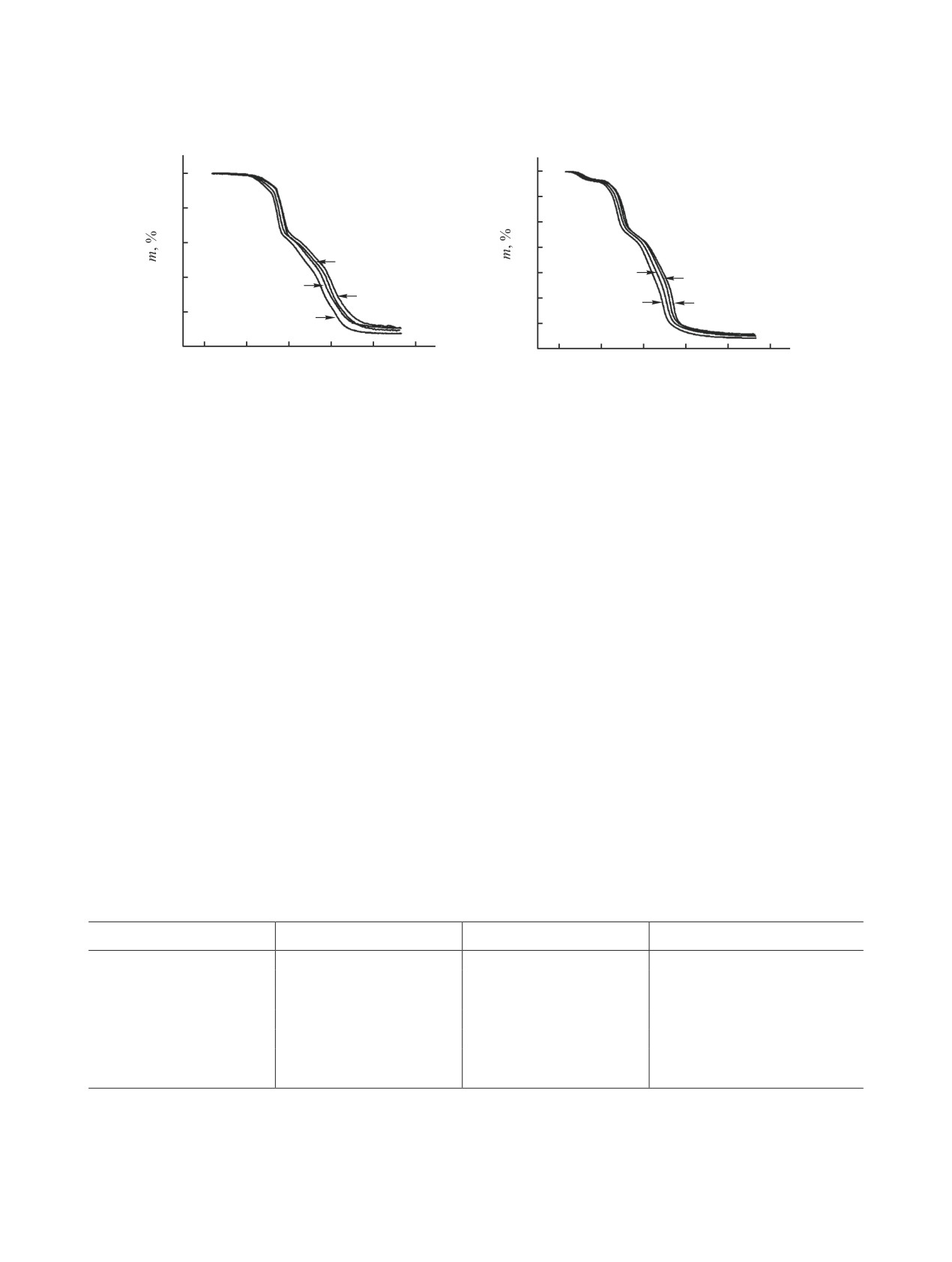
Рис. 4. ТГ-Кривые разложения гидроксидов самария (а) и иттрия (б) при скоростях нагрева 5 (1), 10 (2), 20 (3) и
40 (4) град/мин.
сида SmO на границах сосуществующих фаз, что
Sm(OH)3·(H2O)gel и Y(OH)3·(H2O)gel, удаление
подтверждается методом РФА (рис. 2а). В интер-
воды, связанной в наноструктуре геля (H2O)gel,
вале температур 370-480°С на ДТГ-кривой образ-
образование оксогидроксидов и завершающая
ца 2 наблюдается дополнительный пик, вероятно,
стадия
- формирование полуторных оксидов
связанный с тем, что дегидроксилирование проте-
самария и иттрия.
кает через стадию образования устойчивых проме-
Экспериментальные ТГ-кривые разложения ги-
жуточных нестехиометрических соединений в си-
дроксидов самария и иттрия при скоростях нагре-
стеме YOOH-Y2O3 на границах сосуществующих
ва 5, 10, 20 и 40 град/мин представлены на рис. 4.
фаз.
Предварительная обработка ТГ-кривых мето-
Суммарная потеря массы в образцах на всех
дом модифицированной линейной регрессии по-
ступенях разложения составляет 22.9 (1) и 32.7%
казала, что наилучшие модели топохимических
(2). Расчет кинетических параметров проведен в
реакций, описывающих образование фаз в иссле-
интервале температур 520-700 и 480-600°C для
дуемых системах, - это An (Авраами-Ерофеева),
стадий образования полуторных оксидов Sm и Y.
Fn (кинетическое уравнение n-ного порядка) или
Таким образом, анализ механизма разложе-
CnB (реакции с автокатализом). В табл. 1 приве-
ния гидроксидов Sm и Y позволил выделить че-
дены результаты оценки надежности и критерии
тыре стадии образования фаз: дегидратация до
выбора F с высокими коэффициентами корреля-
Таблица 1. Результаты кинетического анализа и критерии надежности моделей топохимических реакций, описыва-
ющих дегидроксилирование гидроксида Sm
Fexp
Fаcrit
Уравнение
Коэффициент корреляции
1.00
1.30
An
0.9995
1.40
1.30
Fn
0.9993
1.41
1.30
CnB
0.9993
1.41
1.30
Bna
0.9993
1.99
1.30
F1
0.9993
2.01
1.30
D1F
0.9992
2.04
1.30
C1B
0.9992
a Fcrit - критическое значение параметра F. Если значение Fexp > Fcrit, в этом случае используемая модель топохимической реакции
не подходит для описания эксперимента.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КИНЕТИКА ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ ГИДРОКСИДОВ
1113
Таблица 2. Стадии разложения соединений Ln(OH)3·(H2O)gel·nH2O 1, 2 и [Sm(OH)3·(H2O)gel·nH2O]q@[Y(OH)3·
(H2O)gel·nH2O]p 3
Соединение
Стадия
Процесс
Модель топохимических реакций
1, 2
A→Б
Отщепление гидратной воды
Авраами-Ерофеева (An)
Б→В
Образование LnOOH
An
В→Г
An
Г→Д
Образование Ln2O3
An
3
АSm@Y→БSm@Y
Отщепление гидратной воды
An
БSm@Y→ВSm@Y
Образование LnOOH
An
ВSm@Y→ГSm@Y
ГSm@Y→ДSm@Y
Образование Ln2O3
An
Таблица 3. Кинетические параметры стадий разложения гидроксидов редкоземельных металлов 1-3
1
2
3
Стадия
Схема процесса
Eкаж,
Eкаж,
Eкаж,
lgA, с-1
lgA, с-1
lgA, с-1
кДж/моль
кДж/моль
кДж/моль
A→Б
Ln(OH)3·(H2O)gel·nH2O
–
-
95±7
10.5±0.9
46±3
3.3±0.4
→Ln(OH)3·(H2O)gel
Б→В
Ln(OH)3·(H2O)gel →Ln(OH)3
177±7
16.1± 0.7
173±2
14.1±0.2
155±8
14.8±1.1
В→Г
Ln(OH)3→LnOOH
252± 5
19.2±0.4
218±10
12.8±0.8
202±11
16.0±1.4
Г→Д
LnOOH→Ln2O3
288±6
18.6±0.2
242±3
16.9±0.2
293±14
18.9±1.0
ции подходящих моделей в системе с самарием.
lgA = 19.2±0.4 [с-1], коэффициент корреляции
Аналогичные результаты получены и для системы
0.9995, T 310-410°С.
с иттрием. По этим результатам для дальнейшего
Г→Д, f(α) = (1 - α)·[-ln(1 - α)]0.91,
анализа всех стадий была выбрана модель An то-
Eкаж 288±6 кДж/моль,
похимической реакции (табл. 2).
lgA = 18.6±0.2 [с-1], коэффициент корреляции
Разложение гидроксидов редкоземельных ме-
0.9997, T 410-650°С.
таллов может быть описано последовательными
Y(OH)3·(H2O)gel·nH2O (2)
стадиями А-Д:
A→Б, f(α) = (1 - α)·[-ln(1 - α)]0.51, Eкаж 95±7 кДж/моль,
Ln(OH)3·(H2O)gel·nH2O (A) → Ln(OH)3·(H2O)gel (Б)
lgA = 10.5±0.9 [с-1], коэффициент корреляции
→ Ln2O(OH)4 (В) → LnOOH (Г) → Ln2O3 (Д).
0.9996, T 50-180°С.
Кинетические уравнения последовательных
Б→В, f(α) = (1 - α)·[-ln(1 - α)]0.59,
стадий термолиза соединений 1, 2 и их параметры
Eкаж 173±2 кДж/моль,
(модель An) представлены ниже.
lgA = 14.1±0.2 [с-1], коэффициент корреляции
Sm(OH)3·(H2O)gel·nH2O (1)
0.9991, T 180-250°С.
Стадия A→Б не рассматривается ввиду незна-
В→Г, f(α) = (1 - α)·[-ln(1 - α)]0.39,
чительного содержания адсорбированной воды
Eкаж 218±10 кДж/моль,
(n·H2O).
lgA = 12.8±0.8 [с-1], коэффициент корреляции
Б→В, f(α) = (1 - α)·[-ln(1 - α)]0.44,
Eкаж 177±7 кДж/моль,
0.9996, T 250-350°С.
lgA = 16.1±0.7 [с-1], коэффициент корреляции
Г→Д, f(α) = (1 - α)·[-ln(1 - α)]0.72,
Eкаж 242±3 кДж/моль,
0.9995, T 200-310°С.
В→Г, f(α) = (1 - α)·[-ln(1 - α)]0.60,
lgA = 16.9±0.2 [с-1], коэффициент корреляции
Eкаж 252±5 кДж/моль,
0.9998, T 380-570°С.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1114
СОТНИКОВ и др.
(а)
Ядро
(б)
Ядро
Ядро
Оболочка
10 нм
20 нм
(в)
10 нм
Рис. 5. Результаты HRTEM-микроскопии соединения с наноструктурой ядро-оболочка [Sm2O3]q@[Y2O3]p (а, б) и распре-
деление элементов (в).
Результаты расчетов методом нелинейной ре-
лочка. На рис.
5 представлены результаты
грессии кинетических параметров (кажущейся
HRTEM-микроскопии оксидов [Sm2O3]q@[Y2O3]p,
энергии активации Eкаж и предэкспоненты A для
полученных в результате отжига при 700°С образ-
стадий) приведены в табл. 3. Полученные кинети-
цов композита 3 на воздухе. Результаты, представ-
ческие параметры для двухстадийного образова-
ленные рис. 5в, подтвердили образование компо-
ния оксогидроксидов SmOOH и YOOH отличаются
зита с наноструктурой ядро-оболочка [33]. Ядра,
от параметров, найденных для Gd(OH)3·0.64H2O
состоящие из гостевых молекул [Sm2O3]q (темно-
[28] (табл. 3). Это, по-видимому, связано с различ-
серого цвета), покрыты сетчатой оболочкой
ной энергией связывания гидратной воды, воды
хозяина [Y2O3]p (светло-серого цвета). Средние
в пористой наноструктуре геля и гидроксильных
размеры полученных частиц [Sm2O3]q@[Y2O3]p
групп с различными редкоземельными металлами.
составляют 40-60 нм.
Соединение [Sm(OH)3·(H2O)gel·nH2O]q@[Y(OH)3·
Дегидратация и дегидроксилирование соеди-
(H2O)gel·nH2O]p 3 c наноструктурой ядро-обо-
нения 3 протекают, как при разложении индиви-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КИНЕТИКА ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ ГИДРОКСИДОВ
1115
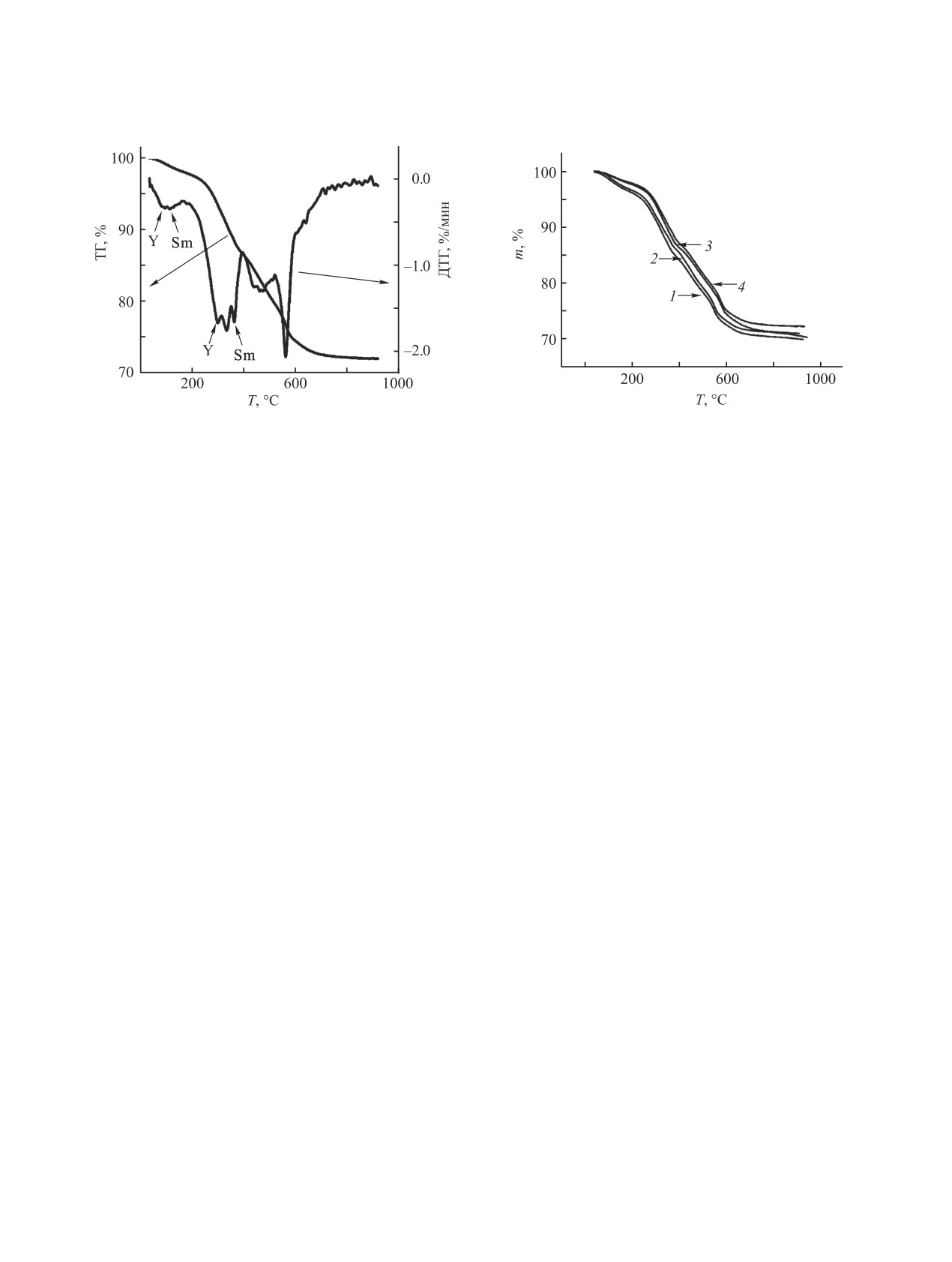
Рис. 6. ТГ- и ДТГ-кривые разложения соединения 3
Рис. 7. ТГ-Кривые разложения соединения 3 с нано-
с наноструктурой ядро-оболочка. Скорость нагрева -
структурой ядро-оболочка при скоростях нагрева 5 (1),
20 град/мин.
10 (2), 20 (3) и 40 (4) град/мин.
дуальных гидроксидов редкоземельных металлов.
ем оксогидроксидов редкоземельных металлов:
В интервале температур 25-410°C происходит
БSm@Y→ВSm@Y→ГSm@Y.
удаление гидратной воды, связанной в пористой
Рассчитанные кинетические параметры (мо-
матрице геля, и воды, образующейся при разложе-
дель An) - энергии активации и значения предэкс-
нии гидроксидов, и образование оксогидроксидов
понент - представлены в табл. 3.
редкоземельных металлов. На ДТГ-кривой наблю-
ASm@Y→БSm@Y, f(α) = (1 - α)·[-ln(1 - α)]0.51,
даются пики, соответствующие разложению инди-
Eкаж 46±3 кДж/моль,
видуальных гидроксидов (рис. 6).
lgA = 3.3±0.4 [с-1], коэффициент корреляции
На рис. 7 представлены ТГ-кривые потери мас-
0.9985, T 50-180°С.
сы образцов соединения 3 с при скоростях нагрева
БSm@Y→ВSm@Y, f(α)
=
(1
- α)·[-ln(1
- α)]0.42,
5, 10, 20 и 40 град/мин. Для температурного интер-
Eкаж 155±8 кДж/моль,
вала 25- 410°C рассчитаны кинетические параме-
lgA = 14.8±1.1 [с-1], коэффициент корреляции
тры стадии дегидратации и стадий удаления воды,
0.9995, T 180-280°С.
связанной с матрицей геля, и воды, образующейся
ВSm@Y→ГSm@Y, f(α) = (1 - α)·[-ln(1 - α)]0.12,
при разложении гидроксидов с образованием ок-
Eкаж 202±11 кДж/моль,
согидроксидов редкоземельных металлов в систе-
lgA = 16.0±1.4 [с-1], коэффициент корреляции
ме самария (ядро) и иттрия (оболочка). Наилучшее
0.9996, T 280-390°С.
описание ТГ-кривых проведено в рамках модели
An последовательных стадий поликонденсации
ГSm@Y→ДSm@Y (модель An),
композита, как единого образования. Разложение
f(α) = (1 - α)·[-ln(1 - α)]0.15, Eкаж 293±14 кДж/моль,
рассматривается как процесс, в котором дегидра-
lgA = 18.9±1.0 [с-1], коэффициент корреляции
тация, удаление воды (H2O)gel и образование оксо-
0.9994, T 400-590°С.
гидроксидов редкоземельных металлов происхо-
Принимая во внимание, что интервалы тем-
дят одновременно как в системе самария, так и в
ператур для отдельных стадий дегидратации и
системе иттрия:
дегидроксилирования малы и не превышают
- дегидратация: ASm@Y→БSm@Y;
100-200°С, можно считать, что предэкспоненты
- удаление воды, связанной в пористой нано-
кинетических уравнений остаются постоянными.
структуре геля (H2O)gel, и воды, выделяющей-
Кроме того, их величины для всех стадий доста-
ся при разложении гидроксидов с образовани-
точно близки, кроме стадии дегидратации. Ли-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1116
СОТНИКОВ и др.
митирующими стадиями оказываются стадии с
щью распыляющих форсунок, нагревали до 70°С
наибольшими кажущимися энергиями активации.
при перемешивании. После осаждения в течение
Таким образом, из табл. 3 следует, что удаление
1 ч дополнительно перемешивали 30 мин. Полу-
гидратной воды из композита существенно об-
ченный осадок отфильтровывали, промывали во-
легчено, что, вероятно, связано с его пониженной
дой до нейтрального pH и сушили при 250°С и по-
плотностью по сравнению с индивидуальными
лучали индивидуальные соединения 1 и 2.
соединениями; удаление воды, адсорбированной в
Соединение 3 с наноструктурой ядро-оболочка
нанопористой структуре геля ядро-оболочка, так-
получали по подобной схеме с последовательной
же облегчено по причине его меньшей плотности;
подачей растворов: сначала осаждали гидроксид
для индивидуальных соединений лимитирующая
самария, после чего в колбу подавали растворы
стадия поликонденсации гидроксидов - стадия
нитрата иттрия, самария и водного раствора амми-
дегидроксилирования фазы LnOOH с образова-
ака для осаждения гидроксида 2 на поверхности
нием полуторного оксида Ln2O3; стадия дегидра-
частиц соединения 1.
тации гидроксидов ускоряется в ряду соединений
Фазовый состав полученных соединений опре-
1-2-3. Для композита 3 лимитирующая стадия об-
деляли методом порошковой дифрактометрии.
разования наноструктуры ядро-оболочка - деги-
Рентгенофазовый анализ поликристаллов про-
дроксилирование ядра SmOOH до Sm2O3; энергия
водили на дифрактометрe Shimadzu XRD-7000
активации стадий дегидратации и дегидроксили-
(CuKα-излучение, Ni фильтр, диапазон 2θ 10-80°,
рования соединения с наноструктурой ядро-обо-
шаг 0.03°, накопление - 2 с). Картограмму распре-
лочка меньше, чем энергия активации стадий, про-
деления элементов Sm и Y в соединении 3 с на-
текающих при поликонденсации индивидуальных
ноструктурой ядро-оболочка получали методом
гидроксидов.
просвечивающей электронной микроскопии на
Таким образом, в работе изучены механизмы
приборе JEOL 2010, ускоряющее напряжение -
200 кВ, разрешающая способность - 1.4 Å.
дегидратации и дегидроксилирования индивиду-
альных гидратированных гидроксидов самария и
Синхронный термический анализ, включаю-
иттрия 1 и 2, а также соединения 3 с нанострук-
щий в себя одновременное проведение термогра-
турой ядро-оболочка до соответствующих окси-
виметрических определений дифференциальной
дов Sm2O3, Y2O3 и [Sm2O3]q@[Y2O3]p в интервале
сканирующей калориметрии и масс-спектроме-
температур 25-900°С. Найдены кинетические па-
трического анализа выделенного газа проводили
раметры последовательного образования фаз при
на приборе STA 449F1 Jupiter фирмы NETZSCH,
термической обработке соединений 1-3. В ряду
совмещенном с квадрупольным масс-спектроме-
изученных соединений наибольшей кажущейся
тром QMS 403D Aëolos. Эксперименты проводили
энергией активации фазовых превращений обла-
в смеси аргона и кислорода (20 об% O2) при ско-
дает соединение 1.
рости потока газа 50 мл/мин, использовали тигли
из Al2O3, скорость нагрева 10 град/мин в темпера-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
турном диапазоне 30-1000°C. Обработку экспери-
Гидроксиды самария (1) и иттрия (2) полу-
ментальных данных проводили с использованием
чали золь-гель методом [16]. В качестве исходных
пакета программ Proteus analysis [34]. Для термо-
реагентов использовали полученные из оксидов
гравиметрических исследований использовали
нитраты Sm(NO3)3∙6H2O и Y(NO3)3∙5H2O (доля ос-
термовесы Netzsch TG 209 F3. Эксперименты про-
новных компонентов не менее 99.9%). Гидрокси-
водили в потоке синтетического воздуха (80 об%
ды Sm и Y осаждали водным раствором аммиака
Ar, 20 об% O2, скорость потока 40 мл/мин) при
из растворов нитратов самария и иттрия. Концен-
скоростях нагрева 5, 10, 20 и 40 град/мин. Массы
трация растворов нитратов редкоземельных ме-
исходных навесок для измерений 10 мг.
таллов и аммиака 0.2 моль/л. Растворы нитратов и
Термогравиметрические данные обрабаты-
водного раствора аммиака одновременно подавали
вали в специальном пакете программ Netzsch
в колбу со скоростью 100 капель в минуту с помо-
Thermokinetics 3.1 [35]. Специальный программ-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КИНЕТИКА ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ ГИДРОКСИДОВ
1117
ный модуль Model-free на основе известных иссле-
Плюснин Павел Евгеньевич, ORCID: http://
дований [36-43] позволяет обрабатывать несколь-
orcid.org/0000-0002-7494-6240
ко термогравиметрических кривых, полученных
БЛАГОДАРНОСТИ
при разных скоростях нагрева. Далее использовал-
ся тот же набор экспериментальных данных для
Авторы выражают благодарность Т.Д. Пиво-
поиска соответствующих кинетических уравнений
варовой (Институт неорганической химии им.
топохимических процессов. Выборку проводили
А.В. Николаева СО РАН) за помощь в синтезе ги-
по 16 моделям топохимических реакций, учиты-
дроксидов самария и иттрия и В.А. Логвиненко
вающих химическую реакцию на границе раздела,
(Институт неорганической химии им. А.В.
образование зародышей, диффузию и т. д. Расчеты
Николаева СО РАН) за помощь в интерпретации
проводили с помощью метода Борхардта-Дэниелса
результатов.
в рамках множественного линейного регрессион-
ФОНДОВАЯ ПОДДЕРЖКА
ного метода [28]. Далее анализировали значения
условного критерия Fexp для установления модели,
Исследование выполнено при финансовой под-
которая статистически более точно описывает на-
держке в рамках научного проекта Президента РФ
блюдаемые процессы ДТГ [28]. Выбор использу-
№ МК-3688.2021.1.3.
емой при расчетах модели топохимической реак-
ции проводили по принципу: чем ближе значение
КОНФЛИКТ ИНТЕРЕСОВ
параметра Fexp к единице, тем более подходящая
Авторы заявляют об отсутствии конфликта
модель.
интересов.
Далее анализировали характер изменения сте-
СПИСОК ЛИТЕРАТУРЫ
пеней превращения одной фазы в другую по прин-
ципу нелинейной регрессии, что позволило опре-
1. Сотников А.В., Баковец В.В. // Неорг. матер. 2014.
Т. 50. № 12. С. 1309; Sotnikov A.V., Bakovets V.V. //
делить кинетические параметры (кинетическое
Inorg. Mater. 2014. Vol. 50. N 12. P. 1214. doi 10.1134/
уравнение, энергия активации, предэкспонента
S002016851412019X
реакции) для многоступенчатых процессов, на-
2. Bakovets V.V., Sotnikov A.V., Korolkov I.V. // J. Am.
блюдаемых в исследуемых системах.
Ceram. Soc. 2017. Vol. 100. N 4. P. 1320. doi 10.1111/
Случайные погрешности значений энергии
jace.14692
активации для рассматриваемых реакций разло-
3. Ayodele B.V., Hossain M.A., Chong S.L., Soh J.C.,
Abdullah S., Khan M.R., Cheng C.K. // J. Therm. Anal.
жения обычно не превышают 10% [28]. При вы-
Cal. 2016. Vol. 125. P. 423. doi 10.1007/s10973-016-
полнении расчетов были учтены известные реко-
5450-6
мендации по анализу кинетических параметров по
4. Chang C., Mao D. // Int. J. Chem. Kinet. 2006. Vol. 39.
данным термического анализа (расчет минимум
N 2. P. 75. doi 10.1002/kin.20221
по трем различным температурным режимам, ап-
5. Mohammadi M., Salarirad M.M. // Ind. Engin. Chem.
проксимация кинетических зависимостей мето-
Res. 2013. Vol. 52. N. 22. P. 7333. doi 10.1021/
ie400127q
дом линейной и нелинейной регрессий т. д.) [44].
6. Logvinenko V.A., Aliev S.B., Bolotov V.A., Dybtsev D.N.,
Полученные уравнения, используемые для расчета
Fedin V.P. // J. Therm. Anal. Cal. 2017. Vol. 127. N 1.
кинетических параметров, являются топохимиче-
P. 779. doi 10.1007/s10973-016-5398-6
скими, а расчетные параметры (энергия активации
7. Bell L.E. // Sci. 2008. Vol. 321. P. 1457. doi 10.1126/
и предэкспонент реакции) - кажущимися с точки
science.1158899
зрения формальной кинетики элементарных хими-
8. Aswal D.K., Basu R., Singh A. // En. Conv. Man. 2016.
ческих реакций.
Vol. 114. P. 50. doi 10.1016/j.enconman.2016.01.065
9. Zhu T., Liu Y., Fu C., Heremans J.P., Snyder J.G.,
ИНФОРМАЦИЯ ОБ АВТОРАХ
Zhao X. // Adv. Mater. 2017. Vol. 29. P. 1605884. doi
10.1002/adma.201605884
Сотников Александр Вадимович, ORCID: http://
10. Sotnikov A.V., Bakovets V.V., Korotaev E.V., Trubi-
orcid.org/0000-0003-3601-9689
na S.V., Zaikovskiy V.I. // Mater. Res. Bull. 2020.
Баковец Владимир Викторович, ORCID:
Vo l .
131. P.
110963. doi
10.1016/j.
materresbull.2020.110963
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
1118
СОТНИКОВ и др.
11.
Sotnikov A.V., Ohta M., Jood P. // ACS Omega. 2020.
kov V.V., Kazanin M.M., Kaminskii V.V., Solov’ev S.M.,
Vol. 5. N 22. P. 13006. doi 10.1021/acsomega.0c00908
Trushnikova L.N. // Inorg. Mater. 2003. Vol. 39. N 12.
12.
Сотников А.В., Баковец В.В., Агажанов А.Ш.,
P. 1251. doi 10.1023/B:INMA.0000008909.13771.f3
Станкус С.В., Пищур Д.П., Соколов В.В. // ФТТ.
27.
Айлер Р. Химия кремнезема. М. Мир. 1982. С. 416.
2018. Т. 60. № 3. С. 482; Sotnikov A.V., Bakovets V.V.,
28.
Logvinenko V.A., Bakovets V.V., Trushnikova L.N. // J.
Agazhanov A.Sh., Stankus S.V., Pishchur D.P., Soko-
Therm. Anal. Cal. 2014. Vol. 115. P. 1. doi 10.1007/
lov V.V. // Phys. Sol. St. 2018. Vol. 60. N 3. P. 487. doi
s10973-013-3274-1
10.1134/S1063783418030290
29.
Lu B., Li J-G., Sakka Y. // Sci. Tech. Adv. Mater. 2013.
13.
Bakovets V.V., Sotnikov A.V., Agazhanov A.Sh., Stan-
Vol. 14. P. 064202. doi 10.1088/1468-6996/14/6/064202
kus S.V., Korotaev E.V., Pishchur D.P., Shkatulov A.I. //
30.
Баковец В.В., Трушникова Л.Н., Корольков И.В.,
J. Am. Ceram. Soc. 2018. Vol. 101. N 10. P. 4773. doi
Плюснин П.Е., Долговесова И.П., Пивоварова Т.Д.,
10.1111/jace.15735
Алферова Н.И. // ЖОХ. 2013. Т. 83. № 1. С. 3;
14.
Лугуев С.М., Лугуева Н.В., Соколов В.В. // Тепл.
Bakovets V.V., Trushnikova L.N., Korolkov I.V., Plyu-
аэромех. 2012. Т. 19. № 3. С. 375; Luguev S.M.,
snin P.E., Dolgovesova I.P., Pivovarova T.D., Alfero-
Lugueva N.V., Sokolov V.V. // Therm. Aeromech. 2012.
va N.I. // Russ. J. Gen. Chem. 2013. Vol. 83. N. 1. P. 1.
Vol. 19. N 2. P. 343. doi 10.1134/S0869864312020175
doi 10.1134/S1070363213010015
15.
Гаджиев Г.Г., Исмаилов Ш.М., Абдулаев Х.Х., Ха-
31.
Баковец В.В., Трушникова Л.Н., Плюснин П.Е., Ко-
мидов М.М., Омаров З.М. // Теплофизика высоких
рольков И.В., Долговесова И.П., Пивоварова Т.Д.,
температур. 2001. Т. 39. № 3. С. 437; Gadzhiev G.G.,
Савинцева С.А. // ЖОХ. 2013. Т. 83. № 10. С. 1596;
Ismailov Sh.M., Abdullaev Kh.Kh., Khadimov M.M.,
Bakovets V.V., Trushnikova L.N., Plyusnin P.E., Korol-
Omarov Z.M. // High. Temper. 2001. Vol. 39. N. 3.
kov I.V., Dolgovesova I.P., Pivovarova T.D., Savintse-
P. 407. doi 10.1023/A:1017510725871
va S.A. // Russ. J. Gen. Chem. 2013. Vol. 83. N 10.
16.
Сотников А.В., Баковец В.В., Ohta M., Агажа-
P. 1808. doi 10.1134/S1070363213100034
нов А.Ш., Станкус С.В. // Физика твердого те-
32.
Li J-G., Li X., Sun X., Ishigaki T. // J. Phys. Chem. (C).
ла. 2020. Т. 62. № 4. С. 537; Sotnikov A.V., Bako-
2008. Vol. 112. P. 11707. doi 10.1021/jp802383a
vets V.V., Ohta M., Agazhanov A.Sh., Stankus S.V. //
33.
Meng A.C., Braun M.R., Wang Y., Peng S., Tan W.,
Phys. Solid State. 2020. Vol. 62. N. 4. P. 611. doi
Lentz J.Z., Xue M., Pakzad A., Marshall A.F., Har-
10.1134/S1063783420040216
ris J.S., Cai W., McIntyre P.C. //. Mat. Today. 2020.
17.
Ohta M., Hirai S., Kuzuya T. // J. Electron. Mater. 2011.
Vol. 40. P. 101. doi 10.1016/j.mattod.2020.05.019
Vol. 40. N 5. P. 537. doi 10.1007/s11664-010-1436-5
34.
NETZSCH Proteus Software for Thermal Analysis
18.
Баковец В.В., Сотников А.В., Агажанов А.Ш., Стан-
v.6.1.0 - NETZSCH-Gerätebau GmbH- Selb/Bayern,
кус С.В. // Тепл. аэромех. 2020. Т. 27. № 3. С. 465;
Germany. 2013.
Bakovets V.V., Sotnikov A.V., Agazhanov A.Sh., Stan-
35.
kus S.V. // Therm. Aeromech. 2020. Vol. 27. N 3. P. 439.
english/kinetics.htm.
doi 10.1134/S0869864320030129
36.
Kissinger H.E. // Anal. Chem. 1957. Vol. 29. N 11.
19.
He J., Kanatzidis M.G., Dravid V.P. // Mater.
P. 1702. doi 10.1021/ac60131a045
Today. 2013. Vol. 16. N 5. P. 166. doi 10.1016/j.
37.
Friedman H.L. // J Pol. Sci. 1963. Vol. 6. P. 183. doi
mattod.2013.05.004
10.1002/polc.5070060121
20.
Zebarjadi M., Esfarjani K., Dresselhaus M.S., Ren Z.F.,
38.
Ozawa T. // Bull. Chem. Soc. Japan. 1965. Vol. 38.
Chen G. // Energy Environ. Sci. 2012. Vol. 5. N. 1
P. 1881. doi 10.1246/bcsj.38.1881
P. 5147. doi 10.1039/C1EE02497C
39.
Ozawa T. // Thermochim. Acta. 1992. Vol. 203. P. 159.
21.
Шевельков А.В. // Усп. хим. 2008. Т. 77. № 1. С. 3;
doi 10.1016/0040-6031(92)85192-X
Shevelkov A.V., // Russ. Chem. Rev. 2008. Vol. 77. N 1.
P. 1. doi 10.1070/RC2008v077n01ABEH003746
40.
Flynn J.H., Wall L.A. // J. Res. Nat. Bur. Stand. 1966.
22.
Snyder G.J., Toberer E.S. // Nat. Mater. 2008. Vol. 7.
Vol. 70. P.478. doi 10.1016/jres.070a.043
41.
Opfermann J., Kaisersberger E. // Thermochim.
N 2. P. 105. doi 10.1038/nmat2090
23.
Liu W., Jie Q., Kim H.S., Ren Z. // Acta Mater. 2008.
Acta. 1992. Vol. 203. P. 167. doi 10.1016/0040-
Vol.
87. N
155.P.
357. doi
10.1016/j.
6031(92)85193-Y
actamat.2014.12.042
42.
Opfermann J., Kaisersberger E., Flammersheim H.J. //
24.
Zhao L.-D., He J., Wu C.-I., Hogan T.P., Zhou X., Uher
Thermochim. Acta. 2002. Vol. 391. P. 119. doi 10.1016/
C., Dravid V.P., Kanatzidis M.G. // J. Am. Chem. Soc.
S0040-6031(02)00169-7
2012. Vol. 134. N 18. P. 7902. doi 10.1021/ja301772w
43.
Vyazovkin S. // J Therm. Anal. Calorim. 2006. Vol. 83.
25.
Rowe D.M. Handbook of thermoelectrics. New York:
P. 45. doi 10.1007/s10973-005-7044-6
CRS Press, 1995. 720 p.
44.
Vyazovkin S., Burnham A.K., Criado J.M., Luis A.,
26.
Голубков А.В., Казаний М.М., Каминский В.В.,
Perez-Maqueda L.A., Popescu C., Sbirrazzuoli N. //
Соколов В.В., Соловьев С.М., Трушникова Л.Н. //
Therm. Acta. 2011. Vol. 520 P. 1. doi 10.1016/j.
Неорг. матер. 2003. Т. 39. № 12. С. 1448; Golub-
tca.2020.178597
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021
КИНЕТИКА ТЕРМИЧЕСКОГО Р
АЗЛОЖЕНИЯ ГИДРОКСИДОВ
1119
Kinetics of Thermal Decomposition of Y and Sm Hydroxides
and Sm(OH)3@Y(OH)3 Compound with a Core-Shell
Nanostructure
A. V. Sotnikov*, V. V. Bakovets, and P. E. Plyusnin
Nikolaev Institute of Inorganic Chemistry, Siberian Branch of the Russian Academy of Sciences,
Novosibirsk, 630090 Russia
*e-mail: sotnikov@niic.nsc.ru
Received May 5, 2021; revised May 15, 2021; accepted May 20, 2021
The mechanisms of decomposition of hydrated hydroxides of rare-earth metals Sm(OH)3·(H2O)gel·nH2O and
Y(OH)3·(H2O)gel·nH2O, as well as compounds with a core-shell nanostructure [Sm(OH)3·(H2O)gel·nH2O]q@
[Y(OH)3·(H2O)gel·nH2O]p were studied. During the thermal treatment of hydroxides in the temperature range of
25-900°C, stages of successive phase transformations were observed. The model of topochemical reactions ac-
cording to Avraami-Erofeev describes the formation of phases in the studied systems with the highest correlation
coefficient. The kinetics of successive processes of dehydration and dehydroxylation of the indicated compounds
was studied with the presentation of the kinetic equations of topochemical reactions and the calculation of the
apparent activation energies and the preexponent of the reactions. The activation energy for polycondensation
of a compound with a nanostructure core-shell is lower than the activation energy for polycondensation of
individual hydrates of Sm and Y hydroxides.
Keywords: dihydroxylation kinetics, topochemical reactions models, rare earth metal hydroxides
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 7 2021