ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 8, с. 1198-1212
УДК 547.822.7;547.233.1;547.281.1
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ
МОРФОЛИНИЕВОЙ СОЛИ 6-АМИНО-4-ФЕНИЛ-
2-(ДИЦИАНОМЕТИЛЕН)-1,2-ДИГИДРОПИРИДИН-
3,5-ДИКАРБОНИТРИЛА
© 2021 г. А. О. Курсковаa, В. В. Доценкоb,c, К. А. Фроловa, Н. А. Аксеновc, И. В. Аксеноваc,
Б. С. Кривоколыскоd, С. Г. Кривоколыскоa,d,*
a Лаборатория «ХимЭкс», Луганский государственный университет имени В. Даля,
кв. Молодежный 20-А/7, Луганск, 91034 Украина
b Кубанский государственный университет, Краснодар, 350040 Россия
c Северо-Кавказский федеральный университет, Ставрополь, 355009 Россия
d Луганский государственный медицинский университет имени Святителя Луки, Луганск, 91045 Украина
*e-mail: ksg-group-lugansk@mail.ru
Поступило в Редакцию 17 мая 2021 г.
После доработки 17 мая 2021 г.
Принято к печати 3 июня 2021 г.
При конденсации бензальдегида, малононитрила и димера малононитрила (2-аминопропен-1,1,3-три-
карбонитрила) в присутствии избытка морфолина в этаноле получена морфолиниевая соль 6-амино-4-
фенил-2-(дицианометилен)-1,2-дигидропиридин-3,5-дикарбонитрила. Последняя в условиях реакции
Манниха с участием первичных аминов и формальдегида дает, в зависимости от условий, 6-амино-4-
фенил-2-(дицианометилен)-1,2-дигидропиридин-3,5-дикарбонитрил, 6-(гидроксиметиламино)-4-
фенил-2-(дицианометилен)-1,2-дигидропиридин-3,5-дикарбонитрил или цвиттер-ионные продукты
аминометилирования, 6-(аммониометиламино)-4-фенил-3,5-дицианопиридин-2-ил)дицианометаниды.
Строение продуктов реакций установлено с привлечением методов 2D ЯМР спектроскопии и рентгено-
структурного анализа. Проведен предикторный анализ биологической активности новых соединений
in silico.
Ключевые слова: димер малононитрила, 2-(дицианометилен)-1,2-дигидропиридины, аминометилиро-
вание, реакция Манниха
DOI: 10.31857/S0044460X21080084
В литературе содержится множество приме-
на [5-8], ингибиторы киназ с противоопухолевым
ров практического применения димера малоно-
действием [9] и т. п. В ряде работ описан синтез
нитрила
(2-аминопропен-1,1,3-трикарбонитрила)
6-амино-2-(дицианометилен)-1,2-дигидропири-
1 в органическом синтезе (обзорные работы см.
дин-3,5-дикарбонитрилов 3 или их солей 4 реак-
[1, 2]). Одним из важных направлений использова-
цией димера малононитрила 1 с непредельными
ния димера малононитрила является синтез функ-
динитрилами 2 [10-12] (схема 1).
циональных гетероциклических соединений
-
Изоструктурные аналоги соединений 3, 4 -
полицианопиридинов [3]. Такие соединения пред-
производные цианоацетамида и цианотиоацета-
ставляют интерес как перспективные флуорес-
мида 6, 7 - представляют собой перспективные
центные красители [4], реагенты для получения
субстраты для аминометилирования, и в условиях
труднодоступных производных ряда нафтириди-
реакции Манниха под действием первичных ами-
1198
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ МОРФОЛИНИЕВОЙ СОЛИ
1199
Схема 1.
R
R
CN
CN
NC
CN
NC
CN
+
R
NC
CN
CN
CN
CN
H2N
N
H2N
N
NH2
X
H
1
2
BH
CN
CN
3
4
В - органическое основание; Х - Н или уходящая группа.
Схема 2.
Ar
Ar
NC
CN
NC
CN
RNH2, HCHO
HN
N
X
X = O, S
H2N
N
X
H
N
6
R
Ar
8
NC
CN
S
CN
NH
NC
Ar
N
H
N
S
HCHO
2N
N
NMMH
Ar
CN
7
HN
CN
S
9
Схема 3.
PhCHO
Ph
CN
O
NC
NC
CN
EtOH
+
CN
65%
CN
H
CN
2N
N
H2N
N
O
CN
H H
CN
1
10
N
H
нов и/или формальдегида превращаются в про-
[18-21], мы решили изучить поведение аналогов
изводные пиридо[1,2-a][1,3,5]триазина 8 или ди-
соединений 3, 4 в условиях реакции Манниха.
гидро[1,2-a:1′,2′-e][1,3,5,7]тетразоцина
9
[13-17]
Установлено, что последовательное взаимодей-
(схема 2).
ствие бензальдегида, малононитрила, димера ма-
6-Амино-2-(дицианометилен)-1,2-дигидро-
лононитрила 1 в присутствии избытка морфолина
пиридин-3,5-дикарбонитрилы 3 ранее в реакции
в этаноле при 25°С приводит к образованию мор-
аминометилирования не вводились. В продолже-
фолиниевой соли 6-амино-4-фенил-2-(дицианоме-
ние наших исследований в области реакций гете-
тилен)-1,2-дигидропиридин-3,5-дикарбонитрила
роциклизации с участием димера малононитрила
10 (R = Ph) с выходом 65% (схема 3).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1200
КУРСКОВА и др.
Таблица 1. Основные корреляции в спектрах ЯМР 1H-13C HSQC и HMBC соединения 10a
7.48H
7.48
H
128.4
129.6
128.4
128.4
7.39
H
H
7.39
135.7
NC
CN
H H
160.0
3.09
3.09
H
N
H
CN
42.9
42.9
H2N
N
63.3
63.3
CN
O
H3.74
δC, м. д.
δH, м. д.
1H-13C HSQC
1H-13C HMBC
3.09 уш. с (4Н, CH2NCH2)
42.9 (CH2NCH2)
42.9 (CH2NCH2), 63.3 (CH2OCH2)
3.74 т (4Н, CH2OCH2)
63.3 (CH2OCH2)
42.9 (CH2NCH2), 63.3 (CH2OCH2)
7.39 м (2Н, С2Н, С6H, Ph)
128.4* (С2H, C6H, Ph)
129.6* (C4H, Ph), 160.0 (C4)
128.4* (С2H, C6H, Ph), 128.4* (C3H,
7.48 м (2Н, С3Н, С5H, Ph)
128.4* (C3H, C5H, Ph)
C5H, Ph), 135.7 (C1, Ph)
7.48 м (1Н, С4H, Ph)
129.6* (C4H, Ph)
-
a Здесь и далее звездочкой обозначены сигналы атомов углерода, находящиеся в противофазе в спектре ЯМР 13C DEPTQ.
Строение соединения 10 было изучено с при-
10 с избытком НСНО и пропиламином либо изо-
влечением методов спектроскопии ЯМР на ядрах
пропиламином дает только продукт гидроксиме-
1Н и 13С (DEPTQ), 2D ЯМР (1H-13C HSQC, 1H-13C
тилирования по аминогруппе С6NH2 - пиридин 14
HMBC) (табл. 1), а также ИК спектроскопии.
(выходы 40 и 44%). Полученные результаты мож-
но объяснить следующим образом: образование
Установлено, что кратковременное кипячение
соединений 11 происходит вследствие связывания
соли 10 с избытком формалина в EtOH или i-PrOH
морфолина формальдегидом, либо же через под-
приводит вместо образования продуктов окси- или
аминометилирования к выделению 6-амино-4-фе-
кисление соли 10 муравьиной кислотой, неизбеж-
но присутствующей в водном формалине вслед-
нил-2-(дицианометилен)-1,2-дигидропиридин-
ствие окисления/диспропорционирования НСНО.
3,5-дикарбонитрила 11 с выходами 53 и 56% со-
Наличием НСООН можно также объяснить про-
ответственно. При кипячении соли 10 с избытком
текание побочной реакции N-метилирования по
НСНО, метиламином или изопропиламином в
Эшвайлеру-Кларку в случае соединений 13, по-
EtOH были получены продукты аминометилиро-
скольку формалин для реакции берется в избыт-
вания 12a, б с выходами 35 и 50% по аминогруп-
пе С6NH2 (схема 4). В то же время, проведение
ке, и муравьиная кислота, очевидно, присутствует
в реакционной массе в достаточном количестве.
реакции Манниха в аналогичных условиях, но с
Образование соединений 12 (вместо 13) предпо-
участием пропиламина или пара-толуидина со-
ложительно связано с меньшей растворимостью и
провождается реакцией метилирования по Эшвай-
выведением из сферы реакции.
леру-Кларку [22, 23] с образованием бетаинов
13a, б (выходы 29 и 41%). При использовании в
Примечательно, что в отличие от серных и
качестве растворителя изопропанола реакция соли
кислородных аналогов 6, 7, ни в одном из случа-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ МОРФОЛИНИЕВОЙ СОЛИ
1201
Схема 4.
Ph
Ph
NC
CN
NC
CN
Ph
MeNH2 или
CN
CN
NC
CN
HO
N
N
H2N
N
i-PrNH2,
H
H
H
HCHO, EtOH
CN
CN
R
CN
N
N
N
14 (40-44%)
11
H
H
H
CN
HCHO,
53-56%
12a, R = Me (35%)
PrNH2 или
EtOH или
i-PrOH
12б,
R = i-Pr (50%)
i-PrNH2,
HCHO, i-PrOH
Ph
Ph
NC
CN
O
PrNH2 или
NC
CN
p-TolNH2,
R
CN
HCHO, EtOH
N
N
N
H
H
CN
CN
N
Me
H2N
N
H H
13a, R = Pr (29%)
CN
13б,
R = p-tolyl (41%)
10
ев не было отмечено образования 1,3,5-триазино-
нуклефильностью атома азота пиридинового цик-
вого или 1,3,5,7-тетразоцинового циклов. Столь
ла вследствие суммарного акцепторного действия
существенная разница в регионаправленности
двух нитрильных и дицианометиленовой групп,
реакций аминометилирования соли 10 по сравне-
либо образованием устойчивых бетаиновых струк-
нию с результатами, представленными в работах
тур типа 12 без возможности для дальнейшей гете-
[13-17], может быть объяснена либо пониженной
роциклизации.
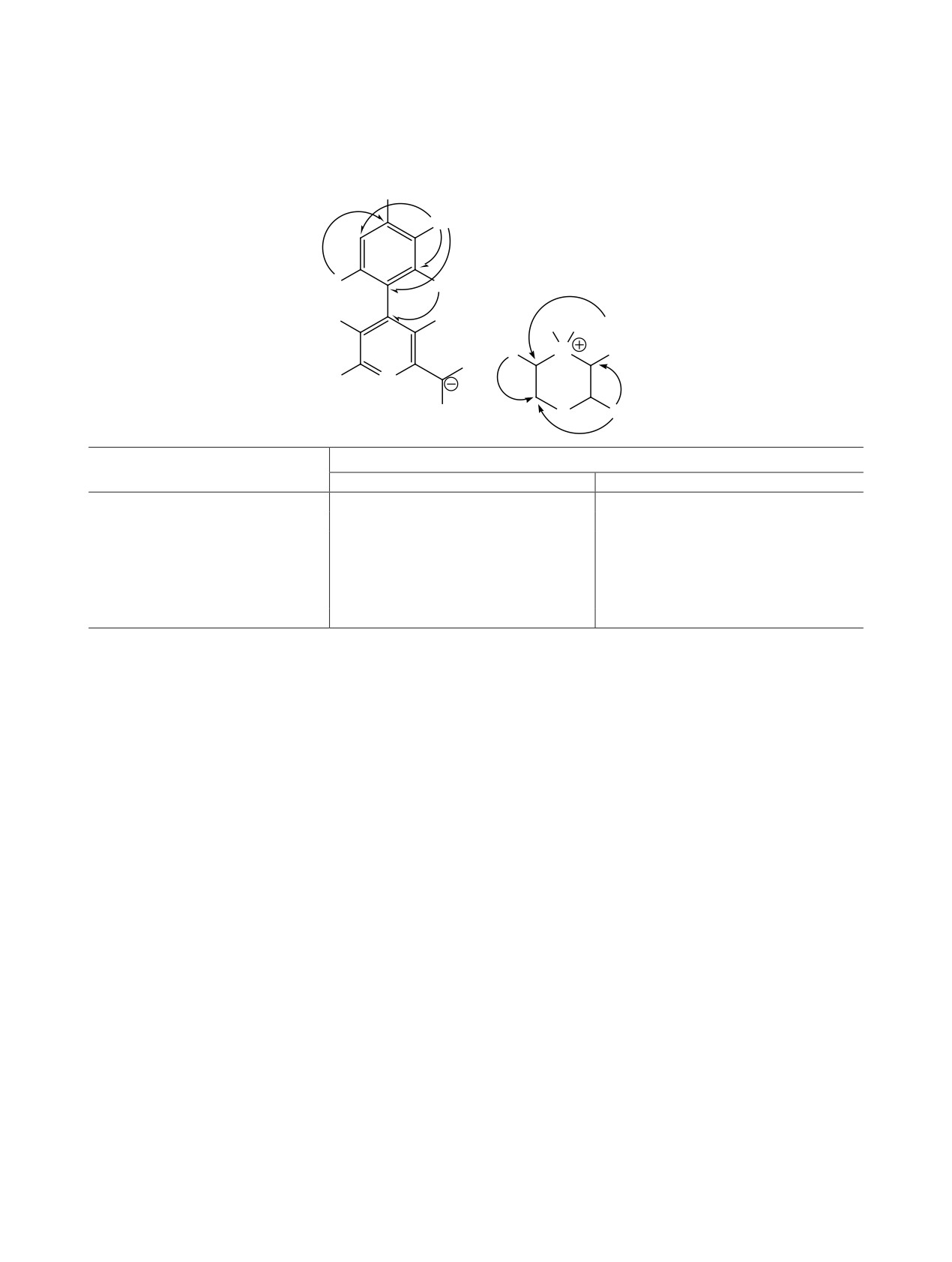
Рис. 1. Общий вид молекулы соединения 13а в кристалле. Тепловые эллипсоиды неводородных атомов показаны на уровне
50%-ной вероятности нахождения атома.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1202
КУРСКОВА и др.
Таблица 2. Основные корреляции в спектрах ЯМР HSQC и HMBC 1H-13C и 1H-15N соединения 12a
7.52
H
7.52
H
128.4
129.9
128.4
128.4
7.42
H
128.4
H
7.42
NC
CN
160.1
8.47
H
CN
156.2
N
N
86.3
230.5
4.69
H
63.2
H
CN
N
46.7
4.59H
H
40.6
8.91
H
H
2.79
2.79
H
δC, м. д.
δN, м. д.
δH, м. д.
1H-13C HSQC
1H-13C HMBC
1H-15N HSQC
1H-15N HMBC
2.79 д (3Н, Ме)
40.6* (Ме)
63.2 (NCH2N)
-
-
4.59 м (1H, NCH2N)
63.2 (NCH2N)
40.6* (Ме), 156.2 (C6)
-
-
4.69 м (1H, NCH2N)
63.2 (NCH2N)
156.2 (C6)
-
-
7.42 м (2Н, С2Н, С6H,
128.4* (С2H, C6H, Ph)
129.9* (C4H, Ph), 160.1
-
-
Ph)
(C4)
7.52 м (1Н, С4H, Ph)
129.9* (C4H, Ph)
128.4* (C2H, C3H, C5H,
–
-
C6H, Ph)
7.52 м (2Н, С3Н, С5H,
128.4* (C3H, C5H, Ph)
128.4* (C2H, C3H, C5H,
-
-
Ph)
C6H, Ph)
8.47 т (1H, NH)
-
156.2 (C6)
86.3 (NH)
230.5 (N1)
8.91 уш. с (1Н, N+H)
-
-
46.7 (N+H)
-
Строение соединений 11-14 было изучено с
дают противомикробным [24-26], антиприонным
использованием методов спектроскопии ЯМР на
[27-29], противоопухолевым [30] действием, про-
ядрах 1Н и 13С (DEPTQ), двумерных эксперимен-
являют свойства ингибиторов тирозинкиназ [31],
тов 2D ЯМР (1H-13C HSQC, 1H-13C HMBC, 1H-15N
ингибиторов α-глюкозидазы [32] и агонистов аде-
HSQC, 1H-15N HMBC) (табл. 2-4), а также ИК
нозиновых рецепторов [33-36]. Из числа наиболее
спектроскопии. Строение соединения 13а допол-
эффективных препаратов последней группы стоит
нительно подтверждено данными рентгенострук-
отметить кападенозон (capadenoson) 16 [37-39] и
турных исследований (рис. 1).
неладеносон-биаланат (neladenoson bialanate) 17
[40, 41], используемые для лечения стенокардии и
Следует отметить, что полученные соединения
хронической сердечной недостаточности.
являются структурными аналогами 2-амино-6-(R-
тио)пиридин-3,5-дикарбонитрилов общей фор-
В связи с этим мы решили провести первич-
мулы 15 (схема 5). Подобные соединения обла-
ный предикторный анализ и расчет in silico воз-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ МОРФОЛИНИЕВОЙ СОЛИ
1203
Таблица 3. Основные корреляции в спектрах ЯМР HSQC и HMBC 1H-13C и 1H-15N соединения 13а
7.52
H
7.52
H
128.8
130.3
128.8
128.8
7.41
H
128.8
H
7.41
135.6
NC
CN
160.6
8.41
H
87.2
CN
156.6
H
8.78
N
N
230.1
2.75
H
H
38.4
H
4.78
H
CN
62.7
H
4.52
N
55.4
55.2
H
17.3
2.98
1.70
H
H
H
11.2
H
H H0.90
δC, м. д.
δN, м. д.
δH, м. д.
1H-15N
1H-15N
1H-13C HSQC
1H-13C HMBC
HSQC
HMBC
0.90 т (3Н, Ме Pr)
11.2* (Ме Pr)
17.3 (СН2Ме Pr), 55.2 (СН2 Pr)
-
-
1.70 м (2Н, СН2Ме Pr)
17.3 (СН2Ме Pr)
11.2* (Ме Pr), 55.2 (СН2 Pr)
-
-
2.75 д (3Н, Ме)
38.4* (Ме)
55.2 (СН2 Pr), 62.7 (NCH2N)
-
-
2.98 м (2Н, СН2 Pr)
55.2 (СН2 Pr)
17.3 (СН2Ме Pr), 62.7 (NCH2N)
-
-
4.52 м (1H, NCH2N)
62.7 (NCH2N)
156.6 (C6)
-
-
4.78 м (1H, NCH2N)
62.7 (NCH2N)
156.6 (C6)
-
-
7.41 м (2Н, С2Н, С6H, Ph)
128.8* (С2H, C6H, Ph)
130.3* (C4H, Ph), 160.6 (C4)
-
-
7.52 м (1Н, С4H, Ph)
130.3* (C4H, Ph)
-
-
-
7.52 м (2Н, С3Н, С5H, Ph)
128.8* (С3H, C5H, Ph)
128.8* (С2H, C6H, Ph), 128.8* (С3H,
-
-
C5H, Ph), 135.6 (C1, Ph)
8.41 т (1H, NH)
-
62.7 (NCH2N), 156.6 (C6)
87.2 (NH)
230.1 (N1)
8.78 уш. с (1Н, N+H)
-
-
55.4 (N+H)
-
Схема 5.
Ar
Me
O
HO
NC
CN
O
NH2
• HCl
O
O
N
H
R1
O
Me
N
N
S
R2
R
15
NC
CN
NC
CN
N
N
Cl
N N S
Cl
H2N
N
S
S
S
16
17
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1204
КУРСКОВА и др.
Таблица 4. Основные корреляции в спектрах ЯМР HSQC и HMBC 1H-13C соединения 14
7.49
H
7.49
H
129.5
128.5
128.5
128.5
7.39
7.39
H
H
135.7
NC
CN
159.7
7.62
H
CN
156.6
N
N
H
4.84
H
64.6
CN
H
O
H 5.12
δC, м. д.
δH, м. д.
1
H-13C HSQC
1H-13C HMBC
4.84 м (2H, NCH2O)
64.6 (NCH2O)
156.6 (C6)
5.12 т (1Н, ОН)
-
64.6 (NCH2O)
7.39 м (2Н, С2Н, С6H, Ph)
128.5* (С2H, C6H, Ph)
128.5* (C3H, C5H, Ph), 129.5* (C4H, Ph), 135.7
(C1, Ph), 159.7 (C4)
7.49 м (2Н, С3Н, С5H, Ph)
128.5* (C3H, C5H, Ph)
128.5* (С2H, C6H, Ph), 135.7 (C1, Ph)
7.49 м (1Н, С4H, Ph)
129.5* (C4H, Ph)
128.5* (C2H, C3H, C5H, C6H, Ph)
Таблица 5. Риски токсичности и физико-химические параметры соединений 11-14, спрогнозированные с помощью
программного пакета OSIRIS Property Explorer
Риск токсичностиа
Физико-химические параметры
Соединение
А
В
С
D
сLogP
logS
MW
TPSA
drug-likeness
drug-score
11
-
-
-
-
0.59
-4.86
284
133.2
-6.75
0.37
12a
-
-
-
-
-0.43
-6.54
327
136.6
-5.56
0.28
12б
-
-
-
-
0.34
-7.22
355
136.6
-5.49
0.25
13а
-
-
-
-
0.56
-6.75
369
124.5
-5.82
0.26
13б
-
-
-
-
2.40
-8.37
417
124.5
-6.78
0.22
14
±
+
+
+
0.44
-5.10
314
139.4
-6.82
0.06
а Знаком «+» показан высокий риск токсичности, «±» - умеренный риск, «-» - отсутствие токсичности. A - Мутагенность, B -
канцерогенность, С - раздражающее действие, D - репродуктивные эффекты.
можных мишеней, параметров ADMET и соответ-
ющие параметры: сLogP [логарифм коэффици-
ствия критериям биодоступности для соединений
ента распределения между н-октанолом и водой
11-14. Анализ структур на соответствие «правилу
log(coctanol/cwater)], растворимость (logS), пло-
пяти» К. Липински [молекулярная масса (MW) ≤
щадь топологической полярной поверхности
500, сLogP ≤ 5.0, TPSA ≤ 140 Å2, число акцепто-
(Topological Polar Surface Area, TPSA), ряд токси-
ров водородных связей ≤ 10, доноров ≤ 5] [42-44]
кологических характеристик - рисков побочных
проведен с использованием программного сервиса
эффектов (мутагенные, онкогенные, репродуктив-
OSIRIS Property Explorer [45]. Рассчитаны следу-
ные эффекты), параметр сходство с известными
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ МОРФОЛИНИЕВОЙ СОЛИ
1205
Таблица 6. Расчетные параметры ADMET для соединений 11-14а
Ингибирование цитохромов Р450
Острая
Тест
токсичность
№
CYP1A2
CYP2C19
CYP2C9
CYP2D6
CYP3A4
Эймса
(крысы) pLD50,
lg [1/(моль/кг)]
11
0.6253
0.9863
0.7779
0.5102
0.5340
0.9005
0.6638
0.7887
2.7519
+
+
+
+
-
-
-
+
12a
0.8792
0.9191
0.7263
0.5829
0.8480
0.8620
0.6255
0.5961
2.8731
+
+
+
-
-
-
+
+
12б
0.8218
0.8880
0.6892
0.5000
0.7694
0.8321
0.6596
0.5271
2.9129
+
+
+
-
-
-
+
+
13а
0.6667
0.8292
0.5545
0.7600
0.7810
0.7380
0.7455
0.6567
2.6426
+
+
-
-
-
-
-
-
13б
0.8380
0.8057
0.7555
0.5480
0.7632
0.6333
0.6469
0.5172
2.9104
+
+
+
-
-
-
+
+
14
0.7717
0.9384
0.6734
0.5252
0.6492
0.7869
0.6961
0.5252
2.5256
+
+
+
+
-
-
-
-
а Знаком «+» или «-» показано наличие или отсутствие эффекта, число означает вероятность эффекта в долях от единицы.
лекарственными препаратами (drug-likeness), а
ной токсичности исследуемые соединения можно
также общая оценка фармакологического потен-
отнести к III (13а, 500 мг/кг < LD50 < 5000 мг/кг)
циала соединения (drug-score).
и II (остальные соединения, 50 мг/кг < LD50 <
500 мг/кг) категориям. Для всех соединений про-
Согласно приведенным в табл. 5 данным, зна-
гнозируется высокая гастроэнтеральная абсорб-
чение сLogP для соединений 11-14 находится в
ция и вероятная возможность проникновения че-
диапазоне -0.43-2.40, что указывает на вероятную
рез гематоэнцефалический барьер (ГЭБ). Только
хорошую абсорбцию [42-44]. В то же время значе-
для соединения 13а прогнозируется полное отсут-
ние logS < -4.0 для всех исследуемых соединений
ствие ингибирующего действия в отношении ци-
указывает на весьма низкую растворимость (менее
тохромов Р450 и возможного мутагенного эффекта
1×10-4 моль/л), что снижает биодоступность. Мо-
в тесте Эймса (табл. 6).
лекулярные массы всех соединений и показатели
параметра TPSA соответствует критериям перо-
Возможные протеиновые мишени для пока-
ральной биодоступности. Все соединения, кроме
завшего наивысшее значение drug-score соеди-
обладающего аминоалкилирующими свойствами
нения 11 соединений были спрогнозированы с
гидроксиметильного производного 14, в прогно-
использованием протокола протеин-лигандного
зе с использованием OSIRIS Property Explorer де-
докинга GalaxySagittarius [47] на базе веб-сервера
монстрируют отсутствие риска возможных ток-
GalaxyWeb [48, 49]. Предварительно 3D-структура
сических эффектов. Для соединения 11 отмечено
была оптимизирована средствами молекулярной
наивысшее значение показателя фармакологиче-
механики в силовом поле ММ2 для оптимизации
ского потенциала соединения (drug-score). Для
геометрии и минимизации энергии. Докинг с ис-
прогнозирования параметров ADMET (Absorption,
пользованием протокола GalaxySagittarius прово-
Distribution, Metabolism, Excretion, Toxicity) также
дили в режимах Binding compatability prediction
использовался программный пакет admetSAR [46].
и Re-ranking using docking. В табл. 7 представле-
Согласно критериям US EPA, по острой перораль-
ны результаты докинга для соединения 11 для 20
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1206
КУРСКОВА и др.
Таблица 7. Результаты прогнозирования протеин-лигандного взаимодействия для соединения 11
Пре-докинговая
Свободная
Общая оценка
Идентификатор
Идентификатор
оценка протеин-
энергия
протеин-
Соединение
протеина PDB
протеина
лигандного
связывания,
лигандного
ID
UniProt ID
взаимодействия
ккал/моль
взаимодействия
(Predock score)
(Docking score)
6aaj
O60674
0.104
-6.462
0.153
3zbx
P08581
0.084
-9.114
0.152
4qyg
O14757
0.087
-8.527
0.151
N
N
5n1v
P68400, P68400
0.092
-7.613
0.150
N
5up3
Q99683
0.091
-7.398
0.146
6ocq
Q13546,
0.065
-10.825
0.146
H2N
N
H
Q13546
3nxx
P00374
0.085
-7.519
0.141
N
4g9r
P15056, P15056
0.074
-8.883
0.140
11
4xs2
Q9NWZ3
0.083
-7.453
0.139
1unl
Q00535
0.077
-8.100
0.137
5ebz
O15111, O15111
0.072
-8.541
0.136
6i8z
Q05397
0.089
-6.220
0.135
6q4e
P24941
0.097
-5.015
0.135
5hcl
O60885
0.098
-4.718
0.134
3eyg
P23458
0.076
-7.640
0.133
2xir
P35968
0.087
-6.181
0.133
4gj3
P29597
0.081
-6.956
0.133
4z16
P52333, P52333
0.078
-7.358
0.133
5gjf
O43318
0.073
-7.924
0.133
3mtl
Q00536
0.057
-9.968
0.132
комплексов мишень-лиганд с минимальной сво-
бодной энергии связывания ΔGbind и наилучшей
оценкой протеин-лигандного взаимодействия.
Прогнозируемые протеиновые мишени указаны с
помощью ID-идентификаторов в Protein Data Bank
(PDB) и в базе данных UniProt. Как можно заме-
тить из табл. 7, полученные соединения обнару-
живают сродство к широкой группе белков-киназ.
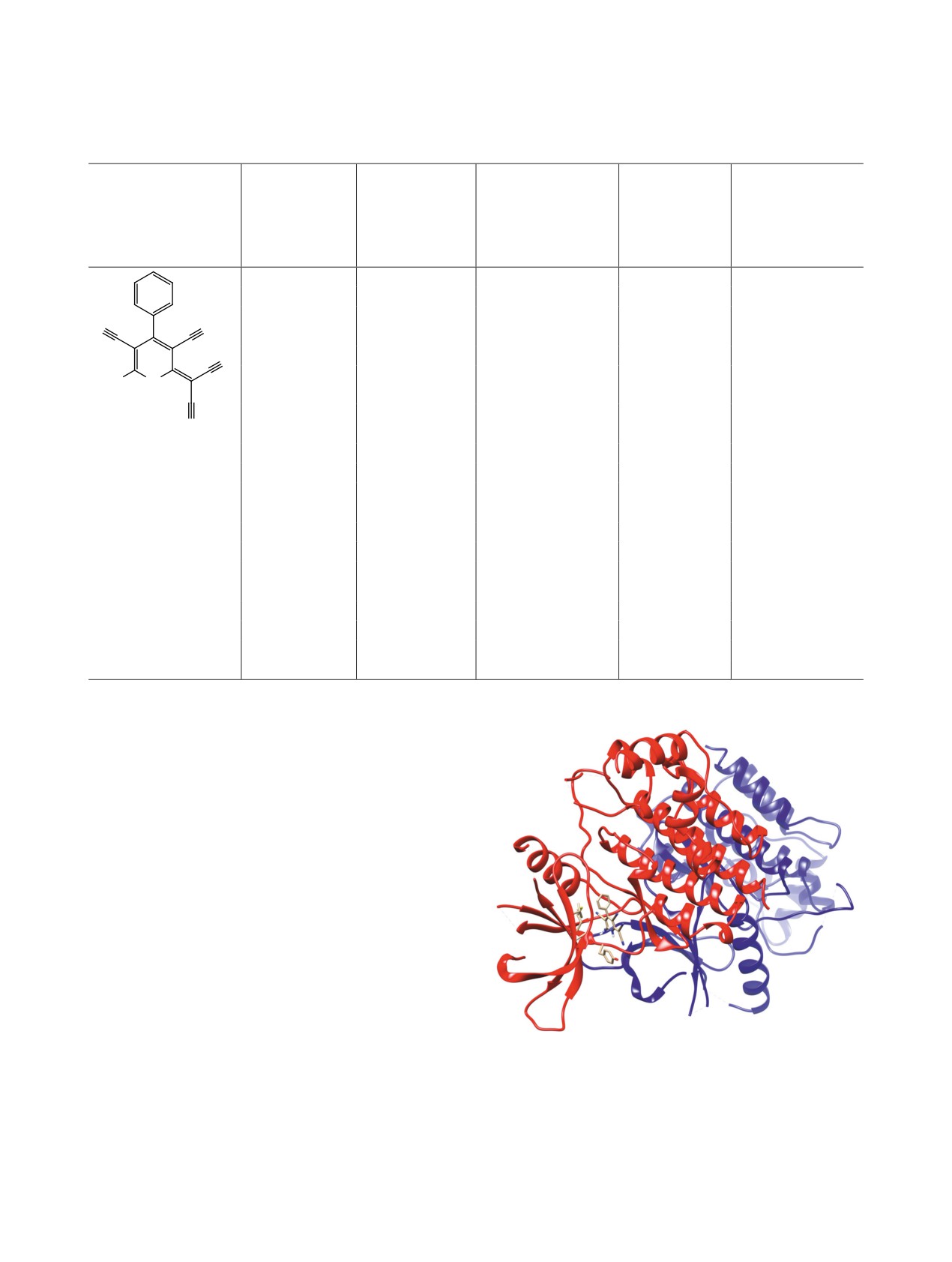
В частности, прогнозируется афинность к тиро-
зин-протеиновой Янус-киназе JAK2 (PDB ID 6aaj)
(рис. 2), с-Met-киназе (PDB ID 3zbx), серин-трео-
нин-киназе CHK1 (PDB ID 4qyg) и ряду других,
что указывает на перспективность изучения актив-
ности соединения 11 в отношении аутоиммунных
и онкологических заболеваний.
Суммируя результаты работы, необходимо
отметить, что ранее не описанным в литерату-
Рис. 2. Прогнозируемая структура протеин-лиганд-
ре способом (последовательной конденсацией
ного комплекса соединения 11 и Янус-киназы JAK2
бензальдегида, малононитрила и
2-аминопро-
(PDB ID 6aaj) (получено с использованием протокола
пен-1,1,3-трикарбонитрила в присутствии избытка
GalaxySagittarius).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ МОРФОЛИНИЕВОЙ СОЛИ
1207
морфолина) была получена морфолиниевая соль
Морфолиниевая соль
6-амино-4-фенил-2-
6-амино-4-фенил-2-(дицианометилен)-1,2-диги-
(дицианометилен)-1,2-дигидропиридин-3,5-ди-
дропиридин-3,5-дикарбонитрила. Показано, что
карбонитрила (10). Смесь 0.77 мл (7.5 ммоль)
аминометилирование этой соли с первичными
бензальдегида, 0.5 г (7.5 ммоль) малононитрила
аминами и избытком формальдегида протекает не-
и 1 капли морфолина в 25 мл этанола перемеши-
однозначно, с образованием различных произво-
вали при 25°С. Через 10 мин прибавляли 1.0 г
дных полицианопиридина, функционализирован-
(7.5 ммоль) димера малононитрила 1 и 1.3 мл
ных по С6NH2-группе. Установлено образование
(15 ммоль) морфолина. После растворения всех
необычных продуктов восстановления по Эшвей-
исходных компонентов реакционную массу остав-
леру-Кларку; в то же время, образования продук-
ляли на 12 ч, затем образовавшийся осадок от-
тов гетероциклизации не наблюдалось. В целом
фильтровывали, промывали холодным этанолом
следует отметить меньшую реакционную способ-
и ацетоном, сушили 3 ч при 60°С. Выход 65%,
ность производных 2-(дицианометилен)пиридина
темно-желтый мелкокристаллический порошок,
в сравнении с пиридин-2(1Н)-онами и -тионами
т. пл. 281-283°С. ИК спектр, ν, см-1: 2165 ш, 2180
близкого строения. Предикторный анализ биоло-
ш (C≡N), 3253 ш, 3313 ш, 3520 ш (NH2, N+H2).
гической активности показал перспективность
Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.: 3.09 уш. с
молекул как возможных лигандов для белковых
(4Н, CH2NCH2), 3.74 т (4Н, CH2OCH2, 3JHH 4.8 Гц),
мишеней, но при этом спрогнозирована недоста-
7.00 уш. с (частично в дейтерообмене), 8.66 уш.
точная растворимость для всех соединений, что
с (2×2Н, NH2, N+H2), 7.39 м (2Н, С2Н, С6H, Ph),
подтверждается экспериментально. Возможным
7.48 м (3Н, С3Н, С4Н, С5H, Ph). Спектр ЯМР 13С
направлением дальнейших исследований в данной
DEPTQ (ДМСО-d6), δС, м. д.: 42.9 (CH2NCH2), 63.3
области является получение соединений с фарма-
(CH2OCH2), 80.5, 85.2 (C3, C5), 116.3, 116.6 (4C≡N),
кофорным
6-амино-4-арил-3,5-дицианопириди-
128.4* (С2H, C3H, C5H, C6H, Ph), 129.6* (C4H, Ph),
новым фрагментом, но с лучшими показателями
135.7 (C1, Ph), 158.4 (C6), 160.0 (C4), 161.8 (C2).
биодоступности.
Сигнал углерода С(C≡N)2 в спектре не обнаружи-
вается. Здесь и далее звездочкой обозначены сигна-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
лы в противофазе. Масс-спектр, m/z (Iотн, %): 372
Спектры ЯМР 1Н записаны на спектроме-
(3) [M + 1]+, 329 (100) [M - катион морфолиния +
тре Bruker DPX-400 [400.40 (1Н), 100.63 (13С),
46]+, 307 (30) [M - катион морфолиния + 1 + 23]+.
40.55 МГц (15N)] в ДМСО-d6 или CDCl3. Внутрен-
Найдено, %: С 64.49; H 4.48; N 26.15. C20H17N7O.
ний стандарт - ТМС или остаточные сигналы рас-
Вычислено, %: C 64.68; H 4.61; N 26.40. M 371.4.
творителя. ИК спектры зарегистрированы на ИК
6-Aмино-4-фенил-2-(дицианометилен)-
Фурье-спектрометре Bruker Vertex 70 с приставкой
1,2-дигидропиридин-3,5-дикарбонитрил (11). К
НПВО на кристалле алмаза. Масс-спектры полу-
суспензии 0.74 г (2 ммоль) соли 10 в 20 мл этано-
чены на приборе Shimadzu GCMS-QP 2010S путем
ла или изопропанола прибавляли 3.5 мл 37%-ного
прямого ввода вещества в ионный источник (энер-
HCHO. Реакционную массу нагревали до кипения
гия ионизирующего излучения - 70 эВ). Элемент-
(происходила гомогенизация) и фильтровали через
ный анализ выполнен на C,H,N-анализаторе Carlo
бумажный фильтр. Образовавшийся осадок через
Erba 1106, погрешность измерения ±0.4%. Кон-
24 ч отделяли, промывали холодным этанолом и
троль чистоты полученных соединений осущест-
сушили 3 ч при 60°С. Выход 53% (из EtOH), 56%
вляли методом ТСХ на пластинах Silufol UV254,
(из i-PrOH), мелкокристаллический порошок бе-
элюент - ацетон-гексан 1:1, проявитель - пары
жевого цвета, т. пл. 260-263°С (т. пл. 302-307°С
йода, УФ детектор. Температуры плавления опре-
[10], 195-197°С [11]). ИК спектр, ν, см-1: 2173 ср,
делены на столике Кофлера.
2200 ср (C≡N), 3285 ш (NH, NH2). Спектр ЯМР
Для синтезов использовали коммерчески до-
1Н (ДМСО-d6), δ, м. д.: 7.40 м (2Н, С2Н, С6H, Ph),
ступные реагенты, димер малононитрила 1 полу-
7.49 м (3Н, С3Н, С4Н, С5H, Ph). Сигналы водоро-
чен димеризацией малононитрила в присутствии
дов NH, NH2 не проявляются в следствие дейте-
KОН по известному методу [50].
рообмена, что отмечалось ранее в работах [10, 11].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1208
КУРСКОВА и др.
Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.: 48.1
Ph), 129.8 (C4H, Ph), 135.2* (C1, Ph), 156.1* (C6),
[C(C≡N)2], 81.3, 85.3 (C3, C5), 116.3 (4C≡N), 128.4*
160.1* (C4), 162.0* (C2). Масс-спектр, m/z (Iотн, %):
(С2H, C3H, C5H, C6H, Ph), 129.6* (C4H, Ph), 135.6
353 (60) [M - 2]+, 400 (5) [M - 1+ 46]+. Найдено, %:
(C1, Ph), 156.5 (C6), 159.7 (C4), 162.1 (C2). Масс-
С 67.30; H 4.74; N 27.49. C20H17N7. Вычислено, %:
спектр, m/z (Iотн, %): 353 (50) [M + 23 + 46]+. Най-
C 67.59; H 4.82; N 27.59. M 355.4.
дено, %: С 67.48; H 2.75; N 29.32. C16H8N6. Вычис-
(6-{[(Метил(пропил)аммонио)метил]ами-
лено, %: C 67.60; H 2.84; N 29.56. M 284.3.
но}-4-фенил-3,5-дицианопиридин-2-ил)дициа-
Общая методика получения соединений 12-
нометанид (13a). Выход 29%, светло-коричневый
14. Смесь 0.74 г (2 ммоль) соли 10, 2 ммоль соот-
мелкокристаллический порошок, т. пл. 215-217°С.
ветствующего первичного амина, 3.5 мл 37%-ного
ИК спектр, ν, см-1: 2160 с, 2180 с (C≡N), 3101 ш,
НСНО в 20 мл этанола (или изопропанола для со-
3310 ш (NH, N+H). Спектр ЯМР 1Н (ДМСО-d6), δ,
единения 14) доводили до кипения и гомогениза-
м. д.: 0.90 т (3Н, Ме, Pr, 3JHH 7.4 Гц), 1.70 м (2Н,
ции, затем фильтровали через бумажный фильтр.
СН2Ме, Pr), 2.75 д (3Н, Ме, 3JHH 4.6 Гц), 2.98 м
Образовавшийся осадок через 24 ч отделяли,
(2Н, СН2 Pr), 4.52 м, 4.78 м (2H, NCH2N), 7.41 м
промывали холодным этанолом и сушили 3 ч при
(2Н, С2Н, С6H, Ph), 7.52 м (3Н, С3Н, С4Н, С5H,
60°С.
Ph), 8.41 т (1H, NH, 3JHH 6.1 Гц), 8.78 уш. с (1Н,
N+H, частично в дейтерообмене). Спектр ЯМР 13С
(6-{[(Метиламмонио)метил]амино}-4-фенил-
DEPTQ (ДМСО-d6), δС, м. д.: 11.2* (Ме, Pr), 17.3
3,5-дицианопиридин-2-ил)дицианометанид
(СН2Ме, Pr), 38.4* (Ме), 46.9 [С(C≡N)2], 55.2 (СН2,
(12a). Выход 35%, светло-желтый мелкокристал-
Pr), 62.7 (NCH2N), 82.0, 87.5 (C3, C5), 116.2, 116.5,
лический порошок, т. пл. 242-244°С. ИК спектр, ν,
119.6, 121.8 (4C≡N), 128.8* (С2H, C3H, C5H, C6H,
см-1: 2183 ср, 2190 ср, 2225 ср (С≡N), 3103 ш, 3290
ш (NH, N+H2). Спектр ЯМР 1Н (ДМСО-d6), δ, м. д.:
Ph), 130.3* (C4H, Ph), 135.6 (C1, Ph), 156.6 (C6),
160.6 (C4), 162.3 (C2). Масс-спектр, m/z (Iотн, %):
2.79 д (3Н, Ме, 3JHH 4.7 Гц), 4.59 м, 4.69 м (2H,
392 (45) [M + 23]+. Найдено, %: С 68.01; H 5.10; N
NCH2N), 7.42 м (2Н, С2Н, С6H, Ph), 7.52 м (3Н,
26.40. C21H19N7. Вычислено, %: C 68.28; H 5.18; N
С3Н, С4Н, С5H, Ph), 8.47 т (1H, NH, 3JHH 5.7 Гц),
26.54. M 369.4.
8.91 уш. с, 9.18 уш. с (2Н, N+H2, частично в дей-
терообмене). Спектр ЯМР 13С DEPTQ (ДМСО-d6),
(6-{[(Метил(4-метилфенил)аммонио)метил]-
δС, м. д.: 40.6* (Ме), 45.7 [С(C≡N)2], 63.2 (NCH2N),
амино}-4-фенил-3,5-дицианопиридин-2-ил)ди-
81.7, 87.0 (C3, C5), 115.8, 116.0, 119.0, 121.4 (4C≡N),
цианометанид (13б). Выход 41%, темно-желтый
128.4* (С2H, C3H, C5H, C6H, Ph), 129.9* (C4H, Ph),
мелкокристаллический порошок, т. пл. 271-273°С.
135.2 (C1, Ph), 156.2 (C6), 160.1 (C4), 161.8 (C2).
ИК спектр, ν, см-1: 2112 ш, 2173 ср (C≡N), 3143
Масс-спектр, m/z (Iотн, %): 374 (100) [M + 46 + 1]+.
ш, 3175 ш, 3200 ш (NH, N+H). Спектр ЯМР 1Н
Найдено, %: С 65.90; H 3.89; N 29.69. C18H13N7.
(ДМСО-d6), δ, м. д.: 2.18-2.35 м (6Н, Ме), 4.67
Вычислено, %: C 66.04; H 4.00; N 29.95. M 327.3.
уш. с, 5.21 уш. с (2Н, NCH2N), 7.05-7.51 м (9Н,
2Ar), 8.37 уш. с (1H, NH), 8.83 м (1Н, N+H). Спектр
(6-{[(Изопропиламмонио)метил]амино}-
ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.: 15.2*, 20.5*
4-фенил-3,5-дицианопиридин-2-ил)дицианоме-
танид (12б). Выход 50%, желтый мелкокристал-
(2Ме), 49.7 [С(C≡N)2], 63.3 (NCH2N), 70.3, 70.9
(C3, C5), 115.4, 116.8, 121.5, 121.8 (4C≡N), 128.4
лический порошок, т. пл. 191-193°С. ИК спектр,
(С2H, C3H, C5H, C6H, Ph), 129.8 (C4H, Ph), 128.6,
ν, см-1: 2157 ср, 2170 ср, 2225 ср, 2237 ср (С≡N),
130.1 (2×2СН, p-Tol), 135.7* (C1, Ph), 138.3 (C4,
3242 ш, 3297 ш (NH, N+H2).Спектр ЯМР 1Н (ДМ-
p-Tol), 149.1 (C1, p-Tol), 156.3* (C6), 160.1* (C4),
СО-d6), δ, м. д.: 1.25 д (6Н, 2Ме, i-Pr, 3JHH 6.4 Гц),
3.53 м (1Н, СН i-Pr), 4.59 м (2H, NCH2N), 7.41 м
161.9* (C2). Найдено, %: С 71.63; H 4.41; N 23.35.
C25H19N7. Вычислено, %: C 71.93; H 4.59; N 23.49.
(2Н, С2Н, С6H, Ph), 7.51 м (3Н, С3Н, С4Н, С5H, Ph),
M 417.5.
8.13 т (1H, NH, 3JHH 5.8 Гц), 8.38 уш. с (2Н, N+H2).
Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС, м. д.: 18.9
6-[(Гидроксиметил)амино]-4-фенил-2-(ди-
(2Ме, i-Pr), 45.6* [С(C≡N)2], 48.3 (СН, i-Pr), 52.1*
цианометилен)-1,2-дигидропиридин-3,5-дикар-
(NCH2N), 81.4*, 86.7* (C3, C5), 115.8*, 116.1*,
бонитрил (14). Выход 40% (при использовании
119.2*, 121.2* (4C≡N), 128.4 (С2H, C3H, C5H, C6H,
PrNH2), 44% (при использовании i-PrNH2), мелко-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ МОРФОЛИНИЕВОЙ СОЛИ
1209
кристаллический порошок бежевого цвета, т. пл.
Доценко Виктор Викторович, ORCID: http://
˃300°С (разл.). ИК спектр, ν, см-1: 2170 ср, 2195
orcid.org/0000-0001-7163-0497
ср (C≡N), 3288 ш, 3315 ш (2NH, OH). Спектр ЯМР
Фролов Константин Александрович, ORCID:
1Н (ДМСО-d6), δ, м. д.: 4.84 м (2H, NCH2O), 5.12
т (1Н, ОН, 3JHH 6.9 Гц), 7.39 м (2Н, С2Н, С6H, Ph),
Аксенов Николай Александрович, ORCID:
7.49 м (3Н, С3Н, С4Н, С5H, Ph), 7.62 т (1H, NH, 3JHH
5.9 Гц). Спектр ЯМР 13С DEPTQ (ДМСО-d6), δС,
Аксенова Инна Валерьевна, ORCID: http://
м. д.: 64.6 (NCH2O), 81.1, 85.3 (C3, C5), 116.3, 116.6
orcid.org/0000-0002-8083-1407
(4C≡N), 128.5* (С2H, C3H, C5H, C6H, Ph), 129.5*
(C4H, Ph), 135.7 (C1, Ph), 156.6 (C6), 159.7 (C4),
Кривоколыско Богдан Сергеевич, ORCID: http://
162.2 (C2). Сигнал углерода С(C≡N)2 в спектре не
orcid.org/0000-0002-3181-7609
проявляется. Масс-спектр, m/z (Iотн, %): 360 (70)
Кривоколыско Сергей Геннадиевич, ORCID:
[M + 46]+. Найдено, %: С 64.71; H 3.10; N 26.52.
C17H10N6O. Вычислено, %: C 64.96; H 3.21; N
ФОНДОВАЯ ПОДДЕРЖКА
26.74. M 314.3.
Рентгеноструктурный анализ. Эксперимен-
Исследование выполнено при финансовой
тальный материал для кристалла 13a (C21H19N7)
поддержке Кубанского научного фонда в рам-
получен на автоматическом четырехкружном диф-
ках научного проекта МФИ-20.1-26/20 (заявка №
рактометре Agilent Super Nova, Dual, Cu at zero,
МФИ-20.1/45), а также Министерства образования
Atlas S2 при 293(2) K. Структура расшифрована
и науки Российской Федерации (тема 0795-2020-
прямым методом в комплексе программ Olex2
0031) с использованием приборного парка Эколо-
[51] и ShelXD [52], и уточнена с помощью пакета
го-аналитического центра и Научно-образователь-
SHELXL [53]. Структура уточнена полноматрич-
ного центра «Диагностика структуры и свойств
ным МНК в анизотропном приближении для нево-
наноматериалов» Кубанского государственного
дородных атомов по F2. Основные характеристики
университета.
эксперимента и параметры элементарной ячейки
13a: размер 0.401 × 0.115 × 0.073 мм, кристалли-
КОНФЛИКТ ИНТЕРЕСОВ
ческая система ромбическая, пространственная
Авторы заявляют об отсутствии конфликта
группа Pbca, M 369.43; параметры элементарной
интересов.
ячейки: а 19.9261(3), b 7.96740(10), с 23.9885(4) Å,
V 3808.40(10) Å3, Z 8, dвыч 1.289 г/см3; μ(CuKα 0.654
СПИСОК ЛИТЕРАТУРЫ
мм-1, F(000) 1552.0, область углов съемки θ 7.37-
1. Доценко В.В., Кривоколыско С.Г., Семенова А.М. //
152.746°, интервалы индексов отражений: -25 ≤
ХГС. 2018. Т. 54. № 11. С. 989; Dotsenko V.V.,
h ≤ 25, -6 ≤ k ≤ 9, -29 ≤ l ≤ 30, число измеренных
Krivokolysko S.G., Semenova A.M. // Chem. Heterocycl.
отражений 20423, число независимых отражений
Compd. 2018. Vol. 54. N 11. P. 989. doi 10.1007/
3965 [Rint 0.0178, Rsigma 0.0123], число отражений
s10593-018-2383-y
с I > 2σ(I) 3965, число уточняемых параметров
2. Shaabani A., Hooshmand S.E. // Mol. Divers. 2018.
294, R-фактор [I ≥ 2σ(I)]: R1 0.0595, wR2 0.1888;
Vol. 22. P. 207. doi 10.1007/s11030-017-9807-y
R-фактор по всем отражениям: R1 0.0645, wR2
3. Ершов О.В., Бардасов И.Н. // ХГС. 2017. Т. 53.
0.1961; GOOF по F2 1.042, Δρmax и Δρmin 0.54 и
№ 11. С. 1178; Ershov O.V., Bardasov I.N. // Chem.
-0.38 е/Å3. Результаты РСА соединения 13a депо-
Heterocycl. Compd. 2017. Vol. 53. N 11. P. 1178. doi
10.1007/s10593-018-2190-5
нированы в Кембриджский банк структурных дан-
4. Bardasov I.N., Alekseeva A.U., Chunikhin S.S., Tafeen-
ных (CCDC 2076093).
ko V.A., Ershov O.V. // Tetrahedron Lett. 2017. Vol. 58.
ИНФОРМАЦИЯ ОБ АВТОРАХ
N 41. P. 3919. doi 10.1016/j.tetlet.2017.08.076
5. Carrión F., Mont N., Batllori X., Borrell J.I., Teixidó J. //
Tetrahedron. 2007. Vol. 63. N 1. P. 215. doi 10.1016/j.
org/0000-0001-9014-3248
tet.2006.10.025
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1210
КУРСКОВА и др.
6.
Carrión F., Pettersson S.H., Rifá J., Farran J., Batllori X.,
ga A.N., Litvinov V.P. // Russ. Chem. Bull. 2003. Vol. 52.
Borrell J.I., Teixidó J. // Mol. Divers. 2010. Vol. 14.
N 4. P. 969. doi 10.1023/A:1024420930528
N 4. P. 755. doi 10.1007/s11030-009-9222-0
19.
Tverdokhleb N.M., Khoroshilov G.E., Dotsenko V.V. //
7.
Tu M.S., Li Y., Wang X., Jiang B., Wang S.L., Tu S.J. //
Tetrahedron Lett. 2014. Vol. 55. P. 6593. doi 10.1016/j.
RSC Adv. 2013. Vol. 3. N 12. P. 3877. doi 10.1039/
tetlet.2014.10.046
c3ra22328
20.
Доценко В.В., Чигорина Е.А., Кривоколыско С.Г. //
8.
Bardasov I.N., Alekseeva A.U., Ershov O.V., Beli-
ХГС. 2017. Т. 53. № 5. С. 626; Dotsenko V.V.,
kov M.Y. // Tetrahedron Lett. 2015. Vol. 56. N 40.
Chigorina E.A., Krivokolysko S.G. // Chem. Heterocycl.
P. 5434. doi 10.1016/j.tetlet.2015.08.013
Compd. 2017. Vol. 53. N. 5. P. 626. doi 10.1007/s10593-
9.
Mohareb R.M., Abouzied A.S., Abbas N.S. // Anti-Cancer
017-2103-z
Agents Med. Chem. 2017. Vol. 17. N 14. P. 1951. doi
21.
Доценко В.В., Беспалов А.В., Русских А.А., Киндоп В.К.,
10.2174/1871520617666170725153523
Аксенов Н.А., Аксенова И.В., Щербаков С.В., Овча-
10.
Fuentes L., Vaquero J.J., Soto J.L. // Synthesis. 1982.
ров С.Н. // ЖОХ. 2021. Т. 91. № 6. С. 823; Dotsen-
N 4. P. 320. doi 10.1055/s-1982-29798
ko V.V., Bespalov A.V., Russkikh A.A., Kindop V.K., Ak-
11.
Helmy N.M., El-Baih F.E.M., Al-Alshaikh M.A.,
senov N.A., Aksenova I.V., Shcherbakov S.V., Ovcha-
Moustafa M.S. // Molecules. 2011. Vol. 16. N 1. P. 298.
rov S.N. // Russ. J. Gen. Chem. 2021. Vol. 91. N 6.
doi 10.3390/molecules16010298.
Р. 951. doi 10.1134/S1070363221060013
12.
Fuentes L., Márquez C., Contreras M.C., Loren-
22.
Clarke H.T., Gillespie H.B., Weisshaus S.Z. // J. Am.
zo M.J., Fonseca I., Sanz-Aparicio J., Balcazar J.L. //
Chem. Soc. 1933. Vol. 55. N 11. P. 4571. doi 10.1021/
J. Heterocycl. Chem. 1995. Vol. 32. N 1. P. 29. doi
ja01338a041
10.1002/jhet.5570320105
23.
Pine S. H. // J. Chem. Educ. 1968. Vol. 45. N 2. P. 118.
13.
Хрусталева А.Н., Фролов К.А., Доценко В.В., Дми-
doi 10.1021/ed045p118
триенко А.О., Бушмаринов И.С., Кривоколыско С.Г. //
24.
Grigor’ev A.A., Shtyrlin N.V., Gabbasova R.R.,
ХГС. 2014. Т. 50. № 1. С. 52; Khrustaleva A.N.,
Zeldi M.I., Grishaev D.Yu., Gnezdilov O.I.,
Frolov K.A., Dotsenko V.V., Dmitrienko A.O.,
Balakin K.V., Nasakin O.E., Shtyrlin Y.G. //
Bushmarinov I.S., Krivokolysko S.G. // Chem.
Synth. Commun. 2018. Vol. 48. N 17. P. 2288. doi
Heterocycl. Compd. 2014. Vol. 50. N 1. P. 46.
10.1080/00397911.2018.1501487
doi10.1007/s10593-014-1447-x
25.
Kanani M.B., Patel M.P. // Med. Chem. Res. 2013. Vol.
14.
Доценко В.В., Кривоколыско С.Г., Литвинов В.П. //
22. P. 2912. doi 10.1007/s00044-012-0292-7
ХГС. 2007. № 4. C. 621; Dotsenko V.V., Krivokolys-
26.
Makawana J.A., Patel M.P., Patel R.G. // Med. Chem.
ko S.G., Litvinov V.P. // Chem. Heterocycl. Compd.
Res. 2012. Vol. 21. P. 616. doi 10.1007/s00044-011-
2007. Vol. 43. N 4. P. 517. doi 10.1007/s10593-007-
9568-6
0080-3
27.
May B.C., Zorn J.A., Witkop J., Sherrill J., Wallace A.C.,
15.
Хрусталева А.Н., Фролов К.А., Доценко В.В.,
Legname G., Prusiner S.B., Cohen F.E. // J. Med. Chem.
Кривоколыско С.Г. // ЖОрХ. 2014. Т.50. № 12.
2007. Vol. 50. N 1. P. 65. doi 10.1021/jm061045z
С. 1823; Khrustaleva A.N., Frolov K.A., Dotsenkо V.V.,
28.
Perrier V., Wallace A.C., Kaneko K., Safar J., Prusi-
Krivokolysko S.G. // Russ. J. Org. Chem. 2014. Vol. 50.
ner S.B., Cohen F.E. // Proc. Natl. Acad. Sci. 2000.
N 12. P. 1804. doi 10.1134/S107042801412015X
Vol. 97. P. 6073. doi 10.1073/pnas.97.11.6073
16.
Доценко В.В., Суйков С.Ю., Пехтерева Т.М.,
29.
Reddy T.R.K., Mutter R., Heal W., Guo K., Gillet V.J.,
Кривоколыско С.Г. // ХГС. 2013. Т. 49. № 7.
Pratt S., Chen B. // J. Med. Chem. 2006. Vol. 49. P. 607.
С. 1082; Dotsenko V.V., Suikov S.Y., Pekhtereva T.M.,
doi 10.1021/jm050610f
Krivokolysko S.G. // Chem. Heterocycl. Compd. 2013.
30.
Abbas H.A.S., El Sayed W.A., Fathy N.M. // Eur.
Vol. 49. N 7. P. 1009. doi10.1007/s10593-013-1339-5
J. Med. Chem. 2010. Vol. 45. P. 973. doi 10.1016/j.
17.
Доценко В.В., Фролов К.А., Чигорина Е.А., Хруста-
ejmech.2009.11.039
лева А.Н., Бибик Е.Ю., Кривоколыско С.Г. // Изв.
31.
Ali M., Khan K.M., Mahdavi M., Jabbar A., Shamim S.,
АН. Сер. хим. 2019. Т. 68. № 4. С. 691; Dotsenko V.V.,
Salar U., Taha M., Perveen S., Larijani B., Faramar-
Frolov K.A., Chigorina E.A., Khrustaleva A.N.,
zi M.A. // Bioorg. Chem. 2020. Vol. 100. Paper N
Bibik E.Yu., Krivokolysko S.G. // Russ. Chem. Bull.
103879. doi 10.1016/j.bioorg.2020.103879
2019. Vol. 68. N 4. P. 691. doi 10.1007/s11172-019-
32.
Brandt W., Mologni L., Preu L., Lemcke T., Gambacorti-
2476-5
Passerini C., Kunick C. // Eur. J. Med. Chem. 2010.
18.
Доценко В.В., Кривоколыско С.Г., Чернега А.Н.,
Vol. 45. P. 2919. doi 10.1016/j.ejmech.2010.03.017
Литвинов В.П. // Изв. АН. Сер. xим. 2003. № 4.
33.
Auchampach J.A., Kreckler L.M., Wan T.C., Maas J.E.,
С. 918; Dotsenko V.V., Krivokolysko S.G., Cherne-
van der Hoeven D., Gizewski E., Narayanan J.,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
СИНТЕЗ И АМИНОМЕТИЛИРОВАНИЕ МОРФОЛИНИЕВОЙ СОЛИ
1211
Maas G.E. // J., Pharmacol. Exp. Ther. 2009. Vol. 329.
Butler J. // Eur. J. Heart. Fail. 2019. Vol. 21. N 11.
P. 2. doi 10.1124/jpet.108.148270
P. 1426. doi 10.1002/ejhf.1591
34.
Beukers M.W., Chang L.C.W., von Frijtag Drabbe
42.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
Kunzel J.K., Mulder-Krieger T., Spanjersberg R.F.,
Adv. Drug. Delivery Rev. 1997. Vol. 23. N 1-3. P. 4. doi
Brussee J., IJzerman A.P. // J. Med. Chem. 2004.
10.1016/S0169-409X(96)00423-1
Vol. 47. P. 3707. doi 10.1021/jm049947s
43.
Lipinski C.A. // Drug Discov. Today: Technologies. 2004.
35.
Chang L.C.W., von Frijtag Drabbe Kunzel J.K., Mulder-
Vol. 1. N 4. P. 337. doi 10.1016/j.ddtec.2004.11.007
Krieger T., Spanjersberg R.F., Roerink S.F., van den
44.
Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. //
Hout G., Beukers M.W., Brussee J., IJzerman A.P. //
Adv. Drug. Delivery Rev. 2012. Vol. 64. Suppl. P. 4. doi
J. Med. Chem. 2005. Vol. 48. P. 2045. doi 10.1021/
10.1016/j.addr.2012.09.019
jm049597+
45.
Sander T. OSIRIS Property Explorer. Idorsia,
36.
Betti M., Catarzi D., Varano F., Falsini M., Varani K.,
Vincenzi F., Dal Ben D., Lambertucci C., Colotta V. //
chemistry.org/prog/peo/
Eur. J. Med. Chem. 2018. Vol. 150. P. 127. doi
46.
Cheng F., Li W., Zhou Y., Shen J., Wu Z., Liu G.,
10.1016/j.ejmech.2018.02.081
Lee P.W., Tang Y. // J. Chem. Inf. Model. 2012. Vol. 52.
37.
Louvel J., Guo D., Soethoudt M., Mocking T.A.M.,
N 11. P. 3099. doi 10.1021/ci300367a
Lenselink E.B., Mulder-Krieger T., Heitman L.H.,
47.
Yang J., Kwon S., Bae S.H., Park K.M., Yoon C.,
IJzerman A.P. // Eur. J. Med. Chem. 2015. Vol. 101.
Lee J.H., Seok C. // J. Chem. Inf. Model. 2020. Vol. 60.
P. 681. doi 10.1016/j.ejmech.2015.07.023
N 6. P. 3246. doi 10.1021/acs.jcim.0c00104
38.
Baltos J.A., Vecchio E.A., Harris M.A., Qin C.X.,
48.
GalaxyWEB. A web server for protein structure
Ritchie R.H., Christopoulos A., White P.J., May L.T.
prediction, refinement, and related methods.
// Biochem., Pharmacol. 2017. Vol. 135. P. 79. doi
Computational Biology Lab, Department of Chemistry,
10.1016/j.bcp.2017.03.014
39.
Bott-Flügel L., Bernshausen A., Schneider H., Luppa P.,
seoklab.org/index.html
Zimmermann K., Albrecht-Küpper B., Kast R.,
49.
Ko J., Park H., Heo L., Seok C. // Nucleic Acids Res.
Laugwitz K.-L., Ehmke H., Knorr A., Seyfarth M. // PloS
2012. Vol. 40. N W1. P. W294. doi 10.1093/nar/gks493
One. 2011. Vol. 6. N 3. Paper N e18048. doi 10.1371/
50.
Mittelbach M. // Monatsh. Chem. 1985. Vol. 116. N 5.
journal.pone.0018048
P. 689. doi 10.1007/bf00798796
40.
Meibom D., Albrecht-Küpper B., Diedrichs N.,
51.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
Hübsch W., Kast R., Krämer T., Krenz U., Lerchen H.-G.,
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
Mittendorf J., Nell P.G., Süssmeier F., Vakalopoulos A.,
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Zimmermann K. // ChemMedChem. 2017. Vol. 12.
52.
Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
N 10. P. 728. doi 10.1002/cmdc.201700151
P. 112. doi 10.1107/S0108767307043930
41.
Voors A.A., Bax J.J., Hernandez A.F., Wirtz A.B.,
53.
Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
Pap A.F., Ferreira A.C., Senni M., van der Laan M.,
P. 3. doi 10.1107/S2053229614024218
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1212
КУРСКОВА и др.
Synthesis and Aminomethylation
of 6-Amino-2-(dicyanomethylene)-4-phenyl-
1,2-dihydropyridine-3,5-dicarbonitrile Morpholinium Salt
A. O. Kurskovaa, V. V. Dotsenkob,c, K. A. Frolova, N. A. Aksenovc, I. V. Aksenovac,
B. S. Krivokolyskod, and S. G. Krivokolyskoa,d,*
a Laboratory “ChemEx”, V. Dal Lugansk State University, Lugansk, 91034 Ukraine
b Kuban State University, Krasnodar, 350040 Russia
c North Caucasus Federal University, Stavropol, 355009 Russia
d St. Luke Lugansk State Medical University, Lugansk, 91045 Ukraine
*e-mail: ksg-group-lugansk@mail.ru
Received May 17, 2021; revised May 17, 2021; accepted June 3, 2021
Condensation of benzaldehyde with malononitrile and malononitrile dimer (2-aminopropene-1,1,3-tricarbo-
nitrile) in the presence of an excess of morpholine in ethanol afforded the morpholinium salt of 6-amino-2-(di-
cyanomethylene)-4-phenyl-1,2-dihydropyridine-3,5-dicarbonitrile. The latter, under the Mannich reaction
conditions with the participation of primary amines and formaldehyde, gives 6-amino-2-(dicyanomethy-
lene)-4-phenyl-1,2-dihydropyridine-3,5-dicarbonitrile, 2-(dicyanomethylene)-6-(hydroxymethylamino)-4-
phenyl-1,2-dihydropyridine-3,5-dicarbonitrile or zwitterionic aminomethylation products, 6-(ammoniomethyl-
amino)-3,5-dicyano-4-phenylpyridin-2-yl)dicyanomethanides. Structure of the obtained compounds was estab-
lished using 2D NMR spectroscopy and single crystal X-ray diffraction analysis. In silico predictive analysis
of the biological activity of new compounds was carried out.
Keywords: malononitrile dimer, 2-(dicyanomethylene)-1,2-dihydropyridines, aminomethylation, Mannich
reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021