ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 8, с. 1231-1244
УДК 547.341
ВНУТРИМОЛЕКУЛЯРНАЯ ЦИКЛИЗАЦИЯ
МЕРКАПТОМЕТИЛЬНЫХ ПРОИЗВОДНЫХ ЭФИРОВ
3-(ФУРИЛ)-3-(ДИЭТОКСИФОСФОРИЛ)АКРИЛОВЫХ
КИСЛОТ
© 2021 г. Л. М. Певзнер*
Санкт-Петербургский государственный технологический институт (технический университет),
Московский пр. 26, Санкт-Петербург, 190013 Россия
*e-mail: pevzner_lm@list.ru
Поступило в Редакцию 28 июня 2021 г.
После доработки 28 июня 2021 г.
Принято к печати 10 июля 2021 г.
Эфиры Е-3-(фурил)-3-(диэтоксифосфорил)акриловых кислот, содержащие меркаптометильную груп-
пу в положении фуранового кольца, соседствующем с алкеновым фрагментом, легко генерируются в
водно-этанольной среде действием эквивалента гидроокиси калия на соответствующую тиурониевую
соль. Они очень легко присоединяются по двойной связи алкенового фрагмента с образованием диги-
дротиопирано[3,4-b]фуранов, дигидротиопирано[4,3-b]фуранов или дигидротиопирано[3,4-с]фуранов в
зависимости от относительного расположения заместителей в фурановом кольце. Циклизация стерически
загруженного эфира 3-(3-метил-4-меркаптометил-5-трет-бутилфуран-4-ил)-3-(диэтоксифосфорил)-
акриловой кислоты приводит формированию аннелированной системы дигидротиено[3,4-с]фурана.
Ключевые слова: фурилакрилаты, тиурониевые соли, меркаптометилфураны, внутримолекулярное
нуклеофильное присоединение, дигидротиопиранофураны, дигидротиенофураны
DOI: 10.31857/S0044460X21080114
Интерес к предельным гетероциклам, аннели-
при их использовании практически невозможна.
рованным с фурановым кольцом, был проявлен
В дальнейшем для построения указанной гетеро-
сравнительно давно при попытках синтезировать
циклической системы была использована внутри-
нуклеотиды, у которых один из остатков фосфор-
молекулярная конденсация Кляйзена с участием
ной кислоты в дифосфате дезоксирибозы был
этоксикарбонилметилтиоксометильного фрагмен-
заменен на тиопирановый цикл [1]. Для построе-
та, введенного в соседствующее со сложноэфир-
ния аннелированной гетероциклической системы
ной группой положение фуранового кольца [4].
использовали циклизацию разветвленно-цепного
Однако оказалось, что реакция очень чувствитель-
тиосахара, который сам по себе труднодоступен.
на к наличию других СН-кислотных центров в мо-
В дальнейшем были использованы более удоб-
лекуле. В результате доступным оказался сравни-
ные подходы к получению 7Н-тиопирано[3,4-b]-
тельно небольшой ряд гидротиопиранофуранов,
фуранов, включающие ацилоиновую конденсацию
имеющих сложноэфирную и гидрокси- или алкок-
сигруппу в тиопирановом кольце.
3-гидрокситетрагидропиран-4-она с
1,3-дикето-
нами [2] и реакцию Принса между 6-меркапто-
Вместе с тем, постоянный интерес к указанным
гексен-1-олом и ароматическими альдегидами
аннелированным гетероциклам показывает, что от
[3]. Однако эти методы также достаточно трудо-
подобных структур можно ожидать проявления
емки, и функционализация тиопиранового цикла
высокой биологической активности. Следователь-
1231
1232
ПЕВЗНЕР
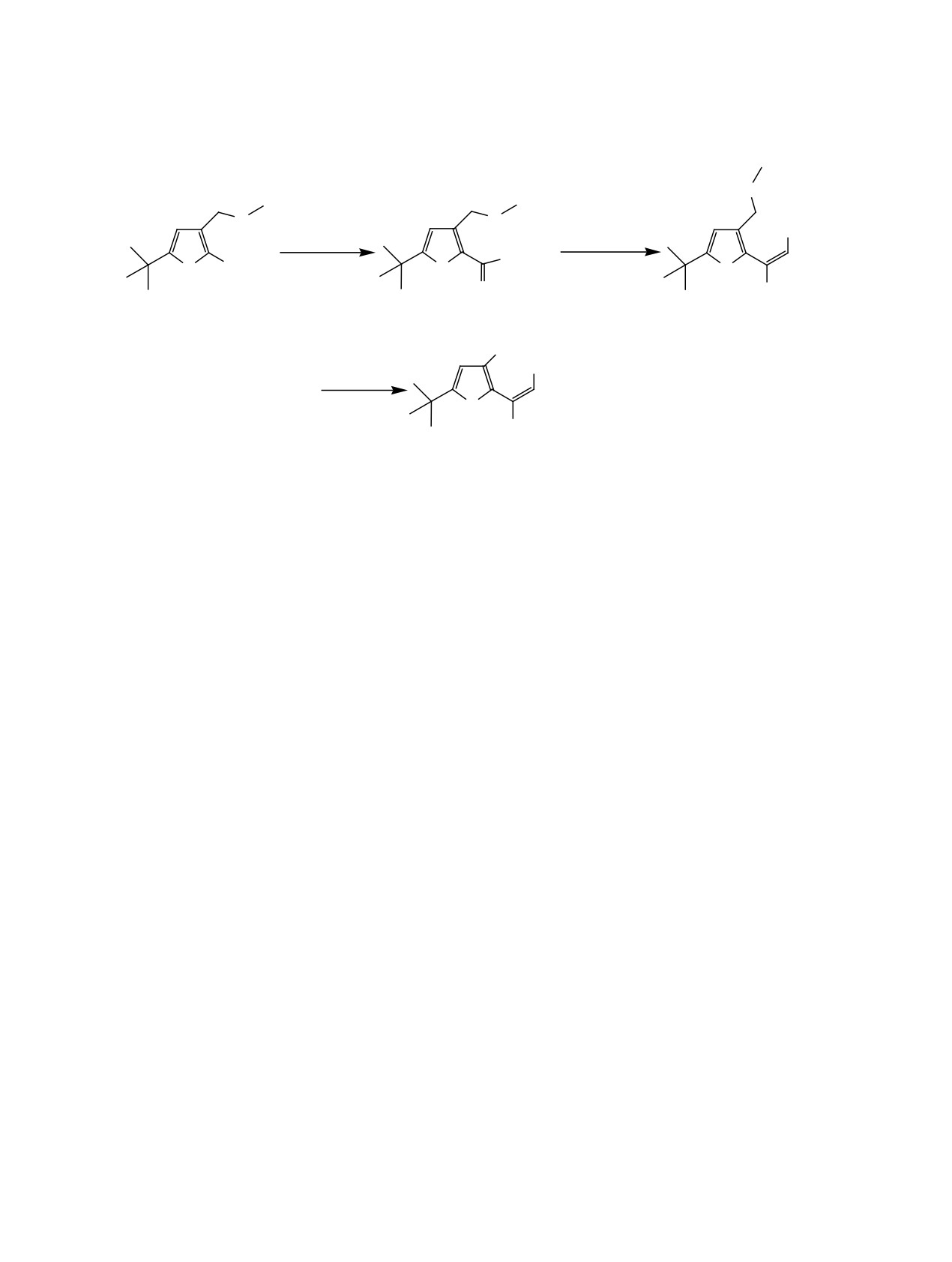
Схема 1.
S
S
S
O
O
O
1
2
3
Схема 2.
(Et)2OP
(Et)2OP
(Et)2OP
CO2Et(NH2)2C=S
CO2Et
CO2Et
X KOH
R
CH2X
R
R
CH2SH
O
O
O
NH2
S
4а-в
NH2
(Et)2OP
CO2Et
S
R
O
5а-в
R = H, X = Cl
(4а);
R = t-Bu, X = Br
(4б);
R = X = Br
(4в);
R = H
(5а),
t-Bu
(5б),
Br
(5в).
но, разработка новых методов их построения явля-
(1), [4,3-b] (2) и [3,4-с] (3), в которых атом серы
ется актуальной задачей.
непосредственно не связан с фурановым кольцом
(схема 1).
Ранее нами было изучено присоединение бутан-
тиола к эфирам 3-(фурил)-3-(диэтоксифосфорил)-
В качестве исходных соединений для получе-
акриловой кислоты [Певзнер Л.М., ЖОХ, 2017,
ния веществ с типом аннелирования 1 были выбра-
т. 87, вып. 6]. Оказалось, что эта реакция протека-
ны синтезированные ранее фосфорилированные
ет очень легко в присутствии следовых количеств
галогенметильные производные фурилакрилатов
гидроксида калия при комнатной температуре.
4а-в [6, 7]. Получение тиурониевых солей прово-
Хотя процесс не отличался региоселективностью,
дили кипячением этанольных растворов этих сое-
мы решили попытаться использовать внутри-
динений с 10%-ным мольным избытком тиомоче-
молекулярный вариант этой реакции, генерируя
вины. В случае хлорида 4а реакция завершалась в
мепкаптометильную группу путем разложения
течение 9 ч, тогда как бромиды 4б, в реагировали
соответствующей тиурониевой соли эквивален-
в течение 4 ч. После этого раствор тиурониевой
том гидроокиси калия в водно-этанольной среде.
соли обрабатывали 1 эквивалентом 20%-ного во-
Можно было ожидать преимущественного образо-
дного раствора гидроксида калия и полученную
вания аннелированных систем, содержащих диги-
смесь кипятили в течение 4 ч (схема 2).
дротиопирановый и фурановый циклы поскольку
В спектрах ЯМР 31Р продуктов реакции сиг-
предельные пятичленные циклы аннелируются к
нал ядра фосфора наблюдается в интервале 23.5-
фурановому кольцу достаточно трудно [5].
24.3 м. д., характерном для предельных фосфона-
Существует три варианта сочленения диги-
тов. В спектрах ЯМР 1Н около 3.5-3.7 м. д. присут-
дротиопиранового и фуранового циклов: [3,4-b]
ствует сигнал протонов АВ-системы, расщеплен-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ
1233
Схема 3.
O
O
O
CO2Et
P(OEt)3
Ph3P=CHCO2Et
PO(OEt)2
O COCl
O
O
O
PO(OEt)2
7
8
9
CH2Cl
CO2Et
Cl2CHOCH3
ZnCl2
O
PO(OEt)2
6в
ной дополнительно от фосфора, с константами
мере известных фурилакрилатов 6а, б [6, 7] и
JAB 16 Гц и JРН 4-5 Гц, которые были отнесены к
5-трет-бутильного производного 6в синтезиро-
фрагменту фуран-СН2S. Сигнал соответствующе-
ванного по следующей схеме из описанного ранее
го ядра углерода располагается при 21.9-22.3 м. д.
хлорангидрида 7 [Певзнер Л.М., ЖОХ, 2003, т. 73,
(4JРС 2.3-2.5 Гц). Сигнал протона Н4 тиопираново-
вып. 11].
го фрагмента регистрируется в спектрах соедине-
Его фосфорилирование триэтилфосфитом в
ний 5б, в в виде уширенного дублета при 3.69 м. д.
бензоле при 60-70°С в течение 4 ч привело к обра-
(JРН 20.0 и 23.6 Гц соответственно). В спектре со-
зованию ацилфосфоната 8. Последний был введен
единения 5а он сильно перекрывается с сигналом
в реакцию Виттига с этоксикарбонилметилентри-
соседнего протона Н5. Дублет соответствующего
фенилфосфораном, в результате которой был по-
ядра углерода С4 находится при 35.9-36.4 м. д.
лучен эфир Е-3-(фурил)-3-(диэтоксифосфорил)-
(1JРС 142.8-143.3 Гц). Сигнал углерода С5 обна-
акриловой кислоты 9 (схема 3). Эфир 9 обработкой
руживается при 40.7-40.9 м. д. (2JРС 2.1–2.3 Гц).
дихлорметилметиловым эфиром в хлороформе
Сигнал ядра углерода карбонильной группы имеет
при 40°С в присутствии следовых количеств хло-
сдвиг около 170 м. д., характерный для насыщен-
рида цинка был превращен в целевое хлорметиль-
ных карбоновых кислот. Он расщеплен от фосфо-
ное производное 6в. Подробное описание синтеза
ра с константой 3JРС 14-17 Гц.
и спектральные характеристики полученных сое-
Таким образом, полученные спектральные
динений приведены в Экспериментальной части.
данные однозначно доказывают, что в ходе ре-
Получение тиурониевой соли и ее разложение
акции происходит формирование насыщенного
(схема 4) проводили как описано выше. В спек-
шестичленного гетероцикла, содержащего суль-
трах ЯМР 31Р полученных соединений сигнал
фидный атом серы. Выходы соединений 5а-в со-
ядра фосфора наблюдается при 21.8-21.9 м. д., что
ставили 30, 86 и 14% соответственно. Отсюда сле-
характерно для предельных фосфонатов, связан-
дует, что присутствие атома брома в α-положении
ных через углеродный атом с α-положением фу-
фуранового кольца, видимо, вызывает проявление
ранового кольца. В спектре ЯМР 1Н соединений
побочных направлений, связанных с расщеплени-
10а, б наблюдается сигнал протонов, образующих
ем связи С-Br и разрушением фуранового кольца.
АВ-систему, расщепленную дополнительно от
Напротив, введение трет-бутильной группы ста-
ядра фосфора. При этом сигнал протона НА, распо-
билизирует систему.
ложенный в более сильном поле, имеет меньшую
Реакция внутримолекулярной циклизации с
константу спин-спинового взаимодействия с ядром
образованием фрагмента 2 была изучена на при-
фосфора, чем сигнал протона НВ. Кроме того, в
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1234
ПЕВЗНЕР
Схема 4.
NH2
CH2X
S
CH2SH
CO2Et(H
CO2Et
NH2
2N)2C=S
X KOH
PO(OEt)2
R
O
R
O
R
O
PO(OEt)2
PO(OEt)2
EtO2C
6а-в
S
CO2Et
R
O
PO(OEt)
2
10а, б
R = H, X = Cl (6a); R = X = Br
(6б);
R = t-Bu, X = Cl
(6в);
R = H (10a), t-Bu
(10б).
Схема 5.
O
O
O
BrH2C
O
O
O
O
NBS
MeONa
AIBN
O
O
O
12
13
14
O
O
O
O
O
O
OHSOCl
Cl
PO(OEt)2
KOH
2
P(OEt)
3
O
O
O
15
16
17
(EtO)2OP
(EtO)2OP
O
Cl
CO2EtCl2CHOCH3
CO2Et
Ph3P=CHCO2Et
O
O
18
11в
спектре соединения 10а сигнал протона НВ допол-
станты в спектре наблюдается уширение. Сигнал
нительно расщеплен от протона Н6 тиопиранового
соответствующего ядра углерода С4 располагается
кольца с JHH 1.6 Гц. В соединении 10б взаимодей-
при 22.8-22.9 м. д. (4JPC 2.3 Гц). Сигнал протона Н7
ствие более слабое, и вместо дополнительной кон-
проявляется при 3.83-3.89 м. д. (JРH 22.0-22.4 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ
1235
Схема 6.
NH2
(EtO)2OP
(EtO)2OP
H2N
YH2C
S
Y
+
CO2Et (H2N)2C=S
CO2Et
R
X
R
X
O
O
11а-г
CO2Et
S
(EtO)2OP
2
PO(OEt)
HSH2C
KOH
CO2Et
R
X
R
X
O
O
19а-г
R = X = H, Y = Cl (11a); R = X = Y = Br (11б); R = t-Bu, X = H, Y = Cl (11в); R = t-Bu, X = Y = Br (11г); R = X = H
(19a); R = X = Br (19б); R = t-Bu, X = H (19в); R = t-Bu, X = Br (19г).
а сигнал соответствующего ядра углерода - при
метилатом натрия в смеси метанола с бензолом
36.4-37.7 м. д. (1JPC 141.7-142.4 Гц). Сигнал ядра
было превращено в эфир 4-метоксиметил-5-трет-
углерода С6 наблюдается при 41.3-41.6 м. д. (2JPC
бутилфуран-3-карбоновой кислоты 14. Щелочным
2.1-2.3 Гц), а сигнал карбонильного ядра углерода
гидролизом последнего была получена кислота
около - 170 м. д. (3JPC 15.3-15.5 Гц).
15, из которой действием хлористого тионила был
получен хлорангидрид 16. Он был введен в реак-
Полученные данные свидетельствуют о том,
цию Арбузова с триэтилфосфитом в бензоле при
что и в данном случае происходит образование
60°С в мольном соотношении хлорангидрид:фос-
насыщенного гетероциклического фрагмента,
фит = 1:1.5. Фосфорилирование продолжалось 4
имеющего сульфидный атом серы. Качественно,
ч и завершалось образованием ацилфосфоната
влияние заместителей проявляется так же, как и
17, существующего в виде двух конформеров в
при циклизации, рассмотренной выше. Незаме-
соотношении 1:0.5 с химическими сдвигами сиг-
щенное соединение 6а дает продукт циклизации
налов фосфора -3.04 и -4.30 м. д. соответствен-
10а с выходом 28%, бромид 6б в условиях реакции
но. В основном конформере дублет карбонильного
полностью разлагается, а в случае 5-трет-бутиль-
ядра углерода наблюдается при 193.84 м. д. (1JPC
ного производного 6в соединение 10б образуется
178.2 Гц), а в минорном конформере
- при
с выходом 51%.
202.49 м. д. (1JPC 192.8 Гц). Удвоенные сигналы
Внутримолекулярная циклизация с обра-
наблюдались также для протонов и ядер углерода
зованием фрагмента 3 была изучена на при-
метоксиметильной и трет-бутильной групп.
мере известных соединений 11a, б, г [6, 7], и
Ацилфосфонат
17 был введен в реакцию
специально синтезированного вещества
11в
Виттига с этоксиметилентрифенилфосфораном,
(схема
5). Получение последнего соединения
что привело к образованию 3-(фурил)-3-(диэток-
начинали с бромирования известного эфира 4-ме-
сифосфорил)акрилата 18 (схема 5). Заменой ме-
тил-5-трет-бутилфуран-3-карбоновой кислоты
токсиметильной группы в этом соединении на
12
[7] N-бромсукцинимидом. Образовавшееся
хлорметильную действием дихлорметилметило-
4-бромметильное производное
13 обработкой
вого эфира в присутствии хлористого цинка было
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1236
ПЕВЗНЕР
Схема 7.
O
O
O
O
O
O
O
O
O
OHSOCl
ClP(OEt)3
PO(OEt)2
KOH
2
O
O
O
O
21
22
23
24
PO(OEt)2
CO2Et
PO(OEt)2
CO2Et
S
CO2Et
O
H2CCl
PO(OEt)2
Ph3P=CHCO2Et
Cl2CHOCH3
(H2N)C=S
ZnCl
2
KOH
O
O
O
25
26
27
синтезировано целевое соединение 11в. Методики
типами аннелирования 1 и 2. Так, соединение 19а
синтеза и спектральные данные подробно приве-
со свободными положениями 2 и 5 фуранового
дены в Экспериментальной части.
кольца было получено с выходом 61%. В случае
дибромида 19б выход снизился до 49%, а для со-
Получение тиурониевых солей из соединений
единении 19г, имеющем бром и трет-бутильную
11а-г и их разложение проводили аналогично рас-
группу он составил 63%, тогда как для соединении
смотренным выше случаям (схема 6).
19в, имеющем только трет-бутильный замести-
Сигнал ядра фосфора в спектрах ЯМР 31Р по-
тель он увеличился до 74%. Таким образом, и в
лученных соединений наблюдается при
20.7-
случае аннелирования типа 3 качественно просле-
24.3 м. д., т. е. в области, характерной для насыщен-
живается аналогичное влияние заместителей на
ных фосфонатов. Во всех случаях в спектре ЯМР
выход продукта циклизации.
1Н наблюдали сигналы протонов АВ-системы про-
Представляло интерес также выяснить, на-
тонов фрагмента С4Н2 с характерной константой
сколько размер заместителей в положениях 2 и 5
около 15 Гц. Если положение 2 фуранового кольца
фуранового кольца будет сказываться на строении
было занято трет-бутильной группой, то допол-
продуктов циклизации. С этой целью был син-
нительно проявляются константы взаимодействия
тезирован
3-(2-метил-4-хлорметил-5-трет-бу-
каждого из этих протонов с ядром фосфора. Сиг-
тил-3-фуранил)-3-(диэтоксифосфорил)акрилат
20
нал углерода С4 проявляется в пределах 20.1-
и исследован процесс его циклизации (схема 7).
23.4 м. д. и от фосфора не расщепляется. Сигнал
Синтез целевого соединения начинали исходя из
ядра углерода С7, непосредственно связанного с
описанного эфира 21 [Певзнер Л.М., ЖОХ, 2002,
фосфором, располагается в пределах 31.6-34.6 м. д.
т. 72, вып. 7]. Его щелочным гидролизом была по-
(1JPC 134-147 Гц), а сигнал углерода С6 - в обла-
лучена кислота 22, которая действием хлористо-
сти 37-41 м. д. (2JPC 0-4 Гц). Сигнал соседнего
го тионила была превращена в хлорангидрид 23.
ядра карбонильного углерода находится в области
Фосфорилирование последнего проводили дей-
168-170 м. д. (3JPC 12-19 Гц), характерной для на-
ствием триэтилфосфита в мольном соотношении
сыщенных карбоновых кислот. Таким образом, и в
хлорангидрид:фосфит = 1:1.5 в бензоле при 60-
данном случае внутримолекулярное нуклеофиль-
70°С в течение 4 ч. Ядро фосфора в образовавшем-
ное присоединение SH-группы приводит к форми-
ся фуроилфосфонате 24 резонирует при -2.64 м. д.
рованию насыщенного шестичленного гетероцик-
Сигнал ядра углерода, связанного с фосфором, ре-
ла, содержащего сульфидный атом серы.
гистрируется при 195.99 м. д. (1JPC 180.5 Гц).
Выходы продуктов циклизации 19a-г разли-
Полученный фосфонат 24 вводили в реакцию
чаются значительно меньше, чем в структурах с
Виттига с этоксикарбонилметилентрифенилфос-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ
1237
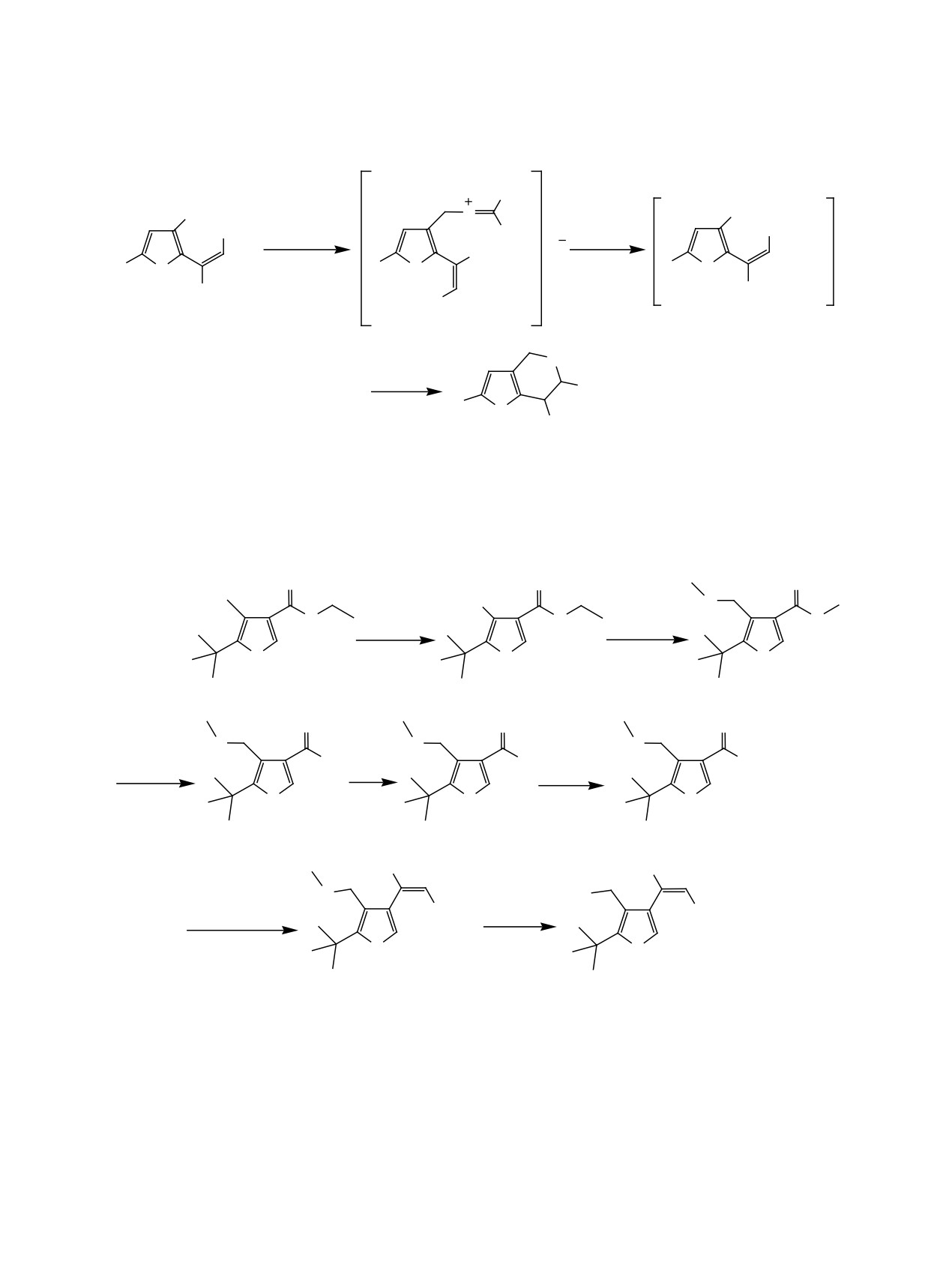
фораном в бензоле при кипячении. Неожиданно
кольцо аннелировано с предельным пятичленным
оказалось, что вместо обычного продукта Е-кон-
гетероциклом. Можно предположить, что из-за
фигурации в этом случае образуется Z-изомер
сильной стерической загруженности кольца алке-
25 (схема 7). Константа спин-спинового взаимо-
новый фрагмент не может развернуться в поло-
действия между протоном при двойной связи и
жение, при котором становится возможной атака
ядром фосфора в этом случае имеет характерное
меркаптид-иона на атом углерода боковой цепи,
для транс-конфигурации значение 43.6 Гц, тогда
соседствующий со сложноэфирной группой. В
как обычно наблюдаемая для продуктов Е-конфи-
результате происходит присоединение в обратном
гурации величина составляет 21-23 Гц. Напротив,
направлении, сходное с тем, которое наблюдается
константа взаимодействия 3JPC между ядром фос-
в реакции бутантиола с 3-(фурил)-3-(диэтокси-
фора и карбонильным углеродом вместо обычно
фосфорил)акрилатами [Певзнер Л.М., ЖОХ, 2017,
наблюдаемого значения 27-29 Гц уменьшилась до
т. 87, вып. 6]. Выход продукта 27 составил 72%.
8.2 Гц. Таким образом, оказалось, что увеличение
Таким образом, меркаптометильные произво-
стерической загруженности фуранового кольца
дные Е-3-(фурил)-3-(диэтоксифосфорил)акрила-
приводит к изменению конфигурации продукта в
тов в момент образования вступают в реакцию
реакции Виттига. При этом более термодинамиче-
внутримолекулярного нуклеофильного присо-
ски выгодным становится соединение, у которо-
единения по двойной связи акрилата с образо-
го фосфонатная и сложноэфирная группы имеют
ванием
дигидро-5Н-тиопирано[3,4-b]фуранов,
цис-расположение относительно двойной связи.
дигидро-4Н-тиопирано[4,3-b]фуранов или диги-
Соединение 25 обработкой дихлорметилмети-
дро-4Н-тиопирано[3,4-с]фуранов в зависимости
ловым эфиром в присутствии хлористого цинка
от относительного расположения меркаптометиль-
было превращено в хлорметильное производное
ной группы и алкенового фрагмента в фурановом
26. Строение алкенового фрагмента при этом не
кольце. В случае сильно стерически загруженного
изменилось. Взаимодействие с тиомочевиной и ги-
тризамещенного ацилфосфоната в результате ре-
дролиз тиурониевой соли проводили аналогично
акции Виттига неожиданно образуется Z-3-(фу-
описанным ранее случаям. В спектре ЯМР 31Р вы-
рил)-3-(диэтоксифосфорил)акрилат. Полученное
деленного продукта наблюдали сигнал ядра фос-
на его основе меркаптометильное производное
фора при 22.36 м. д., характерный для предельных
циклизуется с образованием 4Н,6Н-тиено[3,4-c]-
фосфонатов. В спектре ЯМР 1Н наблюдается сиг-
фуранового фрагмента.
нал протонов АВ-системы, дополнительно расще-
пленной от фосфора с параметрами δНА 2.98 м. д.,
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
δНВ 3.10 м. д., JPА 6.0, JPВ 13.6, JАВ 14.6 Гц. Сиг-
Спектры ЯМР 1Н, 13С, и 31Р получали на при-
нал соответствующего ядра углерода располагает-
боре Bruker AVANCE-400 (400.13, 100.16, 161.97
ся при 29.51 м.д. с константой JPС 7.9 Гц. Сигнал
МГц соответственно).
ядра углерода, непосредственно связанного с фос-
фором, находится при 49.75 м. д. (1JPС 157.9 Гц).
Диэтил-3-метоксиметил-5-трет-бутил-2-фу-
Анализ спектра DEPT показывает, что протона при
роилфосфонат (8). К раствору 2.08 г 3-метокси-
этом атоме углерода нет. Кроме того, при 3.97 м. д.
метил-5-трет-бутил-2-фуроилхлорида 7 в 30 мл
в спектре ЯМР 1Н располагается сигнал прото-
бензола прибавляли 2.4 мл триэтилфосфита и по-
на метиленовой группы при сере с константа-
лученную смесь нагревали 4 ч при 60-70°С. После
ми JАВ 15.0 и JPА 4.6 Гц. Второй компонент этой
удаления легколетучих веществ остаток выдержи-
АВ-системы, видимо, перекрывается с сигналами
вали в вакууме (1 мм рт. ст.) 1 ч при комнатной
протонов групп ОСН2 и вследствие этого не был
температуре. Выход 2.85 г (95%), светло-корич-
идентифицирован. Сигнал соответствующего ядра
невое сиропообразное вещество. Спектр ЯМР 1Н
углерода располагается при 39.42 м. д. (JPС 5.1 Гц).
(CDCl3), δ, м. д.: 1.34 с (9Н, СН3-трет-бутил), 1.38
Полученные спектральные данные показывают,
т (6Н, СН3-фосфонат, JHH 7.2 Гц), 3.42 с (3Н, СН3О),
что в данном случае полученный продукт мож-
4.29 д. к (4Н, СН2О-фосфонат, JHH 7.2, JРH 14.8 Гц),
но описать структурой 27, в которой фурановое
4.66 с (2Н, ОСН2-фуран), 6.42 д (1Н, Н4-фуран,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1238
ПЕВЗНЕР
JРH 1.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
шенный раствор фильтровали через слой силика-
16.48 д (СН3-фосфонат, 3JРС 5.8 Гц), 28.65 (СН3-
геля и упаривали. Остаток выдерживали в вакууме
трет-бутил), 33.49 (С-четв., трет-бутил), 58.90
(1 мм рт. ст.) 1 ч при комнатной температуре. Вы-
(СН3О), 63.73 д (СН2О-фосфонат, 2JРС 7.2 Гц),
ход 1.94 г (86%), светло-желтого сиропообразного
66.88 (ОСН2-фуран), 107.01 д (С4-фуран, 4JРС 2.1 Гц),
вещества. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.19 т
138.54 д (С3-фуран, 3JРС 9.2 Гц), 146.16 д (С2-
(3Н, СН3-эфир, JHH 7.2 Гц), 1.25 с (9Н, СН3-трет-
фуран, 2JРС 60.4 Гц), 171.19 (С5-фуран), 185.50 д
бутил), 1.26-1.34 м (6Н, СН3-фосфонат), 4.06-4.15
(С=О, 1JРС 184.9 Гц). Спектр ЯМР 31Р (CDCl3): δP
м (6Н, СН2О-эфир, СН2О-фосфонат), 4.39 с (2Н,
-1.14 м. д.
СlСН2-фуран), 6.13 с (1Н, Н4-фуран), 6.94 д (1Н,
СН, JРH 21.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
Этиловый эфир 3-(3-метоксиметил-5-трет-
13.98 (СН3-эфир),
16.22 д (СН3-фосфонат, 3JРС
бутилфур-2-ил)-3-(диэтоксифосфорил)акри-
6.3 Гц), 28.80 (СН3-трет-бутил), 32.75 (С-четв.,
ловой кислоты (9). К раствору 2.85 г фуроил-
трет-бутил), 37.84 (СlСН2), 61.21 (СН2О-эфир),
фосфоната 8 в 30 мл бензола прибавляли при
63.06 д (СН2О-фосфонат, 2JРС 5.8 Гц),
105.13
перемешивании 3.6 г этоксикарбонилметилентри-
(С4-фуран), 123.30 д (С4-фуран, 3JРС 6.4 Гц), 132.08
фенилфосфорана и полученную смесь кипятили
д (=СН, 2JРС 9.7 Гц), 132.42 д (РС=, 1JРС 174.6 Гц),
10 ч. Горячую смесь разбавляли 100 мл гексана и
140.63 (С2-фуран, 2JРС 7.4 Гц), 164.06 д (С=О, 3JРС
перемешивали 30 мин, после чего оставляли на
26.1 Гц), 165.79 д (С5-фуран, 4JРС 2.1 Гц). Спектр
ночь. Отфильтровывали окись трифенилфосфина,
фильтрат пропускали через слой силикагеля и упа-
ЯМР 31Р (CDCl3): δP 12.51 м. д.
ривали досуха. Остаток выдерживали в вакууме (1
Этиловый эфир 4-бромметил-5-трет-бутил-
мм рт. ст.) 1 ч при комнатной температуре. Выход
фуран-3-карбоновой кислоты (13). Смесь 3.53 г
2.23 г (65%), светло-желтое сиропообразное ве-
этилового эфира
4-метил-5-трет-бутилфуран-
щество. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.21 т
3-карбоновой кислоты, 3.30 г N-бромсукциними-
(3Н, СН3-эфир, JHH 7.2 Гц), 1.26 с (9Н, СН3-трет-
да, 0.1 г азобис(изобутиронитрила) и 50 мл четы-
бутил), 1.29 т (6Н, СН3-фосфонат, JHH 7.2 Гц),
реххлористого углерода кипятили 6 ч и оставляли
3.29 с (3Н, СН3О), 4.07-4.14 м (6Н, СН2О-эфир,
на ночь. На следующий день отфильтровывали
СН2О-фосфонат), 4.16 д (2Н, ОСН2-фуран, JРH
сукцинимид и отгоняли четыреххлористый угле-
1.6 Гц), 6.13 с (1Н, Н4-фуран), 6.90 д (1Н, СН,
род. Остаток перегоняли в вакууме. Выход 4.42 г
JРH 22.0 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
(88%), бесцветная вязкая жидкость, т. кип. 111°С
14.06 (СН3-эфир),
16.26 д (СН3-фосфонат, 3JРС
(1 мм рт. ст.). Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.35
6.5 Гц), 28.88 (СН3-трет-бутил), 32.74 (С-четв.,
т (3Н, СН3-эфир, JHH 7.2 Гц), 1.37 с (4.5Н, СН3-
трет-бутил), 58.06 (СН3О), 61.01 (СН2О-эфир),
трет-бутил), 1.38 с (4.5Н, СН3-трет-бутил), 4.32
62.77 д (СН2О-фосфонат, 2JРС 5.8 Гц), 66.64 уш.
к (2Н, СН2О-эфир, JHH 7.2 Гц), 4.73 с (1Н, CH2Br),
с (ОСН2-фуран), 104.60 (С4-фуран), 124.76 д (С4-
4.87 с (1Н, CH2Br), 7.84 с (1Н, Н2-фуран). Спектр
фуран, 3JРС 7.2 Гц), 132.90 д (РС=, 1JРС 174.6 Гц),
ЯМР 13С (CDCl3), δС, м. д.: 14.28 (СН3-эфир),
133.64 д (=СН, 2JРС 10.2 Гц), 140.69 (С2-фуран,
23.63 (CH2Br),
29.05 (СН3-трет-бутил),
29.21
2JРС 5.9 Гц), 164.33 д (С=О, 3JРС 26.4 Гц), 165.56 д
(СН3-трет-бутил), 34.66 (С-четв., трет-бутил),
(С5-фуран, 4JРС 1.8 Гц). Спектр ЯМР 31Р (CDCl3):
60.28 (СН2О-эфир), 115.13 (С4-фуран), 117.87 (С3-
δP 13.14 м. д.
фуран), 146.02 (С2-фуран), 161.99 (С=О), 163.05
Этиловый эфир
3-(3-[хлорметил-5-трет-
(С5-фуран).
бутилфур-2-ил)-3-(диэтоксифосфорил)акрило-
Метиловый эфир 4-метоксиметил-5-трет-
вой кислоты (10). К раствору 2.23 г акрилата 9 в
бутилфуран-3-карбоновой кислоты (14). Раство-
25 мл хлороформа прибавляли при перемешивании
ряли 0.35 г натрия в 5 мл метанола и к получен-
2 мл дихлорметилметилового эфира и 0.05 г хло-
ному раствору прибавляли раствор 4.42 г бромида
ристого цинка. Реакционную массу нагревали при
13 в 50 мл бензола и 0.2 г иодида калия. Получен-
35-40°С 8 ч, затем промывали 10 мл воды, 10 мл
ную смесь кипятили при перемешивании 12 ч,
насыщенного раствора бикарбоната натрия, 10 мл
затем отфильтровывали осадок. Фильтрат упа-
раствора NaCl и сушили сульфатом натрия. Высу-
ривали, остаток растворяли в 50 мл этилацетата,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ
1239
промывали 15 мл воды, 15 мл раствора NaCl и
трет-бутил), 3.39 с (3Н, СН3О), 4.54 с (2Н, CH2О),
сушили сульфатом натрия. Перегонкой в вакууме
8.11 с (1Н, Н2-фуран). Спектр ЯМР 13С (CDCl3),
получали 2.68 г (80%) соединения 14 в виде под-
δС, м. д.: 29.23 (СН3-трет-бутил), 29.33 (СН3-
вижного масла с т. кип. 92°С (1 мм рт. ст.). Спектр
трет-бутил), 34.35 (С-четв., трет-бутил), 34.43
ЯМР 1Н (CDCl3), δ, м. д.: 1.36 с (9Н, СН3-трет-
(С-четв., трет-бутил), 114.12 (С4-фуран), 124.12
бутил), 3.39 с (3Н, СН3О), 3.80 с (3Н, СН3ОСО),
(С3-фуран),
151.60 (С2-фуран),
159.13 (С=О),
4.62 с (2Н, CH2О), 7.82 с (1Н, Н2-фуран). Спектр
163.54 (С5-фуран).
ЯМР 13С (CDCl3), δС, м. д.: 29.32 (СН3-трет-
Диэтил-4-метоксиметил-5-трет-бутил-3-
бутил), 34.36 (С-четв., трет-бутил), 51.17 (СН3О),
фуроилфосфонат (17). Раствор 1.61 г хлоранги-
57.88 (СН3ОСО),
62.84 (CH2О),
114.18 (С4-
дрида 16 и 1.9 мл триэтилфосфита в 40 мл бен-
фуран),
118.60 (С3-фуран),
145.59 (С2-фуран),
зола нагревали при перемешивании при 60-70°С
162.86 (С=О), 163.93 (С5-фуран).
4 ч. После удаления легколетучих веществ оста-
4-Метоксиметил-5-трет-бутилфуран-3-кар-
ток выдерживали в вакууме (1 мм рт. ст.) 1 ч
боновая кислота (15). Смесь 3.08 г эфира 14, 1 г
при комнатной температуре. Выход 2.30 г (99%),
гидроксида калия, 5 мл воды и 25 мл этанола кипя-
светло-коричневое сиропообразное вещество.
тили 6 ч. После этого реакционную массу упари-
Спектр ЯМР 1Н (CDCl3), δ, м. д.: общие сигналы:
вали, остаток растворяли в 40 мл воды, промывали
1.32-1.36 м (9Н, СН3-эфир, СН3-фосфонат), 1.37 с
10 мл этилацетата и подкисляли до рН 2. Выпавшее
(9Н, СН3-трет-бутил), 4.17-4.30 м (6Н, СН2О-э-
масло постепенно кристаллизовалось. Его раство-
фир, СН2О-фосфонат), 8.68 с (1Н, Н2-фуран);
ряли в 40 мл хлороформа, промывали 10 мл рас-
основной конформер, 3.37 с (3Н, СН3О), 4.60 с
твора NaCl и сушили сульфатом натрия. Раствори-
(2Н, СН2О-фуран); минорный конформер, 3.25
тель отгоняли и получали 2.04 г (71%) кислоты 15,
с (3Н, СН3О), 4.55 с (2Н, СН2О-фуран). Спектр
т. пл. 53°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: общие
ЯМР 13С (CDCl3), δС, м. д.: общие сигналы, 29.23
сигналы, 1.36 с (3Н, СН3-трет-бутил), 1.38 с (3Н,
(СН3-трет-бутил), 29.33 (СН3-трет-бутил), 34.35
СН3-трет-бутил), 1.40 с (3Н, СН3-трет-бутил),
(С-четв., трет-бутил), 34.42 (С-четв., трет-бу-
7.96 с (1Н, Н2-фуран), 11.42 уш. с (1Н, СООН);
тил), 113.83 д (С4-фуран, 3JРС 5.9 Гц), 126.33 д
основной конформер, 3.41 с (3Н, СН3О), 4.66 с (2Н,
(С3-фуран, 2JРС 69.2 Гц), 152.75 д (С2-фуран, 3JРС
CH2О); минорный конформер, 3.39 с (3Н, СН3О),
4.1 Гц), 163.54 (С5-фуран); основной конформер,
4.53 с (2Н, CH2О). Спектр ЯМР 13С (CDCl3), δС, м. д.:
16.34 д (СН3-фосфонат, 3JРС 5.7 Гц), 57.95 (СН3О),
общие сигналы, 28.42 (СН3-трет-бутил), 29.34
62.84 (СН2О-фуран), 63.89 д (СН2О-фосфонат, 2JРС
(СН3-трет-бутил),
29.62
(СН3-трет-бутил),
7.0 Гц), 193.84 д (С=О, 3JРС 178.2 Гц); минорный
34.13 (С-четв., трет-бутил), 34.40 (С-четв., трет-
конформер, 16.11 д (СН3-фосфонат, 3JРС 6.7 Гц),
бутил), 34.70 (С-четв., трет-бутил); основной
57.68 (СН3О), 63.64 д (СН2О-фосфонат, 2JРС 7.3 Гц),
конформер, 51.75 (СН3О), 62.86 (CH2О), 113.83
65.96 (СН2О-фуран), 202.49 д (С=О, 3JРС 192.8 Гц).
(С4-фуран),
118.61 (С3-фуран),
147.22 (С2-фу-
Спектр ЯМР 31Р (CDCl3), δP, м. д.: -3.04, -4.30 (со-
ран), 163.11 (С5-фуран), 168.48 (С=О); минорный
отношение конформеров 1:0.55).
конформер, 51.85 (СН3О), 64.12 (CH2О), 112.63
Этиловый эфир Е-3-(4-метоксиметил-5-
(С4-фуран), 114.68 (С3-фуран), 157.34 (С2-фуран),
трет-бутилфур-3-ил)-3-(диэтоксифосфорил)-
164.66 (С5-фуран), 169.45 (С=О). Соотношение
акриловой кислоты (18). Смесь 2.27 г фуроил-
конформеров 1:0.8.
фосфоната 17, 2.85 г этоксикарбонилметилентри-
Хлорангидрид
4-метоксиметил-5-трет-
фенилфосфорана и 30 мл бензола кипятили при
бутилфуран-3-карбоновой кислоты (16). К рас-
перемешивании 10 ч, после чего горячий раствор
твору 1.97 г кислоты 15 в 15 мл бензола прибавля-
разбавляли 80 мл гексана, перемешивали 30 мин
ли при перемешивании 1 мл хлористого тионила и
и оставляли на ночь. На следующий день отфиль-
3 капли ДМФА. Полученную смесь кипятили при
тровывали окись трифенилфосфина, фильтрат
перемешивании 5 ч, затем перегоняли в вакууме.
пропускали через слой силикагеля и отгоняли
Выход 1.61 г (87%), т. кип. 102°С (1 мм рт. ст.).
растворители. Остаток выдерживали в вакууме
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.39 с (3Н, СН3-
(1 мм рт. ст.) 1 ч при комнатной температуре. Выход
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1240
ПЕВЗНЕР
2.21 г (80%), светло-желтое масло. Спектр ЯМР 1Н
трет-бутил), 34.49 (С-четв., трет-бутил), 36.89
(CDCl3), δ, м. д.: общие сигналы, 1.15 т (3Н, СН3-
(СН2Сl), 60.97 (СН2О-эфир), 63.24 д (СН2О-фос-
эфир, JHH 7.2 Гц), 1.27-1.31 м (6Н, СН3-фосфо-
фонат, 2JРС 6.3 Гц), 114.82 д (С4-фуран, 3JРС 4.9 Гц),
нат), 4.06-4.13 м (4Н, СН2О-фосфонат), 4.23 к (2Н,
118.92 д (С3-фуран, 2JРС 7.2 Гц), 132.19 д (=СН,
СН2О-эфир, JHH 7.2 Гц), 6.87 д (1Н, =СН, JРH 22.8
2JРС 10.1 Гц), 135.49 д (=СР, 1JРС 178.6 Гц), 137.51
Гц), 7.26 д (1Н, Н2-фуран, JРH 2.8 Гц); основной
д (С2-фуран, 3JРС 5.6 Гц), 160.92 (С2-фуран), 164.11
конформер, 1.36 с (9Н, СН3-трет-бутил), 3.26 с
д (С=О, 3JРС 28.4 Гц). Спектр ЯМР 31Р (CDCl3): δP
(3Н, СН3О), 4.56 с (2Н, СН2О-фуран); минорный
13.52 м. д.
конформер, 1.34 с (9Н, СН3-трет-бутил), 3.34
2-Метил-4-метоксиметил-5-трет-бутил-
с (3Н, СН3О), 4.41 с (2Н, СН2О-фуран). Спектр
фуран-3-карбоновая кислота (22). Смесь 3.32 г
ЯМР 13С (CDCl3), δС, м. д.: общие сигналы, 13.82
эфира 21, 1 г гидроксида калия, 5 мл воды и
(СН3-эфир), 16.26 д (СН3-фосфонат, 3JРС 6.4 Гц),
25 мл этанола кипятили 6 ч. После этого реакцион-
16.37 д (СН3-фосфонат, 3JРС 5.7 Гц), 60.82 (СН2О-э-
ную массу упаривали, остаток растворяли в 40 мл
фир), 62.93 д (СН2О-фосфонат, 2JРС 6.0 Гц), 63.66 д
воды, промывали 10 мл этилацетата и подкисляли
(СН2О-фосфонат, 2JРС 7.4 Гц), 114.50 д (С4-фуран,
до рН 2. Выпавшее масло постепенно кристал-
3JРС 5.4 Гц), 119.81 д (С3-фуран, 2JРС 7.5 Гц), 132.09
лизовалось. Полученную твердую фазу затирали
д (=СН, 2JРС 9.8 Гц), 135.85 д (=СР, 1JРС 176.5 Гц),
с водой до образования мелкокристаллического
137.03 д (С2-фуран, 3JРС 5.6 Гц), 160.92 (С2-фу-
порошка, отфильтровывали и сушили на воздухе
ран), 164.42 д (С=О, 3JРС 28.6 Гц); основной кон-
до постоянной массы. Выход 2.64 г (84%), т. пл.
формер, 29.18 (СН3-трет-бутил), 34.02 (С-четв.,
65°С. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.38 с (9Н,
трет-бутил),
57.47 (СН3О),
64.36 (СН2О-фу-
СН3-трет-бутил), 2.55 с (3Н, СН3-фуран), 3.42 с
ран); минорный конформер, 29.36 (СН3-трет-
(3Н, СН3О), 4.63 с (2Н, CH2О). Спектр ЯМР 13С
бутил), 34.54 (С-четв., трет-бутил), 57.71 (СН3О),
(CDCl3), δС, м. д.: 14.28 (СН3-фуран), 29.67 (СН3-
65.93 (СН2О-фуран). Спектр ЯМР 31Р (CDCl3): δP
трет-бутил), 34.13 (С-четв., трет-бутил), 57.74
14.25 м. д. (соотношение конформеров 1:0.5).
(СН3О), 63.68 (CH2О), 113.13 (С4-фуран), 113.96
(С3-фуран), 158.70 (С2-фуран), 159.46 (С5-фуран),
Этиловый эфир Е-3-(4-хлорметил-5-трет-
168.96 (С=О).
бутилфур-3-ил)-3-(диэтоксифосфорил)акри-
ловой кислоты (11в). Смесь 1.87 г акрилата 18,
Хлорангидрид
2-метил-4-метоксиметил-5-
1.5 мл дихлорметилметилового эфира, 0.1 г хло-
трет-бутилфуран-3-карбоновой кислоты (23).
ристого цинка и 30 мл хлороформа перемешивали
Смесь 2.64 г кислоты 22, 1.3 мл хлористого тиони-
10 ч. Температура реакционной массы поднима-
ла, 2 капель ДМФА и 30 мл бензола кипятили при
лась с 30 до 35°С, а затем постепенно возвраща-
перемешивании 6 ч и перегоняли в вакууме. Вы-
лась к исходному значению. Образовавшуюся
ход 2.77 г (97%), т. кип. 118°С (1 мм рт. ст.). Спектр
смесь разбавляли 30 мл хлороформа, промывали
ЯМР 1Н (CDCl3), δ, м. д.: 1.37 с (9Н, СН3-трет-
20 мл воды, 20 мл насыщенного раствора бикарбо-
бутил), 2.64 с (3Н, СН3-фуран), 3.39 с (3Н, СН3О),
ната натрия, 20 мл раствора NaCl и сушили суль-
4.51 с (2Н, CH2О). Спектр ЯМР 13С (CDCl3), δС,
фатом натрия. После удаления растворителя оста-
м. д.: 15.93 (СН3-фуран), 29.49 (СН3-трет-бутил),
ток выдерживали в вакууме (1 мм рт. ст.) 1 ч при
34.13 (С-четв, трет-бутил), 58.14 (СН3О), 63.08
комнатной температуре. Выход 1.86 г (98%), жел-
(CH2О),
114.79 (С4-фуран),
118.76 (С3-фуран),
тое масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.16 т
160.10 (С2-фуран), 160.38 (С=О), 160.59 (С5-фу-
(3Н, СН3-эфир, JHH 7.2 Гц), 1.31 т (6Н, СН3-фос-
ран).
фонат, JHH 7.2 Гц), 1.38 уш. с (9Н, СН3-трет-бу-
Диэтил-2-метил-4-метоксиметил-5-трет-
тил), 4.08-4.16 м (4Н, СН2О-фосфонат), 4.34 к (2Н,
бутил-3-фуроилфосфонат (24). Смесь 2.64 г хлор-
СН2О-эфир, JHH 7.2 Гц), 4.49 с (2Н, CH2Cl), 6.91 д
ангидрида 23, 4 мл триэтилфосфита и 40 мл бен-
(1Н, =СН, JРH 22.4 Гц), 7.24 д (1Н, Н2-фуран, JРH
зола нагревали 4 ч при 60-70°С. Образовавшуюся
3.2 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 13.86
смесь упаривали, остаток выдерживали в вакуу-
(СН3-эфир), 16.28 д (СН3-фосфонат, 3JРС 6.0 Гц),
ме (1 мм рт. ст.) 1 ч при комнатной температуре.
16.32 д (СН3-фосфонат, 3JРС 6.0 Гц), 29.15 (СН3-
Выход
3.51 г
(95%), светло-коричневое мас-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ
1241
ло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.31 с (9Н,
10 ч при 30-32°С. Реакционную массу промыва-
СН3-трет-бутил), 1.33 т (6Н, СН3-фосфонат, JНН
ли 15 мл воды, 15 мл насыщенного раствора би-
7.2 Гц), 2.61 с (3Н, СН3-фуран), 3.31 с (3Н, СН3О),
карбоната натрия, 15 мл раствора NaCl и сушили
4.11 д. к (2Н, СН2О-фосфонат, JНН 7.2, JРН 14.0 Гц),
сульфатом натрия. Высушенный раствор пропу-
4.19 д. к (2Н, СН2О-фосфонат, JНН 7.2, JРН 14.8 Гц),
скали через слой силикагеля, отгоняли хлороформ,
4.48 с (2Н, CH2О). Спектр ЯМР 13С (CDCl3), δС,
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
м. д.: 14.71 (СН3-фуран), 16.27 д (СН3-фосфонат,
при комнатной температуре. Выход 2.07 г (82%),
3JРС 5.8 Гц), 29.43 (СН3-трет-бутил), 33.93 (С-четв.,
желтое масло. Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.16
трет-бутил), 57.78 (СН3О), 63.57 (CH2О), 63.72 д
т (3Н, СН3-эфир, JНН 7.2 Гц), 1.22 т (6Н, СН3-фос-
(СН2О-фосфонат, 2JРС 7.5 Гц), 64.18 д (СН2О-фос-
фонат, JНН 7.2 Гц), 1.35 с (9Н, СН3-трет-бутил),
фонат, 2JРС 7.2 Гц), 114.78 д (С4-фуран, 3JРС 7.7 Гц),
2.19 д (3Н, СН3-фуран, JРН 2.0 Гц), 4.02-4.16 м
122.26 д (С3-фуран, 2JРС 66.3 Гц), 158.03 (С5-
(4Н, СН2О-фосфонат), 4.27 к (2Н, СН2О-эфир,
фуран), 159.42 д (С2-фуран, 3JРС 1.1 Гц), 195.99 д
JНН 7.2 Гц), 4.53 с (2Н, СН2Сl), 6.53 д (1Н, СН=,
(С=О, 1JРС 180.5 Гц). Спектр ЯМР 31Р (CDCl3): δP
JРН 43.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
-2.64 м. д.
12.20 уш. с (СН3-фуран), 14.05 (СН3-эфир), 16.16 д
(СН3-фосфонат, 3JРС 6.2 Гц), 29.33 (СН3-трет-бу-
Этиловый эфир Z-3-(2-метил-4-метоксиме-
тил-5-трет-бутилфур-3-ил)-3-(диэтоксифос-
тил), 34.03 (С-четв., трет-бутил), 37.31 (СН2Сl),
61.38 (СН2О-эфир), 62.70 д (СН2О-фосфонат, 2JРС
форил)акриловой кислоты (25). Смесь 3.51 г
6.4 Гц), 115.06 д (С4-фуран, 3JРС 2.9 Гц), 117.60 д
фуроилфосфоната 24, 4.23 г этоксикарбонилмети-
(С3-фуран, 2JРС 9.1 Гц), 132.07 д (=СН, 2JРС 9.7 Гц),
лентрифенилфосфорана и 40 мл бензола кипяти-
132.09 д (СР=, 1JРС 179.6 Гц), 158.77 (С2-фуран),
ли при перемешивании 10 ч, после чего горячую
162.38 (С5-фуран), 165.08 д (С=О, 3JРС 8.0 Гц).
смесь разбавляли 130 мл гексана, перемешивали
Спектр ЯМР 31Р (CDCl3): δP 11.70 м. д.
30 мин и оставляли на ночь. Отфильтровывали
окись трифенилфосфина, фильтрат пропускали
Реакция галогенметильных производных
через слой силикагеля и отгоняли растворители.
3-(фурил)-3-(диэтоксифосфорил)акрилатов с
Остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
тиомочевиной (общая методика). К раствору
при комнатной температуре. Выход 2.94 г (70%),
4 ммоль галогенметильного производного в 30 мл
светло-желтое масло. Спектр ЯМР 1Н (CDCl3), δ,
этанола прибавляли 4.05 ммоль тиомочевины и
м. д.: 1.18-1.23 м (9Н, СН3-эфир, СН3-фосфонат),
полученную смесь кипятили 4 ч в случае броми-
1.31 с (9Н, СН3-трет-бутил), 2.20 д (3Н, СН3-
дов и 10 ч в случае хлоридов. К образовавшемуся
фуран, JРН 2.4 Гц), 3.28 с (3Н, СН3О), 4.02-4.16 м
раствору тиурониевой соли прибавляли раствор
(4Н, СН2О-фосфонат), 4.19 с (2Н, CH2О), 4.26 к
4.1 ммоль гидроксида калия в смеси 10 мл этанола
(2Н, СН2О-эфир, JНН 7.2 Гц), 6.48 д (1Н, СН=, JРН
и 1 мл воды и кипятили 4 ч. После этого отгоня-
43.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.: 12.32
ли этанол, остаток растворяли в 40 мл хлорофор-
(СН3-фуран), 14.04 (СН3-эфир), 16.13 д (СН3-фос-
ма, промывали 15 мл воды, 15 мл раствора NaCl и
фонат,
3JРС
6.4 Гц),
29.47 (СН3-трет-бутил),
сушили сульфатом натрия. Отгоняли хлороформ,
33.94 (С-четв., трет-бутил), 57.62 (СН3О), 61.19
остаток выдерживали в вакууме (1 мм рт. ст.) 1 ч
(СН2О-эфир), 62.44 д (СН2О-фосфонат, 2JРС 6.3 Гц),
при комнатной температуре.
64.94 (CH2О), 114.95 д (С4-фуран, 3JРС 3.6 Гц),
Этиловый эфир
4-(диэтоксифосфорил)-
118.50 д (С3-фуран, 2JРС 8.9 Гц), 132.94 д (=СН,
4,7-дигидро-5Н-тиопирано[3,4-b]фуран-5-кар-
2JРС 10.0 Гц), 133.25 д (СР=, 1JРС 175.3 Гц), 157.41
боновой кислоты (5а). Выход 30%, светло-корич-
(С2-фуран), 158.86 (С5-фуран), 165.34 д (С=О, 3JРС
невое сиропообразное вещество. Спектр ЯМР 1Н
8.2 Гц). Спектр ЯМР 31Р (CDCl3): δP 12.07 м. д.
(CDCl3), δ, м. д.: 1.25-1.30 м (6Н, СН3-фосфонат),
Этиловый эфир Z-3-(2-метил-4-хлорметил-
1.34 уш. т (3Н, СН3-эфир, JНН 7.2 Гц), 3.57 д. д (1Н,
5-трет-бутилфур-3-ил)-3-(диэтоксифосфорил)-
Н7А, JАВ 16.0, JРА 4.0 Гц), 3.60 д. д (1Н, Н7В, JАВ
акриловой кислоты (26). Смесь 2.49 г акрилата
16.0, JРВ 4.0 Гц), 3.73-3.81 м (2Н, Н4,5), 4.02-4.14 м
25, 2 мл дихлорметилметилового эфира, 0.3 г хло-
(4Н, СН2О-фосфонат), 4.17 к (1Н, СН2О-эфир, JНН
ристого цинка и 40 мл хлороформа перемешивали
6.8 Гц), 4.18 к (1Н, СН2О-эфир, JНН 7.2 Гц), 6.50 уш. с
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1242
ПЕВЗНЕР
(1Н, Н3-фуран), 7.27 д (1Н, Н2-фуран, JНН 1.6 Гц).
фонат, 2JРС 7.0 Гц), 112.89 д (С3-фуран, 3JРС 1.0 Гц),
Спектр ЯМР 13С (CDCl3), δС, м. д.: 14.02 (СН3-
115.22 д (С4-фуран, 2JРС 8.5 Гц), 145.49 (С5-фуран),
эфир), 16.34 д (СН3-фосфонат, 3JРС 5.6 Гц), 16.36
147.51 д (С2-фуран, 3JРС 10.8 Гц), 169.84 д (С=О,
д (СН3-фосфонат, 3JРС 7.2 Гц), 22.29 д (С7, 4JРС
3JРС 15.5 Гц). Спектр ЯМР 31Р (CDCl3): δP 23.51 м. д.
2.3 Гц), 36.35 д (С4, 1JРС 142.5 Гц), 40.74 д (С5, 2JРС
Этиловый эфир 7-(диэтоксифосфорил)-6,7-
2.2 Гц), 61.92 (СН2О-эфир), 62.60 д (СН2О-фос-
дигидро-4Н-тиопирано[4,3-b]фуран-6-карбо-
фонат, 2JРС 6.8 Гц), 62.82 д (СН2О-фосфонат, 2JРС
новой кислоты (10а). Выход 28%, светло-жел-
6.7 Гц), 111.41 д (С3-фуран, 3JРС 1.4 Гц), 112.19 д
тое сиропообразное вещество. Спектр ЯМР 1Н
(С4-фуран, 2JРС 8.1 Гц), 140.29 (С2-фуран), 145.59
(CDCl3), δ, м. д.: 1.24 уш. с (6Н, СН3-фосфонат),
д (С5-фуран, 3JРС 10.6 Гц), 170.65 д (С=О, 3JРС
1.32 т (3Н, СН3-эфир, JНН 7.2 Гц), 3.43 д. д (1Н,
17.4 Гц). Спектр ЯМР 31Р (CDCl3): δP 24.10 м. д.
Н4А, JАВ 15.6, JРА 3.6 Гц), 3.69 д. д. д (1Н, Н4В, JАВ
15.6, JРВ 4.8, JВН 1.6 Гц), 3.89 уш. д (1Н, Н7, JРН
Этиловый эфир 2-трет-бутил-4-(диэтокси-
22.4 Гц), 4.07-4.13 м (5Н, СН2О-фосфонат, Н6),
фосфорил)-4,7-дигидро-5Н-тиопирано[3,4-b]-
4.16 к (2Н, СН2О-эфир, JНН 7.2 Гц), 6.24 уш. с
фуран-5-карбоновой кислоты (5б). Выход 86%,
(1Н, Н3-фуран), 7.33 уш. с (1Н, Н2-фуран). Спектр
светло-желтое сиропообразное вещество. Спектр
ЯМР 13С (CDCl3), δС, м. д.: 14.06 (СН3-эфир), 16.34
ЯМР 1Н (CDCl3), δ, м. д.: 1.21 с (9Н, СН3-трет-
д (СН3-фосфонат, 3JРС 5.6 Гц), 16.35 д (СН3-фос-
бутил),
1.22-1.30 м
(9Н, СН3-фосфонат, СН3-
фонат, 3JРС 5.9 Гц), 22.87 д (С4, 4JРС 2.3 Гц), 36.66
эфир), 3.55 д. д (1Н, Н7А, JАВ 16.0, JРА 4.0 Гц),
д (С7, 1JРС 142.4 Гц), 41.36 д (С6, 2JРС 2.3 Гц),
3.71-3.77 м (2Н, Н7В, Н4), 4.02-4.14 м (4Н, СН2О-
61.93 (СН2О-эфир), 62.56 д (СН2О-фосфонат, 2JРС
фосфонат), 4.15 к (1Н, СН2О-эфир, JНН 7.2 Гц),
6.8 Гц), 63.08 д (СН2О-фосфонат, 2JРС 6.7 Гц),
4.16 д. д (1Н, Н5, JНН 2.4 Гц, JРН 6.8 Гц), 4.17 к (1Н,
110.02 д (С3-фуран, 3JРС 3.2 Гц), 115.39 д (С4-
СН2О-эфир, JНН 7.2 Гц),. Спектр ЯМР 13С (CDCl3),
фуран, 3JРС 8.7 Гц), 141.14 д (С5-фуран, 4JРС 3.3 Гц),
δС, м. д.: 14.05 (СН3-эфир), 16.24 д (СН3-фосфо-
144.08 д (С2-фуран, 2JРС 11.6 Гц), 169.95 д (С=О,
нат, 3JРС 5.7 Гц),
16.29 д (СН3-фосфонат, 3JРС
3JРС 15.5 Гц). Спектр ЯМР 31Р (CDCl3): δP 21.78 м. д.
5.8 Гц), 22.39 д (С7, 4JРС 2.4 Гц), 28.97 (СН3-трет-
Этиловый эфир 2-трет-бутил-7-(диэтокси-
бутил), 32.43 (С-четв., трет-бутил), 36.36 д (С4,
фосфорил)-6,7-дигидро-4Н-тиопирано[4,3-b]-
1JРС
141.8 Гц), 40.97 д (С5, 2JРС 2.3 Гц), 61.81
фуран-6-карбоновой кислоты (10б). Выход 51%,
(СН2О-эфир), 62.62 д (СН2О-фосфонат, 2JРС 6.8 Гц),
желтое сиропообразное вещество. Спектр ЯМР
62.64 д (СН2О-фосфонат, 2JРС 6.7 Гц), 103.78 д
1Н (CDCl3), δ, м. д.: 1.20 т (3Н, СН3-фосфонат, JНН
(С3-фуран, 3JРС 1.1 Гц), 111.93 д (С4-фуран, 2JРС
7.2 Гц), 1.22 с (9Н, СН3-трет-бутил), 1.28 т (3Н,
8.0 Гц), 143.41 д (С5-фуран, 3JРС 10.7 Гц), 161.87
СН3-фосфонат, JНН 7.2 Гц), 1.31 т (3Н, СН3-эфир,
(С2-фуран), 170.18 д (С=О, 3JРС 14.4 Гц). Спектр
J
7.2 Гц), 3.39 д. д (1Н, Н4А, JАВ 15.4, JРА 4.4 Гц),
НН
ЯМР 31Р (CDCl3): δP 24.34 м. д.
3.69 уш. д. д (1Н, Н4В, JАВ 15.4, JРВ 5.6 Гц), 3.83 уш.
Этиловый эфир
2-бром-4-(диэтоксифосфо-
д (1Н, Н7, JРН 22.0 Гц), 4.08 д. к (4Н, СН2О-фос-
рил)-4,7-дигидро-5Н-тиопирано[3,4-b]фуран-
фонат, JНН 7.2, JРН 14.8 Гц), 4.15 к (СН2О-эфир,
5-карбоновой кислоты (5в). Выход 14%, свет-
J
7.2 Гц), 4.21 д. д (1Н, Н6, JНН 3.0, JРН 11.6 Гц),
НН
ло-коричневое сиропообразное вещество. Спектр
5.79 с (1Н, Н3-фуран). Спектр ЯМР 13С (CDCl3),
ЯМР 1Н (CDCl3), δ, м. д.: 1.26-1.35 м (9Н, СН3-фос-
δС, м. д.: 14.04 (СН3-эфир), 16.11 д (СН3-фос-
фонат, СН3-эфир), 3.54 д. д (1Н, Н7А, JАВ 16.0, JРА
фонат, 3JРС 6.6 Гц), 16.37 д (СН3-фосфонат, 3JРС
4.0 Гц), 3.38 д. д. д (1Н, Н7В, JАВ 16.0, JРВ 5.0, JВН
5.9 Гц), 22.96 д (С4, 4JРС 2.3 Гц), 28.96 (СН3-трет-
1.6 Гц), 3.69 уш. д (1Н, Н4, JРН 23.6 Гц), 4.06-4.23
бутил), 32.48 (С-четв., трет-бутил), 36.38 д (С7, 1JРС
м (7Н, СН2О-фосфонат, СН2О-эфир, Н4), 6.42 уш. с
141.7 Гц), 41.37 д (С6, 2JРС 2.1 Гц), 61.82 (СН2О-
(1Н, Н3-фуран). Спектр ЯМР 13С (CDCl3), δС, м. д.:
эфир), 62.29 д (СН2О-фосфонат, 2JРС 6.9 Гц), 63.02
14.08 (СН3-эфир),
16.41 д (СН3-фосфонат, 3JРС
д (СН2О-фосфонат, 2JРС 7.1 Гц), 102.56 д (С3-фу-
5.7 Гц), 16.42 д (СН3-фосфонат, 3JРС 5.4 Гц), 21.93
ран, 3JРС 3.1 Гц), 115.54 д (С4-фуран, 3JРС 8.9 Гц),
д (С7, 4JРС 2.5 Гц), 35.96 д (С4, 1JРС 143.3 Гц), 40.30
141.67 д (С2-фуран, 2JРС 12.2 Гц), 162.69 д (С5-фу-
д (С5, 2JРС 2.1 Гц), 62.07 (СН2О-эфир), 62.02 д
ран, 4JРС 3.5 Гц), 170.10 д (С=О, 3JРС 15.3 Гц).
(СН2О-фосфонат, 2JРС 6.6 Гц), 62.72 д (СН2О-фос-
Спектр ЯМР 31Р (CDCl3): δP 21.89 м. д.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ВНУТРИМОЛЕКУ
ЛЯРНАЯ ЦИКЛИЗАЦИЯ
1243
Этиловый эфир
7-(диэтоксифосфорил)-
основной конформер, 1.36 с (9Н, СН3-трет-
6,7-дигидро-4Н-тиопирано[3,4-с]фуран-6-кар-
бутил), 3.10 д (1Н, Н4А, JАВ 7.6 Гц), 3.79 д (1Н, Н4В,
боновой кислоты (19а). Выход 61%, светло-жел-
JАВ 7.6 Гц); минорный конформер, 1.37 с (9Н,
тое сиропообразное вещество. Спектр ЯМР 1Н
СН3-трет-бутил), 3.08 д (1Н, Н4А, JАВ 5.2 Гц), 3.95
(CDCl3), δ, м. д.: 1.19 т (3Н, СН3-эфир, JНН 7.2 Гц),
д (1Н, Н4В, JАВ 5.2 Гц). Спектр ЯМР 13С (CDCl3), δС,
1.24 т (6Н, СН3-фосфонат, JНН 7.2 Гц), 3.57 д (1Н,
м. д.: общие сигналы, 16.13 д (СН3-фосфонат, 3JРС
Н4А, JАВ 15.4 Гц), 3.64 д (1Н, Н4В, JАВ 15.4 Гц),
6.7 Гц), 16.33 д (СН3-фосфонат, 3JРС 7.2 Гц), 22.69
3.81 д. д (1Н, Н7, JРН 23.3, JНН 5.2 Гц), 3.99-4.11 м
(С4), 62.94 д (СН2О-фосфонат, 2JРС 7.1 Гц), 63.44 д
(5Н, СН2О-фосфонат, Н6), 4.17 к (2Н, СН2О-эфир,
(СН2О-фосфонат, 2JРС 5.5 Гц), 114.61 д (С4-фуран,
JНН 7.2 Гц), 7.22 с (1Н, Н2-фуран), 7.52 д (1Н, Н5-
2JРС 7.2 Гц), 120.98 д (С3-фуран, 3JРС 5.0 Гц), 137.89
фуран, JРН 1.6 Гц). Спектр ЯМР 13С (CDCl3), δС, м. д.:
д (С5-фуран, 3JРС 6.2 Гц), 161.45 (С2-фуран), 169.13
14.03 (СН3-эфир),
16.29 д (СН3-фосфонат, 3JРС
д (С=О, 3JРС 13.7 Гц); основной конформер, 14.12
5.7 Гц), 16.31 д (СН3-фосфонат, 3JРС 5.7 Гц), 21.17
(СН3-эфир), 29.72 (СН3-трет-бутил), 33.37 д (С7,
(С4), 32.73 д (С7, 1JРС 140.3 Гц), 41.66 д (С6, 2JРС
1JРС 137.6 Гц), 34.55 (С-четв., трет-бутил), 41.74
2.6 Гц), 61.80 (СН2О-эфир), 62.73 д (СН2О-фос-
д (С6, 3JРС 4.9 Гц); минорный конформер, 14.04
фонат, 2JРС 6.9 Гц), 62.90 д (СН2О-фосфонат, 2JРС
(СН3-эфир), 28.39 (СН3-трет-бутил), 33.42 д (С7,
6.8 Гц), 114.32 д (С4-фуран, 2JРС 7.5 Гц), 116.87 д
1JРС 133.4 Гц), 34.39 (С-четв., трет-бутил), 41.05 д
(С3-фуран, 3JРС 5.4 Гц), 137.22 (С2-фуран), 141.16
(С6, 3JРС 4.9 Гц). Спектр ЯМР 31Р (CDCl3), δP, м. д.:
д (С5-фуран, 3JРС 5.7 Гц), 170.24 д (С=О, 3JРС
20.08, 24.54 (соотношение конформеров 1:0.5).
12.2 Гц). Спектр ЯМР 31Р (CDCl3): δP 24.29 м. д.
Этиловый эфир 2-трет-бутил-9-бром-7-(ди-
Этиловый эфир 2,9-дибром-7-(диэтоксифос-
этоксифосфорил)-6,7-дигидро-4Н-тиопира-
форил)-6,7-дигидро-4Н-тиопирано[3,4-с]фу-
но[3,4-с]фуран-6-карбоновой кислоты (19г). Вы-
ран-6-карбоновой кислоты (19б). Выход 49%,
ход 63%, светло-желтое сиропообразное вещество.
желто-коричневое сиропообразное вещество.
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.17-1.35 м (9Н,
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.24 т (3Н,
СН3-фосфонат, СН3-эфир), 1.36 с (9Н, СН3-трет-
СН3-фосфонат, JНН 7.2 Гц), 1.26 т (3Н, СН3-фос-
бутил), 3.12 д. д (1Н, Н4А, JАВ 15.2, JРА 6.6 Гц), 3.24
фонат, JНН 7.2 Гц), 1.36 т (3Н, СН3-эфир, JНН
д (1Н, Н4В, JАВ 15.2, JРВ 13.6 Гц), 3.78 д. д (1Н, Н6,
7.2 Гц), 3.36 д (1Н, Н4А, JАВ 15.6 Гц), 3.62 д (1Н,
J
12.4, JНН 4.4 Гц), 4.04-4.37 м (7Н, СН2О-фос-
РН
Н4В, JАВ 15.6 Гц), 3.75 д. д (1Н, Н7, JРН 22.3, JНН
фонат, СН2О-эфир, Н7). Спектр ЯМР 13С (CDCl3),
2.4 Гц), 4.10-4.22 м (6Н, СН2О-фосфонат, СН2О-
δС, м. д.: 14.05 (СН3-эфир), 16.32 д (СН3-фосфонат,
эфир), 4.27 д. д (1Н, Н6, JРН 10.8, JНН 2.4 Гц). Спектр
3JРС 6.5 Гц), 16.52 д (СН3-фосфонат, 3JРС 5.7 Гц),
ЯМР 13С (CDCl3), δС, м. д.: 14.05 (СН3-эфир), 16.44
23.42 (С4), 28.87 (СН3-трет-бутил), 31.61 д (С7,
д (СН3-фосфонат, 3JРС 5.6 Гц), 20.15 (С4), 34.62 д
1JРС 134.5 Гц), 33.49 (С-четв., трет-бутил), 37.66
(С7, 1JРС 147.6 Гц), 40.28 уш. с (С6), 62.04 (СН2О-э-
д (С6, 3JРС 3.9 Гц), 60.64 (СН2О-эфир), 63.49 д
фир), 62.41 д (СН2О-фосфонат, 2JРС 6.9 Гц), 117.77
(СН2О-фосфонат, 2JРС 7.9 Гц), 63.67 д (СН2О-фос-
д (С4-фуран, 2JРС 9.6 Гц), 118.43 д (С3-фуран, 3JРС
фонат, 2JРС 5.7 Гц), 117.76 д (С4-фуран, 2JРС 6.0
3.0 Гц), 142.41 д (С5-фуран, 3JРС 5.7 Гц), 149.71
Гц), 120.78 д (С3-фуран, 3JРС 3.7 Гц), 143.75 д (С5-
д (С2-фуран, 4JРС 1.1 Гц), 169.71 д (С=О, 3JРС
фуран, 3JРС 7.4 Гц), 149.45 д (С2-фуран, 4JРС 1.7
19.6 Гц). Спектр ЯМР 31Р (CDCl3): δP 22.87 м. д.
Гц), 168.83 д (С=О, 3JРС 14.6 Гц). Спектр ЯМР 31Р
(CDCl3): δP 20.72 м. д.
Этиловый эфир 2-трет-бутил-7-(диэтокси-
фосфорил)-6,7-дигидро-4Н-тиопирано[3,4-с]-
Этиловый эфир
[2-метил-4-(диэтоксифос-
фуран-6-карбоновой кислоты (19в). Выход 74%,
форил)-8-трет-бутил-4Н,7Н-тиено[3,4-c]фу-
светло-желтое сиропообразное вещество. Спектр
ран-4-ил]уксусной кислоты (27). Выход 72%,
ЯМР 1Н (CDCl3), δ, м. д.: Спектр ЯМР 1Н (CDCl3),
светло-желтое сиропообразное вещество. Спектр
δ, м. д.: общие сигналы, 1.29-1.36 м (9Н, СН3-фос-
ЯМР 1Н (CDCl3), δ, м. д.: 1.10 т (3Н, СН3-эфир, JНН
фонат, СН3-эфир), 4.01-4.11 м (2Н, Н6,Н7), 4.04-
7.2 Гц), 1.18 с (9Н, СН3-трет-бутил), 1.26-1.31
4.37 м (4Н, СН2О-фосфонат), 4.34 к (2Н, СН2О-э-
м (6Н, СН3-фосфонат), 2.23 д (3Н, СН3-фуран,
фир, JНН 7.2 Гц), 7.14 д (1Н, Н5-фуран, JРН 3.2 Гц);
JРН 3.2 Гц), 2.98 д. д (1Н, НА-ацетил, JАВ 14.6, JРА
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1244
ПЕВЗНЕР
6.0 Гц), 3.09 д (1Н, НАВ-ацетил, JАВ 14.6, JРВ 13.6 Гц),
технологического института (технического уни-
3.97 д. д (1Н, Н6А, JАВ 15.0, JРА 4.6 Гц), 4.00-4.37
верситета).
м (7Н, СН2О-фосфонат, СН2О-эфир, Н6В). Спектр
КОНФЛИКТ ИНТЕРЕСОВ
ЯМР 13С (CDCl3), δС, м. д.: 12.70 д (СН3-фуран,
4JРС
1.0 Гц), 13.97 (СН3-эфир), 16.35 д (СН3-
Автор заявляет об отсутствии конфликта
фосфонат, 3JРС 6.1 Гц), 16.41 д (СН3-фосфонат,
интересов.
3JРС 6.5 Гц), 29.00 (СН3-трет-бутил), 29.51 (СН2-
ацетил), 31.61 д (С7, 1JРС 134.5 Гц), 32.82 (С-четв.,
СПИСОК ЛИТЕРАТУРЫ
трет-бутил), 39.42 д (С6, 3JРС 5.1 Гц), 49.75 д
1. Kawai K., Chin J., Just G. // Nucleosides, Nucleotides.
(С4, 3JРС 157.9 Гц), 60.45 (СН2О-эфир), 63.19 д
1990. Vol. 9. P. 1045. doi 10.1080/07328319008046061
(СН2О-фосфонат, 2JРС 7.9 Гц), 63.59 д (СН2О-фос-
2. Subba Reddy B.V., Venkateswarlu A., Borkar P.,
фонат, 2JРС 5.7 Гц), 124.02 д (С4-фуран, 3JРС 4.3 Гц),
Yadav J.S., Sridhar B., Gree R. // J. Org. Chem. 2014.
124.84 д (С3-фуран, 2JРС 5.6 Гц), 141.70 д (С2-
Vol. 79. P. 2716. doi 10.1021/jo402832t
фуран, 3JРС 5.5 Гц), 150.22 д (С5-фуран, 4JРС 1.0 Гц),
3. Schickmous B., Christoffers J. // Eur. J. Org. Chem.
168.99 д (С=О, 3JРС 15.6 Гц). Спектр ЯМР 31Р
2014. N 20. P. 4410. doi 10.1002/ejoc201402388
4. Певзнер Л.М., Степанова Н.П. // ЖОХ. 2020. Т. 90.
(CDCl3): δP 22.36 м. д.
Вып. 2. С. 173. doi 10.31857/S0044460Х2002002Х;
ИНФОРМАЦИЯ ОБ АВТОРЕ
Pevzner L.M., Stepanova N.P. // Russ. J. Gen.
Chem. 2020. Vol. 90. N 2. P. 166. doi 10.1134/
S1070363220020024
org/0000-0002-1678-2524
5. Boberg F., Kieso A. // Lieb. Ann. 1959. Vol. 626. N 1.
P. 71. doi 10.1002/jlac19596260108
ФОНДОВАЯ ПОДДЕРЖКА
6. Певзнер Л.М. // ЖОХ. 2016. Т. 86. Вып. 8. С. 1327;
Pevzner L.M. // Russ. J. Gen. Chem. 2016. Vol. 86. N 8.
Работа выполнена в рамках государственного
P. 1864. doi 10.1134/S1070363216080156
задания Министерства науки и высшего образо-
7. Певзнер Л.М. // ЖОХ. 2021. Т. 91. Вып. 6. С. 896. doi
вания Российской Федерации № 785.00.X6019 с
10.31857/S0044460Х2106007Х; Pevzner L.M. // Russ.
использованием оборудования инжинирингового
J. Gen. Chem. 2021. Vol. 91. N 6. P. 1016. 10.1134/
центра Санкт-Петербургского государственного
S1070363221060074
Intramolecular Cyclization of Mercaptomethyl Derivatives
of 3-(Furyl)-3-(diethoxyphosphoryl)acrylic Acids
L. M. Pevzner*
St. Petersburg State Institute of Technology (Technical University), St. Petersburg, 190013 Russia
*e-mail: pevzner_lm@list.ru
Received June 28, 2021; revised June 28, 2021; accepted July 10, 2021
E-3-(Furyl)-3-(diethoxyphosphoryl)acrylic acids esters containing a mercaptomethyl group in the position of
the furan ring adjacent to the alkene moiety are easily generated in an aqueous ethanol medium by the action
of an equivalent of potassium hydroxide on the corresponding thiuronium salt. They are very easily attached
at the double bond of the alkene fragment to form dihydrothiopyrano[3,4-b]furans, dihydrothiopyrano[4,3-b]-
furans or dihydrothiopyrano[3,4-c]furans, depending on the relative position of the substituents in the furan ring.
Cyclization of sterically hindered 3-(3-methyl-4-mercaptomethyl-5-tert-butylfuran-4-yl)-3-(diethoxyphosphoryl)-
acrylic acid ester leads to the formation of an annelated dihydrothieno[3,4-c]furan system.
Keywords: furylacrylates, thiuronium salts, mercaptomethylfurans, intramolecular nucleophilic addition, di-
hydrothiopyranofurans, dihydrothienofurans
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021