ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 8, с. 1245-1252
УДК 547.786;547.788
ПРОИЗВОДНЫЕ МЕТИЛАМИНА С 1,2-АЗОЛЬНЫМИ
ФРАГМЕНТАМИ: СИНТЕЗ, КОМПЛЕКСЫ С
ПАЛЛАДИЕМ, КАТАЛИЗ РЕАКЦИИ СУЗУКИ
© 2021 г. Е. А. Акишинаa,*, Е. А. Дикусарa, С. К. Петкевичa, Р. С. Алексеевb,
Н. А. Бумагинb, В. И. Поткинa
a Институт физико-органической химии Национальной академии наук Беларуси,
ул. Сурганова 13, Минск, 220072 Беларусь
b Московский государственный университет имени М. В. Ломоносова, Москва, 119991 Россия
*e-mail: che.semenovaea@mail.ru
Поступило в Редакцию 24 мая 2021 г.
После доработки 3 июня 2021 г.
Принято к печати 7 июня 2021 г.
Синтезированы новые производные метиламина с 1,2-азольными фрагментами (фенилизоксазольным,
п-толилизоксазольным, 2,5-диметилфенилизоксазольным и 4,5-дихлоризотиазольным) и их палладиевые
комплексы. Показано, что полученные N-метил-1-(1,2-азол-3-ил)метиламиновые комплексы палладия
проявляют высокую каталитическую активность в реакции Сузуки в водной среде.
Ключевые слова: метиламин, 5-арилизоксазолы, 4,5-дихлоризотиазол, комплексы палладия, катализ,
реакция Сузуки
DOI: 10.31857/S0044460X21080126
В настоящее время большое внимание уделяет-
ризотиазольным), их комплексов с палладием и
ся разработке новых биологически активных суб-
испытание полученных комплексов в качестве
станций, содержащих азольные фрагменты. В этом
потенциальных катализаторов в реакции Сузуки.
отношении являются перспективными 1,2-азоль-
Ранее нами были получены различные функци-
ные производные метиламина [1-3]. Метиламин
онализированные 1,2-азолы и показано, что они
содержится в растениях семейства молочайных
являются эффективными лигандами палладиевых
Mercurlalis annua и Mercurlalis perennis, часто об-
комплексов в катализе реакций кросс-сочетания
разуется при разложении алкалоидов и белковых
[6-12].
веществ [4]. Метилированныe амины являются
Выбранный маршрут синтеза включает две по-
важнейшими прекурсорами в органическом син-
следовательных стадии: конденсацию 5-арилизок-
тезе, поэтому они повсеместно используются в
сазол- или 4,5-дихлоризотиазол-3-карбальдегидов
синтезе лекарственных препаратов, пестицидов,
с метиламином в соответствующие азометины (a),
красителей [5]. Наиболее коммерчески значимыми
и далее, их восстановление боргидридом натрия в
являются фармацевтические препараты эфедрин
амины 1-4 (L1-4) (б) (схема 1). В результате серии
и теофиллин, пестициды карбофуран, карбарил и
экспериментов были подобраны оптимальные ус-
метам-натрий.
ловия, и целевые амины были получены с выходом
Цель данной работы - синтез новых произво-
65-75%. Поскольку синтезированные N-метил-
дных метиламина с 1,2-азольными фрагментами
1-(1,2-азол-3-ил)метиламины
1-4 представляют
(фенилизоксазольным,
п-толилизоксазольным,
собой маслообразные соединения, для удобства
2,5-диметилфенилизоксазольным и
4,5-дихло-
работы с ними и хранения они были переведены
1245
1246
АКИШИНА и др.
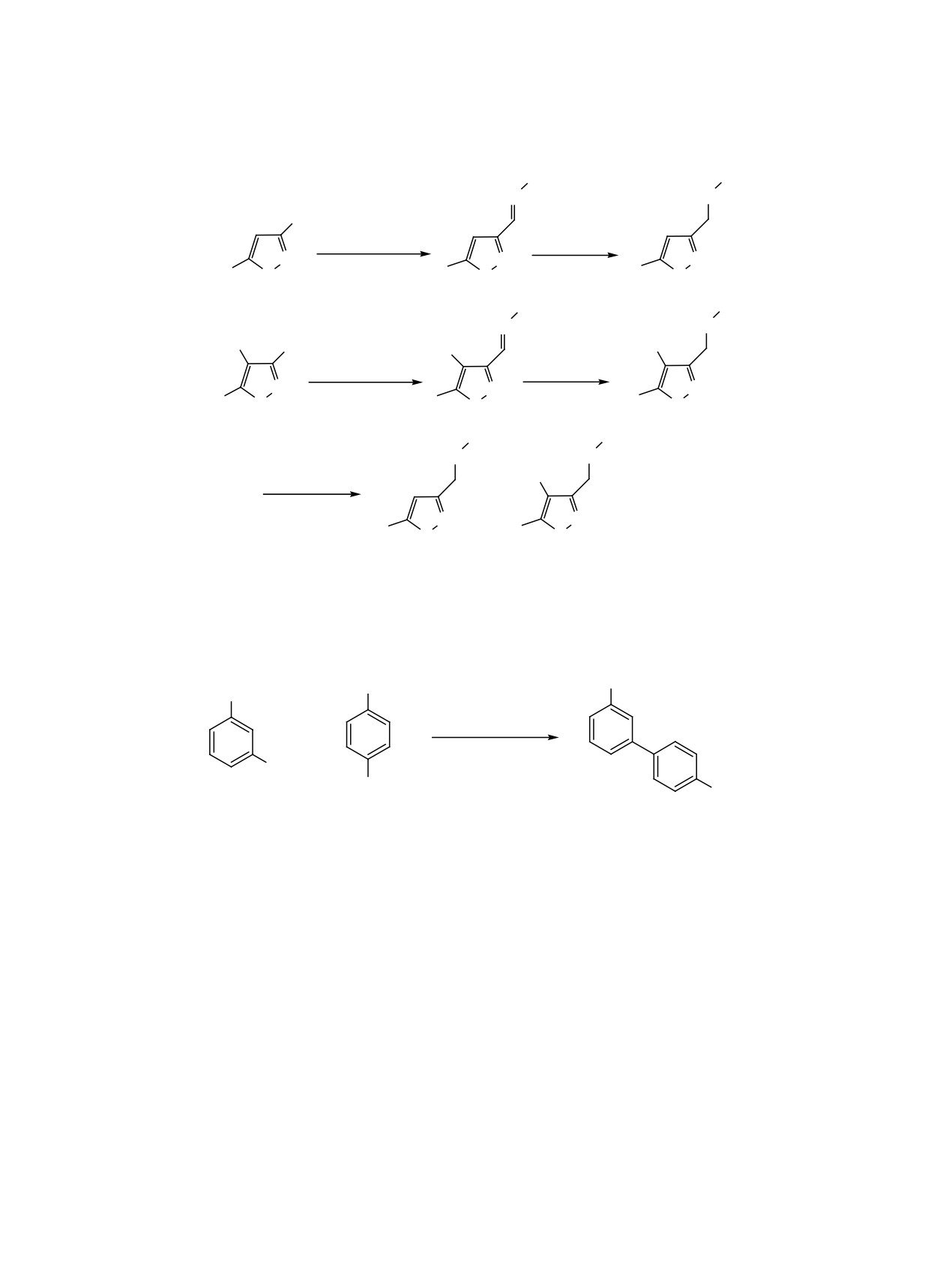
Схема 1.
Me
Me
N
HN
CHO
MeNH2.HCl,
NaHCO3
NaBH4
N
MeOH, 20oC, 96 ч
N
N
Ar
Ar
i-PrOH, 20oC,
Ar
O
O
O
96 ч
1-3
Me
Me
N
HN
Cl
CHO
Cl
Cl
MeNH2.HCl,
NaHCO3
NaBH4
N
MeOH, 20oC, 96 ч
N
i-PrOH, 20oC,
N
Cl
Cl
Cl
S
S
96 ч
S
4
Me
Me
HCl·NH
HCl·NH
Cl
HCl
1-4
Et2O
N
N
Ar
Cl
O
S
5-7
8
Ar = Ph (1, 5), p-Tol (2, 6), 2,5-Me2C6H3 (3, 7).
Схема 2.
H
CO2
OMe
CO2H
0.1 мол% Pd
+
K2CO3, H2O
Br
20-100oC
B(OH)
2
OMe
13
в соответствующие гидрохлориды по реакции с га-
оранжевые или светло-коричневые порошки, име-
зообразным HCl в диэтиловом эфире.
ют состав LPdCl2. Синтезированные комплексы
охарактеризованы данными элементного анализа,
Cинтез комплексов палладия проводили в среде
ИК и ЯМР спектроскопии.
метанола, в котором новые лиганды L1-4 облада-
ют достаточной растворимостью. При добавлении
Для испытания комплексов L1PdCl2-L4PdCl2 в
к раствору тетрахлорпалладата натрия в метано-
качестве катализаторов реакции Сузуки были ис-
ле (0.05 М.) растворов лигандов L1-4 в метаноле
пользованы их растворы в ДМФА (0.02 М). Исходя
(0.02 М.) (L:Pd = 1:1) характерная темно-коричне-
из стоящих перед нами задач по адаптации новых
вая окраска Na2PdCl4 мгновенно переходит в жел-
катализаторов к водным средам и разработке основ
то-оранжевую, и в реакционных смесях, по дан-
экологически безопасных процессов, при выборе
ным ТСХ, полностью исчезают исходные лиганды.
растворителей для реакции мы ориентировались,
По данным элементного анализа, полученные
прежде всего, на воду. В качестве модельной ре-
комплексы 10-12, представляющие собой желто-
акции Сузуки была выбрана реакция 4-метоксифе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ПРОИЗВОДНЫЕ МЕТИЛАМИНА С 1,2-АЗОЛЬНЫМИ ФР
АГМЕНТАМИ
1247
Таблица 1. Каталитическая активность комплексов палладия с N-метил-1-(1,2-азол-3-ил)метиламинами LPdCl2
(9-12) в реакции 3-бромбензойной кислоты с 4-метоксифенилборной кислотойа
№ опыта
Pd
T, °C
Время, мин
Выходб, %
1
L1PdCl2 (9)
20
5
100
2
L1PdCl2 (9)
100
<1
99
3
L1PdCl2 (9)в
100
5
100
4
L1PdCl2 (9)г
100
10
98
5
L2PdCl2 (10)
20
5
100
6
L2PdCl2 (10)
100
<1
100
7
L2PdCl2 (10)г
100
10
97
8
L3PdCl2 (11)
20
5
100
9
L3PdCl2 (11)
100
<1
98
10
L3PdCl2 (11)г
100
10
100
11д
L3PdCl2 (11)в
20
15
100
12
L4PdCl2 (12)
20
15
46
13
L4PdCl2 (12)
100
5
96
а ArBr (0.50 ммоль), Ar′B(OH)2 (0.60 ммоль), K2CO3 (1.25 ммоль), 0.1 мол% LPdCl2, 5 мл H2O.
б Выход по данным ЯМР 1Н относительно 0.5 ммоль тетрахлорэтана.
в 0.01 мол%.
г 0.001 мол%.
д Реакция с 3-иодбензойной кислотой.
нилборной кислоты с 3-бромбензойной кислотой
палладия 12 при комнатной температуре проявляет
(схема 2). Испытания проводили при 20 и 100°С в
меньшую активность, но при повышенной темпе-
присутствии комплексов палладия и карбоната ка-
ратуре достаточно активен (оп. № 12, 13).
лия в качестве основания на воздухе в отсутствие
Высокая каталитическая активность разрабо-
инертной атмосферы. Результаты испытания ката-
танных комплексов палладия, количественные
литической активности комплексов представлены
выходы и применение воды в качестве реакцион-
в табл. 1.
ной среды позволяют максимально упростить про-
Как следует из полученных данных, изоксазо-
цедуру выделения продуктов и сделать процесс
льные комплексы 9-11 проявляют очень высокую
кросс-сочетания более экологически безопасны-
каталитическую активность в широком интервале
ми. Для получения аналитически чистых образцов
температур. Например, в присутствии 0.1 мол%
реакционную смесь после завершения реакции
этих комплексов реакция завершается полностью
фильтровали, затем прибавляли 10-15% (по объ-
за 5 мин при 20°C, давая с количественным выхо-
ему) спирта, нагревали практически до кипения и
дом продукт кросс-сочетания - 4′-метокси[1,1′-би-
медленно подкисляли 10%-ной HCl при переме-
фенил]-3-карбоновую кислоту 13 (оп. № 1, 5, 8).
шивании. В результате получается мелкокристал-
При 100°C продолжительность реакции не пре-
лический, хорошо фильтрующийся осадок бифе-
вышает 1 мин (оп. № 2, 6, 9). При повышенной
нилкарбоновой кислоты 13.
температуре в водной среде при уменьшении ко-
Таким образом, разработан двухстадийный
личества катализатора в 10-100 раз время реакции
способ синтеза новых производных метиламина с
составляет не более 5-10 мин (TON до 105, TOF
1,2-азольными фрагментами. На их основе получе-
до 6×105 ч-1) (оп. № 3, 4, 7, 10). При использова-
ны высокоэффективные палладиевые катализато-
нии в реакции вместо арилбромида соответству-
ры для реакции Сузуки в водных средах. Синтези-
ющего иодпроизводного количество катализатора
рованные N-метил-1-(1,2-азол-3-ил)метиламины и
можно сократить на порядок даже при комнатной
их палладиевые комплексы представляют интерес
температуре (оп. № 11). Изотиазольный комплекс
для их биотестирования с целью выявления цито-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1248
АКИШИНА и др.
статической, антимикробной и фунгицидной ак-
спензии в 3-4 приема прибавляли 6 г (0.07 моль)
тивности.
гидрокарбоната натрия и перемешивали еще 2 ч.
Целевые амины экстрагировали диэтиловым эфи-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ром (3×50 мл), объединенные эфирные вытяжки
В работе использованы растворители и реакти-
сушили Na2SO4. Растворитель удаляли, остаток
вы квалификации ОСЧ с содержанием основного
сушили в вакууме.
компонента более 99.9%.
N-Метил-1-(5-фенилизоксазол-3-ил)метил-
ИК спектры записаны на Фурье-спектрофото-
амин (1). Выход 0.28 г (75%), т. пл. 39-40°С. ИК
метре Protege-460 Nicolet с приготовлением об-
спектр, ν, см-1: 3329, 3111, 3064, 2971, 2934, 2885,
разцов в виде таблеток с KBr. Спектры ЯМР 1Н и
2849, 2793, 1614, 1592, 1574, 1501, 1464, 1451,
13С записаны на спектрометре Avance-500 Bruker
1422, 1384, 1340, 1318, 1261, 1105, 1050, 948, 825,
и Bruker Avance II 400 в CDCl3 (1-4), ДМСО-d6
805, 765, 691. Спектр ЯМР 1H (500 МГц, CDCl3), δ,
(5-8) или ДМФА-d7 (9-12) относительно оста-
м. д.: 1.67 уш. с (1Н, NH), 2.47 с (3Н, МеN), 3.83 с
точных сигналов растворителей. Исследования
(2Н, СН2), 6.50 с (СНизокс), 7.37-7.43 м (3НAr), 7.71-
методом ВЭЖХ-МС выполнены с использова-
7.75 м (2НAr). Спектр ЯМР 13C (125 МГц, CDCl3), δC,
нием жидкостного хроматографа Agilent 1200 с
м. д.: 36.16 (МеN), 46.89 (СН2), 98.89 (CHизокс),
масс-селективным детектором Agilent 6410 Triple
125.82 (2CHAr), 129.01 (2CHAr), 130.15 (1CHAr),
Quad в режиме Positive ESI MS2 Scan. Колонка
127.56, 163.49, 169.99 (3Счетв). Масс-спектр, m/z
ZORBAX Eclipse XDB-C18 (4.6 × 50 мм; 1.8 мкм).
(Iотн, %): 189.10 (84) [M+Н]+. Найдено, %: C 70.23;
Мобильная фаза: смесь воды, содержащей 0.05%
H 6.58; N 14.77. C11H12N2O. Вычислено, %: C
(по объему) муравьиной кислоты, и ацетонитрила
70.19; H 6.43; N 14.88.
(от 40 до 90% за 10 мин), скорость элюирования -
N-Метил-1-[5-(п-толил)изоксазол-3-ил]мети-
0.5 мл/мин. Элементный анализ C,H,N,S-содержа-
ламин (2). Выход 0.27 г (66%), масло. ИК спектр,
щих соединений выполнен на CHNS-анализаторе
ν, см-1: 3317, 3129, 3059, 3032, 2970, 2923, 2884,
Vario MICRO cube V1.9.7. Содержание палладия
2854, 2796, 1619, 1599, 1568, 1515, 1465, 1432,
в комплексах определено методом атомно-абсорб-
1384, 1342, 1315, 1289, 1260, 1184, 1170, 1112,
ционной спектрометрии на спектрометре АО Ак-
1048, 1020, 1011, 948, 890, 823, 801, 716, 680, 506.
вилон МГА-915. Контроль за ходом реакций осу-
Спектр ЯМР 1H (500 МГц, CDCl3), δ, м. д.: 2.03 уш.
ществлен методом ТСХ на пластинах Merck Silica
с (1Н, NH), 2.34 с (3Н, МеAr), 2.46 с (3Н, МеN),
gel 60 F254.
3.82 с (2Н, СН2), 6.45 с (СНизокс), 7.19 д (2НAr, J
N-Метил-1-(5-арилизоксазол- или 4,5-дихло-
7.8 Гц), 7.60 д (2НAr, J 7.8 Гц). Спектр ЯМР 13C
ризотиазол-3-ил)метиламины
1-4 (общая
(125 МГц, CDCl3), δC, м. д.: 21.44 (МеAr), 36.04
методика). Смесь
2 ммоль соответствующего
(МеN), 46.79 (СН2), 98.27 (CHизокс), 125.70 (2CHAr),
5-арилизоксазол- или 4,5-дихлоризотиазол-3-кар-
129.64
(2CHAr), 124.78, 140.38, 163.27,
170.16
бальдегида, 0.15 г (2.1 моль) гидрохлорида мети-
(4Счетв). Найдено, %: C 71.38; H 7.12; N 13.78.
ламина и 2 г (2.4 моль) гидрокарбоната натрия в
Масс-спектр, m/z (Iотн, %): 203.10 (84) [M+Н]+.
50 мл абсолютного метанола перемешивали
C12H14N2O. Вычислено, %: C 71.26; H 6.98; N
96 ч при 20°С, периодически прибавляя порциями
13.85.
(3×0.15 г, 2.1 моль) гидрохлорид метиламина. Ре-
N-Метил-1-[5-(2,5-диметилфенил)изокса-
акционную смесь фильтровали через стеклянный
зол-3-ил]метиламин (3). Выход 0.30 г (69%), мас-
фильтр Шотта, растворитель удаляли в вакууме.
ло. ИК спектр, ν, см-1: 3320, 3175, 3133, 3046, 3024,
Остаток, содержащий азометин и хлорид на-
2975, 2925, 2867, 2850, 2794, 1584, 1505, 1460,
трия, суспендировали в 50 мл безводного изопро-
1423, 1383, 1341, 1300, 1290, 1257, 1200, 1180,
пилового спирта. К полученной смеси при пере-
1150, 1134, 1104, 1047, 1012, 962, 917, 890, 858,
мешивании при 20°С в течение 96 ч прибавляли
810, 730, 687, 550, 454. Спектр ЯМР 1H (500 МГц,
порциями (8×0.04 г, 0.001 моль) боргидрид натрия.
CDCl3), δ, м. д.: 1.93 уш. с (1Н, NH), 2.35 с (3Н,
Растворитель удаляли, остаток разбавляли водой
Ме2Ar), 2.44 с (3Н, МеN), 2.52 с (3Н, Me2Ar), 3.89 с
(50 мл) и перемешивали 2 ч. К полученной су-
(2Н, СН2), 6.41 с (СНизокс), 7.07-7.21 м (2НAr), 7.52
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ПРОИЗВОДНЫЕ МЕТИЛАМИНА С 1,2-АЗОЛЬНЫМИ ФР
АГМЕНТАМИ
1249
с (1НAr). Спектр ЯМР 13C (125 МГц, CDCl3), δC,
1622, 1600, 1571, 1516, 1480, 1471, 1459, 1437,
м. д.: 20.98 (Ме2С6Н4), 21.12 (Ме2Ar), 36.27 (МеN),
1424, 1353, 1323, 1289, 1260, 1184, 1115, 1052,
47.04 (СН2), 101.97 (CHизокс), 129.01 (CHAr), 130.82
1037, 1011, 970, 950, 920, 870, 837, 807, 760, 716,
(CHAr),
131.38 (CHAr),
126.95,
133.14,
135.86,
682, 652, 504, 420. Спектр ЯМР 1H (500 МГц,
163.02, 170.28 (5Счетв). Масс-спектр, m/z (Iотн, %):
ДМСО-d6), δ, м. д.: 2.36 с (3Н, МеAr), 2.61 с (3Н,
217.10 (84) [M + Н]+. Найдено, %: C 72.32; H 7.59;
МеN), 4.29 с (2Н, СН2), 7.21 с (СНизокс), 7.36 д
N 12.78. C13H16N2O. Вычислено, %: C 72.19; H
(2НAr, J 7.8 Гц), 7.72 д (2НAr, J 7.7 Гц), 9.95 уш. с
7.46; N 12.95.
(2Н, NH+). Спектр ЯМР 13C (125 МГц, ДМСО-d6),
δC, м. д.: 21.61 (МеAr), 32.95 (МеN), 43.15 (СН2),
N-Метил-1-(4,5-дихлоризотиазол-3-ил)метил-
100.58 (CHизокс), 126.16 (2CHAr), 130.54 (2CHAr),
амин (4). Выход 0.26 г (65%), масло. ИК спектр,
124.27, 141.38, 158.17, 170.51 (4Счетв). Найдено, %:
ν, см-1: 3327, 3083, 2975, 2941, 2867, 2850, 2796,
C 60.49; H 6.45; Cl 14.55; N 11.68. C12H15ClN2O.
1611, 1509, 1474, 1449, 1373, 1334, 1300, 1169,
Вычислено, %: C 60.38; H 6.33; Cl 14.85; N 11.74.
1114, 1084, 967, 922, 892, 844, 807, 777, 761, 717,
М 238.72.
621, 511, 435. Спектр ЯМР 1H (500 МГц, CDCl3),
Гидрохлорид
N-метил-1-[5-(2,5-диметил-
δ, м.д.: 1.93 уш.с (1Н, NH), 2.47 с (3Н, МеN), 3.86
фенил)изоксазол-3-ил]метиламина
(7). Выход
с (2Н, СН2). Спектр ЯМР 13C (125 МГц, CDCl3),
0.20 г (81%), т. пл. 188-190°С. ИК спектр, ν, см-1:
δ, м.д.: 36.15 (МеN), 51.71 (СН2), 122.30, 147.70,
3160, 3136, 2957, 2924, 2848, 2761, 2700, 2560,
165.76 (3Счетв). Масс-спектр, m/z (Iотн, %): 198.10
2441, 1592, 1578, 1506, 1475, 1458, 1436, 1413,
(84) [M+Н]+. Найдено, %: C 30.82; H 3.17; Cl 35.68;
1380, 1360, 1294, 1170, 1147, 1050, 1038, 1010, 963,
N 14.01; S 16.03. C5H6Cl2N2S. Вычислено, %: C
949, 935, 880, 816, 764, 730, 690, 650, 549, 455.
30.47; H 3.07; Cl 35.98; N 14.21; S 16.27.
Спектр ЯМР 1H (500 МГц, ДМСО-d6), δ, м. д.: 2.33
Гидрохлориды аминов 5-8 (общая методика).
с (3Н, Ме2Ar), 2.41 с (3Н, МеN), 2.62 с (3Н, Me2Ar),
Через раствор 1 ммоль амина 1-4 в 20 мл абсо-
4.32 с (2Н, СН2), 7.19 с (СНизокс), 7.21-7.25 м
лютного эфира в течение 15 мин пропускали газо-
(1НAr), 7.26-7.31 м (1НAr), 7.53 с (1НAr), 9.99 уш. с
образный сухой HCl. Осадок гидрохлорида амина
(2Н, NH+). Спектр ЯМР 13C (125 МГц, ДМСО-d6),
отделяли фильтрованием на стеклянном пористом
δC, м.д.: 20.98 (Ме2Ar), 21.16 (Ме2Ar), 32.88 (МеN),
фильтре и сушили в вакууме.
43.18 (СН2), 104.17 (CHизокс), 128.78 (CHAr), 131.76
Гидрохлорид
N-метил-1-(5-фенилизокса-
(CHAr),
132.11 (CHAr),
126.31,
133.33,
136.30,
зол-3-ил)метиламина (5). Выход 0.18 г (79%),
157.92, 170.17 (5Счетв). Найдено, %: C 61.90; H
т. пл. 200-202°С. ИК спектр, ν, см-1: 3126, 2985,
6.81; Cl 13.85; N 10.79. C13H17ClN2O. Вычислено,
2963, 2922, 2852, 2783, 2762, 2705, 2558, 2435,
%: C 61.78; H 6.78; Cl 14.03; N 11.08. М 252.74.
1613, 1594, 1575, 1504, 1478, 1451, 1432, 1422,
Гидрохлорид N-метил-1-(4,5-дихлоризоти-
1354, 1331, 1289, 1257, 1191, 1075, 1053, 1037, 1012,
азол-3-ил)метиламина (8). Выход 0.18 г (78%),
970, 949, 921, 815, 763, 687, 672, 644, 495. Спектр
т. пл. 174-176°С. ИК спектр, ν, см-1: 2960, 2930,
ЯМР 1H (500 МГц, ДМСО-d6), δ, м. д.: 2.62 с (3Н,
2767, 2689, 2592, 2432, 1602, 1581, 1515, 1469, 1444,
МеN), 4.31 с (2Н, СН2), 7.28 с (СНизокс), 7.49-7.60
1430, 1420, 1378, 1321, 1168, 1147, 1097, 1049, 982,
м (3НAr), 7.81-7.87 м (2НAr), 9.94 уш. с (2H, NH2+).
951, 867, 849, 816, 554, 515, 434. Спектр ЯМР 1H
Спектр ЯМР 13C (125 МГц, ДМСО-d6), δC, м. д.:
(500 МГц, ДМСО-d6), δ, м. д.: 2.66 с (3Н, МеN),
32.94 (МеN), 43.13 (СН2), 101.27 (CHизокс), 126.21
4.32 с (2Н, СН2), 9.90 уш.с (2Н, NH+). Спектр ЯМР
(2CHAr),
130.02
(2CHAr), 131.42 (CHAr), 126.92,
13C (125 МГц, ДМСО-d6), δ, м. д.: 33.44 (МеN),
158.26, 170.34 (3Счетв). Найдено, %: C 58.99; H
47.43 (СН2), 122.37, 148.83, 159.55 (3Счетв.). Най-
5.91; Cl 15.55; N 12.36. C11H13ClN2O. Вычислено,
дено, %: C 25.92; H 3.08; Cl 45.32; N 11.82; S 13.55.
%: C 58.80; H 5.83; Cl 15.78; N 12.47. М 224.69.
C5H7Cl3N2S. Вычислено, %: C 25.72; H 3.02; Cl
Гидрохлорид N-метил-1-[5-(п-толил)изок-
45.54; N 12.00; S 13.73. М 233.54.
сазол-3-ил]метиламина (6). Выход 0.19 г (78%),
Общая методика синтеза комплексов палла-
т. пл. 234-236°С. ИК спектр, ν, см-1: 3127, 3017,
дия с N-метил-1-(1,2-азол-3-ил)метиламинами
2988, 2958, 2920, 2856, 2763, 2705, 2558, 2435,
(9-12). 10 мл (1 ммоль) 0.1 М. раствора Na2PdCl4
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1250
АКИШИНА и др.
в метаноле разбавляли 10 мл метанола и к полу-
Дихлор{N-метил-1-[5-(2,5-диметилфенил)-
ченному раствору при перемешивании прибавля-
1,2-оксазол-3-ил-κN]метанамин-κN}палладий
ли раствор 1 ммоль соответствующего лиганда 1-4
(11). Выход 0.378 г (96%), светло-оранжевый поро-
в 50 мл MeOH при комнатной температуре. При
шок, т. пл. >250°С (разл.). ИК спектр, ν, см-1: 3483,
смешении реагентов характерная красно-коричне-
3458, 3169, 3133, 3026, 2957, 2935, 2867, 1615,
вая окраска раствора Na2PdCl4 быстро переходила
1577, 1495, 1471, 1416, 1390, 1328, 1292, 1253,
в желто-оранжевую, и наблюдалось образование
1200, 1167, 1140, 1088, 1056, 1030, 992, 960, 933,
светло-коричневого осадка. Анализ реакционной
886, 867, 808, 725, 679, 625, 538. Спектр ЯМР 1H
смеси через 5 мин методом ТСХ (элюент - эфир-
(400 МГц, ДМФА-d7), δ, м. д.: 2.36 с (3H, 5-МеAr),
метанол, 3:0.1) показал отсутствие исходных ли-
2.47 с (3H, 2-МеAr), 2.78 д (3H, MeN, J 5.9 Гц),
гандов. Затем смесь дополнительно перемешива-
3.98 д. д (1Н, СН2, J 17.0, 3.7 Гц), 4.49 д. д (1H,
ли в течение 1 ч. После удаления растворителя,
СН2, J 17.0, 6.7 Гц), 6.50 уш. с (H, NH), 7.23 с (1H,
остаток промывали водой, метанолом и сушили
Н4изокс), 7.34 м (2H, H3,4), 7.56 с (1H, H6). Спектр
при комнатной температуре.
ЯМР 13C (100 МГц, ДМФА-d7), δC, м. д.: 20.6 (2-
Дихлор[N-метил-1-(5-фенил-1,2-оксазол-
MeAr), 20.7 (5-MeAr), 42.3 (MeN), 53.0 (СН2),
3-ил-κN)метанамин-κN]палладий
(9).
Выход
103.2 (C4изокс), 125.5 (С1), 129.5 (C6), 132.5 (C4),
0.271 г (74%), светло-коричневый порошок, т. пл.
133.0 (С3), 134.6 (С4), 136.9 (С5), 169.3 (С3изокс),
259°С (разл.). ИК спектр, ν, см-1: 3146, 3114, 2924,
172.0 (С5изокс). Найдено, %: C 39.57; H 4.19; N 7.04;
2854, 1604, 1590, 1570, 1510, 1466, 1445, 1425,
Pd 26.91. C13H16Cl2N2OPd. Вычислено, %: C 39.67;
1400, 1377, 1317, 1280, 1253, 1073, 1043, 1023,
H 4.10; Cl 18.01; N 7.12; O 4.06; Pd 27.04.
948, 923, 817, 767, 689. Спектр ЯМР 1H (500 МГц,
Дихлор[N-метил-1-(4,5-дихлор-1,2-тиазол-
ДМФА-d7), δ, м. д.: 2.76 д (3Н, МеN, J 5.9 Гц,),
3-ил-κN)метанамин-κN}палладий
(12). Выход
3.96 д. д (1Н, СН2, J 17.0, 3.7 Гц), 4.46 д. д (1Н,
0.332 г (89%), светло-коричневый порошок, т. пл.
СН2, J 17.0, 6.7 Гц), 6.45 уш. с (H, NH), 7.42 с (1H,
>260°С (разл.). ИК спектр, ν, см-1: 3527, 3458, 3162,
Н4изокс), 7.57-7.64 м (3Н, H3,4,5), 7.87-7.93 м (2Н,
2932, 2018, 1633, 1608, 1513, 1447, 1431, 1393,
H2,6). Спектр ЯМР 13C (125 МГц, ДМФА-d7), δC,
1319, 1112, 1076, 996, 940, 923, 845, 569. Спектр
м. д.: 42.1 (MeN), 52.7 (СН2), 100.4 (C4изокс), 126.1 (С1),
ЯМР 1H (400 МГц, ДМФА-d7), δ, м. д.: 2.77 д (3H,
126.6 (С2,6), 130.0 (С3,5), 132.4 (С4), 169.56 (C3изокс),
MeN, J 5.9 Гц) 4.12 д. д (1H, CH2, J 17.5, 4.4 Гц),
171.4 (C5изокс). Найдено, %: C 36.23; H 3.39; N 7.52;
4.62 д. д (1H, CH2, J 17.4, 6.7 Гц), 6.59 уш. с (1Н,
Pd 29.22. C11H12Cl2N2OPd. Вычислено, %: C 36.14;
NH). Спектр ЯМР 13C (100 МГц, ДМФА-d7), δC,
H 3.31; Cl 19.40; N 7.66; O 4.38, Pd 29.11.
м. д.: 42.3 (MeN), 59.9 (CH2), 120.9 (C4изотиазол),
Дихлор{N-метил-1-[5-(4-метилфенил)-1,2-
149.4 (C5изотиазол),
173.3 (C3изотиазол). Найде-
оксазол-3-ил-κN]метанамин-κN}палладий (10).
но, %: C 15.95; H 1.70; N 7.39; Pd 28.31; S 8.48.
Выход 0.353 г (93%), желто-оранжевый порошок,
C5H6Cl4N2PdS. Вычислено, %: C 16.04; H 1.62; Cl
т. пл. >265°С (разл.). ИК спектр, ν, см-1: 3531, 3154,
37.88; N 7.48; Pd 28.42; S 8.56.
3114, 3055, 3034, 2944, 1611, 1590, 1565, 1519,
Каталитическая активность комплексов
1476, 1416, 1394, 1329, 1314, 1279, 1254, 1184,
1123, 1080, 1036, 1016, 948, 922, 811, 715, 677,
палладия с N-метил-1-(1,2-азол-3-ил)метила-
638, 620. Спектр ЯМР 1H (400 МГц, ДМФА-d7), δ,
минами в реакции Сузуки. К смеси 0.6 ммоль
м. д.: 2.41с (3H, МеAr), 2.78 д (3H, MeN, J 5.9 Гц),
арилборной кислоты,
0.5 ммоль арилбромида
3.97 д. д (1Н, СН2, J 17.0, 3.7 Гц), 4.48 д. д (1H,
и 1.25 ммоль K2CO3 в 5 мл Н2О добавляли 0.1-
СН2, J 17.0, 6.7 Гц), 6.50 уш. с (H, NH), 7.39 с (1H,
0.001 мол% LPdCl2. Реакционную смесь интен-
Н4изокс), 7.44 д (2H, H3,5, J 8.1 Гц), 7.81 д (2H, H2,6,
сивно перемешивали при соответствующей тем-
J 8.2 Гц). Спектр ЯМР 13C (100 МГц, ДМФА-d7),
пературе (табл. 1). Ход реакций контролировали
δC, м. д.: 21.3 (MeAr), 42.2 (MeN), 52.8 (СН2), 99.9
методом ТСХ (элюент - гексан-Et2O, 3:1) с при-
(C4изокс), 123.5 (С1), 126.6 (C2,6), 130.7 (C3,5), 143.2
менением калибровочных растворов соответ-
(С4), 169.6 (С3изокс), 171.7 (С5изокс). Найдено, %: C
ствующего биарила и арилбромида (при мольном
37.89; H 3.81; N 7.30; Pd 27.93. C12H14Cl2N2OPd.
соотношении 1:1 и 9:1). Выход продукта опре-
Вычислено, %: C 37.97; H 3.72; Cl 18.68; N 7.38; O
деляли методом ЯМР 1H при использовании те-
4.22; Pd 28.04.
трахлорэтана (0.5 ммоль) в качестве внутреннего
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
ПРОИЗВОДНЫЕ МЕТИЛАМИНА С 1,2-АЗОЛЬНЫМИ ФР
АГМЕНТАМИ
1251
стандарта. Для выделения продукта кросс-сочета-
СПИСОК ЛИТЕРАТУРЫ
ния реакционную смесь разбавляли водой, нагре-
1.
Мусатов Д.М., Стародубцева Е.В., Ракишев А.К.,
вали, фильтровали, затем добавляли 10-15% (по
Турова О.В., Виноградов М.Г. // ЖОрХ. 2011. Т. 47.
объему) этилового спирта, нагревали до ~50°C и
Вып. 8. С. 1181; Musatov D.M., Starodubtseva E.V.,
медленно подкисляли 5%-ной HCl до pH 2-3 при
Rakishev A.K., Turova O.V., Vinogradov M.G. // Russ.
J. Org. Chem. 2011. Vol. 47. N 8. P. 1199. doi 10.1134/
перемешивании. В итоге формируются хорошо
s1070428011080136
фильтрующиеся осадки, и без применения хрома-
2.
Young R.J., Borthwick A.D., Brown D., Burns-
тографических методов получаются аналитически
Kurtis C.L., Campbell M., Chan C., Charbaut M.,
чистые образцы продуктов кросс-сочетания.
Convery M.A., Diallo H., Hortense E., Irving W.R.,
Kelly H.A., King N.P., Kleanthous S., Mason A.M.,
4′-Метокси-[1,1′-бифенил]-3-карбоновая
Pateman A.J., Patikis A.N., Pinto I.L., Pollard D.R.,
кислота (13). Выход 0.112 г (97%), белый кристал-
Senger S., Shah G.P., Toomey J.R., Watson N.S.,
лический порошок, т. пл. 203-204°C (т. пл. 202-
Westona H.E., Zhoua P. // Bioorg. Med. Chem. Lett.
203°C [13]). Спектр ЯМР 1H (400 МГц, ДМСО-d6),
2008. Vol. 18. N 1. P. 28. doi 10.1016/j.bmcl.2007.11.019
δ, м. д.: 3.83 с (3H, MeO), 7.05 д. д (2H, H3’,5’, J 6.8,
3.
Banert K., Hagedorn M., Hemeltjen C., Ihle A.,
2.1 Гц), 7.56 т (1H, НAr, J 7.7 Гц), 7.66 д. д (2H,
Weigand K., Priebe H. // Arkivoc. 2016. N 5. P. 338.
doi 10.24820/ark.5550190.p009.846
H2’,6’, J 6.8, 2.1 Гц), 7.83-7.94 м (2H, НAr), 8.11 д.
4.
Cromwell B.T. // Biochem J. 1949. Vol. 45. N 1. P. 84.
д (1H, H4, J 7.8, 2.0 Гц), 13.12 уш. с (1H, COOH).
doi 10.1042/bj0450084
Спектр ЯМР 13С (100 МГц, ДМСО-d6), δС, м. д.:
5.
Eller K., Henkes E., Rossbacher R., Höke H. Amines,
54.3 (MeO), 114.0, 127.2, 127.4, 127.6, 128.5, 130.6,
Aliphatic. Ullmann’s Encyclopedia of Industrial
131.0, 132.4, 141.0, 159.7, 168.5 (COOH). Найде-
Chemistry. Weinheim: Wiley-VCH Verlag GmbH &
но, %: C 73.64; H 5.37. C14H12O3. Вычислено, %: C
Co. KGaA, 2012. Vol. 2. P. 648. doi 10.1002/14356007.
a02_001
73.67; H 5.30.
6.
Kletskov A.V., Bumagin N.A., Petkevich S.K., Diku-
ИНФОРМАЦИЯ ОБ АВТОРАХ
sar E.A., Lyakhov A.S., Ivashkevich L.S., Kolesnik I.A.,
Potkin V.I. // Inorg. Chem. 2020. Vol. 59. N 15. P. 10384.
Акишина Екатерина Александровна, ORCID:
doi 10.1021/acs.inorgchem.0c01035
7.
Kletskov A.V., Bumagin N.A., Zubkov F.I., Grudi-
Дикусар Евгений Анатольевич, ORCID: http://
nin D.G., Potkin V.I. // Synthesis. 2020. Vol. 52. N 2.
P. 159. doi 10.1055/s-0039-1690688
orcid.org/0000-0002-3868-1871
8.
Бумагин Н.А., Петкевич С.К., Клецков А.В., Пот-
Петкевич Сергей Константинович, ORCID:
кин В.И. // ХГС. 2017. Т. 53. Вып. 12. С. 1340;
Bumagin N.A., Petkevich S.K., Kletskov A.V., Pot-
kin V.I. // Chem. Heterocycl. Compd. 2017. Vol. 53. N
12. P. 1340. doi 10.1007/s10593-018-2216-z
org/0000-0002-3714-0379
9.
Бумагин Н.А., Петкевич С.К., Клецков А.В., Алексе-
Бумагин Николай Александрович, ORCID:
ев Р.С., Поткин В.И. // ХГС. 2019. Т. 55. Вып. 6.
С. 508; Bumagin N.A., Petkevich S.K., Kletskov A.V.,
Alekseev R.S., Potkin V.I. // Chem. Heterocycl. Compd.
Поткин Владимир Иванович, ORCID: http://
2019. Vol. 55. N 6. P. 508. doi 10.1007/s10593-019-
orcid.org/0000-0003-0250-837X
02492-8
ФОНДОВАЯ ПОДДЕРЖКА
10.
Бумагин Н.А., Поткин В.И. // Изв. АН. Сер. хим.
2016. № 2. C. 321; Bumagin N.A., Potkin V.I. // Russ.
Работа выполнена при частичной финансовой
Chem. Bull. 2016. Vol. 65. N 2. P. 321. doi 10.1007/
поддержке Российского фонда фундаментальных
s11172-016-1306-2
исследований (грант 20-58-00005-Бел_a) и Бело-
11.
Bumagin N.A. // Catal. Commun. 2016. Vol. 79. P. 17.
doi 10.1016/j.catcom.2016.02.016
русского республиканского фонда фундаменталь-
12.
Potkin V.I., Bumagin N.A., Petkevich S.K., Lyakhov A.S.,
ных исследований (грант Х20Р-017).
Rudakov D.A., Livantsov M.V., Golantsov N.E. //
КОНФЛИКТ ИНТЕРЕСОВ
Synthesis. 2012. Vol. 44. N 1. P. 151. doi 10.1055/s-
0031-1289618
Авторы заявляют об отсутствии конфликта
13.
Dauben W. G., Tanabe M. // J. Am. Chem. Soc. 1953.
интересов.
Vol. 75. N 20. P. 4969. doi 10.1021/ja01116a026
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1252
АКИШИНА и др.
Methylamine Derivatives with 1,2-Azole Fragments:
Synthesis, Palladium Complexes, Catalysis
of the Suzuki Reaction
E. A. Akishinaa,*, Е. А. Dikusara, S. K. Petkevicha, R. S. Alekseyevb,
N. A. Bumaginb, and V. I. Potkina
a Institute of Physical Organic Chemistry, National Academy of Sciences of Belarus, Minsk, 220072 Belarus
b Lomonosov Moscow State University, Moscow, 119991 Russia
*e-mail: che.semenovaea@mail.ru
Received May 24, 2021; revised June 3, 2021; accepted June 7, 2021
New methylamine derivatives with 1,2-azole fragments (phenylisoxazole, p-tolylisoxazole, 2,5-dimethylphenyli-
soxazole and 4,5-dichloroisothiazole) and their palladium complexes were synthesized. It was shown that
palladium complexes with the obtained N-methyl-1-(1,2-azol-3-yl)methylamine exhibit high catalytic activity
in the Suzuki reaction in aqueous medium.
Keywords: methylamine, 5-arylisoxazoles, 4,5-dichloroisothiazole, palladium complexes, catalysis, Suzuki
reaction
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021