ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 8, с. 1261-1268
УДК 541.572.128
РЕАКЦИЯ МЕТАЛЛООБМЕНА
о,о′-ДИГАЛОГЕНЗАМЕЩЕННЫХ
ТЕТРАФЕНИЛПОРФИРИНАТОВ Cd(II) С СОЛЯМИ
d-МЕТАЛЛОВ В ДМФА
© 2021 г. С. В. Звездина*, Н. В. Чижова, Н. Ж. Мамардашвили
Институт химии растворов имени Г. А. Крестова Российской академии наук,
ул. Академическая 1, Иваново, 153040 Россия
*е-mail: svvr@isc-ras.ru
Поступило в Редакцию 24 мая 2021 г.
После доработки 24 мая 2021 г.
Принято к печати 10 июня 2021 г.
Спектрофотометрическим методом изучены реакции металлообмена 5,10,15,20-тетра-(2,6-дихлорфенил)-
порфирината Cd(II) и 5,10,15,20-тетра-(2,6-дифторфенил)порфирината Cd(II) с хлоридами кобальта и
цинка в ДМФА. Рассчитаны кинетические параметры металлообмена, предложен возможный стехи-
ометрический механизм. Синтезированы и идентифицированы методами электронной абсорбцион-
ной, ЯМР 1Н спектроскопии и масс-спектрометрии комплексы цинка(II) и кобальта(II) с 5,10,15,20-
тетра-(2,6-дихлорфенил)порфирином и 5,10,15,20-тетра-(2,6-дифторфенил)порфирином.
Ключевые слова: тетракис(2,6-дигалогенофенил)порфирины, комплексы Cd(II), реакции металлооб-
мена, электронная спектроскопия поглощения
DOI: 10.31857/S0044460X2108014X
Все проявления жизни на Земле так или иначе
превращаются в новые металлопорфирины [9, 10].
связаны с фотосинтетической функцией растений,
Реакция металлообмена (1) может быть использо-
в основе которой лежит вещество, имеющее пор-
вана для получения заданных металломолекуляр-
фириновую структуру. Реакции металлообмена
ных структур на поверхностях, причем отмечается
с природными порфиринами протекают в биоси-
возможность металлообмена при взаимодействии
стемах животных и растений и играют важную
тетрафенилпорфиринатов Fe(II) и Cu(II) с метал-
роль в регулировании биологических процессов.
лическим кобальтом [11].
Впервые возможные механизмы металлообмена
MР + M′Xn(Solv)m-n → M′Р + MXn(Solv)m-n.
(1)
природных и синтетических металлопорфиринов
Здесь МP и M′P
- металлопорфирины,
в органических растворителях обсуждались в ра-
M′Xn(Solv)m-n - сольваты солей металлов.
ботах [1-6].
Исследование действия различных факторов
Реакции металлообмена нашли практическое
на протекание металлообмена в растворах метал-
применение в синтезе труднодоступных комплек-
лопорфиринов позволяет не только лучше понять
сов природных и синтетических порфиринов и
механизм процесса, но и подобрать оптимальные
фталоцианинов. В качестве исходных соединений
условия синтеза металлопорофиринов, образую-
используют лабильные комплексы порфиринов с
щихся по реакции (1). Нами изучены реакции ме-
ионами Cd(II) и Mg(II) [7, 8], которые в условиях
таллообмена 5,10,15,20-тетра-(2,6-дихлорфенил)-
реакции металлообмена с солями металлов легко
порфирината Cd(II) 1 и 5,10,15,20-тетра-(2,6-ди-
1261
1262
ЗВЕЗДИНА и др.
Схема 1.
R
R
R
R
R
R
R
R
N
N
N
N
MCl2
Cd
M
ДМФА
N
N
N
N
R
R
R
R
R
R
R
R
3-6
1, 2
R = Cl (1, 3, 4), F (2, 5, 6); М = Zn(II) (3, 5), Co(II) (4, 6).
фторфенил)порфирината Cd(II) 2 с хлоридами ко-
В ходе исследования металлообмена комплексов
бальта и цинка в диметилформамиде (схема 1).
кадмия 1 и 2 с CoCl2 и ZnCl2 в ДМФА обнаружено,
что порядок реакции по соли, определенный как
Изменения ЭСП в ходе реакций металлообмена
тангенс угла наклона прямолинейной зависимости
соединений 1 и 2 с CoCl2 и ZnCl2 в ДМФА пред-
lоgkэф = f(lоgссоли), равен единице во всех случаях,
ставлены на рис. 1, полученные эксперименталь-
и кинетическое уравнение реакции металлообме-
ные данные приведены в табл. 1-4.
на соединений 1 и 2 с CoCl2 и ZnCl2 в ДМФА имеет
Экспериментальные данные показывают, что
вид (2).
скорость металлообмена соединений 1 и 2 с CoCl2
-dсMР/dτ = kv[MP][МCl2],
(2)
и ZnCl2 в ДМФА описывается уравнением пер-
МР = 1, 2, МCl2 = CoCl2, ZnCl2.
вого порядка по кадмиевому комплексу. Об этом
свидетельствует прямолинейная зависимость
Из данных табл. 1-4 следует, что реакция ме-
lоg(с0MP/сMP) от времени прохождения реакции τ
таллообмена соединений 1 и 2 с CoCl2 и ZnCl2 в
(рис. 2).
ДМФА протекает по бимолекулярному ассоциа-
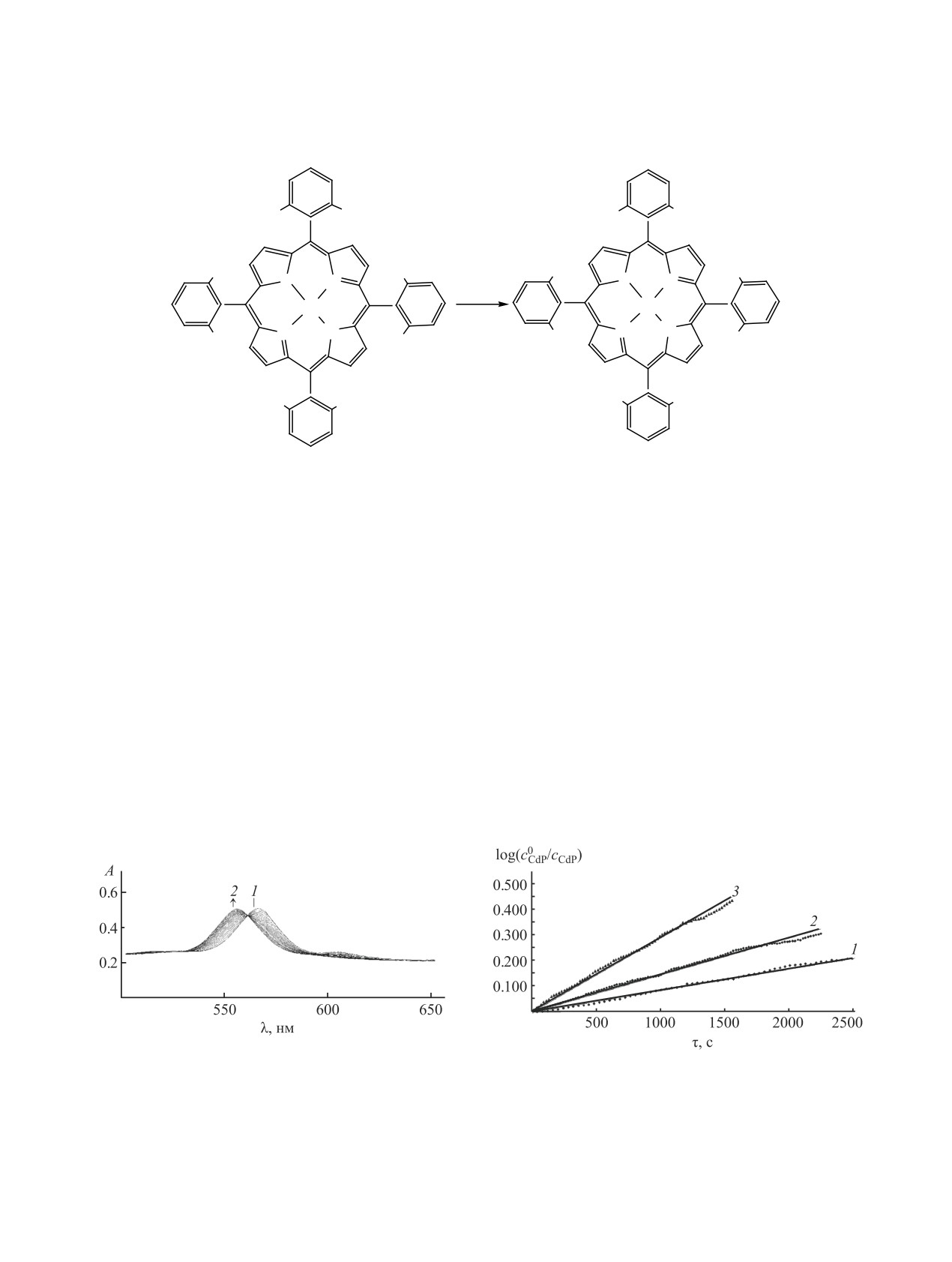
Рис. 1. Изменение ЭСП в ходе реакции металлообмена
5,10,15,20-тетра-(2,6-дифторфенил)порфирината Сd(II)
Рис. 2. Зависимость lоg(с0CdP/сCdP) от времени взаимо-
2 с ZnCl2 в ДМФА при 343 K в начальный момент
действия 5,10,15,20-тетра-(2,6-дифторфенил)порфи-
времени (1) и через 80 мин (2). сCdP 2.5×10-5 моль/л;
рината Сd(II) 2 с ZnCl2 в ДМФА при 323 (1), 333 (2),
сZnCl
2.5×10-3 моль/л.
343 K (3). с
ZnCl2
2.5×10-3 моль/л.
2
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
РЕАКЦИЯ МЕТАЛЛООБМЕНА
1263
Таблица 1. Скорости обмена Cd2+ на Cо2+ в комплексе 5,10,15,20-тетра-(2,6-дихлорфенил)порфирината Сd(II) в
ДМФА (сСdР 2.5×10-5 моль/л)
сCоCl
Т, K
kэф×104, с-1
kv×102, л/(моль∙с)
Еа, кДж/моль
ΔS≠, Дж/(моль∙K)
2
×103, моль/л
2.5
298
0.38a
1.52
37±15
-208±50
338
2.20±0.07
8.80
343
2.88±0.10
11.52
348
3.22±0.14
12.88
а Рассчитанное значение.
Таблица 2. Скорости обмена Cd2+ на Zn2+ в комплексе 5,10,15,20-тетра-(2,6-дихлорфенил)порфирината Сd(II) в
ДМФА (сСdР 2.5×10-5 моль/л)
сZnCl
×102, моль/л
Т, K
kэф×104, с-1
kv×103, л/(моль∙с)
Еа, кДж/моль
ΔS≠, Дж/(моль∙K)
2
1.25
298
0.81a
6.48
36±8
-211±26
333
3.79±0.09
30.32
343
5.10±0.07
40.80
353
7.89±0.37
63.12
1.0
298
0.70a
7.00
32±1
-224±4
333
2.78±0.0
27.80
343
3.96±0.06
39.60
353
5.41±0.23
54.10
0.75
298
0.52a
6.93
32±8
-228±26
333
2.07±0.10
27.60
343
2.67±0.12
35.60
353
3.97±0.15
52.94
а Рассчитанное значение.
Таблица 3. Скорости обмена Cd2+ на Со2+ в комплексе 5,10,15,20-тетра-(2,6-дихлорфенил)порфирината Сd(II) в
ДМФА (сСdР 2.5×10-5 моль/л)
сСоCl
×103, моль/л
Т, K
kэф×104, с-1
kv×102, л/(моль∙с)
Еа, кДж/моль
ΔS≠, Дж/(моль∙K)
2
2.5
298
1.35a
5.40
71±13
-90±42
303
2.27± 0.09
9.08
313
4.76±0.11
19.04
323
12.86±0.32
51.44
2.0
298
1.09a
5.45
73±11
-84±38
303
1.86±0.06
9.30
313
4.08± 0.11
20.40
323
11.14±0.50
55.70
1.5
298
0.9a
6.07
69±17
-98±57
303
1.55± 0.06
10.33
313
3.02± 0.09
20.13
323
8.46±0.29
56.40
а Рассчитанное значение.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1264
ЗВЕЗДИНА и др.
Таблица 4. Скорости обмена Cd2+ на Zn2+ в комплексе 5,10,15,20-тетра-(2,6-дихлорфенил)порфирината Сd(II) в
ДМФА (сСdР 2.5×10-5 моль/л)
сZnCl
×103, моль/л
Т, K
kэф×104, с-1
kv×102, л/(моль∙с)
Еа, кДж/моль
ΔS≠, Дж/(моль∙K)
2
2.5
298
0.38a
1.52
57± 22
-148±74
323
2.35±0.07
9.40
333
3.46±0.09
13.84
343
7.93±0.20
31.72
2.0
298
0.31a
1.55
54±20
-159±68
323
1.73±0.07
8.65
333
2.52±0.10
12.60
343
5.52±0.18
27.60
1.5
298
0.24a
1.60
53±25
-164±85
323
1.33±0.05
8.87
333
1.81±0.06
12.07
343
4.14±0.12
27.60
а Рассчитанное значение.
тивному механизму [12]. Размер иона металла в
5,10,15,20-Тетра-(2,6-дихлорфенил)порфи-
составе исходного комплекса способствует метал-
ринат Zn(II) 3 получен при кипячении раствора
лообмену. Из-за большого размера ион Сd(II) вы-
Cd(II)-порфирина 1 в диметилформамиде с ZnCl2
ходит из плоскости порфиринового цикла и может
(мольное соотношение реагентов 1:10) в течение
эффективно сольватироваться растворителем. В
2 мин. Для образования 5,10,15,20-тетра-(2,6-ди-
совокупности с активацией внеплоскостных коле-
фторфенил)порфирината Zn(II) 5 достаточно на-
баний связей N-M это облегчает протекание реак-
гревания до температуры кипения раствора ком-
ции (1).
плекса кадмия 2 с хлоридом цинка в ДМФА. На
Для установления влияния природы сольва-
реакцию металлообмена (1) существенное вли-
та соли на скорость металлообмена проведено
яние оказывает положение заместителей в фе-
сравнение истинных констант скоростей (k298) ре-
нильных группах Cd(II)-порфирина. В отличие от
акций комплексов кадмия 1 и 2 с CoCl2 и ZnCl2
о,о′-дигалогенофенилзамещенных комплексов 1, 2
в ДМФА. Металлообмен соединения 1 с CoCl2 в
при смешивании 5,10,15,20-тетра-(4-хлорфенил)-
ДМФА протекает в 2 раза быстрее, чем c ZnCl2
порфирината Cd(II) с хлоридом цинка п-хлорфе-
(табл. 1, 2). Металлообмен комплекса 2 с CoCl2 в
нилзамещенный комплекс Zn(II) образуется при
ДМФА протекает в 3.6 раза быстрее, чем c ZnCl2
комнатной температуре через 20 мин [13].
(табл. 3, 4).
Металлообмен кадмиевых комплексов с ацета-
Из-за более выраженного -I-эффекта о-F-заме-
тами цинка протекает медленнее, чем с хлоридами
щенные тетрафенилпорфиринаты Cd(II) 2 облада-
цинка, из-за образования более прочного сольва-
ют в 3.6 раза большей скоростью металлообмена в
та соли Zn [14]. 5,10,15,20-Тетра-(2,6-дихлорфе-
ДМФА с CoCl2 и в 2.3 раза - с ZnCl2 по сравнению
нил)порфиринат Zn(II) образуется через 12 мин
с о-Cl-замещенными 1.
при кипячении раствора Cd(II)-порфирина 1 в
диметилформамиде с Zn(ОАс)2 (мольное соот-
Методом отбора проб исследованы реакции
ношение реагентов 1:10). В сравнимых условиях
металлообмена орто-замещенных порфиринатов
5,10,15,20-тетра-(2,6-дифторфенил)порфиринат
Cd(II) 1, 2 с хлоридами и ацетатами цинка(II) и
Zn(II) образуется через 2 мин.
кобальта(II) в диметилформамиде. Найдены опти-
мальные условия синтеза 2,6-дигалогенозамещен-
При кипячении раствора комплекса кадмия 1
ных порфиринатов Zn(II) и Co(II).
в диметилформамиде с CoCl2 в течение 30 с об-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
РЕАКЦИЯ МЕТАЛЛООБМЕНА
1265
разуется
5,10,15,20-тетра-(2,6-дихлорфенил)пор-
фиринат Co(II) 4. Для образования 5,10,15,20-
тетра-(2,6-дифторфенил)порфирината Co(II) 6 до-
статочно нагревания Cd(II)-порфирина 2 с CoCl2 в
ДМФА до 100°С. Замена хлорида кобальта на аце-
тат кобальта приводит к существенному увеличе-
нию времени реакции металлообмена: о,о′-дихлор-
фенилзамещенный комплекс Co(II) 4 получен при
взаимодействии Cd(II)-порфирина 1 с Co(ОАс)2
(мольное соотношение реагентов 1:10) в течение
20 мин. Реакция металлообмена Cd(II)-порфи-
рина 2 с Co(ОАс)2 в кипящем ДМФА протекает
в течение 2 мин с образованием 5,10,15,20-те-
тра-(2,6-дифторфенил)порфирината Co(II) 6.
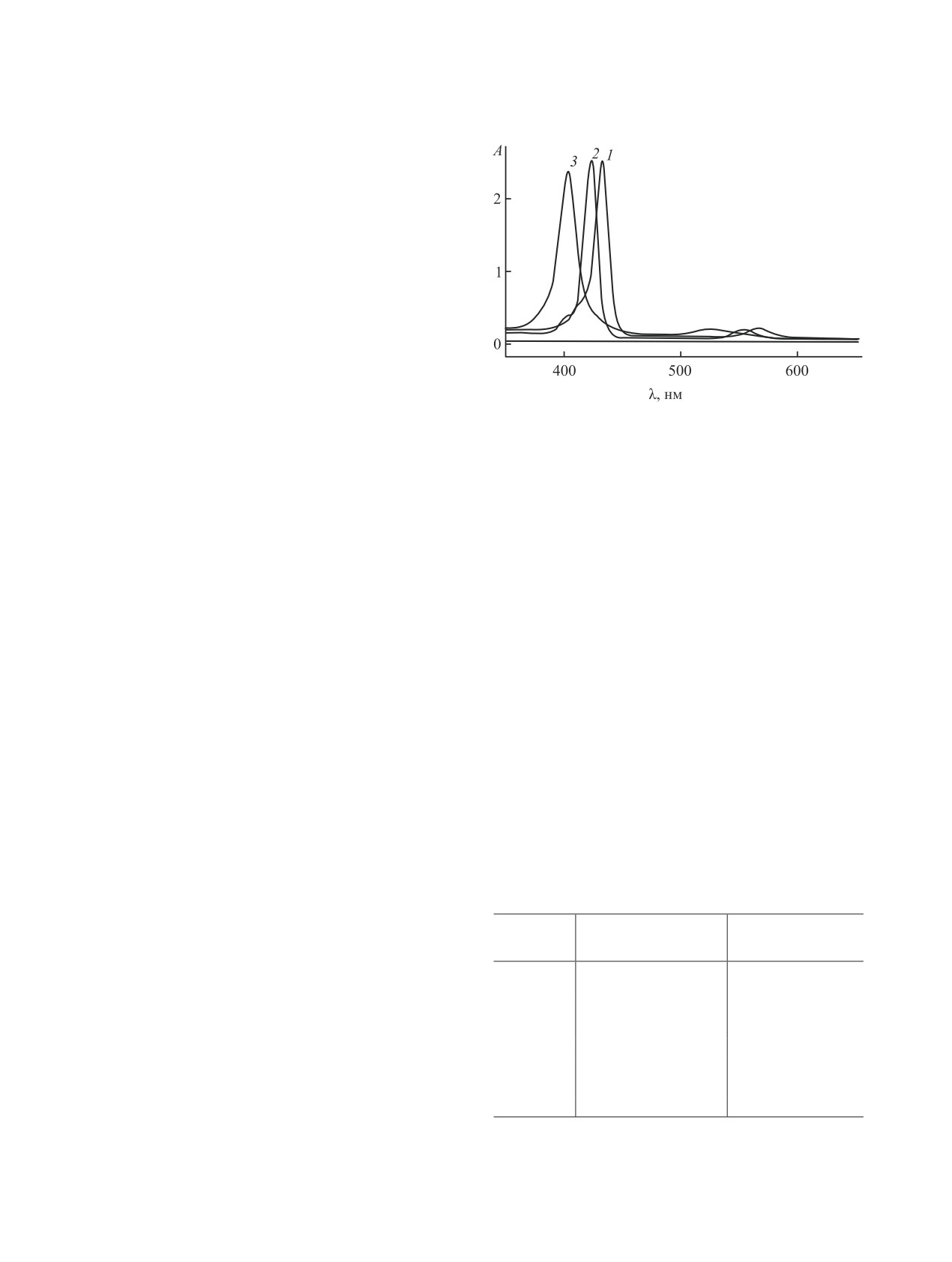
Рис. 3. ЭСП 2,6-дихлорзамещенных комплексов Cd(II)
(1), Zn(II) (2), Co(II) (3) в хлороформе.
На рис. 3 приведены электронные спектры по-
глощения о,о′-дихлорфенилзамещенных порфи-
Методика кинетического эксперимента и обра-
ринатов Cd(II), Zn(II) и Co(II) в хлороформе. Ха-
ботка экспериментальных данных подробно опи-
рактеристики электронных спектров поглощения
саны в работе [16].
синтезированных соединений в ДМФА представ-
лены в табл. 5.
Комплексы кадмия 1 и 2 получали по методу
Строение полученных комплексов изучено ме-
Адлера [17].
тодами масс-спектрометрии и спектроскопии ЯМР
5,10,15,20-Тетра-(2,6-дихлорфенил)порфири-
1Н. Спектральные данные Со(II)-тетрафенилпор-
нат Cd(II) (1) получали по известной методике
фиринов подобны описанным ранее в работе [15].
[18] из 0.02 г (0.0225 ммоль) тетра-(2,6-дихлорфе-
Таким образом, при изучении металлообмена
нил)порфирина и 0.052 г (0.225 ммоль) Cd(OAc)2,
5,10,15,20-тетра-(2,6-дихлорфенил)порфирината
продолжительность реакции - 3 мин. Выход 0.02 г
Cd(II) и 5,10,15,20-тетра-(2,6-дифторфенил)пор-
(0.02 ммоль, 88%). Спектр ЯМР 1H (C6D6), δ, м. д.:
фирината Cd(II) с хлоридами и ацетатами кобаль-
8.73 с (8Н, пиррол), 7.36 д (8Н, Нм, J 7.6 Гц), 6.97
та и цинка в ДМФА обнаружено сильное влияние
т (4Н, Нn, J 7.65 Гц). Масс-спектр, m/z (Iотн, %):
орто-замещения в комплексах и природы соли на
1000.2 (82) [M]+ (вычислено для С44H20CdCl8N4:.
скорость реакции.
1000.7).
5,10,15,20-Тетра-(2,6-дифторфенил)порфи-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ринат Cd(II) (2). Cмесь
0.02 г (0.0264 ммоль)
В работе
использовали
5,10,15,20-
тетра-(2,6-дихлорфенил)порфирин и
5,10,15,20-
Таблица 5. Параметры электронных спектров погло-
щения галогензамещенных тетрафенилпорфиринатов
тетра-(2,6-дифторфенил)порфирин (Porphychem),
Cd(II) (1, 2), Zn(II) (3, 5) и Co(II) (4, 6) в ДМФА
хлориды и ацетаты цинка(II) и кобальта(II)
(Across), оксид алюминия (Merck), CDCl3, C6D6
Полосы Соре,
Q-Полосы,
Комплекс
(Aldrich), ДМФА (Panreac); растворители (ХЧ)
λ, нм (lgε)
λ, нм (lgε)
использовали без дополнительной обработки.
578 (4.34), 620
1
418 (4.77), 438 (5.53)
Электронные спектры поглощения записывали
(3.98)
572 (4.41), 612
на спектрофотометре Cary-100 (Varian). Спектры
2
413 (4.88), 435 (5.63)
(3.89)
ЯМР 1Н (500 МГц) получали на приборе Bruker AV
3
405 (4.66), 426 (5.50)
559 (4.35), 594 пл
III-500 (внутренний стандарт - ТМС). Масс-спек-
5
399 (4.76), 419 (5.64
552 (4.44), 588 пл
тры регистрировали на масс-спектрометре Maldi
4
411 (5.32)
532 (4.26)
ToF Shimadzu Biotech Axima Confidence (матрица -
6
407 (5.39)
532 (4.36)
дигидроксибензойная кислота).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1266
ЗВЕЗДИНА и др.
тетра-(2,6-дифторфенил)порфирина и
0.061 г
тили 20 мин, затем обрабатывали, как описано в
(0.264 ммоль) Cd(OAc)2 в 5 мл ДМФА кипятили
методе а. Выход 0.017 г (0.0180 ммоль, 89). Спектр
30 с. Реакционную смесь охлаждали, выливали
ЯМР 1Н, (CDCl3), δ, м. д.: 14.65 уш. с (8Н, пир-
в воду, выпавший осадок отфильтровывали, про-
рол), 9.45 уш. с (4Н, Нn), 8.90 уш. с (8Н, Нм). Масс-
мывали водой, сушили и переосаждали из гекса-
спектр, m/z (Iотн, %): 947.69 (98) [M + Н]+ (вычис-
на. Выход 0.021 г (0.0242 ммоль, 92%). Спектр
лено для С44Н20Cl8СoN4: 947.22).
ЯМР 1H (C6D6), δ, м. д.: 8.96 с (8Н, пиррол), 7.09 д
5,10,15,20-Тетра-(2,6-дифторфенил)порфи-
(8Н, Нм, J 7.6 Гц), 6.96 т (4Н, Нn, J 7.65 Гц). Масс-
ринат Zn(II) (5). а. Смесь 0.02 г (0.023 ммоль) ком-
спектр, m/z (Iотн, %): 870.88 (87) [M + 2H]+ (вычис-
плекса 2 и 0.031 г (0.23 ммоль) ZnCl2 в 5 мл ДМФА
лено для С44H20CdF8N4: 869.08).
нагревали до температуры кипения. Реакционную
Исследование реакций металлообмена 2,6-ди-
смесь охлаждали, выливали в воду, затем прибав-
галогенозамещенных порфиринатов Cd(II) с соля-
ляли твердый NaCl. Осадок отфильтровывали,
ми цинка и кобальта в ДМФА проводили методом
промывали водой, сушили и хроматографировали
отбора проб. Через определенные промежутки
на оксиде алюминия, элюент - дихлорметан, затем
времени из реакционной смеси отбирали равные
хлороформ. Выход 0.018 г (0.0219 ммоль, 95%).
по объему пробы, растворяли в равном количестве
б. Смесь 0.02 г (0.023 ммоль) комплекса 2 и
ДМФА, помещали в кювету спектрофотометра и
0.042 г (0.23 ммоль) Zn(ОАс)2 в 5 мл ДМФА кипя-
записывали электронные спектры поглощения при
тили 2 мин, затем обрабатывали, как в описано
комнатной температуре.
в опыте а. Выход 0.017 г (0.0297 ммоль, 90%).
5,10,15,20-Тетра-(2,6-дихлорфенил)порфири-
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 8.99 с (8Н, пир-
нат Zn(II) (3). а. Смесь 0.02 г (0.02 ммоль) ком-
рол), 7.82 т (4Н, Нn, J 7.65 Гц), 7.41 д (8Н, Нм, J 7.6
плекса 1 и 0.027 г (0.2 ммоль) хлорида цинка(II) в
Гц). Масс-спектр, m/z (Iотн, %): 823.4 (98) [M + Н]+
12 мл ДМФА кипятили 2 мин. Реакционную смесь
(вычислено для С44H20F8N4Zn: 822.1).
охлаждали, выливали в воду, осадок отфильтровы-
5,10,15,20-Тетра-(2,6-дифторфенил)порфи-
вали, промывали водой, сушили и хроматографи-
ринат Cо(II) (6). а. Смесь 0.02 г (0.023 ммоль)
ровали на оксиде алюминия, элюент - дихлорме-
комплекса 2 и 0.03 г (0.23 ммоль) CоCl2 в 5 мл
тан. Выход 0.018 г (0.0190 ммоль, 94%).
ДМФА нагревали до 100°C. Реакционную смесь
охлаждали, выливали в воду, затем прибавляли
б. Смесь 0.02 г (0.02 ммоль) комплекса 1 и
0.037 г (0.2 ммоль) Zn(ОАс)2 в 12 мл ДМФА кипя-
твердый NaCl. Осадок отфильтровывали, промы-
тили 12 мин, затем обрабатывали, как в описано
вали водой, сушивали и хроматографировали на
оксиде алюминия, элюент - дихлорметан, затем
в методе а. Выход 0.017 г (0.0179 ммоль, 89%).
Спектр ЯМР 1Н, (CDCl3), δ, м. д.: 8.75 с (8Н,
хлороформ. Выход 0.018 г (0.0221 ммоль, 95%).
пиррол), 7.79 д (8Н, Нм, J 7.6 Гц), 7.70 т (4Н, Нn, J
б. Смесь 0.02 г (0.023 ммоль) комплекса 2 и
7.65 Гц). Масс-спектр, m/z (Iотн, %): 952.9 (98) [M]+
0.041 г (0.23 ммоль) Cо(OAc)2 в 5 мл ДМФА кипя-
(вычислено для С44H20Cl8N4Zn: 953.7).
тили 2 мин, затем обрабатывали, как описано в ме-
тоде а. Выход 0.017 г (0.0209 ммоль, 90%). Спектр
5,10,15,20-Тетра-(2,6-дихлорфенил)порфири-
ЯМР 1Н (CDCl3), δ, м. д.: 15.36 уш. с (8Н, пиррол),
нат Cо(II) (3). а. Смесь 0.02 г (0.02 ммоль) ком-
9.43 уш. с (4Н, Hn), 9.28 уш. с (8Н, Нм). Масс-
плекса 1 и 0.026 г (0.2 ммоль) CоCl2 в 15 мл ДМФА
спектр, m/z (Iотн, %): 815.96 (97) [M + Н]+ (вычис-
кипятили 30 с. Реакционную смесь охлаждали,
лено для С44Н20СoF8N4: 815.61).
выливали в воду, затем прибавляли твердый NaCl.
Осадок отфильтровывали, промывали водой, су-
ИНФОРМАЦИЯ ОБ АВТОРАХ:
шили и хроматографировали на оксиде алюминия,
элюент - хлороформ. Выход 0.018 г (0.0190 ммоль,
Чижова Наталья Васильевна, ORCID: http://
94%).
orcid.org/0000-0001-5387-5933
б. Смесь 0.02 г (0.02 ммоль) комплекса 1 и
Мамардашвили Нугзар Жораевич, ORCID:
0.035 г (0.2 ммоль) Cо(OAc)2 в 15 мл ДМФА кипя-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
РЕАКЦИЯ МЕТАЛЛООБМЕНА
1267
ФОНДОВАЯ ПОДДЕРЖКА
9.
Stuzhin P.A., Ivanova S.S., Koifman O.I., Petrov O.A.,
Nazarova A. // Inorg. Chem. Commun. 2014. Vol. 49.
Работа выполнена при финансовой поддержке
Р. 72. doi 10.1016/j.inoche.2014.09.002
Российского фонда фундаментальных исследо-
10.
Чижова Н.В., Иванова Ю.Б., Русанов А.И., Хрушко-
ваний (проект № 19-03-00078 А) с привлечением
ва Ю.В., Мамардашвили Н.Ж. // ЖОрХ. 2019. Т. 55.
Вып. 5. С. 753; Chizhova N.V., Ivanova J.B., Rusa-
оборудования Верхневолжского регионального
nov A.I., Khrushkova J.V., Mamardashvili N.Z. // Russ.
центра физико-химических исследований.
J. Org. Chem. 2019. Vol. 55. N 5. Р. 655. doi 10.1134/
КОНФЛИКТ ИНТЕРЕСОВ
S1070428019050129
11.
Hötger D., Abufager P., Morchutt C., Alexa P., Grumel-
Авторы заявляют об отсутствии конфликта ин-
li D., Dreiser J., Stepanow S., Gambardella P., Busnen-
тересов.
go H., Etzkorn M., Gutzler R., Kerna K.// Nanoscale.
2018. Vol. 10. Р. 21116. doi 10.1039/c8nr04786c
СПИСОК ЛИТЕРАТУРЫ
12.
Звездина С.В., Березин М.Б., Березин Б.Д. // ЖНХ.
2007. Т. 52. № 8. С. 1354; Zvezdina S.V., Berezin M.B.,
1.
Grant C., Hembright P. // J. Am. Chem. Soc. 1969. Vol.
Berezin B.D. // Russ. J. Inorg. Chem. 2007. Vol. 52.
91. N 15. P. 4195. doi 10.1021/ja01043a030
N 8. Р. 1269. doi 10.1134/S0036023607080177
2.
Хембрайт П. // Усп. хим. 1977. Т. 46. № 7. С. 1207;
13.
Звездина С.В., Чижова Н.В., Мамардашвили Н.Ж. //
Hambright P. // Russ. Chem. Rev. 1977. Vol. 46. N 7.
ЖОХ. 2020. Т. 90. Вып. 11. С. 1732; Zvezdina S.V.,
P. 1207.
Chizhova N.V., Mamardashvili N.Z. // Russ. J. Gen.
3.
Hambright P. In: Porphyrin handbook / Eds K. Smith,
Chem. 2020. Vol. 90. N 11. Р. 2105. doi 10.1134/
K. Kadish, R. Guillard. New York: Academic Press, 2000.
S1070363220110134
Vol. 3. P. 129.
14.
Березин Б.Д., Голубчиков О.А. Координационная
4.
Березин Б.Д., Румянцева С.В., Березин М.Б. // Ко-
химия сольватокомплексов солей переходных ме-
орд. хим. 2004. Т. 30. № 4. С. 312; Berezin B.D.,
таллов. М.: Наука, 1992. 234 с.
Rumyantseva S.V., Berezin M.B. // Russ. J. Coord.
15.
Чижова Н.В., Кумеев Р.С., Мамардашвили Н.Ж. //
Chem. 2004. Vol. 30. N 4. Р. 291. doi 10.1023/B:RU
ЖНХ. 2013. Т. 58. № 6. С. 836; Chizhova N.V., Kume-
CO.0000022806.85114.93
ev R.S., Mamardashvili N.Z. // Russ. J. Inorg.
5.
Березин М.Б., Звездина С.В., Березин Б.Д. // Кoорд.
Chem. 2013. Vol. 58. N 6. Р. 740. doi 10.1134/
хим. 2007. Т. 33. № 7. С. 499; Berezin M.B., Zvezdi-
S0036023613060089
na S.V., Berezin B.D. // Russ. J. Coord. Chem. 2007.
16.
Звездина С.В., Мамардашвили Н.Ж. // Коорд. хим.
Vol. 33. N 7. Р. 488. doi:10.1134/S1070328407070032
2012. Т. 38. № 5. С. 333; Zvezdina S.V., Mamardashvi-
6.
Звездина С.В., Березин М.Б., Березин Б.Д. // Корд.
li N.Zh. // Russ. J. Coord. Chem. 2012. Vol. 38. N 5.
химия. 2010. Т.36. № 12. С. 925; Zvezdina S.V., Berezin
P. 323. doi 10.1134/ S1070328412050120
M.B., Berezin B.D. // Russ. J. Coord. Chem. 2010.
17.
Adler A.D., Longo F.R., Kampas F., Kim J. // J. Inorg.
Vol. 36. N 12. Р. 913. doi 10.1134/S1070328410120080
Nucl. Chem. 1970. Vol. 32. Р. 2443. doi 10.1016/0022-
7.
Linstead R.P., Weiss F.T. // J. Chem. Soc. 1950. Р. 2975.
1902(70)80535-8
doi 10.1039/JR9500002975
18.
Чижова Н.В., Мамардашвили Г.М., Дмитриева О.А.,
8.
Чижова Н.В., Хелевина О.Г., Березин Б.Д. // ЖОХ.
Мамардашвили Н.Ж., Койфман О.И. // Макрогетеро-
2003. Т. 73. Вып. 10. С. 1738; Chizhova N.V., Khelevi-
циклы. 2019. Т. 12. № 4. С. 364; Chizhova N.V.,
na О.G., Berezin B.D.
// Russ. J. Gen.
Mamardashvili G.M., Dmitrieva O.A., Mamardashvi-
Chem.
2003. Vol.
73. N
10 Р.
1645. doi
li N.Z., Koifman O.I. // Macroheterocycles. 2019.
10.1023/B:RUGC.0000016039.52090.d2
Vol. 12. N 4. Р. 364. doi 10.6060/mhc190556m
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1268
ЗВЕЗДИНА и др.
Metal Exchange Reactions of o,o′-Dihalosubstituted Cd(II)
Tetraphenylporphyrinates with d-Metal Salts in DMF
S. V. Zvezdina*, N. V. Chizhova, and N. Z. Mamardashvili
G.A. Krestov Institute of Solutions Chemistry, Russian Academy of Sciences, Ivanovo, 153045 Russia
*е-mail: svvr@isc-ras.ru
Received May 24, 2021; revised May 24, 2021; accepted June 10, 2021
The metal exchange reactions of Cd(II)-5,10,15,20-tetra-(2,6-dichlorophenyl)porphyrin and Cd(II)-
5,10,15,20-tetra-(2,6-difluorophenyl)porphyrin with Zn(II) and Co(II) cations in dimethylformamide were stud-
ied by the spectrophotometric method. The kinetic parameters of the metal exchange reaction were calculated
and a possible stoichiometric mechanism of the process is proposed. The metal exchange reactions of 2,6-di-
halogenated cadmium porphyrins with Zn(II) and Co(II) chlorides and acetates in dimethylformamide were
investigated by the sampling method. Zn(II)- and Co(II)-complexes with 5,10,15,20-tetra-(2,6-dichlorophenyl)-
porphyrin and 5,10,15,20-tetra-(2,6-difluorophenyl)pophirin were synthesized and identified by UV-Vis, 1H
NMR spectroscopy and mass spectrometry methods.
Keywords: tetra-(2,6-dihalophenyl)porphyrins, Cd(II) complexes, complexation, metal exchange reactions,
electronic absorption spectroscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021