ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 8, с. 1309-1312
КРАТКИЕ
СООБЩЕНИЯ
УДК 544.344.3
КОМПЛЕКСООБРАЗОВАНИЕ ИОНОВ МЕДИ(II)
С ФТАЛАТ-ИОНАМИ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
© 2021 г. Н. А. Богачев, К. А. Подрядрова, М. Ю. Скрипкин, А. С. Мерещенко*
Санкт-Петербургский государственный университет,
Университетская наб. 7-9, Санкт-Петербург, 199034 Россия
*e-mail: a.mereshchenko@spbu.ru
Поступило в Редакцию 4 июня 2021 г.
После доработки 28 июня 2021 г.
Принято к печати 3 июля 2021 г.
Получены электронные спектры фталатных комплексов меди(II) в неводных растворителях. Определены
константы устойчивости комплексов. Показано, что величины констант устойчивости и донорных чисел
растворителей изменяются антибатно.
Ключевые слова: комплексообразование, фталаты, ионы меди, неводные растворители, электронная
спектроскопия поглощения
DOI: 10.31857/S0044460X21080187
Фталат-ион (1,2-бензолдикарбоксилат-ион, 1,2-
и ацетонитриле. Использование фталата тетраэ-
bdc) как бидентатный лиганд используется в каче-
тиламмония как источника фталат-ионов обу-
стве линкера при получении металлоорганических
словлено тем, что он полностью диссоциирует в
каркасных структур [1-3]. На топологию каркас-
выбранных растворителях [7]. Хемометрическая
ных структур влияют условия синтеза, в частности,
обработка спектров позволила установить коли-
подбор растворителей для сольвотермального син-
чество равновесных химических форм в растворе
теза [4]. Наиболее часто применяются полярные
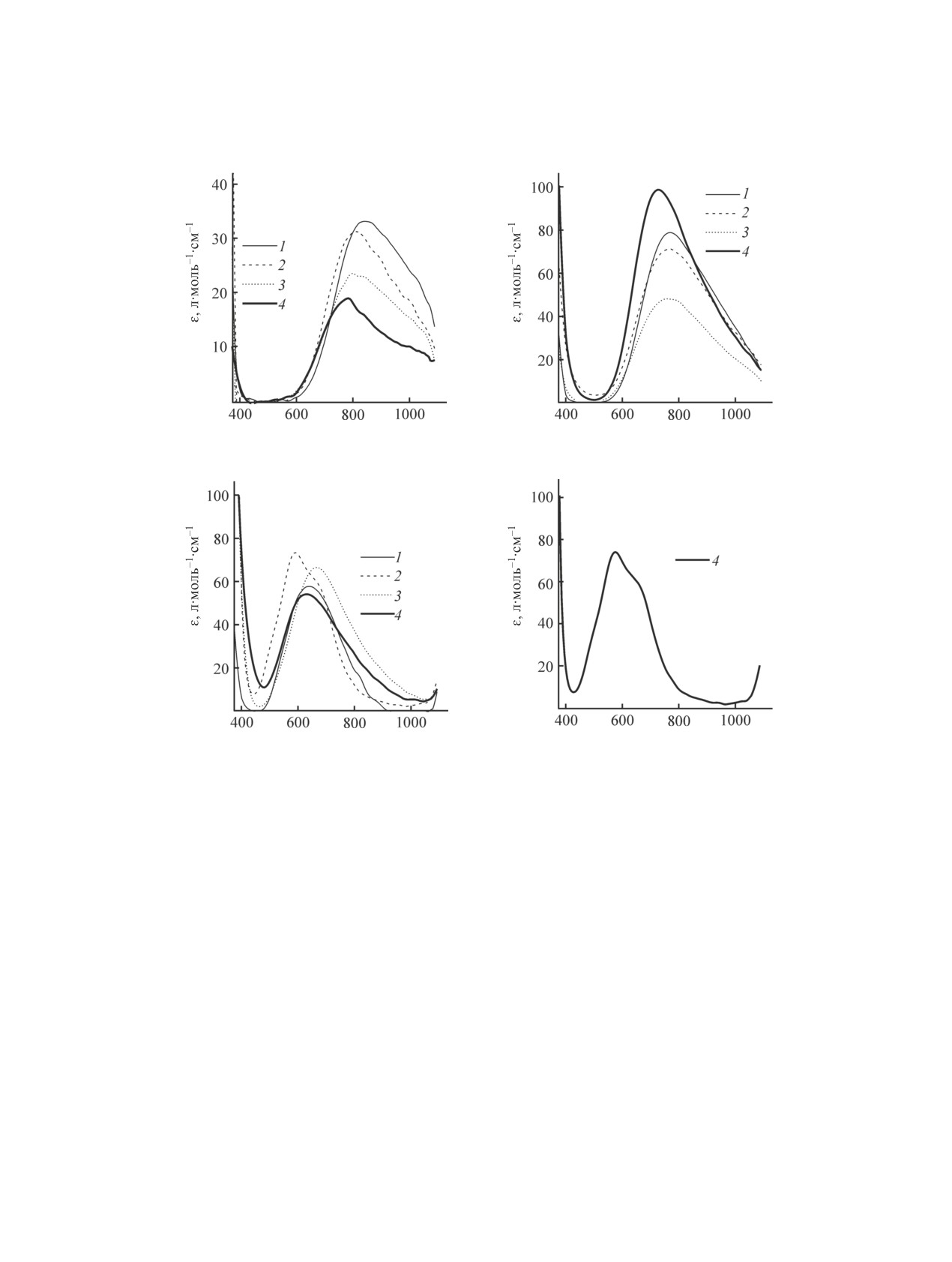
и индивидуальные спектры этих форм (рис. 1). В
донорные органические растворители диметил-
ацетонитриле комплексообразование иона меди
сульфоксид (ДМСO), диметилформамид (ДМФА),
с фталат-ионом протекает в 3 ступени, в осталь-
этанол и ацетонитрил [5]. Подробные механизм и
ных растворителях оно ограничивается стадией
кинетика кристаллизации каркасных структур, в
образования комплекса Cu(1,2-bdc)2-. В исследуе-
том числе образование вторичных строительных
мом спектральном диапазоне наблюдаются поло-
блоков, остаются не до конца изученными несмо-
сы поглощения, соответствующие d-d-переходам
тря на большое число синтезированных соедине-
иона меди(II), с максимумами при 785-845 нм для
ний и широкие области применения [6].
сольватокомплексов Cu2+ и при 730-760, 590-700 и
Нами исследована первая стадия образования
575
нм,
соответствующие
Cu(1,2-bdc),
вторичных строительных блоков металлооргани-
Cu(1,2-bdc)2- и Cu(1,2-bdc)4-. Гипсохромный сдвиг
ческих каркасных структур на основе фталевой
связан с тем, что фталат-ион, как и бензоат-ион
кислоты и ионов меди(II). Методом УФ спектро-
[8-10], является лигандом более сильного поля,
скопии измерены спектры поглощения растворов
чем молекулы используемых растворителей. Спек-
Cu(ClO4)2 (5 ммоль/л) и фталата тетраэтиламмо-
тры фталатных комплексов меди(II) характеризу-
ния (0-200 ммоль/л) в ДМСО, ДМФА, этаноле
ются более высокими коэффициентами экстинк-
1309
1310
БОГАЧЕВ и др.
(а)
(б)
λ, нм
λ, нм
(в)
(г)
λ, нм
λ, нм
Рис. 1. Электронные спектры поглощения сольватокомплекса Cu2+ (а) и комплексов меди(II) с фталат-ионами (1,2-bdc):
Cu(1,2-bdc) (б), Cu(1,2-bdc)2- (в) и Cu(1,2-bdc)4- (г) в ДМСО (1), ДМФА (2), этаноле (3) и ацетонитриле (4), по результатам
хемометрической обработки данных.
ции, чем спектры сольватокомплексов (рис. 1),
термодинамику формирования металлоорганиче-
что, по-видимому, связано с более низкой симме-
ских каркасных структур в этих системах.
трией комплексов меди(II) с фталат-ионами, чем
В работе использовали реактивы: фталевая кис-
сольватокомплексов.
лота (> 99.5%, Sigma-Aldrich), гидроксид тетраэ-
В табл. 1 приведены константы устойчивости
тиламмония (35%-ный водный раствор, Sigma-
комплексов. Выявлена антибатность изменения
Aldrich), Cu(ClO4)2∙6H2O (> 98%, Sigma-Aldrich),
констант устойчивости фталатных комплексов ме-
ацетонитрил (ОСЧ, Криохром), ДМСО (ХЧ, Лен-
ди(II) и донорных чисел растворителей [11]: с уве-
реактив), ДМФА (ХЧ, Ленреактив), EtOH (ХЧ,
личением основности растворителя наблюдается
Ленреактив). Синтез и характеристики фталата
уменьшение констант устойчивости комплексов.
тетраэтиламмония описаны ранее [7].
Это позволяет сделать вывод о том, что сольвата-
Использовали растворы с одинаковой кон-
ция катиона конкурирует с ацидокомплексообра-
центрацией перхлората меди(II) (5 ммоль/л) и с
зованием в рассмотренных системах и определяет
различными концентрациями фталата тетраэти-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
КОМПЛЕКСООБРАЗОВАНИЕ ИОНОВ МЕДИ(II)
1311
Таблица 1. Общие константы образования фталатных комплексов меди(II) в различных растворителях и донорные
числа растворителей
Донорное число,
Растворитель
β1
β 2
β3
ккал/моль
Диметилсульфоксид
490±10
1480±10
-
29.8
Диметилформамид
(1.3±0.5)×106
(1.0±0.5)×109
-
26.6
Этанол
(1.0±0.5)×1012
(1.0±0.5)×1019
-
19.2
Ацетонитрил
(1.3±0.5)×1013
(1.3±0.5)×1018
7±2×1019
14.1
ламмония (0-200 ммоль/л). Измерение спектров
2.
Bagheri A.R., Ghaedi M. // Arab. J. Chem. 2020.
проводили в течение 5 мин после приготовления
Vol. 13. N 5. P. 5218. doi 10.1016/j.arabjc.2020.02.020
растворов во избежание полимеризации (образо-
3.
Wang Q., Astruc D. // Chem. Rev. 2020. Vol. 120. N 2.
вания металлорганических каркасных структур)
P. 1438. doi 10.1021/acs.chemrev.9b00223
при
25°С на прецизионном спектрофотометре
4.
Niu Y.-F., Cui L.-T., Han J., Zhao X.-L. // J. Solid
СФ-2000 в кварцевых кюветах толщиной 1 см. Об-
State Chem. 2016. Vol. 241. P. 18. doi 10.1016/j.
работку результатов проводили с помощью про-
jssc.2016.05.024
граммного обеспечения ReactLab Еquilibria.
5.
Seetharaj R., Vandana P.V., Arya P., Mathew S. // Arab.
ИНФОРМАЦИЯ ОБ АВТОРАХ
J. Chem. 2019. Vol. 12. N 3. P. 295. doi 10.1016/j.
Богачев Никита Александрович, ORCID: http://
arabjc.2016.01.003
orcid.org/0000-0002-9495-0669
6.
Safaei M., Foroughi M. M., Ebrahimpoor N., Jahani S.,
Скрипкин Михаил Юрьевич, ORCID: http://
Omidi A., Khatami M. // Trends Analyt. Chem. 2019.
orcid.org/0000-0001-9841-150X
Vol. 118. P. 401. doi 10.1016/j.trac.2019.06.007
Мерещенко Андрей Сергеевич, ORCID: http://
7.
Носов В.Г., Подрядова К.А., Васильева М.С., Бога-
orcid.org/0000-0001-9390-1446
чев Н.А., Скрипкин М.Ю., Мерещенко А.С. // ЖОХ.
2021. Т. 91. Вып. 5. С. 659; Nosov V.G., Podryadrova
ФОНДОВАЯ ПОДДЕРЖКА
K.A., Vasilyeva M.S., Bogachev N.A., Skripkin M.Yu.,
Работа выполнена при поддержке Российско-
Mereshchenko A.S. // Russ. J. Gen. Chem. 2021. Vol. 91.
го фонда фундаментальных исследований (проект
N 5. P. 753. doi 10.1134/S1070363221050017
№ 20-33-70025 «Стабильность») с использованием
8.
Odunola O. A., Adeoye I. O., Woods J. A. O. // Synth.
оборудования ресурсного центра Научного парка
React. Inorg. Metal-Org. Chem. 2002. Vol. 32. N 4.
Санкт-Петербургского государственного универ-
P. 801. doi 10.1081/SIM-120004447
ситета «Оптические и лазерные методы исследо-
вания вещества».
9.
Hausmann J., Klingele M. H., Lozan V., Steinfeld G.,
Siebert D., Journaux Y., Girerd J. J., Kersting B. //
КОНФЛИКТ ИНТЕРЕСОВ
Chem. Eur. J. 2004. Vol. 10. N 7. P. 1716. doi 10.1002/
Авторы заявляют об отсутствии конфликта
chem.200305705
интересов.
10.
Greenwood N. N., Earnshaw A. Chemie der Elemente.
СПИСОК ЛИТЕРАТУРЫ
Weinheim: VCH, 1988. P. 1707
1. Mason J.A., Veenstra M., Long J.R. // Chem. Sci. 2014.
11.
Marcus Y. Ions in solution and their solvation. Hoboken:
Vol. 5. N 1. P. 32. doi 10.1039/c3sc52633j
John Wiley & Sons, 2015. P. 82.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021
1312
БОГАЧЕВ и др.
Complex Formation of Copper(II) Ions with Phthalate Ions
in Non-Aqueous Solvents
N. A. Bogachev, K. A. Podryadrova, M. Yu. Skripkin, and A. S. Mereshchenko*
St. Petersburg State University, St. Petersburg, 199034 Russia
*e-mail: a.mereshchenko@spbu.ru
Received June 4, 2021; revised June 28, 2021; accepted July 3, 2021
The electronic absorption spectra of copper(II) complexes and 1,2-benzenedicarboxylate ions in non-aqueous
solvents were registered, and the stability constants of these complexes were determined. The values of stability
constants decrease by increase of the donor numbers of solvents.
Keywords: complex formation, phthalates, copper, non-aqueous solvents, electronic absorption spectroscopy
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 8 2021