ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1321-1327
УДК 547.234.1
СИНТЕЗ 2,2-ДИМЕТИЛГИДРАЗОНО-БУТ-
2-ЕННИТРИЛОВ И [(2,2-ДИМЕТИЛГИДРАЗОНО)-
МЕТИЛ]ФЕНИЛАКРИЛОНИТРИЛОВ
ДЛЯ РАЗРАБОТКИ АНТИМИКРОБНЫХ
ФЛУОРЕСЦЕНТНЫХ КРАСИТЕЛЕЙ
© 2021 г. М. А. Марьясовa,*, В. В. Давыдоваa, О. Е. Насакинa,
С. А. Штейнгольцb, О. А. Лодочниковаb
a Чувашский государственный университет имени И. Н. Ульянова, Московский пр. 15, Чебоксары, 428015 Россия
b Институт органической и физической химии имени А. Е. Арбузова Федерального исследовательского центра
«Казанский научный центр Российской академии наук, Казань, 420088 Россия
*e-mail: marsikprovisor@mail.ru
Поступило в Редакцию 8 июня 2021 г.
После доработки 13 июля 2021 г.
Принято к печати 16 июля 2021 г.
Для получения новых потенциальных антимикробных красителей и возможных фотосенсибилизаторов
из класса полиметиннитрильных красителей проведена серия реакций диметилгидразонов некоторых
диальдегидов с различными нитрилсодержащими реагентами. В результате реакций получены 4-(2,2-ди-
метилгидразоно)бут-2-ен-нитрилы и 3-{4-[(2,2-диметилгидразоно)метил]фенил}акрилонитрилы и изу-
чены их некоторые фотофизические свойства.
Ключевые слова: полиметиннитрильные красители, фотосенсибилизаторы, бут-2-ен-нитрилы, акрило-
нитрилы, диметилгидразоны, этен-1,1,2,2-тетракарбонитрил
DOI: 10.31857/S0044460X2109002X
Устойчивость к антибиотикам - одна из самых
Среди работ, посвященных полиметино-
серьезных угроз для здоровья в современной ме-
вым красителям, не так много публикаций по
дицине. В последние годы активно развиваются
2-замещенным гидразоно-бут-2-еннитрилам. Осо-
альтернативные методы борьбы с инфекционными
бо можно выделить работы двух команд, а имен-
заболеваниями. Одной из многообещающих групп
но группы Северина [5-7] и Юнека с соавторами
методов является световая противоинфекционная
[8, 9]. Кроме того, несколько соединений этой се-
терапия, которая, среди прочего, включает анти-
рии были получены исследовательской группой
микробную фотодинамическую терапию (aPDT)
Карраско и Бартулина [10]. Биологическая актив-
[1, 2]. Фотодинамическая терапия включает ис-
ность этих соединений не изучена.
пользование нетоксичных фотосенсибилизаторов
Большой интерес представляют соединения,
[3] в сочетании с безвредным видимым светом с
способные к фотоиндуцированной реакции внутри-
соответствующей длиной волны для их возбужде-
молекулярного переноса заряда. Они позволяют
ния. Кроме того, в антимикробной химиотерапии
изучать сложные организованные системы, напри-
уже давно используется ряд красителей различной
мер мицеллы. Одним из примеров этих соединений
структуры [4].
являются 4-диметиламиноарилакрилонитрилы [11].
1321
1322
МАРЬЯСОВ и др.
Схема 1.
NC
R
CN
N
O
N
N
(C2H5)3N, t
N
R
H
1
2а-г
R = CN (a), COOCH3 (б), CONH2 (в), C(NH2)C(CN)2 (г).
Схема 2.
X
NC
R
X
CN
O
(C2H5)3N, t
R
3
4а, б
X = (CH3)2NNCH; R = CN (a), C(NH2)C(CN)2 (б).
Схема 3.
NC
R
CN
O
(C2H5)3N, t
X
X
CN
5
6
X = (CH3)2NNCH.
Для получения новых полиметиннитрильных
Строение соединений 2, 4 и 6 подтверждено
красителей и последующего изучения их актив-
данными ИК, ЯМР 1Н, 13С спектроскопии.
ности мы провели серию реакций диметилгидра-
В случае реакции N,N-диметилгидразона гли-
зонов глиоксаля и терефталевого альдегида с раз-
оксаля
1 с пропан-1,1,3,3-тетракарбонитрилом
личными нитрилсодержащими реагентами (NCR).
вместо ожидаемого 2-[2-(2,2-диметилгидразоно)-
При постоянном перемешивании и нагревании
этилиден]пропан-1,1,3,3-тетракарбонитрила или
N,N-диметилгидразона глиоксаля 1 с такими сое-
6-амино-2-[(2,2-диметилгидразоно)метил]-2H-пи-
динениями, как малононитрил, метилцианоацетат,
ран-3,3,5(4H)-трикарбонитрила была получена
цианоацетамид и 2-аминопроп-1-ен-1,1,3-трикар-
глиоксалевая кислота 7 (схема 4).
бонитрил в присутствии триэтиламина были полу-
Образование натриевой соли глиоксалевой кис-
чены 4-(2,2-диметилгидразоно)бут-2-еннитрилы в
лоты 7а подтверждено методом рентгеноструктур-
виде соответствующих производных 3-циано-4-ок-
ного анализа (рис. 1).
собут-2-ен-1-илиден)-2,2-диметилгидразин-1-ия
Взаимодействием N,N-диметилгидразона фор-
2а-г (схема 1).
мальдегида 8 с этен-1,1,2,2-тетракарбонитрилом в
Аналогичным образом N,N-диметилгидра-
ацетонитриле был получен 3-(2,2-диметилгидра-
зона терефталевого альдегида 3 были получены
зоно)проп-1-ен-1,1,2-трикарбонитрил 9 (схема 5).
3-{4-[(2,2-диметилгидразоно)метил]фенил}акри-
Структура соединения 9 определена методами
лонитрилы 4 (схема 2).
ИК, ЯМР 1H, ЯМР 13C спектроскопии и рентгено-
Взаимодействие гидразона изофталевого аль-
структурного анализа (рис. 2).
дегида 5 с малонитрилом привело к образованию
Для соединений 2, 4, 6 и 9 наиболее информа-
2-{3-[(2,2-диметилгидразоно)метил]бензилиден}-
тивными являются спектральные данные, указы-
малононитрила 6 (схема 3).
вающие на наличие фрагмента этенкарбонитрила
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ 2,2-ДИМЕТИЛГИДРАЗОНО-БУТ-2-ЕННИТРИЛОВ
1323
Схема 4.
NH2
CN
O
CN
+
O
CN
X
1
X
NC CN
NC
CN
HO
CN
OH
O
H2O, HO
X
CN
O
O
NC CN
ONa
7a
X = (CH3)2NNCH.
Схема 5.
CN
NC
CN
CN
N
NC
N
N
N
CN
CN
8
9
и связи (H)C=N. Так, в ИК спектрах полученных
трах ЯМР 13С присутствуют сигналы нитрильных
соединений присутствуют полосы поглощения
(112.57-116.55 м. д.) и метильных групп (40.97-
группы CN (2189-2222 см-1) и связей С=N (1600-
52.49 м. д.). Важно отметить, что в случае соедине-
1700 см-1) и С=C (1560-1590 см-1). В спектрах
ний 2а-г в спектрах наблюдается дополнительный
ЯМР 1Н зафиксированы сигналы групп HC=C
сигнал протона в области 3.33-3.31 м. д., который,
(8.35-7.65 м. д.) и HC=N (7.24-6.99 м. д.). В спек-
по-видимому, принадлежит группе +NH.
N8
N7
C8
9
C
C7
N2
C5
C3
C4
N1
C10
C6
N6
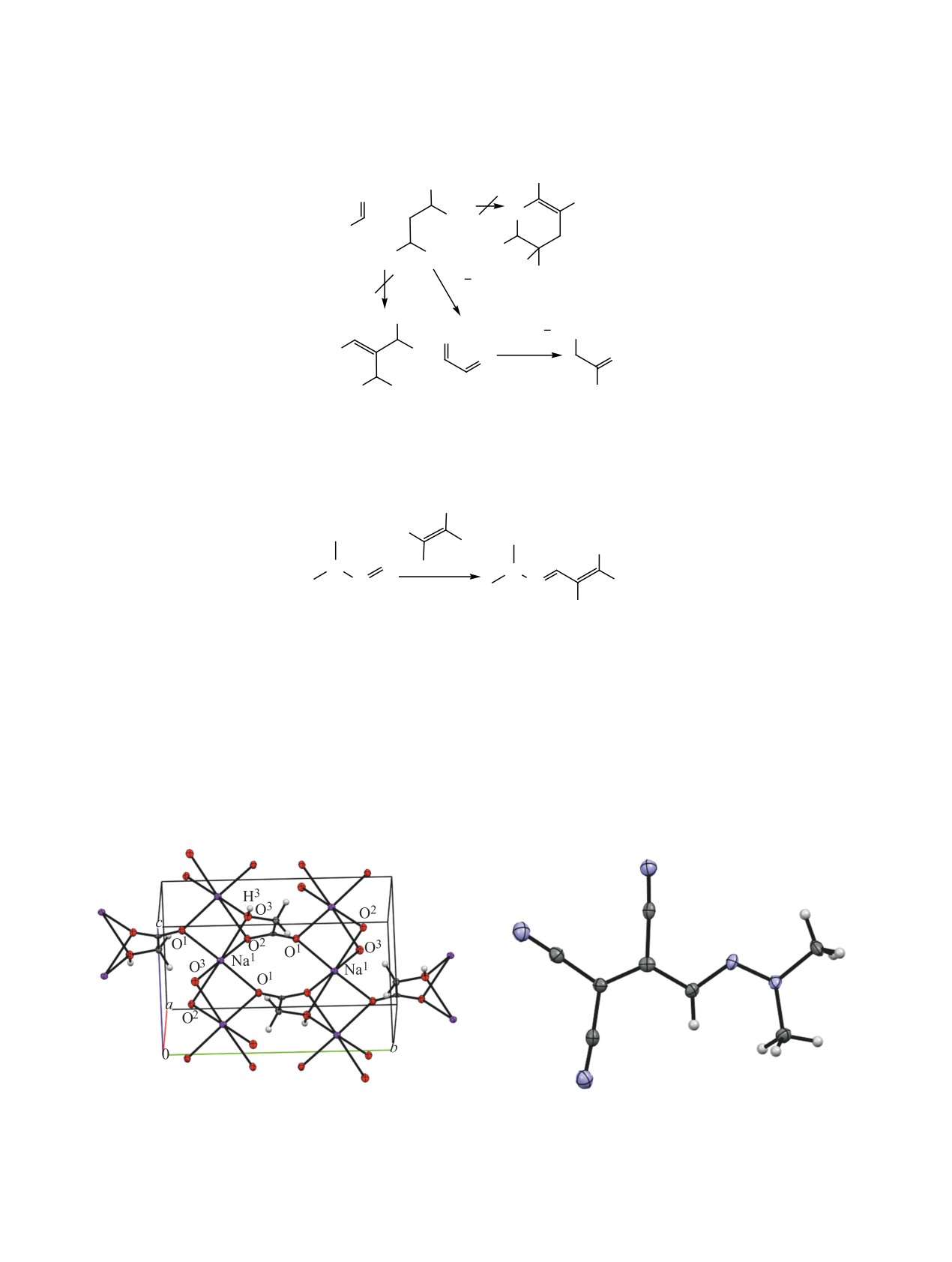
Рис. 1. Общий вид молекулы комплекса 7a в кристалле
Рис. 2. Общий вид молекулы молекулы 9 в кристалле
по данным РСА (CCDC 1986197).
по данным РСА (CCDC 1986196).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1324
МАРЬЯСОВ и др.
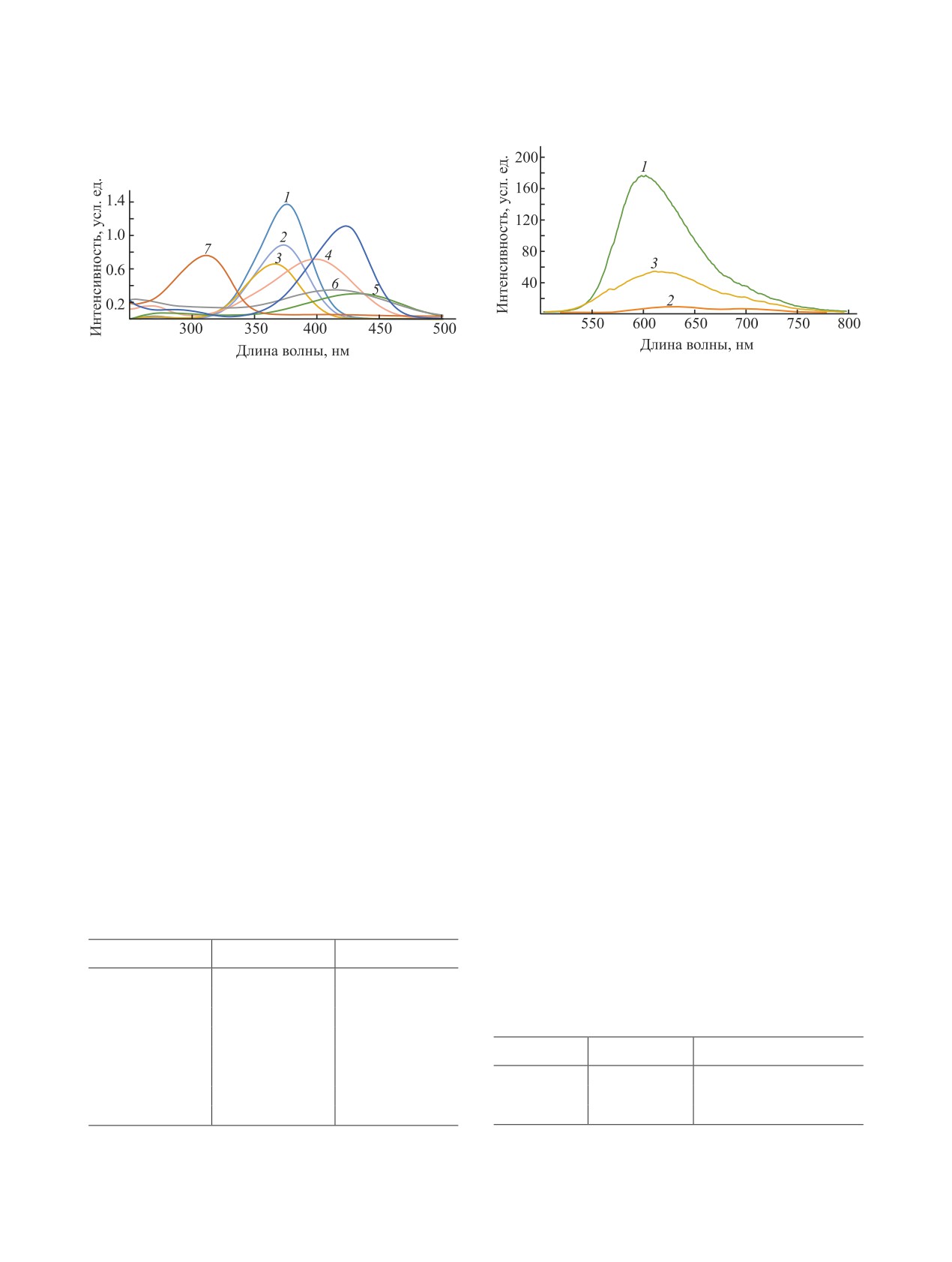
Рис. 4. Спектры флуоресценции для соединений 4а (1),
Рис. 3. УФ спектры соединений 2-8 (1-7).
4б (2) и 6 (3).
УФ спектры полученных соединений в мета-
нительной очистки. За ходом реакций и чистотой
ноле (с 0.15×10-9 М.) приведены на рис. 3. Для
продуктов следили методом ТСХ на пластинах
соединений 2а-г максимум поглощения наблюда-
Sorbfil (пятна визуализировались в УФ свете, при
ется в области 360-400 нм, для соединений 4а, б -
обработке парами иода или при нагревании). Тем-
410-440 нм (табл. 1).
пературы плавления и разложения определены на
приборе Optimelt MPA100. ИК спектры записаны
Поскольку флуоресценция в растворах прак-
на спектрометре ФСМ-1202 с преобразованием
тически отсутствовала, измеряли твердофазную
Фурье для образцов, диспергированных в нуйоле.
флуоресценцию. Наиболее выраженная флуорес-
Спектры ЯМР 1Н и 13С записаны в ДМСО-d6 с вну-
ценция наблюдалась в случае соединений 4а, б и
тренним стандартом ТМС на спектрометре Bruker
6 при длине волны возбуждения 365 нм (рис. 4,
AVANCE400 WB при рабочей частоте 400.13 (1H)
табл. 2).
и 100.61 МГц (13C). УФ спектрофотометрию про-
Таким образом, полученные нами полиметин-
водили на спектрофотометре СФ-200. Измерение
нитриловые красители могут быть использованы в
флуоресценции выполняли на спектрофлуориме-
медицинской практике в качестве потенциальных
тре Agilent Cary Eclipse.
противомикробных средств или фотосенсибилиза-
Данные рентгеновской дифракции монокри-
торов для фотодинамической терапии.
сталлов были собраны на дифрактометре Bruker
Smart Apex II CCD. Структуры расшифрованы
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
прямым методом с использованием программы
Все реагенты были приобретены у коммерче-
SHELXT-2014/5 и уточнены полноматричным
ских поставщиков и использовались без допол-
методом наименьших квадратов по F2 с исполь-
зованием программы SHELXL-2017/1. Расчеты в
Таблица 1. Данные УФ спектроскопии соединений 2-8
основном проводилии с использованием пакета
программ WinGX-2014.1. Неводородные атомы
Соединение
λmax, нм
ε, л/(моль·см)
2а
374
32330.49
2б
374
28466.49
Таблица 2. Данные флуоресценции соединений 4а, б
2в
364
17420.90
и 6
2г
399
27818.47
Соединение
λmax, нм
Относительный сдвиг
4а
434
12109.25
4б
414
14479.47
4а
602
1
6
310
26609.22
4б
634
0.05
8
424
29009.15
6
612
0.31
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ 2,2-ДИМЕТИЛГИДРАЗОНО-БУТ-2-ЕННИТРИЛОВ
1325
уточнены анизотропно. Атомы водорода в струк-
2,2-Диметил-1-(4-метокси-3-циано-4-оксо-
туре 9, а также CH-атомы водорода в структуре 7a
бут-2-ен-1-илиден)гидразин-1-ий
(2б). Выход
помещены в вычисленные положения и уточнены
57%, т. пл. 72-74℃ (i-PrOH). ИК спектр, ν, см-1:
по модели наездника. Положение гидроксильного
3400 (N-H), 2216 (C≡N), 1705 (С=O), 1680 (C=N),
атома водорода в структуре 7a определено из раз-
1583 (C=C). Спектр ЯМР 1H, δ, м. д.: 7.79 д (1H,
ностных рядов Фурье и уточнено в изотропном
СH, JHH 10.5 Гц), 7.00 д (1H, СH, JHH 10.5 Гц),
приближении
3.73 с (3H, OCН3), 3.31 с (1H, +NН), 3.29 с [6H,
(СН3)2]. Спектр ЯМР 13C, δC, м. д.: 163.69 (CO),
Кристаллы соединения 7a (C2H3O3Na) ромби-
ческие, пространственная группа Pbcm. Параме-
153.73 (C1), 125.46 (C2), 123.06 (C3), 115.80 (CN),
тры элементарной ячейки при 150 K: a 5.2755(11),
92.51 (OCH3), 52.49 (CH3). Масс-спектр, m/z (Iотн,
b 10.5358(19), c 6.3623(15) Å, V 353.63(13)Å3, Z 4
%): 182 (100) [M]+. Найдено, %: C 52.68; H 5.98; N
(Z′ 0.5), dвыч 1.841 г/см3, μ(Мо) 2.70 см-1. Измерены
23.34. C8H12N3O2+. Вычислено, %: C 52.74; H 6.64;
интенсивности 2648 отражений, 421 из которых с
N 23.06.
I ≥ 2σ. Окончательные значения факторов расходи-
2,2-Диметил-1-(4-амино-3-циано-4-оксобут-
мости: R 0.0306, Rw 0.0793.
2-ен-1-илиден)гидразин-1-ий (2в). Выход 77%,
Кристаллы соединения 9 (C8H7N5), ромбиче-
т. пл. 181-183℃ (i-PrOH). ИК спектр, ν, см-1: 3406
ские, пространственная группа Pca21. Параме-
(N-H), 3352 (N-H2), 2213 (C≡N), 1665 (С=O), 1600
тры элементарной ячейки при 100 K: a 20.022(4),
(C=N), 1574 (C=C). Спектр ЯМР 1H, δ, м. д.: 7.77 д
b 5.5006(11), c 7.7641(13), V 855.1(3) Å3, Z 4, dвыч
(1H, СH, JHH 9.6 Гц), 7.58 с (1H, NH2), 7.30 с (1H,
1.345 г/см3, μ(Мо) 0.91 см-1. Измерены интенсив-
NH2), 6.95 д (1H, СH, JHH 9.7 Гц), 3.32 с (1H, +NН),
ности 5390 отражений, 1026 из которых с I ≥ 2σ.
3.21 с (6H, (СН3)2). Спектр ЯМР 13C, δC, м. д.:
Окончательные значения факторов расходимости:
163.83 (CO), 149.42 (C1), 123.59 (C2, C3), 116.55
R 0.0623, Rw 0.1282 .
(CN), 42.89 (CH3). Масс-спектр, m/z (Iотн, %): 167
Данные РСА структур депонированы в Кем-
(100) [M]+. Найдено, %: C 51.83; H 6,57; N 32.08.
C7H11N4O+. Вычислено, %: C 50.29; H 6.63; N
бриджском банке структурных данных [CCDC
33.51.
1986197 (7a), 1986196 (9)].
2,2-Диметил-1-(4-амино-3,5,5-трицианопен-
Общая методика получения соединений 2, 4,
6. К раствору 2 ммоль цианопроизводного (мало-
та-2,4-диен-1-илиден)гидразин-1-ий (2г). Выход
нонитрил, 2-цианоацетамид, метил-2-цианоацетат
65%, т. пл. 198-200℃ (i-PrOH). ИК спектр, ν, см-1:
3406, 3352 (N-H2), 3230 (N-H), 2210, 2189 (C≡N),
или
2-аминопроп-1-ен-1,1,3-трикарбонитрил) в
2-5 мл 2-пропанола добавляли 2 ммоль соответ-
1671 (С=N), 1647, 1580 (C=C). Спектр ЯМР 1H, δ,
ствующего N,N’-диметилгидразона в 1-3 мл того
м. д.: 8.54 с (2H, NH2), 7.66 д. (1Н, СН, JHH 9.6 Гц),
же растворителя и 1 каплю триэтиламина. Смесь
7.01 д (1Н, СН, JHH 9.6 Гц), 3.33 с (1H, +NH), 3.30
перемешивали при 50℃ в течение 3-6 ч (контроль
с [6Н, (СН3)2]. Спектр ЯМР 13C, δC, м. д.: 165.25
ТСХ) и охлаждали. Осадок отфильтровывали, про-
(C4), 152.62 (C1), 149.89 (C2), 123.40 (C3), 116.19
мывали 2 мл охлажденного 2-пропанола и сушили.
(CN), 115.86 (CN), 114.97 (CN), 92.95 (C5), 47.54
(CH3). Масс-спектр, m/z (Iотн, %): 215 (100) [M]+.
2,2-Диметил-1-(3,3-дицианоаллилиден)ги-
Найдено, %: C 55.28; H 4.81; N 38.65. C10H11N6+.
дразин-1-ий (2a). Выход 62%, т. пл. 127-129℃
Вычислено, %: C 55.80; H 5.15; N 39.50.
(i-PrOH). ИК спектр, ν, см-1: 3361 (N-H), 2219,
2211 (C≡N), 1653 (С=N), 1577 (C=C). Спектр ЯМР
2-{4-[(2,2-Диметилгидразоно)метил]бензи-
1H, δ, м. д.: 7.87 д (1H, СН, JHH 9.8 Гц), 7.02 д (1Н,
лиден}малононитрил (4а). Выход 70%, т. пл.
СН, JHH 9.7 Гц), 3.45 с (3H, СH3), 3.32 с (1H, +NН),
97-99℃ (i-PrOH). ИК спектр, ν, см-1: 2222 (C≡N),
3.21 с (3H, СН3). Спектр ЯМР 13C, δC, м. д.: 158.35
1600 (C=N), 1583 (C=C). Спектр ЯМР 1H, δ, м. д.:
(C1), 123.34 (C2), 115.86 (CN), 113.96 (CN), 68.80
8.35 с (1H, СН), 7.88 д (2H, СH, JHH 8.1 Гц), 7.65
(C3), 48.65 (CH3). Масс-спектр, m/z (Iотн, %): 149
д (2H, СH, JHH 8.1 Гц), 7.21 с (1H, СН), 3.05 с [6Н,
(100) [M]+. Найдено, %: C 57.11; H 6.32; N 37.03.
(СН3)2]. Спектр ЯМР 13C, δC, м. д.: 160.41 (C2),
C7H9N4+. Вычислено, %: C 56.36; H 6.08; N 37.56.
143.46 (HС=N), 131.44 (C1ʹ), 129.05 (C3ʹ, C5ʹ), 127.88
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1326
МАРЬЯСОВ и др.
(C2ʹ, C6ʹ), 125.23 (C4ʹ), 114.88 (CN), 78.09 (C1), 42.45
50.04 (CH3), 40.97 (CH3). Масс-спектр, m/z (Iотн,
(CH3). Масс-спектр, m/z (Iотн, %): 224 (100) [M]+.
%): 173 (100) [M]+. Найдено, %: C 54.88; H 4.31;
Найдено, %: C 70.21; H 5.18; N 24.71. C13H12N4.
N 41.65. C8H7N5. Вычислено, %: C 55.48; H 4.07;
Вычислено, %: C 69.62; H 5.39; N 24.98.
N 40.44.
2-Амино-4-{4-[(2,2-диметилгидразоно)ме-
ИНФОРМАЦИЯ ОБ АВТОРАХ
тил]фенил}бута-1,3-диен-1,1,3-трикарбони-
трил (4б). Выход 67%, т. пл. 210-212℃ (i-PrOH).
Марьясов Максим Андреевич, ORCID: http://
ИК спектр, ν, см-1: 3330, 3212 (N-H2), 2220, 2212
orcid.org/0000-0002-4935-0250
(C≡N), 1660 (С=N), 1582, 1553 (C=C). Спектр ЯМР
Давыдова Вера Владимировна, ORCID: http://
1H, δ, м. д.: 9.05 д (2H, NH2, JHH 21.9 Гц), 7.95 с
orcid.org/0000-0003-3992-4158
(1Н, СН), 7.90 д (2Н, СН, JHH 8.1 Гц), 7.67 д (2Н,
СН, JHH 8.9 Гц), 7.24 с (H, СH), 3.02 с [6Н, (СН3)2].
org/0000-0002-5603-7385
Спектр ЯМР 13C, δC, м. д.: 165.92 (C2), 152.90 (C4),
Штейнгольц Сергей Андреевич, ORCID: http://
141.96 (HC=N), 130.91 (C1ʹ), 129.35 (C3ʹ, C5ʹ), 128.60
orcid.org/0000-0001-6265-5684
(C2ʹ, C6ʹ), 125.35 (C4ʹ), 115.72 (CN), 115.44 (CN),
Лодочникова Ольга Александровна, ORCID:
114.91 (CN), 99.69 (C3), 49.63 (C1), 42.45 (CH3),
8.72. Масс-спектр, m/z (Iотн, %): 290 (100) [M]+.
Найдено, %: C 65.86; H 4.03; N 28.08. C16H14N6.
КОНФЛИКТ ИНТЕРЕСОВ
Вычислено, %: C 66.19; H 4.86; N 28.95.
2-{3-[(2,2-Диметилгидразоно)метил]бензи-
Авторы заявляют об отсутствии конфликта
интересов.
лиден}малононитрил (6). Выход 64%, т. пл. 109-
111℃ (i-PrOH). ИК спектр, ν, см-1: 2222 (C≡N),
СПИСОК ЛИТЕРАТУРЫ
1600 (С=N), 1560 (C=C). Спектр ЯМР 1H, δ, м. д.:
8.51 с (1H, СН), 8.08 с (1Н, СН), 7.76 д (1H, СH,
1. Ahmed I., Fang Y., Lu M., Yan Q., El-Hussein A.,
Hamblin M. R., Dai T. // Recent Pat. Antiinfect. Drug
JHH 1.6 Гц), 7.74 д (1H, СH, JHH 1.6 Гц), 7.53 т
Discov. 2018. Vol. 13. N 1. P. 70. doi 10.2174/1872213
(1H, СH, JHH 7.7 Гц), 7.24 с (1H, СH), 2.95 с [6Н,
X11666171108104104
(СН3)2]. Спектр ЯМР 13C, δC, м. д.: 161.74 (C2),
2. Mahmoudi H., Bahador A., Pourhajibagher M., Alik-
138.31 (HС=N), 131.63 (C1ʹ), 130.88 (C3ʹ), 129.71
hani M.Y. // J. Lasers Med. Sci. 2018. Vol. 9. N 3. P. 154.
3. Levy J.G. // Semin. Oncol. 1994. Vol. 21. N 6.
(C6ʹ), 129.13 (C4ʹ), 128.41 (C5ʹ), 126.54 (C2ʹ), 114.33
Suppl. 15. P. 4.
(CN), 113.27 (C1), 42.47 (CH3). Масс-спектр, m/z
4. Boulos R.A. // Antonie van Leeuwenhoek. 2013.
(Iотн, %): 224 (100) [M]+. Найдено, %: C 68.81; H
Vol. 104. P. 155. doi 10.1007/s10482-013-9937-x
5.03; N 24.22. C13H12N4. Вычислено, %: C 69.62; H
5. Mayring L., Severin Th. // Chem. Ber. 1981. Vol. 114.
5.39; N 24.98.
N 12. P. 3863. doi 10.1002/cber.19811141210
6. Lerche H., Fischer H., Severin Th. // Chem. Ber. 1985.
3-(2,2-Диметилгидразоно)проп-1-ен-1,1,2-
Vol. 118. N 8. P. 3011. doi 10.1002/cber.19851180802
трикарбонитрил
(9). К раствору
2 ммоль
7. Severin Th., Lerch H., Zimmermann B. // Chem.
этен-1,1,2,2-тетракарбонитрила (0.256 г) в 2 мл
Ber. 1985. Vol. 118. N 12. P. 4760. doi 10.1002/
этилацетата добавляли 2 ммоль 1,1-диметил-2-ме-
cber.19851181211
8. Junek H., Hermetter A., Fischer-Colbrie H. // Chem.
тиленгидразина (0.144 г) в 1 мл того же раствори-
Ber. 1976. Vol. 109. N 5. P. 1787. doi 10.1002/
теля. Реакция протекала в течение 3-4 ч (контроль
cber.19761090522
ТСХ, гидрохиноновый тест). Смесь охлаждали до
9. Schmidt H.W., Gfrerer G., Junek H. // Zeit. Naturforsch.
5℃ и выдерживали 24 ч. Осадок отфильтровыва-
(B). 1982. Vol. 37. N 10. P. 1327. doi 10.1515/znb-
ли, промывали 2 мл охлажденного этилацетата.
1982-1020
10. Carrasco D., Bartulin F. // Rev. R. Acad. Cianc.
Выход 58%, т. пл. 124-126℃ (EtOAc). ИК спектр,
Exactas, Fis. Nat. Madrid. 1968. Vol. 62. P. 485 // C. A.
ν, см-1: 2207 (C≡N), 1701 (С=N). Спектр ЯМР 1H,
1969. Vol. 70. P. 28512n.
δ, м. д.: 7.24 с (1Н, СН), 3.62 с (3Н, СН3), 3.35 с
11. Samanta A., Paul B.K., Guchhait N. // Spectrochim
(3H, CH3). Спектр ЯМР 13C, δC, м. д.: 137.23 (C3),
Acta (A). 2011. Vol. 78. N 5. P. 1525. doi 10.1016/j.
123.45 (C2), 114.02 (CN), 112.57 (CN), 73.50 (C1),
saa.2011.01.044
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
СИНТЕЗ 2,2-ДИМЕТИЛГИДРАЗОНО-БУТ-2-ЕННИТРИЛОВ
1327
Synthesis of 2,2-Dimethylhydrazonebut-2-enenitriles
and [(2,2-Dimethylhydrazono)methyl]phenylacrylonitriles
for Development of Antimicrobial Fluorescent Dyes
M. A. Maryasova,*, V. V. Davydovaa, O. E. Nasakina, S. A. Shteingoltsb, and O. A. Lodochnikovab
a I. N. Ulyanov Chuvash State University, Cheboksary, 428015 Russia
b A. E. Arbuzov Institute of Organic and Physical Chemistry, Federal Research Center
“Kazan Scientific Center of the Russian Academy of Sciences”, Kazan, 420088 Russia
*e-mail: marsikprovisor@mail.ru
Received June 8, 2021; revised July 13, 2021; accepted July 16, 2021
To obtain new potential antimicrobial dyes and possible photosensitizers from the polymethine-nitrile dyes, a
series of reactions of some dialdehydes dimethylhydrazones with various nitrile-containing reagents was carried
out. As a result of the reactions, 4-(2,2-dimethylhydrazono)but-2-enenitriles and 3-{4-[(2,2-dimethylhydrazono)-
methyl]phenyl}acrylonitriles were obtained and some of their photophysical properties were studied.
Keywords: polymethine-nitrile dyes, photosensitizers, but-2-enenitriles, acrylonitriles, dimethylhydrazones,
ethene-1,1,2,2-tetracarbonitrile
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021