ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1328-1332
УДК 547.424
ГИДРИРОВАНИЕ ЗАМЕЩЕННЫХ
5-АЦИЛ-1,3-ДИОКСАНОВ
В ПРИСУТСТВИИ КАТАЛИЗАТОРА Pd/C
© 2021 г. Ю. Г. Борисоваа,*, А. И. Мусинb, Н. В. Якупова, Г. З. Раскильдинаа,
Р. Р. Даминевb, С. С. Злотскийа
а Уфимский государственный нефтяной технический университет, ул. Космонавтов 1, Уфа, 450064 Россия
bУ фимский государственный нефтяной технический университет, Стерлитамак, 453118 Россия
*e-mail: yulianna_borisova@mail.ru
Поступило в Редакцию 14 июня 2021 г.
После доработки 10 июля 2021 г.
Принято к печати 12 июля 2021 г.
Гидрирование замещенных 5-ацил-1,3-диоксанов в присутствии катализатора Pd/C приводит к образо-
ванию замещенных 1,3-диоксановых спиртов в качестве единственных продуктов реакции. Исследовано
влияние ряда факторов (температуры, скорости подачи водорода и сырья) на конверсию кетона и селек-
тивность образования спирта.
Ключевые слова: 5-ацил-1,3-диоксан, катализатор Pd/C, кетоны, гидрирование
DOI: 10.31857/S0044460X21090031
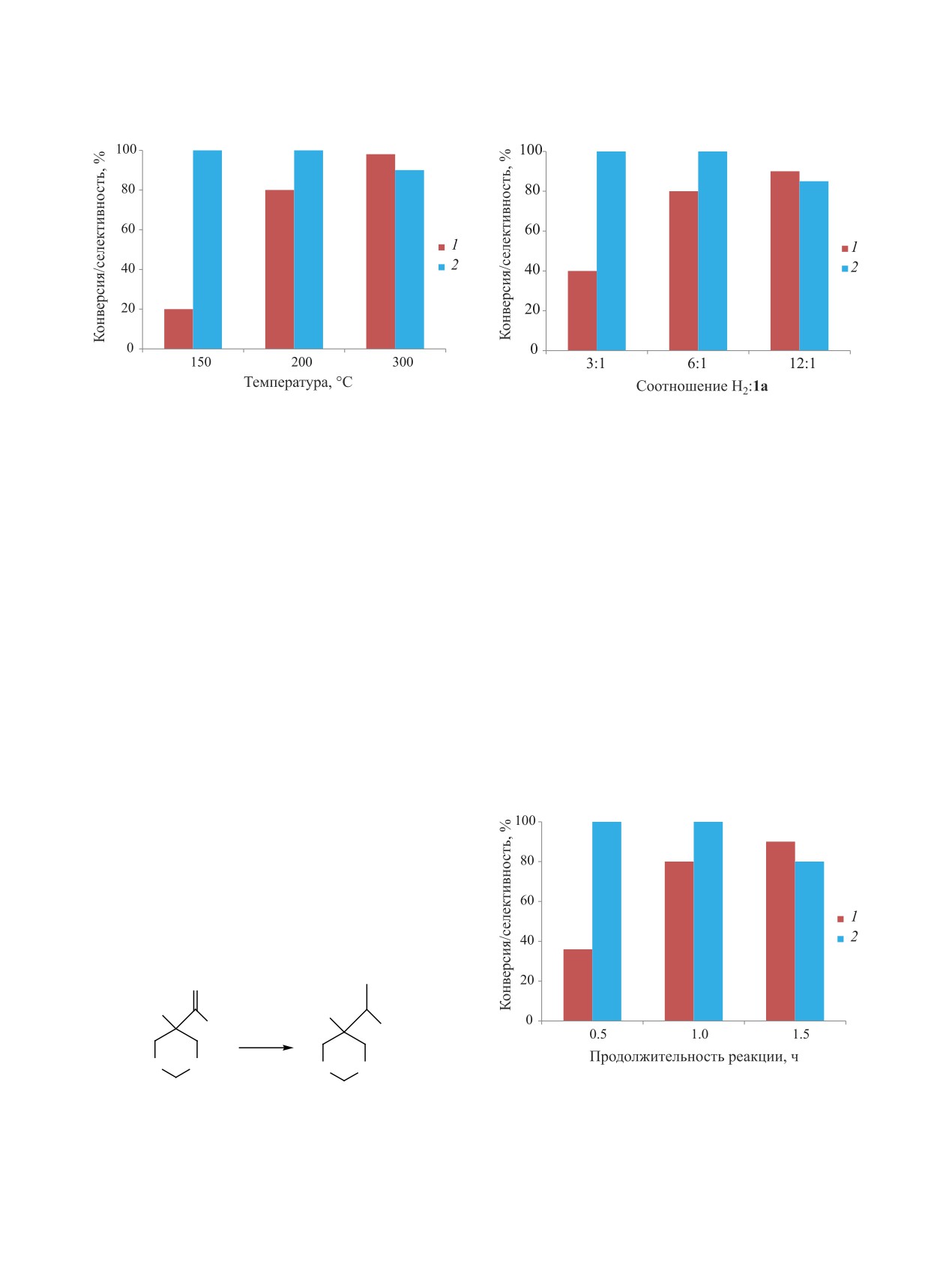
Гидроксиметил-1,3-диоксациклоалканы - цик-
В интервале температур 150-250°С конверсия ке-
лические ацетали триолов - находят широкое
тона 1а возрастает с 25 до 95%, тогда как селектив-
применение в синтезе растворителей, пластифи-
ность образования спирта 2а изменяется незначи-
каторов, химических средств защиты растений и
тельно (от 98 до 90%) (рис. 1).
др. [1-4]. Основной метод получения спиртов c
При 200°С с увеличением избытка водорода в
циклоацетальным фрагментом - конденсация три-
реакционной смеси от 3- до 6-кратного конверсия
олов с карбонильными соединениями [5, 6]. Для
соединения 1а возрастает от 45 до 80% (рис. 2).
получения вторичных 1,3-диоксациклоалкановых
С дальнейшим увеличением избытка водорода до
спиртов предложено восстанавливать оксогруппы
12-кратного незначительно изменяется конверсия
в 5-ацил-1,3-диоксанах гидридами металлов [7],
кетона 1а (92%) и снижается селективность обра-
но для препаративного синтеза в промышленных
зования спирта 2а (90%).
условиях этот метод гидрирования малопригоден.
Мы изучили гетерогенно-каталитическое ги-
Схема 1.
дрирование 5-ацил-1,3-диоксанов в присутствии
широко используемого катализатора Pd/C [8, 9].
OH
O
Было установлено, что в токе водорода кетон 1а
на катализаторе Pd/C восстанавливается до спирта
2а (схема 1).
H2
При температурах выше 250°С протекает гидро-
O O
Pd/C
O O
генолиз 1,3-диоксанов [10], что ограничивает воз-
1a
2a
можность повышения температуры гидрирования.
1328
ГИДРИРОВАНИЕ ЗАМЕЩЕННЫХ 5-АЦИЛ-1,3-ДИОКСАНОВ
1329
Рис. 1. Влияние температуры реакции на конверсию
Рис. 2. Влияние мольного соотношения Н2-1а на кон-
кетона 1а (1) и селективность образования спирта 2а
версию соединения 1а (1) и селективность образования
(2). Продолжительность реакции - 1 ч, мольное соот-
спирта 2а (2) при 200°C. Продолжительность реакции -
ношение кетон 1а:Н2 = 1:6.
1 ч.
При мольном соотношении Н2:1а = 6:1 увели-
Предложенный метод может быть использован
чение продолжительности пребывания кетона 1а
для препаративного получения вторичных гетеро-
в зоне реакции с 0.5 до 1 ч при 200°C конверсия
циклических спиртов из соответствующих кето-
возрастает с 35 до 80% (рис. 3). Увеличение про-
нов в условиях гетерогенного катализа.
должительности реакции до 1.5 ч увеличивает
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
конверсию соединения 1 до 95%, а селективность
образования спирта 2а снижается до 80%.
Для определения качественного и количе-
Следовательно, оптимальными условиями ги-
ственного состава использовали газожидкостную
дрирования (конверсия кетона 1а 80%, селектив-
хроматографию на аппаратно-программном ком-
ность образования спирта 2а 98%) являются: тем-
плексе Кристалл 2000 с детектором по теплопро-
пература 200°С, мольное соотношение Н2:1а = 6:1
водности, газ-носитель - гелий марки А, колонка
и продолжительность реакции 1 ч. В этих услови-
длиной 2 м и диаметром 5 мм (5% SE-30 на носи-
ях было проведено восстановление циклических
кетонов 1б, в до соответствующих спиртов 2б, в
(схема 2). Увеличение объема алкильного замести-
теля при карбонильной группе оказывает незначи-
тельное влияние на ход реакции (табл. 1).
Схема 2.
OH
O
R1
R1
R2
R2
H2
Pd/C
O O
O O
Рис. 3. Влияние продолжительности реакции на
конверсию кетона 1а (1) и селективность образо-
1б, в
2б, в
вания спирта 2а (2) при 200°C. Мольное соотно-
R1 = Et, R2 = Me (б); R1 = i-Pr, R2 = Me (в).
шение 1а:Н2 = 1:6.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1330
БОРИСОВА и др.
Таблица 1. Гидрирование замещенных 5-ацил-1,3-диоксанов 1а-в в присутствии Pd/Cа
Исходное соединение
Продукт реакции
Конверсия, %
Селективность, %
1а
2а
80
98
1б
2б
85
95
1в
2в
85
95
а Условия синтеза: температура 200°С, продолжительность реакции 1 ч, мольное соотношение кетон 1а:Н2 = 1:6.
теле Chromaton N-AW; программированный тем-
(3 мм рт. ст.). Спектр ЯМР 1 Н, δ, м. д. (J, Гц): 0.75
пературный режим: термостатирование колонок
т (3Н, СН3СН2, J 7.6), 1.48 к (2Н, СН3СН2, J 7.6),
при 80-250°С, скорость подъема температуры -
2.25 с (3Н, СН3СО), 3.57 д (2Н, ССН2, J 11.5), 4.32
10 град/мин, температура испарителя и детектора -
д (2Н, ССН2, J 11.5), 4.68 д (1Н, СНAО, J 6.0), 4.88
250°С). Масс-спектры регистрировали на прибо-
д (1Н, СНBО, J 5.9). Спектр ЯМР 13С, δС, м. д.: 7.78
ре Хроматэк-Кристалл 5000М с базой NIST 2012
(СН3СН2,), 25.08 (СН3СН2), 26.98 (СН3СО), 51.10
(длина колонки - 30 м, внутренний диаметр -
(С), 71.95 (2СН2), 94.17 (СН2О), 208.91 (С=О).
0.25 мм, толщина фазы - 0.25 мкм при потоке че-
Масс-спектр, m/z (Iотн, %): 158 (1) [M]+, 128 (10), 99
рез колонку 1.0 мл/мин, газ-носитель - гелий мар-
(5), 83 (30), 71 (7), 67 (10), 57 (20), 43 (100). Масс-
ки А, температура источника ионов - 260°С). Про-
спектр, m/z (Iотн, %): 158.0831 (1) [М + H]+.
граммирование температуры термостата колонки
1-(5-Изопропил-1,3-диоксан-5-ил)этанон
с 80 до 290°С со скоростью 20 град/мин. Для полу-
(1в). Выход 80%, бесцветная жидкость, т. кип.
чения масс-спектров использовали метод иониза-
129-131°С (3 мм рт. ст.). Спектр ЯМР 1 Н, δ, м. д.
ции электронным ударом. Масс-спектры высокого
(J, Гц): 0.9 д (3Н, СН3СН, J 7.0), 1.00 д (3Н, СН3СН,
разрешения для соединений 1б и 2б зарегистриро-
J 7.0), 1.63 м (2Н, СН3СН), 2.27 с (3Н, СН3СО),
ваны на приборе Bruker maXis impact (тандемный
3.48 д (2Н, ССН2, J 11.5), 4.34 д (2Н, ССН2, J 11.4),
квадрупольный/времяпролетный масс-анализа-
4.62 д (1Н, СНАО, J 6.0), 4.98 д (1Н, СНБО, J 6.0).
тор) (Германия), оборудованном источником иони-
Спектр ЯМР 13С, δС, м. д.: 16.02 (СН3СН), 26.94
зации электрораспылением. Диапазон сканирова-
(СН3СО), 29.29 (СН3СН), 51.18 (С), 71.76 (2СН2),
ния m/z 100-1000. Измерения проводили в режиме
94.12 (СН2О), 209.93 (С=О). Масс-спектр, m/z (Iотн,
регистрации положительных ионов. Данные обра-
%): 158 (2) [M]+, 12 (50), 110 (20), 99 (30), 86 (70),
батывали с использованием программного пакета
83 (80), 71 (20), 57 (40), 43 (100).
Bruker Compass DataAnalysis 5.1. Спектры ЯМР
Физико-химические константы кетонов 1а, в
получены на приборе Bruker AM-500 с рабочими
соответствуют литературным данным [11].
частотами 500 и 125 МГц, растворитель - CDCl3.
Общая методика гидрирования кетонов
Исходные кетоны 1а-в получали по известной
1а-в. Катализатор Pd/C (CAS 7440-05-3, ТУ 2172-
методике [11].
013-94509069-200, количество палладия 5%) пе-
1-(5-Метил-1,3-диоксан-5-ил)этанон
(1а).
ред использованием измельчали в ступке, просе-
Выход 85%, бесцветная жидкость, т. кип. 99-101°С
ивали и хранили в эксикаторе. Для гидрирования
(3 мм рт. ст.). Спектр ЯМР 1 Н, δ, м. д. (J, Гц): 0.92 с
использовали проточную каталитическую уста-
(3Н, СН3С), 2.22 с (3Н, СН3СО), 3.45 д (2Н, ССН2,
новку Катакон, состоящую из металлического ре-
J 11.6), 4.24 д (2Н, ССН2, J 11.6), 4.70 д (1Н, СНАО,
актора с нагревательной рубашкой, бюреткой для
J 6.1), 4.74 д (1Н, СНВО, J 6.0). Спектр ЯМР 13С,
подачи сырья, автоматического насоса и блока
δС, м. д.: 18.28 (СН3С), 26.96 (СН3СО), 51.15 (С),
управления. Рабочие параметры установки: объем
71.22 (2СН2), 94.55 (СН2О), 208.92 (С=О). Масс-
реакционной зоны - 15 см3, диапазон температур -
спектр, m/z (Iотн, %): 144 (2) [M]+, 114 (30), 84 (10),
50-600°С, давление до 100 атм.
72 (40), 69 (50), 57 (30), 43 (100).
В проточный реактор загружали активиро-
1-(5-Этил-1,3-диоксан-5-ил)этанон (1б). Вы-
ванный катализатор Pd/C. При заданной темпе-
ход 80%, бесцветная жидкость, т. кип. 110-112°С
ратуре (150, 200 или 250°С) со скоростью 0.12
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ГИДРИРОВАНИЕ ЗАМЕЩЕННЫХ 5-АЦИЛ-1,3-ДИОКСАНОВ
1331
или 0.27 либо 0.5 мл/мин подавали 15 мл кетона
ИНФОРМАЦИЯ ОБ АВТОРАХ
(0.01 моль), водород со скоростью 0.125 или 0.230
Мусин Айрат Ильдарович, ORCID: 0000-0002-
либо 0.460 мл/мин и устанавливали давление на
8662-9680
уровне 8 кг/см. Полученный катализат отфильтро-
вывали и упаривали.
Раскильдина Гульнара Зинуровна, ORCID:
0000-0001-9770-5434
1-(5-Метил-1,3-диоксан-5-ил)этанол
(2а).
Выход
80%, бесцветная жидкость, т. кип.
Якупов Наиль Владиславович, ORCID: 0000-
0002-5055-084X
105-106°С (3 мм рт. ст.). Спектр ЯМР 1 Н, δ, м. д.
(J, Гц): 0.83 с (3Н, СН3С), 1.14 д (3Н, СН3СН2,
ФОНДОВАЯ ПОДДЕРЖКА
J 6.5), 2.22 с (3Н, СН3СО), 3.45 д. д (2Н, ССН2,
J 11.4, 11.5), 3.75 д (1Н, СНОН, J 11.4), 4.24 д. д
Работа выполнена при финансовой поддержке
(2Н, ССН2, J 11.6, 11.2), 4.70 д (1Н, СНАО, J 6.1),
Уфимского государственного нефтяного техни-
4.74 д (1Н, СНВО, J 6.0). Спектр ЯМР 13С, δС, м. д.:
ческого университета (конкурс лидерских проек-
14.28 (СН3С), 18.47 (СН3С), 26.96 (СН3СО), 39.66
тов, номинация «Фонд научных исследований»).
(С), 69.44 (СН), 71.43 (ССН2), 71.92 (ССН2), 94.55
Структурные исследования проведены в Регио-
(СН2О). Масс-спектр, m/z (Iотн, %): 146 (2) [M]+, 98
нальном центре коллективного пользования Аги-
(10), 86 (20), 72 (100), 57 (95), 43 (90).
дель Уфимского федерального исследовательского
1-(5-Этил-1,3-диоксан-5-ил)этанол
(2б).
центра РАН в рамках выполнения государственно-
го задания (тема АААА-А19-119022290004-8).
Выход
85%, бесцветная жидкость, т. кип.
122-123°С (3 мм рт. ст.). Спектр ЯМР 1 Н, δ, м. д.
СПИСОК ЛИТЕРАТУРЫ
(J, Гц): 0.8 т (3Н, СН3СН2, J 11.9), 1.15 д (1Н,
СН3СН, J 6.5), 1.42-1.55 м (2Н, СН3СН2), 3.75 д.
1. Яковенко Е.А., Раскильдина Г.З., Мрясова Л.М.,
д (2Н, ССН2, J 11.7, 11.4), 3.88 д (1Н, СНОН, J
Злотский С.С. // Хим. и технол. орг. веществ. 2019.
Т. 3. № 11. С. 4.
11.6), 4.08 д. д (2Н, ССН2, J 6.8, 10.5), 4.75 д (1Н,
2. Genta M.T., Villa C., Mariani E., Loupy A., Petit A.,
СНAО, J 6.0), 4.85 д (1Н, СНBО, J 6.0). Спектр ЯМР
Rizzetto R., Mascarotti A., Morini F., Ferro M. // Int. J.
13С, δС, м. д.: 8.49 (СН3СН2), 17.49 (СН3СН), 26.81
Pharm. 2002. Vol. 231. Р. 11.
(СН3СН2), 37.74 (С), 68.38 (СНОН), 73.46 (ССН2),
3. Максимов А.Л., Нехаев А.И., Рамазанов Д.Н. //
74.13 (ССН2), 94.05 (СН2О). Масс-спектр, m/z (Iотн,
Нефтехимия. 2015. Т. 55. № 1. С. 1; Maximov A.L.,
%): 160 (≤1) [M]+, 98 (10), 86 (60), 72 (100), 57 (95),
Nekhaev A.I., Ramazanov D.N. // Petroleum Chem.
43 (90). Масс-спектр, m/z (Iотн, %): 160.0999 (100)
2015. Vol.
55. N
1. Р.
1. doi
10.1134/
[М + H]+.
S0965544115010107
4. Раскильдина Г.З., Султанова Р.М., Злотский С.С. //
1-(5-Изопропил-1,3-диоксан-5-ил)этанол
Изв. Уфимск. научн. центра РАН. 2019. № 3. С. 5.
(2в). Выход 85%, бесцветная жидкость, т. кип.
5. Валиев В.Ф., Раскильдина Г.З., Султанова Р.М.,
131-132°С (2 мм рт. ст.). Спектр ЯМР 1 Н, δ, м. д.
Злотский С.С. // ЖПХ. 2015. Т. 88. Вып. 10. C. 1414;
(J, Гц): 0.9 д (3Н, СН3СН, J 9.1), 1.00 д (3Н, СН3СН,
Raskil’dina G.Z., Valiev V.F., Sultanova R.M., Zlots-
J 7), 1.27 д (1Н, СН3СН, J 6.5), 1.73-1.81 м (2Н,
kii S.S. // Russ. J. Appl. Chem. 2015. Vol. 88. N 10.
СН3СН), 3.72 д. д (2Н, ССН2, J 6.0, 11.0), 4.00 д
P. 1599. doi 10.1134/S1070427215100079
(1Н, СНОН, J 11.6), 4.12 д. д (2Н, ССН2, J 6.6, 11.5),
6. Sultanova R.М., Raskil’dina G.Z., Borisova Y.G.,
4.67 д (1Н, СНAО, J 5.8), 4.88 д (1Н, СНBО, J 5.8).
Zlotskii S.S. // J. Chin Chem. Soc. 2020. Р. 1. doi
Спектр ЯМР 13С, δС, м. д.: 16.02 (СН3СН), 19.27
10.1002/jccs.201900401
7. Lesnikova E.T., Zlotskii S.S., Rakhmankulov D.L. //
(СН3СН), 26.91 (СН3СО), 39.17 (С), 68.44 (СНОН),
Chem. Heterocycl. Compd. 1991. Vol. 27. N 1. P. 30.
72.41 (ССН2), 72.66 (ССН2), 94.14 (СН2О). Масс-
doi 10.1007/BF00633211
спектр, m/z (Iотн, %): 160 (2) [M]+, 72 (60), 57 (50),
8. Мусин А.И., Раскильдина Г.З., Борисова Ю.Г., Злот-
45 (30), 43 (70), 39 (20), 32 (100).
ский С.С. // Тонкие химические технологии. 2020.
Физико-химические константы спиртов 2а, в
Т. 15. № 5. С. 16; Musin A.I., Borisova Yu.G.,
соответствуют литературным данным [11].
Raskil’dina G.Z., Rabaev R.U., Daminev R.R., Zlot-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1332
БОРИСОВА и др.
skii S.S. // Fine Chem. Technol. 2020. Vol. 15. N 5.
10. Апьок Й., Барток М., Караханов Р.А., Шуй-
Р. 16. doi 10.32362/2410-6593-2020-15-5-16-25
кин Н.И. // Усп. хим. 1969. 38. № 1. С. 72; Apok I.,
Bartok M., Karakhanov R.A., Shuikin N.I. // Russ.
9. Акчурин Т.И., Байбулатова Н.З., Докичев В.А. //
Chem. Rev. 1969. Vol. 38. N 1. P. 37. doi 10.1070/
ЖОХ. 2018. Т. 88. Вып. 2. С. 215; Akchurin T.I.,
RC1969v038n01ABEH001723
Baibulatov N.Z., Dokichev V.A. // Russ. J. Gen.
11. Zlotskij S.S., Lesnikova E.T., Rachmankulov D.L.,
Chem. 2018. Vol. 88. N 2. Р. 195. doi 10.1134/
Timpe H.-J. // Z. Chem. 1990. 30. N 8. Р. 281. doi
S1070363218020032
10.1002/zfch.19900300804
Pd/C-Catalyzed Hydrogenation
of Substituted 5-Acyl-1,3-dioxanes
Yu. G. Borisovaa,*, A. I. Musinb, N. V. Yakupova, G. Z. Raskildinaa,
R. R. Daminevb, and S. S. Zlotskiia
a Ufa State Petroleum Technical University, Ufa, 450064 Russia
b Ufa State Petroleum Technological University, Sterlitamak, 453118 Russia
*e-mail: yulianna_borisova@mail.ru
Received June 14, 2021; revised July 10, 2021; accepted July 12, 2021
Hydrogenation of substituted 5-acyl-1,3-dioxanes in the presence of a Pd/C catalyst leads to the formation of
substituted 1,3-dioxane alcohols as the only reaction products. The effect of a number of factors (temperature,
rate of hydrogen and substrate supply) on the conversion of the ketone and the selectivity of the formation of
alcohol was investigated.
Keywords: 5-acyl-1,3-dioxane, Pd/C catalyst, ketones, hydrogenation
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021