ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1390-1396
УДК 547.979.8;577.151.43
ХЕМОЭНЗИМНЫЙ СИНТЕЗ all-trans-ИЗОМЕРОВ
ЛЮТЕИНА И ЗЕАКСАНТИНА
© 2021 г. С. В. Печинскийa,*, А. Г. Курегянa, Э. Т. Оганесянa
a Пятигорский медико-фармацевтический институт, филиал Волгоградского государственного медицинского
университета Министерства здравоохранения России, пр. Калинина 11, Пятигорск, 357532 Россия
*e-mail: hplc@yandex.ru
Поступило в Редакцию 1 июля 2021 г.
После доработки 21 июля 2021 г.
Принято к печати 26 июля 2021 г.
Предложен способ синтеза all-trans-изомеров лютеина и зеаксантина, который включает этап этерифи-
кации лютеина и зеаксантина бензойной кислотой в присутствии энантиоселективной липазы Novozyme
435. Дальнейший гидролиз дибензоатов лютеина и зеаксантина приводит к образованию исходных
ксантофиллов только в all-trans-конфигурации.
Ключевые слова: лютеин, зеаксантин, бензойная кислота, этерификация, Новозим 435 (Novozyme 435),
сложные эфиры
DOI: 10.31857/S0044460X21090109
Предыдущие наши сообщения были посвяще-
необходимость развития идеи получения ксанто-
ны разработке методики модификации структур
филлов с определенной геометрической конфигу-
ксантофиллов с целью обоснования получения це-
рацией как объектов дальнейшей химической мо-
левых соединений на их основе. Эксперимент про-
дификации.
водился на примере астаксантина, лютеина и зеак-
Так, природные лютеин и зеаксантин преиму-
сантина природного происхождения [1, 2]. Нас, в
щественно являются полностью транс-изомера-
первую очередь, интересовала сама возможность
ми. Для них возможны стереоизомеры R и S по
этерификации ксантофиллов с целью дальнейшей
положению 3 и 3′, а также цис- и транс-изомеры
химической оптимизации молекулы и поэтому мы
по положениям 9, 9′ и 13, 13′ [5, 6]. Геометрия
не ставили целью предыдущего эксперимента по-
молекулы каротиноидов, в частности лютеина и
лучить продукт с определенной геометрической
зеаксантина, играет важнейшую роль в их фар-
конфигурацией. Однако, когда методика этерифи-
макологической активности и биодоступности
кации разработана, опубликована и в соответствии
[7, 8]. Нативной конфигурацией для обоих соеди-
с ней получены новые экспериментальные соеди-
нений является транс-форма, которая обеспечива-
нения [3, 4], несомненно, встал вопрос о геометри-
ет максимальное сродство с рецепторами, и, сле-
ческой конфигурации и исходных ксантофиллов, и
довательно, биологическое действие [9].
продуктов их этерификации, и их изомерных форм.
Эту задачу тем более необходимо решать, так как
Еще одной значимой проблемой, связанной с
каротиноиды - это рекордсмены среди природных
каротиноидами в целом, является то, что человече-
соединений по числу возможных изомеров, а боль-
ский организм не способен синтезировать кароти-
шинство групп лекарственных веществ, которые
ноиды de novo [10]. Это в полной мере относится к
было бы логично в дальнейшем использовать для
лютеину и зеаксантину, которые называют «маку-
этерификации ксантофиллов, тоже могут иметь
лярными ксантофиллами». Они избирательно на-
изомеры. В связи с этим становится очевидной
капливаются в макуле, предотвращая фотоокисли-
1390
ХЕМОЭНЗИМНЫЙ СИНТЕЗ all-trans-ИЗОМЕРОВ
1391
тельный стресс, способны подавлять возрастную
и принципиальное значение в области не только
макулярную дегенерацию, и поэтому являются
синтеза фармакологически активных субстанций,
незаменимыми компонентами пищевого рациона
но и создания стандартных образцов для любых
и пищевыми добавками [11, 12].
классов соединений, так как их использование
обеспечивает не только аналитическую достовер-
По сведениям разных авторов, среднее потре-
ность и воспроизводимость исследований, но и
бление лютеина в сутки составляет 1-3.5 мг/сут,
достоверность фармакологического эксперимента.
а зеаксантина - 0.1 мг/сут [13, 14]. В России ре-
комендован суточный прием лютеина до 5 мг/сут,
Решить фактически все эти проблемы можно,
для зеаксантина - до 1 мг/сут [15]. Как уже отме-
опираясь на один из важнейших приоритетов в со-
чалось выше, значимым фактором, влияющим на
временном фармацевтическом синтезе - концеп-
степень усвоения каротиноидов, является не толь-
цию «зеленой» химии, которая объединяет 12 на-
правлений экологичных химических технологий.
ко количество потребляемого каротиноида, но его
геометрическая конфигурация.
Внедрение принципов «зеленого» синтеза - это
яркое проявление современного тренда и запроса
Получение каротиноидов из природного сы-
на будущее в области разработки новых лекар-
рья подразумевает его технологическую обра-
ственных средств. Следует выделить некоторые
ботку, например, экстракцию. Так, традиционная
пункты концепции «зеленой» химии, которые име-
экстракция каротиноидов из растительных объ-
ют непосредственное отношение к фармацевтиче-
ектов проводится при высоких температурах, в
скому синтезу и тематике нашего исследования, -
большей степени неполярными растворителями,
оптимальный катализ, минимизация использова-
например, н-гесаном или хлороформом, требует
ния вспомогательных веществ в ходе синтеза и
дополнительной обработки сырья вспомогатель-
снижение энергозатрат синтеза [20].
ными реагентами. В результате большинства тех-
Идея получения соединений в форме только
нологических операций, как правило, происходит
одного из изомеров может быть реализована пу-
частичный переход транс-изомеров в цис-формы,
тем стереоселективного синтеза. Инструментом
что не может не влиять на биодоступность и фи-
для достижения такой цели во всем мире является
зиологическую активность каротиноидов
[16].
хемоэнзимный синтез, который по совокупности
Изомеризацию ксантофиллов могут иницииро-
условий проведения является примером практи-
вать различные факторы, например, механическое
ческого применения принципов «зеленой» химии.
воздействие, в частности интенсивное перемеши-
Такой прогрессивный подход имеет несколько
вание [17], присутствие катионов металлов [18],
преимуществ перед традиционным химическим
повышение температуры, воздействие света [19].
синтезом, а именно стереоселективность, возмож-
Эти негативные с точки зрения геометрии молеку-
ность проведения реакций без нагревания или при
лы ксантофилла факторы следует учитывать при
невысоких температурах, без повышения давле-
разработке способов и методик их получения.
ния, без использования агрессивных растворите-
Лютеин и зеаксантин получают не только экс-
лей. Кроме того, применение энзимов позволяет
тракцией из растительных объектов, но и синте-
проводить синтезы в органических (неводных)
тическим путем, который характеризуется зна-
средах, а иммобилизация энзимов решает вопросы
чительной многостадийностью, использованием
их повторного использования [21].
агрессивных реагентов, катализаторов и высокой
Липазы, благодаря их уникальным свойствам,
энергозатратностью и обладает низкой энантиосе-
все чаще используются в биокаталитических ре-
лективностью.
акциях. Они могут катализировать как реакции
Следует подчеркнуть, что в целом проблема по-
гидролиза, так и этерификации в зависимости от
лучения и использования субстанций с большим
условий. В отличие от других ферментов, они ра-
диапазоном изомерных форм является важной не
ботают в реакциях с сильно отличающимися суб-
только для каротиноидов. Получение образцов,
стратами, что позволяет использовать широкий
содержащих только один тип изомеров, с высо-
спектр различных спиртов и карбоновых кислот
ким уровнем чистоты имеет общетеоретическое
в реакциях этерификации [22]. Липазы облада-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1392
ПЕЧИНСКИЙ и др.
ют высокой энантиоселективностью за счет про-
цикле активность не падает ниже 80%, что явля-
странственного строения активного домена.
ется важной экономической составляющей. Таким
образом, в эксперименте были учтены некоторые
Расположение аминокислот в активном центре
липаз, взаимодействующим с субстратом, не по-
принципы «зеленого» синтеза, что может быть
преимуществом нашей методики перед ранее из-
зволяет образовываться нескольким изомерным
вестными в случае ее опытно-промышленного
формам целевого продукта. Боковые цепи амино-
масштабировании.
кислот, входящих в активный центр, создают мак-
симально узкий промежуток-тоннель между ними,
В качестве кислоты для реакции этерификации
за счет чего пространственно ориентируют моле-
нами было предложено использовать кислоту бен-
кулы только в одном направлении. В настоящее
зойную, так как она является ароматическим сое-
время липазы с заданными энантиоселективными
динением, имеет относительно простое строение,
свойствами получают методом направленной эво-
является мало токсичной, обладает свойствами
люции [23].
консерванта и была ранее использована для полу-
чения эфиров ксантофиллов. Вероятней всего, для
Учитывая все эти преимущества липаз, мы
получения транс-изомеров лютеина и зеаксантина
предположили, что хемоэнзимный синтез можно
использовать для получения all-trans-изомеров
можно использовать и другие кислоты, с которыми
ранее были получены сложные эфиры лютеина и
лютеина и зеаксантина.
зеаксантина [1, 2].
В качестве биокатализатора в эксперименте
В качестве объектов исследования, характе-
мы использовали иммобилизированную Candida
ризующихся наличием изомерных форм, исполь-
antarctica липазу В, выпускаемую под коммерче-
зовали образцы лютеина и зеаксантина (Sigma-
ским наименованием Novozyme 435, которая обла-
Aldrich), полученные из растительных объектов
дает высокой стабильностью и активностью в ор-
ганических растворителях и катализирует реакции
по ранее описанной методике [26-28] и их изоме-
ризованные формы.
с соединениями, имеющими ароматические фраг-
менты в структуре. Кроме того, этот тип биоката-
Все образцы предварительно были проанализи-
лизатора использовался при синтезе пальмитата
рованы метом ВЭЖХ. Установлено, что в образ-
ретинола [24] и лаурата ретинола [25] с образова-
цах лютеина и зеаксантина производства Sigma-
нием транс-изомеров этих эфиров.
Aldrich содержание транс-изомеров составляло
95.2 и 94.7%. В лютеине и зеаксантине, получен-
Использование биокатализатора Novozyme 435
ных из природных объектов, содержание транс-
позволяет избежать использования агрессивных
изомеров равно
76.4 и
73.1% соответственно
дополнительных реактивов, характерных для клас-
(табл. 1).
сической схемы этерификации, тем самым снижа-
ет значение Е-фактора синтеза [20]. Кроме того,
Изомеризацию исходных ксантофиллов прово-
эффективность этерификации сильно зависит от
дили, используя положительные результаты экс-
температуры. Повышение температуры увеличи-
периментов, описанные в работах [25, 29]. Для
вает выход продукта, но при температурах выше
изомеризации ксантофиллов 2 ммоль гексановые
50°С наблюдается деградация фермента и ксанто-
растворы лютеина и зеаксантина обрабатывали
филла и со временем снижается эффективность,
1 ммоль раствором иода. Дополнительно на ре-
поэтому нами была выбрана температура 37°С как
акционную смесь воздействовали флуоресцент-
баланс между эффективностью и стабильностью.
ной лампой мощностью 25 Вт в течение 10 мин.
Синтез при температуре ниже 40°С - это еще одно
После изомеризации количество транс-изомеров
преимущество методики с позиций
«зеленой»
лютеина и зеаксантина в образцах составляло 57.5
химии, так ка при промышленном масштабиро-
и 52.3% соответственно. Анализ всех полученных
вании произойдет резкое снижение энергозатрат
образцов после синтеза показал высокую чистоту
для получения целевого продукта. Несомненным
и содержание транс-изомеров более 99% (табл. 1),
плюсом данного подхода является многократное
что подтверждает высокую энантиоселективность
использование биокатализатора, даже на десятом
данного способа.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ХЕМОЭНЗИМНЫЙ СИНТЕЗ all-trans-ИЗОМЕРОВ
1393
Таблица 1. Содержание транс-изомеров в субстанциях лютеина и зеаксантина
Содержание транс-изомеров, %
Образцы
до синтеза
после синтеза
Лютеин (Sigma-Aldrich)
95.2
99.7
Зеаксантин (Sigma-Aldrich)
94.7
99.5
Лютен из растительного объекта
76.4
99.6
Зеаксантин из растительного объекта
73.1
99.4
Лютеин после изомеризации
57.5
99.4
Зеаксантин после изомеризации
52.3
99.3
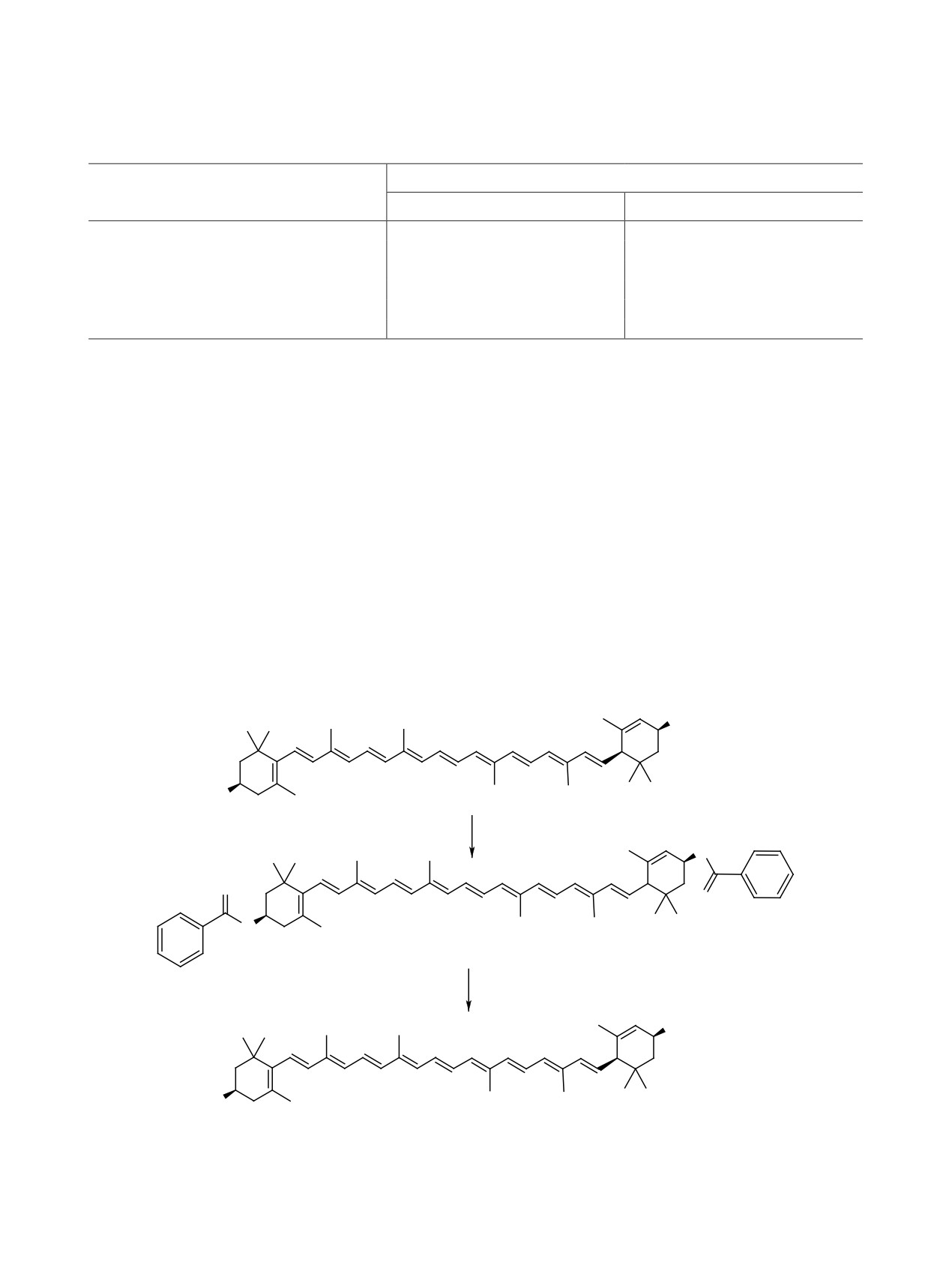
Преимуществом предложенного способа явля-
На первой стадии проводится этерификация
ется то, что его можно использовать для объектов
ксантофиллов, катализируемая иммобилизиро-
с исходным низким содержанием транс-изомеров.
ванным энантиоселекстивным энзимом Novozyme
Причем выход продукта реакции несколько выше,
435. Этерификация ксантофилла происходит в
чем содержание транс-изомеров в первоначаль-
активном центре энзима. Этот центр представля-
ном образце. Это, по-видимому, связано с перехо-
ет собой «карман», который является доступным
дом цис-изомеров в транс-форму под действием
только для одного типа изомера ксантофилла и
фермента или других благоприятных условий об-
помимо этого стабильно, и, вероятней всего, не-
ратной изомеризации.
обратимо изомеризует структуру каротиноида под
Таким образом, нами предложен двухступенча-
себя. В результате этого продуктом реакции на
тый способ получения all-trans-изомеров зеаксан-
первой стадии является дибензоат all-trans-люте-
тина и лютеина (схема 1).
ина или -зеаксантина, а последующий гидролиз
Схема 1.
OH
HO
лютеин
Novozyme 435
O
O
O
O
дибензоат all-trans-лютеина
OH
HO
all-trans-лютеин
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1394
ПЕЧИНСКИЙ и др.
этих транс-эфиров на втором этапе позволяет по-
лампой мощностью 25 Вт в течение 10 мин. Не-
лучить каротиноид в all-транс-конфигурации.
прореагировавщий иод отмывали 10%-ным спир-
товым раствором иодида калия.
Резюмируя обсуждение результатов экспери-
мента, можно констатировать, что предложенный
Методика получения all-trans-изомеров лю-
способ получения all-транс-изомеров лютеина и
теина или зеаксантина. К раствору 2 ммоль лю-
зеаксантина имеет перспективы использования
теина или зеаксантина в 20 мл н-гексана добав-
при получении субстанций и стандартных образ-
ляли 0.3 г Novozyme 435 и избыток бензойной
цов, содержащих только один тип изомера, причем
кислоты (0.6 г, 5 ммоль). Полученную реакцион-
для объектов с изначально низким содержанием
ную смесь перемешивали в течение 12 ч при 37°С
транс-изомеров; способ может применяться для
со скоростью 50 об/мин. После окончания реакции
очистки указанных ксантофиллов, полученных из
этерификации иммобилизированный фермент от-
природного сырья, или после неправильного хра-
деляли фильтрованием. Для отделения непрореа-
нения. Разработанный способ отвечает требовани-
гировавшей бензойной кислоты, изомеров лютеи-
ям концепции «зеленого» синтеза, отличается эко-
на или зеаксантина фильтрат охлаждали до -4°С.
номическим и технологическим преимуществом и
Полученный раствор фильтровали, к фильтрату
с этих позиций он имеет приоритет в случае про-
прибавляли 80 мл ацетона и охлаждали до -10°С в
мышленного масштабирования.
течение 12 ч. Дибензоаты лютеина и зеаксантина,
которые кристаллизуются при температуре ниже
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
-7°С, отделяли фильтрованием.
Лютеин и зеаксантин, использованные в экспе-
К полученным эфирам прибавляли
50 мл
рименте, были получены по методикам, описан-
10%-ного спиртового раствора гидроксида ка-
ным в работах [26-28].
лия и перемешивали в течение 3 ч со скоростью
Регистрацию спектров ЯМР
1Н проводи-
100 об/мин при температуре 40°С. За ходом реак-
ли на спектрометре Bruker AMXIII-400 при
ции омыления следили с помощью ВЭЖХ-анали-
400 МГц в ДМСО-d6, внутренний стандарт - ТМС.
за, чтобы определить завершение омыления, о чем
Масс-спектры регистрировали на масс-спектроме-
свидетельствует полное исчезновение пика эфира.
тре Agilent 6420, сопряженном с ВЭЖХ-системой
Далее раствор количественно переносили в дели-
Agilent HPLC 1100, методом химической иониза-
тельную воронку, прибавляли 100 мл н-гексана и
ции при атмосферном давлении (APCI), темпе-
5 г сульфата натрия, перемешивали 10 мин и от-
ратура ионного источника - 120°C, газ-носитель
деляли верхний слой органического растворите-
- гелий, энергия CID - 40 эВ. Параметры ВЭЖХ:
ля. Раствор промывали водой, очищенной до зна-
колонка Dionex Acclaim C30 (250x4.6 мм × 5 мкм),
чения рН 7. Полученный раствор охлаждали при
температура колонки - 30°С; УФ детектор 445 нм;
температуре -20°С в течение 12 ч. транс-Изомеры
линейный градиент: подвижная фаза - метанол-
лютеина или зеаксантина отделяли фильтровани-
трет-бутилметиловый эфир:ацетонитрил (90:5:5,
ем. На всех этапах получения реакционные смеси
фаза А), трет-бутилметиловый эфир-метанол-
предохраняли от действия света и кислорода воз-
ацетонитрил (90:5:5, фаза Б); линейный градиент:
духа, учитывая высокую светочувствительность и
фазы А-Б (100:1%)→А-Б (10:90%) за 90 мин;
способность к окислению лютеина и зеаксантина.
объем пробы - 20 мкл, скорость подвижной фазы -
all-trans-β,ε-Каротин-3,3′-дибензоат (1).Выход
1.0 мл/мин; объем пробы, автоматически вводимой
1.12 г (69%), т. пл. 166-168°С. Спектр ЯМР 1Н, δ,
в масс-детектор, - 20 мкл. Температуры плавления
м. д. (J, Гц): 1.05 c (6Н, Ме16′,17′), 1.17 c (6Н, Ме16,17),
определены на приборе ПТП (М).
1.62 с (3Н, Ме5′), 1.74 c (3Н, Ме5), 1.84 т (1H, H2,
Методика получения смеси изомеров (изо-
J 12.0), 1.89 д. д (1Н, H2′, J 13.1, 7.4), 1.92 c (3Н,
меризация). К раствору 2 ммоль лютеина или зе-
Ме19′), 1.97 c (9Н, Ме19,20,20′), 2.29 д. д (1H, ax-H4,
аксантина в 20 мл н-гексана прибавляли 1 ммоль
J 16.5, 9.5), 2.58 м (1Н, eq-H4, J 16.5), 5.55 с (1H,
иода. Реакционную смесь при перемешивании со
H4′), 6.10 c (2Н, Н7,8), 6.14 м (3Н, Н8′,10,10′), 6.27 м
скоростью 50 об/мин облучали флуоресцентной
(2Н, Н14,14′), 6.36 д (2Н, Н12,12′, J 14.5), 6.65-6.71 м
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ХЕМОЭНЗИМНЫЙ СИНТЕЗ all-trans-ИЗОМЕРОВ
1395
(4Н, Н11,11′,15,15′), 7.45 д (4H, HAr, J 8.5), 7.57 т (2H,
2.
Печинский С.В., Курегян А.Г., Оганесян Э.Т. // ЖОХ.
HAr, J 7.5), 8.06 д (4H, HAr, J 2.0). Масс-спектр, m/z:
2020. Т.90. № 5. С. 730; Pechinsky S.V., Kuregyan A.G.,
Oganesyan E.T. // Russ. J. Gen. Chem. 2020. Vol. 90.
777.4851 [M + Н]+ (вычислено для С54Н64О4Н+:
N 5. P.827. doi 10.31857/S0044460X2005011X
777.4877).
3.
Печинский С.В., Курегян А.Г., Степанова Э.Ф. Пат.
all-trans-β,β-Каротин-3,3′-дибензоат
(2).
РФ 2702005 (2018) // Б. И. 2019. № 28.
Выход 1.10 г (68%), т. пл. 184-186°С. Спектр ЯМР
4.
Печинский С.В., Курегян А.Г., Оганесян Э.Т. Пат. РФ
1Н, δ, м. д. (J, Гц): 1.12 c (6Н, Ме16′,17′), 1.17 c (6Н,
2739248 (20119) // Б. И. 2020. № 36.
Ме16,17), 1.74 c (6Н, Ме5,5′), 1.77 м (1Н, H2′), 1.95
5.
Britton G. Carotenoids. Nutrition and Health. Basel;
т (1H, H2, J 12.0), 1.97 c (12Н, Ме19,19′,20,20′), 2.28
Boston; Berlin: Birkhäuser Verlag, 2009. Vol. 5. P. 464.
д. д (1H, ax-H4, J 16.5, 9.5), 2.58 м (1Н, eq-H4, J
6.
Krinsky N. Carotenoids in health and disease. New
16.5), 6.12 c (2Н, Н7,8), 6.13 м (3Н, Н8′,10,10′), 6.28
York: Dekker, 2004. P. 503.
7.
Ceron C. M., Inmaculada C., Sanchez F.J., Aci´en G.F.,
м (2Н, Н14,14′), 6.37 д (2Н, Н12,12′, J 14.5), 6.68-6.73
Emilio M., Fern´andez-Sevilla M.J. // J. Agric. Food
м (4Н, Н11,11′,15,15′), 7.45 д (4H, HAr, J 8.5), 7.57 т
Chem. 2008. N 56. Р. 11761. doi 10.1021/jf8025875
(2H, HAr, J 7.5), 8.06 д (4H, HAr, J 2.0). Масс-спектр,
8.
Sathasivam R., Radhakrishnan R., Hashem A., Abd
m/z: 777.4853 [M + Н]+ (вычислено для С54Н64О4Н+
Allah E.F. // Saudi J. Biol. Sci. 2019. N 26. Р. 709. doi
777.4877).
10.1016/j.sjbs.2017.11.003
all-trans-β,ε-Каротин (3). Выход 0.77 г (98%),
9.
Horvath M.P., George E.W., Tran Q.T., Baumgardner K.,
т. пл. 184-185°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
Zharov G., Lee S., Sharifzadeh H., Shihab S., Mattin-
0.99 c (6Н, Ме16′,17′), 1.07 c (6Н, Ме16,17), 1.37 д. д
son T., Li B., Bernstein P.S. // Struct. Biol. Commun.
(1Н, H2′, J 13.0, 7.0), 1.62 с (3Н, Ме5′), 1.74 c (3Н,
2016. Vol.
72. N
8. P.
609. doi
10.1107/
S2053230X16010694
Ме5), 1.84 т (1H, H2, J 12.0), 1.92 c (3Н, Ме19′), 1.97
10.
Perez-Galvez A., Mınguez-Mosquera M.I. // Nutr. Res.
c (9Н, Ме19,20,20′), 2.05 д. д (1H, ax-H4, J 16.5, 9.5),
2005. N 25. Р. 631. doi 10.1016/j.nutres.2005.07.002
2.38 м (1Н, eq-H4, J 16.5), 5.55 с (1H, H4′), 6.09 c (2Н,
11.
Billsten H.H., Bhosale P., Yemelyanov A., Bernstein P.S.,
Н7,8), 6.13 м (3Н, Н8′,10,10′), 6.26 м (2Н, Н14,14′), 6.35
Polivka, T. // Photochem. Photobiol. 2003. Vol. 78.
д (2Н, Н12,12′, J 14.5), 6.65-6.71 м (4Н, Н11,11′,15,15′).
N 2. P. 138. doi 10.1562/0031-8655(2003)078<0138:pp
Масс-спектр, m/z: 569.4334 [M + Н]+ (вычислено
oxic>2.0.co;2
для С54Н64О4Н+ 569.4353).
12.
Murillo A.G., Hu S., Fernandez M.L. // Antioxidants.
all-trans-β,β-Каротин (4). Выход 0.75 г (96%),
2019. Vol. 8. N 9. P. 390. doi 10.3390/antiox8090390
т. пл. 207-208°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
13.
Berson E.L., Rosner B., Sandberg M.A., Weigel-
DiFranco C., Brockhurst R.J., Hayes K.C., John-
1.06 c (6Н, Ме16′,17′), 1.07 c (6Н, Ме16,17), 1.48 т (1H,
son E.J., Anderson E.J., Johnson C.A., Gaudio A.R.,
H2, J 12.0), 1.74 c (6Н, Ме5,5′), 1.77 м (1Н, H2′), 1.97 c
Willett W.C., Schaefer E.J. // Arch. Ophthalmol.
(12Н, Ме19,19′,20,20′), 2.04 д. д (1H, ax-H4, J 16.5; 9.5),
2010. Vol. 128. N 4. Р. 403. doi 10.1001/
2.39 м (1Н, eq-H4, J 16.5), 6.11 c (2Н, Н7,8), 6.12 м
archophthalmol.2010.32
(3Н, Н8′,10,10′), 6.27 м (2Н, Н14,14′), 6.36 д (2Н, Н12,12′,
14.
Jia Y.-P., Sun L., Yu H.-S., Liang L.-P., Li W., Ding H.,
J 14.5), 6.68-6.73 м (4Н, Н11,11′,15,15′). Масс-спектр,
Song X.-B., Zhang L.-J. // Molecules. 2017. Vol. 22.
m/z: 569.4337 [M + Н]+ (вычислено для С54Н64О4Н+
N 4. Р. 610. doi 10.3390/molecules22040610
569.4353).
15.
Рекомендуемые уровни потребления пищевых и
биологически активных веществ: МР 2.3.1.1915-04.
КОНФЛИКТ ИНТЕРЕСОВ
16.
Mares J. // Annu. Rev. Nutr. 2016. N 36. Р. 571. doi
Авторы заявляют об отсутствии конфликта
10.1146/annurev-nutr-071715-051110.
интересов.
17.
Milborrow B.V. // Carotenoid Chemistry and
Biochemistry. 1981. P. 2027. doi 10.1016/B978-0-08-
СПИСОК ЛИТЕРАТУРЫ
026224-6.50024-3
1. Печинский С.В., Курегян А.Г., Оганесян Э.Т., Степа-
18.
Li X.-X., Han L.-J. // Eur. Food Res. Technol. 2008.
нова Э.Ф. // ЖОХ. 2019. Т. 89. № 5. С. 721; Pechin-
N 227. P.1307. doi 10.1007/s00217-008-0878-y
sky S.V., Kuregyan A.G., Oganesyan E.T., Stepano-
19.
Hernandez-Marin E., Martínez A., Galano A. // J. Phys.
va E.F. // Russ. J. Gen. Chem. 2019. Vol. 89. N 5. P. 913.
Chem. (B). 2013. Vol. 117. N 15. Р. 4050. doi 10.1021/
doi 10.1134/S1070363219050098
jp401647n
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1396
ПЕЧИНСКИЙ и др.
20. Anastas P.T., Williamson T.C. // ACS Symp. Ser. 1996.
25. Huang S.-M., Li H.-J., Liu Y.-C., Kuo C.-H., Shieh C.-J. //
Vol. 626. Р. 1. doi 10.1021/bk-1996-0626.ch001
Molecules. 2017. Vol. 22. N 11. P. 1972. doi 10.3390/
21. Wang R., Hou M., Zhang Y., Ge J., Liu Z. // Catal. Lett.
molecules22111972.
2015. N 145. P. 995. doi 10.1007/s10562-015-1493-8
26. Курегян А.Г., Печинский С.В., Степанова Э.Ф. Пат.
22. Shangguan H., Zhang S., Li X., Zhou Q., Shi J.,
РФ 2659165 (2018) // Б. И. 2018. № 19.
Deng Q., Huang F. // RSC Adv. 2020. N 10. P. 8949. doi
27. Курегян А.Г., Печинский С.В. // Вопр. биол., мед. и
10.1039/D0RA00563K
фарм. хим. 2016. Вып. 1. С. 22.
23. Engstrom K., Nyhlen J., Sandstrom A.G., Backvall J.-E. //
28. Курегян, С.В. Печинский // Матер. ХХI Междунар.
J. Am. Chem. Soc. 2010. Vol. 132. N 20. Р. 7038. doi
заочной науч.-практ. конф. «Современная медицина
10.1021/ja100593j
актуальные вопросы». Новосибирск., 2013. С. 94.
24. Liu Z.-Q., Zhou L.-M., Liu P., Baker P.J., Liu S.-S.,
Xue Y.-P., Xu M., Zheng Y.-G. // Appl. Microbiol.
29. Sundquist A.R., Hanusch M., Stahl W., Sies H. //
Biotechnol. 2015. N 99. Р. 8891. doi 10.1007/s00253-
Photochem. Photobiol. 1993. Vol. 57. N 5. Р. 185. doi
015-6825-5
10.1111/j.1751-1097.1993.tb09211.x
Chemoenzyme Synthesis of all-trans-Isomers
of Lutein and Zeaxanthin
S. V. Pechinskiia,*, A. G. Kuregyana, and E. T. Oganesyana
a Medical Pharmaceutical Institute of Pyatigorsk Branch of Volgograd Medical State University, Pyatigorsk, 357532 Russia
*e-mail: hplc@yandex.ru
Received July 1, 2021; revised July 21, 2021; accepted July 26, 2021
A method for the synthesis of all-trans-isomers of lutein and zeaxanthin was proposed, which includes the stage
of esterification of lutein and zeaxanthin with benzoic acid in the presence of enantioselective lipase Novozyme
435. Further hydrolysis of lutein and zeaxanthin dibenzoates leads to the formation of the initial xanthophylls
in the all-trans configuration.
Keywords: lutein, zeaxanthin, benzoic acid, esterification, Novozyme 435, esters
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021