ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1446-1452
УДК 546.86;546.712;547.53.024;548.312.5
ДИКАРБОКСИЛАТЫ
ТРИС(2-МЕТОКСИ-5-ХЛОРФЕНИЛ)СУРЬМЫ - НОВЫЕ
СОЕДИНЕНИЯ ГИПЕРКООРДИНИРОВАННОЙ
СУРЬМЫ
© 2021 г. В. В. Шарутин*, О. К. Шарутина, O. A. Хайбуллина
Национальный исследовательский Южно-Уральский государственный университет,
пр. Ленина 76, Челябинск, 454080 Россия
*e-mail: vvsharutin@rambler.ru
Поступило в Редакцию 7 июля 2021 г.
После доработки 15 июля 2021 г.
Принято к печати 17 июля 2021 г.
Взаимодействием трис(2-метокси-5-хлорфенил)сурьмы с пентафторпропионовой, гептафторбутановой,
пентафторбензойной и 2-метоксибензойной кислотами в присутствии пероксида водорода (1:2:1 мольн.)
в диэтиловом эфире синтезированы дикарбоксилаты трис(2-метокси-5-хлорфенил)сурьмы (2-MeO-5-
ClC6H3)3Sb[OC(O)R]2, R = C2F5, C3F7, C6F5, C6H4ОMe-2. Изучено строение полученных соединений.
Ключевые слова: трис(2-метокси-5-хлорфенил)сурьма, перфторкарбоновые кислоты, 2-метоксибен-
зойная кислота, дикарбоксилаты трис(2-метокси-5-хлорфенил)сурьмы
DOI: 10.31857/S0044460X2109016X
Известно, что дикарбоксилаты триарилсурьмы
го лежит реакция окислительного присоединения
обладают противоопухолевыми, антилейшманиоз-
[22].
ными, антибактериальными и другими практиче-
В продолжение изучения синтеза и особен-
ски полезными свойствами [1-12]. Установлено,
ностей строения производных высококоорди-
что фторсодержащие замеcтители влияют на такие
нированной сурьмы(V) с объемными арильны-
свойства, как способность к абсорбции и липо-
ми лигандами, содержащими потенциальные
фильность, а значит и на химическую и биологи-
координирующие центры, в настоящей работе
ческую активность соединений [13] и могут быть
реакциями окислительного присоединения три-
использованы в медицине [14, 15]. Однако только в
с(2-метокси-5-хлорфенил)сурьмы с пентафтор-
нескольких работах обсуждается вопросы синтеза
пропионовой, гептафторбутановой, пентафтор-
и строения дикарбоксилатов триарилсурьмы с ато-
бензойной и 2-метоксибензойной кислотами в
мами фтора в карбоксилатных лигандах [16-21].
присутствии пероксида водорода (1:2:1 мольн.) в
Из методов синтеза арильных соединений пя-
диэтиловом эфире синтезированы дикарбоксила-
тивалентной сурьмы следует выделить один из
ты трис(2-метокси-5-хлорфенил)сурьмы с выхо-
наиболее эффективных способов, в основе которо-
дом до 85% (схема 1).
Схема 1.
(2-MeO-5-ClC6H3)3Sb + 2HOC(O)R + H2O2 → (2-MeO-5-ClC6H3)3Sb[OC(O)R]2 + 2H2O,
R = C2F5 (1), C3F7 (2), C6F5 (3), C6H4OMe-2 (4).
1446
ДИКАРБОКСИЛАТЫ ТРИС(2-МЕТОКСИ-5-ХЛОРФЕНИЛ)СУРЬМЫ
1447
Соединения 1-4 представляют собой бесцвет-
ные кристаллические вещества, устойчивые к
действию влаги и кислорода воздуха, хорошо рас-
творимые в ароматических углеводородах, четы-
реххлористом углероде, тетрагидрофуране, хлоро-
форме.
В ИК спектрах соединений 1-4 наблюдаются
интенсивные полосы при 444, 447, 446, 444 см-1
(Sb-C), 1258, 1258, 1258, 1250 см-1 (О-C), 1479,
1479, 1479, 1477 см-1 (Ar), 2849, 2847, 2851,
2833 см-1 (H-CAlk), 3103, 3107, 3107, 3103 см-1
(H-CAr). Кроме того, наблюдаются интенсивные
полосы при 1715, 1713, 1678, 1655 см-1, отвечаю-
щие валентным колебаниям карбонильных групп
[23, 24].
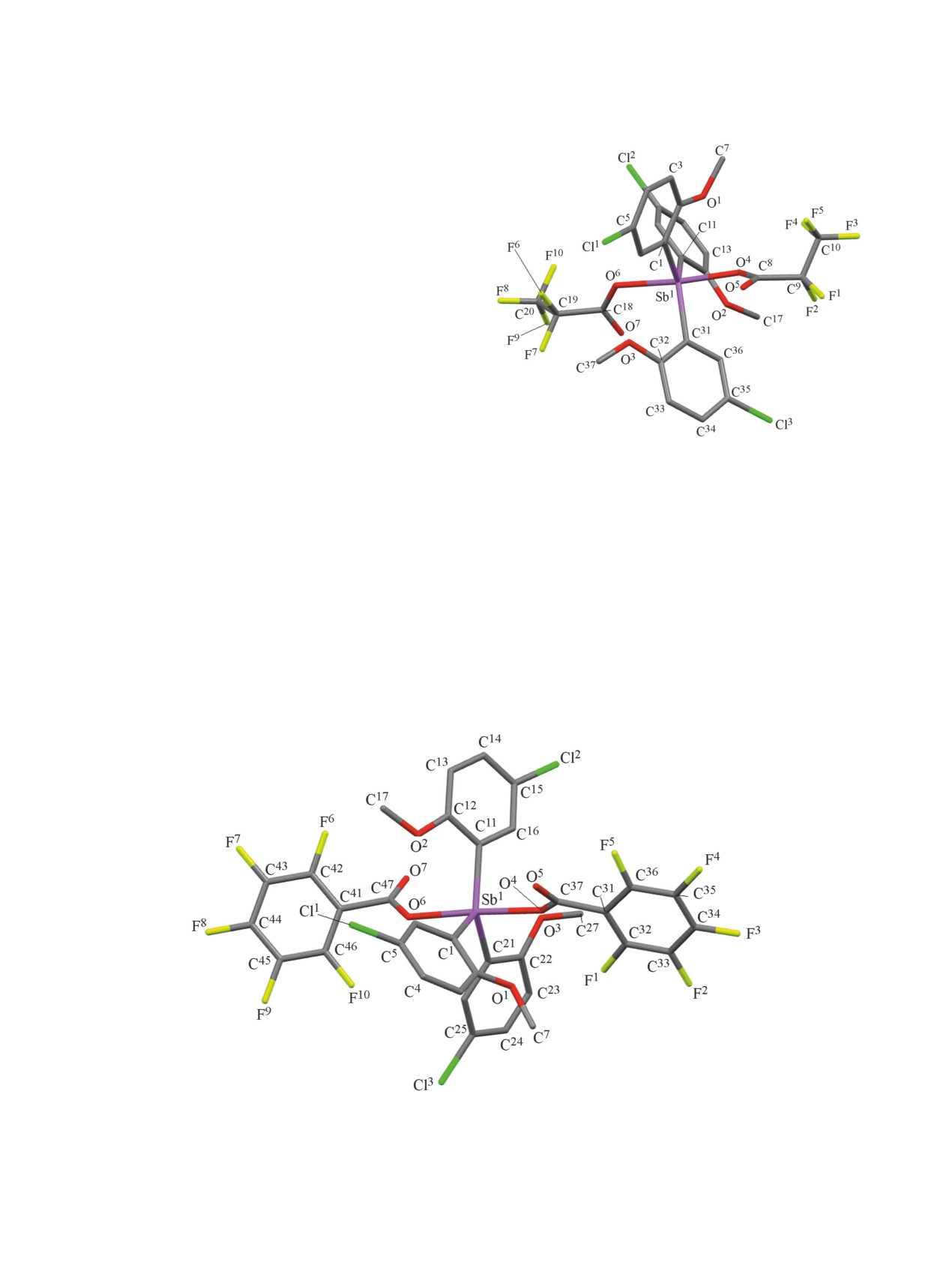
Рис. 1. Общий вид молекулы бис(пентафторпропиона-
то)трис(2-метокси-5-хлорфенил)сурьмы 1 в кристалле
По данным РСА, молекулы соединений 1-4
(атомы водорода не показаны).
имеют конфигурацию тригональной бипирамиды
с карбоксилатными лигандами в аксиальных поло-
жениях (табл. 1, рис. 1, 2). Аксиальные углы ОSbО
в соединениях 1-4 равны 174.05(13), 174.9(2),
связей Sb-C таким образом, чтобы свести к мини-
175.94(12) и 172.95(12)° соответственно (табл. 2).
муму внутри- и межмолекулярные контакты. Дли-
Атомы сурьмы практически находятся в экватори-
ны связей Sb-C в соединениях 1-4 равны 2.102(4)-
альной плоскости [C3], отклонения атома металла
2.109(5), 2.098(11)-2.143(9), 2.096(11)-2.118(4) и
составляют 0.013, 0.049, 0.049 и 0.054 Å. Плоские
2.115(4)-2.125(4) Å соответственно, расстояния
арильные кольца в структурах развернуты вокруг
Sb-O составляют 2.132(3), 2.109(3) (1), 2.121(7),
Рис. 2. Общий вид молекулы бис(пентафторбензоато)трис(2-метокси-5-хлорфенил)сурьмы 3 в кристалле (атомы водорода
не показаны).
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1448
ШАРУТИН и др.
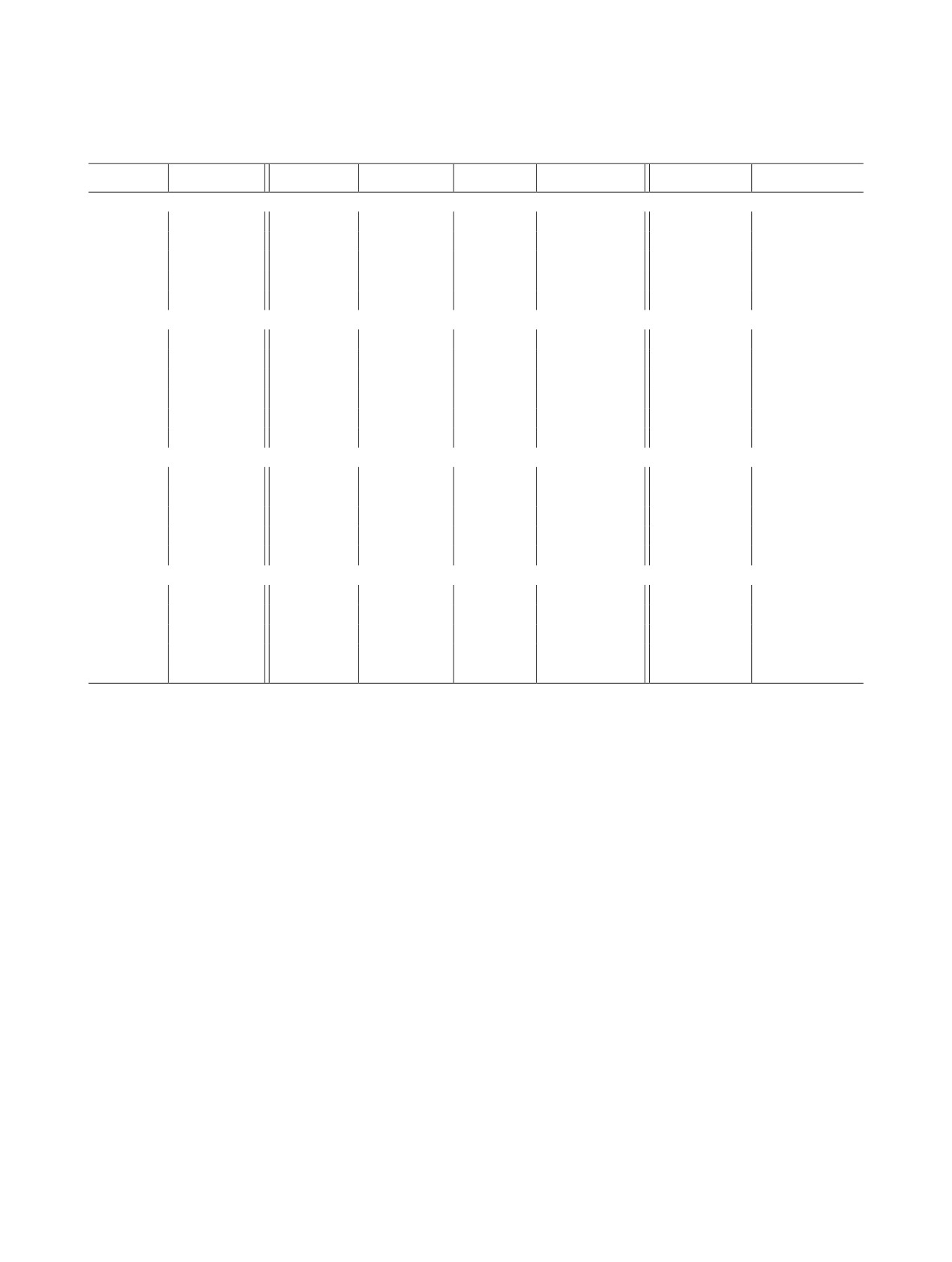
Таблица 1. Кристаллографические данные, параметры эксперимента и уточнения структуры соединений 1-4
Параметр
1
2
3
4
Брутто-формула
C27H18Cl3F10O7Sb
C
H18Cl3F14O7Sb
C
H18Cl3F10O7Sb
C37H32Cl3O9Sb
29
35
М
872.51
972.51
968.59
848.73
Сингония
Моноклинная
Моноклинная
Триклинная
Моноклинная
Пространственная группа
P21/c
I2/a
P-1
P21/n
a, Å
12.525(5)
19.84(2)
10.444(6)
16.791(13)
b, Å
16.809(7)
17.82(3)
13.295(8)
9.682(6)
c, Å
17.248(7)
22.59(2)
16.156(8)
23.402(17)
α, град
90.00
90.00
113.82(3)
90.00
β, град
110.437(13)
109.38(8)
90.46(2)
103.58(5)
γ, град
90.00
90.00
110.66(2)
90.00
V, Å3
3403(2)
7534(17)
1890.4(18)
3698(5)
Z
4
8
2
4
dвыч, г/см3
1.703
1.715
1.702
1.524
μMo, мм-1
1.142
1.056
1.038
1.016
F(000)
1712.0
3808.0
952.0
1712.0
Размер кристалла, мм
0.56×0.4×0.23
0.38×0.2×0.1
0.65×0.58×0.55
0.5×0.13×0.06
2θ, град
5.962-53.644
4.572-55.764
6.162-56.98
4.58-52.92
Интервалы индексов
-15 ≤ h ≤ 15,
-26 ≤ h ≤ 25,
-13 ≤ h ≤ 13,
–18 ≤ h ≤ 20,
-21 ≤ k ≤ 21,
-22 ≤ k ≤ 22,
-17 ≤ k ≤ 17,
-12 ≤ k ≤ 12,
-21 ≤ l ≤ 21
-15 ≤ l ≤ 27
-21 ≤ l ≤ 21
-28 ≤ l ≤ 29
Всего отражений
49802
15304
42852
21475
Независимых отражений
7242
7703
8493
7270
Rint
0.0242
0.0828
0.0335
0.1206
Число уточняемых
481
527
497
456
параметров
GOOF
1.044
0.992
1.121
1.051
R-Факторы по F2 > 2σ(F2)
R1 0.0495,
R1 0.0783,
R1 0.0497,
R1 0.0482,
wR2 0.1313
wR2 0.2030
wR2 0.1520
wR2 0.0954
R-Факторы по всем
R1 0.0614,
R1 0.1832,
R1 0.0582,
R1 0.0770,
отражениям
wR2 0.1468
wR2 0.3038
wR2 0.1630
wR2 0.1040
Остаточная электронная
0.84/-0.88
0.85/-1.81
0.94/-1.02
0.84/-0.87
плотность (min/max), e/Å3
2.131(7)
(2),
2.092(3),
2.124(3)
(3),
2.100(3),
возрастает, например, до 151.7° [26], при умень-
2.110(3) Å (4) и приближаются по своему значе-
шении значений двух других экваториальных
нию к сумме ковалентных радиусов атомов сурь-
углов. В отличие от большинства структурно оха-
мы и кислорода (2.14 Å [25]).
рактеризованных дикарбоксилатов триарилсурь-
мы в соединениях 1-4 углы между плоскостями
Как правило, карбоксилатные лиганды в дикар-
карбоксильных групп составляют 62.20, 61.35,
боксилатах трифенилсурьмы имеют относительно
64.21 и 43.75°, контакты Sb···O(=C) расположе-
фрагмента SbC3 цис-ориентацию и расположены
ны внутри разных экваториальных углов СSbС,
таким образом, что внутримолекулярные контак-
которые мало отличаются от идеального значения
ты Sb···O(=C) (расстояния Sb···O во всех случа-
120°:
115.34(17)-125.41(18),
112.4(4)-125.0(4),
ях меньше суммы ван-дер-ваальсовых радиусов
110.75(18)-124.51(18) и 109.35(17)-128.57(19)°. В
атомов Sb и O 3.58 Å [25]), формируются внутри
соединениях 1-4 расстояния Sb···O(=С) составля-
одного экваториального угла, значение которого
ют 3.155(7), 3.210(7) (1), 3.139(11), 3.275(11) (2),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ДИКАРБОКСИЛАТЫ ТРИС(2-МЕТОКСИ-5-ХЛОРФЕНИЛ)СУРЬМЫ
1449
Таблица 2. Основные длины связей и валентных углов в соединениях 1-4
Связь
d, Å
Связь
d, Å
Угол
ω, град
Угол
ω, град
1
Sb1-O4
2.109(3)
Sb1∙∙∙O1
3.055(15)
O4Sb1O6
174.05(13)
C1Sb1O4
94.18(15)
Sb1-O6
2.132(3)
Sb1∙∙∙O2
3.143(16)
O4Sb1C31
89.41(17)
C1Sb1O6
85.31(14)
Sb1-C11
2.106(4)
Sb1∙∙∙O3
3.160(12)
C11Sb1O4
87.80(16)
C1Sb1C11
115.34(17)
Sb1-C1
2.102(4)
Sb1∙∙∙O5
3.210(12)
C11Sb1O6
87.07(16)
C1Sb1C31
119.24(18)
Sb1-C31
2.109(5)
Sb1∙∙∙O7
3.155(15)
C11Sb1C31
125.41(18)
C31Sb1O6
96.02(17)
2
Sb1-O4
2.121(7)
O1-C7
1.430(17)
O4Sb1O6
174.9(2)
C11Sb1O4
87.8(4)
Sb1-O6
2.131(7)
Sb1∙∙∙O1
3.081(15)
O4Sb1C1
98.6(3)
C11Sb1O6
94.7(4)
Sb1-C1
2.123(10)
Sb1∙∙∙O2
3.113(16)
O4Sb1C21
88.1(3)
C11Sb1C1
122.4(4)
Sb1-C11
2.098(11)
Sb1∙∙∙O3
3.089(12)
O6Sb1C21
86.8(3)
C11Sb1C21
125.0(4)
Sb1-C21
2.143(9)
Sb1∙∙∙O5
3.139(12)
C1Sb1O6
83.9(3)
C2O1C7
116.0(12)
O1-C2
1.363(13)
Sb1∙∙∙O7
3.275(15)
C1Sb1C21
112.4(4)
Cl2O2C17
121.2(11)
3
Sb1-O4
2.092(3)
Sb1∙∙∙O1
3.089(5)
O4Sb1O6
175.94(12)
C11Sb1C1
124.57(16)
Sb1-O6
2.124(3)
Sb1∙∙∙O2
3.096(6)
O4Sb1C11
87.86(15)
C21Sb1O6
88.04(16)
Sb1-C11
2.113(4)
Sb1∙∙∙O3
3.187(4)
O4Sb1C21
87.90(16)
C21Sb1C11
124.51(18)
Sb1-C21
2.096(4)
Sb1∙∙∙O5
3.224(4)
O4Sb1C1
98.73(17)
C21Sb1C1
110.75(18)
Sb1-C1
2.118(4)
Sb1∙∙∙O7
3.361(5)
C11Sb1O6
94.46(15)
C1Sb1O6
82.70(17)
4
Sb1-O4
2.100(3)
Sb1∙∙∙O1
3.193(5)
O4Sb1O7
172.95(12)
O7Sb1C11
89.05(14)
Sb1-O7
2.110(3)
Sb1∙∙∙O2
3.186(6)
O4Sb1C1
101.61(15)
O7Sb1C21
91.50(14)
Sb1-C1
2.125(4)
Sb1∙∙∙O3
3.123(5)
O4Sb1C11
85.52(14)
C11Sb1C1
109.35(17)
Sb1-C11
2.115(4)
Sb1∙∙∙O5
3.060(7)
O4Sb1C21
88.40(15)
C11Sb1C21
128.57(19)
Sb1-C21
2.122(4)
Sb1∙∙∙O8
3.011(6)
O7Sb1C1
84.41(14)
C21Sb1C1
121.88(17)
3.224(4), 3.361(4) (3), 3.011(4), 3.060(4) Å (4), при
в соединениях 1-3, что не свидетельствует о влия-
этом самые короткие контакты, ожидаемо, на-
нии природы заместителя R на внутримолекуляр-
блюдаются в молекуле 4, в которой органический
ные контакты атома Sb с потенциальными коор-
радикал в остатке кислоты не содержит электро-
динирующими центрами лигандов, окружающих
отрицательных групп, снижающих донорные
центральный атом.
способности карбонильного кислорода. Атомы
Возможно, особенность строения молекул 1-4,
кислорода метоксигрупп координированы на атом
которая проявляется в нарушении типичной для
сурьмы [внутримолекулярные расстояния Sb∙∙∙O
дикарбоксилатов триарилсурьмы цис-ориентации
составляют 3.055(5)-3.160(5), 3.081(10)-3.113(11),
карбоксилатных лигандов относительно фрагмен-
3.089(4)-3.187(4), 3.123(5)-3.193(5) Å в соединени-
та SbC3, объясняется наличием внутримолекуляр-
ях 1-4 соответственно]. Однако в молекулах трех
ных взаимодействий между атомами металла и
ранее синтезированных дикарбоксилатов трис-
кислорода метоксигрупп.
(2-метокси-5-хлорфенил)сурьмы, содержащих в
Таким образом, реакцией окислительного при-
карбоксилатных лигандах OC(O)R электроотри-
соединения впервые синтезирован ряд дикарбок-
цательные заместители (R = CH2Br, CH2C6H4F-3,
силатов трис(2-метокси-5-хлорфенил)сурьмы и
C6H3F2-2,3) расстояния Sb∙∙∙O=С
[2.997(2)-
изучены особенности их строения. Внутримоле-
3.181(3) Å] и Sb∙∙∙OMe [3.060(1)-3.203(1) Å] [20]
кулярная координация атомов кислорода метокси-
близки к аналогичным величинам, наблюдаемым
групп с центральным атомом металла не изменяет
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1450
ШАРУТИН и др.
тригонально-бипирамидальной конфигурации мо-
раствора пероксида водорода. Полученную смесь
лекул полученных дикарбоксилатов триарилсурь-
выдерживали 18 ч при 20°С. Образовавшиеся кри-
мы, однако приводит к изменению конформации
сталлы отфильтровывали и сушили. Выход 148 мг
карбоксилатных лигандов, характерной для фе-
(85%), т. пл. 177°С. Найдено, %: С 31.08; Н 2.09.
нильных производных сурьмы. Во всех дикарбок-
C27H18Cl3F10O7Sb. Вычислено, %: С 31.13; Н 2.06.
силатах триарилсурьмы расстояния Sb-O близки
Соединения 2-4 получены аналогично.
к сумме ковалентных радиусов атомов сурьмы и
Бис(гептафторбутаноато)трис(2-метокси-
кислорода, а средние значения длин связей Sb-C
5-хлорфенил)сурьма (2). Выход 79%, бесцветные
изменяются в узком интервале значений и не зави-
кристаллы, т. пл. 147°С. Найдено, %: С 35.69; Н
сят от числа электроноакцепторных заместителей
1.92. C29H18Cl3F14O7Sb. Вычислено, %: С 35.78; Н
в карбоксигруппах.
1.85.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Бис(пентафторбензоато)трис(2-метокси-
5-хлорфенил)сурьма (3). Выход 84%, бесцветные
ИК спектры соединений 1-4 записывали на ИК
кристаллы, т. разл. 146°С. Найдено, %: С 43.22; Н
Фурье-спектрометре Shimadzu IRAffinity-1S; об-
1.90. C35H18Cl3F10O7Sb. Вычислено, %: С 43.36; Н
разцы готовили таблетированием с KBr (область
1.86.
поглощения 4000-400 см-1). Элементный анализ
на углерод и водород выполнен на элементном
Бис(2-метоксибензоато)трис(2-метокси-
анализаторе Carlo Erba CHNS-O EA 1108. Темпе-
5-хлорфенил)сурьма (4). Выход 80%, бесцветные
ратуры плавления измерены на синхронном тер-
кристаллы, т. пл. 201°С. Найдено, %: С 52.26; Н
моанализаторе Netzsch 449C Jupiter.
3.81. C37H32O9Cl3Sb. Вычислено, %: С 52.31; Н
Рентгеноструктурный анализ кристаллов со-
3.77.
единений 1-4 проводили на автоматическом че-
ИНФОРМАЦИЯ ОБ АВТОРАХ
тырехкружном дифрактометре D8 QUEST Bruker
(MoKα-излучение, λ 0.71073 Å, графитовый моно-
Шарутин Владимир Викторович, ORCID: http://
хроматор). Сбор, редактирование данных и уточ-
orcid.org/0000-0003-2582-4893
нение параметров элементарной ячейки, а так-
Хайбуллина Ольга Андреевна, ORCID: http://
же учет поглощения проведены по программам
orcid.org/0000-0003-0411-6847
SMART и SAINT-Plus [27]. Все расчеты по опреде-
лению и уточнению структуры выполнены по про-
КОНФЛИКТ ИНТЕРЕСОВ
граммам SHELXL/PC [28] и OLEX2 [29]. Структу-
Авторы заявляют об отсутствии конфликта
ры соединений 1-4 определены прямым методом
интересов.
и уточнены методом наименьших квадратов в
анизотропном приближении для неводородных
СПИСОК ЛИТЕРАТУРЫ
атомов. Основные кристаллографические данные
и результаты уточнения структур приведены в
1. Iftikhar T., Rauf M.K., Sarwar S., Badshah A., Waseem D.,
табл. 1, основные длины связей и валентные углы -
Tahir M.N., Khan A., Khan K.M., Khan G.M. // J.
в табл. 2. Полные таблицы координат атомов, длин
Organomet. Chem. 2017. Vol. 851. P. 89. doi 10.1016/j.
jorganchem.2017.09.002
связей и валентных углов депонированы в Кем-
2. Mushtaq R., Rauf M.K., Bond M., Badshah A., Ali M.I.,
бриджском банке структурных данных [ССDC
Nadhman A., Yasinzai M. // Appl. Organomet. Chem.
2048154 (1), 2048288 (2), 2048150 (3), 2049696 (4)].
2016. Vol. 30. N 6. P. 465. doi 10.1002/aoc.3456
Бис(пентафторпропионато)трис(2-метокси-
3. Mushtaq R., Rauf M.K., Bolte M., Nadhman A.,
5-хлорфенил)сурьма
(1).
К смеси
117 мг
Badshah A., Tahir M.N., Yasinzai M. // Appl.
(0.2 ммоль) сольвата трис(2-метокси-5-хлорфе-
Organomet. Chem. 2017. Vol. 31. N 5. P. e3606. doi
нил)сурьмы с бензолом [30] и 66 мг (0.4 ммоль)
10.1002/aoc.3606
пентафторпропионовой кислоты в 20 мл диэтило-
4. Ali M.I., Rauf M.K., Badshah A., Kumar I., Forsyth C.M.,
вого эфира прибавляли 23 мг 30%-ного водного
Junk P.C., Kedzierski L., Andrews P.C. // J. Chem.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ДИКАРБОКСИЛАТЫ ТРИС(2-МЕТОКСИ-5-ХЛОРФЕНИЛ)СУРЬМЫ
1451
Soc. Dalton Trans. 2013. Vol. 42. N 48. P. 16733. doi
19.
Quan L., Yin H., Cui L., Yang M., Wang D. // Acta
10.1039/c3dt51382c
Crystallogr. 2009. Vol. 65. N. 6. P. m656. doi 10.1107/
5.
Ma Y.Q., Yu L., Li J.S. // Heteroat. Chem. 2002. Vol. 13.
s1600536809017449
N 4. P. 299. doi 10.1002/hc.10033
20.
Шарутин В.В., Шарутина О.К. // ЖНХ. 2021.
6.
Islam A., Da Silva J.G., Berbet F.M., Da Silva S.M.,
Т. 66. № 3. С. 358. doi 10.31857/S0044457X21030156;
Rodriques B.L., Beraldo H., Melo M.N., Frezard F.,
Sharutin V.V., Sharutina O.K. // Russ. J. Inorg.
Demicheli C. // Molecules. 2014. Vol. 19. N 5. P. 6009.
Chem. 2021. Vol. 66. N 3. P. 361. doi 10.1134/
doi 10.3390/molecules19056009
S0036023621030153
7.
Liu R.C., Ma Y.Q., Yu L., Li J.S., Cui J.R., Wang R.Q. //
21.
Шарутин В.В., Шарутина О.К. // ЖОХ. 2021.
Appl. Organomet. Chem. 2003. V. 17. N 9. P. 662. doi
Т. 91. № 4. С. 598. doi 10.31857/S0044460X21040156;
10.1002/aoc.491
Sharutin V.V., Sharutina O.K. // Russ. J. Gen.
8.
Li J.S., Liu R.C., Chi X.B., Wang G.C., Guo Q.S. //
Chem. 2021. Vol. 91. N 4. P. 672. doi 10.1134/
Inorg. Chim. Acta. 2004. Vol. 357. N 7. P. 2176. doi
S1070363221040150
10.1016/j.ica.2003.12.012
22.
Шарутин В.В., Поддельский А.И., Шарутина О.К. //
9.
Ma Y., Li J., Xuan Z., Liu R. // J. Organomet. Chem.
Коорд. хим. 2020. Т. 46. № 10. С. 579. doi 10.31857/
2001. Vol. 620. N 1-2. P. 235. doi 10.1016/S0022-
S0132344X20100011; Sharutin V.V., Poddel’sky A.I.,
328X(00)00799-3
Sharutina O.K. // Russ. J. Coord. Chem. 2020. Vol. 46.
10.
Li J.S., Ma Y.Q., Cui J.R., Wang R.Q. // Appl.
N 10. P. 663. doi 10.1134/S1070328420100012
Organomet. Chem. 2001. Vol. 15. N 7. P. 639. doi
23.
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина
10.1002/aoc.200.
Т.Г. Инфракрасная спектроскопия органических и
11.
Zhang X.-Y., Cui L., Zhang X., Jin F., Fan Y.-H. // J.
природных соединений. СПб: СПбГЛТА, 2007. 54 с.
Mol. Struct. 2017. Vol. 134. P. 742. doi 10.1016/j.
24.
Тарасевич Б.Н. ИК спектры основных классов орга-
molstruc.2017.01.039
нических соединений. М.: МГУ, 2012. 55 с.
12.
Lowe K., Powell R. // J. Fluor. Chem. 2001. Vol. 109.
25.
Бацанов С.С. // ЖНХ. 1991. Т. 36. № 12. С. 3015.
N 1. P. 1. doi 10.1016/S0022-1139(01)00371-2
26.
Шарутин В.В., Шарутина О.К., Пакусина А.П.,
13.
Smart B.E. // J. Fluor. Chem. 2001. Vol. 109. N 1. P. 3.
Бельский В.К. // ЖОХ. 1997. Т. 67. № 9. С. 1536.
doi 10.1016/S0022-1139(01)00375-X
27.
SMART and SAINT-Plus. Version 5.0. Data Collection
14.
Park B.K., Kitteringham N.R. // Drug Metab.
and Processing Software for the SMART System.
Rev. 1994. Vol. 26, N 3. P. 605. doi 10.3109/
Madison (WI, USA): Bruker AXS Inc., 1998.
03602539408998319
28.
SHELXTL/PC. Version 5.10. An Integrated System for
15.
Maienfisch P., Hall R.G. // Chimia Int. J. Chem. 2004.
Solving, Refining and Displaying Crystal Structures
Vol. 58. N 3. P. 93. doi 10.2533/000942904777678091
from Diffraction Data. Bruker AXS Inc., Madison: (WI,
16.
Wen L., Yin H., Quan L., Wang D. // Acta Crystallogr.
USA), 1998.
(E). 2008. Vol. 64. N. 10. P. m1303. doi 10.1107/
29.
Dolomanov O.V., Bourhis L.J., Gildea R.J., Ho-
s1600536808029656
ward J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
17.
Ferguson G., Kaitner B., Glidewell C., Smith S. // J.
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Organomet. Chem. 1991. Vol. 419. N. 3. P. 283. doi
30.
Шарутин В.В., Шарутина О.К. // ЖОХ. 2020.
10.1016/0022-328x(91)80241-b
Т.
90.
№ 10. С.
1577. doi
10.31857/
18.
Zhang X.-Y., Cui L., Zhang X., Jin F., Fan Y.-H. // J.
S0044460X20100133; Sharutin V.V., Sharutina O.K. //
Mol. Struct. 2017. Vol. 1134. P. 742. doi 10.1016/j.
Russ. J. Gen. Chem. 2020. Vol. 90. № 10. P. 1901. doi
molstruc.2017.01.039
10.1134/S1070363220100138
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1452
ШАРУТИН и др.
Tris(2-methoxy-5-chlorophenyl)antimony Dicarboxylates
as a New Hypercoordinated Antimony Compounds
V. V. Sharutin*, O. K. Sharutina, and O. A. Khaybullina
National Research South Ural State University, Chelyabinsk, 454080 Russia
*e-mail: vvsharutin@rambler.ru
Received July 7, 2021; revised July 15, 2021; accepted July 17, 2021
The reaction of tris(2-methoxy-5-chlorophenyl)antimony with pentafluoropropionic, heptafluorobutanoic,
pentafluorobenzoic and 2-methoxybenzoic acids in the presence of hydrogen peroxide (1:2:1 mol.)
in diethyl ether was used to synthesize tris(2-methoxy-5-chlorophenyl)antimony dicarboxylates
(2-MeO-5-ClC6H3)3Sb[OC(O)R]2, R = C2F5, C3F7, C6F5, C6H4ОMe-2. Structure of the synthesized compounds
was studied.
Keywords: tris(2-methoxy-5-chlorophenyl)antimony, perfluorocarboxylic acids, 2-methoxybenzoic, acid,
tris(2-methoxy-5-chlorophenyl)antimony dicarboxylates
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021