ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2021, том 91, № 9, с. 1465-1473
УДК 542.61:546.98:547.786.1
ЭКСТРАКЦИЯ ПАЛЛАДИЯ(II) ИЗ СОЛЯНОКИСЛЫХ
РАСТВОРОВ 4-[(ГЕКСИЛСУЛЬФАНИЛ)МЕТИЛ]-
3,5-ДИМЕТИЛИЗОКСАЗОЛОМ
© 2021 г. Г. Р. Анпилогова*, Л. А. Баева, Ю. И. Муринов
Уфимский институт химии Уфимского федерального исследовательского центра Российской академии наук,
пр. Октября 69, Уфа, 450054 Россия
*e-mail: sulfur@anrb.ru
Поступило в Редакцию 14 июля 2021 г.
После доработки 29 июля 2021 г.
Принято к печати 31 июля 2021 г.
Изучены экстракционные свойства нового экстрагента - 4-[(гексилсульфанил)метил]-3,5-диметилизокса-
зола (разбавитель толуол) - в условиях извлечения палладия(II) из солянокислых растворов. Экстрагент
эффективно и с высокой селективностью относительно Pt(IV), Cu(II), Ni(II), Fe(III) и Al(III) извлекает
Pd(II) из 0.1-6 М. растворов HCl. Установлен координационный механизм экстракции Pd(II) из 1 М.
растворов HCl с образованием экстрагируемого соединения [Cl2Pd(μ-L)2PdCl2]. Оценены значения кон-
центрационной константы и термодинамических параметров экстракции Pd(II) из 1 М. растворов HCl.
Палладий(II) количественно реэкстрагируется солянокислым раствором тиомочевины.
Ключевые слова: экстракция, 4-[(гексилсульфанил)метил]-3,5-диметилизоксазол, палладий(II), хлори-
стоводородная кислота
DOI: 10.31857/S0044460X21090195
Палладий - один из наиболее востребованных и
зуются диалкилсульфиды (алкил-гексил, октил),
дорогих металлов платиновой группы [1]. Большая
α- и β-гидроксиоксимы (LIX 63, LIX 64N, LIX 84I)
часть потребляемого в мире палладия использует-
[3, 4]. Общий недостаток этих промышленных экс-
ся в электронной, химической, нефтехимической
трагентов - медленная скорость извлечения Pd(II).
и автомобильной промышленности. Селектив-
Добавка солей четвертичных аммониевых основа-
ное и полное извлечение платиновых металлов
ний или третичных аминов ускоряет экстракцию,
из растворов выщелачивания вторичного сырья
но ухудшает селективность извлечения Pd(II).
(электронный лом, отработанные промышленные
В обзорных работах [4, 5] рассмотрен широ-
и автомобильные катализаторы и др.) особенно ак-
кий ряд промышленных и синтезированных за
туально для стран, не имеющих природных источ-
последние 20 лет экстрагентов различных классов
ников этих металлов [2]. В гидрометаллургии пла-
в аспекте селективности, эффективности и кине-
тиновых металлов при переработке концентратов
тики извлечения палладия(II) из солянокислых
и вторичного сырья получают солянокислые рас-
растворов. Анализ литературных данных показал,
творы. Разделение и очистку платиновых металлов
что высокой селективностью характеризуются в
проводят по классической технологии осаждения
основном серосодержащие экстрагенты, извле-
или с использованием более эффективных и тех-
кающие Pd(II) по координационному механизму
нологичных экстракционных и сорбционных ме-
и не протонирующиеся при контакте с кислы-
тодов. В технологической экстракционной схеме
ми растворами [4]. К ним относятся функциона-
для селективного извлечения палладия(II) исполь-
лизированные алифатическими тиоэфирными
1465
1466
АНПИЛОГОВА и др.
трагента по палладию(II) относительно меди(II) и
платины(IV) [17, 18]. С целью расширения обла-
сти селективной экстракции палладия(II) относи-
тельно платины(IV) (из солянокислых растворов с
концентрацией более 2 моль/л HCl) и железа(III)
(из растворов с концентрацией HCl более 3-
4 моль/л) проведено дальнейшее уменьшение ос-
новности экстрагента путем замены пиразольного
кольца изоксазольным. Сведения об экстракцион-
ных свойствах реагентов с диалкилсульфидным
заместителем в изоксазольном кольце отсутствуют.
Нами изучены экстракционные свойства ново-
го комплексообразующего экстракционного агента
4-[(гексилсульфанил)метил]-3,5-диметилизоксазо-
ла (толуол) в условиях извлечения палладия(II) из
солянокислых растворов.
Рис. 1. Кинетические кривые экстракции Pd(II) из со-
лянокислых сред раствором реагента L в толуоле (cL
Предварительно установлено, что
4-[(гек-
0.0048 моль/л;
0.0040 моль/л). 1 - 0.1 моль/л HCl, cPd
силсульфанил)метил]-3,5-диметилизоксазол (L,
0.0048 моль/л; 3 - 4.0 моль/л
2 - 1.0 моль/л HCl, cPd
схема 1) характеризуется низкой растворимостью
HCl, cPd 0.0051 моль/л.
в воде (~0.061 г/л при 20°С).
Хлороформ и толуол могут быть использованы
группами N,N-диалкилзамещенные моноамиды и
в качестве разбавителя реагента L при извлечении
N,N,N′,N′-тетраалкилзамещенные диамиды [6, 7],
палладия(II) из солянокислых растворов. Выбор
N,N,N′,N′-тетра-(2-этилгексил)дитиодигликоль-
толуола обусловлен применением ароматических
амид [8]; новые макроциклические экстрагенты -
разбавителей в промышленных экстракционных
диметоксидиоксадитиабензо-14-краун-эфиры
процессах [4]. Реагент L можно отнести к ней-
[9]; пинцерные SCS-лиганды - 1,3-бис[2-(октил-
тральным экстрагентам, поскольку экстракция
сульфанил)пропан-2-ил]бензол и 1,3-бис[(октил-
кислоты 0.030 М. раствором реагента L в толу-
сульфанил)метил]бензол [10]; хелатообразующий
оле из 0.1-5 М. растворов HCl не обнаружена, а
дитиоэфир
-
1,2-бис(2-метоксиэтилсульфанил)-
степень его протонирования при контакте с 6 М.
бензол [11]; функционализированные алкилсуль-
раствором HCl не превышает 4%.
фанилметильными группами каликс[4,6]арены
Время установления равновесия экстракции
[12], тиоамидными группами азотиакаликс[4]арен
палладия(II) реагентом L (толуол) из 0.1, 1 и 4 М.
[13]; эктрагенты с двумя тиоамидными группами -
растворов HCl составляет 10, 60 и 45 мин соответ-
п- и м-бис(диметилтиокарбамоилокси)бензолы
ственно (рис. 1).
и др. [14, 15]; новый тиофосфатный экстрагент
Более быстрая экстракция палладия(II) из
1,3-бис(диэтокситиофосфиноилокси)бензол [16].
0.1 М. раствора HCl реагентом L так же, как и
Нами изучены новые комплексообразующие
бидентатные реагенты:
4-[(гексилсульфанил)-
Схема 1.
метил]-3,5-диметил-1Н-пиразол (хлороформ) и
2
1
4-[(гексилсульфанил)метил]-3,5-диметил-1-фе-
N O
нил-1Н-пиразол (толуол, хлороформ) - высоко-
3
5
эффективные экстрагенты для извлечения палла-
H3C
CH3
4
дия(II) из солянокислых растворов. Уменьшение
3'
5'
7'
1'
основности аминосульфида путем введения фе-
S
CH
3
4'
6'
8'
нильного заместителя к атому N1 пиразольного
L
кольца позволило повысить селективность экс-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ЭКСТРАКЦИЯ ПАЛЛАДИЯ(II) ИЗ СОЛЯНОКИСЛЫХ РАСТВОРОВ
1467
комплексообразующими экстрагентами п-толил-
(сульфанилметил)каликс[4]ареном (толуол)
[12]
и
4-[(гексилсульфанил)метил]-3,5-диметил-1-
фенил-1Н-пиразолом (толуол) [18], обусловлена
более быстрым замещением внутрисферных мо-
лекул воды нейтральными лигандами в аквахло-
ридных комплексах палладия(II), присутству-
ющих в водном растворе [19], по сравнению с
замещением хлорид-ионов в доминирующем ком-
плексе [PdCl4]2- при концентрации HCl в водной
фазе более 1 моль/л [19]. В аналогичных услови-
ях
4-[(гексилсульфанил)метил]-3,5-диметил-1-
фенил-1Н-пиразол (толуол) извлекает палладий(II)
из 0.1 М. раствора HCl в 4 раза медленнее реагента
L [18], что обусловлено, вероятно, стерическими
затруднениями, создаваемыми фенильным заме-
Рис. 2. Зависимость степени извлечения Pd(II) и Fe(III)
стителем в пиразольном цикле. Время достиже-
реагентом L (толуол) от концентрации хлористоводо-
ния равновесия экстракции палладия(II) данными
родной кислоты в водной фазе. 1 - cPd 0.0047 моль/л,
cL 0.010 моль/л; 2 - cFe 0.0096 моль/л, cL 0.030 моль/л;
гетероциклическими реагентами из более кислых
время контакта фаз - 1 ч.
1 и 4 М. растворов HCl сопоставимо [18]. Реагент
L значительно быстрее извлекает палладий(II) из
солянокислых растворов, чем промышленные экс-
ружено (в пределах ошибки определения). В оди-
трагенты диоктилсульфид и β-гидроксиоксимы
наковых условиях экстракции степень извлече-
(время установления равновесия экстракции не-
ния железа(III) из 6 М. раствора HCl реагентом L
сколько часов [4]) и 1,2-бис(2-метоксиэтилсульфа-
(рис. 2) значительно ниже, чем 4-[(гексилсульфа-
нил)бензол в хлороформе (более 3 ч при экстрак-
нил)метил]-3,5-диметил-1-фенил-1Н-пиразолом
ции из 1-5 М. растворов HCl [11]). Дальнейшее
(89%) [18].
изучение экстракционных свойств реагента L про-
Таким образом, замена пиразольного кольца в
водили при времени контакта фаз 1 ч.
структуре аминосульфида менее основным изок-
Установлено, что реагент L с высокой эффек-
сазольным позволила повысить селективность экс-
тивностью извлекает палладий(II) из 0.1-1 М. рас-
трагента (реагент L) по палладию(II) относительно
творов HCl (рис. 2). С увеличением концентрации
платины(IV), железа(III) и меди(II), существенно
хлористоводородной кислоты до 6 моль/л степень
увеличить интервал концентрации кислоты (до
извлечения палладия(II) уменьшается до 92%, что
6 моль/л) для высокоселективного отделения пал-
несколько ниже, чем при экстракции 4-[(гексил-
ладия(II) от платины(IV) и железа(III) по сравне-
сульфанил)метил]-3,5-диметил-1-фенил-1Н-пи-
нию c промышленными диалкилсульфидами и
разолом (толуол) в аналогичных условиях (96%)
аминосульфидами на основе пиразола [4, 17, 18],
[18]. При экстракции палладия(II) из растворов
а также расширить область применения реагента
с концентрацией кислоты более 6 моль/л наблю-
L для извлечения палладия(II) до 6 моль/л раство-
дается образование третьей фазы в виде тонкого
ров HCl и использовать подходящий для промыш-
коричневого осадка на границе радела фаз, объем
ленных процессов ароматический разбавитель по
которого возрастает с увеличением концентрации
сравнению с 4-[(гексилсульфанил)метил]-3,5-ди-
HCl в водной фазе до 10 моль/л. Экстракции ре-
метил-1Н-пиразолом (0.1-4 моль/л HCl, разбави-
агентом L из 0.1-6 М. растворов HCl сопутству-
тель хлороформ) [17].
ющих элементов: платины(IV) (cPt 0.0056 моль/л,
cL 0.010 моль/л), железа(III) (0.1-5 моль/л HCl,
В равновесных условиях при постоянной
рис.
2), меди(II), никеля(II) и алюминия(III)
ионной силе водного раствора 2 моль/л (HCl +
(cCu,Ni,Al 0.010 моль/л, cL 0.030 моль/л) - не обна-
NaCl) коэффициент распределения палладия(II)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1468
АНПИЛОГОВА и др.
тракта, охарактеризовано элементным анализом и
рядом спектральных методов.
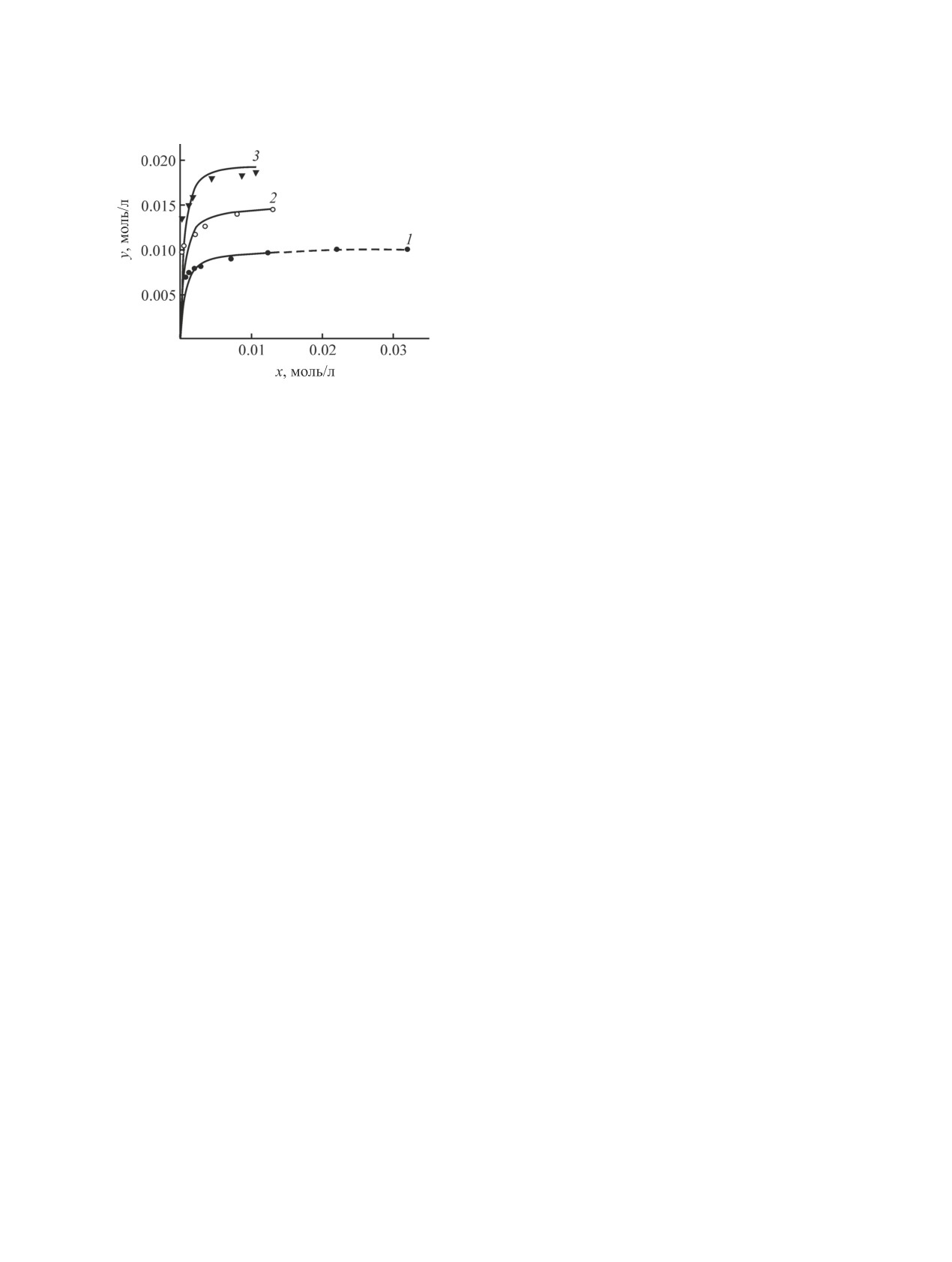
Крутизна начальных участков изотерм экстрак-
ции палладия(II) (рис. 3) свидетельствует о высо-
кой эффективности экстрагента. Сольватное число
палладия(II), определенное методом насыщения
(рис. 3, 1), равно единице.
Содержание элементов в экстрагируемом сое-
динении соответствует составу PdCl2L, что согла-
суется со значением сольватного числа. В молеку-
ле реагента L два электронодонорных атома: атом
S тиоэфирной группы и атом N изоксазольного
Рис. 3. Изотермы экстракции Pd(II) из 1 М. растворов
кольца - способны к образованию донорно-акцеп-
HCl реагентом L (толуол). cL 0.010 (1), 0.015 (2) и
0.020 (3) моль/л; точки - экспериментальные данные,
торной связи с палладием(II). Известно, что в ком-
сплошные линии - расчетные.
плексах типа [PdCl2L2] изоксазол и 3,5-диметили-
зоксазол координируются к центральному иону
металла через атом азота [20, 21].
практически не зависит от концентрации ионов
Поскольку взаимное расположение донорных
H+ в области 0.1-2 г-ион/л (DPd 12.9±0.1 при cPd
атомов реагента L неблагоприятно для образова-
0.0058 моль/л, cL 0.010 моль/л). Увеличение кон-
ния комплекса хелатного типа, то, можно предпо-
центрации NaCl от 0 до 3 моль/л при постоянной
ложить, что в экстрагируемом соединении реагент
концентрации кислоты в водной фазе 1 моль/л (cPd
L выступает в роли мостикового лиганда, а само
0.0047 моль/л и cL 0.010 моль/л) сопровождается
соединение представляет собой полиядерный ком-
уменьшением коэффициента распределения пал-
плекс, как и соединения палладия(II), экстрагиру-
ладия(II) от ~104 до 18 и небольшим изменением
емые из 1 М. растворов HCl аминосульфидами на
степени извлечения: от 99.9 до 94.6%. Данные
основе пиразола [17, 18]. Для описания экстрак-
факты наряду с достаточно медленным установ-
ции палладия(II) по координационному механизму
лением равновесия экстракции палладия(II) из 1 и
с образованием n-ядерного экстрагируемого хло-
4 М. растворов HCl позволяют предположить коор-
рокомплекса может быть предложено уравнение
динационный механизм экстракции палладия(II)
(1) [22].
из солянокислых растворов непротонированной
формой реагента L. Подтверждением координаци-
nPdCl2-aq + nLorg ← PdnCl2nLn org + 2nCl-aq.
(1)
онного механизма может служить присутствие в
Концентрационная константа равновесия экс-
видимой области электронных спектров поглоще-
тракции имеет вид (2).
ния (ЭСП) экстрактов палладия(II), полученных
при концентрации HCl в водной фазе 0.1-6 моль/л
Kex = [PdnCl2nLn]org∙[Cl-]2n/([PdCl42-]naq∙[L]norg).
(2)
в условиях, (рис. 2) полосы поглощения (плечо) с
Принимая равновесные концентрации палла-
максимумом при 423 нм (ε ~300), соответствую-
дия(II) в водной фазе, экстрагируемого соединения
щей d-d-переходам в ионе палладия(II) в плоско-
и реагента L в органической фазе соответственно:
квадратных хлорокомплексах с нейтральными S- и
[PdCl2-]aq = x, [PdnCl2nLn]org = y/n, [L]org = cL - y,
S,N-лигандами [17, 18].
где cL - исходная концентрация реагента, y - рав-
Для получения большей информации о меха-
новесная концентрации палладия(II) в экстракте,
низме и стехиометрии экстракционного взаимо-
моль/л, получаем выражение (3).
действия рассмотрены изотермы экстракции пал-
Kex = y[Cl-]2n/[n∙xn∙(cL - y)n].
(3)
ладия(II) из 1 М. раствора HCl; экстрагируемое
соединение палладия(II), выделенное из насыщен-
После замены y/x = DPd и логарифмирования
ного при данной кислотности водной фазы экс-
уравнения
(3) получена зависимость lgDPd от
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ЭКСТРАКЦИЯ ПАЛЛАДИЯ(II) ИЗ СОЛЯНОКИСЛЫХ РАСТВОРОВ
1469
концентрации компонентов экстракционной сис-
ΔG = -RTlnKex,
(6)
темы (4).
Kex 1.92×108,
lgDPd = lgKex + lgn + (n - 1)lgx + nlg(cL - y)
ΔG = ΔH - TΔS.
(7)
- 2nlg[Cl-]aq.
(4)
Экстрагируемое соединение Pd2Cl4L2 хоро-
В интервале концентраций cL 0.005-0.020 моль/л
шо растворимо в толуоле, хлороформе и ацетоне,
по тангенсу угла наклона прямолинейной зави-
мало растворимо в этаноле, нерастворимо в гек-
симости lgDPd от lg(cL - y) (коэффициент прямо-
сане и в воде. Низкое значение молярной элек-
линейной корреляции по методу наименьших
тропроводности раствора соединения в ацетоне
квадратов r 0.999, tgα 2.05), полученной при по-
0.7 см2/(Ом∙моль) свидетельствует о том, что оно
стоянной равновесной концентрации палладия(II)
представляет собой нейтральный комплекс.
в водной фазе х = 0.0020 моль/л и концентрации
В ЭСП раствора соединения в хлороформе
хлорид-ионов, равной концентрации хлористово-
присутствуют интенсивная полоса поглощения
дородной кислоты, [Cl-]aq ≈ cHCl = 1 моль/л, опре-
переноса заряда L→Pd с максимумом при 302 нм
делено число n = 2. Следовательно, экстрагируе-
(ε 5600) и слабая полоса с максимумом при 417 нм
мое соединение, вероятно, является биядерным.
(ε 268), соответствующая d-d-переходам в ионе
Значения Kex для начальных участков изотерм
палладия(II). Спектр соединения аналогичен спек-
экстракции рассчитывали по уравнению (3) при
трам плоско-квадратных комплексов палладия(II)
n = 2, используя рассчитанные значения концен-
с аминосульфидами хелатного типа [PdCl2L] [23]
трации хлорид-ионов в водной фазе [Cl-]aq = cHCl +
и спектру экстрагируемого комплексного соедине-
2y, моль/л. Доверительный интервал концентраци-
ния [PdCl2μ-L]n {n > 2, L - 4-[(гексилсульфанил)-
онной константы экстракции Kex (1.92± 0.62)×108
метил]-3,5-диметил-1Н-пиразол} с плоско-ква-
рассчитан по t-распределению Стьюдента для P
дратной геометрией координационных узлов [17].
0.95 и числа экспериментальных точек 6 в обла-
В ЭСП экстрагируемого соединения наблюдается
сти равновесных концентраций палладия(II) в
также край сильно интенсивной полосы переноса
водной фазе 0.0012-0.0028 моль/л и cL 0.005-
заряда Cl→Pd, максимум которой, вероятно, нахо-
0.020 моль/л. Отклонение расчетных значений y от
дится в области 240-250 нм [17, 23]. Присутству-
экспериментальных не превышает 6% в области
ющие в дальней области ИК спектра экстрагиру-
концентраций x = 0.0012-0.0130 моль/л почти до
емого соединения две интенсивные полосы при
365 и 349 см-1 соответствуют частотам валентных
полного насыщения органической фазы (рис. 3).
колебаний ν(Pd-Cl) в координационных узлах
Концентрационная константа экстракции
цис-конфигурации, как в спектрах хелатных ком-
палладия(II) из 1 М. раствора HCl уменьшает-
плексов[PdCl2L], гдеL‒1,1′-(3-тиапентан-1,5-диил)-
ся с возрастанием температуры от 10 до 40°С,
бис(3,5-диметил-1Н-пиразол) (координационный
следовательно, экстракция
- экзотермиче-
узел цис-PdCl2NS) и 1,1′-(3-оксапентан-1,5-диил)-
ский процесс. В соответствии с интегральной
бис(3,5-диметил-1Н-пиразол) (цис-PdCl2N2)
[24,
формой уравнения Вант-Гоффа (5) по танген-
25]. В ближней области (4000-600 см-1) ИК спектр
су угла наклона прямолинейной зависимости
экстрагируемого соединения мало отличается от
lnKex = f(1/T) оценен термодинамический параметр
спектра реагента L (вазелиновое масло). Смеще-
экстракции ΔH = -10.2 ± 0.8 кДж/моль.
ние полосы поглощения валентных колебаний
lnKex = -ΔH/(RT) + Constant,
(5)
связи ν(C=N) изоксазольного кольца в спектре экс-
трагируемого соединения на 11 см-1 в низкочастот-
где R = 8.314 Дж/(моль·K).
ную область относительно ее положения в спектре
Оценка термодинамических параметров ΔG и
реагента (при 1639 см-1) косвенно свидетельствует
ΔS экстракции палладия(II) из 1 М. растворов HCl
о координации реагента к ионам палладия(II) че-
при 297 K проведена по уравнениям (6) и (7) соот-
рез атом азота. Это согласуется с данными спек-
ветственно: ΔG = -47.1±0.8 кДж/моль, ΔS = 124±
троскопии ЯМР 1H и 13С для экстрагируемого со-
6 Дж/(моль·K).
единения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1470
АНПИЛОГОВА и др.
Значительное слабопольное смещение синглет-
тиомочевины и HCl (время контакта фаз 10 мин)
ных сигналов протонов метильных заместителей
и промывки экстрагента 1 М. раствором HCl
изоксазольного кольца 3-СH3 и 5-СH3 в спектре
(В:О = 1:1, время контакта фаз 3 мин), экстракция
ЯМР 1H экстрагируемого соединения (на 0.24 и
палладия(II) уменьшилась от 99% в первом цикле
0.32 м. д. соответственно относительно их положе-
до 97% в последнем, реэкстракция составляла не
ния в спектре реагента L), а также сигналов атомов
менее 99% в каждом цикле.
углерода данных метильных групп (на 1.8 и 2.0 м.
Высокая эффективность реагента L позволя-
д. соответственно) и сигналов атомов гетероцикла
ет проводить концентрирование палладия(II) при
С3 и С5 (на 3.7 и 6.2 м. д. соответственно) в спектре
небольшом стехиометрическом избытке реагента
ЯМР 13С экстрагируемого соединения относитель-
и меньшем времени контакта фаз. Показана воз-
но положения сигналов соответствующих атомов
можность 10-кратного концентрирования палла-
в спектре реагента L позволяет предположить уча-
дия(II) из 1 М. раствора HCl (cPd 0.0056 моль/л, cL
стие атома азота изоксазольного кольца в образо-
0.17 моль/л, В:О = 10:1, время контакта фаз
вании координационной связи.
20 мин) с полным (> 99.9%) извлечением палла-
В спектре ЯМР 1H экстрагируемого соедине-
дия(II) в органическую фазу. Реэкстракция пал-
ния наибольшее изменение химического сдвига
ладия(II) солянокислым (0.1 моль/л HCl) 0.8 М.
наблюдается для уширенного синглетного сигна-
раствором тиомочевины при В:О = 1:1 и времени
ла неэквивалентных протонов соседней с атомом
контакта фаз 15 мин составила > 99.9%.
серы метиленовой группы (Δδ = 0.45 м. д.). В спек-
Результаты проведенных исследований показа-
тре ЯМР 13С сильное смещение в слабое поле ис-
ли, что нейтральное комплексообразующее соеди-
пытывают сигналы углеродных атомов С1’ (Δδ =
нение 4-[(гексилсульфанил)метил]-3,5-диметили-
7.5 м. д.) и С3’ (Δδ = 4.6 м. д.) гексилсульфанилме-
зоксазол L (в толуоле) является эффективным и
тильного заместителя. В совокупности эти данные
высокоселективным экстрагентом для извлечения
указывают на координацию реагента через атом
палладия(II) из 0.1-6 М. растворов HCl с умерен-
серы [17, 18, 23].
ным солевым фоном. Возможность применения
Таким образом, данные ИК и ЯМР спектроско-
ароматического разбавителя позволяет использо-
пии свидетельствуют о том, что реагент L коор-
вать экстрагент в гидрометаллургических процес-
динирован к ионам палладия(II) через донорные
сах для концентрирования и высокоселективного
атомы серы и азота. Вероятные координационные
отделения палладия(II) от Pt(IV), Cu(II), Ni(II),
узлы PdCl2NS в комплексе [Cl2Pd(μ-L)2PdCl2] име-
Fe(III) и Al(III) в циклическом режиме экстрак-
ют цис-конфигурацию.
ция-реэкстракция. Палладий(II) извлекается из
В одинаковых условиях [cPd 0.0055 моль/л, cL
1 М. растворов хлористоводородной кислоты ней-
0.0050 моль/л, разбавитель толуол, соотношение
тральной формой реагента L по координацион-
водной (В) и органической (О) фаз В:О = 1:1, вре-
ному механизму с образованием экстрагируемого
мя контакта фаз 1 ч] эффективность экстракции
соединения [Cl2Pd(μ-L)2PdCl2].
палладия(II) из 1 М. раствора HCl реагентом L
(DPd 1.8) меньше, чем 4-[(гексилсульфанил)ме-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
тил]-3,5-диметил-1-фенил-1Н-пиразолом (DPd 5.6
[18]), что обусловлено, вероятно, меньшей элек-
Использовали K2PdCl4, полученный известным
тронодонорной способностью атома N2 изоксазо-
методом [26] из PdCl2 (Ч, ОАО «Красцветмет»),
льного цикла.
реактивы и растворители, указанные в работе [18].
Изучение возможности использования реагента
Концентрацию Pd(II) и Pt(IV) в водных растворах,
L в циклическом режиме экстракция-реэкстракция
концентрацию Pd(II) в экстрагируемом соедине-
показало, что при проведении трех циклов, вклю-
нии определяли спектрофотометрическими ме-
чающих стадии экстракции палладия(II) из 1 М.
тодами с хлоридом олова(II) [18, 19]. Концентра-
раствора HCl (cPd 0.0056 моль/л, cL 0.010 моль/л,
цию ионов других металлов в водных растворах
время контакта фаз 1 ч), реэкстракции палла-
определяли комплексонометрическими методами
дия(II) раствором , содержащим по 0.1 моль/л
[17, 18].
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ЭКСТРАКЦИЯ ПАЛЛАДИЯ(II) ИЗ СОЛЯНОКИСЛЫХ РАСТВОРОВ
1471
Методики проведения спектрофотометриче-
соответствующей максимуму широкой полосы
ских анализов и исследований, регистрации спек-
поглощения (плечо) π→π*-переходов 3,4,5-триал-
тров ЯМР 1H и 13C соединений (растворитель
килзамещенного изоксазольного кольца [28]. Рас-
CDCl3), определения температуры плавления экс-
творы реагента L в толуоле готовили по точным
трагируемого соединения см. [18]. ИК спектры со-
навескам.
единений регистрировали на спектрофотометрах
Экстрагируемое соединение палладия(II)
IR Prestige-21 (Shimadzu) и Specord M80 в области
[Cl2Pd(μ-L)2PdCl2] осаждали гексаном из насы-
4000-400 и 600-250 см-1 соответственно (тонкая
щенного экстракта, полученного при концентра-
пленка или вазелиновое масло). Удельную элек-
тропроводность 0.001 М. раствора экстрагируе-
ции HCl в водной фазе 1 моль/л, cPd 0.0165 моль/л,
мого соединения в ацетоне (ХЧ, АО «ЭКОС-1»)
cL 0.060 моль/л, В:О = 10:1 и времени контакта
определяли с помощью кондуктометра типа ОК
фаз 1 ч. Промытое гексаном соединение сушили
102/1 (Венгрия) с электродом ОР-907/3. Запись ИК
на воздухе. Выход 71%, светло-желтый порошок,
и ЯМР спектров и элементный анализ соединений
т. пл. 101-106°С. ИК спектр (вазелиновое мас-
выполняли на оборудовании Центра коллектив-
ло), ν, см-1: 1628 ср (C=N), 349 ср, 365 с (Pd-Cl).
ного пользования «Химия» Уфимского института
Спектр ЯМР 1H (CDCl3), δ, м. д.: 0.89 т (3H, C8′H3,
химии РАН и Регионального центра коллективно-
3J 6.7 Гц), 1.24-1.38 м (4H, С6′,7′Н2), 1.38-1.52 м
го пользования «Агидель» Уфимского федераль-
(2H, С5′Н2), 1.75-1.88 м и 1.88-2.00 м (2H, С4′H2),
ного исследовательского центра РАН.
2.40-2.76 м (2H, С3′H2), 2.52 с (3H, CH3C3), 2.67 с
Экстракцию ионов металлов и соляной кис-
(3H, CH3C5), 3.83-3.94 уш. с (2H, C1′H2). Спектр
лоты и реэкстракцию палладия(II) проводили по
ЯМР 13С (CDCl3), δС, м. д.: 12.1 (СH3C5), 12.8
методике [18] при 24±1°С, объемное соотношение
(СH3C3), 14.0 (C8′), 22.4 (С7′), 28.2, 28.6 (С4′, С5′),
водной (В) и органической (О) фаз В:О = 1:1, раз-
31.1, 31.2 (С1′, С6′), 36.3 (С3′), 110.9 (С4); 163.3 (C3),
бавитель - толуол. Экстракцию соляной кислоты
171.9 (C5). Найдено, %: С 35.41; H 5.43; Cl 16.29;
проводили при времени контакта фаз 10 мин, до-
N 3.27; Pd 28.88; S 7.89. С24Н42Cl4N2O2Pd2S2. Вы-
статочном для установления экстракционного рав-
новесия. Время расслоения фаз во всех экспери-
числено, %: С 35.61; H 5.24; Cl 17.52; N 3.46; Pd
ментах составляло 30-60 с.
26.29; S 7.92.
4-[(Гексилсульфанил)метил]-3,5-диметил-
ИНФОРМАЦИЯ ОБ АВТОРАХ
изоксазол (L) получали методом гетероциклиза-
ции 3-[(гексилсульфанил)метил]пентан-2,4-диона
Анпилогова Галина Рудольфовна, ORCID:
при взаимодействии с солянокислым гидрокси-
ламином в этаноле в присутствии NaOH при на-
гревании и очищали хроматографическим мето-
org/0000-0002-4475-8556
дом [27]. Соединение представляет собой вязкую
бесцветную жидкость. Его индивидуальность
подтверждена элементным анализом, методами
org/0000-0002-8199-1912
ИК и ЯМР 1Н и 13С спектроскопии. Спектраль-
БПАГОДАРНОСТИ
ные характеристики соответствуют литературным
данным [27], чистота, по данным газожидкостной
Авторы выражают благодарность Л.Г. Голубят-
хроматографии и спектроскопии ЯМР, не менее
никовой (Уфимский институт химии Уфимского
97%. Реагент L хорошо растворим в ацетоне, аце-
федерального исследовательского центра РАН) за
тонитриле, этаноле, хлороформе, толуоле и гекса-
регистрацию ИК спектров и Н.Г. Афзалетдиновой
не. Растворимость реагента в воде определяли по
(Уфимский институт химии Уфимского федераль-
описанной методике [17]. Концентрацию реагента
в насыщенном водном растворе оценивали мето-
ного исследовательского центра РАН) за определе-
дом электронной спектроскопии в среде вода-
ние молярной электропроводности раствора экс-
этанол (1:1) при длине волны 216.5 нм (ε 4930),
трагируемого соединения.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
1472
АНПИЛОГОВА и др.
ФОНДОВАЯ ПОДДЕРЖКА
15.
Yamada M., Gandhi M.R., Sato D., Kaneta Y., Kimu-
ra N. // Ind. Eng. Chem. Res. 2016. Vol. 55. N 33.
Работа выполнена в рамках государственного
P. 8914. doi. 10.1021/acs.iecr.6b02135
задания (темы № АААА-А20-120012090027-6 и
16.
Yamada M., Gandhi M.R., Kunda U.M.R., Morti T.,
№ АААА-А19-119011790021-4).
Haga K., Shibayama A. // Hydrometallurgy. 2020.
Vol. 191. 105221. doi 10.1016/j.hydromet.2019.105221
КОНФЛИКТ ИНТЕРЕСОВ
17.
Анпилогова Г.Р., Баева Л.А., Нугуманов Р.М., Фа-
Авторы заявляют об отсутствии конфликта
тыхов А.А., Муринов Ю.И. // ЖНХ. 2018. Т. 63.
№ 8. С. 1065; Anpilogova G.R., Baeva L.A.,
интересов.
Nugumanov R.M., Fatykhov A.A., Murinov Yu.I. // Russ.
СПИСОК ЛИТЕРАТУРЫ
J. Inorg. Chem. 2018. Vol. 63. N 8. P. 1100. doi 10.1134/
S0036023618080028
1.
Cowley A. // Pgm Market Report May 2021. Johnson
18.
Анпилогова Г.Р., Баева Л.А., Нугуманов Р.М., Фа-
Matthey PLC, 2021. 60 p.
тыхов А.А., Муринов Ю.И. // ЖНХ. 2020. Т. 65.
2.
Moon J., Nishihama S., Yoshizuka K. // Solvent
№ 1. С. 104; Anpilogova G.R., Baeva L.A., Nuguma-
Extr. Ion Exch. 2018. Vol. 36. N 5. P. 470. doi
nov R.M., Fatykhov A.A., Murinov Yu.I. // Russ. J.
10.1080/07366299.2018.1527806
Inorg. Chem. 2020. Vol. 65. N 1. P. 106. doi 10.1134/
3.
Bernardis F.L., Grant R.A., Sherrington D.C. // React.
Funct. Polym. 2005. Vol. 65. N 3. P. 205. doi 10.1016/j.
S0036023620010027
reactfunctpolym.2005.05.011
19.
Гинзбург С.И., Езерская Н.А., Прокофьева И.В., Фе-
4.
Wang J., Xu W., Liu H., Yu F., Wang H. // Min. Eng. 2021.
доренко Н.В., Шленская В.И., Бельский Н.К. Анали-
Vol. 163. P. 106798. doi 10.1016/j.mineng.2021.106798
тическая химия платиновых металлов. М.: Наука,
5.
Paiva A.P. // Metals. 2017. Vol. 7. N 11. P. 505. doi
1972. 616 с.
10.3390/met7110505
20.
Pinna R., Ponticelli G., Preti C. // J. Inorg. Nucl.
6.
Narita H., Morisaku K., Tamura K., Tanaka M., Shiwa-
Chem. 1975. Vol. 37. N 7/8. P. 1681. doi 10.1016/0022-
ku H., Okamoto Y., Suzuki S., Yaita T. // Ind. Eng. Chem.
1902(75)80298-3
Res. 2014. Vol. 53. N 9. P. 3636. doi 10.1021/ie404363b
21.
Kim J.-S., Song Y.-D. // J. Korean Chem. Soc. 1998.
7.
Narita H., Tanaka M., Morisaku K. // Miner. Eng. 2008.
Vol. 42. N 4. P. 369.
Vol. 21. N 6. P. 483. doi 10.1016/j.mineng.2008.01.011
22.
Вольдман Г.М. Основы экстракционных и ионооб-
8.
Das A., Ruhela R., Singh A.K., Hubli R.C. // Sep.
менных процессов гидрометаллургии // М.: Метал-
Purif. Technol. 2014. Vol. 125. P. 151. doi 10.1016/j.
лургия, 1982. С. 85.
seppur.2014.01.001
23.
Хисамутдинов Р.А., Афзалетдинова Н.Г., Мури-
9.
Torrejos R.E.C., Nisola G.M., Min S.H., Han J.W.,
нов Ю.И., Никифорова Г.И., Шакирова А.М. // ЖНХ.
Lee S.-P., Chung W.-J. // J. Ind. Eng. Chem. 2020.
Vol. 89. P. 428. doi 10.1016/j.jiec.2020.06.015
1988. Т. 33. № 11. С. 2864.
10.
Gandhi R.M., Yamada M., Haga K., Shibayama A. // Sci.
24.
Garsia-Anton J., Pons J., Solans X., Font-Bardia M.,
Rep. 2017. Vol. 7. N 1. P. 8709. doi 10.1038/s41598-
Ros J. // Eur. J. Inorg. Chem. 2003. N 8. P. 3952. doi
017-09053-z
10.1002/ejic.200300235
11.
Traeger J., Koenig J., Staedtke A., Holdt H.J. //
25.
Boixassa A., Pons J., Solans X., Font-Bardia M.,
Hydrometallurgy. 2012. Vol. 127-128. P. 30. doi
Ros J. // Inorg. chim. acta. 2004. Vol. 357. N 3. P. 827.
10.1016/j.hydromet.2012.07.002
doi 10.1016/j.ica.2003.10.001
12.
Торгов В.Г., Костин Г.А., Машуков В.И., Корда Т.М.,
26.
Синтез комплексных соединений металлов плати-
Драпайло А.Б., Касьян О.В., Кальченко В.И. // ЖНХ.
новой группы: Справ. / Под ред. И.И. Черняева. М.:
2008. Т. 53. № 11. С. 1932; Torgov V.G., Kostin G.A.,
Наука, 1964. 340 с.
Mashukov V.I., Korda T.M., Drapailo A.B., Kas’yan
27.
Баева Л.А., Нугуманов Р.М., Фатыхов А.А., Ляпи-
O.V., Kal’chenko V.I. // Russ. J. Inorg. Chem. 2008.
на Н.К. // ЖОрХ. 2018. Т. 54. Вып. 3. С. 439; Bae-
Vol. 53. N 11. P. 1809. doi 10.1134/S0036023608110235
va L.A., Nugumanov R.M., Fatykhov A.A., Lyapina N.K. //
13.
Senthil K., Akiba U., Fujiwara K., Kondo Y. // Sep.
Russ. J. Org. Chem. 2018. Vol. 54. N 3. P. 444. doi
Sci. Technol. 2017. Vol. 52. N 8. P. 1365. doi
10.1134/S1070428018030120
10.1080/01496395.2017.1288743
14.
Gandhi M.R., Yamada M., Kondo Y. Shibayama A.,
28.
The Chemistry of Heterocyclic Compounds / Eds
Hamada F. // RSC Adv. 2016. Vol. 6. P. 1243. doi
P. Grunanger, P. Vita-Finzi. New-York: J. Willey & Sons
10.1039/C5RA23146A
Inc., 1991. Vol. 49. Pt 1. P. 8.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021
ЭКСТРАКЦИЯ ПАЛЛАДИЯ(II) ИЗ СОЛЯНОКИСЛЫХ РАСТВОРОВ
1473
Palladium(II) Extraction from Hydrochloric Acid Solutions
with 4-[(Hexylsulfanyl)methyl]-3,5-dimethylisoxazole
G. R. Anpilogova*, L. A. Baeva, and Yu. I. Murinov
Ufa Institute of Chemistry, Ufa Federal Research Centre of Russian Academy of Sciences, Ufa, 450054 Russia
*e-mail: sulfur@anrb.ru
Received July 14, 2021; revised July 29, 2021; accepted July 31, 2021
The extraction properties of the novel extracting agent 4-[(hexylsulfanyl)methyl]-3,5-dimethylisoxazole have
been studied in the palladium(II) extraction from hydrochloric acid solutions using toluene as a diluent. The
extractant efficiently recovers Pd(II) from the solutions of 0.1-6 mol/L HCl with high selectivity toward palla-
dium(II) over Pt(IV), Cu(II), Ni(II), Fe(III) and Al(III). The coordination mechanism of the extraction of Pd(II)
from 1 mol/L HCl solutions with the formation of an extracted compound of the type [Cl2Pd(μ-L)2PdCl2] has
been established. The values of the concentration constant and thermodynamic parameters of the extraction of
Pd(II) were estimated at the aqueous phase acidity of 1 mol/L HCl. Complete stripping of Pd(II) was achieved
with a hydrochloric acid solution of thiourea.
Keywords: extraction, 4-[(hexylsulfanyl)methyl]-3,5-dimethylisoxazole, palladium(II), hydrochloric acid
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 91 № 9 2021