ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 12, с. 1946-1956
К 145-летию со дня рождения А. Е. Арбузова
УДК 541.(64+14):547.514:546.93
НОРБОРНЕНЗАМЕЩЕННЫЙ КАТИОННЫЙ
КОМПЛЕКС ИРИДИЯ(III) И ВОДОРАСТВОРИМЫЕ
ЛЮМИНЕСЦЕНТНЫЕ ПОЛИМЕРЫ НА ЕГО ОСНОВЕ.
СИНТЕЗ, ФОТОФИЗИЧЕСКИЕ И ЦИТОТОКСИЧЕСКИЕ
СВОЙСТВА
© 2022 г. Ю. П. Паршинаa, Т. А. Ковылинаa, А. Н. Коневa, А. А. Беликовa, П. О. Баберa,
А. Д. Комароваb,c, Е. А. Ромаевас, Л. Н. Бочкаревa,*
a Институт металлоорганической химии имени Г. А. Разуваева Российской академии наук,
ул. Тропинина 49, Нижний Новгород, 603950 Россия
b Приволжский исследовательский медицинский университет, Нижний Новгород, 603005 Россия
с Нижегородский государственный университет имени Н. И. Лобачевского, Нижний Новгород, 603950 Россия
*e-mail: lnb@iomc.ras.ru
Поступило в редакцию 3 октября 2022 г.
После доработки 30 октября 2022 г.
Принято к печати 1 ноября 2022 г.
Синтезирован норборнензамещенный катионный комплекс иридия(III), содержащий 1-фенилизохино-
линовые циклометаллирующие лиганды и фенилимидазофенантролиновый дополнительный лиганд.
На основе полученного комплекса иридия методом метатезисной полимеризации с раскрытием цикла
(ROMP) синтезированы водорастворимые полимеры, проявляющие кислород-зависимую фосфорес-
ценцию в оранжевой области спектра. Полученные полимеры проявили высокую цитотоксичность по
отношению к раковым клеткам линии HCT116.
Ключевые слова: циклометаллированные комплексы иридия, функционализированные полинорборне-
ны, метатезисная полимеризация, иридийсодержащие полимеры, фотолюминесценция, цитотоксичность
DOI: 10.31857/S0044460X22120162, EDN: MWAESW
Последние два десятилетия люминесцентные
гулировать цвет и эффективность люминесценции
циклометаллированные комплексы иридия(III)
иридиевых люминофоров [6-9]. Природа диими-
привлекают большое внимание как агенты биои-
новых лигандов, входящих в состав катионных
миджинга и сенсоры кислорода в биологических
комплексов, также оказывает заметное влияние на
объектах [1-5]. В настоящее время известно зна-
фотофизические характеристики иридиевых эмит-
чительное число иридийсодержащих люмино-
теров [10-13].
форов как нейтрального, так и ионного строения
Наибольший интерес представляют комплексы
[6-13]. Фотофизические свойства нейтральных
комплексов определяются в основном природой
иридия, люминесцирующие в красной и ближней
циклометаллирующих лигандов, связанных с ири-
инфракрасной областях спектра, поскольку такое
дием. Варьирование таких лигандов позволяет ре-
излучение наиболее глубоко проникает в биологи-
1946
НОРБОРНЕНЗАМЕЩЕННЫЙ КАТИОННЫЙ КОМПЛЕКС ИРИДИЯ(III)
1947
Схема 1.
O
O
O
O
O
O
O
(CH2)5
NH
O
N
N
N
O
NH
O
O
-
Ir
PF6
O
N
N
O
O
O
O
N
1
2
3
ческие ткани. Иридиевые люминофоры, излучаю-
лярного кислорода в живых опухолевых клетках и
щие красный свет, были успешно использованы в
тканях [28, 29].
качестве люминесцентных маркеров и сенсоров
В настоящей работе сообщается о синтезе но-
кислорода в различных биологических объектах
вого норборнензамещенного катионного комплек-
[5, 14, 15]. Одним из основных требований, предъ-
са иридия(III) и получении на его основе методом
являемых к иридиевым биомаркерам и сенсорам,
ROMP водорастворимых полимеров, проявляю-
является достаточно высокая растворимость в
щих интенсивную кислород-зависимую фосфо-
воде. Для повышения растворимости люминес-
ресценцию в оранжевой области спектра и высо-
центных комплексов иридия использовались два
кую цитотоксичность по отношению к клеткам
подхода. Первый заключается в функционали-
колоректального рака человека.
зации циклометаллирующих и дополнительных
Для получения целевых иридийсодержащих
лигандов в комплексах иридия гидрофильными
полимеров были использованы окса-норборнено-
группами [16-20]. Согласно второму подходу, лю-
вые мономеры 1 и 2 с олигоэфирными и амино-
минесцентные комплексы иридия внедряются в
кислотными группами и норборненовый мономер
водорастворимую полимерную матрицу [21-24].
3, содержащий катионный комплекс иридия(III)
Водорастворимые полимерные иридиевые люми-
(схема 1).
нофоры, синтезированные с использованием вто-
Известные органические мономеры 1 и 2 полу-
рого подхода, наиболее привлекательны, посколь-
чены по литературным методикам [30, 31]. Новый
ку такие полимерные биомаркеры, по сравнению
иридийсодержащий мономер 3 синтезирован в со-
с низкомолекулярными аналогами, кроме высокой
ответствии со схемой 2.
растворимости в воде и эффективных люминес-
Мономер 3 выделен в виде устойчивого на воз-
центных характеристик, обладают способностью
духе твердого вещества красного цвета, раствори-
накапливаться в опухолях за счет, так называемого
эффекта повышенной проницаемости и удержания
мого в ТГФ, CH2Cl2, CHCl3 и не растворимого в
(EPR, enhanced permeability and retention [25-27]).
гексане. Согласно данным ЯМР 1H, соединение
является смесью эндо- и экзо-изомеров в соотно-
В ходе недавних исследований нами были синте-
шении 85:15.
зированы функционализированные люминесцент-
ные иридийсодержащие полинорборнены и про-
В дальнейших исследованиях было установле-
демонстрирована возможность их использования
но, что иридийсодержащий мономер 3 вступает в
в качестве фосфоресцентных сенсоров молеку-
реакции метатезисной сополимеризации с орга-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1948
ПАРШИНА и др.
Схема 2.
N
Cl
N
(CH2)5
Ir
Ir
+
2
Cl
N
N
N
N
N
N
[Ir2(piq)4Cl2]
NBE(CH2)5phphen
+
1)
CH2Cl2, MeOH, 60oC
(CH2)5
2)
NH4PF6, 20oC
N
N
N
2
-
Ir
PF6
N
N
N
3
ническими мономерами 1 и 2 и образует люми-
Методом динамического светорассеяния уста-
несцентные водорастворимые полимеры P1 и P2
новлено, что в водных растворах при концентра-
(схема 3).
ции 0.1-0.2 г/л полимерные соединения образуют
наночастицы со средними размерами 21 (P1) и
Реакции ROMP с участием мономеров 1-3 про-
15 нм (P2). Распределение частиц по размерам по-
текают в присутствии катализатора Граббса треть-
казано на рис. S2 (см. Дополнительные материалы).
его поколения (мономеры:катализатор = 100:1).
Полимерные продукты выделены с высокими
Частицы полимеров, по-видимому, представляют
собой мицеллы, оболочка которых состоит из оли-
выходами в виде устойчивых на воздухе смолоо-
гоэфирных и аминокислотных групп, а ядро вклю-
бразных веществ коричневого цвета, растворимых
чает боковые цепи с комплексами иридия.
в ТГФ, CH2Cl2, CHCl3, H2O и не растворимых в
гексане. Соединения P1 и P2 идентифицированы
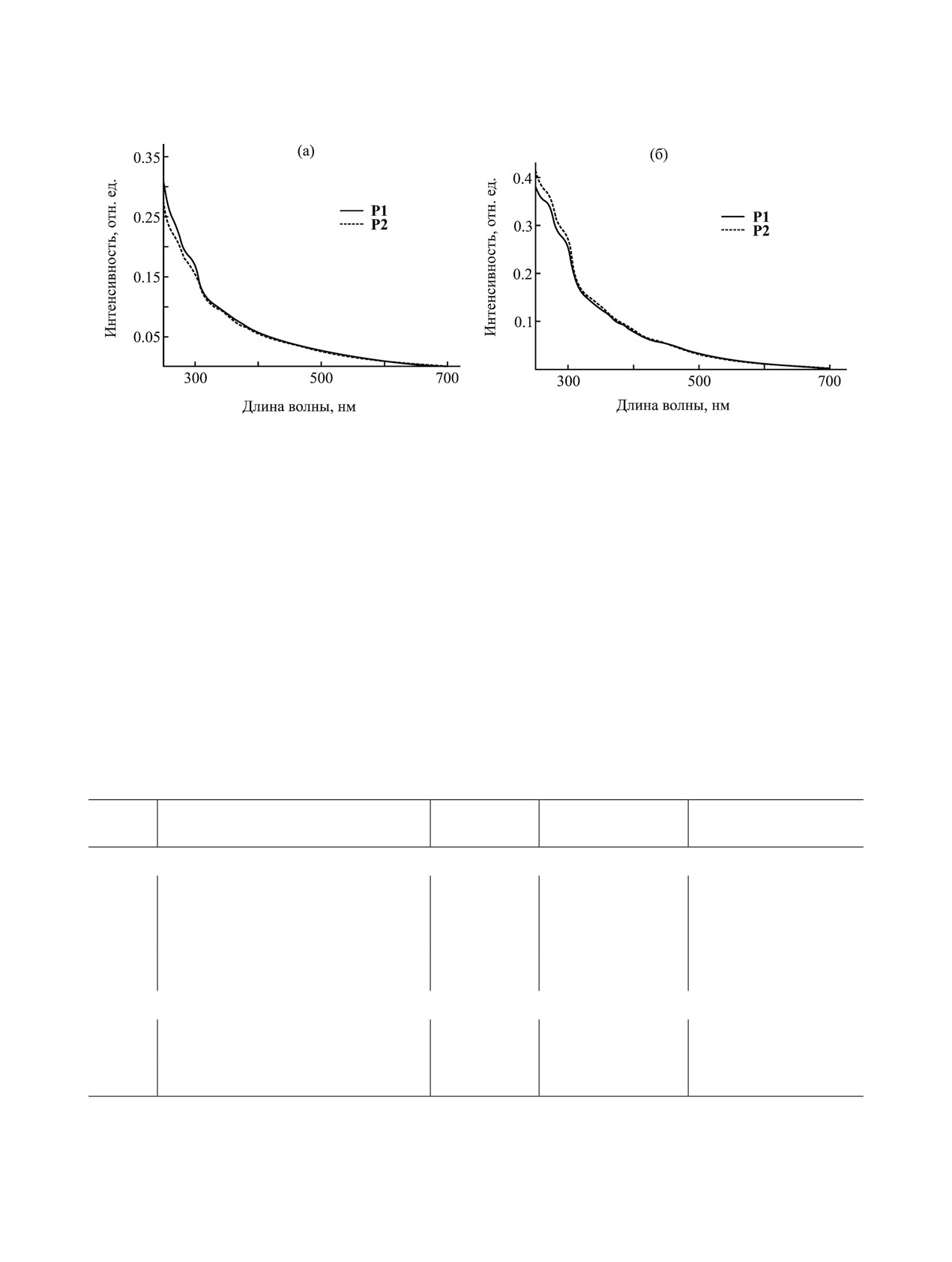
Спектр поглощения иридийсодержащего моно-
данными элементного анализа, ИК и ЯМР спек-
мера 3 (рис. S3a, см. Дополнительные материалы)
троскопии, а также ГПХ. Полимеры P1, P2 об-
содержит интенсивные полосы в области 250-360
ладают средними молекулярными массами (Mw
нм, относящиеся к внутрилигандным 1(π→π*)-пе-
26000-28100 Да) и достаточно узким молекуляр-
реходам в 1-фенилизохинолиновых и фенилими-
но-массовым распределением (Mw/Mn = 1.21-1.36,
дазофенантролиновом лигандах (табл. 1) [32, 33].
рис. S1, см. Дополнительные материалы).
Полосы меньшей интенсивности в области 400-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
НОРБОРНЕНЗАМЕЩЕННЫЙ КАТИОННЫЙ КОМПЛЕКС ИРИДИЯ(III)
1949
Схема 3.
O
+
O
O
O
(CH2)5
O
O
m
O
+
n
+ z
N
N
N
NH
-
O
NH
O
Ir
PF6
O
O
N
N
O
O
O
N
O
O
1
2
3
O
O
m
n
z
[Ru]
O
ТГФ
NH
O
NH
(CH2)5
O
O
O
O
O
N
N
N
O
O
PF
O
Ir
6
2
2
N
N
O
O
N
N N
Cl
Cl
P1, P2
[Ru] =
Ru
N
N
m:n:z = 40:0:1 (P1); m:n:z = 30:10:1 (P2).
Ph
Br
Br
500 нм относятся к переходам с переносом заряда
относящиеся к 3MLCT/3LLCT переходам (табл. 1)
с металла на лиганд (MLCT), смешанными с пе-
[32, 33]. Координаты цветности ФЛ мономера 3 и
реходами с переносом заряда с лиганда на лиганд
полимеров P1, P2 в диаграмме CIE (Commision
(LLCT) [32, 33]. В спектрах поглощения полиме-
Internationalede l’Eclairage) (табл. 1) соответству-
ров P1 и P2 (рис. 1, табл.1) наблюдаются полосы,
ют оранжевому цвету.
характерные для комплексов иридия, связанных с
Интенсивность фотолюминесценции и кванто-
полимерной цепью.
вые выходы мономера 3 и полимеров P1, P2 в аэри-
В спектрах фотолюминесценции мономера 3
рованных растворах значительно меньше по срав-
(рис. S3b, см. Дополнительные материалы) и по-
нению с дегазированными растворами (табл. 1,
лимеров P1, P2 (рис. 2) проявляются широкие
рис. 2, S3b, см. Дополнительные материалы). При-
полосы с максимумами при 587 и 626 нм (плечо),
чина этого заключается в том, что кислород явля-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1950
ПАРШИНА и др.
Рис. 1. Спектры поглощения полимеров P1 и P2 в хлористом метилене (a) и в воде (б).
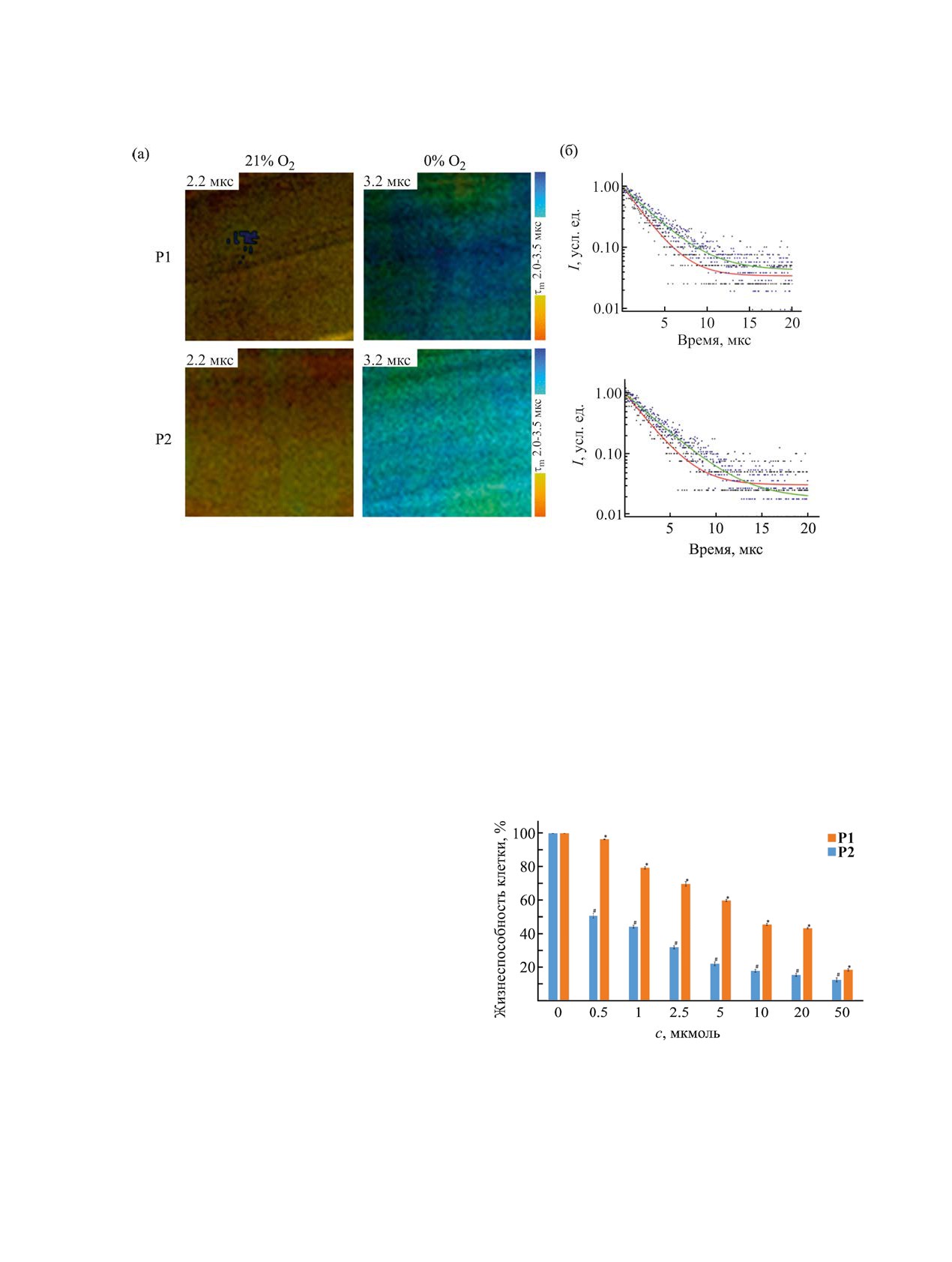
ется активным тушителем фосфоресценции ци-
аэрированных водных растворах (2.2 мкс) также
клометаллированных комплексов иридия(III) [34],
существенно меньше по сравнению с дегазиро-
в результате чего интенсивность фотолюминес-
ванными растворами (3.2 мкс). Фосфоресцентные
ценции и квантовые выходы иридийсодержащих
изображения растворов полимеров Р1 и Р2 и кри-
полимеров в аэрированных растворах существен-
вые затухания фосфоресценции представлены на
но понижаются.
рис. 3.
Времена жизни фосфоресценции иридийсодер-
Известно, что ряд люминесцентных цикломе-
жащих полимеров P1, P2, измеренные методом
таллированных комплексов иридия(III) является
фосфоресцентного время-разрешенного имид-
токсичным в отношении опухолевых клеток, что
жинга PLIM (Phosphorescence Lifetime Imaging) в
позволяет рассматривать их не только в качестве
Таблица 1. Фотофизические характеристики мономера 3 и полимеров P1, P2
Квантовый выход,
Координаты цветности в
№
λmaxabs, нм (logε)
λmaxem, нм
%а
диаграмме CIE (x; y)
В растворе CH2Cl2
3
269 (4.77), 294 (4.68), 362 (4.27), 410
587, 626 пл
18.42
(3.79)
0.55; 0.41
(4.09), 443 (3.99), 475 (3.86)
P1
265 (5,28), 293 (5,15), 362 (4,79), 409
587, 626 пл
17.67
(2.97)
0.57; 0.41
(4,63), 443 (4,51), 475 (4,40)
P2
269 (5.58), 293 (5.47), 360 (5.13), 409
587, 626 пл
10.98
(2.83)
0.57; 0.41
(4.96), 443 (4.85), 475 (4.72)
В растворе H2O
P1
264 (4.90), 290 (4.79), 360 (4.41), 412
587, 626 пл
7.28
(4.54)
0.56; 0.40
(4.20), 443 (4.11), 475 (3.97)
P2
269 (4.78), 293 (4.68), 360 (4.30), 409
587, 626 пл
9.74
(5.76)
0.57; 0.40
(4.09), 443 (3.99), 478 (3.83)
а Дегазированный раствор, в скобках приведены данные для аэрированного раствора.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
НОРБОРНЕНЗАМЕЩЕННЫЙ КАТИОННЫЙ КОМПЛЕКС ИРИДИЯ(III)
1951
Рис. 2. Спектры фотолюминесценции полимеров P1, P2 в растворе хлористого метилена (a, б) и в водном растворе (в, г)
при комнатной температуре, λex 360 нм. 1 - Дегазированный раствор, 2 - аэрированный раствор.
агентов биоимиджинга, но и как потенциальные
ный комплекс иридия(III) и на его основе методом
противоопухолевые агенты [35]. В связи с этим
ROMP получены водорастворимые полимеры P1
представлялось целесообразным определить сте-
и P2, проявляющие кислород-зависимую оран-
пень цитотоксичности полимеров Р1 и Р2 на
жевую фосфоресценцию. Методом МТТ-теста
примере клеток колоректального рака человека
установлено, что полимерные продукты обладают
HCT116. С использованием МТТ-теста установ-
высокой цитотоксичностью по отношению к рако-
лено, что синтезированные полимеры проявляют
вым клеткам линии HCT116. Физико-химические
высокую цитотоксичность. Значения полуингиби-
и биологические свойства полученных полимеров
рующих концентраций IC50 составили 10 (Р1) и
позволяют рассматривать их как потенциальные
0.5 мкмоль (Р2) (рис. 4). Следует отметить, что ци-
сенсоры кислорода и противоопухолевые агенты.
тотоксичность полимеров Р1 и Р2 сопоставима с
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
цитотоксичностью широко применяемых препара-
тов для химиотерапии рака, таких как цисплатин/
Все операции с легко окисляющимися и ги-
оксалиплатин и 5-фторурацил [36, 37].
дролизующимися веществами проводили в ва-
Таким образом, синтезирован новый норбор-
кууме или в аргоне с использованием стан-
нензамещенный циклометаллированный катион-
дартной техники Шленка. Димерный хлорид
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1952
ПАРШИНА и др.
Рис. 3. Фосфоресценция полимеров Р1 и Р2 в аэрированных и дегазированных водных растворах: (а) макро-PLIM изобра-
жения растворов полимеров в пробирках при возбуждении на длине волны 375 нм; (б) кривые затухания фосфоресценции
в дегазированном (зеленая кривая) и аэрированном (красная кривая) растворах. Моноэкспоненциальное затухание. Размер
изображений 4.5×4.5 мм.
иридия [Ir2(piq)4Cl2] [38], норборнензамещенный
ренциальным рефрактометром Smartline RID 2300
фенилимидазофенантролинNBE(CH2)5phphen[39],
в качестве детектора, с набором из двух колонок
7-оксанорборненовые мономеры с олигоэфирны-
Phenomenex с сорбентом Phenogel с размером пор
ми группами (1) [30] и аминокислотными фрагмен-
тами (2) [31], и (H2IMes)(3-Br-py)2(Cl)2Ru=CHPh
(катализатор Граббса III поколения) [40, 41] синте-
зировали как описано в литературе.
C, H, N элементный анализ выполняли на ав-
томатическом элементном анализаторе Elementar
Vario EL cube elemental analyzer. Спектры ЯМР
1H и 13C регистрировали на спектрометре Bruker
Avance Neo 300. Химические сдвиги указаны от-
носительно сигнала остаточных протонов дейте-
рированного растворителя. ИК спектры регистри-
ровали на ИК Фурье-спектрометре ФСМ 1201.
Образцы соединений готовили в виде тонких пле-
Рис. 4. Анализ влияния полимеров P1 и P2 на жиз-
нок между пластинами KBr.
неспособность опухолевых клеток НСТ116 методом
Молекулярно-массовое распределение полиме-
МТТ-теста. Среднее значение±стандартное отклоне-
ров определяли методом гельпроникающей хрома-
ние. *, # - статистически значимое отличие от контро-
ля, p ≤ 0.05, n = 3.
тографии (ГПХ) на хроматографе Knauer с диффе-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
НОРБОРНЕНЗАМЕЩЕННЫЙ КАТИОННЫЙ КОМПЛЕКС ИРИДИЯ(III)
1953
104 и 105 Å (элюент - ТГФ, 2 мл/мин, 40°С, объем
ки НСТ116 высеивали на 96-ти луночый планшет
пробы -20 мкл, концентрация образца - 10 мг/мл).
в количестве 1×104 клеток на лунку. Через 24 ч, по-
Калибровку колонок производили по 13 полисти-
сле адгезии клеток, заменяли питательную среду
рольным стандартам. Размеры полимерных частиц
DMEM на растворы исследуемых полимеров Р1
в водных растворах определяли методом динами-
и Р2 в концентрациях: 0.5, 1.0, 2.5, 5.0, 10.0, 20.0,
ческого светорассеяния на приборе Brookhaven
50.0 мкмоль в 3 повторностях по 10 лунок для ка-
NanoBrook Omni.
ждой концентрации и инкубировали 24 ч. Реагент
Электронные спектры поглощения полимеров
МТТ (0.5 мг/мл) (Alfa Aesar, США) добавляли в
в растворе CH2Cl2 и H2O снимали на спектроме-
культуральную среду и инкубировали в течении
тре PerkinElmer Lambda 25. Спектры фотолюми-
4 ч. Измерение оптической плотности производи-
несценции регистрировали на флуоресцентном
ли спектрофотометрически на мультимодальном
спектрометре PerkinElmer LS 55. Квантовые вы-
планшетном ридере (SynergyTM Mx, BioTek®
ходы фотолюминесценции иридийсодержаще-
Instruments, Inc.) при поглощении на длинах волн
го мономера 3 в растворе CH2Cl2 и полимерных
570 и 630 нм, затем рассчитывали количество (%)
продуктов P1, P2 в растворах CH2Cl2 и H2O опре-
живых клеток в присутствии комплекса по сравне-
деляли при комнатной температуре, длина волны
нию с контролем. В качестве контроля использова-
возбуждения 360 нм. Значения квантовых выходов
ли клетки без добавления полимеров.
рассчитаны относительно Родамина B в этаноле
Иридийсодержащий мономер 3. К суспензии
(Φf 0.70) [42] по методике, описанной в литературе
[Ir2CI2(piq)4] (0.0962 г, 0.076 ммоль) в смеси ме-
[43].
танола (4 мл) и дихлорметана (8 мл) добавляли
Оценку чувствительности фосфоресцентных
NBE(CH2)5phph (0.0684 г, 0.149 ммоль) и реакци-
полимеров P1, P2 к кислороду в растворах про-
онную смесь кипятили в течение 8 ч. Реакционный
водили с использованием двухканального FLIM/
раствор охлаждали до комнатной температуры,
PLIM конфокального макросканера (Becker&Hickl,
добавляли NH4PF6 (0.12 г, 0.74 ммоль) и переме-
Германия) [44]. Запаянные ампулы с аэрированны-
шивали 2 ч при комнатной температуре, затем от-
ми (21% O2) и дегазированными (0% O2) водными
деляли от осадка центрифугированием. Раствори-
растворами исследуемых фосфоресцентных поли-
тель удаляли в вакууме, твердый остаток очищали
меров Р1 и Р2 помещали на предметный столик
хроматографией на силикагеле (CH2Cl2-MeOH,
макросканера. Возбуждение комплексов осущест-
10:1 об.). После удаления растворителя остаток
вляли на длине волны 375 нм в однофотонном
сушили 1 ч в вакууме при 50°С. Получено 0.0885 г
режиме с помощью пикосекундного лазера BDL-
(49%) мономера 3 в виде устойчивого на воздухе
375-SMC (Becker&Hickl, Германия) с мощностью
твердого вещества красного цвета. ИК спектр, ν,
8 мВт. Время накопления сигнала составляло 60
см-1: 3041сл, 2957 о. с, 2934 о. с, 2852 о. с, 1739 сл,
с. Полученные изображения обрабатывали в про-
1598 ср, 1461 с, 1380 с, 1260 ср, 1156 ср, 1040 ср,
грамме SPCImage 8.5 (Becker&Hiсkl, Германия).
843 с, 731 ср, 559 ср. Спектр ЯМР 1Н (CDCl3), δ, м.
Кривые затухания фосфоресценции аппроксими-
д. (J, Гц): 0.30-0.42 м (1Н, Alk), 0.58-1.00 м (5Н,
ровали одноэкспоненциальной функцией с допу-
Alk), 1.08-1.16 м (5Н, Alk), 1.86-1.96 м (2Н, Alk),
стимым χ2 (от 0.8 до 1.2). Время жизни фосфорес-
2.58-2.70 м (2Н, Alk), 4.64-4.90 м (2Н, Alk), 5.76-
ценции рассчитывали с использованием метода
5.81 м (0.85Н, =CH эндо), 5.86-5.97 м (0.30Н, =CH
максимального правдоподобия (MLE).
экзо), 6.01-6.06 м (0.85Н, =CH эндо), 6.41 д (2Н,
Оценку цитотоксичности исследуемых поли-
Ar, J 7.6), 6.93-7.01 м (2Н, Ar), 7.14-7.18 м (3Н,
меров Р1 и Р2 проводили на библиотечной кле-
Ar), 7.29 с (2Н, Ar), 7.57-7.63 м (3Н, Ar), 7.68-7.80
точной культуре НСТ116 (колоректальный рак
м (8Н, Ar), 7.81-7.88 м (2Н, Ar), 7.96-8.03 м (1Н,
человека) методом МТТ-теста. Клетки культивиро-
Ar), 8.07 т (2Н, Ar, J 5.2), 8.32 д (2Н, Ar, J 8.2), 8.97
вали в полной ростовой среде DMEM (Dulbecco′s
т (2Н, Ar, J 9.5), 9.06 д (1Н, Ar, J 8.4), 9.25 д (1Н,
Modified Eagle’s Medium) с добавлением L-глу-
Ar, J 8.2). Спектр ЯМР 13C (CDCl3), δС, м. д.: 26.3,
тамина и 10% фетальной бычьей сыворотки при
27.8, 29.7, 30.1, 30.9, 32.3, 34.4, 38.5, 42.5, 45.3,
37°С, 5% СО2. Для оценки цитотоксичности клет-
46.8, 49.5, 121.6, 122.6, 126.4, 126.8, 127.3, 127.4,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1954
ПАРШИНА и др.
127.7, 128.6, 128.8, 129.1, 129.4, 129.9, 131.2, 132.3,
Alk), 3.30-3.40 м (200H, Alk), 3.48-3.56 м (120H,
132.5, 132.6, 136.9, 137.1, 139.9, 140.6, 141.4, 145.4,
Alk), 3.58-3.75 м (540H, Alk), 4.10-4.30 м (140H,
145.8, 148.8, 153.3. Найдено, %: С 60.68; Н 4.35;
Alk), 4.55-4.80 м (40H, Alk), 4.90-5.20 м (42H,
N 6.57. C61H50F6IrN6P. Вычислено, %: С 60.84; Н
Alk), 5.40-5.70 м (42H, =CH), 5.75-5.95 м (40H,
4.18; N 6.98.
=CH), 6.30-6.45 (2H, Ar), 6.80-7.00 м (4H, Ar),
Полимер P1. К раствору мономера 1 (0.1023 г,
7.10-7.20 м (8H, Ar), 7.55-7.65 (3H, Ar), 7.70-7.85
0.2146 ммоль) и мономера 3 (0.0065 г, 0.0054
м (6H, Ar), 7.95-8.15 м (2H, Ar), 8.20-8.40 м (2H,
ммоль) в 1 мл ТГФ добавляли раствор катализато-
Ar), 8.90-9.10 м (2H, Ar). Найдено, %: С 56.50; Н
ра Граббса III поколения (0.0019 г, 0.0022 ммоль)
7.36; N 1.78. C941H1470F6IrN26O400P. Вычислено,
в 1 мл ТГФ. Смесь перемешивали при 40°С. Про-
%: С 56.83; Н 7.47; N 1.83. Mw 26000, Mn 21400,
текание полимеризации контролировали методом
Mw/Mn = 1.21.
тонкослойной хроматографии. Время полимери-
ФИНАНСОВАЯ ПОДДЕРЖКА
зации составило 10 ч. После завершения реакции
к полученной смеси добавляли несколько капель
Работа выполнена при финансовой под-
этилвинилового эфира для разложения катализа-
держке Российского фонда фундаментальных
тора и дополнительно перемешивали в течение
исследований (грант № 20-03-00102) с исполь-
20 мин при комнатной температуре. Образовав-
зованием оборудования Аналитического цен-
шийся полимер осаждали гексаном (30 мл) и су-
тра Института металлоорганической химии им.
шили в вакууме при 40°С до постоянной массы.
Г.А. Разуваева при поддержке Министерства обра-
Выход 0.1034 г (95%), коричневое смолообразное
зования и науки России (уникальный идентифика-
вещество. ИК спектр, ν, см-1: 2920 о. с, 2882 о. с,
тор RF 2296.61321X0017, соглашение № 075-15-
2825 с, 1741 о. с, 1453 ср, 1384 ср, 1355 ср, 1287
2021-670).
ср, 1200 с, 1109 о. с, 1032 ср, 847 ср, 762 о. сл.
Спектр ЯМР 1Н (CDCl3), δ, м. д.: 1.22-1.28 м (1H,
КОНФЛИКТ ИНТЕРЕСОВ
Alk), 1.82-1.88 м (7H, Alk), 2.20-2.40 м (3H, Alk),
Авторы заявляют об отсутствии конфликта
3.00-3.20 м (82H, Alk), 3.48-3.56 м (160H, Alk),
интересов.
4.10-4.30 м (160H, Alk), 3.30-3.40 м (242H, Alk),
3.58-3.70 м (640H, Alk), 4.55-4.75 м (40H, Alk),
ДОПОЛНИТЕЛЬНЫЕ МАТЕРИАЛЫ
4.90-5.20 м (42H, Alk), 5.35-5.65 м (42H, =CH),
5.75-5.95 м (40H, =CH), 6.30-6.45 (2H, Ar), 6.80-
Дополнительные материалы для этой статьи
7.00 м (4H, Ar), 7.10-7.20 м (8H, Ar), 7.55-7.70
доступны по doi
10.31857/S0044460X22120162
(3H, Ar), 7.70-7.80 м (6H, Ar), 7.90-8.15 м (2H, Ar),
для авторизованных пользователей.
8.20-8.40 м (2H, Ar), 8.90-9.10 м (2H, Ar). Найде-
СПИСОК ЛИТЕРАТУРЫ
но, %: С 55.45; Н 7.40; N 0.43. C941H1490F6IrN6O440P.
Вычислено, %: С 55.76; Н 7.43; N 0.41. Mw 28100,
1. Zhao Q., Huang C., Li F. // Chem. Soc. Rev. 2011. Vol.
Mn 20600, Mw/Mn = 1.36.
40. P. 2508. doi 10.1039/c0cs00114g
Полимер P2 получали аналогично из мономера
2. You Y., Nam W. // Chem. Soc. Rev.
2012.
1 (0.1121 г, 0.2352 ммоль), мономера 2 (0.0343 г,
Vol. 41. P. 7061. doi 10.1039/c2cs35171d
3. Wang X., Wolfbeis O.S. // Chem. Soc. Rev. 2014.
0.0782 ммоль), мономера 3 (0.0093 г, 0.0077 ммоль)
Vol. 43. P. 3666. doi 10.1039/c4cs00039k
в 2 мл ТГФ и раствора катализатора Граббса III
4. Tobita S., Yoshihara T. // Current Opinion Chem. Biol.
поколения (0.0027 г, 0.0031ммоль) в 1 мл ТГФ.
2016. Vol. 33. P. 39. doi 10.1016/j.cbpa.2016.05.017
Выход 0.1448 г (93%), коричневое смолообразное
5. Yoshihara T., Hirakawa Y., Hosaka M., Nangaku M.,
вещество. ИК спектр, ν, см-1: 3324 ср, 2952 о. с,
Tobita S. // J. Photochem. Photobiol. (C). 2017. Vol. 30.
2877 о. с, 2821 с, 1744 о. с, 1683 ср, 1538 ср, 1451
P. 71. doi 10.1016/j.jphotochemrev.2017.01.001
ср, 1352 ср, 1285 с, 1250 с, 1202 о. с, 1109 о. с,
6. Lamansky S., Djurovich P., Murphy D., Abdel-Razzaq F.,
1032 с, 980 ср, 845 ср, 746 о. сл. Спектр ЯМР 1Н
Kwong R., Tsyba I., Bortz M., Mui B., Bau R., Thomp-
(CDCl3), δ, м. д.: 0.80-0.98 (120H, Alk), 1.18-1.28
son M.E. // Inorg. Chem. 2001. Vol. 40. P. 1704. doi
(6H, Alk), 1.52-1.80 (67H, Alk), 3.00-3.20 м (84H,
10.1021/ic0008969
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
НОРБОРНЕНЗАМЕЩЕННЫЙ КАТИОННЫЙ КОМПЛЕКС ИРИДИЯ(III)
1955
7.
Tsuboyama A., Iwawaki H., Furugori M., Mukaide T.,
23.
Sankaran N.B., Rys A.Z., Nassif R., Nayak M.K.,
Kamatani J., Igawa S., Moriyama T., Miura S.,
Metera K., Chen B., Bazzi H.S., Sleiman H.F. //
Takiguchi T., Okada S., Hoshino M., Ueno K. // J. Am.
Macromolecules. 2010. Vol. 43. P. 5530. doi 10.1021/
Chem. Soc. 2003. Vol. 125. P. 12971. doi 10.1021/
ma100234j
ja034732d
24.
Zheng X., Wang X., Mao H., Wu W., Liu B., Jiang X. //
8.
Highly Efficient OLEDs with Phosphorescent Materials /
Nat. Commun. 2015. Vol. 6. P. 5834. doi 10.1038/
Ed. H. Yersin. Weinheim: Wiley-VCH, 2008. 456 p.
ncomms6834
9.
You Y., Park S.Y. // Dalton Trans. 2009. N 8. P. 1267. doi
25.
Miller T., Hill A., Uezguen S., Weigandt M., Goep-
10.1039/b812281d
ferich A. // Biomacromolecules. 2012. Vol. 13. P. 1707.
10.
Bolink H.J., Cappelli L., Coronado E., Grätzel M.,
doi 10.1021/bm3002045
Ortı E., Costa R.D., Pedro M. Viruela P.M., Nazeerud-
26.
Chen W., Zhou S., Ge L., Wu W., Jiang X. //
Biomacromolecules. 2018. Vol. 19. P. 1732. doi
din M.K. // J. Am. Chem. Soc. 2006. Vol. 128. P. 14786.
10.1021/acs.biomac.8b00218
doi 10.1021/ja066416f
27.
Maeda H. // J. Pers. Med. 2021. Vol. 11. P. 229. doi
11.
He L., Duan L., Qiao J., Wang R., Wei P., Wang L.,
10.3390/jpm11030229
Qiu Y. // Adv. Funct. Mater. 2008. Vol. 18. P. 2123. doi
28.
Bochkarev L.N., Parshina Y.P., Gracheva Y.V.,
10.1002/adfm.200701505
Kovylina T.A., Lermontova S.A., Klapshina L.G.,
12.
Sheet S.K., Sen B., Khatua S. // Inorg. Chem. 2019.
Konev A.N., Lopatin M.A., Lukina M.M., Komaro-
Vol. 58. P. 3635. doi 10.1021/acs.inorgchem.8b03044
va A.D., Shcheslavskiy V.I., Shirmanova M.V. //
13.
Liu B., Lystrom L., Brown S.L., Hobbie E.K., Kilina S.,
Molecules. 2021. Vol. 26. P. 6349. doi 10.3390/
Sun W. // Inorg. Chem. 2019. Vol. 58. P. 5483. doi
molecules26216349
10.1021/acs.inorgchem.8b03162
29.
Parshina Y.P., Komarova A.D., Bochkarev L.N.,
14.
Ko C.-N., Li G., Leung C.-H., Ma D.-L. // Coord. Chem.
Kovylina T.A., Plekhanov A.A., Klapshina L.G.,
Rev. 2019. Vol. 381. P. 79. doi 10.1016/j.ccr.2018.11.013
Konev A.N., Mozherov A.M., Shchechkin I.D.,
15.
Shen J., Rees T.W., Ji L., Chao H. // Coord. Chem.
Sirotkina M.A., Shcheslavskiy V.I., Shirmanova M.V. //
Rev. 2019. Vol. 443. P. 214016. doi 10.1016/j.
Int. J. Mol. Sci. 2022. Vol. 23. P. 10263. doi 10.3390/
ccr.2021.214016
ijms231810263
16.
Li S.P.-Y., Lau C.T.-S., Louie M.-W., Lam Y.-W.,
30.
Hersey J.S., Meller A., Grinstaff M.W. // Anal. Chem.
Cheng S.H., Lo K.K.-W. // Biomaterials. 2013. Vol. 34.
2015. Vol.
87. P.
11863. doi
10.1021/acs.
P. 7519. doi 10.1016/j.biomaterials.2013.06.028
analchem.5b03386
17.
Yoshihara T., Hosaka M., Terata M., Ichikawa K.,
31.
Sutthasupa S., Shiotsuki M., Matsuoka H., Masuda T.,
Murayama S., Tanaka A., Mori M., Itabashi H.,
Sanda F. // Macromolecules. 2010. Vol. 43. P. 1815. doi
Takeuchi T., Tobita S. // Anal. Chem. 2015. Vol. 87.
10.1021/ma902405g
P. 2710. doi 10.1021/ac5040067
32.
Su Y.-J., Huang H.-L., Li C.-L., Chien C.-H., Tao Y.-T.,
18.
Yin S.-Y., Sun S.-S., Pan M., Fan Y.-Z., Chen Y.-X.,
Chou P.-T., Datta S., Liu R.-S. // Adv. Mater. 2003.
Wang H.-P., Fan Y.-N. // Inorg. Chem. Commun. 2017.
Vol. 15. P. 884. doi 10.1002/adma.200304630
Vol. 83. P. 81. doi 10.1016/j.inoche.2017.06.025
33.
Castor K.J., Metera K.L., Tefashe U.M., Serpell C.J.,
19.
Solomatina A.I., Su S.H., Lukina M.M., Dudenkova V.V.,
Mauzeroll J., Sleiman H.F. // Inorg. Chem. 2015.
Shcheslavskiy V.I., Wu C.H., Chelushkin P.S., Chou P.T.,
Vol. 54. P. 6958. doi 10.1021/acs.inorgchem.5b00921
Koshevoy I.O., Tunik S.P. // RSC Adv. 2018. Vol. 8.
34.
Montalti M., Credi A., Prodi L., Gandolfi M.T.
P. 17224. doi 10.1039/c8ra02742k
Handbook of Photochemistry. Boca Raton: CRC Press,
20.
Kritchenkov I.S., Elistratova A.A., Sokolov V.V.,
2006. 633 p.
Chelushkin P.S., Shirmanova M.V., Lukina M.M.,
35.
Tan C.-P., Zhong Y.-M., Ji L.-N., Mao Z.-W. // Chem.
Dudenkova V.V., Shcheslavskiy V.I., Kalinina S.,
Sci. 2021. Vol. 12. P. 2357. doi 10.1039/d0sc06885c
Reeß K., Rück A., Tunik S.P. // New J. Chem. 2020.
36.
Shimolina L., Gulin A., Ignatova N., Druzhkova I.,
Vol. 44. P. 10459. doi 10.1039/d0nj01405b
Gubina M., Lukina M., Snopova L., Zagaynova E.,
21.
Sun P., Lu X., Fan Q., Zhang Z., Song W., Li B.,
Kuimova M. K., Shirmanova M. // Cancers. 2021.
Huang L., Peng J., Huang W. // Macromolecules. 2011.
Vol. 13. P. 6165. doi 10.3390/cancers13246165
Vol. 44. P. 8763. doi 10.1021/ma201614z
37.
Shirshin E.A., Shirmanova M.V., Gayer A.V.,
22.
Liu S., Qiao W., Cao G., Chen Y., Ma Y., Huang Y.,
Lukina M.M., Nikonova E.E., Yakimov B.P.,
Liu X., Xu W., Zhao Q., Huang W. // Macromol.
Budylin G.S., Dudenkova V.V., Ignatova N.I.,
Rapid Commun. 2013. Vol. 34. P. 81. doi 10.1002/
Komarov D.V., Yakovlev V.V., Becker W., Zagaynova E.V.,
marc.201200589
Shcheslavskiy V.I., Scully M.O // Proc. Natl. Acad. Sci.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022
1956
ПАРШИНА и др.
USA 2022. Vol. 119. P. e2118241119. doi 10.1073/
41. Love J.A., Morgan J.P., Trnka T.M., Grubbs R.H. //
pnas.2118241119
Angew. Chem. Int. Ed. 2002. Vol. 41. P. 4035. doi
38. Lepeltier M., Dumur F., Marrot J., Contal E., Bertin D.,
10.1002/1521-3773(20021104)41:21<4035::AID-
Gigmes D., Mayer C.R. // Dalton Trans. 2013. Vol. 42.
ANIE4035>3.0.CO;2-I
P. 4479. doi 10.1039/c2dt32071a
42. López Arbeloa F., Ruiz Ojeda P., López Arbeloa I. //
39. Баринова Ю.П., Ильичева А.И., Бочкарев Л.Н.,
J. Lumin. 1989. Vol. 44. P. 105. doi 10.1016/0022-
Ильичев В.А., Курский Ю.А. // ЖОХ 2013. Т. 83.
2313(89)90027-6
Вып. 1. С. 80; Barinova Yu.P., Ilicheva A.I.,
43. Demas J.N., Crosby G.A. // J. Phys. Chem. 1971.
Bochkarev L.N., Ilichev V.A., Kurskii Yu.A. // Russ. J.
Vol. 75. P. 991. doi 10.1021/j100678a001
Gen. Chem. 2013. Vol. 83. N 1. P. 72. doi 10.1134/
44. Shcheslavskiy V.I., Shirmanova M.V., Dudenkova V.V.,
S107036321301012X
Lukyanov K.A., Gavrina A.I., Shumilova A.V.,
40. Scholl M., Ding S., Lee C.W., Grubbs R.H. // Org. Lett.
Zagaynova E.V., Becker W. // Opt. Lett. 2018. Vol. 43.
1999. Vol. 1. P. 953. doi 10.1021/ol990909q
P. 3152. doi 10.1364/OL.43.003152
Norbornene-Substituted Cationic Iridium(III) Complex and
Water-Soluble Luminescent Polymers Based on It: Synthesis,
Photophysical and Cytotoxic Properties
Yu. P. Parshinaa, T. A. Kovylinaa, A. N. Koneva, A. A. Belikova, P. O. Babera, A. D. Komarovab,c,
E. A. Romaevac, and L. N. Bochkareva,*
a G. A. Razuvaev Institute of Organometallic Chemistry, Russian Academy of Sciences, Nizhny Novgorod, 603950 Russia
b Privolzhsky Research Medical University, Nizhny Novgorod, 603005 Russia
c Lobachevsky State University of Nizhny Novgorod, Nizhny Novgorod, 603950 Russia
*e-mail: lnb@iomc.ras.ru
Received October 3, 2022; revised October 30, 2022; accepted November 1, 2022
A norbornene-substituted cationic iridium(III) complex containing 1-phenylisoquinoline cyclometalating ligands
and an ancillary phenylimidazophenanthroline ligand was synthesized. On the base of the iridium complex
water-soluble polymers were obtained by ring-opening metathesis polymerization (ROMP). The resulting poly-
mers showed oxygen-dependent phosphorescence in the orange spectral region and revealed high cytotoxicity
against HCT116 cancer cells.
Keywords: iridium cyclometalated complexes, functionalized polynorbornenes, metathesis polymerization,
iridium-containing polymers, photoluminescence, cytotoxicity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 12 2022