ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 5, с. 746-754
УДК 547.246
ВЗАИМОДЕЙСТВИЕ АЛЛИЛСИЛАНОВ
С МЕТИЛХЛОРГИДРИДСИЛАНАМИ И
СИММЕТРИЧНЫМ ТЕТРАМЕТИЛДИСИЛОКСАНОМ
© 2022 г. В. Г. Лахтин*, Д. А. Ефименко, А. М. Филиппов, И. Б. Сокольская,
А. К. Шестакова, Т. И. Шулятьева, Н. Г. Комаленкова, П. А. Стороженко
Государственный научно-исследовательский институт химии и технологии элементоорганических соединений,
ш. Энтузиастов 38, Москва, 105118 Россия
*e-mail: vlachtin@rambler.ru
Поступило в редакцию 14 декабря 2021 г.
После доработки 31 января 2022 г.
Принято к печати 2 февраля 2022 г.
Проведены реакции гидросилилирования аллилсиланов R3SiAll (R = Cl, Me) метилхлоргидридсиланами
MenCl3-nSiH (n = 0-2) и симметричным тетраметилдисилоксаном в присутствии катализатора Карстедта.
Изменение реакционной способности аллилсиланов аналогично аллилгерманам, за исключением вза-
имодействия аллилтрихлорсилана с диметилхлорсиланом, возможно, из-за меньшей электроотрица-
тельности группы Cl3Si по сравнению с группой Cl3Ge. Аллилсиланы проявляют большую реакционую
способность в данных реакциях, чем изоструктурные аллилгерманы. Предложена схема возможного
протекания реакций гидросилилирования. Полученные соединения идентификацированы с помощью
ЯМР 1H и хромато-масс-спектрометрии.
Ключевые слова: аллилгерман, органохлоргидридсиланы, гидросилилирование, аддукт, катализатор
Карстедта, хромато-масс-спектрометрия
DOI: 10.31857/S0044460X22050109, EDN: CJZPTF
Недавно опубликованы результаты исследова-
ном с различным успехом проводились в разных
ния реакций гидросилилирования аллилгерманов
условиях с применением катализаторов Спайера
R3GeAll (R = Cl, Me) гидридсиланами MenCl3-nSiH
[2-5], Pt/C [6], Карстедта [7], родиевого катали-
(n = 0-2) и 1,1,3,3-тетраметилдисилоксаном [1], от-
затора [8], перекисей ацетила и бензоила [9-12].
мечена потенциальная полезность аддуктов с ато-
Сообщалось о гидросилилировании метокси- и
мами Si, Ge, C, H в молекулах. Выбор заместите-
этоксиаллилсиланов в присутствии катализаторов
лей у атомов кремния и германия сделан с учетом
Спайера и Карстедта [13, 14], а также тетрааллил-
того, чтобы получаемые аддукты - 1,3-бис(силил/
силана и аллилтриметилсилана гидридсиланами
гермил)пропаны - имели активные заместители
HSiMe2(CH2Cl) и HSiMe2(CH2SPh) с использо-
(Cl) при атомах Si и Ge и могли быть прекурсо-
ванием платиновых катализаторов Карстедта и
рами для получения на их основе новых биологи-
(Bu4N)2PtCl6 [15-18]. Полученные аддукты ис-
чески активных соединений, например, атрановой
пользовались для синтеза дендримеров и цирко-
структуры. Продолжая исследования в этом на-
ноценов. Для гидросилилирования применялись и
правлении, мы изучили реакции гидросилилиро-
более сложные катализаторы: катионы фосфония
вания кремниевых аналогов - аллилсиланов.
с пиридином и перфторфенилом в качестве заме-
Некоторые реакции аллилметилхлорсиланов с
стителей при атоме Р [19], ненасыщенные 16-элек-
гидридсиланами и 1,1,3,3-тетраметилдисилокса-
тронные гидридосилильные комплексы Rh(III)
746
ВЗАИМОДЕЙСТВИЕ АЛЛИЛСИЛАНОВ С МЕТИЛХЛОРГИДРИДСИЛАНАМИ
747
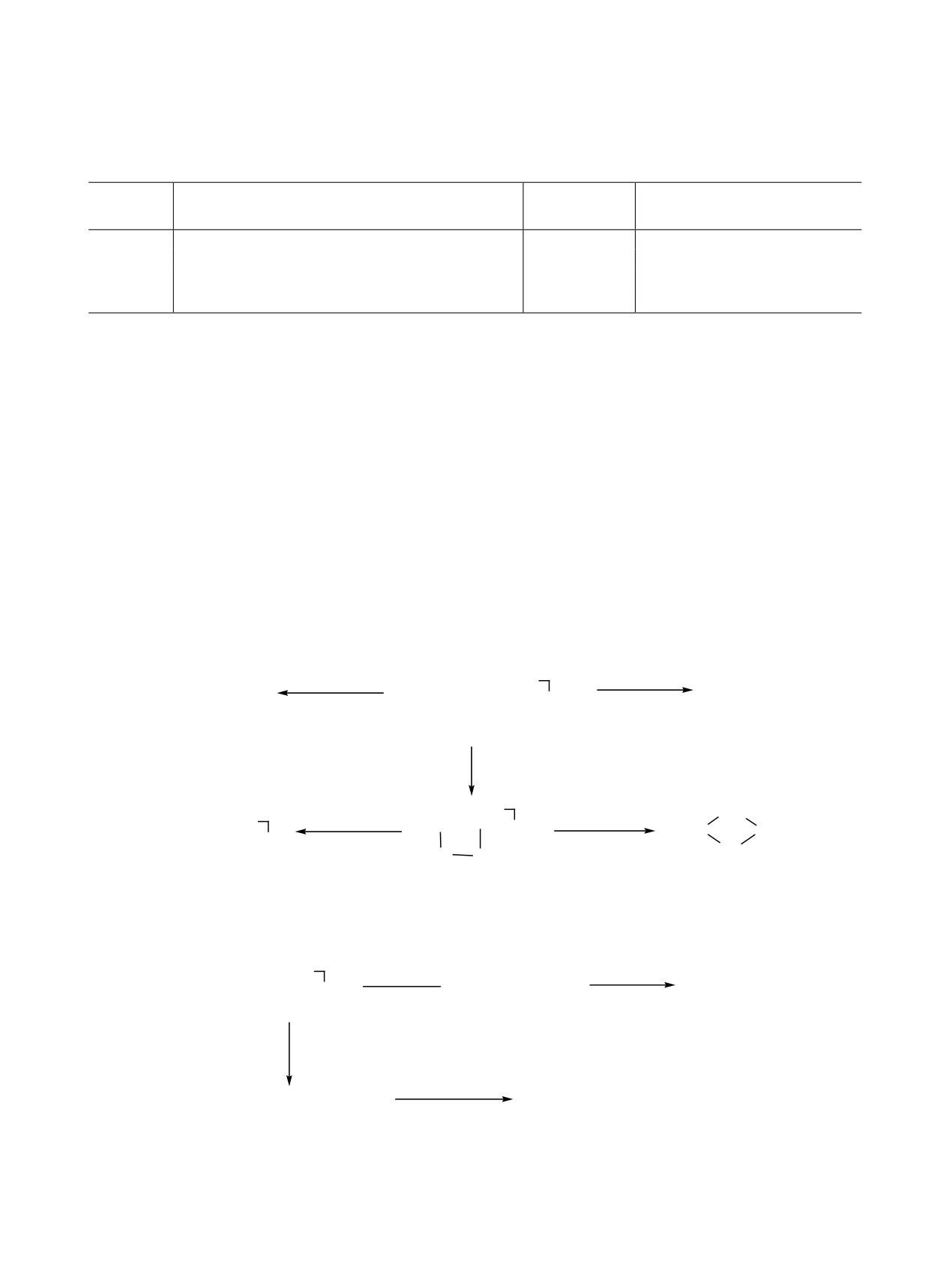
Таблица 1. Гидросилилирование аллилсиланов 1 и 2
№
Продукт реак-
Время
Мольное соотношение
Исходные реагенты
Выход, %
опыта
ции
реакции, ч
олефин-гидридсилан,
1
1
HSiCl3
3а
2
1:1.2
86
2
1
MeCl2SiH
3б
3
1:1.2
79
3
1
Me2ClSiH
3в
3
1:1.2
61
4
2
HSiCl3
4а
6
1:1.2
-
5
2
MeCl2SiH
4б
2
1:1.2
77
6
2
Me2ClSiH
4в
2
1:1.2
85
7
1
(HSiMe2)2O
5а
10
1:2
-
8
2
(HSiMe2)2O
5б
4
1:2
84
[20, 21]. Сообщалось и о фотокаталитическом ги-
дных, и получения прекурсоров для синтеза новых
дросилилировании в отсутствие металлов [22].
биологически активных соединений.
Влияние заместителей при атоме кремния ал-
Катализатор
Карстедта,
представляю-
лилсиланов на реакционную способность кратной
щий собой
2%-ный раствор комплекса Pt0 с
углерод-углеродной связи в реакции гидросили-
1,3-дивинил-1,1,3,3-тетраметилдисилоксаном,
Pt2[(Me2SiCH=CH2)2O]3, был выбран как один из
лирования изучалось только в одной работе [2]. В
наиболее доступных и эффективных катализато-
остальных приведенных выше публикациях реак-
ров гидросилилирования. Реакции проводили в
ции проводили либо с целью установления прин-
запаянных ампулах в присутствии катализатора
ципиальной возможности их реализации, либо для
Карстедта при 100°С, мольное соотношение ал-
получения конкретного соединения-прекурсора в
лилсилан:гидридсилан = 1:1.2 (схема 1). Были по-
синтезе более сложных молекул.
лучены исключительно γ-аддукты (табл. 1).
Нами проведены реакции аллилсиланов R3SiAll
Сравнение полученных экспериментальных
(R = Me, Cl) с гидридсиланами MenCl3-nSiH (n =
данных с полученными нами ранее [1] показало,
0-2) и 1,1,3,3-тетраметилдисилоксаном в тех же
что изменение реакционной способности аллилси-
условиях (в присутствии катализатора Карстед-
ланов во многом аналогично аллилгерманам: ре-
та, 100°С), что и реакции германиевых аналогов
акционная способность аллилсилана 1 снижается
(аллилтрихлор- и аллилтриметилгерманов) с ука-
при переходе от HSiCl3 к Me2ClSiH, а у аллилсила-
занными гидридами [1], с целью получения срав-
на 2 наоборот - в той же последовательности воз-
нительных данных о реакционной способности
растает, причем взаимодействие аллилтриметил-
исходных реагентов и оценки эффективности ка-
силана 2, как и аллилтриметилгермана, с HSiCl3
ждой из изучаемых реакций, проводимых в одина-
полностью отсутствует. Аллилтрихлорсилан 1 так
ковых условиях, а также попытки оценить влияние
же, как аллилтрихлоргерман, не вступает в реак-
замены атомов германия на кремний на эффект ги-
цию с (HSiMe2)2O, но в отличие от AllGeCl3 легко
персопряжения, характерный для аллилпроизво-
реагирует с диметилхлорсиланом. Эти факты, а
также меньшее время проведения реакций гидро-
силилирования аллилсиланов и большие выходы
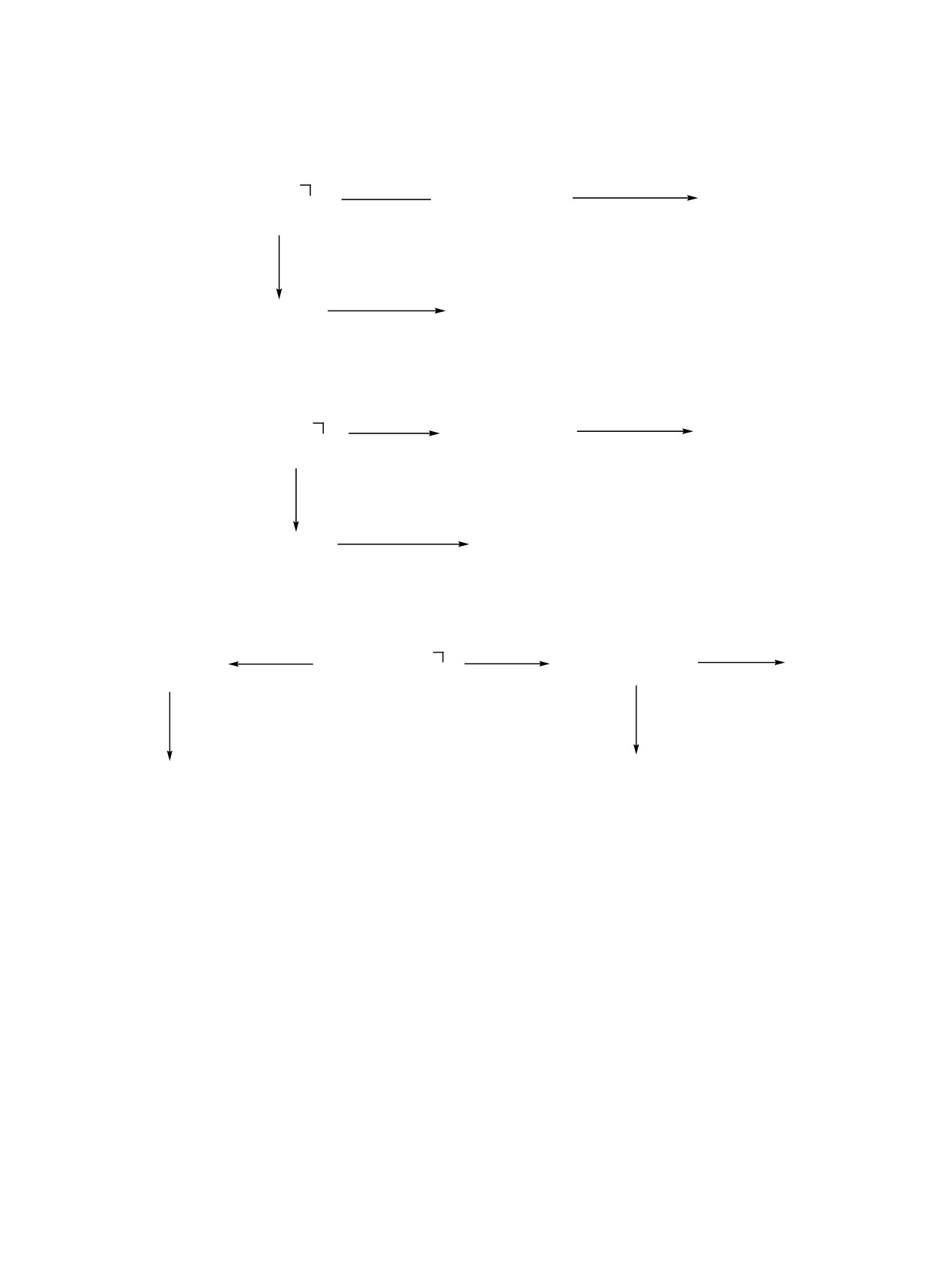
Схема 1.
аддуктов свидетельствуют о большей реакцион-
ной способности аллилсиланов по сравнению с
cat
R3SiCH2CH=CH2 + HX
R3SiCH2CH2CH2X
германиевыми аналогами в изучаемых реакциях.
Это подтверждается конкурирующими реакциями
1, 2
3а-в, 4а-в, 5а, б
гидросилилирования аллилсиланов и аллилгерма-
R = Cl, Х = SiCl3 (3a), SiMeCl2 (3б), SiMe2Cl (3в),
нов (табл. 2).
Me2SiOSiMe2H (5a); R = Me, Х = SiCl3 (4a), SiMeCl2
При гидросилилировании аллилсилана
2
(4б), SiMe2Cl (4в), Me2SiOSiMe2H (5б).
1,1,3,3-тетраметилдисилоксаном (табл.
1, оп.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
748
ЛАХТИН и др.
Таблица 2. Относительная реакционная способность аллилсиланов и аллилгерманов в реакциях с гидридсиланами
(катализатор Карстедта, 100°С, 2 ч)
Мольное соотношение выходов
№ опыта
Конкурирующие олефины
Гидросилан
продуктов гидросилилированияа
1
Cl3SiAll/Cl3GeAll
HSiCl3
1.82
2
Cl3SiAll/Cl3GeAll
HSiMeCl2
1.51
3
Me3SiAll/Me3GeAll
HSiMeCl2
1.32
4
Me3SiAll/Me3GeAll
HSiMe2Cl
1.25
а Рассчитано методом газожидкостной хроматографии.
№ 8) для увеличения выхода продукта моноприсо-
ленных методом хроматографирования на колонке
единения 5б реакцию проводили при соотношении
соединений. Фрагментация аддукта 3а приводит
реагентов аллилсилан:силоксан = 1:2. При таком
к образованию катионов с такими же значениями
соотношении продукт двойного присоединения
массы к заряду m/z, как и в работе [2], но мы пред-
образуется с незначительным выходом (~12%).
полагаем, что катионы с m/z 139 и 161 имеют дру-
гое строение (схема 2).
Данные спектров ЯМР 1Н и полученные в
условиях электронной ионизации масс-спектры
При фрагментации соединения 3б (схема 3)
синтезированных соединений приведены в Экс-
происходит прямой разрыв связи меж-
периментальной части. Анализ фрагментации
ду
пропан-1,3-дихлорсилилпропиль-
подтверждает строение синтезированных и выде-
ной и метилдихлорсилильной группами
Схема 2.
+
•
- •Cl, Cl2Si(CH2)3
- •CH2SiCl3
Cl3SiCH2CH2CH2SiCl3
Cl3Si+
ClC2H4Si+Cl2
m/z 161 (33.1)
m/z 308 (0)
m/z 133 (100)
-HCl
+•
•
CH2
+•
- C2H4
Cl3SiCH-SiCl2
- SiCl3
Cl3SiCH=SiCl2
ClHC
Si+Cl
CH2
CH2
CH2
m/z 244 (8.8)
m/z 272 (24.2)
m/z 139 (25.7)
Схема 3.
+•
- Cl2Si(CH2)3
- •Cl
Cl3SiC3H6SiMeCl2
Cl2Si+C3H6SiMeCl2
MeCl2Si+
m/z 288 (0)
m/z 253 (0)
m/z 133(100)
− •CH3
- Cl2Si(CH2)3
Cl3SiCH2CH2CH2Si+Cl2
Cl3Si+
m/z 273 (25.1)
m/z 133 (33.9)
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
ВЗАИМОДЕЙСТВИЕ АЛЛИЛСИЛАНОВ С МЕТИЛХЛОРГИДРИДСИЛАНАМИ
749
Схема 4.
+•
-MeClSi(CH2)3
- •CH3
Cl3SiC3H6SiMe2Cl
Cl3SiC3H6Si+MeCl
Cl3Si+
m/z 268 (0)
m/z 253 (17.1)
m/z 133(16.1)
− •Cl
-Cl2Si(CH2)3
Cl2Si+C3H6SiCl2
Me2ClSi+
m/z 233 (11.8)
m/z 93 (100)
Схема 5.
+•
- •CH3
-Cl2Si(CH2)3
Me3SiC3H6SiMeCl2
Me3SiC3H6Si+Cl
2
Me3Si+
m/z 288 (0)
m/z 213 (17.7)
m/z 73 (100)
− •Cl
-Me2Si(CH2)3
Me3SiC3H6Si+MeCl
Me2ClSi+
m/z 193 (6.1)
m/z 93 (4.2)
Схема 6.
+•
-Me2Si(CH2)3
- •CH3
- •CH3
Me3SiC3H6SiMe+Cl
Me3SiC3H6SiMe2Cl
Me2Si+C3H6SiMe2Cl
Me2ClSi+
б
m/z 193
m/z 208 (0)
m/z 93 (15)
m/z 193
-HSiMe2Cl
a
-MeClSi(CH2)3
Me2Si+C3H5
Me3Si+
m/z 99 (19.5)
m/z 73 (100)
с образованием катиона максимальной интенсив-
радикала и 1,1-дихлорсилациклобутана с образо-
ности MeCl2Si+. Второе, менее интенсивное на-
ванием катиона Me3Si+ (m/z 73) максимальной ин-
правление, - выброс метильного радикала •CH3
тенсивности. Второе направление проявляется в
и
1,1-дихлорсилациклобутана Cl2Si(CH2)3, что
отрыве радикала •Cl c образованием катиона, m/z
приводит к появлению трихлорсилильного ка-
193, и элиминировании 1,1-диметилсилациклобу-
тиона Cl3Si+. При фрагментации соединения 3в
тана c образованием катиона m/z 93.
(схема 4) за выбросом метильного радикала сле-
Фрагментация аддукта 4в происходит с выбро-
дует элиминирование 1-метил-1-хлорсилациклоб-
сом •CH3 от первого или второго атома кремния
утана MeClSi(CH2)3.
(схема 6). В обоих случаях образуются катионы с
Основное направление фрагментации соеди-
m/z 193 с локализацией заряда на первом или вто-
нения 4б (схемa 5) - элиминирование метильного
ром атоме кремния, которые распадаются с элими-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
750
ЛАХТИН и др.
Схема 7.
- •CH3
Me3SiC3H6SiMe2OSiMe2H
Me3SiC3H6SiMe2OSi+MeH
m/z 248 (1)
m/z 233 (44)
-Me
O Si(Me)H
2Si
-Me3SiH
CH2
CH2
CH2
−Me2Si(CH2)3
Me2Si+OSi(Me)2H
Me2Si
O Si+Me
Me3Si+
m/z 133 (85.5)
m/z 73 (100)
CH2
CH2
CH2
m/z 159 (45.9)
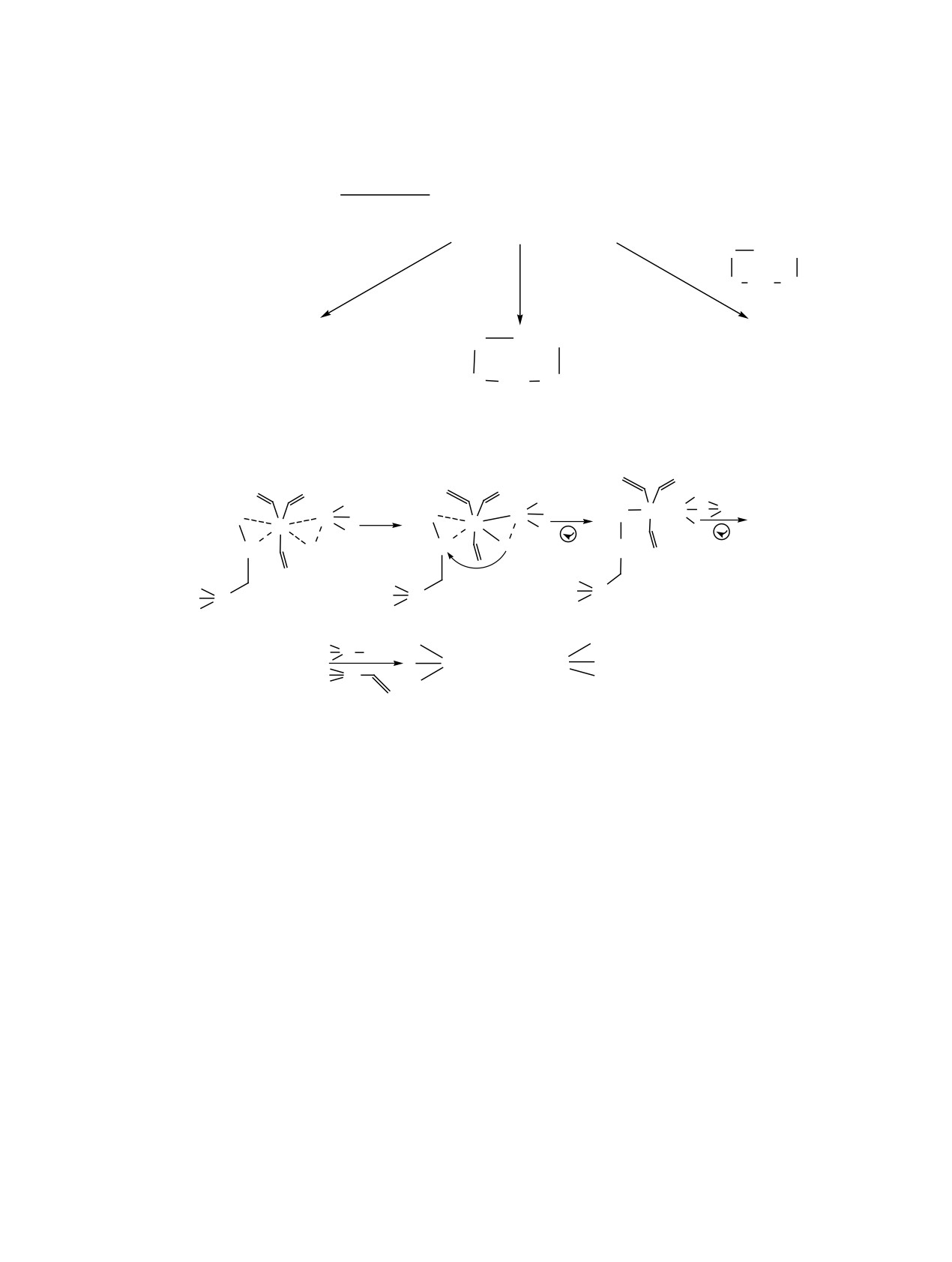
Схема 8.
H
H
C
Pt Si
Si
H
Si
H
Si
2
2C
2C
Pt
Pt
CH
H
CH
H
H2C
Si
Si
Si
A
Б
В
Si
H
SiCH2CH2CH2Si
+ A
Si
нированием 1-метил-1-хлорсилациклобутана (а) и
схему 8, аналогичную предложенной нами для ре-
1,1-диметилсилациклобутана (б). Максимальную
акций с аллилгерманами [1].
интенсивность в масс-спектре имеет триметилси-
На первой стадии происходит образование
лил-катион Me3Si+.
π-комплекса и активация силана А. При этом элек-
Отличительная особенность фрагментации ад-
трофильный металл координируется к γ-углерод-
ному атому, так как именно на нем сосредоточена
дукта 5б (схемa 7) - элиминирование циклическо-
максимальная электронная плотность [2, 23], и, в
го нейтрального фрагмента с массой 160 Дa и об-
конечном итоге, образуются исключительно γ-ад-
разование циклического катиона с m/z 159.
дукты. На следующем этапе на каталитическом
Во всех полученных соединениях присутству-
центре происходит взаимодействие активирован-
ет группа С3Н6, которая при фрагментации об-
ного гидридсилана с координированным олефи-
условливает образование силациклобутановых
ном, и атом водорода присоединяется к β-атому
фрагментов с заместителями Me и Cl при атоме
углерода (Б→В). Реакция протекает легче с увели-
кремния или элиминирование этилена при вну-
чением дефицита электронной плотности на атоме
тримолекулярных перегруппировках в условиях
углерода и степени гидридности атома водорода
электронной ионизации.
в соответствующем гидридсилане. По-видимому,
Полученные при гидросилилировании аллил-
под влиянием электроноакцепторной группы Cl3Si
силанов результаты можно объяснить, рассмотрев
в молекуле аллилтрихлорсилана (как и группы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
ВЗАИМОДЕЙСТВИЕ АЛЛИЛСИЛАНОВ С МЕТИЛХЛОРГИДРИДСИЛАНАМИ
751
Cl3Ge в аллилтрихлоргермане) электронная плот-
многом аналогичны результатам аналогичных ре-
ность связи Сβ=Сγ частично смещается к β-атому
акций изоструктурных германиевых соединений.
углерода. Гидридный характер атома водорода в
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
гидридсиланах качественно согласуется с изме-
нением его химического сдвига и увеличивается в
Без дополнительной очистки использова-
ряду HSiCl3 (6.0 м. д.) → HSiMeCl2 (5.5 м. д.) →
ли реагенты: Cl3SiH (98%, HORS Technologies),
HSiMe2Cl (4.8 м. д.). К аллилтрихлоргерману при-
Me2ClSiH (98%, Acros), MeCl2SiH (98%, Acros),
соединяются только трихлорсилан и метилдихлор-
1,1,3,3-тетраметилдисилоксан (97%, Acros), 2%-
силан, в которых степень гидридности атома водо-
ный раствор платина(0)-1,2-дивинил-1,1,3,3-
тетраметилдисилоксановый комплекс (катализа-
рода наименьшая. У Me2ClSi+H‾ она повышается
настолько, что Н‾ уже не способен присоединить-
тор Карстедта, ABCR).
ся к β-атому углерода [1]. Тем не менее, как было
Количественное определение исходных соеди-
указано выше, аллилсилан 1 легко реагирует с
нений и продуктов реакций проводили методом
Me2ClSiH, образуя с хорошим выходом аддукт 3в.
ГЖХ на приборе Хроматэк-Кристалл 5000.2 в изо-
термических условиях, температура капиллярной
Большая реакционная способность аллилтрихлор-
колонки НР-1 (30 × 0.32 × 0.25) - 110°С, температу-
силана по сравнению с аллилтрихлоргерманом в
ра испарителя и детектора по теплопроводности -
реакции с диметилхлорсиланом объясняется, воз-
230°С. Спектры ЯМР 1H соединений регистриро-
можно, меньшей электроотрицательностью груп-
вали на спектрометре Bruker AM-360 с рабочей
пы Cl3Si, чем группы Cl3Ge. Это подтверждается
частотой 360 МГц при 303 K. В качестве внутрен-
данными ЯМР 1Н: все химические сдвиги прото-
него стандарта использовали тетраметилсилан.
нов аллильной группы в AllSiCl3 находятся в более
Для идентификации полученных соединений ис-
сильном поле по сравнению с аналогичными сиг-
пользовали хромато-масс-спектрометр с ионной
налами в спектрах AllGeCl3 [AllSiCl3 (CDCl3), δ,
ловушкой 240 Ion Trap GC/MS Agilent Technologiеs
м. д.: 2.37 м (2Н, СН2), 5.24 м (2Н, =СН2), 5.79
и энергией ионизирующих электронов
70 эВ
м (1Н, СН=); AllGeCl3 (CDCl3), δ, м. д.: 2.89 м
(метод ХМС). Для разделения компонентов ис-
(2Н, СН2), 5.35 м (2Н, =СН2), 5.85 м (1Н, СН=)].
пользовали капиллярную колонку DB-1 (25 м ×
Видимо, поэтому группа Cl3Si в меньшей степени
0.32 мм × 0.25 мкм). Соединения растворяли в гек-
влияет на смещение электронной плотности связи
сане. Навеску 3 мг образца растворяли в 1 мл рас-
Сβ=Сγ к β-атому углерода, и атом водорода гидрид-
творителя и с помощью автоматического дозатора
силана Me2ClSi+H- легко присоединяется к нему.
вводили 1 мкл пробы в испаритель хроматографа
при 240°С. Разделение газового потока составляло
В присутствии в молекуле исходного олефина
1:30, скорость газа-носителя (гелий марки 6.0) -
электронодонорной группы Ме3Si (аллилсилан 2),
1 мл/мин. Анализ начинали при 50°С в изотерме
по-видимому, не происходит смещения электрон-
0.5 мин, затем нагревали до 200°С со скоростью
ной плотности связи Сβ=Сγ, и на β-углеродном
10 град/мин. Для идентификации исследуемых со-
атоме сохраняется ее дефицит. Поэтому в данном
единений использовали электронную библиотеку
случае невозможно присоединение трихлорсила-
масс-спектров NIST 11 [24].
на. Образование аддуктов наблюдается только при
Аллилтрихлорсилан 1 получали по методике
взаимодействии с гидридсиланами MeCl2Si+H- и
[25], аллилтриметилсилан 2 - по методике [26],
Me2ClSi+H-, что характерно и для германиевого
но в качестве реактива Гриньяра использовали
аналога.
MeMgCl. Аллилтрихлоргерман получали по мето-
Результаты, полученные в реакциях аллилсила-
дике, подробно изложенной в работе [27]. Аллил-
нов 1 и 2 с симметричным тетраметилдисилокса-
триметилгерман получали по известной методике
ном, можно объяснить аналогично.
[28].
Таким образом, конечные результаты гидроси-
Гидросилилирование аллилсиланов. В сте-
лилирования зависят главным образом от окру-
клянную ампулу загружали расчетное количество
жения атомов кремния в исходных реагентах и во
исходных реагентов в молярном соотношении ре-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
752
ЛАХТИН и др.
агентов аллилсилан-гидридсилан 1:1.2 и каплю
(5 мм рт. ст.), n20 1.4441. Спектр ЯМР 1H (CDCl3),
катализатора Карстедта. Запаянную ампулу по-
δ, м. д.: 0.02 с (9H, Me3Si), 0.63-0.68 м (2Н,
мещали в масляную баню и выдерживали 1-16 ч
СН2SiMe3), 0.78 c (3Н, MeSi), 1.17-1.22 м (2Н,
при 100°С. Затем ампулу вскрывали, реакционную
СН2SiMeCl2),
1.53-1.62 м
(2Н, СН2СН2СН2).
смесь анализировали методом ГЖХ и разгоняли в
Масс-спектр, m/z (Iотн, %): 228 (0) [M]+., 213 (17.7)
вакууме. Выделенные продукты реакции иденти-
[M - Me]+, 193 (6.1) [M - Cl]+, 93 (4.2) [Me2ClSi]+,
фицировали методами ЯМР 1Н спектроскопии и
73 (100) [Me3Si]+.
хромато-масс-спектрометрии.
1-(Диметилхлорсилил)-3-(триметилсилил)-
Реакции аллилсиланов с (HSiMe2)2O проводили
пропан (4в). Выход 84.5%, т. кип. 38-40°С (5-
по аналогичной методике в соотношении аллилси-
6 мм рт. ст.), n20 1.4350. Спектр ЯМР 1H (CDCl3), δ,
лан-тетраметидисилоксан 1:2
м. д.: 0.01 с (9H, Me3 Si), 0.42 с (6Н, Me2Si), 0.58-0.63
м (2Н СН2SiMe3), 0.88-0.93 м [2Н, СН2(SiMe2Cl)],
Конкурирующие реакции гидросилилиро-
1.44-1.52 м (2Н, СН2СН2СН2). Масс-спектр, m/z
вания. В стеклянную ампулу загружали 1.75 г
(0.01 моль) аллилтрихлорсилана, 2.20 г (0.01моль),
(Iотн, %): 208 (0) [M]+, 193 (15.3) [M - CH3]+, 165
аллилтрихлоргермана, 0.7 г (0.005) трихлорсилана
(3.8) [M - CH3С2Н4]+, 100 (12.7) [Me2Si(CH2)3]+, 99
(19.5) [Me2C3H5Si]+, 93 (15) [Me2ClSi]+, 85 (8.3), 73
и каплю катализатора Карстедта. Запаянную ампу-
(100) [Me3Si]+, 59 (14.8), 45 (9.9).
лу помещали в масляную баню и выдерживали 2 ч
при 100°С. Затем ампулу вскрывали, реакционную
1-(Тетраметилдисилокси)-3-(триметилси-
смесь анализировали методом ГЖХ и рассчитыва-
лил)пропан (5б). Выход 81.4%, т. кип. 65-67°С
20
ли соотношение полученных аддуктов.
(1-2 мм рт. ст.), n
1.4172. Спектр ЯМР 1H
(CDCl3), δ, м.д.: 0.02 с (9H, Me3Si), 0.41 с (6Н,
Остальные конкурирующие реакции проводи-
Me2Si), 0.58-0.63 м (2Н, СН2SiMe3), 0.88-0.93 м
ли аналогично.
[2Н, СН2(SiMe2Cl)], 1.44-1.52 м (2Н, СН2СН2СН2).
1,3-Бис(трихлорсилил)пропан
(3а). Выход
Масс-спектр, m/z (Iотн, %): 248 (1) [M]+, 233 (44)
86.1%, т. кип. 67-68°С (2 мм рт. ст.), n20 1.4747.
[M - Me]+, 159 (45.9) [M - Me - 74]+, 133 (85.5)
Спектр ЯМР 1H (CDCl3), δ, м. д.: 1.55-1.61 м (4Н,
[Me2SiOSi(Me)2H]+.
CH2Si),
1.90-1.99 м
(2Н, CH2CH2CH2). Масс-
спектр, m/z (Iотн, %): 308 (0) [M]+., 272 (24.6)
КОНФЛИКТ ИНТЕРЕСОВ
[M - HCl]+., 244 (8.8) [272 - C2H4]+., 161 (33.0)
[C2H4SiCl3]+, 133 (100) [Cl3Si]+.
Авторы заявляют об отсутствии конфликта
интересов.
1-(Метилдихлорсилил)-3-(трихлорсилил)-
пропан (3б). Выход 79.2%, т. кип. 85-86°С (5 мм
СПИСОК ЛИТЕРАТУРЫ
рт. ст.), n20 1.4700. Спектр ЯМР 1H (CDCl3), δ, м. д.:
0.82 с (3Н, MeSi), 1.26-1.32 м [2Н, СН2(SiMeCl2)],
1. Лахтин В.Г., Ефименко Д.А., Филиппов А.М., Шуля-
тьева Т.И., Сокольская И.Б., Семяшкина И.А., Кома-
1.52-1.58 м (2Н, СН2SiCl3), 1.82-1.92 м (2Н,
ленкова Н.Г., Стороженко П.А. // ЖОХ. 2021. Т. 91.
СН2СН2СН2). Масс-спектр, m/z (Iотн, %): 288 (0)
Вып. 1. С. 102. doi 10.31857/S0044460X21010108;
[M]+., 273 (25.1) [M - Me]+, 133 (33.9) [Cl3Si]+, 113
Lakhtin V.G., Efimenko D.A., Filippov A.M., Shulyatie-
(100) [MeCl2Si]+.
va T.I., Sokolskaya I.B., Semyashkina I.A., Komalenko-
1-(Диметилхлорсилил)-3-(трихлорсилил)-
va N.G., Storozhenko P.A. // Russ. J. Gen. Chem. 2021.
пропан (3в). Выход 61.0%, т. кип. 73-75°С (5 мм
Vol. 91. N 1. P. 77. doi 10.1134/S1070363221010084
рт. ст.), n20 1.4685. Спектр ЯМР 1H (CDCl3), δ, м. д.:
2. Жунь В.И., Цветков А.Л., Бочкарев В.Н., Слюса-
0.45 с (6Н, Me2Si), 0.97-1.03 м (2Н, СН2SiMe2Cl),
ренко Т.Ф., Туркельтауб, Г.Н., Шелудяков В.Д. //
ЖОХ. 1989. Т. 59. Вып. 2. С. 390; Zhun’, V.I., Tsvet-
1.50-1.55 м (2Н, СН2SiCl3), 1.74-1.80 м (2Н,
kov, A.L., Bochkarev, V.N., Slyusarenko T.F., Turkel’-
СН2СН2СН2). Масс-спектр, m/z (Iотн., %): 268 (0)
taub G.N., Sheludyakov V.D. // J. Gen. Chem. USSR.
[M]+., 253 (17.1) [M - Me]+, 233 (11.8) [M - Cl]+,
1989. Vol. 59. N 2. P. 344.
133 (16.1) [Cl3Si]+, 93 (100) [Me2ClSi]+.
3. Hosomi A., Kohra S., Tominaga Y., Inaba M.,
1-(Метилдихлорсилил)-3-(триметилсилил)-
Sakurai H. // Chem. Pharm. Bull. 1988. Vol. 36. N 7.
пропан
(4б). Выход
76.7%, т. кип.
63-64°С
P. 2342. doi 10.1248/cpb.36.2342
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
ВЗАИМОДЕЙСТВИЕ АЛЛИЛСИЛАНОВ С МЕТИЛХЛОРГИДРИДСИЛАНАМИ
753
4.
Suzuki M., Obayashi T., Saegusa T. // Chem. Commun.
16.
Meijboom R., Overett M.J., Moss J.R. // J. Organomet.
1993. N 8. P. 717. doi 10.1039/c39930000717
Chem. 2004. Vol. 689. P.987. doi 10.1016/j.
5.
Irran E., Klare H.F.T., Oestreich M., Koy A., Wang G.,
jorganchem.2003.11.034
Wu Q. // Angew. Chem. 2020. Bd 132. N 26. S. 10609.
17.
Groot D., Reek J.N.H., Kamer P.C.J., Leeu-
wen P.W.N.M. // Eur. J. Org. Chem. 2002. Vol. 6. P. 1085.
doi 10.1002/anie.202003799
doi 10.1002/1099-0690(200203)2002:6<1085::AID-
6.
Петров А.Д., Пономаренко В.А., Соколов Б.А.,
EJOC1085>3.0.CO;2-6
Одабашян Г.В. // Изв. АН СССР. 1957. Вып. 10.
18.
Meijboom R. // J. Organomet. Chem. 2010. Vol. 695.
С. 1206; Petrov A.D., Ponomarenko V.A., Sokolov B.A.,
N 19-20. P. 2277. doi 10.1016/j.jorganchem.2010.06.011
Odabashyan G.V. // Russ. Chem. Bull. 1957. Vol 6.
19.
Ryon J.A., Saurabh S.C., Douglas W.S. // Chem.
N 10. P. 1230. doi: 10.1007/BF01167392
Commun. 2019. Vol. 55. P. 5599. doi 10.1039/
7.
Leatherman M.D., Peng W., Policello G.A., Rajara-
c9cc02460c
man S.K., Wagner R., Xia Z. Pat. US 0269467 (2007).
20.
Azpeitia S., Garralda M.A., Huertos M.A. //
8.
Januszewski R., Grzelak M., Orwat B., Duthiewich M.,
ChemCatChem. 2017. Vol. 9. P. 1901. doi 10.1002/
Kownachi I. // J. Catalysis. 2020. Vol. 390. Р. 103. doi
cctc.201700222
10.1016/j.jcat.2020.07.015
21.
Prieto U., Azpeitia S., Sebastian E.S., Freixa Z.,
9.
Burkhard C.A., Krieble R.H. // J. Am. Chem. Soc. 1947.
Garraida M.A., Huertos M.A. // ChemCatChem. 2021.
Vol. 69. P. 2687. doi 10.1021/ja01203a039
Vol. 13. N 5. P. 1403. doi 10.1002/cctc.202001699
10.
Петров А.Д., Пономаренко В.А. // Докл. АН СССР.
22.
ZhouR., Goh Y.Y., Liu H., Tao H., Li L., Wu J. // Angew.
1953. Т. 90. № 3. С. 387.
Chem. Int. Ed. 2017. Vol. 56. P. 16621. doi 10.1002/
11.
Топчиев А.В., Наметкин Н.С., Чернышева Т.И., Дур-
anie.201711250
23.
Deleris G., Pillot J.P., Rayex J.G. // Tetrahedron.
гарьян С.Г. // Докл. АН СССР. 1956. Т. 110. № 1.
1980. Vol. 36. N 15. P. 2215. doi 10.1016/0040-
С. 97; Topchiev A.V., Nametkin N.S., Chernysheva T.I.,
4020(80)80114-1
Durgaryan S.G. // Doklady Chem. 1956. Vol. 106-111.
24.
Электронная библиотека масс-спектров, NIST 11.
P. 545.
NIST/EPA/NIH (NIST 11) Mass Spectral Data base.
12.
Schmdbaur H., Dorzbach C. // Z. Naturforsch. 1987.
2011.
Bd 42. N 9. S. 1088. doi 10.1515/znb-1987-0906
25.
Furuya N., Sukawa T. // J. Organomet. Chem. 1975.
13.
Dawes S.B., Matthews J.R. Pat. US 207937 (2008).
Vol. 96. N 1. P. C1. doi 10.1016/S0022-328X(00)86430-X
14.
Herrero M., Sevilla R., Casado C.M., Losada J.,
26.
Burchard C.A. // J. Am. Chem. Soc. 1950. Vol. 72. N 3.
Garcia-Armada P., Rodrigues-Diegues A., Briones D.,
P. 1078. doi 10.1021/ja01159a007
Alonso B. // Organometallics. 2013. Vol. 32. N 20.
27.
Наметкин Н.С., Королев В. К., Кузьмин О.В. // Докл.
P. 5826. doi 10.1021/om400387c
АН СССР. 1972. Т. 205. № 5. С. 1111.
15.
Meijboom R., Hutton A.T., Moss J.R. // Organometallics.
28.
Петров А.Д., Миронов В.Ф., Долгий И.Е. // Изв. АН
2003. Vol. 22. P. 1811. doi 10.1021/om020799i
СССР. Сер. хим. 1956. № 9. С. 1146.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022
754
ЛАХТИН и др.
Reaction of Allylsilanes with Methylchlorohydride Silanes
and Symmetrical Tetramethyldisiloxane
V. G. Lakhtin*, D. A. Efimenko, A. M. Filippov, I. B. Sokolskaya, A. K. Shestakova,
T. I. Shulyatieva, N. G. Komalenkova, and P. A. Storozhenko
State Research Institute of Chemistry and Technology of Organoelement Compounds, Moscow, 105118 Russia
*e-mail: vlachtin@rambler.ru
Received December 14, 2021; revised January 31, 2022; accepted February 2, 2022
The hydrosilylation reactions of allylsilanes R3SiAll (R = Cl3, Me3) with methylchlorohydridsilanes
MenCl3-nSIH (n = 0-2) and symmetrical tetramethyldisiloxane in the presence of a Karstedt catalyst were
studied. It was found that the change in reactivity for allylsilanes in these reactions has a similar character
as for allylgermanes, except for the reaction of allyltrichlorosilane with dimethylchlorosilane, which may be
explained by the lower electronegativity of the Cl3Si group compared to the Cl3Ge group. Allylsilanes showed
greater reactivity in these reactions than isostructured allylgermanes. A scheme of the possible course of the
studied reactions was proposed. The synthesized compounds were identified using 1H NMR spectroscopy and
chromatography-mass spectrometry.
Keywords: allylsilane, allylgermane, methylchlorohydridesilanes, hydrosilylation, adduct, Karstedt catalyst,
chromatography-mass spectrometry
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 5 2022