ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2022, том 92, № 8, с. 1200-1207
УДК 547-326;577.151.43
ХЕМОЭНЗИМНЫЙ СИНТЕЗ СЛОЖНЫХ ЭФИРОВ
ФЛАВОНОИДОВ
© 2022 г. С. В. Печинскийa,*, А. Г. Курегянa, Э. Т. Оганесянa
а Пятигорский медико-фармацевтический институт, филиал Волгоградского государственного медицинского
университета Министерства здравоохранения России, пр. Калинина 11, Пятигорск, 357532 Россия
*e-mail: hplc@yandex.ru
Поступило в редакцию 27 апреля 2022 г.
После доработки 29 мая 2022 г.
Принято к печати 2 июня 2022 г.
Разработан региоселективный синтез сложных эфиров природных агликонов флавоноидов - наринге-
нина, кверцетина и гесперетина в присутствии липазы Novozyme 435. В реакции этерификации исполь-
зовали бензойную, салициловую, никотиновую и коричную кислоты.
Ключевые слова: нарингенин, кверцетин, гесперетин, этерификация, сложные эфиры, фермент Новозим
435 (Novozyme 435)
DOI: 10.31857/S0044460X22080066, EDN: IOFQQO
Направленная химическая модификация струк-
применение флавоноидов в медицине и фарма-
туры природных соединений - один из наиболее
ции в виде лекарственных препаратов ограни-
эффективных способов усиления их фармаколо-
чено их малым количеством в исходном сырье и
гической активности и повышения биологиче-
экономическими затратами при получении инди-
ской доступности [1]. Так как модифицируемые
видуальных соединений в препаративных целях.
структуры, как правило, достаточно изучены и
Флавоноиды легко окисляются и из-за низкой ли-
не несут потенциальной опасности, у продуктов
пофильности имеют невысокую биодоступность.
модификации предполагается малая токсичность.
Между числом гидроксигрупп и липофильностью
Кардинальное изменение структуры природных
флавоноидов существует обратная корреляция [9].
соединений позволяет получить новые объекты
Один из путей увеличения липофильности - пере-
для фармакологических исследований с позиции
вод гидроксильных групп в сложноэфирные [10]
взаимосвязи структура-активность и расширить
методом традиционной этерификации или в при-
базу данных для теоретического изучения актив-
сутствии биокатализаторов [9, 11].
ности, токсичности и путей деструкции методами
К недостаткам традиционных химических
in silico.
схем синтеза сложных эфиров относятся приме-
Флавоноиды - группа природных биологиче-
нение токсичных органических растворителей,
ски активных полифенолов, которые встречаются
длительность реакций, необходимость нагревания
в виде гликозидов, агликонов и их метилпроиз-
и невысокий выход продукта этерификации. Все
водных. Изучены их антиоксидантная, ангиопро-
это приводит к низким экологическим и эконо-
текторная [2, 3], гепатопротекторная, антибакте-
мическим показателям [12]. Получение сложных
риальная, антимутагенная, противоопухолевая и
эфиров традиционными химическими методами
противовирусная активности [4-8]. Несмотря на
предполагает использование большого количе-
широкий спектр фармакологической активности,
ства органических растворителей, относящихся,
1200
ХЕМОЭНЗИМНЫЙ СИНТЕЗ СЛОЖНЫХ ЭФИРОВ ФЛАВОНОИДОВ
1201
как правило, к 2 классу токсичности. Например,
batatas [22]. С использованием иммобилизован-
пентаацетилкверцетин получают при кипячении в
ной липазы из Candida antarctica проведена эте-
среде пиридина с уксусным ангидридом в течение
рификация нарингина в касторовом масле, основ-
5-48 ч, этерификацию флавоноидов проводят в
ным компонентом которого является рицинолевая
среде пиридина, хлороформа, толуола или ацетона
кислота, а также чистой рицинолевой кислотой
при 100°C [13-16]. В таких условиях отсутствует
[21]. В присутствии липазы В Candida antarctica
региоселективность этерификации, сложный эфир
(Новозим 435) флавоноидные гликозиды, в част-
получается с выходом 10-60% с одновременным
ности, нарингин и изокверцитрин, ацилировали
образованием побочных моно-, ди- и полиэфи-
пальмитиновой,
3-фенилпропановой,
3-(2-гид-
ров. При использовании полученных эфиров в
роксифенил)пропановой,
3-(3,4-дигидроксифе-
производстве лекарственных средств требуется
нил)пропановой и транс-коричной кислотами,
их дополнительная очистка с обязательной иден-
выход продуктов ацилирования - от 25 до 95%
тификацией и проверкой на примесь каждого из
[23]. Ацилирование флавоноидов пальмитиновой
использованных растворителей.
кислотой значительно повышает их липофиль-
Учитывая возможность применения модифи-
ность. Этерификацию рутина лауриновой кисло-
цированных флавоноидов в фармации, мы прове-
той в присутствии иммобилизованной липазы из
ли их этерификацию с использованием биокатали-
Candida Antarctica (CAL-B) проводили в диапа-
заторов. В этом способе полностью исключаются
зоне температур от 20 до 55°С. В этих условиях
токсичные растворители и высокие температуры,
получается эфир рутина по положению 4‴-О рам-
существенно увеличивается выход сложных эфи-
нозного остатка, побочные продукты реакции от-
ров и обеспечивается регио- и стереоселектив-
сутствовали [25]. Давление в 200 мбар позволяет
ность реакции [1, 10]. Указанные факторы в от-
повысить выход продукта биокаталитического
дельности или в совокупности создают очевидные
одностадийного ацилирования рутина и наринги-
преимущества при выборе биокатализа для синте-
на пальмитиновой кислотой в присутствии иммо-
за новых органических молекул или модификации
билизованной липазы В из Candida antarctica до
известных соединений, в том числе флавоноидов.
85% по сравнению с выходом 32% при атмосфер-
В растениях биосинтез эфиров флавоноидов
ном давлении. Этерификация протекает регио-
специфично по первичной гидроксильной группе
катализируется ацилтрансферазами
[17], одна-
ко их использование в лабораторных условиях
углеводного остатка [26]. Этерификации рутина и
неудобно, поскольку необходимо введение в ре-
нарингина олеиновой, линолевой и линоленовой
акционную смесь стехиометрических количеств
кислотами в присутствии иммобилизованной ли-
соответствующего ацилкофермента А [18]. Более
пазы В из Candida antarctica (Novozym 4351) за
предпочтительно применение липаз в качестве
96 ч при 50°C приводит к сложным эфирам нарин-
катализаторов, так как в данном случае не требу-
гина и рутина с выходами 85 и 70% соответствен-
ется добавления кофермента. Липазы устойчивы
но [27]. Ферментативное ацилирование рутина и
в органических растворителях, а их иммобилизо-
нарингина протекает региоселективно: в конеч-
ванные формы могут сохранять свою активность
ных продуктах реакции идентифицированы толь-
в течение нескольких десятков циклов реакций
ко моноэфиры этих флавоноидов. Сложные эфиры
[19, 20].
нарингина и рутина с октановой, декановой и до-
декановой кислотами получены в присутствии ли-
Модификация флавоноидов в присутствии
пазы В из Candida antarctica (Novozyme 435) при
биокатализаторов в основном заключается в их
45°С [28]. В качестве растворителей использовали
этерификации по гидроксигруппам углеводного
воду и трет-бутиловый спирт с добавлением со-
фрагмента в гликозидах [21-26]. Например, этери-
лей (хлорида лития, хлорида магния, хлорида ко-
фикация изокверцитрина и хризантемина кофей-
бальта, нитрата калия и нитрата натрия).
ной и п-кумаровой кислотами приводит к эфирам
флавоноидов по положению 6′′-O в присутствии в
Описан способ синтеза сложного эфира агли-
качестве катализатора ферментативной реакцион-
кона кверцетина винилацетатом [29]. По предва-
ной системы из культивируемых клеток Ipomoea
рительному прогнозу in silico, конфигурация ак-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1202
ПЕЧИНСКИЙ и др.
программы PASS [31]. Прогноз позволил провести
выбор по антиоксидантному и мембранопротек-
торному действию, по активности в отношении
свободных радикалов, по антигиперхолестерине-
мическому эффекту, острой токсичности, доступ-
ности и по стоимости реактивов. Эфиры коричной
кислоты будут обладать более высокой антиокси-
дантной активностью по сравнению с исходными
флавоноидами; эфиры бензойной и салициловой
кислот теоретически имеют более сильное мем-
бранопротекторное действие и активность в от-
ношении свободных радикалов; введение нико-
тиновой кислоты должно приводить к появлению
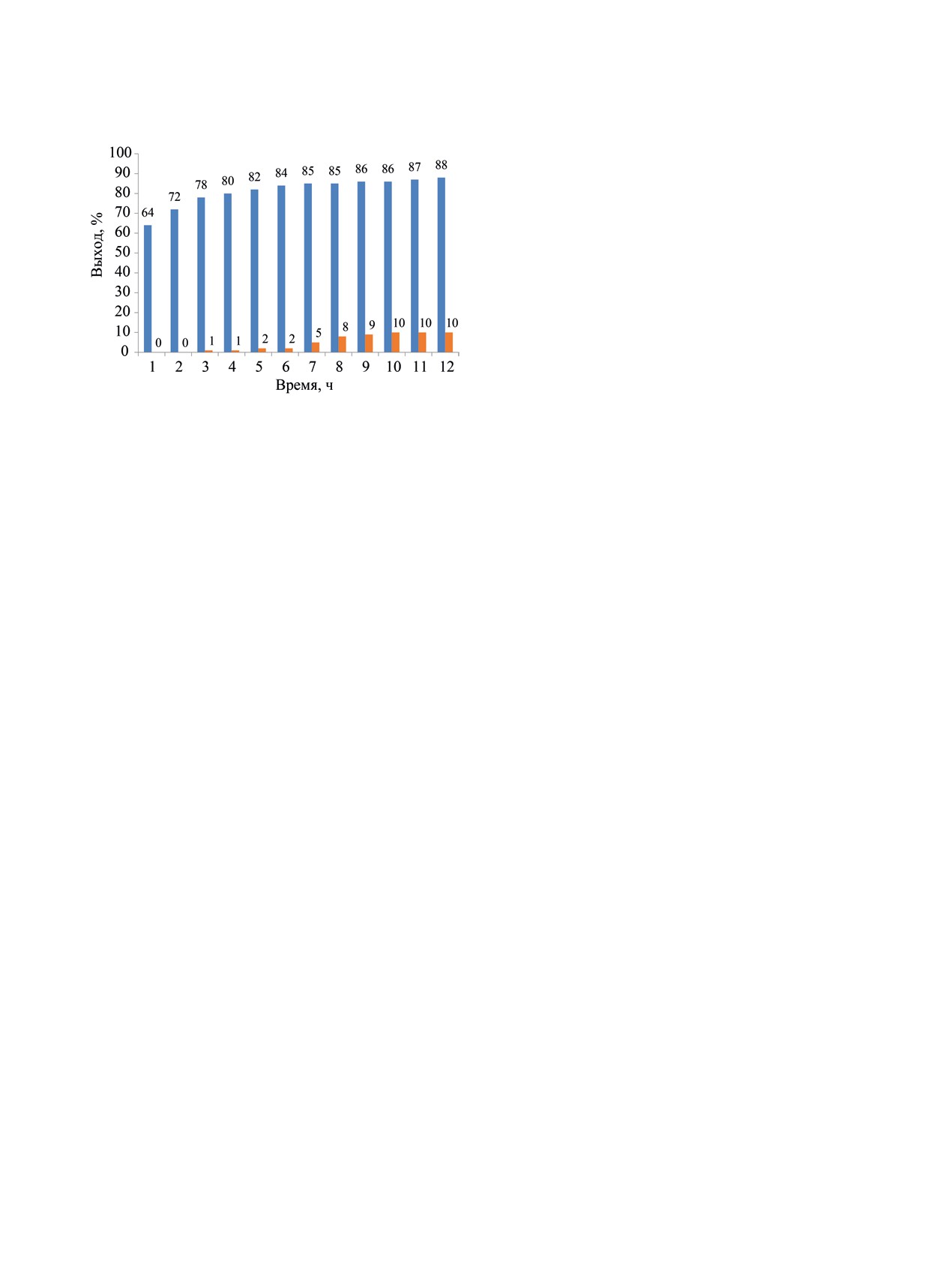
Рис. 1. Динамика образования главного (моноацили-
антигиперхолестеринемического эффекта, особен-
производного) и побочного (диацилпроизводного) про-
но у эфиров нарингенина и гесперетина. Острая
дуктов синтеза.
токсичность, установленная с помощью компью-
терного прогноза PASS, меньше или сопоставима
с токсичностью исходных флавоноидов. Сложные
тивного центра катализатора липазы B из Candida
эфиры флавоноидов перспективны для создания
antarctica должна обеспечить этерификацию по
новых лекарственных средств, но достоверным
3′-гидроксигруппе в фенильном заместителе. Од-
подтверждением их активности и низкой токсич-
нако по экспериментальным данным, кверцетин
ности могут быть только результаты дальнейших
ацилируется региоселективно сначала по положе-
фармакологических исследований.
нию 4′ с выходом 35%, а затем - по положению 3′.
С учетом опубликованных результатов [29, 30],
По нашему мнению, этерификация агликонов
для получения сложных эфиров использованы аг-
флавоноидов более целесообразна, поскольку имен-
ликоны флавоноидов - нарингенин, кверцетин,
но от них зависит фармакологическая активность,
гесперетин, в качестве ацилирующих реагентов -
а этерификация должна усилить липофильность
бензойная, салициловая, коричная и никотиновая
агликонов. Нарингенин проявляет антимикроб-
кислоты, в качестве катализатора - липаза B из
ные и антивирусные свойства, кверцетин
-
Candida antarctica. Изучено влияние различных
один из наиболее распространенных флавоноидов
факторов на выход побочных продуктов этерифи-
с хорошо изученными фармакологическими свой-
кации - диацилпроизводных: временного фактора
ствами, с высокой скоростью метаболизма, геспе-
(продолжительность реакции от 0 до 12 ч), моляр-
ретин проявляет выраженные ангиопротекторные
ного соотношения агликон-кислота (3:1, 2:1; 2:2;
и вазодилатирующие свойства [11, 17]. Даже не-
2:3), скорости перемешивания реакционной сме-
большие изменения в структуре флавоноидов при-
си (60, 120, 180 об/мин), температурного режима
водят к проявлению новых свойств [30].
(30, 40, 50, 60°С). Наибольшее влияние оказывает
Мы предполагаем, что полученные сложные
продолжительность реакции (рис. 1), в меньшей
эфиры могут проявлять свойства исходного фла-
степени - избыток кислоты, а также скорость пе-
воноида и ацилирующего компонента, однако воз-
ремешивания и температура.
можен и эффект усиления их фармакологических
Из представленных данных следует, что диа-
свойств. В качестве ацилирующих реагентов нами
цилпроизводные появляются только через 3 ч, их
выбраны бензойная, салициловая, коричная и ни-
концентрация постепенно возрастает до 10% с уве-
котиновая кислоты. Поскольку все выбранные ис-
личением длительности реакции до 10 ч и остает-
ходные соединения мало токсичны, прогнозирова-
ся уровне 10% в течение последующих двух часов.
лась низкая токсичность их сложных эфиров.
Выход моноэфира возрастает в течение первых
Нами проведены расчеты фармакологической
6 ч синтеза. Максимальный выход 84% зафиксиро-
активности и токсичности in silico с помощью
ван через 6 ч. В течение последующих 6 ч выход
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ХЕМОЭНЗИМНЫЙ СИНТЕЗ СЛОЖНЫХ ЭФИРОВ ФЛАВОНОИДОВ
1203
Схема 1.
OH
O
HO
O
бензойная кислота,
Novozyme 435
HO
O
O
-H2O
OH O
нарингенин
OH O
1
OH
коричная кислота,
O
HO
O
OH
Novozyme 435
−H2O
HO
O
O
OH
OH
OH O
OH
кверцетин
OH O
7
O
O
CH
3
CH3
HO
O
HO
O
OH
O
никотиновая кислота,
Novozyme 435
O
-H2O
OH O
OH O
N
9
гесперетин
моноэфира увеличивается незначительно от 85 до
ные эфиры по положению 3′ (на схеме 1 - эфир 9 с
88%. Таким образом, оптимальное время реакции
никотиновой кислотой).
6 ч, так как за это время образуется максимальное
Строение синтезированных соединений под-
количество моноэфира с минимальной примесью
тверждено методами ЯМР 1Н и масс-спектроме-
продукта диацилирования.
трии. Отсутствие сигнала при 9.58 м. д. для на-
Чистоту исходных соединений и продуктов ре-
рингенина, 9.65 м. д. для кверцетина и 9.14 м. д.
акции контролировали методом ВЭЖХ. Первую
для гесперетина указывает на образование слож-
пробу отбирали после добавления всех реактивов,
ноэфирной связи в положениях 4′ нарингенина и
кроме фермента. Затем добавляли Novozyme 435 и
кверцетина и 3′ - в гесперетине.
последующие пробы отбирали через каждый час.
Таким образом, проведен региоселективный
Реакции нарингенина с бензойной кислотой и
синтез сложных эфиров нарингенина и кверцетина
кверцетина с коричной кислотой протекают регио-
по положению 4′, а гесперетина - по положению 3′
селективно по положению 4′ цикла В с образовани-
при взаимодействии с четырьмя ароматическими
ем сложных эфиров 1 и 7 (схема 1). Гесперетин со
кислотами в присутствии биокатализатора. Пред-
всеми кислотами региоселективно образует слож-
ставляется перспективным дальнейшее исследо-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1204
ПЕЧИНСКИЙ и др.
вание фармакологических свойств полученных
ной (0.366 г), салициловой (0.414 г), коричной
сложных эфиров.
(0.444 г) или никотиновой (0.369 г) кислоты и 0.5 г
Novozyme 435. Реакционную смесь перемешивали
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
6 ч при 50°С со скоростью 120 об/мин, изменяя на-
правление перемешивания через каждые 15 мин.
В эксперименте использованы флавоноиды:
После окончания реакции иммобилизованный
нарингенин (Sigma-Aldrich, кат. № 5893), квер-
фермент отфильтровывали. Полученный раствор
цетин (Sigma-Aldrich, кат. № Q4951), гесперетин
очищали от избытка непрореагировавших кис-
(Biosynth Carbosynth, кат. № FH23766), ароматиче-
лот и диацилпроизводных методом твердофазной
ские кислоты: бензойная кислота (Sigma-Aldrich,
экстракции на картридже Agilent Bond Elut C18,
кат. № 242381), салициловая кислота (Sigma-
500 мг/6 мл, элюент - смесь 0.1%-ного раствора
Aldrich, кат. № 247588), никотиновая кислота
уксусной кислоты и ацетонитрила (8:2), скорость
(Sigma-Aldrich, кат. № N4126), коричная кисло-
потока - 1 мл/мин. Чистоту собираемой фракции
та (Sigma-Aldrich, кат. № 8.00235), катализатор
(первые 6 мл после введения пробы) контроли-
Novozyme 435 (Sigma-Aldrich, кат. № L4777).
ровали методом ВЭЖХ. Полученную фракцию с
Спектры ЯМР 1Н регистрировали на спек-
эфиром нарингенина, кверцетина или гесперетина,
трометре Bruker AMXIII-400 при 400 МГц в
сушили 2 ч при (50 мм рт. ст., 60°С). Полученное
ДМСО-d6, внутренний стандарт - ТМС. Масс-спек-
вещество запаивали в ампулы из темного стекла.
тры получали на масс-спектрометре Agilent 6420,
Нарингенин-4′-бензоат
[4-(5,7-дигидрокси-
сопряженном с ВЭЖХ-системой Agilent HPLC
4-оксохроман-2-ил)фенилбензоат,
1].
Выход
1260, методом химической ионизации при атмос-
0.655 г (87%), т. пл. 229-232°С. Спектр ЯМР 1Н, δ,
ферном давлении (APCI), температура ионного
м. д. (J, Гц): 2.69 д. д (1H, H3a, J 2.9, 17.0), 3.25 д. д
источника 120°C, газ-носитель - гелий, энер-
(1H, H3e, J 12.9, 17.1), 5.44 д. д (1H, H2, J 3.0, 12.7),
гия CID - 40 эВ. Параметры ВЭЖХ: колонка
5.92 м (2H, H6,8), 6.88 д (2H, H3′,5′, J 8.8), 7.33 д (2H,
Phenomenex Luna C18 (250×4.6 мм × 5 мкм), тем-
H2′,6′, J 8.4), 7.45 д (2Н, Н3′′,5′′, J 8.5), 7.58 т (1Н, Н4′′,
пература колонки 30°С, УФ детектор 270 нм; под-
J 7.3), 8.07 д (2Н, Н2′′, 6′′, J 2.0), 10.78 с (1H, С7-OH),
вижные фазы: тетрагидрофуран-раствор дигидро-
12.15 с (1H, С5-OH). Масс-спектр, m/z: 377.09 [M +
фосфата натрия, 15.6 г/л, доведенный фосфорной
Н]+ (вычислено для С22Н17О6+: 377.10).
кислотой до рН 3.0 (фаза А), 5:95, и тетрагидро-
фуран-раствор дигидрофосфата натрия, 15.6 г/л,
Нарингенин-4′-салицилат
[4-(5,7-дигидрок-
доведенный фосфорной кислотой до рН 3.0 (фаза
си-4-оксохроман-2-ил)фенил-2-гидроксибен-
Б), 40:60; линейный градиент: 0-15 мин, фазы
зоат, 2]. Выход 0.670 г (86%), т. пл. 251-253°С.
А 50 + Б 50% → А 0 + Б 100%; 15-30 мин, фазы
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 2.69 д. д (1H, H3a,
А 0 + Б 100% → А 50 + Б 50%; объем пробы
J 2.9, 17.0), 3.25 д. д (1H, H3e, J 12.9, 17.1), 5.44 д.
20 мкл, скорость подвижной фазы 1.0 мл/мин;
д (1H, H2, J 3.0, 12.7), 5.92 м (2H, H6,8), 6.88 д (2H,
объем пробы, автоматически вводимой в масс-де-
H3′,5′, J 8.8), 6.91 т (1Н, Н5′′, J 7.4), 6.97 д (1Н, Н3′′, J
тектор, 20 мкл. Время удерживания и порядок вы-
7.5), 7.33 д (2H, H2′,6′, J 8.4), 7.53 т (1Н, Н4′′, J 7.3),
хода пиков на хроматограмме на примере синтеза
7.82 д (1Н, Н6′′, J 7.7), 10.78 с (1H, С7-OH), 11.53 с
нарингенин-4′-бензоата: 7.32 мин - нарингенин
(1H, С2′′-OH), 12.15 с (1H, OH5). Масс-спектр, m/z:
4′-бензоат, 17.08 мин - нарингенин, 26.57 мин -
393.08 [M + Н]+ (вычислено для С22Н17О7+: 393.09).
бензойная кислота. Аналогичный порядок наблю-
Нарингенин-4′-циннамат [4-(5,7-дигидрок-
дался при хроматографировании других эфиров.
си-4-оксохроман-2-ил)фенил-(2E)-3-(4-гидрок-
Температуры плавления определены на приборе
сифенил)проп-2-еноат, 3]. Выход 0.685 г (85%),
ПТП (М).
т. пл. 234-237°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
Общая методика синтеза эфиров флавоно-
2.69 д. д (1H, H H3a, J 2.9, 17.0), 3.25 д. д (1H, H3e,
идов. К раствору 2 ммоль нарингенина (0.544 г),
J 12.9, 17.1), 5.44 д. д (1H, H2, J 3.0, 12.7), 5.92 м
кверцетина (0.604 г) или гесперетина (0.604 г) в
(2H, H6,8), 6.45 д (1H, H2′′′, J 15.9), 6.88 д (2H, H3′,5′,
50 мл ацетона прибавляли
3 ммоль бензой-
J 8.8), 7.33 д (2H, H2′,6′, J 8.4), 7.40 т (2Н, Н3′′,5′′, J
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ХЕМОЭНЗИМНЫЙ СИНТЕЗ СЛОЖНЫХ ЭФИРОВ ФЛАВОНОИДОВ
1205
7.9), 7.45 д (1Н, Н4′′, J 7.3), 7.55 д (2H, H2′′,6′′, J 16.0),
2.0), 9.35 с (1H, С3′-OH), 9.55 с (1H, С3-OH), 10.76
7.81 д (1H, H3′′′, J 15.9), 10.78 с (1H, С7-OH), 12.15
с (1H, С7-OH), 12.48 с (1H, С5-OH). Масс-спектр,
с (1H, С5-OH). Масс-спектр, m/z: 403.09 [M + Н]+
m/z: 433.07 [M + Н]+ (вычислено для С24Н17О8+:
(вычислено для С24Н19О6+: 403.11).
433.09).
Нарингенин-4′-никотиноат [4-(5,7-дигидрок-
Кверцетин-4′-никотиноат
[2-гидрокси-4-
си-4-оксохроман-2-ил)фенилпиридин-3-кар-
(3,5,7-тригидрокси-4-оксо-4Н-хромен-2-ил)фе-
боксилат, 4]. Выход 0.664 г (88%), т. пл. 245-
нилпиридин-3-карбоксилат, 8]. Выход 0.685 г
247°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 2.69 д. д
(84%), т. пл. 308-310°С. Спектр ЯМР 1Н, δ, м. д.
(1H, H3a, J 2.9, 17.0), 3.25 д. д (1H, H3e, J 12.9, 17.1),
(J, Гц): 6.19 д (1H, H6, J 2.0), 6.41 д (1H, H8, J 2.0),
5.44 д. д (1H, H2, J 3.0, 12.7), 5.92 м (2H, H6,8), 6.88
6.88 д (1H, H5′, J 8.4), 7.54 д. д (1H, H6′, J 2.2, J 8.4),
д (2H, H3′,5′, J 8.8), 7.33 д (2H, H2′,6′, J 8.4), 7.57 т
7.57 т (1Н, Н5′′, J 8.0), 7.67 д (1H, H2′, J 2.0), 8.31 д
(1Н, Н5′′, J 8.0), 8.31 д (1Н, Н4′′, J 7.9), 8.81 д (1Н,
(1Н, Н4′′, J 7.9), 8.81 д (1Н, Н6′′, J 5.0), 9.11 с (1Н,
Н6′′, J 5.0), 9.11 с (1Н, Н2′′), 10.78 с (1H, С7-OH),
Н2′′), 9.35 с (1H, С3′-OH), 9.55 с (1H, С3-OH), 10.76
12.15 с (1H, С5-OH). Масс-спектр, m/z: 378.07 [M +
с (1H, С7-OH), 12.48 с (1H, С5-OH). Масс-спектр,
Н]+ (вычислено для С21Н16NО6+: 378.09).
m/z: 408.07 [M + Н]+ (вычислено для С21Н14NО8+:
408.06).
Кверцетин-4′-бензоат
[2-гидрокси-4-(3,5,7-
тригидрокси-4-оксо-4Н-хромен-2-ил)фенилбен-
Гесперетин-3′-бензоат
[5-(5,7-дигидрокси-
зоат, 5]. Выход 0.715 г (88%), т. пл. 289-292°С.
4-оксохроман-2-ил)-2-метоксифенилбензоат, 9].
Спектр ЯМР 1Н, δ, м. д. (J, Гц): 6.19 д (1H, H6, J
Выход 0.655 г (87%), т. пл. 229-232°С. Спектр ЯМР
2.0), 6.41 д (1H, H8, J 2.0), 6.88 д (1H, H5′, J 8.4),
1Н, δ, м. д. (J, Гц): 2.69 д. д (1H, H3a, J 3.0, 17.0),
7.45 д (2Н, Н3′′,5′′, J 8.5), 7.54 д. д (1H, H6′, J 2.2, J
3.24 д. д (1H, H3е, J 12.9, 17.2), 3.78 с (3H, OCH3),
8.4), 7.58 т (1Н, Н4′′, J 7.3), 7.67 д (1H, H2′, J 2.0),
5.42 д. д (1H, H2, J 3.0, 12.7), 5.88 м (2H, H6,8), 6.96
8.07 д (2Н, Н2′′, 6′′, J 2.0), 9.35 с (1H, OH3′), 9.55 с
д (1H, H5′, J 8.5), 7.02 д. д (1H, H6′, J 8.3), 7.11 д (1H,
(1H, OH3), 10.76 с (1H, С7-OH), 12.48 с (1H, С5-
H2′, J 2.5), 7.45 д (2Н, Н3′′,5′′, J 8.5), 7.58 т (1Н, Н4′′, J
OH). Масс-спектр, m/z: 407.04 [M + Н]+ (вычисле-
7.3), 8.05 д (2Н, Н2′′, 6′′, J 2.0), 10.71 с (1H, С7-OH),
но для С22Н15О8+: 407.07).
12.12 с (1H, С5-OH). Масс-спектр, m/z: 407.10 [M +
Н]+ (вычислено для С23Н19О7+: 407.11).
Кверцетин-4′-салицилат
[2-гидрокси-4-
(3,5,7-тригидрокси-4-оксо-4Н-хромен-2-ил)фе-
Гесперетин-3′-никотиноат [5-(5,7-дигидрок-
нил-2-гидроксибензоат, 6]. Выход 0.717 г (85%),
си-4-оксохроман-2-ил)-2-метоксифенилпири-
т. пл. 322-324°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц):
дин-3-карбоксилат, 10]. Выход 0.694 г (85%), т.
6.19 д (1H, H6, J 2.0), 6.41 д (1H, H8, J 2.0), 6.88 д
пл. 244-246°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 2.69
(1H, H5′, J 8.4), 6.91 т (1Н, Н5′′, J 7.4), 6.97 д (1Н,
д. д (1H, H3a, J 3.0, 17.0), 3.24 д. д (1H, H3е, J 12.9,
Н3′′, J 7.5), 7.54 д. д (1H, H6′, J 2.2, J 8.4), 7.58 т
17.2), 3.78 с (3H, OCH3), 5.42 д. д (1H, H2, J 3.0,
(1Н, Н4′′, J 7.3), 7.67 д (1H, H2′, J 2.0), 8.01 д (1Н,
12.7), 5.88 м (2H, H6,8), 6.96 д (1H, H5′, J 8.5), 7.02
Н6′′, J 7.7), 9.35 с (1H, С3′-OH), 9.55 с (1H, С3-OH),
д. д (1H, H6′, J 8.3), 7.11 д (1H, H2′, J 2.5), 7.57 т (1Н,
10.76 с (1H, С7-OH), 11.53 с (1H, С2′′-OH), 12.48
Н5′′, J 8.0), 8.31 д (1Н, Н4′′, J 7.9), 8.81 д (1Н, Н6′′,
с (1H, С5-OH). Масс-спектр, m/z: 423.06 [M + Н]+
J 5.0), 9.11 с (1Н, Н2′′), 10.71 с (1H, С7-OH), 12.12
(вычислено для С22Н15О9+: 423.06).
с (1H, С5-OH). Масс-спектр, m/z: 408.08 [M + Н]+
(вычислено для С22Н18NО7+: 408.10).
Кверцетин-4′-циннамат
[2-гидрокси-4-
(3,5,7-тригидрокси-4-оксо-4Н-хромен-2-ил)-
Гесперетин-3′-салицилат [5-(5,7-дигидрокси-
фенил-(2E)-3-(4-гидроксифенил)проп-2-еноат,
4-оксохроман-2-ил)-2-метоксифенил-2-гидрок-
7]. Выход 0.760 г (88%), т. пл. 297-299°С. Спектр
сибензоат, 11]. Выход 0.701 г (83%), т. пл. 251-
ЯМР 1Н, δ, м. д. (J, Гц): 6.19 д (1H, H6, J 2.0), 6.41
253°С. Спектр ЯМР 1Н, δ, м. д. (J, Гц): 2.69 д. д
д (1H, H8, J 2.0), 6.45 д (1H, H2′′′, J 15.9), 6.88 д (1H,
(1H, H3а, J 3.0, 17.0), 3.24 д. д (1H, H3е, J 12.9, 17.2),
H5′, J 8.4), 7.45 д (2Н, Н3′′,5′′, J 8.5), 7.54 д. д (1H, H6′,
3.78 с (3H, OCH3), 5.42 д. д (1H, H2, J 3.0, 12.7),
J 2.2, J 8.4), 7.58 т (1Н, Н4′′, J 7.3), 7.67 д (1H, H2′,
5.88 м (2H, H6,8), 6.96 д (1H, H5′, J 8.5), 7.02 д. д
J 2.0), 7.81 д (1H, H3′′′, J 15.9), 8.07 д (2Н, Н2′′, 6′′, J
(1H, H6′, J 8.3), 7.11 д (1H, H2′, J 2.5), 7.45 д (2Н,
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
1206
ПЕЧИНСКИЙ и др.
Н3′′,5′′, J 8.5), 7.58 т (1Н, Н4′′, J 7.3), 7.79 д (1Н, Н6′′,
8.
Zou M., Liu H., Li J., Yao X., Chen Y., Ke C., Liu S. //
J 7.7), 10.71 с (1H, С7-OH), 11.53 с (1H, С2′′-OH),
Biochem. Pharmacol. 2020. Vol. 177. P. 113962. doi
10.1016/j.bcp.2020.113962
12.12 с (1H, С5-OH). Масс-спектр, m/z: 423.07 [M +
9.
van Dijk1 C., Driessen A.J., Recourt K. // Biochem.
Н]+ (вычислено для С23Н19О8+: 423.10).
Pharmacol. 2000. Vol. 60. N 11. P.1593. doi 10.1016/
Гесперетин-3′-циннамат [5-(5,7-дигидрокси-
S0006-2952(00)00488-3
4-оксохроман-2-ил)-2-метоксифенил-(2E)-
10.
Viskupicova J., Ondrejovic M., Maliar T. // Biochem.
3-(4-гидроксифенил)проп-2-еноат,
12]. Выход
2011. doi 10.5772/34174
0.727 г (84%), т. пл. 231-233°С. Спектр ЯМР 1Н, δ,
11.
Flavonoids: Chemistry, Biochemistry and Applications /
м. д. (J, Гц): 2.69 д. д (1H, H3а, J 3.0, 17.0), 3.24 д.
Eds Ø.M. Andersen, K.R. Markham. Boca Raton: Taylor
& Francis Group, LLC, 2006. 1212 р.
д (1H, H3е, J 12.9, 17.2), 3.78 с (3H, OCH3), 5.42 д.
12.
Anastas P.T., Williamson T.C. // ACS Symp. Ser. 1996.
д (1H, H2, J 3.0, 12.7), 5.88 м (2H, H6,8), 6.45 д (1H,
Vol. 626. Р. 1. doi 10.1021/bk-1996-0626.ch001
H2′′′, J 15.9), 6.96 д (1H, H5′, J 8.5), 7.02 д. д (1H,
13.
Biasutto L., Marotta E., De Marchi U., Zoratti M.,
H6′, J 8.3), 7.11 д (1H, H2′, J 2.5), 7.45 д (2Н, Н3′′,5′′, J
Paradisi C. // J. Med. Chem. 2007. Vol. 50. P. 241. doi
8.5), 7.58 т (1Н, Н4′′, J 7.3), 7.81 д (1H, H3′′′, J 15.9),
10.1021/jm060912x
8.07 д (2Н, Н2′′, 6′′, J 2.0), 10.71 с (1H, С7-OH), 12.12
14.
Pat. US 6235294 B1 (2001).
с (1H, С5-OH). Масс-спектр, m/z: 433.11 [M + Н]+
15.
Mohajeri M., Saghaei L., Ghanadian M., Saberi S.,
(вычислено для С25Н21О7+: 433.12).
Pestechian N., Ostadhusseini E. // Adv. Biomed. Res.
2018. Vol. 7. N 64. P. 1. doi 10.4103/abr.abr_76_17
ИНФОРМАЦИЯ ОБ АВТОРАХ
16.
Государственная фармакопея Российской Федера-
17.
Grotewold E. The Science of Flavonoids. Ohio: The
org/0000-0002-0698-8254
Ohio State University Columbus, 2006. 273 р.
18.
Di Carlo G., Mascolo N., Izzo A.A., Capasso F. // Life
КОНФЛИКТ ИНТЕРЕСОВ
Sci. 1999. Vol. 65. N 4. P. 337. doi 10.1016/S0024-
3205(99)00120-4
Авторы заявляют об отсутствии конфликта ин-
19.
Chebil L., Humeau C., Falcimaigne A., Engasser J.,
тересов.
Ghoul M. // Proc. Biochem. 2006. Vol. 41. P. 2237. doi
СПИСОК ЛИТЕРАТУРЫ
10.1021/jf071943j
20.
Jaeger K., Eggert T. // Curr. Opin. Biotechnol. 2002.
1. Milivojevi A., Coroviс M., Carevic M., Banjanac K.,
Vol. 13. P. 390. doi 10.1016/S0958-1669(02)00341-5
Blagojevic S., Pjanovic R., Bezbradica D. // Ind. Eng.
21.
Almeida V.M., Branco C.R.C., Assis S.A., Vieira I.J.C.,
Chem. Res. 2019. Vol. 58. N 9. P. 3640. doi 10.1021/
Braz-Filho R., Branco A. // Chem. Central J. 2012.
acs.iecr.8b06113
Vol. 6. N 41. P. 2. doi 10.1186/1752-153X-6-41
2. Jovanovic S.V., Steeden S., Tosic M., Marjanovic B.,
22.
Nakajima N., Ishihara K., Hamada H., Kawabe S.-I.,
Simic M.G.// J. Am. Chem. Soc. 1994. Vol. 116. P. 4846.
Furuya T. // J. Biosci. Bioeng. 2000. Vol. 90. N 3.
doi 10.1021/ja00090a032
P. 347. doi 10.1016/s1389-1723(00)80095-x
3. Белая Н.И., Белый А.В., Щербаков И.Н. // Ки-
23.
Stevenson D.E., Wibisono R., Jensen D.J., Stanley R.A.,
нетика и катализ. 2020. Т. 61. № 3. С. 334. doi
Cooney J.M. // Enzyme Microbial Technol. 2006. N 39.
10.31857/S0453881120030053; Belaya N.I., Belyi
Р. 1236. doi 10.1016/j.enzmictec.2006.03.006
A.V., Shcherbakov I.N. // Kinetics and catalysis. 2020.
24.
Wu J.-Y., Wang T.-Y., Ding H.-Y., Zhang Y.-R., Lin S.-Y.,
Vol. 61. N 3. P. 360. doi 10.1134/S0023158420030040
Chang T.-S. // Molecules. 2021. N 26. P. 6274. doi
4. Kumar S. Pandey A.K. // Sci. World J. 2013. 162750.
10.3390/molecules26206274
doi 10.1155/2013/162750
25.
Razak N.N.A., Annuar M.S.M. // Indust. Eng. Chem.
5. Jo S., Kim S., Kim D.-Y., Kim M.-S., Shin D.-H. // J.
Res. 2015. Vol. 54. N 21. P. 5604. doi 10.1021/acs.
Enzyme Inhib. Med. Chem. 2020. Vol. 35. N 1. Р. 1539.
iecr.5b00996
doi 10.1080/14756366.2020.1801672
26.
Passicos E., Santarelli X., Coulon D. // Biotechnol.
6. Байсаров Г.М., Жуматаева А.Р., Мукушева Г.К.,
Lett. 2004. N 26. P. 1073. doi 10.1023/B:BI
Шульц Э.Э., Сейдахметова Р.Б., Адекенов С.М. //
LE.0000032967.23282.15
Хим. раст. сырья. 2018. № 3. С. 215. doi 10.14258/
27.
Mellou F., Loutrari H., Stamatis H., Roussos C.,
jcprm.2018033766
Kolisis F.N. // Proc. Biochem. 2006. Vol. 41. Р. 2029.
7. Pat. US 10765660 B2 (2017).
doi 10.1016/j.procbio.2006.05.002
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022
ХЕМОЭНЗИМНЫЙ СИНТЕЗ СЛОЖНЫХ ЭФИРОВ ФЛАВОНОИДОВ
1207
28. Kontogianni A., Skouridou V., Sereti V., Stamatis H.,
30. Kyriakou E., Primikyri A., Charisiadis P., Katsoura M.,
Kolisis F.N. // Eur. J. Lipid Sci. Technol. 2001. N 103.
Gerothanassis I.P., Stamatis H., Tzakos A.G. // Org.
P. 655. doi 10.1002/1438-9312(200110)103:10<655::
Biomol. Chem. 2012. N 10. P. 1739. doi 10.1039/
AID-EJLT655>3.0.CO;2-X
c2ob06784f
29. de Araújo M.E.M.B., Franco Y.E.M., Messias M.C.F.,
Longato G.B., Pamphile J.A., de Carvalho P.O. // Planta
Med. 2017. N 83. P. 7. doi 10.1055/s-0042-118883
index.php
Chemoenzyme Synthesis of Flavonoid Esters
S. V. Pechinskiiа,*, A. G. Kuregyanа, and E.T. Oganesyanа
аMedical Pharmaceutical Institute of Pyatigorsk Branch of Volgograd Medical State University, Pyatigorsk, 357532 Russia
*e-mail: hplc@yandex.ru
Received April 27, 2022; revised May 29, 2022; accepted June 2, 2022
A method for the synthesis of esters of natural flavonoids - naringenin, quercetin and hesperetin - in the pres-
ence of regioselective Novozyme 435 lipase was developed. Benzoic, salicylic, nicotinic and cinnamic acids
were used as acids participating in the esterification reaction. 12 new esters of naringenin, quercetin, hesperetin
were obtained.
Keywords: naringenin, quercetin, hesperetin, esterification, esters, Novozyme 435
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 92 № 8 2022