ЖУРНАЛ ОБЩЕЙ ХИМИИ, 2023, том 93, № 2, с. 188-199
УДК 547.724
ДЕЦИКЛИЗАЦИЯ ЗАМЕЩЕННЫХ
2-[2-ОКСОФУРАН-3(2Н)-ИЛИДЕН]ФУРАН-
2-КАРБОГИДРАЗИДОВ ПОД ДЕЙСТВИЕМ
СПИРТОВ И АНАЛЬГЕТИЧЕСКАЯ АКТИВНОСТЬ
ПОЛУЧЕННЫХ СОЕДИНЕНИЙ
© 2023 г. С. Н. Игидов1,2, А. Ю. Турышев1, Р. Р. Махмудов3, Д. А. Шипиловских4,
М. В. Дмитриев3, О. В. Зверева 1, П. С. Силайчев3, Н. М. Игидов1, С. А. Шипиловских3,5,*
1 Пермская государственная фармацевтическая академия Министерства здравоохранения России,
Пермь, 614990 Россия
2 ООО «Мерк», Москва, 115054 Россия
3 Пермский государственный национальный исследовательский университет, Пермь, 614990 Россия
4 Пермский национальный исследовательский политехнический университет, Пермь, 614990 Россия
5 Университет ИТМО, Санкт-Петербург, Кронверкский пр. 49, 197101 Россия
*e-mail: s.shipilovskikh@metalab.ifmo.ru
Поступило в редакцию 2 ноября 2022 г.
После доработки 9 декабря 2022 г.
Принято к печати 14 декабря 2022 г.
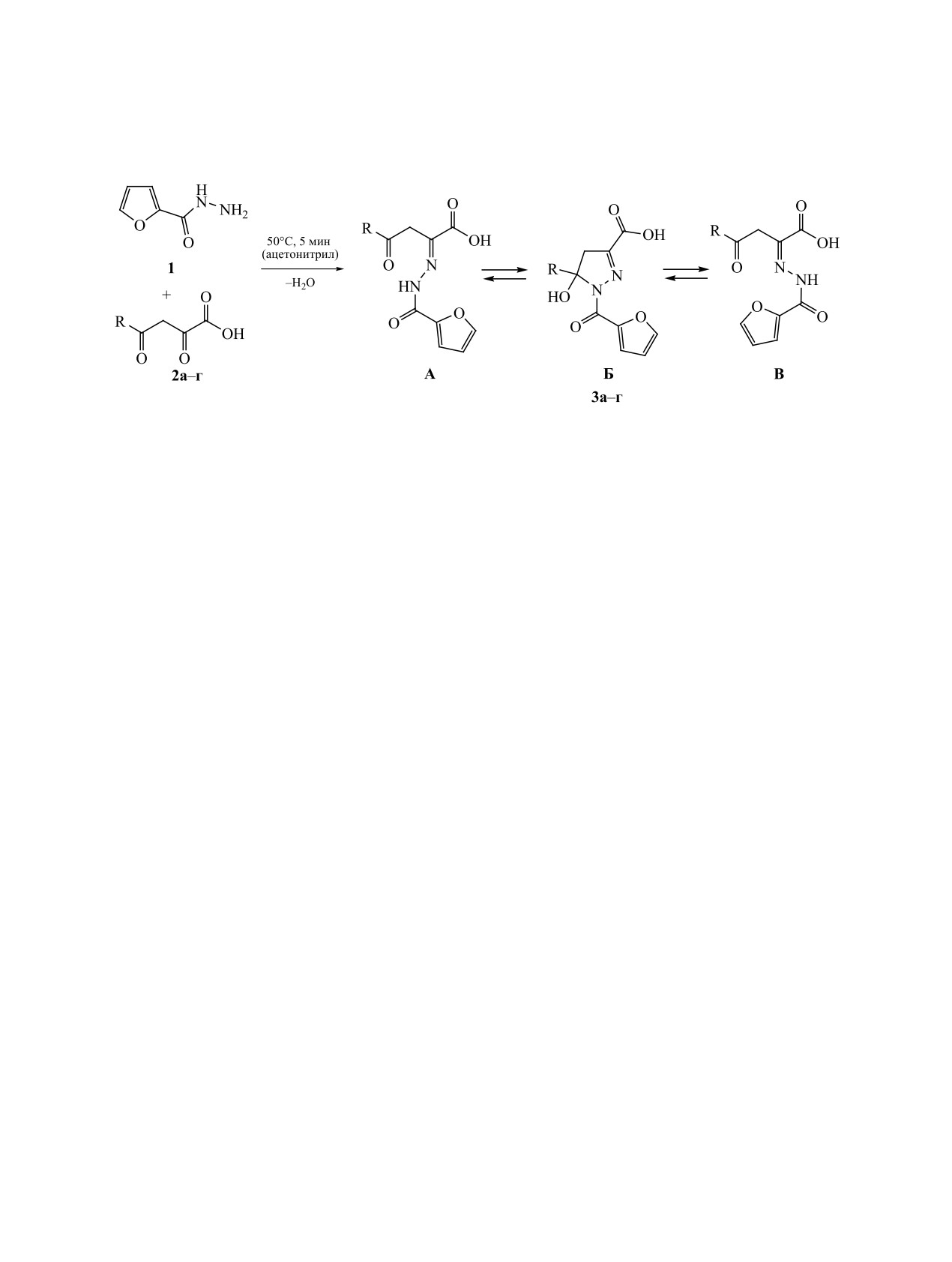
Синтезированы новые представители замещенных 4-оксо-2-[2-(фуран-2-илкарбонил)гидразинилиден]-
бутановых кислот и 2-[2-оксофуран-3(2Н)-илиден]фуран-2-карбогидразидов. Разработана методоло-
гия их дециклизации под действием первичных и вторичных спиртов с образованием замещенных
алкил-4-оксо-2-[2-(фуран-2-илкарбонил)гидразинилиден]бутаноатов, которые существуют в виде трех
изомерных форм. Среди синтезированных соединений обнаружены вещества, обладающие выраженной
анальгетической активностью.
Ключевые слова: 2,4-диоксобутановые кислоты, 3-имино(гидразоно)-3Н-фуран-2-оны, OH-нуклеофилы,
алкил-2-гидразинилиден-4-оксобутаноаты, анальгетическая активность
DOI: 10.31857/S0044460X2302004X, EDN: QAFEXF
Разработка и создание новых лекарственных
выражении по данным, опубликованным марке-
форм с низкой токсичностью являются важными
тинговым агентством DSM Group [9]. Динамично
задачами фармацевтической и медицинской химии
развивающийся рынок анальгетиков создает высо-
[1-7]. Направления науки, связанные с разработ-
кую востребованность в разработке новых аналь-
кой новых биологически активных субстанций,
гетических препаратов и поиске универсальных
входят в список наиболее быстро развивающихся
базовых структур, пригодных для создания на их
областей рационального применения лекарствен-
основе новых биологически активных соедине-
ных препаратов [8]. Среди биологически активных
ний. Такими структурами могут стать замещен-
соединений анальгетики являются одними из наи-
ные 3-имино(гидразоно)-3H-фуран-2-оны, что об-
более востребованных и занимают около 9% фар-
условлено их доступностью, масштабируемостью
мацевтического рынка России в количественном
метода их синтеза [10, 11] и высокой реакционной
188
ДЕЦИКЛИЗАЦИЯ ЗАМЕЩЕННЫХ 2-[2-ОКСОФУР
АН-3(2Н)-ИЛИДЕН]ФУРАН-...
189
Схема 1.
R = t-Bu (a), Ph (б), 4-Me C6H4 (в), 4-MeOC6H4 (г).
способностью этого класса соединений [12-16].
Замещенные
4-оксо-2-[2-(фуран-2-илкарбо-
Производные
3-имино(гидразоно)-фуран-2(3H)-
нил)гидразинилиден]гексановая (3а) и -бутано-
онов могут взаимодействовать с различными
вые (3б-г) кислоты были получены взаимодей-
нуклеофильными реагентами с образованием
ствием 2,4-диоксогексановой (2а) и -бутановых
ациклических продуктов, сохраняющих в своем
(2б-г) кислот, соответственно, с гидразидом фу-
составе фармакофорный структурный фрагмент
ран-2-карбоновой кислоты 1. Реакция проходит
2,4-диоксобутановой кислоты, остающийся в фо-
в среде ацетонитрила при 50°С в течение 5 мин
кусе медицинской химии [17-30].
(схема 1) и приводит к образованию соединений
3а-г с высоким выходом (70-85%).
Ранее нами был предложен удобный способ
получения замещенных
3-гидразоно-3H-фу-
Соединения 3а-г - бледно-желтые (3a) или
ран-2-онов внутримолекулярной конденсаци-
желтые (3б-г) кристаллические вещества, легко-
ей замещенных
4-арил-2-[2-ароилгидразини-
растворимые в хлороформе и ДМСО, при нагрева-
лиден]-4-оксобутановых кислот под действием
нии - в толуоле, диоксане и этаноле, и нераствори-
ангидридов уксусной или пропионовой кислот
мые в алканах и воде. Спектры ЯМР 1Н соединений
[31-33]. Аналогичный подход был использован
3а-г, записанные в растворе ДМСO-d6, свидетель-
для синтеза замещенных 3-(тиофен-2-илимино)-
ствуют о их существовании в виде трех изомер-
фуран-2(3H)-онов, содержащих в своем составе
ных форм. Форма А характеризуются наличием
такой фармакофорный структурный фрагмент, как
синглетного сигнала группы NH в области 11.09-
аминотиофен Гевальда [34, 35]. Среди них были
11.38 м. д. и синглетного сигнала метиленовой
обнаружены вещества с выраженной анальгети-
группы в области 4.04-4.53 м. д. Форма Б характе-
ческой [36], противовоспалительной [37], проти-
ризуются наличием двух дублетных сигналов про-
вомикробной активностью, а также соединения
тонов СН2-группы в области 3.21-3.35 м. д. Для
с выраженными фотолюминесцентными свой-
формы В характерно наличие в спектре синглетно-
ствами [38]. В настоящей работе нами продолже-
го сигнала группы NH в области 13.40-13.72 м. д.
и синглетного сигнала метиленовой группы в об-
ны исследования в области поиска новых низко-
токсичных биологически активных соединений
ласти 3.80-4.29 м. д.
[39, 40], расширены границы применения метода
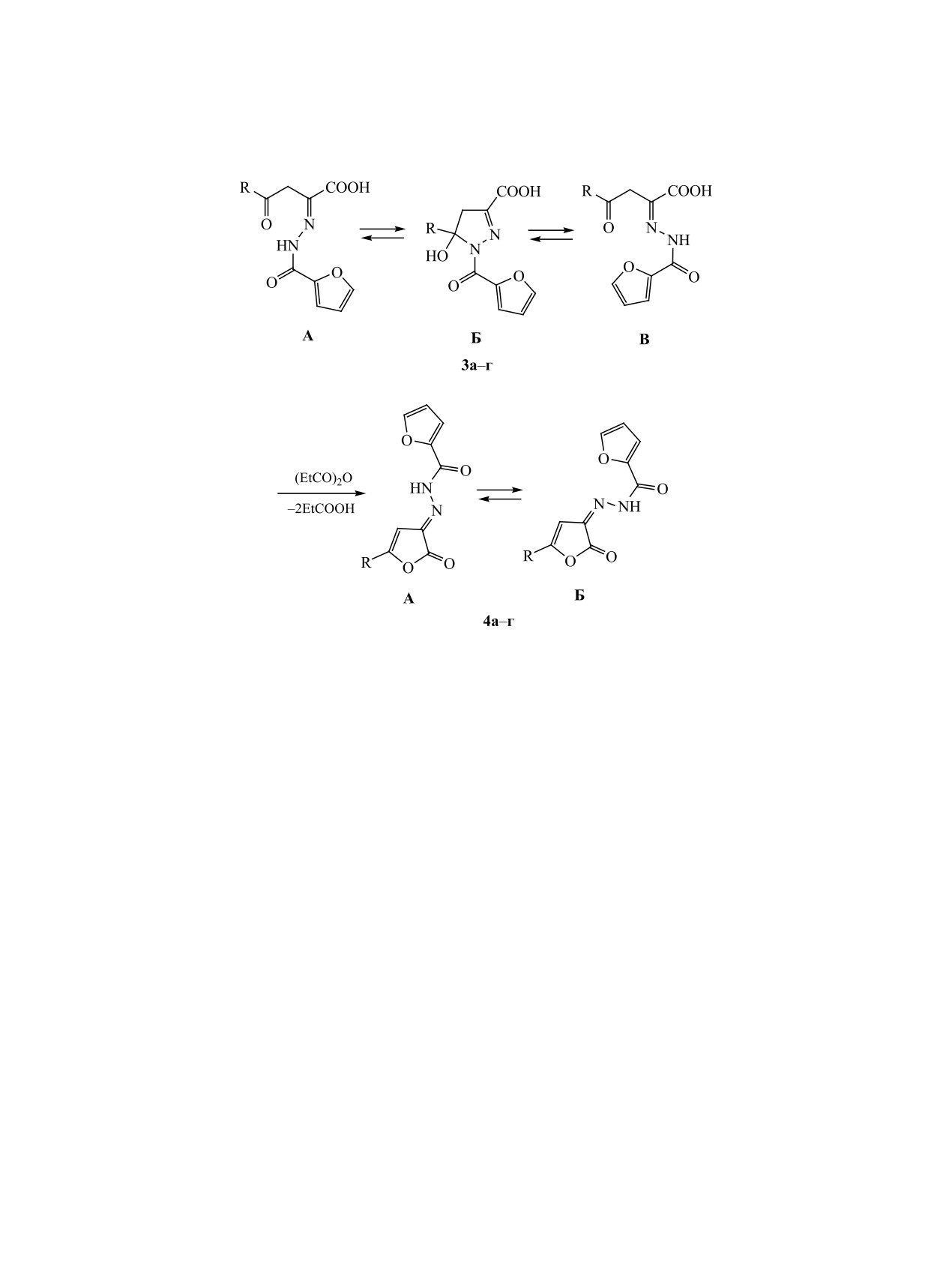
Замещенные
4-оксо-2-[2-(фуран-2-илкарбо-
синтеза
3-гидразонофуран-2(3H)-онов, исследо-
нил)гидразинилиден]гексановая (3а) и -бутано-
вана их дециклизация под действием спиртов, а
вые (3б-г) кислоты при медленном нагревании в
также изучена анальгетическая активность полу-
пропионовом ангидриде до 150°С и последующем
ченных соединений.
перемешивании реакционной массы в течение
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
190
ИГИДОВ и др.
Схема 2.
R = t-Bu (a), Ph (б), 4-Me C6H4 (в), 4-MeOC6H4 (г).
5 мин при этой температуре претерпевают внутри-
смеси Z- и E-изомеров. Форма А характеризуется
молекулярную конденсацию с участием карбок-
наличием синглетного сигнала протона NH-груп-
сильной и енолизованной кетонной карбонильной
пы при 11.63-11.90 м. д. Форма Б характеризуется
групп, приводящую к образованию замещенных
наличием синглета протона NH-группы при 12.36-
N′-[2-оксофуран-3(2Н)-илиден]фуран-2-карбоги-
12.55 м. д. Соединение 4в получено в виде одного
дразидов 4а-г с выходом 52-78% (схема 2).
изомера, характеризующегося наличием синглета
Соединения 4а-г - кристаллические вещества
протона NH-группы при 11.89 м. д. (форма А).
желтого цвета, хорошо растворимые в ДМСО, при
Нами обнаружено, что при нагревании в при-
нагревании - в толуоле, диоксане и нераствори-
сутствии каталитических количеств триэтилами-
мые в воде и алканах. В ИК спектрах соединений
на гидразонофураноны 4а-г реагируют с первич-
4а-г присутствуют полосы поглощения в областях
ными и вторичными спиртами (метанол, этанол,
1793-1801 и 1662-1672 см-1, характерные для ва-
пропан-2-ол) с образованием соответствующих
лентных колебаний лактонной и амидной кар-
эфиров замещенных [(2-(2-фуран-2-илкарбонил)-
бонильных группы, поглощение в области 1693-
гидразинилиден]-4-оксогексановой
(5а, г, з) и
1699 см-1, характерное для валентных колебаний
-4-оксобутановых (5б, в, д-ж) кислот (схема 3).
связи С=N, и полосы поглощения в области 3125-
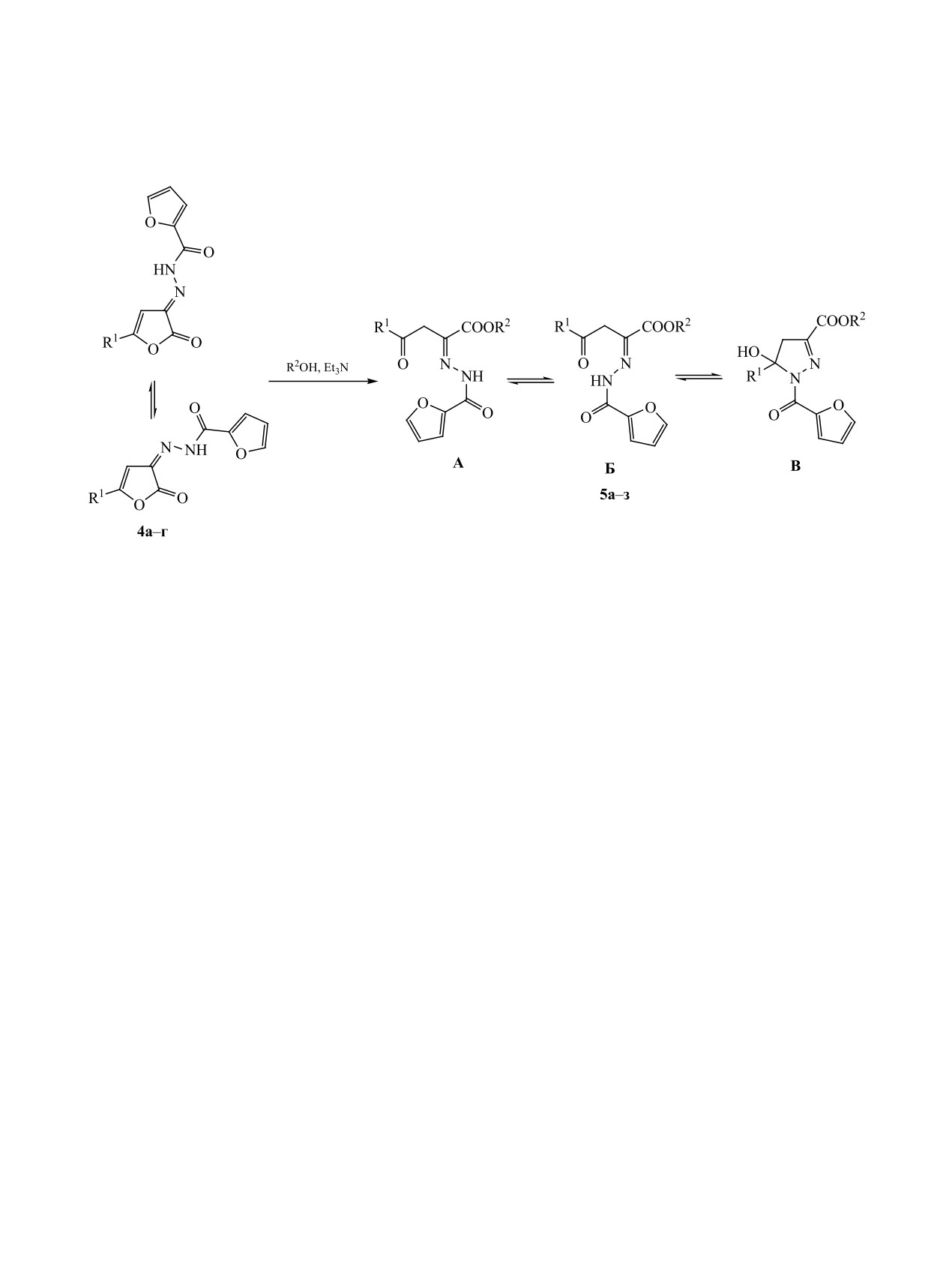
Соединения 5а-з образуются в результате присо-
3186 см-1, соответствующее валентным колебани-
единения спирта к лактонной карбонильной груп-
ям группы NH.
пе иминофуранонов 4 и последующего раскрытия
По данным спектроскопии ЯМР 1Н, соединения
фуранонового цикла по связи O1-C5. Соединения 5
4a, б, г в растворе в ДМСO-d6 существуют в виде
существуют в виде смеси Z- и E-изомеров (формы
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
ДЕЦИКЛИЗАЦИЯ ЗАМЕЩЕННЫХ 2-[2-ОКСОФУР
АН-3(2Н)-ИЛИДЕН]ФУРАН-...
191
Схема 3.
R1 = t-Bu (4а, 5в, 5г, 5з), C6H5 (4б, 5б, 5д), 4-MeC6H4 (4в, 5в, 5е), 4-MeOC6H4 (4г, 5ж); R2 = Me (5а-в), Et (5г-ж),
i-C3H7 (5з).
А и В), кроме того Е-изомер частично претерпева-
виде дублетных и мультиплетных сигналов в об-
ет внутримолекулярную циклизацию вследствие
ластях 1.24-1.30 и 4.98-5.11 м. д. соответственно.
присоединения группы NH к кетонной карбониль-
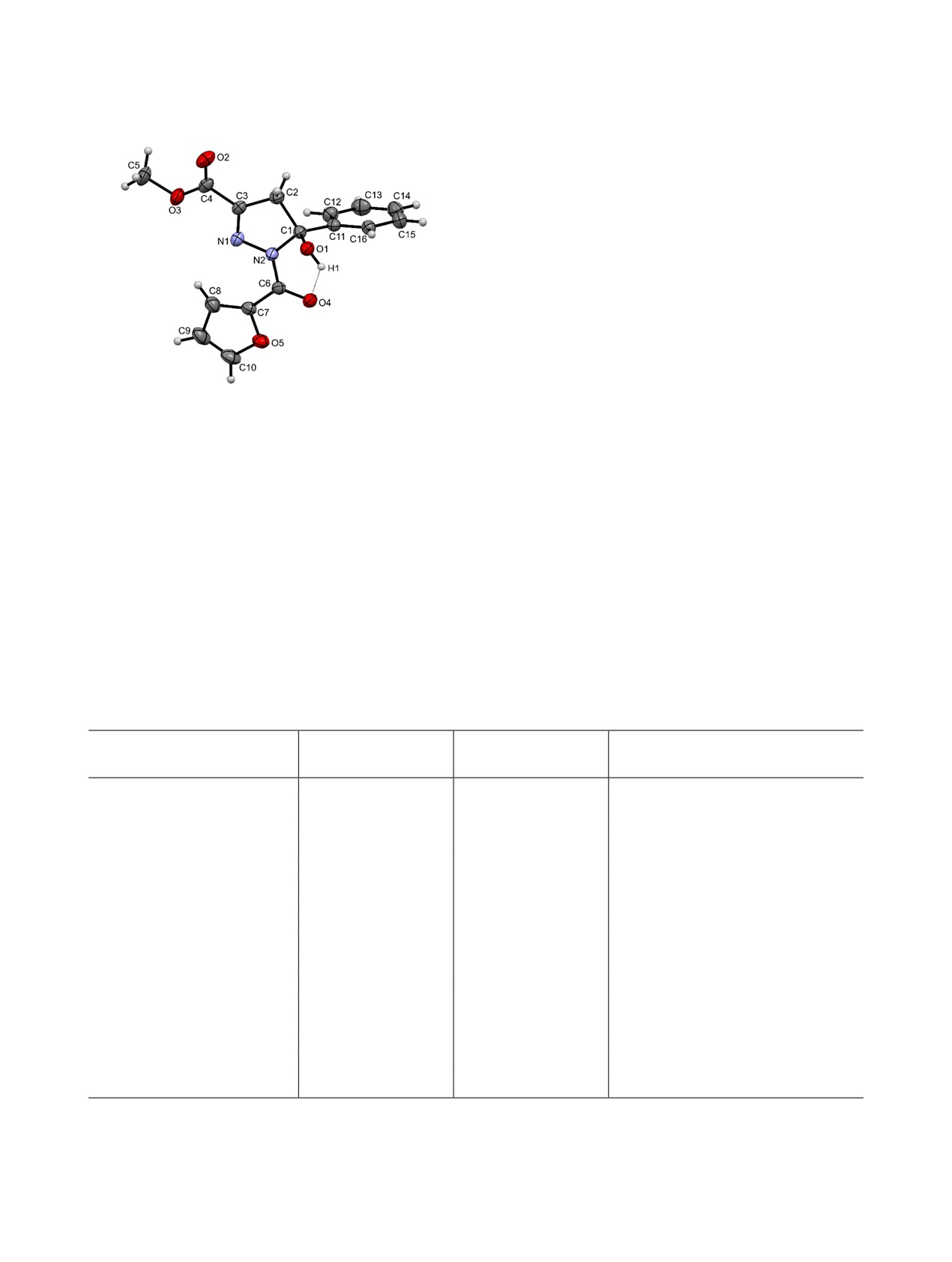
Структура соединения 5б дополнительно под-
ной группе с образованием замещенных 5-гидрок-
тверждена данными рентгеноструктурного анали-
си-4,5-дигидропиразолов (форма Б).
за (рис. 1). Соединение кристаллизуется в цикли-
Соединения 5а-з представляют собой бесцвет-
ческой форме Б в виде рацемата. Пиразолиновый
ные кристаллические вещества, легко раствори-
цикл в молекуле почти плоский (RMSD 0.040 Å).
мые в хлороформе и ДМСО, при нагревании - в
Фуроильный заместитель лежит приблизительно в
толуоле, диоксане и этаноле, и нерастворимые в
плоскости пиразолинового цикла. Гидроксильная
алканах и воде. Согласно данным спектроскопии
группа развернута в сторону карбонильной груп-
пы фуроильного заместителя и образует с ней вну-
ЯМР 1Н, соединения 5а-з существуют в растворе в
тримолекулярную водородную связь O1-H1∙∙∙O4
ДМСО в виде трех изомерных форм А-В. В целом,
[O1-H1 0.85(3) Å, H1∙∙∙O4 2.62(3) Å, O1∙∙∙O4 3.034(2) Å,
спектры ЯМР 1Н соединений 5а-з схожи со спек-
угол O1H1O4 111(2)°].
трами соответствующих кислот 3а-г, за исключе-
нием того, что в первых в дополнение к остальным
Полученные соединения были испытаны на
сигналам присутствуют сигналы протонов алкок-
наличие анальгетической активности. Результаты
сикарбонильных групп: метоксикарбонильных
исследования представлены в табл. 1.
групп в спектрах соединений 5а-в в виде синглет-
Согласно полученным данным, все исследу-
ных сигналов в области 3.76-3.87 м. д., этоксикар-
емые соединения обладают анальгетической ак-
бонильных групп в спектрах соединений 5г-ж в
тивностью, определяемой по методу
«горячая
областях 1.15-1.31 и 3.77-4.39 м. д. и 2-пропокси-
пластинка». Наибольшую активность, сравнимую
карбонильной группы в спектре соединения 5з в
с эффектом диклофенака натрия, показали соеди-
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
192
ИГИДОВ и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
ИК спектры записаны на приборе ФСМ-1202
в вазелиновом масле. Спектры ЯМР 1Н записа-
ны на приборе Bruker Avance III (рабочая частота
400 MГц) в ДМСO-d6, внутренний стандарт - оста-
точный сигнал дейтерорастворителя. Элементный
анализ проведен на приборе Leco CHNS-932. Хи-
мическую чистоту соединений и протекание реак-
ций контролировали методом ТСХ на пластинах
Sorbfil в системе диэтиловый эфир-бензол-ацетон
(10:9:1), детектирование проводили в УФ свете и
парами иода. Температуры плавления определяли
Рис. 1. Молекулярная структура соединения 5б в пред-
ставлении неводородных атомов эллипсоидами тепло-
на приборе SMP40.
вых колебаний с 30%-ной вероятностью.
Методика синтеза 4-оксо-2-[2-(фуран-2-ил-
карбонил)гидразинилиден]бутановых кислот
3а-г. К раствору 5.0 ммоль (630 мг) гидразида фу-
нения 4б, 4в и 5б, несущие в своем составе фе-
ран-2-карбоновой кислоты в 30 мл ацетонитрила
нильный и пара-метилфенильный заместители.
добавляли 5.0 ммоль 2,4-диоксобутановой кисло-
Таким образом, реакция дециклизации замещен-
ты 2a-г. Полученный раствор перемешивали при
ных 2-[2-оксофуран-3(2Н)-илиден]фуран-2-карбо-
50°С 5 мин, затем охлаждали до 0°С. Образовав-
гидразидов с ОН-нуклеофилами открывает широ-
шийся осадок отфильтровывали, промывали хо-
кие возможности для синтезе новых потенциально
лодным ацетонитрилом и сушили в вакууме. При
биологически активных производных ацилпиро-
необходимости продукт чистили перекристаллиза-
виноградных кислот.
цией из ацетонитрила, этанола или 1,4-диоксана.
Таблица 1. Анальгетическая активность исследованных соединений 3-5а
Латентный период оборонительного
Соединение
Доза, мг/кг
ЛД50, мг/кг
рефлекса (180 мин), с
3а
50
> 1500
20.03±0.57
3в
50
> 1500
20.82±0.81
3г
50
> 1500
20.56±0.64
4а
50
> 1500
21.22±0.68
4б
50
> 1500
24.80±0.97
4в
50
> 1500
26.60±1.36
4г
50
> 1500
19.48±0.82
5а
50
> 1500
23.90±0.60
5б
50
> 1500
25.20±1.02
5г
50
> 1500
20.20±0.25
5д
50
> 1500
20.32±0.44
5е
50
> 1500
23.60±0.68
5ж
50
> 1500
20.00±0.38
Метамизол натрия
93 (ЕД50)
16.33±3.02б
Диклофенак натрия
10
74
26.20 ± 0.96
Контроль
-
10.30 ± 0.60
а Достоверность различий по сравнению с контролем p < 0.05. б p < 0.1.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
ДЕЦИКЛИЗАЦИЯ ЗАМЕЩЕННЫХ 2-[2-ОКСОФУР
АН-3(2Н)-ИЛИДЕН]ФУРАН-...
193
5,5-Диметил-4-оксо-2-[2-(фуран-2-илкарбо-
м. д.: форма A (43%), 3.86 с (3Н, СН3О), 4.48 с (2Н,
нил)гидразинилиден]гексановая кислота (3а).
СН2), 6.71 д. д (1Н, HAr, J 3.2, 1.7 Гц), 6.87-8.00 м
Выход 0.98 г (70%), бледно-желтые кристаллы,
(6Н, HAr), 11.29 уш. с (1Н, NH); форма Б (37%),
т. пл. 144-145°С (MeCN). ИК спектр, ν, см-1: 3324,
3.21 д (1Н, С4Н2, J 20.0 Гц), 3.31 д (1Н, С4Н2, J
3204 уш, 3119, 1717, 1676, 1595. Спектр ЯМР 1Н, δ,
20.0 Гц), 6.68 д. д (1Н, J 3.4, 1.6 Гц), 6.87-8.00 м
м. д.: форма A (24%), 1.16 с (3Н, t-Bu), 4.04 с (2Н,
(6Н, HAr + 1Н, ОН); форма В (20%), 3.81 с (3Н,
СН2), 6.62 д. д (1Н, HAr, J 3.5, 1.8 Гц), 7.02-7.95 м
СН3О), 4.24 с (2Н, СН2), 6.71 д. д (1Н, HAr, J 3.2,
(2Н, HAr), 11.09 уш. с (1Н, NH); форма Б (61%),
1.7 Гц), 6.87-8.00 м (6Н, HAr), 13.40 уш. с (1Н, NH).
1.12 с (3Н, t-Bu), 3.21 д (1Н, С4Н2, J 20.0 Гц), 3.35
Найдено, %: C 58.16; H 4.31; N 8.46. C16H14N2О6.
д (1Н, С4Н2, J 20.0 Гц), 6.56 д. д (1Н, J 3.5, 1.8 Гц),
Вычислено, %: C 58.18; H 4.27; N 8.48.
7.03-7.95 м (2Н, HAr + 1Н, ОН); форма В (15%),
Методика
синтеза
2-[5-трет-бутил/
1.14 с (3Н, t-Bu), 3.80 с (2Н, СН2), 6.70 д. т (1Н,
арил-2-оксофуран-3(2Н)-илиден]фуран-2-кар-
HAr, J 1.7, 0.8 Гц), 7.03-7.95 м (2Н, HAr), 13.48 уш.
богидразидов 4а-г. К 5.0 ммоль кислоты 3а-г
с (1Н, NH). Найдено, %: C 55.74; H 5.73; N 10.03.
добавляли 6 мл ангидрида пропионовой кисло-
C13H16N2О5. Вычислено, %: C 55.71; H 5.75; N
ты. Полученную смесь медленно нагревали при
10.00.
перемешивании до 150°С, выдерживали при этой
4-Оксо-4-фенил-2-[2-(фуран-2-илкарбонил)-
температуре 5 мин и охлаждали до комнатной тем-
гидразинилиден]бутановая кислота (3б). Выход
пературы. Образовавшийся осадок отфильтровы-
1.26 г (84%), желтые кристаллы, т. пл. 165-166°С
вали, промывали безводным диэтиловым эфиром
(диоксан). ИК спектр, ν, см-1: 3379, 3299, 3137,
и перекристаллизовывали из безводного толуола
1735, 1645, 1600. Спектр ЯМР 1Н, δ, м. д.: форма
или безводного диоксана.
A (14%), 4.53 с (2Н, СН2), 6.71 д. д (1Н, HAr, J 3.5,
N′-[5-(трет-Бутил)-2-оксофуран-3(2Н)-или-
1.6 Гц), 7.24-8.01 м (7Н, HAr), 11.32 уш. с (1Н, NH);
ден]фуран-2-карбогидразид (4а). Выход 0.68 г
форма Б (79%), 3.21 д (1Н, С4Н2, J 20.0 Гц), 3.33 д
(52%), светло-желтые кристаллы, т. пл. 215-216°С
(1Н, С4Н2, J 20.0 Гц), 6.68 д. д (1Н, J 3.5, 1.8 Гц),
(диоксан). ИК спектр, ν, см-1: 3186, 1793, 1699,
7.24-8.01 м (7Н, HAr + 1Н, ОН); форма В (7%), 4.27
1663, 1622, 1592. Спектр ЯМР 1Н, δ, м. д.: форма A
с (2Н, СН2), 6.71 д. д (1Н, HAr, J 3.5, 1.6 Гц), 7.24-
(88%), 1.22 с (9Н, t-Bu), 6.73 д. д (1Н, J 3.6, 1.8 Гц),
8.01 м (7Н, HAr) 13.72 уш. с (1Н, NH). Найдено, %:
6.83 с (1Н, СН), 7.52 д. д (1Н, J 3.6, 0.7 Гц), 7.98 д.
C 60.02; H 4.01; N 9.36. C15H12N2О5. Вычислено,
д (1Н, J 1.8, 0.8 Гц), 11.63 уш. с (1Н, NH); форма Б
%: C 60.00; H 4.03; N 9.33.
(12%), 1.23 с (9Н, t-Bu), 6.28 с (1Н, СН), 6.76 д. д
4-Оксо-4-(п-толил)-2-[2-(фуран-2-илкарбо-
(1Н, 2НAr, J 3.6, 1.8 Гц), 7.39 д (1Н, J 3.6, 0.7 Гц),
нил)гидразинилиден]бутановая кислота
(3в).
8.02 д. д (1Н, J 1.8, 0.8 Гц), 12.36 уш. с (1Н, NH).
Выход 1.15 г (73%), желтые кристаллы, т. пл. 179-
Найдено, %: C 59.57; 5.35; N 10.66. C13H14N2О4.
180°С (диоксан). Спектр ЯМР 1Н, δ, м. д.: форма
Вычислено, %: C 59.54; H 5.38; N 10.68.
A (30%), 2.41 с (3Н, CH3), 4.52 с (2Н, СН2), 6.73
N′-(2-Оксо-5-фенилфуран-3(2Н)-илиден)фу-
д. д (1Н, HAr, J 3.4, 1.7 Гц), 7.14-7.99 м (6Н, HAr),
ран-2-карбогидразид (4б). Выход 1.10 г (78%),
11.38 уш. с (1Н, NH); форма Б (58%), 2.30 с (3Н,
желтые кристаллы, т. пл. 246-248°С (диоксан).
CH3), 3.22 д (1Н, С4Н2, J 20.0 Гц), 3.32 д (1Н, С4Н2,
ИК спектр, ν, см-1: 3188, 1801, 1698, 1667, 1617.
J 20.0 Гц), 6.70 д. д (1Н, J 3.5, 1.7 Гц), 7.14-7.98
Спектр ЯМР 1Н, δ, м. д.: форма А (69%), 6.78 д. д
м (6Н, HAr + 1Н, ОН); форма В (12%), 2.40 с (3Н,
(1Н, НAr, J 3.5, 1.8 Гц), 7.18-7.87 м (5Н, НAr + 2Н,
CH3), 4.29 с (2Н, СН2), 6.73 д. д (1Н, HAr, J 3.4,
СН), 8.04 д (1Н, J 1.0 Гц), 11.90 уш. с (1Н, NH);
1.7 Гц), 7.14-7.99 м (6Н, HAr) 13.47 уш. с (1Н, NH).
форма Б (31%), 6.80 д. д (1Н, НAr, J 3.6, 1.7 Гц),
Найдено, %: C 61.12; H 4.47; N 8.94. C16H14N2О5.
7.25 с (1Н, СН), 7.43-7.87 м (5Н, НAr + 1Н, СН) 8.07
Вычислено, %: C 61.14; H 4.49; N 8.91.
д (1Н, НAr, J 1.0 Гц), 12.55 с (1Н, NH). Найдено, %:
C 63.80; 3.55; N 9.91. C15H10N2О4. Вычислено, %:
4-(4-Метоксифенил)-4-оксо-2-[2-(фуран-
C 63.83; H 3.57; N 9.93.
2-илкарбонил)гидразинилиден]бутановая кис-
лота (3г). Выход 1.40 г (85%), желтые кристаллы,
N′-[2-Оксо-5-(п-толил)фуран-3(2Н)-илиден]-
т. пл. 159-160°С (диоксан). Спектр ЯМР 1Н, δ,
фуран-2-карбогидразид (4в). Выход 0.79 г (53%),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
194
ИГИДОВ и др.
желтые кристаллы, т. пл. 258-259 °С (диоксан).
Метил-4-оксо-4-фенил-2-[2-(фуран-2-ил-
ИК спектр, ν, см-1: 3125, 1799, 1693, 1672, 1622.
карбонил)гидразинилиден]бутаноат
(5б). Вы-
Спектр ЯМР 1Н, δ, м. д.: форма А (100%), 2.41 с
ход 0.96 г (61%), бесцветные кристаллы, т. пл.
(3Н, СН3), 6.72 д. д (1Н, НAr, J 3.5, 1.8 Гц), 7.36-
141-142°С (этанол). ИК спектр, ν, см-1: 3368,
7.67 м (5Н, НAr + 1Н, СН), 7.98 д (1Н, J 1.0 Гц),
1713, 1657, 1586. Спектр ЯМР 1Н, δ, м. д.: форма
11.89 уш. с (1Н, NH). Найдено, %: C 64.84; 4.11; N
А (17%), 3.80 с (3Н, ОСН3), 4.61 с (2Н, СН2), 6.76
9.48. C16H12N2О4. Вычислено, %: C 64.86; H 4.08;
д. д (1Н, НAr, J 3.5, 1.7 Гц), 7.27-7.46 м (6H, НAr),
N 9.46.
7.56-7.58 м ( 1Н, НAr), 11.48 уш. с (1Н, NH); форма
N′-[5-(4-Метоксифенил)-2-оксофуран-
Б (67%), 3.28 д (1Н, С4Н2, J 19.1 Гц), 3.37 д (1Н,
3(2Н)-илиден]фуран-2-карбогидразид (4г). Вы-
С4Н2, J 19.1), 3.87 с (3Н, ОСН3), 6.73 д. д (1Н, НAr,
ход 0.87 г (56%), желтые кристаллы, т. пл. 265-
J 3.5, 1.8 Гц), 7.27-7.46 м (5H, НAr,1Н,ОН ), 7.52 д.
266°С (диоксан). ИК спектр, ν, см-1: 3137, 1801,
д (1Н, НAr, J 3.5, 0.9 Гц), 7.95 д. д (1Н, НAr, J 1.7,
1666, 1622, 1592. Спектр ЯМР 1Н, δ, м. д.: форма
0.7 Гц); форма В (16%), 3.78 с (3Н, ОСН3), 4.42 с
А (76%), 3.86 с (3Н, ОСН3), 6.74 д. д (1Н, НAr, J
(2Н, СН2), 6.74 д. д (1Н, фурил, J 3.5, 1.7 Гц), 7.27-
3.6, 1.7 Гц), 7.14 д (2Н, НAr, J 8.0 Гц), 7.38 с (1Н,
7.46 м (5H, НAr), 7.59-7.61 м (1Н, НAr), 7.99-8.05
СН), 7.56 д. д (1Н, НAr, J 3.6, 0.8 Гц), 7.72 д (2Н,
м ( 1Н, НAr), 13.07 уш. с (1Н, NH). Найдено, %: C
НAr, J 8.0 Гц), 7.99 д. д (1Н, J 1.6, 0.8 Гц), 11.66
61.17; H 4.47; N 8.94; C16H14N2O5. Вычислено, %:
уш. с (1Н, NH); форма Б (24%), 3.85 с (3Н, ОСН3),
C 61.14; H 4.49; N 8.91.
6.76 д. д (1Н, НAr, J 3.6, 1.7 Гц), 7.03 с (1Н, СН),
Метил-4-оксо-4-(п-толил)-2-[2-(фуран-2-ил-
7.11 д (2Н, НAr, J 9.0 Гц), 7.40 д (1Н, НAr, J 1.0 Гц),
карбонил)гидразинилиден]бутаноат (5в). Выход
7.80 д (2Н, НAr, J 9.0 Гц), 8.02 д (1Н, НAr, J 1.0 Гц),
1.20 г (73%), бесцветные кристаллы, т. пл. 138-
12.44 с (1Н, NH). Найдено, %: C 61.53; 3.85; N
140°С (ацетонитрил). ИК спектр, ν, см-1: 3211,
8.99. C16H12N2О5. Вычислено, %: C 61.54; H 3.87;
3135, 1728, 1617. Спектр ЯМР 1Н, δ, м. д.: форма
N 8.97.
А (20%), 2.40 с (3Н, СН3), 3.78 с (3Н, ОСН3), 4.55 с
Методика синтеза алкил-4-оксо-2-[2-(фу-
(2Н, СН2), 6.72 д. д (1Н, НAr, J 3.6, 1.7 Гц), 7.12-8.00
ран-2-илкарбонил)гидразинилиден]гексано-
м (6Н, НAr), 11.48 уш. с (1Н, NH); форма Б (56%),
атов (5а, г, з) и -бутаноатов (5б, в, д-ж). К су-
2.28 с (3Н, СН3), 3.25 д (1Н, С4Н2, J 19.1 Гц), 3.34
спензии 5.0 ммоль N′-[2-оксофуран-3(2Н)-илиден]
д (1Н, С4Н2, J 19.1), 3.85 с (3Н, ОСН3), 6.71 д. д
фуран-2-карбогидразида 4а-г в 20 мл спирта до-
(1Н, НAr, J 3.6, 1.7 Гц), 7.12-8.00 м (6Н, НAr + 1Н,
бавляли 2-3 капли триэтиламина. Полученную
ОН); форма В (24%), 2.39 с (3Н, СН3), 3.76 с (3Н,
смесь перемешивали при температуре кипения
ОСН3), 4.36 с (2Н, СН2), 6.74 д. д (1Н, НAr, J 3.5,
соответствующего спирта в течение 20-30 мин
1.8 Гц), 7.12-8.00 м (6Н, НAr), 13.01 уш. с (1Н, NH).
и охлаждали до 0°C. Образовавшийся осадок от-
Найдено, %: C 62.16; H 4.89; N 8.55; C17H16N2O5.
фильтровывали, промывали холодным спиртом и
Вычислено, %: C 62.19; H 4.91; N 8.53.
перекристализовывали.
Этил-5,5-диметил-4-оксо-2-[2-(фуран-2-
Метил-5,5-диметил-4-оксо-2-[2-(фуран-2-ил-
илкарбонил)гидразинилиден]гексаноат
(5г).
карбонил)гидразинилиден]гексаноат
(5а).
Выход 1.06 г (69%), бесцветные кристаллы, т. пл.
Выход 0.90 г (61%), бесцветные кристаллы, т. пл.
132-133°С (пропан-2-ол). Спектр ЯМР 1Н, δ, м. д.:
128-129°С (пропан-2-ол). ИК спектр, ν, см-1: 3188,
форма А (80%), 1.17 с (9Н, t-Bu), 1.27 т (3Н, СН3, J
3150, 1718, 1657, 1622. Спектр ЯМР 1Н, δ, м. д.:
форма А (87%), 1.16 с (9Н, t-Bu), 3.76 с (3Н, ОСН3),
7.1 Гц) 4.06 с (2Н, СН2), 4.21 к (2Н, СН2, J 7.1 Гц),
4.06 с (2Н, СН2), 6.72 д. д (1Н, НAr, J 3.5, 1.8 Гц),
6.69 д. д (1Н, НAr, J 3.6, 1.7 Гц), 7.32-7.93 м (2Н,
7.67 м (1Н, НAr), 7.98 д. д (1Н, НAr, J 1.6, 0.8 Гц),
НAr), 11.20 уш. с (1Н, NH); форма Б (9%), 1.02 с
11.34 уш. с (1Н, NH); форма Б (13%), 1.00 с (9Н,
(9Н, t-Bu), 1.31 т (3Н, СН3, J 7.1 Гц), 2.93 д (1Н,
t-Bu), 2.92 д (1Н, С4Н2, J 19.1 Гц), 3.42 д (1Н, С4Н2,
С4Н2, J 19.1 Гц), 3.41 д (1Н, С4Н2, J 19.1), 4.27 к
J 19.1), 3.82 с (3Н, ОСН3), 6.52 уш. с (1Н, ОH), 6.67
(2Н, СН2, J 7.1 Гц), 6.35 уш. с (1Н, ОH), 6.65 д. д
м (1Н, НAr), 7.34 м (1Н, НAr), 7.92 м (1Н, НAr). Най-
(1Н, НAr, J 3.6, 1.7 Гц), 7.32-7.93 м (2Н, НAr); фор-
дено, %: C 57.17; H 6.14; N 9.50; C14H18N2O5. Вы-
ма В (11%), 1.16 с (9Н, t-Bu), 1.25 т (3Н, СН3, J
числено, %: C 57.14; H 6.16; N 9.52.
7.1 Гц), 3.87 с (2Н, СН2), 4.27 к (2Н, СН2, J 7.1 Гц),
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
ДЕЦИКЛИЗАЦИЯ ЗАМЕЩЕННЫХ 2-[2-ОКСОФУР
АН-3(2Н)-ИЛИДЕН]ФУРАН-...
195
6.71 д. д (1Н, НAr, J 3.6, 1.7 Гц), 7.32-7.93 м (2Н,
СН3, J 7.1 Гц), 3.25 д (1Н, С4Н2, J 19.1 Гц), 3.34 д
НAr), 12.94 уш. с (1Н, NH). Найдено, %: C, 58.47;
(1Н, С4Н2, J 19.1), 3.74 с (3Н, ОСН3), 4.30 к (2Н,
H, 6.51; N, 9.11; C15H20N2O5. Вычислено, %: C,
СН2, J 7.1 Гц), 6.71 д. д (1Н, НAr, J 3.6, 1.8 Гц),
58.43; H, 6.54; N, 9.09.
6.86-7.99 м (6Н, НAr, 1Н, ОН); форма В (20%), 1.15
т (3Н, СН3, J 7.1 Гц), 3.86 с (3Н, ОСН3), 4.20-4.27 м
Этил-4-оксо-4-фенил-2-[2-(фуран-2-илкарбо-
нил)гидразинилиден]бутаноат (5д). Выход 1.33 г
(2Н, СН2), 4.28 с (2Н, СН2), 6.66-6.69 м (1Н, НAr),
(81%), бесцветные кристаллы, т. пл. 114-115°С
6.86-7.99 м (6НAr), 12.91 уш. с (1Н, NH). Найдено,
%: C 60.31; H 5.03; N 7.85; C18H18N2O6. Вычисле-
(пропан-2-ол). ИК спектр, ν, см-1: 3378, 3125,
1708, 1647, 1588. Спектр ЯМР 1Н, δ, м. д.: форма
но, %: C 60.33; H 5.06; N 7.82.
А (29%), 1.27 т (3Н, СН3, J 7.1 Гц), 4.24 к (2Н, СН2,
Изопропил-5,5-диметил-4-оксо-2-[2-(фу-
J 7.1 Гц), 4.56 с (2Н, СН2), 6.69-6.72 м (1Н, НAr),
ран-2-илкарбонил)гидразинилиден]гексаноат
7.24-8.01 м (7H, НAr), 11.34 с (1Н, NH); форма Б
(5з). Выход 0.85 г (53%), бесцветные кристаллы,
(68%), 1.31 т (3Н, СН3, J 7.1 Гц), 3.26 д (1Н, С4Н2, J
т. пл. 95-96°С (пропан-2-ол). Спектр ЯМР 1Н,
19.1 Гц), 3.37 д (1Н, С4Н2, J 19.1), 4.31 к (2Н, СН2,
δ, м. д.: форма А (19%), 1.16 с (9Н, t-Bu), 1.26 д
J 7.1 Гц), 6.68 д. д (1Н, НAr, J 3.5, 1.8 Гц), 7.24-8.01
(6Н, СН3, J 6.3 Гц), 4.05 с (2Н, СН2), 5.0 м (1Н,
м (7H, НAr + 1Н, ОН ); форма В (3%), 1.15 т (3Н,
СН), 6.68-6.69 м (1Н, НAr), 7.32-7.95 м (2Н, НAr),
СН3, J 7.1 Гц), 3.77 к (2Н, СН2, J 7.1 Гц), 4.35 с
11.12 уш. с (1Н, NH); форма Б (4%), 1.17 с (9Н,
(2Н, СН2), 6.69-6.71 м (1Н, НAr), 7.24-7.35 м (7H,
t-Bu), 1.30 д (6Н, СН3, J 6.3 Гц), 2.92 д (1Н, С4Н2, J
НAr), 12.92 уш. с (1Н, NH). Найдено, %: C 62.17; H
19.1 Гц), 3.39 д (1Н, С4Н2, J 19.1), 4.98-5.04 м (1Н,
4.93; N 8.56; C17H16N2O5. Вычислено, %: C 62.19;
СН), 6.35 уш. с (1Н, ОH), 6.64-6.66 м (1Н, НAr),
H 4.91; N 8.53.
7.32-7.95 м (2Н, НAr); форма В (77%), 1.17 с (9Н,
Этил-4-оксо-4-(п-толил)-2-[2-(фуран-2-ил-
t-Bu), 1.24 д (6Н, СН3, J 6.3 Гц), 3.86 с (2Н, СН2),
карбонил)гидразинилиден]бутаноат (5е). Выход
5.09 м (1Н, СН), 6.71 д. д (1Н, НAr, J 3.5, 1.8 Гц),
1.96 г (56%), бесцветные кристаллы, т. пл. 90-92°С
7.32-7.95 м (2Н, НAr), 12.91 уш. с (1Н, NH). Найде-
(пропан-2-ол). ИК спектр, ν, см-1: 3348, 3145, 1708,
но, %: C 59.64; H 6.78; N 8.71; C16H22N2O5. Вычис-
1647, 1591. Спектр ЯМР 1Н, δ, м. д.: форма А (37%),
лено, %: C 59.62; H 6.88; N 8.69.
1.29 д. т (3Н, СН3, J 13.8, 7.1 Гц), 2.40 с (3Н, СН3),
Рентгеноструктурный анализ соединения
4.20-4.25 м (2Н, СН2), 4.53 с (2Н, СН2), 6.73 д. д
5б выполнен на дифрактометре Xcalibur Ruby
(1Н, НAr, J 3.6, 1.8 Гц), 7.12-7.98 м (6Н, НAr), 11.48
(Agilent Technologies, Великобритания) с ССD-де-
с (1Н, NH); форма Б (59%), 1.29 д. т (3Н, СН3, J
тектором по стандартной методике [MoKα-излу-
13.8, 7.1 Гц), 2.28 с (3Н, СН3), 3.23 д (1Н, С4Н2, J
чение, 295(2) K, ω-сканирование с шагом 1°]. По-
19.1 Гц), 3.32 д (1Н, С4Н2, J 19.1), 4.31 к (2Н, СН2, J
глощение учтено эмпирически с использованием
7.1 Гц), 6.71 д. д (1Н, НAr, J 3.6, 1.7 Гц), 7.12-7.98 м
алгоритма SCALE3 ABSPACK
[41]. Сингония
(6Н, НAr, 1Н, ОН); форма В (4%), 1.13 т (3Н, СН3, J
кристалла (C16H14N2O5, M 314.29) ромбическая,
7.1 Гц), 2.40 с (3Н, СН3), 4.23 к (2Н, СН2, J 7.1 Гц),
пространственная группа Pbca, a 13.658(3) Å, b
4.33 с (2Н, СН2), 6.74-6.75 м (1Н, НAr), 7.12-7.98
8.883(2) Å, c 25.078(7) Å, V 3042.4(12) Å3, Z 8, dвыч
м (6Н, НAr), 13.07 уш. с (1Н, NH). Найдено, %: C
1.372 г/см3, μ 0.104 мм-1. Структура расшифрована
63.17; H 5.27; N 8.20; C18H18N2O5. Вычислено, %:
с помощью программы SHELXS [42] и уточнена
C 63.15; H 5.30; N 8.18.
полноматричным МНК по F2 в анизотропном при-
Этил-4-(4-метоксифенил)-4-оксо-2-[2-(фу-
ближении для всех неводородных атомов с исполь-
ран-2-илкарбонил)гидразинилиден]бутаноат
зованием программы SHELXL [43] с графическим
(5ж). Выход 1.04 г (58%), бесцветные кристаллы,
интерфейсом OLEX2 [44]. Атом водорода группы
т. пл. 120-121°С (пропан-2-ол). ИК спектр, ν, см-1:
OH уточнен независимо в изотропном приближе-
3277, 3120, 1708, 1677, 1601. Спектр ЯМР 1Н, δ,
нии. При уточнении остальных атомов водорода
м. д.: форма А (58%), 1.26 т (3Н, СН3, J 7.1 Гц),
использована модель наездника. Окончательные
3.86 с (3Н, ОСН3), 4.20-4.27 м (2Н, СН2), 4.50 с
параметры уточнения: R1 0.0563 [для 2242 отраже-
(2Н, СН2), 6.66-6.69 м (1Н, НAr), 6.86-7.99 м (6Н,
ний с I > 2σ(I)], wR2 0.1661 (для всех 3822 незави-
НAr), 11.29 с (1Н, NH); форма Б (22%), 1.31 т (3Н,
симых отражений, Rint 0.0530), S 1.065. Результаты
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
196
ИГИДОВ и др.
РСА зарегистрированы в Кембриджском центре
животных в течение 10 сут. Для исследуемых со-
кристаллографических данных (CCDC 2212115).
единений 3-5 о ЛД50 составляет >1500 мг/кг. Со-
гласно классификации токсичности препаратов,
Биологические исследования. Испытания
соединения 3-5 относятся к V классу практически
анальгетической активности проводили в науч-
нетоксичных препаратов [47].
но-исследовательской лаборатории биологически
активных веществ «Пермского государственного
Статистическую обработку экспериментально-
национального исследовательского университе-
го материала проводили с использованием крите-
та». Анальгетическая активность была определена
риев достоверности Стьюдента. Эффект считали
на беспородных белых мышах обоего пола массой
достоверным при р <0.05 [48].
18-22 г по методике термического раздражения
ИНФОРМАЦИЯ ОБ АВТОРАХ
«горячая пластинка». Исследуемые соединения
вводили внутрибрюшинно в виде взвеси в 2%-ном
Сергей Александрович Шипиловских, ORCID:
крахмальном растворе в дозе 50 мг/кг за 30 мин до
помещения животных на нагретую до 53.5°С ме-
таллическую пластинку [45]. Исследования про-
ФИНАНСОВАЯ ПОДДЕРЖКА
водили через 30, 60, 90, 120 мин после введения
Работа выполнена в рамках Программы
соединения.
деятельности научно-образовательного центра
Показателем изменения болевой чувстви-
мирового уровня «Рациональное недропользова-
тельности служила длительность пребывания
ние», 2023.
животных на горячей пластинке до момента воз-
никновения оборонительного болевого рефлекса -
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ НОРМ
облизывания задних лапок или попытки оторвать
Исследования выполнены в соответствии со
все четыре лапы от поверхности пластинки. Время
всеми применимыми международными, нацио-
наступления этого рефлекса от начала помещения
нальными и институциональными руководящими
животного на пластинку измерялось в секундах
принципами по уходу и использованию животных.
(латентный период). Максимальной длительно-
стью латентного периода (период cut off) выбран
КОНФЛИКТ ИНТЕРЕСОВ
интервал 40 с, так как нахождение животного на
Авторы заявляют об отсутствии конфликта
пластинке более длительное время могло привести
интересов.
к ожогу лап и причинению животному физических
страданий.
СПИСОК ЛИТЕРАТУРЫ
В опыте использовали животные с исходным
1. Bouz G., Dolezal M. // Pharmaceuticals. 2021. Vol. 14.
временем наступления оборонительного рефлекса
N 12. P. 1312. doi 10.3390/ph14121312
не более 15 с. Каждое соединение испытывали на
2. Huang L., Yang J., Wang T., Gao J., Xu D. // J.
6 животных. Результаты оценивали по увеличению
Nanobiotechnol. 2022. Vol. 20. N 1. P. 49. doi 10.1186/
времени наступления оборонительного рефлекса
s12951-022-01257-4
по сравнению с исходными данными.
3. Jhinjharia D., Kaushik A.C., Sahi S. // Chemoinform.
Контрольной группе животных вводили 2%-
Bioinform. Pharm. Sci. 2021. P. 55. doi 10.1016/B978-
ную крахмальную слизь. В качестве препаратов
0-12-821748-1.00009-9
4. Babushkina A.A., Dogadina A.V., Egorov D.M.,
сравнения использовали метамизол натрия (ООО
Piterskaia J.L., Shtro A.A., Nikolaeva Y.V., Galochki-
«Фармхимкомплект») в дозе 93 мг/кг (ЕД50) и
na A.V., Kornev A.A., Boitsov V.M. // Med. Chem. Res.
диклофенак натрия (AlfaAesar®) в дозе 10 мг/кг.
2021. Vol. 30. N 12. P. 2203. doi 10.1007/s00044-021-
Острую токсичность (ЛД50, мг/мл) соединений
02801-x
3-5 определяли по методу Г. Н. Першина [46]. Со-
5. Samy K.E., Gampe C. // Bioorg. Med. Chem. Lett. 2022.
единения 3-5 вводили внутрибрюшинно белым
Vol. 62. P. 128627. doi 10.1016/j.bmcl.2022.128627
мышам массой 16-18 г в виде взвеси в 2%-ной
6. Егорова А.В., Егоров Д.М., Няникова Г.Г., Соколо-
крахмальной слизи и наблюдали за поведением
ва Д.А., Гарабаджиу А.В. // Экол. хим. 2017. Т. 26.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
ДЕЦИКЛИЗАЦИЯ ЗАМЕЩЕННЫХ 2-[2-ОКСОФУР
АН-3(2Н)-ИЛИДЕН]ФУРАН-...
197
№ 6. С. 291; Egorov D.M., Egorova A.V., Nyaniko-
Rocha-Pereira J. // Antivir. Res. 2020. Vol. 183.
va G.G., Sokolova D.A., Garabadzhiu A.V. // Russ. J.
P. 104947. doi 10.1016/j.antiviral.2020.104947
Gen. Chem. 2017. Vol. 87. N 13. P. 3255. doi 10.1134/
20.
Васильева А.Ю., Ваганов В.Ю., Шипиловских
S1070363217130217
С.А., Рубцов А.Е. // ЖОрХ. 2018. Т. 54. № 8. С.
7.
Zhao R., Fu J., Zhu L., Chen Y., Liu B. // J. Hematol.
581; Vasileva A.Y., Vaganov V.Y., Shipilovskikh S.A.,
Oncol. 2022. Vol. 15. N 1. P. 14. doi 10.1186/s13045-
Rubtsov A.E. // Russ. J. Org. Chem. 2018. Vol. 54.
022-01230-6
P. 582. doi 10.1134/S1070428018040115
8.
Ivashchenko A.A., Mitkin O.D., Jones J.C., Nikitin A.V.,
21.
Joksimović N., Janković N., Davidović G., Bugarčić Z. //
Koryakova A.G., Ryakhovskiy A., Karapetian R.N.,
Bioorg. Chem. 2020. Vol. 105. P. 104343. doi 10.1016/j.
Kravchenko D.V., Aladinskiy V., Leneva I.A., Falynsko-
bioorg.2020.104343.
va I.N., Glubokova E.A. // J. Med. Chem. 2020. Vol. 63.
22.
Nair V., Okello M. // Molecules. 2015. Vol. 20. P. 12623.
doi 10.3390/molecules200712623
P. 9403. doi 10.1021/acs.jmedchem.0c00565.
23.
Горбунова И.А., Шадрин В.М., Пулина Н.А., Но-
9.
DSM Group: динамика продаж анальгетиков в
викова В.В., Дубровина С.С., Шипиловских Д.А.,
Шипиловских С.А. // ЖОХ. 2023. Т. 93. № 1. С. 18;
10.
Горбунова И.А., Шипиловских Д.А., Рубцов А.Е.,
Gorbunova I.A., Shadrin V.M., Pulina N.A., Noviko-
Шипиловских С.А. // ЖОХ. 2021. Т. 91. № 9. С. 1333;
va V.V., Dubrovina S.S., Shipilovskikh D.A.,
Gorbunova I.A., Shipilovskikh D.A., Rubtsov A.E.,
Shipilovskikh S.A. // Russ. J. Gen. Chem. 2023. Vol. 93.
Shipilovskikh S.A. // Russ. J. Gen. Chem. 2021. Vol. 91.
N 1. P. 9. doi 10.1134/S1070363223010024
P. 1623. doi 10.1134/S1070363221090048
24.
Sharma H., Sanchez T.W., Neamati N., Detorio M.,
11.
Игидов С.Н., Турышев А.Ю., Махмудов Р.Р.,
Schinazi R.F., Cheng X., Buolamwini J.K. // Bioorg.
Шипиловских Д.А., Игидов Н.М., Шипиловских С.А. //
Med. Chem. Lett. 2013. Vol. 23. P. 6146. doi 10.1016/j.
ЖОХ. 2022. Т. 92. № 9. С. 1378; Igidov S.N.,
bmcl.2013.09.009
Turyshev A.Yu., Makhmudov R.R., Shipilovskikh D.A.,
25.
Bobrovskaya O.V., Russkih A.A., Yankin A.N.,
Igidov N.M., Shipilovskikh S.A. // Russ. J. Gen.
Dmitriev M.V., Bunev A.S., Gein V.L.
/ /
Chem. 2022. Vol. 92. N 9. P. 1629. doi 10.1134/
Synth. Commun. 2021. Vol. 51. P. 1731. doi
S1070363222090067
10.1080/00397911.2021.1903930
12.
Mayorova O.A., Yegorova A.Y. // Magn. Reson. Chem.
26.
Собин Ф.В., Пулина Н.А., Липатников К.В.,
2015. Vol. 10 P. 853. doi 10.1002/mrc.4270
Старкова А.В., Юшкова Т.А., Наугольных Е.А. //
13.
Шипиловских С.А., Шипиловских Д.А., Рубцов А.Е. //
Хим.-фарм. ж. 2020. Т. 54. № 10. С. 21; Sobin F.V.,
ЖОрХ. 2017. Т 53. № 1. С. 138; Shipilovskikh S.A.,
Pulina N.A., Lipatnikov K.V., Starkova A.V., Yushko-
Shipilovskikh D.A., Rubtsov, A.E. // Russ. J. Org.
va T.A., Naugol’nykh E.A. // Pharm. Chem. J. 2020.
Chem. 2017. Vol. 53. N 1. P. 137. doi 10.1134/
Vol. 54. P. 1003. doi 10.1007/s11094-021-02310-6
S1070428017010274
27.
Пулина Н.А., Кузнецов А.С., Краснова А.И., Новико-
14.
Гавкус Д.Н., Майорова О.A., Борисов М.Ю.,
ва В.В. // Хим.-фарм. ж. 2019. Т. 53. № 3. С. 30;
Егорова A.Ю. // ЖОрХ. 2012. Т. 48. С. 1230;
Pulina N.A., Kuznetsov A.S., Krasnova A.I., Noviko-
Gavkus D.N., Maiorova O.A., Borisov M.Y.,
va V.V. // Pharm. Chem. J. 2019. Vol. 53. P. 220. doi
Egorova A.Y. // Russ. J. Org. Chem. 2012. Vol. 48.
10.1007/s11094-019-01983-4
P. 1229. doi 10.1134/s107042801209014x
28.
Гейн В.Л., Замораева T.M., Горгопина E.В.,
15.
Shipilovskikh S.A., Rubtsov A.E. // J. Org. Chem. 2019.
Дмитриев M.В. // ХГС. 2020. Т. 56. № 3. С. 339;
Vol. 84. P. 15788. doi 10.1021/acs.joc.9b00711
Gein V.L., Zamaraeva T.M., Gorgopina E.V.,
16.
Sayed H.H., Hashem A.I., Yousif N.M., El-Sayed W.A. //
Dmitriev M.V. // Chem. Heterocycl. Compd. 2020.
Arch. Pharm. 2007. Vol. 6. P. 315. doi 10.1002/
Vol. 56. P. 339. doi 10.1007/s10593-020-02665-w
ardp.200700043
29.
Гейн В.Л., Замараева Т.М., Бузмакова Н.А.,
17.
Dias A., Bouvier D., Crepin T., McCarthy A.A.,
Рудакова И.П., Дмитриев М.В. // Хим.-фарм. ж.
Hart D.J., Baudin F., Cusack S., Ruigrok R.W. // Nature.
2018. Т. 52. № 6. С. 26; Gein V.L., Zamaraeva T.M.,
2009. Vol. 458. P. 914. doi 10.1038/nature07745
Buzmakova N.A., Rudakova I.P., Dmitriev M.V. //
18.
Шипиловских С.А., Рубцов А.Е. // ЖОрХ. 2014.
Pharm. Chem. J. 2018. Vol. 52. P. 515. doi 10.1007/
Т. 50. № 2. С. 305; Shipilovskikh S.A., Rubtsov A.E. //
s11094-018-1851-0
Russ. J. Org. Chem. 2014. Vol. 50. P. 298. doi 10.1134/
30.
Гейн О.Н, Замараева Т.М., Гейн В.Л. // Хим.-фарм.
S1070428014020286
ж. 2019. Т. 53. № 1. С. 4; Gein O.N., Zamaraeva T.M.,
19.
Fernández-García Y., Horst S., Bassetto M., Brancale A.,
Gein V.L. // Pharm. Chem. J. 2019. Vol. 53. P. 40. doi
Neyts J., Rogolino D., Sechi M., Carcelli M., Günther S.,
10.1007/s11094-019-01952-x
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
198
ИГИДОВ и др.
31.
Денисова Е.И., Липин Д.В., Пархома К.Ю., Девят-
37.
Шаравьева Ю.О., Сюткина А.И., Чащина С.В.,
кин И.О., Шипиловских Д.А., Чащина С.В., Махму-
Новикова В.В., Махмудов Р.Р., Шипиловских С.А. //
дов Р.Р., Игидов Н.М., Шипиловских С.А. // ЖОрХ.
Изв. АН. Сер. хим. 2022. № 3. С. 538; Sharavye-
2021. Т. 57. № 12. С. 1736; Denisova E.I., Lipin D.V.,
va Yu.O., Siutkina A.I., Chashchina S.V., Novikova V.V.,
Parkhoma K.Y., Devyatkin I.O., Shipilovskikh D.A.,
Makhmudov R.R., Shipilovskikh S.A. // Russ. Chem.
Chashchina S.V., Makhmudov R.R., Igidov N.M.,
Bull. 2022. Vol. 71. N 3. P. 538. doi 10.1007/s11172-
Shipilovskikh S.A. // Russ. J. Org. Chem. 2021. Vol. 57.
022-3445-y
P. 1955. doi 10.1134/s1070428021120083
38.
Gunina E., Zhestkij N., Bachinin S., Fisenko S.P.,
32.
Липин Д.В., Денисова Е.И., Девяткин И.О., Око-
Shipilovskikh D.A., Milichko V.A., Shipilovskikh S.A. //
нешникова Е.А., Шипиловских Д.А., Махмудов Р.Р.,
Photonics Nanostruct. 2022. Vol. 48. P. 100990. doi
Игидов Н.М., Шипиловских С.А. // ЖОХ. 2021. Т. 91.
10.1016/j.photonics.2021.100990
№ 12. С. 1962; Lipin D.V., Denisova E.I., Devyatkin
39.
Сюткина А.И., Шаравьева Ю.О., Чащина С.В.,
I.О., Okoneshnikova Е.А., Shipilovskikh D.A., Makhmu-
Шипиловских С.А., Игидов Н.М. // Изв. АН. Сер.
dov R.R., Igidov N.M., Shipilovskikh S.A. // Russ. J.
хим. 2022. № 3. С. 496; Siutkina, A.I., Sharavye-
Gen. Chem. 2021. Vol. 91. N 12. P. 2469. doi 10.1134/
va Yu.O., Chashchina S.V., Shipilovskikh S.A.,
S1070363221120161
Igidov N.M. // Russ. Chem. Bull. 2022. Vol. 71. N 3. P.
33.
Липин Д.В., Денисова Е.И., Шипиловских Д.А.,
496. doi 10.1007/s11172-022-3439-9
Чащина С.В., Махмудов Р.Р., Игидов Н.М., Шипи-
ловских С.А. // ЖОрХ. 2022. Т. 58. № 12. С. 1354;
40.
Siutkina A.I., Chashchina S.V., Kizimova I.A., Igidov N.M.,
Lipin D.V., Denisova E.I., Shipilovskikh D.A.,
Makhmudov R.R., Shipilovskikh S.A. // Russ. J. Org.
Chashchina S.V., Makhmudov R.R., Igidov N.M.,
Chem. 2021. Vol. 57. N 11. P. 1874. doi 10.1134/
Shipilovskikh S.A. // Russ. J. Org. Chem. 2022. Vol. 58.
S1070428021110105
N 12. P. 1759. doi 10.1134/S1070428022120041
41.
CrysAlisPro, Agilent Technologies, Version 1.171.37.33
34.
Горбунова И.А., Шаравьева Ю.А., Махмудов Р.Р.,
(release 27-03-2014 CrysAlis171.NET).
Шипиловских Д.А., Шадрин В.М., Пулина Н.А.,
42.
Sheldrick G.M. // Acta Crystallogr. (A). 2008. Vol. 64.
Шипиловских С.А. // ЖОХ. 2022. Т. 92. № 10.
P. 112. doi 10.1107/S0108767307043930
С. 1520; Gorbunova I.A., Sharavyeva Yu.O., Makhmu-
43.
Sheldrick G.M. // Acta Crystallogr. (C). 2015. Vol. 71.
dov R.R., Shipilovskikh D.A., Shadrin V.M., Pulina N.A.,
P. 3. doi 10.1107/S2053229614024218
Shipilovskikh S.A. // Russ. J. Gen. Chem. 2022. Vol. 92.
44.
Dolomanov O.V., Bourhis L.J., Gildea R.J.,
N 10. P. 1899. doi 10.1134/S1070363222100048
Howard J.A.K., Puschmann H. // J. Appl. Cryst. 2009.
35.
Бабушкина А.А., Питерская Ю.Л., Штро А.А.,
Vol. 42. P. 339. doi 10.1107/S0021889808042726
Николаева Ю.В., Галочкина A.В., Клабуков А.М.,
45.
Миронов А.Н. Руководство по проведению доклини-
Егоров Д.М. // ЖОХ. 2022. Т. 92. № 1. С. 31;
ческих исследований лекарственных веществ. М.:
Babushkina A.A., Piterskaya Yu.L., Shtro A.A.,
Гриф и К, 2012. Т. 1. С. 509.
Nikolaeva Yu.V., Galochkina A.V., Klabukov A.M.,
46.
Першин Г.Н. Методы экспериментальной химиоте-
Egorov D.M. // Russ. J. Gen. Chem. 2022. Vol. 92. N 1.
рапии. М.: Медицина, 1971. С. 100, 109.
P. 18. doi 10.1134/S1070363222010042
47.
Измеров Н.Ф., Саноцкий И.В., Сидоров К.К. Пара-
36.
Шипиловских С.А., Махмудов Р.Р., Лупач Д.Ю.,
Павлов П.Т., Бабушкина Е.В., Рубцов А.Е. // Хим.-
метры токсикометрии промышленных ядов при од-
фарм. ж. 2013. Т. 47. № 7. С. 26; Shipilovskikh S.A.,
нократном воздействии. М.: Медицина, 1977. C. 196.
Makhmudov R.R., Lupach D.Yu., Pavlov P.T.,
48.
Беленький М.Л. Элементы количественной оценки
Babushkina E.V., Rubtsov A.E. // Pharm. Chem. J. 2013.
фармакологического эффекта. Ленинград: Медгиз,
Vol. 47. N 7. P. 366. doi 10.1007/s11094-013-0960-z
1963. C. 146.
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023
ДЕЦИКЛИЗАЦИЯ ЗАМЕЩЕННЫХ 2-[2-ОКСОФУР
АН-3(2Н)-ИЛИДЕН]ФУРАН-...
199
Decyclization of Substituted
2-[2-Oxofuran-3(2H)-ylidene)furan-2-carbohydrazides
by the Action of Alcohols and Analgesic Activity
of the Obtained Compounds
S. N. Igidova,b, A. Yu. Turysheva, R. R. Makhmudovc, D. A. Shipilovskikhd, M. V. Dmitrievc,
O. V. Zverevaa, P. S. Silaichevc, N. M. Igidova, and S. A. Shipilovskikhc,e,*
a Perm State Pharmaceutical Academy, Perm, 614990 Russia
b Merck LLC, Moscow, 115054 Russia
c Perm State University, Perm, 614990 Russia
d Perm National Research Polytechnic University, Perm, 614990 Russia
e ITMO University, St. Petersburg, 197101 Russia
*e-mail: s.shipilovskikh@metalab.ifmo.ru
Received November 2, 2022; revised December 9, 2022; accepted December 14, 2022
A new series of substituted 4-oxo-2-[2-(furan-2-ylcarbonyl)hydrazinylidene]butanoic acids and 2-[2-oxofuran-
3(2H)-ylidene]furan-2-carbohydrazides was synthesized. A methodology was developed for their decyclization
under the action of primary and secondary alcohols with the formation of substituted alkyl 4-oxo-2-[2-(furan-2-
ylcarbonyl)hydrazinylidene]butanoates, which exist in the form of three isomeric forms. Among the synthesized
compounds, substances with pronounced analgesic activity were found.
Keywords: 2,4-dioxobutanoic acids, 3-imino(hydrazono)furan-2(3H)-one, OH-nucleophiles, alkyl
2-hydrazinylidene-4-oxobutanoates, analgesic activity
ЖУРНАЛ ОБЩЕЙ ХИМИИ том 93 № 2 2023